REGISTRO DOI: 10.5281/zenodo.12447844
Ana Luísa Guedes De França E Silva; Andrée Carolle Mariane Amany Kouassi; Daniel Martins De Medeiros; Dennys Kelis Meireles; Gisele Fernandes De Sena; Hellen Ramos; Luana Ribas; Lucas De Mello Ribeiro; Marina Carvalho De Almeida Leitão; Pedro Afonso Spizzirri Do Amaral; Rafaella Sampaio Santos; Orientador: Prof. Me. José Kawazoe Lazzoli
RESUMO
As doenças do aparelho circulatório estão entre as principais causas de morte no Brasil e no mundo, na qual destaca-se a insuficiência cardíaca, uma doença crônica e irreversível. Sabe-se que o transplante cardíaco é atualmente a abordagem cirúrgica padrão-ouro no tratamento da insuficiência cardíaca refratária, embora a doença isquêmica com angina refratária sem possibilidade de regressão e a arritmia ventricular persistente refratária também estejam elegíveis ao procedimento. No entanto, ao lado das vantagens, essa técnica pode apresentar limitações importantes, como a carência de doadores viáveis, as complicações pós-operatórias e as contra-indicações médicas e psicossociais. Assim, este trabalho foi desenvolvido como uma revisão bibliográfica dos estudos sobre transplante cardíaco, ressaltando a parte anatômica do processo e abrangendo aspectos da técnica cirúrgica, mas não deixando de abordar os métodos que precedem a prática terapêutica, bem como as complicações pós-operatórias que eventualmente venham a surgir.
Palavras-chave: Transplante Cardíaco, Cirurgia Cardíaca.
ABSTRACT
Cardiovascular diseases are amongst the main causes of death in Brazil and the world, with emphasis on heart failure, a chronic and irreversible disease. It is a known fact that cardiac transplantation is the gold standard surgical approach in the treatment of refractory heart failure, though refractory angina ischemic disease with no regression possibility and refractory ventricular arrhythmia may also be eligible cases for the procedure. However, on the advantage’s side, this technique may present important limitations, such as lack of potential donors, post-operative complications, and medical and psychosocial contraindications. Therefore, this article was designed as a literary review of the studies about cardiac transplantations, highlighting the anatomical features of the process and approaching aspects of the surgical technique, but not putting aside the methods that precede the therapeutic practice, such as the post-operative complications that might eventually appear.
Keywords: cardiac transplant, cardiac surgery.
1. INTRODUÇÃO
No ano de 1967, na África do Sul, que se registrou o primeiro transplante cardíaco em todo o mundo, creditado ao cirurgião Christian Barnard.1,20 Este, com o auxílio de estudos centenários, não somente realizou com sucesso um procedimento complexo e arriscado em termos anatomofisiológicos, como também possibilitou a rápida e crescente popularização do transplante cardíaco após o seu feito.2 No Brasil, o Sistema Único de Saúde (SUS) catalogou, em 2015, as doenças do aparelho circulatório (DAC) como a terceira causa geral de internações, na qual a insuficiência cardíaca se destacou como o principal motivador dentre todas as hospitalizações por DAC. Nesse cenário, com mais de 1 milhão de brasileiros apresentando problemas cardiovasculares anualmente desde o final do século passado,3 o país se consolida como palco para um grande número de transplantes cardíacos, tendo iniciado seu primeiro procedimento no ano de 1968 — 6 meses após o feito de Barnard, por intermédio do cirurgião Euryclides Zerbini. No final da década de 70, pouco tempo após a execução das primeiras cirurgias cardíacas, a ciclosporina foi introduzida como droga de imunossupressão para transplantados em geral, o que possibilitou a melhora prognóstica aos pacientes recém-operados, que anteriormente corriam maiores riscos de rejeição ao enxerto.1
Apesar dos múltiplos avanços no tratamento de insuficiências cardíacas em estágio terminal, o transplante cardíaco permanece como o padrão ouro.4,20 Contudo, trata-se de uma cirurgia de alta complexidade e múltiplos pontos importantes, sobretudo em termos anatômicos e fisiológicos. Partindo de um ponto de conhecimento básico sobre o assunto, este artigo traz informações de livros, artigos e fontes relevantes para um entendimento inicial do tema apresentado, introduzindo uma visão menos técnica e mais didática. O presente estudo, portanto, concentra seu conteúdo em uma revisão da literatura, com um foco anatomofisiológico feito para compreensão mais clara e imediata da anatomia cardíaca e das particularidades cirúrgicas, abordando, ainda, os processos de seleção do receptor e do doador, as indicações e contraindicações para a realização do transplante, as possíveis complicações pós-cirúrgicas e a situação do procedimento no Brasil hodierno.
2. OBJETIVOS
O objetivo deste artigo foi fazer uma revisão literária sobre o tema transplante cardíaco, ressaltando a parte anatômica do processo, ainda assim abrangendo aspectos como técnica cirúrgica, indicações e complicações.
3. MATERIAIS E MÉTODOS
Trata-se de uma pesquisa bibliográfica realizada por meio de revisão de literatura com base em artigos e diretrizes datados de 2011 a 2024. Os artigos encontram-se disponíveis nas bibliotecas virtuais de saúde PubMed e Scielo que podem ser encontrados nos mecanismos de busca através das palavras-chave “transplante cardíaco” e “cirurgia cardíaca” e o período de escolha visou a seleção de técnicas e procedimentos mais atualizados do transplante cardíaco.
Tais publicações foram discutidas e articuladas com trabalhos impressos consolidados na comunidade acadêmica, como “NETTER, Frank H.. Atlas de Anatomia Humana. 2ªed. Porto Alegre: Artmed, 2000”, “SOBOTTA, Johannes. Atlas de Anatomia Humana. 21ªed. Rio de Janeiro: Guanabara Koogan, 2000”, “BRAUNWALD – Tratado de Doenças Cardiovasculares, 10ªed, São Paulo: Roca, 2006.” e “GARDNER, Ernest. Anatomia: Estudo Regional do Corpo Humano. 4ªed. Rio de Janeiro: Guanabara Koogan, 1998.”
4. BASES ANATÔMICAS
O coração, envolto pelo saco pericárdico, está localizado no mediastino médio. Apresenta forma cônica e contorcida com ápice projetado para a esquerda, anteriormente e inferiormente, e uma base ampla projetada para cima e para a direita, de onde emergem e penetram os grandes vasos; topograficamente, seu ápice encontra-se, normalmente, no 5º espaço intercostal ao nível da linha hemiclavicular. 5,6,7
Figura 1: Vista anterior do pericário, com rebatimento dos pulmões
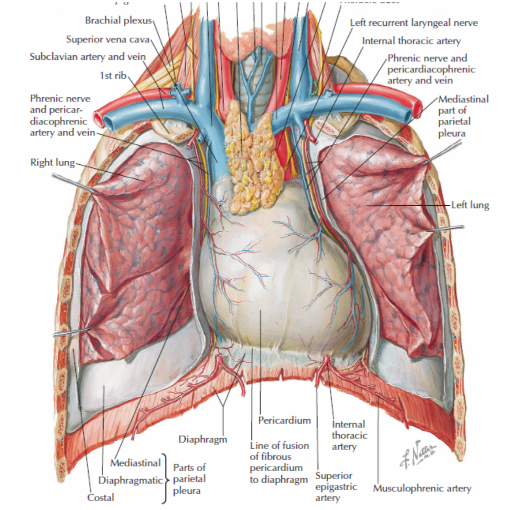
Fonte: Conti, C Richard. The Netter Collection of Medical Illustrations vol 8. 2 ed. 2014. Página 3.8
O pericárdio, membrana fibroserosa, reveste completamente o coração e o início de seus grandes vasos. Está aderido a porções do diafragma e à face posterior do esterno, além de ser, lateralmente, íntimo da pleura mediastinal. Apresenta uma camada mais externa e inextensível, denominada pericárdio fibroso, a qual se reflete internamente como pericárdio seroso. Este último se reflete em lâmina parietal e visceral. Entre essas lâminas encontra-se a cavidade pericárdica com seu fluido. 5
Anterior ao pericárdio e posterior ao externo, encontra-se uma área denominada mediastino anterior, que contém gordura, tecido conjuntivo, linfonodos, ligamentos esterno-pericárdicos, entre outras estruturas. Posteriormente ao pericárdio e anterior as vértebras torácicas, encontra-se o mediastino posterior, onde localizam-se estruturas íntimas ao coração, como a aorta torácica descendente e seus ramos, ducto torácico, terço final do esôfago e nervos esplâncnicos. No mediastino médio, lateralmente e íntimo ao pericárdio, o nervo frênico emite ramos para o pericárdio antes de projetar-se para o diafragma. 5,9
Figura 2: Divisões do mediastino
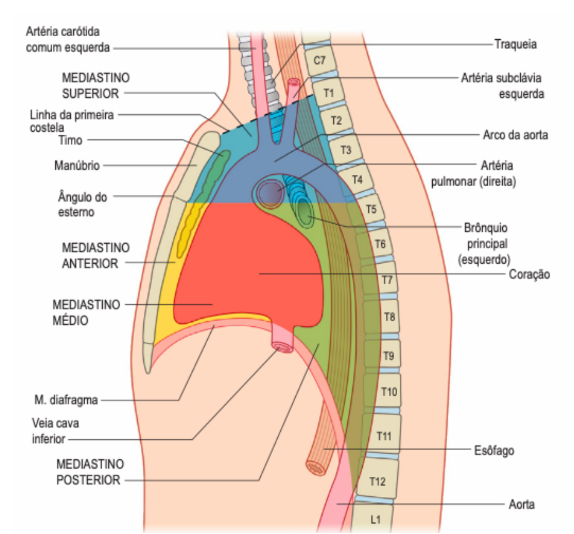
Fonte: Gray’s Anatomia – 40º edição, 2008, pág.939.9
Superiormente, na base do coração, tem-se a emergência dos grandes vasos, localizados no mediastino superior. O tronco pulmonar emerge do ventrículo direito e deixa o pericárdio no início de sua bifurcação em artérias pulmonares esquerda e direita. A porção intrapericárdica da aorta ascendente, cuja origem é, em grande parte, coberta pela aurícula direita, emite as artérias coronárias. Ainda na base do coração, em um plano posterior e inferior à emergência da aorta e tronco pulmonar, as veias cavas superior e inferior adentram o átrio direito, e as veias pulmonares o átrio esquerdo. A cava superior é conectada na parte superior e a cava inferior na parte mais póstero-inferior do átrio direito, ambas as veias são levemente inclinadas para a frente, sendo a cava inferior posicionada mais medialmente. As duas veias pulmonares direitas, originadas do pulmão direito, cruzam posteriormente o átrio direito de forma a entrar no lado direito do átrio esquerdo. As duas veias pulmonares esquerdas, originadas no pulmão esquerdo, entram no lado esquerdo do átrio esquerdo. No teto do átrio esquerdo, surge a bifurcação do tronco pulmonar, seu ramo esquerdo segue de imediato em direção ao pulmão esquerdo, enquanto que seu ramo direito segue por trás da parte proximal da Veia cava superior e por cima das veias pulmonares direitas, seguindo para o pulmão direito.5
Por sua vez, o arco da aorta cruza essa bifurcação do tronco pulmonar e, logo depois, emite seus três principais ramos: artérias braquiocefálica, carótida comum e subclávia esquerda. É possível visualizar também o seio coronário, veia curta e calibrosa, entre o AE e o VE, na porção diafragmática do sulco coronário esquerdo.5
Ao remover a parede anterior do tórax, rebater parte da borda anterior dos pulmões e abrir o pericárdio, observa-se a face esternocostal do coração, sendo composta predominantemente pelo ventrículo direito. O átrio direito encontra-se à direita do ventrículo direito e a separação externa destes é representada pelo sulco coronário (atrioventricular) direito, por onde passa a artéria coronária direita. À esquerda do ventrículo direito, é possível visualizar pequena parte do ventrículo esquerdo, separados externamente pelo sulco interventricular anterior, por onde passa o ramo interventricular anterior (descendente) da artéria coronária esquerda. A presença do sulco interventricular, observado na superfície cardíaca, indica a separação entre os ventrículos direito e esquerdo, por meio do septo interventricular.5
Figura 3: Face esternocostal do coração
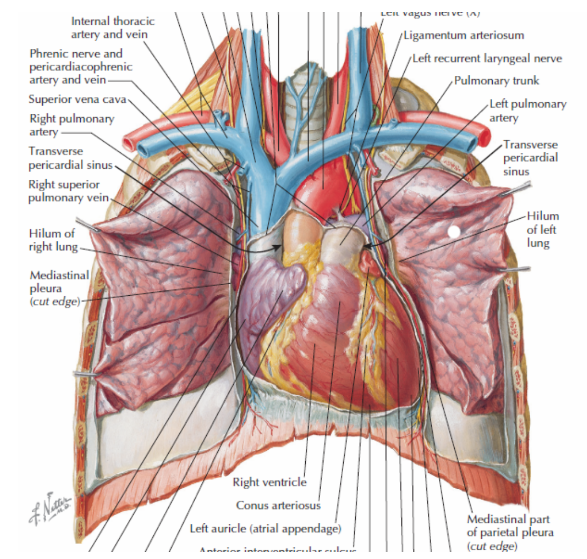
Fonte: Conti, C Richard. The Netter Collection of Medical Illustrations vol 8. 2 ed. 2014. Página 6.8
A face diafragmática, situada posteriormente e inferiormente, é composta por partes dos dois ventrículos e repousa sobre o centro tendíneo do diafragma. Esses segmentos ventriculares são divididos pelo sulco interventricular posterior.5
A face pulmonar, à esquerda, é formada principalmente pelo ventrículo esquerdo; à direita, a face pulmonar é formada pelo átrio direito.5
Figura 4: Vista anterior do coração
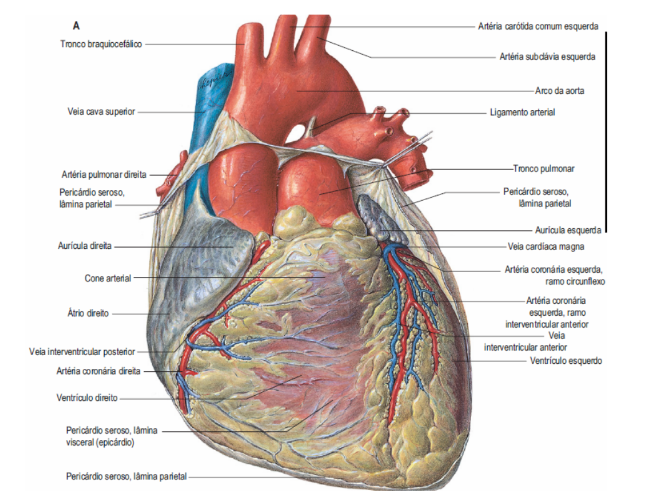
Fonte: Gray, Henry. Anatomia. 40 ed. 2010. Página 961.9
Figura 5: Vista póstero inferior do coração
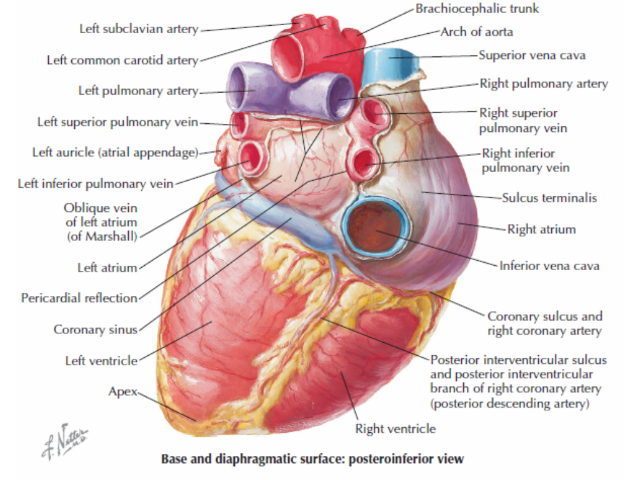
Fonte: Conti, C Richard. The Netter Collection of Medical Illustrations vol 8. 2 ed. 2014. Página 7.8
Figura 6: Base do coração, vista posterior.
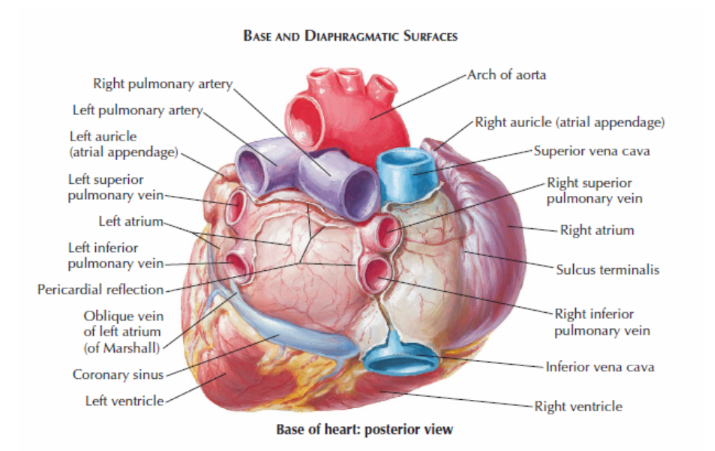
Fonte: Conti, C Richard. The Netter Collection of Medical Illustrations vol 8. 2 ed. 2014. Página 7.8
A superfície interna do AD é composta de duas partes, uma lisa e posterior derivada do seio venoso embrionário, por onde entram as veias cavas superior e inferior (seio das veias cavas), e uma porção trabeculada, contendo os músculos pectíneos. Essas porções atriais são separadas pela crista terminal, estando os músculos pectíneos situados lateralmente a essa crista. Em continuidade com o AD, tem-se a Aurícula Direita, também revestida por músculos pectíneos, que é um ponto de acesso muito utilizado em cirurgias cardíacas.5
Figura 7: Vista do átrio direito
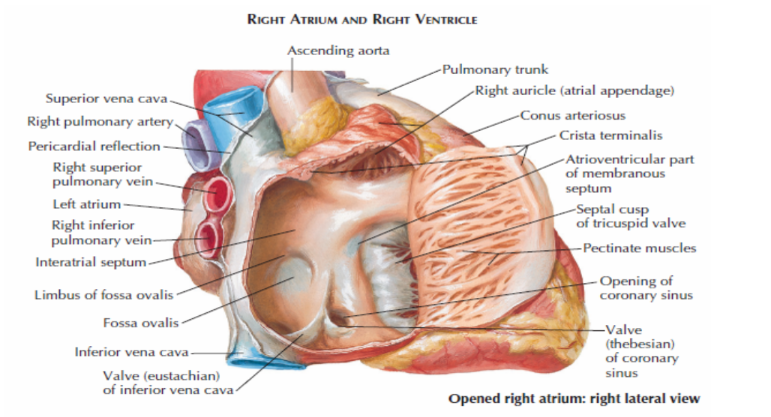
Fonte: Conti, C Richard. The Netter Collection of Medical Illustrations vol 8. 2 ed. 2014. Página 8.8
O nó sinoatrial, marcapasso do coração situado logo abaixo do epicárdio, está localizado na região ântero-lateral da junção entre a veia cava superior e átrio direito, superiormente a crista terminal. O impulso elétrico gerado é conduzido até o nó atrioventricular que, por sua vez, conduz o impulso para os ventrículos através do feixe de Hiss. O nó atrioventricular, situado abaixo do endocárdio e próximo ao septo atrioventricular, está localizado no ápice do trígono de Koch, especificamente no septo membranácio. Sobre os limites deste trígono, a valva do seio coronário e veia cava inferior confluem e formam um tecido conjuntivo, chamado de tendão do todaro, este, juntamente com o orifício do seio coronário e a base da valva tricúspide estabelecer os limites (trígono de Koch).5, 6, 9
Figura 8: Tecido de condução do coração
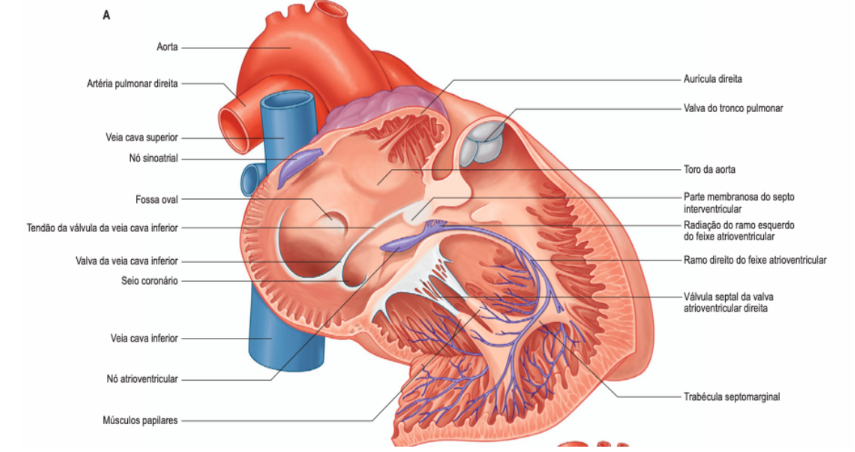
Fonte: Gray’s Anatomia- 40º edição, 2010, pág.976.9
A superfície interna do ventrículo direito pode ser dividida em duas porções: uma porção posterior de entrada, que contém a valva atrioventricular direita(tricúspide), e uma parte antero superior de saída, pela qual origina-se o tronco pulmonar.5
A porção de entrada é vastamente trabeculada, sendo composta pelas trabéculas cárneas. A porção de saída tem poucas trabéculas cárneas e é denominada de cone arterial.5 Os músculos papilares são responsáveis pela fixação das partes livres das válvulas da valva tricúspide às paredes do VD, por meio das cordas tendíneas. O tronco pulmonar emerge do cone arterial no limite superior do VD e segue para trás e para cima, bifurcando-se e formando as artérias pulmonares direita e esquerda.5
Figura 9: vista do ventrículo direito
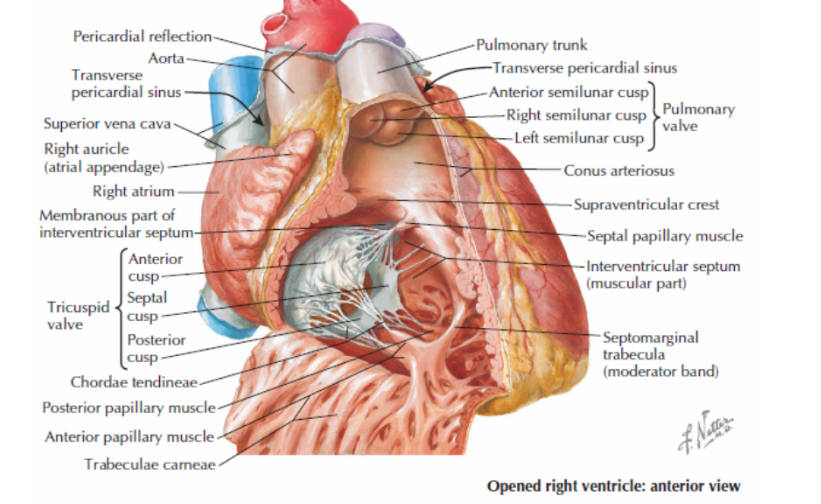
Fonte: Conti, C Richard. The Netter Collection of Medical Illustrations vol 8. 2 ed. 2014. Página 8.8
O Átrio Esquerdo é composto principalmente por uma parede lisa. Nele, entram, geralmente, duas veias pulmonares direitas e duas veias pulmonares esquerdas. Há presença, também, de uma aurícula esquerda, sendo essa estrutura uma continuação esquerda da porção ântero superior do AE.5
A superfície interna do VE, por sua vez, é menos trabeculado do que a do VD, contendo poucas cordas tendíneas. No entanto, a espessura do VE é muito maior, sendo necessária para vencer a pressão a aorta e bombear o sangue.5
Figura 10: Vista do ventrículo esquerdo
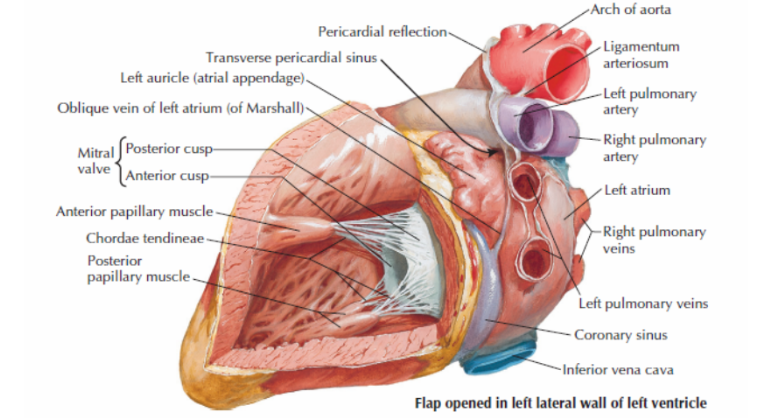
Fonte: Conti, C Richard. The Netter Collection of Medical Illustrations vol 8. 2 ed. 2014. Página 9.8
As artérias coronárias direita e esquerda, responsáveis pela irrigação cardíaca, emergem do seio aórtico, sendo os primeiros ramos da aorta, e apresentam distribuição variável quanto à origem de seus ramos e à área de irrigação.5,6,7
A inervação motora e sensitiva é feita por fibras autônomas que seguem através do nervo vago e cadeia simpática. As fibras parassimpáticas pré-ganglionares seguem através dos ramos cardíacos cervicais superior e inferior e ramo cardíaco torácico do nervo vago (X). Na região do mediastino, esses ramos alcançam o plexo cardíaco, onde fazem sinapse com diversos gânglios. As fibras simpáticas, pós sinapse nos gânglios cervical e torácico, seguem como ramos cardíacos cervicais. As fibras simpáticas e parassimpáticas se projetam, normalmente, atrás e na frente do arco da aorta para penetrar no plexo cardíaco, de onde são direcionadas para os vasos (aorta,tronco pulmonar, coronárias) e para o tecido nervoso intrínseco do coração. Fibras aferentes para sensação dolorosa seguem, através dos nervos simpáticos, para o gânglio da raiz dorsal dos segmentos T1- T4. Fibras aferentes para o reflexo barorreceptor seguem, normalmente, através do nervo vago.5,6
5. INDICAÇÕES E CONTRAINDICAÇÕES PARA O TRANSPLANTE
O transplante é o tratamento de escolha para insuficiência cardíaca (IC) estágio D, quando esta é refratária ao tratamento otimizado e possui estimativa de prognóstico adverso no que diz respeito a otimização terapêutica, de forma que, a indicação deve contemplar a relação risco benefício individual e populacional.10 Outras indicações são: doença isquémica com angina refratária e sem possibilidade de regressão e arritmia ventricular persistente e refratária.1,24
As indicações de transplante cardíaco podem ser divididas em quatro classes de recomendação. Na classe I estão: IC avançada na dependência de drogas inotrópicas e/ou suporte circulatório mecânico; IC avançada classe funcional III persistente e IV com tratamento otimizado na presença de outros fatores de mau prognóstico; arritmias ventriculares sintomáticas e refratárias ao manejo com fármacos, dispositivos elétricos e procedimentos de ablação; e IC avançada e VO2 de pico menor ou igual a 12 ml/kg/minuto, em pacientes em uso de betabloqueadores, ou menor ou igual a 14 ml/kg/minuto em pacientes intolerantes a betabloqueadores. São indicações presentes na classe IIa: IC refratária e VO2 de pico menor ou igual a 50% do previsto em paciente com menos de 50 anos e mulheres; e doença isquémica com angina refratária sem possibilidade de revascularização. Encontram-se na classe IIb: IC refratária e VO2 de pico ajustado para massa magra menor ou igual a 19 mL/kg/minuto em pacientes com índice de massa corporal maior que 30; e IC refratária e equivalente ventilatório de gás carbônico maior que 35, particularmente se VO2 de pico for menor ou igual a 14 mL/kg/minuto e/ou teste cardiopulmonar submáximo. Por último, na classe III estão: disfunção sistólica isolada; prognóstico adverso estimado apenas por escores prognósticos ou VO2 de pico isoladamente; e IC classe funcional NYHA III-IV sem otimização terapêutica.10,23
Atualmente, com os avanços diagnósticos e terapêuticos, muitos fatores antes considerados como contraindicações estão sendo bem manejados em centros de referências. Dessa forma, uma menor quantidade de condições clínicas e comorbidades são consideradas contraindicações para o transplante. Estas são associadas ao risco cirúrgico e redução da sobrevida pós-implante. Um fator, antes considerado contraindicação que merece destaque é a idade, pois estudos recentes demonstraram que pacientes transplantados acima de 60 anos apresentam menores taxas de rejeição e menor incidência de Doença Vascular do Enxerto (DVE), dessa forma, considera-se que pacientes idosos não devem ser usualmente excluídos da avaliação para transplante cardíaco.10
Além da idade, algumas situações clínicas, antes consideradas contraindicações para o transplante, passaram a ser encaradas como “potenciais contraindicações” e atualmente sofrem uma análise mais rigorosa. Entre elas, têm-se as doenças hepáticas, pulmonar ou renal avançadas, de forma que, em candidatos selecionados e centros habilitados, o transplante de múltiplos órgãos pode ser considerado. Ademais, a dependência química também passou a ser ponderada, sendo sugerida a avaliação cautelosa de especialistas em pacientes com história recente de abuso de substâncias (últimos 2 anos), incluindo álcool.10
Algumas contraindicações são: como infecções sistêmicas ativa; comorbidade com baixa expectativa de vida; índice de massa corporal maior que 35 kg/m2; doença cerebrovascular grave sintomática; doença vascular periférica grave sem possibilidade de revascularização e/ou reabilitação; diabetes mellitus com lesões graves em órgão alvo e/ou controle glicêmico inadequado; incompatibilidade ABO; síndromes demenciais ou retardo mental graves; e documentação de baixa adesão ao tratamento medicamentoso em múltiplas ocasiões.10
6. SELEÇÃO DO RECEPTOR E DO DOADOR
6.1 CANDIDATO A RECEPTOR
Para averiguar se um paciente é candidato ao transplante cardíaco e quando ele deverá ser incluído na fila de transplante, ele deve passar por avaliações clínica, laboratorial, imunológica, hemodinâmica, psicológica e social. O paciente deve ser submetido à anamnese e ao exame físico, a testes de imunocompatibilidade, a testes que avaliem a gravidade da insuficiência cardíaca, à avaliação funcional de múltiplos órgãos, ao rastreamento de neoplasias e a sorologias para identificação doenças que possam tornar esse candidato não apto ao transplante. Cabe acrescentar que, uma vez que o paciente é considerado candidato ao transplante, a fila de espera pode ser longa e, por isso, ele deverá ser acompanhado, e alguns exames deverão ser repetidos regularmente para garantir que ele ainda é candidato ao transplante. Todos os possíveis candidatos devem passar por avaliação imunológica que visa identificar o grau de sensibilização do paciente aos Antígenos Leucocitários Humanos (HLA). Apresentar uma grande variedade de anticorpos contra antígenos HLA significa maior dificuldade para encontrar doadores compatíveis. Para esses pacientes, as técnicas de dessensibilização são uma alternativa para reduzir ou eliminar os anticorpos HLA, aumentando assim o número de possíveis doadores e reduzindo a chance de rejeição.10
Ainda, uma avaliação hemodinâmica através da cateterização da artéria pulmonar se faz necessária para incluir o paciente na fila para o transplante.10 Estudos epidemiológicos mostraram que 60-70% dos pacientes com insuficiência cardíaca desenvolvem hipertensão pulmonar (HP), sendo a HP grave uma forte contraindicação ao transplante cardíaco.11 Por isso, a realização de avaliação hemodinâmica é imprescindível para verificar a existência e o grau da hipertensão pulmonar e sua reversibilidade a vasodilatadores. Por fim, todo paciente, para se tornar candidato ao transplante cardíaco, deve ter sua função renal avaliada pela estimativa da taxa de filtração glomerular ou pelo clearance de creatinina, uma vez que a insuficiência renal tem importante papel prognóstico após o transplante e é comum em pacientes com insuficiência cardíaca.10
6.2 CANDIDATO A DOADOR
A seleção de doadores é feita por meio de critérios de inclusão e exclusão. Para se tornar doador, o indivíduo deve apresentar todos os critérios de inclusão e nenhum dos critérios de exclusão. São critérios de inclusão: doador com morte encefálica e consentimento da família, idade inferior a 50 anos, compatibilidade AB0 entre doador e receptor, ausência de doença cardíaca prévia, peso compatível e ausência de neoplasia maligna exceto tumor cerebral primário. São critérios de exclusão: malformação cardíaca significativa ao ecocardiograma, disfunção ventricular grave ao ecocardiograma, doença coronária significativa, septicemia ou síndrome da resposta inflamatória sistêmica, uso de catecolaminas em altas doses por tempo prolongado, infecção por HIV, hepatite B, hepatite C, HTLV I e II detectada à sorologia, alcoolismo acentuado ou uso de drogas endovenosas, paradas cardíacas sem causas circunstanciais e incompatibilidade imunológica. No caso de doadores limítrofes ou marginais, alguns critérios que os tornaram contraindicados ao transplante podem ter sido apresentados, todavia esses corações podem ser ainda doados para receptores clinicamente estáveis ou receptores em situação crítica.10
Uma vez considerado um possível doador, deve-se realizar uma série de cuidados como: administração de metilprednisolona por via intravenosa 15 mg/kg em dose única, controle da hipotermia, ajuste da volemia, correção de alterações respiratórias, correção de alterações metabólicas e hematócrito, controle de diabetes insipidus com reposição de ADH devido à perda da regulação pituitária, reposição hormonal e manutenção hemodinâmica agressiva. Deve também ser feito um controle infeccioso para evitar o transplante de um órgão infectado ou com neoplasia oculta.10
7. COMO É FEITO O TRANSPLANTE
7.1 TÉCNICAS CIRÚRGICAS PARA A COLETA E PARA A RECEPÇÃO DO CORAÇÃO
Antes do procedimento cirúrgico propriamente dito, é fulcral salientar as técnicas cirúrgicas para a coleta e para a recepção do coração do doador. Em primeira análise, há um esforço contínuo e múltiplo visando a procura de órgãos, de modo que a equipe cardiotorácica comumente atua em conjunto com profissionais voltados à área abdominal, haja vista a coleta simultânea do fígado e/ou rins. Dessa forma, o diálogo multi-laboral é fundamental para o manejo eficaz do doador durante o processo de coleta dos órgãos.12
A cirurgia do doador é feita por meio de uma esternotomia mediana (na qual há uma incisão vertical em linha ao longo do esterno), e posterior análise cuidadosa do coração e dos grandes vasos sanguíneos, com o objetivo de investigar possíveis sinais de contusão, infartos, anomalias congênitas e aneurismas, além de examinar a funcionalidade ventricular geral.12
Realiza-se, ainda, a palpação das artérias coronárias para avaliar uma potencial doença coronariana. Essa pesquisa minuciosa ocorre em virtude da identificação de anormalidades substanciais, as quais impediriam e inviabilizaram o uso do coração do doador para transplante. Nestas primeiras etapas, também são canuladas as veias cavas e a aorta.12
Após a dissecção da equipe abdominal, administrou-se heparina ao doador, e uma solução cardioplégica foi infundida na aorta canulada. Essa solução promove a parada dos batimentos cardíacos, porquanto é rica em potássio e oxigênio e resulta em uma parada cardíaca em diástole. O lado esquerdo do coração passa por um processo de descompressão, mediante incisão em uma das veias pulmonares e, em seguida, é esvaziado. Realiza-se um clampeamento cruzado da aorta, que caracteriza um procedimento cirúrgico usado para pinçar a aorta e separar a circulação sistêmica do fluxo de saída do coração. A cardioplegia final fria é administrada na raiz da aorta e, ao final desta infusão, o coração é rapidamente ressecado e excisado através da veia cava superior, das veias pulmonares e da bifurcação da artéria pulmonar para, então, seguir percurso rumo ao paciente receptor.12 A hipotermia contínua e o uso de soluções cardioplégicas são os métodos ideais para a preservação do enxerto cardíaco.10
Por sua vez, a cirurgia do coração transplantado ocorre em duas fases, no indivíduo receptor, a saber: a excisão do órgão próprio do paciente e o implante do aloenxerto – o coração do doador. O paciente é levado para o centro cirúrgico, no qual instalam-se linhas de monitoramento apropriadas e induz-se a anestesia geral e a intubação endotraqueal. Em seguida, o médico cirurgião responsável realiza uma esternotomia mediana, reflete lateralmente o pericárdio e envolve em fitas a aorta ascendente, a veia cava superior (VCS) e a veia cava inferior (VCI). Após a completa heparinização do receptor, a aorta ascendente e ambas as veias cavas são canuladas, procedimento o qual é precedido pela implantação do bypass cardiopulmonar (BCP) e pelo resfriamento do paciente a 28ºC. 12
Quando o coração do doador chega ao centro cirúrgico, a cardiectomia do receptor é realizada com paciente receptor já devidamente submetido a circulação extracorpórea, seguido de clampeamento cruzado da aorta e fechamento completo da luz das veias cavas a partir da constricção das fitas já aplicadas sobre estas, e prossegue-se com a excisão – a depender da técnica de transplante empregada. Após esses preparos inicia-se, por fim, a cirurgia do coração transplantado.4
7.2 TRANSPLANTE CARDÍACO: A CIRURGIA
Distinguem-se duas técnicas cirúrgicas importantes: a técnica convencional ou biatrial e a técnica bicaval ou ortotópica total.12,21
7.2.1 Técnica convencional ou biatrial
Após clampear a Aorta do receptor em uma porção ligeiramente proximal à canulação aórtica, dividem-se as paredes atriais direita e esquerda, o septo atrial, a artéria pulmonar e a aorta, deixando o receptor com cuffs atriais derivados da porção mais posterior dos átrios. As divisões, tanto da artéria pulmonar, quanto da aorta, são feitas logo acima das válvulas semilunares. Após o término da cardiectomia bem-sucedida do receptor, prepara-se o coração do doador para o transplante. O tecido entre os orifícios das quatro veias pulmonares é excisado, deixando uma grande e única abertura.12 A veia Cava Superior é duplamente ligada, e o átrio direito é aberto começando pela face lateral da veia cava inferior, estendendo-se até a base do apêndice atrial direito, com o objetivo de evitar a lesão do nó sinoatrial. O coração é cuidadosamente examinado à procura de anomalias vasculares ou congênitas.4
A técnica padrão ou biatrial – originalmente descrita por Lower e Shumway – prossegue com anastomoses no átrio esquerdo, átrio direito, artéria pulmonar e aorta. Após 30 minutos de reperfusão, no mínimo, retira-se gradualmente o paciente do bypass cardiopulmonar, com a implementação de um suporte inotrópico apropriado. Removem-se as cânulas, e protamina é lentamente administrada para reverter o efeito inicial da heparina. Instalam-se marca-passos atriais e ventriculares temporários, assim como drenos no mediastino e na pleura. Fecha-se o esterno de maneira padrão e, por fim, induz-se a terapia imunossupressiva.12,21
Figura 11: Transplante Cardíaco pela técnica Biatrial
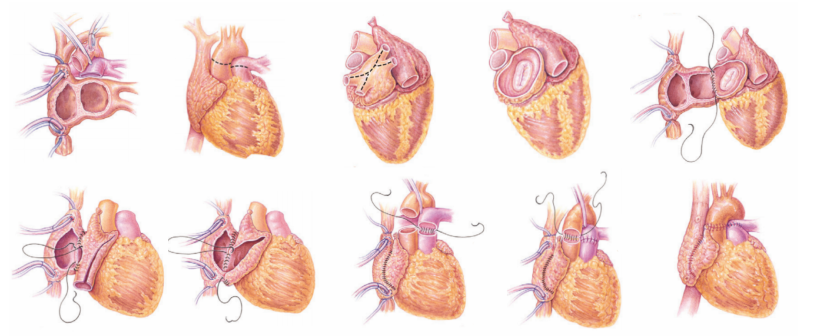
Fonte: Adaptado de Conti, C Richard. The Netter Collection of Medical Illustrations vol 8. 2 ed. 2014. Página 274.8
7.2.2 Técnica bicaval ou ortotópica total
Nos últimos anos, no entanto, a técnica bicaval tornou-se a abordagem mais utilizada nos centros cirúrgicos para transplantes cardíacos. Primeiramente, a veia cava superior é canulada logo abaixo da junção das veias inominadas e a veia cava inferior a nível do diafragma, com a cardiectomia do receptor realizada na forma de um procedimento dividido em duas etapas. Na primeira etapa, o coração é transeccionado no nível médio-atrial, a aorta e a veia pulmonar são divididas e o coração é removido. Na segunda etapa, removem-se as paredes posteriores de ambos os átrios.12 No lado direito, as veias cavas superior e inferior são transeccionadas em sua junção com o átrio direito, e, no lado esquerdo, o átrio esquerdo é aparado, deixando um manguito de tecido ao redor dos orifícios da veia pulmonar, um orifício único onde localizavam-se os locais de conexão das veias pulmonares. O coração do doador é preparado a partir da separação da aorta e veias pulmonares, o manguito atrial esquerdo é então criado com incisões que se conectam entre cada uma das quatro veias pulmonares e qualquer tecido excedente é aparado de forma a criar uma borda lisa e contínua. Nessa etapa, a fossa oval é inspecionada para identificar patências do forame oval, que podem ser corrigidas durante o tempo cirúrgico.Adicionalmente, para esta técnica, a Veia Cava Superior é cortada a nível da abertura da veia Ázigos ou mais, dependendo da condição da estrutura receptora. Na abordagem bicaval, a sequência comumente realizada das anastomoses é a seguinte: átrio esquerdo, veia cava inferior, veia cava superior, artérias pulmonares e, por fim, aorta. As anastomoses do átrio esquerdo, da artéria pulmonar e da aorta são feitas da forma descrita para a técnica biatrial padrão.4
Apesar do crescente desuso, a técnica biatrial padrão ainda é utilizada em alguns centros de transplante em decorrência da vantagem de tempos cirúrgicos mais curtos, o que contribui para evitar possíveis complicações de tromboses e de estenoses das veias cavas inferior e superior. Não obstante, há diversas desvantagens da a técnica biatrial, que promoveram a mudança para a técnica bicaval em muitos centros de transplantes. Por exemplo, a técnica biatrial distorce a geometria atrioventricular, fator o qual pode desencadear dilatação atrial, insuficiência valvular atrial, função atrial deficiente, tromboses atriais e uma propensão para disfunção do nó sinoatrial. Nesse sentido, vários estudos demonstraram uma melhora da função atrial e ventricular e diminuição da insuficiência valvar atrioventricular, além da diminuição na incidência de arritmias e de bloqueio cardíaco com a técnica bicaval. Apesar disso, uma desvantagem registrada da técnica bicaval é o risco de estenose da veia cava superior, sobretudo em casos nos quais há uma desproporção significativa de tamanho entre o doador e o receptor.12
Após qualquer uma das técnicas é imprescindível a execução de ecocardiografia para verificar que todas as conexões estão abertas, todas as valvas estão operando corretamente e que ambos os ventrículos estão funcionando bem.
Figura 12: Transplante Cardíaco pela técnica Bicaval
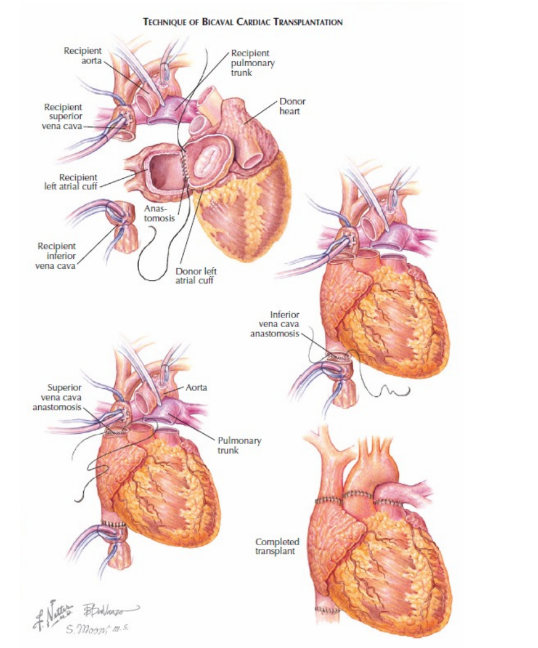
Fonte: Conti, C Richard. The Netter Collection of Medical Illustrations vol 8. 2 ed. 2014. Página 275.8
7.3 TRANSPLANTE CARDÍACO HETEROTÓPICO
O primeiro transplante cardíaco heterotópico em humanos foi realizado em 1974 por Dr. Christiaan Barnard, visando a preservação da função cardíaca em casos de rejeição aguda, sendo atualmente indicado majoritariamente para casos em que o órgão é proveniente de doadores pequenos (desproporção receptor/doador) e em casos de receptores com hipertensão pulmonar acentuada. Essa técnica foi concebida com base no ideal de que o coração do próprio receptor comportaria o paciente até que a rejeição fosse tratada já que o transplante cardíaco heterotópico é um procedimento cirúrgico que permite que o enxerto seja conectado ao coração nativo de forma paralela a fim de fornecer uma espécie de suporte biológico. Dessa forma, no transplante heterotópico, o coração do doador é conectado ao do receptor, sem que o órgão original precise ser removido, e os dois corações funcionam em paralelo. Já no transplante ortotópico, o coração do receptor é removido para que o órgão do doador possa substituí-lo.12,13
8. FISIOLOGIA DO CORAÇÃO TRANSPLANTADO
As principais diferenças fisiológicas da função cardíaca em pacientes transplantados derivam da desnervação. Ao seccionar as fibras autônomas simpáticas e parassimpáticas que chegam ao órgão, impede-se a correta coordenação entre aumentos de demanda decorrentes de aumento de atividade, sobretudo exercício, e mecanismos compensatórios extra cardíacos nervosos. Essa descoordenação ocorre por falta de sinais aferentes de baroceptores, mas, principalmente, por ausência de tônus autônomo e regulação cronotrópica simpática ou parassimpática, a partir de ação interativa sobre o nó sinoatrial, ou regulação inotrópica por ação no próprio músculo cardíaco.14 Visto a desnervação, o aloenxerto funcional e desnervado baseia-se em mecanismos adaptativos incomuns para atingir as demandas do débito cardíaco.12
Em termos de mecanismos fisiológicos intrínsecos ao coração, na ausência da influência autônoma sobre o ritmo cardíaco por regulação da frequência dos potenciais de resposta lenta gerados a nível do nó sinusal, o aloenxerto responde precocemente com o mecanismo intrínseco de Frank-Starling, ou seja, o grau de distensibilidade do músculo cardíaco faz com que ele aumente sua força de contração, em resposta ao aumento da tensão muscular — o que, portanto, aumenta o débito cardíaco decorrente do consequente aumento do retorno venoso.12 Sendo esta resposta marcadamente diferente de um coração não transplantado que apresentaria, em um primeiro momento de esforço físico, uma diminuição da atividade parassimpática vagal, que aumentaria abruptamente o ritmo cardíaco seguido de um aumento progressivo gerado pela combinação de estimulação simpática e humoral por catecolaminas.14
Além disso, por conta da dependência mais marcada da concentração de catecolaminas circulantes, no que tange aumentos da frequência cardíaca, o órgão transplantado apresentará uma resposta cronotrópica lenta, retardada, e com frequência cardíaca submáxima durante o exercício, que continua a se elevar por um tempo por conta da liberação humoral tardia das próprias catecolaminas.12,14 Ao analisar a normalização do ritmo cardíaco e força de contração na recuperação do exercício, nota-se diminuição lenta da FC a partir da metabolização gradual da norepinefrina e epinefrina e diminuição da força de contração pelo mecanismo reverso de Frank-Starling em vez de ser por diminuição da estimulação simpática e por aumento da parassimpática como em um coração normal.14
Não obstante a adequação cardíaca a esses mecanismos adaptativos atípicos, os receptores do coração transplantado apresentam uma capacidade inferior para a prática de exercícios físicos – embora apresentem função hemodinâmica normal e satisfatória para condições de repouso. Apesar disso, os indivíduos receptores detêm capacidade o suficiente para realizar funções rotineiras e exercícios leves e moderados, o que lhes proporciona admirável qualidade de vida, a despeito do coração transplantado, apesar de terem ritmo cardíaco basal mais elevado por conta da secção parassimpática.12
Alguns estudos na literatura médica já indicam que a reinervação pode ocorrer em determinados pacientes em um período relativamente tardio após a realização da cirurgia de transplante cardíaco. Embora não caracterize evento certeiro, sugere-se que a reinervação pode, decerto, levar a uma melhora funcional do coração transplantado, mormente no que tange a prática de exercícios físicos. Apesar disso, como o coração transplantado, via de regra, não apresenta inervação aferente e eferente, os receptores não são capazes de experimentar a sensação de angina pectoris (popularmente caracterizada como a clássica “dor no peito”) em resposta a um quadro isquêmico ou infarto. Dessa forma, esses pacientes podem experimentar sobretudo os sintomas relacionados com as sequelas em decorrência da isquemia, tais como a dispnéia (em consequência da insuficiência cardíaca), arritmias ou baixo débito cardíaco. Em vista disso, é fundamental a atenção minuciosa, por parte dos médicos que acompanham esses indivíduos no período pós operatório tardio, caso haja sinais ou sintomas sutis, os quais podem sinalizar uma doença cardíaca isquêmica.12
9. COMPLICAÇÕES PRECOCES
O transplante cardíaco é considerado uma cirurgia de grande porte e de alta complexidade e pode apresentar complicações pós-operatórias. As complicações precoces que mais acometem os pacientes são insuficiência renal, disfunção do ventrículo direito (DVD), disfunção primária do enxerto cardíaco (DPE) e infecções.15,21
Segundo a terceira diretriz Brasileira de Transplante Cardíaco, as principais drogas utilizadas no transplante são a ciclosporina associada a outro imunossupressor, além dos corticoides. Esses imunossupressores inibidores da calcineurina tendem a apresentar efeitos nefrotóxicos, levando a uma disfunção renal. No entanto, essa deterioração da função renal pode ser relacionada à idade, à má função renal pré-operatória, ao trauma cirúrgico ou a distúrbios perioperatórios. Diante disso, é recomendado evitar o uso precoce e doses elevadas dos inibidores da calcineurina como de outras drogas nefrotóxicas.10
A DVD é uma complicação hemodinâmica comum no pós-operatório do transplante cardíaco e pode ser a principal causa do fracasso imediato do procedimento. Essa falência do VD deve-se a um maior tempo de isquemia (mais de 4 horas), resistência vascular pulmonar (RVP) elevada do receptor, desenvolvimento insuficiente do VD do doador – levando a uma incapacidade de vencer a RVP – proteção inadequada do enxerto, hipoxemia, baixa pressão de perfusão coronariana e hipertensão pulmonar. O tratamento da disfunção da VD envolve a diminuição da RVP usando agentes inotrópicos tais como o isoproterenol, a dobutamina ou a milrinona. Uma outra alternativa terapêutica é a utilização de vasodilatadores pulmonares como nitroprussiato de sódio em dose baixa, milrinona ou óxido nítrico. Este último produz vasodilatação pulmonar sem causar vasodilatação sistêmica e aumenta o fluxo sanguíneo somente nas áreas ventiladas do pulmão, melhorando a relação ventilação/perfusão.10
A infecção é uma das complicações que mais preocupam os profissionais por ser uma das principais causas de morbi-mortalidade associadas ao TC dentre as demais complicações. Ela pode ocorrer em qualquer período pós-operatório, variando de bactérias ou vírus (principalmente infecções por agentes oportunistas como citomegalovírus) e fungos. Esse risco de infecção deve-se a intensificação da imunossupressão devido ao maior risco de rejeição do enxerto nos 6 primeiros meses após o transplante e se organiza em 3 períodos: infecções no primeiro mês de pós-operatório, até 6 meses e mais de 6 meses. As infecções que ocorrem no primeiro mês após o transplante são as infecções hospitalares, geralmente de etiologia bacteriana e dependentes da flora hospitalar. Podem surgir também nesse período algumas infecções oportunistas como as reativações de herpes simples e a candidíase mucocutânea, além de infecções de sítio cirúrgico. A partir do segundo mês até o sexto mês pós-operatório, prevalecem as infecções por agentes oportunistas como CMV, Toxoplasma gondii, Aspergillus, e pneumonia por Pneumocystis jirovecii. Após o sexto mês, com a redução progressiva do risco de rejeição e, consequente redução da intensidade de imunossupressão, ocorrem mais as infecções extra-hospitalares, semelhantes ao da população em geral.1
10. REJEIÇÃO E IMUNOSSUPRESSÃO
No genoma humano, o complexo principal de histocompatibilidade (MHC) forma um conjunto de loci para genes de característica polimórfica, os quais codificam para um grupo de proteínas de mesmo nome. Localizados nas membranas das células, os receptores de MHC, também chamados de HLA (do inglês, human leukocyte antigen), desempenham um importante papel no reconhecimento e na apresentação de antígenos, numa ação integrada entre imunidade inata e adaptativa. Estudos comprovaram a existência de pouco mais de 11 mil alelos na composição de genes para a síntese de HLA, o que justifica a criteriosa seleção de um órgão doador a um indivíduo receptor — afinal, a alta diversidade genética na formação desses receptores está intimamente associada às chances de aceitação ao enxerto.16,21
A rejeição ao órgão transplantado pode ocorrer tanto por mecanismo celular quanto humoral, sendo três as formas clássicas observadas: hiperaguda, aguda celular e aguda humoral.1 A primeira delas está relacionada à pré-existência de imunoglobulinas contra o órgão doador, sendo claramente caracterizada como uma rejeição de incidência incomum, já que os critérios de seleção cirúrgica levam em consideração o sistema ABO e a compatibilidade genética por HLA. Quando há presença significativa de células inflamatórias no tecido cardíaco enxertado, porém, observa-se uma rejeição aguda celular: a forma mais frequente e causa importante de óbito tardio, embora precocemente diagnosticada caso a biópsia endomiocárdica seja periódica no acompanhamento hospitalar pós-operatório. Por fim, mediante alossensibilização, isto é, exposição prévia a procedimentos que induzam a produção de anticorpos, como transfusão sanguínea e gestação Rh incompatível, é possível que se desenvolva um quadro de rejeição aguda humoral, com danos anti HLA ao endotélio vascular do enxerto.1, 17
A fim de prevenir ou amenizar um possível cenário de rejeição, nas suas variadas manifestações e intensidades, os pacientes transplantados são levados a uma terapia de imunossupressão, normalmente realizada pela administração de três classes medicamentosas: corticosteroide, inibidor de calcineurina e antiproliferativo. Como destaque, é possível citar a ciclosporina e o tacrolimus, drogas inibidoras de calcineurina, que apresentam resultados semelhantes, embora o último seja preferível em casos de rejeição por resistência a corticosteroides. Para os antiproliferativos, tem sido demonstrado o uso de micofenolato em detrimento de azatioprina na literatura, uma vez que ele afirma superioridade no controle da rejeição e, possivelmente, na redução da doença vascular do enxerto.1 Também é comum a realização da chamada terapia de indução, presente em aproximadamente 50% dos TCs, seja durante o transplante ou em seu pós-operatório imediato, no intuito de prevenir o enxerto da resposta imune do receptor por meio de tratamento imunossupressor intenso.1, 10
11. COMPLICAÇÕES TARDIAS
11.1 REJEIÇÃO HUMORAL CRÔNICA – DOENÇA VASCULAR DO ENXERTO (DVE)
A doença vascular do enxerto (DVE) é a principal responsável pela morte de indivíduos transplantados e consiste na proliferação difusa das células musculares na túnica íntima, com o acúmulo de células inflamatórias e lipídeos. É uma doença com múltiplas causas, sendo a dislipidemia e a resistência à insulina as principais. É também um processo inflamatório devido ao aumento da espessura da íntima, que acaba se tornando contínuo, visto que as células musculares não param de se multiplicar.18
No diagnóstico, os métodos são divididos em invasivos e não invasivos, variando a especificidade e a acurácia. O método padrão ouro seria a angiografia coronariana, mas seu ponto negativo é a dificuldade de realizar um diagnóstico precoce, graças à sua baixa sensibilidade e ao fato de detectar apenas lesões maiores. Outro exame seria a ecografia intravascular, que é invasiva, mas muito eficaz para o prognóstico, pois consegue avaliar o espessamento do vaso. Vale ressaltar que a biópsia não é recomendada nesse caso, pois pode ser feita de uma parte que não foi acometida pela doença.18
É importante fazer o diagnóstico diferencial da aterosclerose, que é o acúmulo focal de placas de determinadas substâncias, como gordura e cálcio na parede dos vasos. Enquanto que na DVE a proliferação é difusa, na aterosclerose, ela é mais localizada e frequentemente tem mais depósito de cálcio. Outro aspecto importante é que a DVE apresenta características inflamatórias, enquanto a aterosclerose, não.18
A prevenção seria a realização da angiografia anualmente, prevenção da infecção pelo Citomegalovírus, o qual provoca o aumento das células, e controle dos fatores de risco cardiovasculares, como dislipidemia e hipertensão. É importante ressaltar que a hipertensão pode acometer cerca de 90% dos pacientes após 1 ano de transplante, podendo ser resultado pelo uso de ciclosporina, relevante imunossupressor utilizado no tratamento pós transplante.18
O tratamento definitivo seria o transplante, mas, devido às dificuldades, é comum a revascularização e a cirurgia, mas eles não impedem a progressão da doença, sendo um tratamento de ação de caráter paliativo.18
11.2 NEOPLASIAS
Juntamente com a doença vascular do enxerto DVE, as neoplasias figuram entre os fatores de maior impacto na morbimortalidade do paciente em pós-operatório tardio de TxC (transplante cardíaco), visto que o uso contínuo das drogas imunossupressoras faz com que a chance de adquirir câncer seja maior entre os pacientes submetidos a transplante do que no público em geral. Além disso, a ocorrência de malignidades entre os pacientes transplantados cardíacos, em comparação, por exemplo, com os transplantados renais, é maior. Isto se justifica pelo regime mais intenso de imunossupressão. Em média, as neoplasias são diagnosticadas entre 3 e 5 anos após o transplante, tempo esse que pode ser considerado dentro das complicações tardias.10
Segundo a terceira Diretriz Brasileira de transplante cardíaco observa-se que os principais fatores de risco para o desenvolvimento das malignidades são tipo, duração e dose dos imunossupressores, infecções por alguns tipos específicos de vírus e exposição solar. As malignidades mais frequentes são, nesta ordem, as neoplasias cutâneas, as Desordens Linfoproliferativas Pós-Transplante (DLPT) e o sarcoma de Kaposi. Neoplasias em órgãos sólidos, como pulmão, fígado, rins e cólon também têm sua frequência aumentada. Curiosamente, alguns tipos de câncer, como o de mama e o de próstata, têm sua ocorrência reduzida entre os pacientes transplantados.10
Doença linfoproliferativa pós-transplante (DLPT) é considerada uma complicação potencialmente fatal secundária a imunossupressão farmacológica em pacientes que são submetidos a transplante de órgãos sólidos. Sua incidência varia de acordo com o órgão transplantado e é significativamente maior em crianças. DLPT representa um largo espectro de alterações caracterizadas por vários graus de proliferação anormal do tecido linfóide, que se diferenciam em relação à patogênese, aparência histológica e comportamento clínico.10
Considerando que as doenças linfoproliferativas pós-transplante são o segundo tipo de neoplasia que mais se desenvolvem em receptores de transplantes, observa-se que o espectro desta doença envolve lesões hiperplásicas, doença polimórfica ou monomórfica, sendo que esta última forma inclui os linfomas, que são a forma mais grave de acometimento.19
Os achados de imagem também são variáveis, refletindo a possibilidade de envolvimento de múltiplos órgãos e sistemas, típico da doença. Além de suspeitar do diagnóstico.19
12. RESULTADOS E LIMITAÇÕES DO TRANSPLANTE CARDÍACO NO BRASIL
O transplante cardíaco é atualmente a abordagem cirúrgica definitiva padrão-ouro no tratamento da insuficiência cardíaca refratária. No entanto, a escassez de doadores limita a realização de um número maior de transplantes cardíacos, situação em que vem aumentando a utilização de dispositivos de assistência circulatória mecânica. Com indicações e contraindicações bem estabelecidas, além de diagnóstico e tratamento de rejeição, por meio de protocolos definidos de imunossupressão, os resultados do transplante cardíaco são muito favoráveis.1
Apesar das dificuldades para realização do transplante cardíaco, em especial pela escassez de doadores e pela elevada mortalidade em fila de espera, no Brasil, existe um grande potencial, tanto no aumento de doadores efetivos, quanto na utilização de dispositivos de assistência circulatória, o que pode vir a impactar positivamente no número e nos resultados do transplante cardíaco.1
No Brasil, apesar de um perfil de doadores mais jovens, com poucas comorbidades e diagnóstico de morte encefálica em grande número secundária a trauma, a efetivação da doação é limitada, em especial pelas condições desses doadores. Além disso, para os doadores mais velhos, a indisponibilidade de ecocardiograma e cineangiocoronariografia para a avaliação amplifica a inviabilização de potenciais doadores. No mundo, apesar de um melhor aproveitamento dos doadores mesmo com um perfil de idade mais avançada e com mais comorbidades, o número de TCs encontra-se estacionado, devido à escassez inerente de órgãos.1
Com todas as dificuldades para realização do transplante cardíaco, em especial pela escassez de doadores e pela elevada mortalidade em fila de espera no Brasil, existe um grande potencial tanto no aumento de doadores efetivos, quanto na utilização de dispositivos de assistência circulatória, o que pode vir a impactar positivamente no número e nos resultados do transplante cardíaco.1
13. CONCLUSÃO
A fim de realizar um transplante cardíaco, há diversos fatores a serem avaliados, começando pelas bases anatômicas fundamentais para o entendimento do procedimento, como os átrios, ventrículos, os grandes vasos sanguíneos que no coração entram e saem, além de componentes responsáveis por sua inervação e irrigação, assim como relações anatômicas próximas ao órgão e sua localização. Há necessidade, também, de investigar as indicações e contraindicações para o procedimento, como IC em seus diferentes estágios como indicação principal, e doenças que trariam possíveis complicações como contraindicações, como obesidade, comorbidade com baixa expectativa de vida, infecções sistêmicas ativas, entre outros. Deve-se realizar a criteriosa escolha do doador, com avaliação de compatibilidade, além de avaliar possível rejeição, havendo precaução meticulosa para tanto. No transplante propriamente dito, há dois métodos tradicionais mais utilizados, o Biatrial e o bicaval/ortotópico total, ambos com suas limitações e seus benefícios, dependendo de cada caso clínico e cirurgião. De fato, como ocorre em qualquer procedimento cirúrgico, há riscos, assim como há possíveis complicações. No TC, há complicações tanto precoces quanto tardias, mas que, no geral, são superadas pelos benefícios do transplante quando em comparação com o quadro cardíaco grave antecedente ao procedimento. Pode haver, também, a possibilidade de formação de Neoplasias por conta da imunossupressão induzida. Todos esses fatores prós e contras devem ser avaliados pelo cirurgião e pelo paciente antes da cirurgia a fim de determinar o melhor caminho a ser seguido.
14. REFERÊNCIAS BIBLIOGRÁFICAS
1. Mangini Sandrigo, Alves Bárbara Rubim, Silvestre Odílson Marcos, Pires Philippe Vieira, Pires Lucas José Tachotti, Curiati Milena Novaes Cardoso et al . Transplante cardíaco: revisão. Einstein (São Paulo) [Internet]. 2015 June [cited 2021 Mar 18] ; 13( 2 ): 310-318. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1679-45082015000200025&lng=en.
2. Braile DM, Godoy MF. História da cirurgia cardíaca no mundo [bibliography on the Internet]. 1st ed. São José do Rio Preto: Revista Brasileira de Cirurgia Cardiovascular; 2012 [cited 2021 May 5]. 27 vol. Disponível em: https://www.scielo.br/scielo.php?pid=S0102- 76382012000100019&script=sci_arttext&tlng=pt
3. Brasil, Ministério da Saúde. Banco de dados do Sistema Único de Saúde – DATASUS; [cited 2021 May 5]. Disponível em: http://www.datasus.gov.br
4. Ranjit John, MD e Kenneth Liao, MD . Orthotopic Heart Transplantation. Optechstcvs [Internet]. 2010 July [cited 2021 May 09]; 15(2): 138-146. Disponível em: https://www.optechtcs.com/article/S1522-2942(10)00036-X/fulltext
5. Conti, C Richard. Coleção Netter de Ilustrações Médicas vol. 8. 2 ed. Rio de Janeiro: Elsevier; 2015
6. Gardner, Ernest. Anatomia: Estudo Regional do Corpo Humano. 4 ed. Rio de Janeiro: Guanabara Koogan, 2001
7. Sobotta, Johannes. Atlas de Anatomia Humana. 21ªed. Rio de Janeiro: Guanabara Koogan, 2000”
8. Conti, C Richard. The Netter Collection of Medical Illustrations vol 8. 2 ed. Philadelphia: Elsevier; 2014
9. Gray, Henry. Anatomia. 40 ed. Rio de Janeiro: Elsevier; 2010
10. Bacal Fernando, Marcondes-Braga Fabiana G., Rohde Luis Eduardo Paim, Xavier Júnior José Leudo, Brito Flávio de Souza, Moura Lídia Ana Zytynski et al. 3ª Diretriz Brasileira de Transplante Cardíaco. Arq. Bras. Cardiol. [Internet]. 2018 Aug [cited 2021 May 04]; 111(2): 230-289. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0066-782X2018001400230&lng=en
11. Mendes Sofia Lázaro, Moreira Nadia, Batista Manuel, Ferreira Ana Rita, Marinho Ana Vera, Prieto David et al . Resultados Clínicos e Hemodinâmicos de Longo Prazo após o Transplante de Coração em Pacientes Pré-Tratados com Sildenafil. Arq. Bras. Cardiol. [Internet]. 2021 Feb [cited 2021 May 01] ; 116( 2 ): 219-226. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0066-782X2021000200219&lng=en
12. Braunwald. Tratado de Doenças Cardiovasculares, 10ªed. São Paulo: Roca, 2006.
13. Copeland H, Copeland JG. Heterotopic Heart Transplantation; 2018. Disponível em: https://www.intechopen.com/books/heart-transplantation/heterotopic-heart-transplantation
14. Robert F. Wilson, Thomas H. Johnson, George C. Haidet, Spencer H. Kubo, and Marcus Mianuelli . Sympathetic Reinnervation of the Sinus Node and Exercise Hemodynamics After Cardiac Transplantation. Circulation [Internet]. 2000 June[cited 2021 May 08] ; 101(23): 2716–2720. Disponível em: https://doi.org/10.1161/01.CIR.101.23.2727
15. Elaine Araújo da Silva, Daclé Vilma Carvalho. Transplante cardíaco: complicações apresentadas por pacientes durante a internação. Escola Anna Nery; 2012 [cited 2021 April 9]; 16 (4): p. 674-681. Disponível em: https://doi.org/10.1590/S1414-81452012000400005
16. Goldberg AC, Rizzo LV. Estrutura do MHC e função – apresentação de antígenos. Parte 1. São Paulo: Hospital Israelita Albert Einstein; 2014 [cited 2021 Apr 15]. Disponível em: https://www.scielo.br/pdf/eins/v13n1/pt_1679-4508-eins-1679-45082015RB3122.pdf
17. Moreira RD, Moriel AR, Murta LO, Neves LA, Godoy MF. Dimensão fractal na quantificação do grau de rejeição celular miocárdica pós-transplante cardíaco. 2nd ed. São José do Rio Preto: Revista Brasileira de Cirurgia Cardiovascular; 2021 [cited 2021 Apr 21]. 26 vol. Disponível em: https://www.scielo.br/scielo.php?pid=S0102-76382011000200004&script=sci_arttext
18. Calé Rita, Rebocho José Maria, Aguiar Carlos, Almeida Manuel, Melo e Queiroz João, Silva Aniceto José. Diagnóstico, prevenção e tratamento da doença vascular do aloenxerto. Revista Portuguesa de Cardiologia (Lisboa) 2012 [cited 2021 Apr 29] 31(11): 721-730. Disponível em: https://www.sciencedirect.com/science/article/pii/S087025511200193X
19. Almir Galvão Vieira Bitencourt; Paula Nicole Vieira Pinto; Maria Fernanda Arruda Almeida; Wagner Santana Cerqueira; André Moreira de Assis; Adriana Michiko da Silva Tanaka Rodrigues; Rubens Chojniak.Incidência e aspectos de imagem do linfoma pós-transplante hepático em crianças, 2012 [cited 2021 May 14] Radiol Bras vol.45 no.1 São Paulo Jan./Feb. 2012. Disponível em: https://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100- 39842012000100004#:~:text=Doen%C3%A7a%20linfoproliferativa%20p%C3%B3s%2Dtra nsplante%20(DLPT,crian%C3%A7as(1%2D3)
20. Bounader K, Flécher E. End-stage heart failure: The future of heart transplant and artificial heart. Presse Med [Internet]. 2024 [cited 2024 Jun 10];53(1):104191. Disponível em: https://pubmed.ncbi.nlm.nih.gov/37898310/
21. Wu MY, Ali Khawaja RD, Vargas D. Heart transplantation. Radiol Clin North Am [Internet]. 2023 [cited 2024 Jun 10];61(5):847–59. Disponível em: https://pubmed.ncbi.nlm.nih.gov/37495292
22. Souza RVO de, Caldeira RM, Castello RCR, Lobo TF da C. As Opções Terapêuticas Para O Tratamento Da Insuficiência Cardíaca. In: Cardiologia Em Foco: Prevenção, Diagnóstico E Tratamentos Atuais. Epitaya; 2023. p. 82–106.
23. Lemos ALMA, Camillo B de Q, Alves ECM, Carrijo LF, Cavalcante L de AL, Vieira MVA, et al. A Importância Da Abordagem Clínica E Terapêutica Para Manejo E Tratamento Da Insuficiência Cardíaca Avançada. In: Coração Em Foco: Explorando Os Aspectos Fundamentais Da Saúde Cardíaca. Epitaya; 2024. p. 429–54.
24. Dávila FT, Andrade GA de, Oliveira LG de, Oliveira SLA de, Melo V de JV. Perspectivas Em Transplante Cardíaco: Uma Abordagem Dos Recursos Atualmente Disponíveis. In: Saúde Cardiovascular: Conhecimento, Prevenção E Cuidado. Epitaya; 2024. p. 777–98.
