QUANTITATIVE ANALYSIS OF DENGUE CASES IN THE MUNICIPALITIES OF THE NORTHERN COAST OF SÃO PAULO FROM JANUARY 2014 TO DECEMBER 2023
REGISTRO DOI: 10.69849/revistaft/ni10202411120727
Maria Luisa Colacio dos Santos; Karolina Marie Alix Benedictte Van Sebroeck Doria; Solange Maria Franco de Vasconcelos
Resumo
A dengue caracteriza-se como uma enfermidade provocada por um vírus do gênero Flavivírus, transmitida por mosquitos do gênero Aedes, sendo o Aedes aegypti o principal vetor. Devido à sua vasta distribuição e adaptação em ambientes urbanos e Peri domiciliares a dengue é predominantemente encontrada em áreas urbanas. O habitat ideal para o mosquito são as regiões de clima tropical, o que torna o Brasil propício para sua proliferação. Além dos fatores climáticos, a urbanização desordenada também contribui para a multiplicação do mosquito, aumentando os locais propícios para sua reprodução. O ciclo de vida do vetor compreende o ovo, quatro estádios larvais, um estádio de pupa e o adulto, com vida média 10 a 42 dias. Os sintomas da dengue geralmente incluem mal-estar, febre e fraqueza, e a doença tende a ser autolimitada na maioria dos casos, sendo diagnosticada através de exames laboratoriais e caso clínico. O objetivo deste trabalho consiste em analisar o número de casos de dengue nos municípios do litoral norte de São Paulo, Brasil, no período de janeiro de 2014 a dezembro de 2023, tendo sido observado o maior índice no município de São Sebastião com 14,95% de casos de dengue em relação à população total e a menor taxa de casos na Ilhabela uma porcentagem em torno de 7,37%. O ano com maior número de casos na região foi 2015 nos municípios de Caraguatatuba, Ubatuba e São Sebastião e Ilhabela em 2014.
Palavras-chave: saúde pública; dengue; epidemia; litoral norte de São Paulo-Brasil
Abstract
Dengue is characterized as a disease caused by a virus of the Flavivirus genus, transmitted by mosquitoes of the Aedes genus, with Aedes aegypti being the main vector. Due to its wide distribution and adaptation to urban and peri-domestic environments, dengue is predominantly found in urban areas. The ideal habitat for the mosquito is a tropical climate, which makes Brazil ideal for its proliferation. In addition to climatic factors, disorderly urbanization also contributes to the multiplication of the mosquito, increasing the places where it can reproduce. The vector’s life cycle comprises the egg, four larval stages, a pupal stage and the adult, with an average lifespan of 10 to 42 days. Dengue symptoms generally include malaise, fever and weakness, and the disease tends to be self-limiting in most cases, being diagnosed through laboratory tests and clinical case. The aim of this study is to analyze the number of dengue cases in the municipalities of the north coast of São Paulo, Brazil, from January 2014 to December 2023, with the highest rate being observed in the municipality of São Sebastião with 14.95% of dengue cases in relation to the total population and the lowest rate of cases in Ilhabela with a percentage of around 7.37%. The year with the highest number of cases in the region was 2015 in the municipalities of Caraguatatuba, Ubatuba and São Sebastião and Ilhabela in 2014.
Keywords: public health; dengue; epidemic; north coast of São Paulo- Brazil.
1. Introdução
A dengue consiste em um grupo de doenças denominadas arboviroses, causadas por vírus transmitidos através de vetores artrópodes. Os vírus dengues (DENV) são classificados cientificamente na família Flaviviridae, e do gênero Flavivirus caracterizados por RNA simples, três membranas, estruturais capsídeo, membrana (M, expressa como prM, o precursor de M) e envelope (E), sendo conhecidos cientificamente quatro sorotipos: DENV1, DENV-2, DENV-3 e DENV- 4; todos desenvolvem distintos materiais genéticos, genótipos e linhagens. [1],[2]
No Brasil o vetor conhecido é a fêmea do mosquito Aedes aegypti, que infectado transmite o vírus através da picada. A transmissão do vírus também pode ocorrer de mãe para filho durante o período gestacional e raramente por transfusão sanguínea com material contaminado pelo vírus. [1],[2],[3]
2. Histórico da dengue
Relatos clínicos e epidemiológicos que sugerem a presença de dengue foram encontrados em uma enciclopédia chinesa datada de 610, embora o ano exato da ocorrência da doença não seja preciso.[4],[5] Também são mencionados surtos de uma doença febril aguda no Oeste da Índia Francesa em 1635 e no Panamá em 1699; mas não há consenso se esses casos se referem à febre de dengue ou à chikungunya. Os eventos mais bem documentados na literatura, antes da identificação dos agentes causadores, ocorreram na ilha de Java, em Jacarta, e no Egito, ambos em 1779, além de um registro na Filadélfia, EUA, no ano seguinte. Algumas evidências indicam que epidemias de dengue já ocorriam no Brasil desde 1846, com registros nas cidades de São Paulo e Rio de Janeiro. [4],[5], [6], [7], [9]
Segundo Howe (1977), entre 1779 e 1916, ocorreram oito epidemias no mundo, com duração de três a sete anos cada. Após a Segunda Guerra Mundial, epidemias de dengue grave surgiram em vários países do sudeste Asiático. A primeira pandemia foi nas Filipinas, em 1956, associada aos sorotipos DEN-3 e DEN-4. Posteriormente, a doença atingiu a Tailândia em 1958, o sul do Vietnã em 1960, Cingapura em 1962, Malásia em 1963, Indonésia em 1969 e Birmânia em 1970. Nos últimos 40 anos, estima-se que cerca de 3 milhões de casos de dengue grave foram registrados, resultando em aproximadamente 58 mil mortes. [4], [5], [6], [7], [9],[8], [10].
3. Caracterização dos transmissores da dengue
O Aedes aegypti é o mosquito transmissor da dengue, cujas características físicas que os diferenciam dos outros mosquitos são o seu corpo preto com listras brancas no tronco na cabeça e nas pernas, porte pequeno, asas translúcidas e seus ruídos praticamente inaudíveis à espécie humana. O macho da espécie tem como base alimentar exclusiva as frutas, a fêmea por sua vez necessita de sangue para a maturação dos ovos, que por sua vez são depositados em superfícies de água limpa e locais com condições de sobrevivência adequadas, geralmente depositam seus ovos milímetros acima de sua superfície. [4] [11] [12] [13] [14] ‘’
O ciclo de vida do Aedes aegypti compreende o ovo, quatro estádios larvais, um estádio de pupa e o adulto. Os ovos são fixados individualmente nas paredes internas dos recipientes na área úmida logo acima da superfície da água. Em geral, o desenvolvimento embrionário dura cerca de 48 horas, quando o ambiente é úmido e quente. [4] [11] Após a conclusão desse desenvolvimento, os ovos podem resistir a longos períodos de dessecação, algumas vezes por mais de um ano. Ao entrarem novamente em contato com a água, a maioria dos ovos eclode rapidamente, embora alguns precisem ser molhados várias vezes. A capacidade dos ovos de suportarem a dessecação é um dos maiores desafios para a erradicação desse vetor. Além disso, os ovos podem ser transportados por longas distâncias em recipientes secos. [4] [11] [12]
A eliminação dos mosquitos adultos em uma área por vários meses não impede a reinfestação, já que os ovos dessecados, presentes em recipientes secos, podem reiniciar a população de mosquitos ao serem molhados novamente.[4][11][12] As larvas passam por quatro estágios de desenvolvimento, cuja duração depende da temperatura, disponibilidade de alimento e densidade larvária no recipiente. Em condições ideais, o período entre a eclosão do ovo e a pupação pode ser de até cinco dias, enquanto em condições adversas, como baixas temperaturas ou alimentação insuficiente, pode levar várias semanas. Embora a falta de alimento possa prejudicar o crescimento das larvas, a mortalidade antes da maturidade é mais frequentemente causada pelo excesso de água, drenagem ou secagem prematura. As pupas não se alimentam e têm como função a metamorfose do estágio larval para o adulto, o que geralmente ocorre em período de dois a três dias. Um ou dois dias após emergirem, os adultos se acasalam, e as fêmeas realizam o repasto sanguíneo. [4] [11] [12] [13] [14] [15] Embora possam se alimentar do sangue da maioria dos vertebrados, as fêmeas demonstram clara preferência pelo sangue humano. Em média a taxa de vida abrange em torno de 10 a 42 dias e nesse período a fêmea chega a colocar em média 150 a 300 ovos com dispersão de 30 a 50 metros.
Caso seja depositado por uma fêmea contaminada pelo vírus ao fim do ciclo evolutivo, se tornarão transmissores da doença, no qual o mosquito apto a transmitir o vírus após 8 a 12 dias de incubação extrínseca’’. [4] [11] [12] [13] [14] [15].
O Aedes albopictus é predominantemente uma espécie silvestre, adaptando-se a ambientes rurais, suburbanos e urbanos. Menos doméstico que o Aedes aegypti, ele se alimenta e oviposição em áreas peridomiciliares, apresentando uma capacidade de dispersão pelo voo de até 500 metros, o que lhe permite se adaptar melhor a regiões frias, como o Norte da Ásia, onde seus ovos passam o inverno em diapausa. Na Ásia, o Aedes albopictus é um vetor de importância secundária, com surtos frequentes em áreas rurais da Indonésia, onde é a espécie predominante. Nas Américas, ainda não foi identificado consistentemente como vetor da dengue, embora alguns estudos tenham detectado mosquitos naturalmente infectados. Tanto o Aedes aegypti quanto o Aedes albopictus pertencem ao subgênero Stegomyia, que recentemente foi sugerido como um gênero à parte.[4]
3.2 Diagnóstico
Para o diagnóstico de pronto atendimento hospitalar são analisados o quadro clínico do paciente e exames laboratoriais, sendo eles: testes rápidos de NS1 que detecta a fase aguda da doença com janela imunológica do primeiro ao quinto dia de sintoma; testes rápidos de IGG e IGM, pesquisam os anticorpos do paciente sobre o vírus, que são detectados a partir do sexto dia de início da doença. Após ser decretada a epidemia o diagnóstico é feito através de parâmetros clínicos, leucopenia com linfócitos atípicos e plaquetopenia. [1], [4].
3.3 Prevenção
A prevenção da dengue é uma estratégia fundamental para o controle da propagação do vírus transmitido pelo mosquito Aedes aegypti.Além das iniciativas domiciliares, como eliminar ou cobrir recipientes que possam acumular água, como pneus, vasos de plantas, garrafas, calhas e caixas d’água, pois o mosquito deposita seus ovos em água limpa e parada. As autoridades de saúde devem implementar programas de vigilância contínua, com o mapeamento das áreas de maior risco e a realização de campanhas de conscientização para educar a população sobre os hábitos do mosquito e as formas de prevenção. A aplicação de inseticidas, embora útil em determinadas situações, deve ser empregada com cautela e em emergência, para evitar a resistência do mosquito e possíveis acidentes domiciliares.[16] [17]
O Índice de Infestação Predial (IIP) é um dos parâmetros mais utilizados para avaliar o risco de transmissão da dengue em uma área, baseado no monitoramento da presença de larvas do mosquito Aedes aegypti em imóveis. O índice larvário é calculado a partir da proporção de imóveis com larvas em relação ao total de imóveis inspecionados, permite classificar áreas de risco e orientar ações de controle. Índice de Infestação Baixo (< 1%), considerado risco baixo, satisfatória, mas exige manutenção de vigilância e ações preventivas para evitar o aumento,Índice de Infestação Médio (entre 1% e 3,9%) indica risco moderado sugerindo um potencial para epidemia, sendo necessário intensificar ações de controle e monitoramento.O Índice de Infestação Alto (≥ 4%), risco alto comelevada probabilidade de surtos de dengue, com risco significativo para a população, exige medidas de controle intensivas e emergenciais para reduzir o índice rapidamente. É utilizado também o Índice de Breteau, que mede a quantidade de criadouros com larvas por 100 imóveis, fornecendo uma visão complementar. [6], [7].
O Brasil se tornou o primeiro país do mundo a disponibilizar a vacina contra a dengue por meio de seu sistema público de saúde universal. Em dezembro de 2023, o Ministério da Saúde incorporou o imunizante, após análise acelerada da Conitec (Comissão Nacional de Incorporação de Tecnologias no SUS), iniciando a aplicação na população de regiões endêmicas em 521 municípios. A Anvisa aprovou em 2 de março de 2024, o registro de uma nova vacina para prevenção da dengue, por meio da Resolução RE 661/23. A vacina Qdenga, desenvolvida pela empresa Takeda Pharma Ltda., é formulada com quatro sorotipos causadores da doença e a vacinação é permitida para crianças a partir de 4 anos de idade até adultos de 60 anos, para as quais foi testada. Para adultos acima de 60 anos não está autorizada pela Anvisa, aguardando testes clínicos de segurança e eficácia. A aplicação do imunizante, composto por duas doses, ocorre via subcutânea com intervalo de três meses. [16] [17] [18]
4 Área de estudo
O presente trabalho apresenta análises quantitativas de casos de dengue, de acordo com dados populacionais do censo de 2022 do Instituto Brasileiro de Geografia e Estatística (IBGE) nos municípios do litoral norte do estado de São Paulo, Figura 1, no período de janeiro de 2014 a dezembro de 2023.
Figura 1- Mapa de localização do litoral norte do estado de São Paulo – Brasil
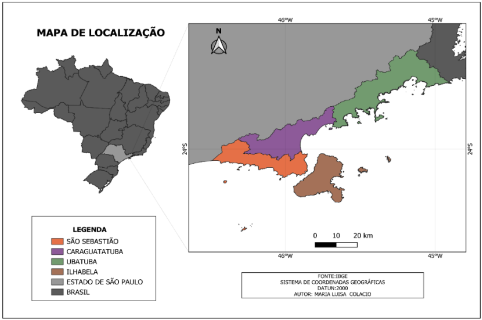
Os municípios pertencentes ao litoral norte de São Paulo são: Caraguatatuba com 134.873 habitantes, densidade demográfica de 278,12 habitantes por quilômetro quadrado e área territorial de 484,947 km²; São Sebastião com 81.595 habitantes e densidade demográfica de 202,77 habitantes por quilômetro quadrado, com área territorial de 402,395 km²; Ubatuba 92.981 habitantes e densidade demográfica de 131,31 habitantes por quilômetro quadrado, com área territorial de 708,105 km² e Ilhabela com 34.934 habitantes, densidade demográfica de 100,85 habitantes por quilômetro quadrado e área territorial de 346,389km², mostrados na Tabela 1.
Tabela 1- Dados estatísticos dos municípios do litoral norte de São Paulo.
Município Habitantes Área (Km2) Densidade demográfica (hab/Km2) Caraguatatuba 134.873 484,947 278,12 São Sebastião 81.595 402,395 202,77 Ubatuba 92.981 708,105 131,31 Ilhabela 34.934 346,389 100,85
A importância da análise dos dados de casos da dengue por município indica o grau de risco que o município se encontra, possibilitando a escolha das melhores estratégias de campanhas de prevenção e tratamento dos infectados.[5], [19],[20].
5 Metodologia
Refere-se a um estudo descritivo, de coorte retrospectivo e procedimento quantitativo, com dados estatísticos coletados de bancos de dados de domínio público: Departamento de Informática do Ministério da Saúde (DATASUS) do qual foram retirados os resultados por período e região da doença, IBGE com os dados estatísticos das informações populacionais de cada município e sites de domínio público. O processo de análise de dados foi realizado a partir de softwares Microsoft Excel 2010, Microsoft Word, dados literários.
6 Resultado e Discussões
Com base nos resultados da análise de dados referentes ao período de janeiro de 2014 a dezembro de 2023, nos municípios do litoral norte de São Paulo, foram utilizadas as notificações de casos de dengue fornecidas pelo DATASUS. Os resultados obtidos são mostrados nos gráficos 1 a 4, referentes a cada município específico.No município de Caraguatatuba, a porcentagem de casos de dengue no período em relação à população total é de aproximadamente 10,01%, com os períodos mais críticos da doença em 2015, 2019 e 2014.[21].[22]
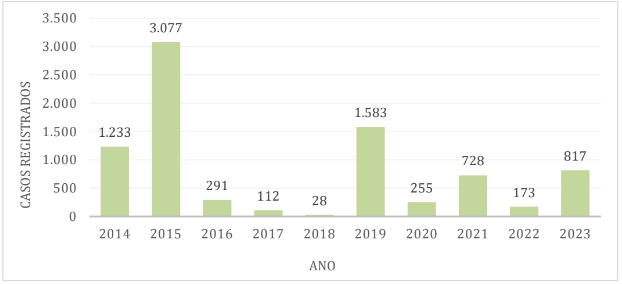
Gráfico 1 – Casos de dengue no município de Caraguatatuba
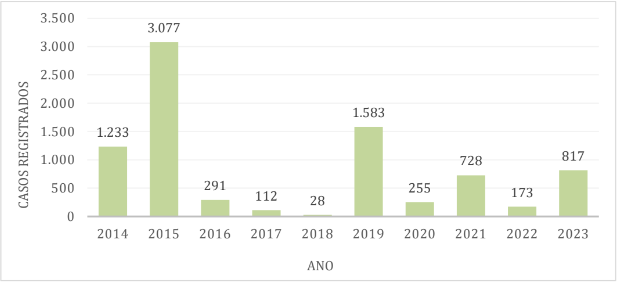
Na região de Ubatuba, a porcentagem de casos de dengue em relação ao número populacional da região é de cerca de 8,92%, com os maiores índices em 2015, 2019 e 2014 respectivamente.[21].[22]
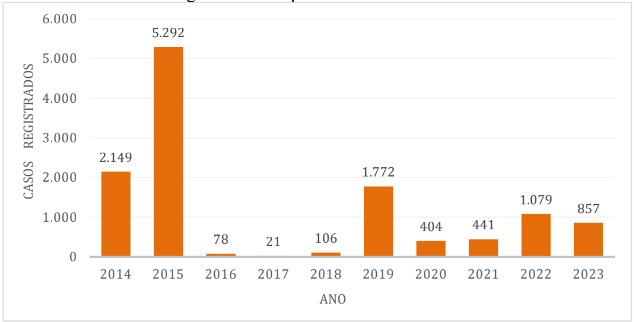
Gráfico 2 – Casos de dengue no município de Ubatuba.
A cidade de São Sebastião apresenta porcentagem de casos de dengue em relação à população total de aproximadamente 14,95%, com os maiores índices em 2015, 2019 e 2014, respectivamente. [21].[22]
Gráfico 3 – Casos de dengue no município de São Sebastião.[21].[22]
No município de Ilhabela a porcentagem de casos dengue em relação à população total é de aproximadamente 7,37%, com os maiores índices em 2014, 2015 e 2021.[21].[22]
Gráfico 4 – Casos de dengue no município de Ilhabela.
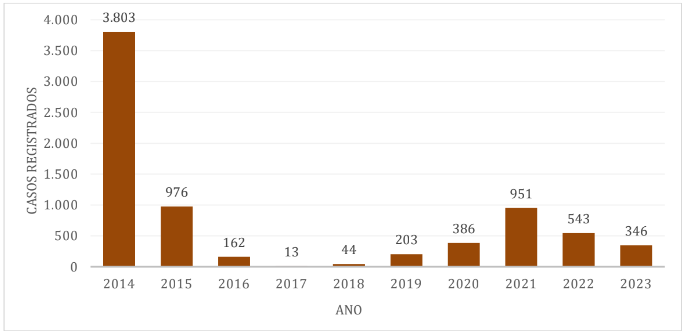
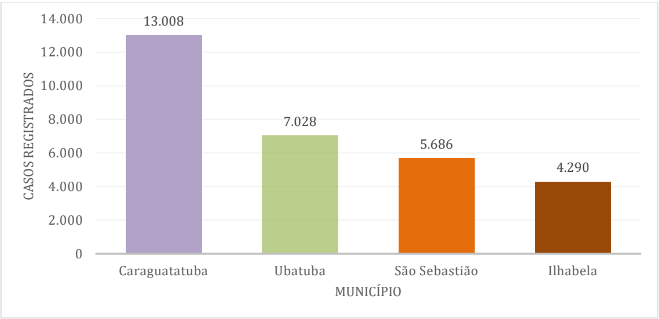
A análise das notificações de dengue de janeiro de 2024 a 11 de setembro de 2024 no litoral norte de São Paulo (Gráfico 5) estimou o número de casos em: 13.008 em Caraguatatuba, 7028 em Ubatuba, 5686 em São Sebastião com 5.686 e 4.290 em Ilhabela.[21].[22]
Gráfico 5 – Notificações de casos de dengue de janeiro a 11 de setembro de 2024
7. Conclusão
A partir dos resultados obtidos após as análises de dados, conclui- se que o município de São Sebastião teve o maior número de casos de dengue em relação ao seu número de habitantes de 14,95% para a somatória total na última década. Em seguida Caraguatatuba, com 10,01% de casos de dengue em relação à população total. Ubatuba teve a porcentagem de casos de dengue em relação à população total de aproximadamente 8,92% e Ilhabela com cerca de 7,37% de casos de dengue em relação a população do município.
Observou-se que, ao longo da década, os anos com maior número de casos de dengue foram 2014, com o município de Ilhabela registrando 3.803 casos, e 2015, com os municípios de Caraguatatuba contabilizando 5.294 casos; São Sebastião com 5.292 casos e Ubatuba com 3.077 casos. Por outro lado, os períodos com menor número de casos ocorreram em 2017, quando São Sebastião registrou 21 casos, Ilhabela 13 casos e em 2018 Caraguatatuba apresentando 13 casos e Ubatuba 28 casos notificados.[21].[22]
Referências
[1] Amabile V. B. e Mariana A. L. O., “Diagnóstico laboratorial da dengue laboratorial “, Revista UNINGÁ Review, Vol.29, n.1, pp.122-126 (Jan – Mar 2017). Disponível em: file:///C:/Users/maria/Downloads/admin,+Gerente+da+revista,+17.pdf. Acesso em: 15 jan. 2024.
[2] Lopes, N., Nozawa, C., & Linhares, R. E. C. (2020). Características gerais e epidemiologia dos arbovírus emergentes no Brasil. Revista an-Amazônica e saúde, 5(3), 10. https://doi.org/10.5123/S2176-62232014000300007. Acesso em: 20 jan. 2024;
[3] Mukhopadhyay S, Kuhn RJ, Rossmann MG. A structural perspective of the flavivirus life cycle. Nat Rev Microbiol. 2005 Jan;3(1):13-22. doi: 10.1038/nrmicro1067. PMID: 15608696. Acesso em: 22 jan. 2024;
[4] SOUZA, L. J. Dengue, zika e chikunguya: diagnóstico, tratamento e prevenção. Rio de Janeiro: Rubio, 2016;
[5] Bisset JA. Uso correcto de insecticidas: control de la resistencia. Rev Cubana Med Trop. 2002; 54(3):202-19;
[6] Braga I. A. Monitoramento da resistência de populações naturais de Aedes aegypti do Brasil a inseticidas e avaliação do potencial de utilização de methoprene, um regulador do crescimento de insetos, em seu controle [Tese]. Rio de Janeiro: Instituto Oswaldo Cruz; 2004; [7] Brasil. Ministério da Saúde. Guia de vigilância epidemiológica. 6. ed. Brasília: MS; 2005;
[7] Brasil. Ministério da Saúde. Plano diretor de erradicação do Aedes aegypti do Brasil. Brasília: MS; 1996;
[8] Brasil. Ministério da Saúde. Superintendência de Campanhas de Saúde Pública. Combate ao Aedes aegypti: instruções para guardas, guardas-chefes e inspetores. Brasil: MS; 1985;
[9] Souza U, Alves /G, Nogueira RM, Gicovate Neto C, Bastos DA, et a. Aminotransferase changes and acute hepatitis in patients with dengue fever: analysis of 1.585 cases. Braz J Infect Dis. 2004; 8(2): 156-63;
[11] Center of Diseases Control (CDC). Control of dengue, vector topics. 1979; 2:1-39;
[12] Donalísio MR, Glasser CM. Vigilância entomológica e controle de vetores do dengue. Rev Bras Epidemiol. 2002;5(3): 259-70;
[13] Fresh JW. Philippine hemorrhagic fever: a clinical, laboratory and necropsy study. J Lab Clin Med. 1969; 73(3):451-8;
[14] Fundação Nacional de Saúde (FUNASA). Programa nacional de controle da dengue (PNCD). Brasília: Ministério da Saúde; 2002;
[15] Fundação Nacional de Saúde (FUNASA). Plano de intensificação das ações de controle da dengue (PIACD). Brasília: Ministério da Saúde; 2001;
[16] Inf. Epidemiol. SUS v.8 n.4 Brasília dez. 1999. Disponível em: http://dx.doi.org/10.5123/S0104-16731999000400002. Acesso em: 04 maio 2024.
[17] Ministério da Saúde. Disponível em: https://www.gov.br/saude/pt-br/assuntos/noticias/2024/janeiro/ministerio-da-saudeanuncia-estrategia-de-vacinacao-contra-a-dengue. Acesso em: 8 jun. 2024
[18] Agência Nacional de Vigilância Sanitária – ANVISA. Disponível em: https://www.gov.br/anvisa/pt-br/search?origem=form&SearchableText=vacina%20dengue. Acesso em: 9 jun. 2024.
[19] Instituto Brasileiro de Geografia e Estatísticas, dados censo 2022. Disponível em: https://www.ibge.gov.br/. Acesso em: 5 mar. 2024;
[20] Mapa QGIS, sistema de coordenadas geográficas, por Maria Luisa Colacio;
[21] Governo estado de São Paulo, DATASUS Tecnologia da Informação a Serviço do SUS. Disponível em http://tabnet.datasus.gov.br/cgi/tabcgi.exe?sinannet/cnv/dengue.def, Acesso em: 11 set. 2024;
[22] Ministério da Saúde/SVSA – Sistema de Informação de Agravos de Notificação – Sinan Net.
Centro Universitário Módulo, Rua Maria D’Assumpção Carvalho, 1000, Martim de Sá, CEP 11662-903, Caraguatatuba-SP, Brazil, malucolacio2@gmail.com.
