QUANTITATIVE ANALYSIS OF THE CITOPHOTOMETRYC EXPRESSION OF MARKERS Ki-67 AND CD34 IN THE MALIGNANT OVARIAN TUMORS.
REGISTRO DOI: 10.69849/revistaft/ch10202506090811
Fábio Roberto Ruiz De Moraes
Orientador: Prof. Dr. Ronaldo Mafia Cuenca
Co-orientador: Osvaldo Malafaia
RESUMO
Introdução – O câncer de ovário é o líder em causas de mortes dentre todos os tumores ginecológicos baixos. No Brasil a perspectiva é de que uma para cada noventa mulheres irá desenvolver a doença. Com a intenção de realizar o diagnóstico precoce, um número grande de marcadores tumorais tem sido estudado, na intenção de definir o diagnóstico ainda sem manifestações da doença ou com lesão tecidual inicial, proporcionando tratamento mais eficaz. O Ki-67 é um marcador nuclear definido por um anticorpo monoclonal associado com a proliferação celular. A técnica utilizada para caracterizar a proliferação celular é a imunohistoquímica. O marcador tumoral CD 34 é um anticorpo monoclonal, que avalia a neovascularização. Objetivo – a) Analisar e quantificar citofotometricamente a correlação e associação da expressão do marcador Ki-67 nos tumores malignos de ovário. b) Analisar e quantificar citofotometricamente a correlação e associação da expressão do marcador CD34 nos tumores malignos de ovário. c) Analisar a capacidade de leitura dos marcadores tumorais Ki-67 e CD34 em relação ao tempo de armazenamento dos blocos de parafina. Material e Método – O estudo foi constituído por 40 casos de tumores malignos de ovário, provenientes de blocos de parafina originados de pacientes submetidas à operação de ressecção ovariana. Os diagnósticos foram confirmados por hematoxilina-eosina e submetidos à técnica imunohistoquímica com os marcadores tumorais Ki-67 e CD34. Posteriormente as lâminas marcadas foram submetidas à leitura pelo sistema SAMBA com o software IMMUNO 4.00. Resultados – Das 40 lâminas selecionadas, 19 foram lidas quando se utilizou o Ki 67 e 39 foram lidas utilizando o CD-34 e uma das lâminas não teve campos lidos para nenhum dos marcadores, o índice médio de marcagem do Ki-67 foi de 75,07% , a densidade óptica média do Ki-67 não apresentou resultados significativamente estatístico. O índice médio de marcagem do CD34 foi de 76,65%, a densidade óptica média do CD34 não apresentou resultados significativamente estatísticos. Conclusão – a) Houve correlação do marcador Ki-67 nos tumores malignos de ovário em relação ao índice de marcagem e não houve correlação do marcador Ki 67 nos tumores malignos de ovário em relação à densidade ótica. b)Houve correlação do marcador CD34 nos tumores malignos de ovário em relação ao índice de marcagem e não houve correlação do marcador CD34 nos tumores malignos de ovário em relação à densidade ótica. c) A capacidade de leitura dos marcadores tumorais Ki-67 e CD34 não se alterou em relação ao tempo de armazenamento dos blocos de parafina com os quais foram confeccionadas as lâminas utilizadas no presente estudo.
Palavras-chave: Ovários; Imunohistoquímica; SAMBA; Ki-67; CD34.
ABSTRACT
Introduction – The ovarian cancer is the leader in death causes among the low gynecological tumors. In Brazil, the perspective is that one in every ninety women will develop the disease. With the intencion to carry through the precocious diagnosis, a large number of tumor markers have been studied, in the intencion to still define the diagnosis without manifestations of the disease or with initial tecidual injury, providing more efficient treatment. The Ki-67 is a nuclear marker defined by a monoclonal antibody associated to a cell prolifereation. The used technique to characterize the cellular proliferation is the immunohistochemistry. The tumor marker CD 34 is monoclonal antibody, that evaluates the neovascularization. Objective – a) To analyze and quantify cytophotometrically the correlation and association of the expression of the Ki-67 marker in the malignant ovarian tumors. b) To analyze and quantify cytophotometrically the correlation and association of the expression of CD34 marker in the malignant ovarian tumors. c) To analyze the reading capacity of Ki-67 and CD34 tumors markers in relation to the storing time of the paraffin blocks. Material and Method – The study it was constituted by 40 cases of malignant ovarian tumors, arising from paraffin blocks originated from patients who had been gone through an ovarian resection surgery. The diagnoses were confirmed by hematoxilin eosine and submitted to the imunohistochemical technique with Ki-67 and CD34 tumors markers. Later the marked laminas were submitted to the reading through the SAMBA system with software IMUNNO 4.00. Results – Of the 40 selected laminas, 19 were read when using the Ki-67 and 39 were read when using the CD34 and one of the laminas was not read for any of the markers, the average index of the Ki-67 marking was 75.07% and the average optical density of the Ki-67 did not present significant statistics results. The average marking index of the CD34 was 76.65% and the average optical density of the CD34 did not present significant statistics results. Conclusion -There was a correlation of the Ki-67 marker on the malignant ovarian tumors in relation to the marking index and there was no correlation of the Ki-67 marker on the malignant ovarian tumors in relation to the optical density. b) There was a correlation of the CD34 marker on the malignant ovarian tumors in relation to the marking index and there was no correlation of the CD34 marker on the malignant ovarian tumors in relation to the optical density. c) The reading capacity of the Ki-67 and CD34 tumor markers did not change in relation to the storing time of the paraffin blocks which originated the laminas that were used in this present study
KeyWords: Ovaries; Imunohistochemical; SAMBA; Ki-67; CD34.
1 INTRODUÇÃO
Os ovários possuem uma grande capacidade de originar tumores das mais diversas linhagens histopatológicas em qualquer época da vida, e apesar dos avanços obtidos nas diversas modalidades de tratamento, a sobrevida das pacientes com câncer de ovário não aumentou significativamente nos últimos anos. A taxa de mortalidade em estágios mais avançados manteve-se constante nas últimas duas décadas, e isto se deve principalmente a grande dificuldade do diagnóstico precoce. (LIMA, GONÇALVES e BARACAT, 2003)
Em ordem de incidência dentre aqueles que acometem os órgãos genitais femininos, os tumores malignos ovarianos, ocupam a terceira colocação no Brasil, liderando a causa mortis dentre as de câncer ginecológico, ficando seu patamar junto com as taxas de outros órgãos como: esôfago, estômago e pulmão, com taxas acima de 50% (PASCALICCHIO, FRISTACHI, CASTANHO, KUE, PIATO e BARACAT, 2000).
Segundo o Instituto Nacional de Câncer (INCA), o câncer de ovário ocupa o oitavo lugar dentre as neoplasias malignas femininas, representando 1,8% das neoplasias em mulheres, e nas genitálias é superado apenas pelas neoplasias do útero e das mamas, mas apresenta taxa de mortalidade mais elevada (INCA, 2003).
A probabilidade de ocorrência do câncer de ovário gira em torno de 1,5%. A sobrevida global atinge 30 a 40% em cinco anos. Isto ocorre, em parte, porque a maioria dos pacientes tem a doença diagnosticada em estadios clínicos avançados, situação em que as opções de tratamento ficam restritas à operação citorredutora e quimioterapia, que são utilizados como métodos paliativos no tratamento do câncer de ovário. (WHITTEMORE, 1994).
O câncer de ovário nos Estados Unidos é o líder em causas de mortes dentre todos os tumores ginecológicos baixos, apresentando em média 26.000 casos novos por ano, o que representa 4% de todos os diagnósticos de câncer femininos, e causando 14.500 mortes por ano. Nos Estados Unidos o câncer de ovário é a sexta neoplasia maligna mais freqüente e a quarta causa de morte por câncer em mulheres (JEMAL, TIWARI, MURRAY, GHAFORR, SAMUELS, WARD, FEUER e THUN, 2004). Estima-se que uma em cada setenta mulheres desenvolverá o carcinoma ao longo da vida. Já no Brasil a perspectiva é de que uma em cada noventa mulheres irá desenvolver a doença (SOUZA, KALIL e FARIA, 2003).
Estudos recentes reforçam que a sobrevida em cinco anos é de 95% para os casos de tumor localizado no ovário, 72% para os casos com implante regional e 31% para os casos com tumor disseminado. No entanto, no momento do diagnóstico, apenas 29% dos casos apresentam-se com tumor restrito aos ovários, 6% com tumores disseminados regionalmente e 59% com disseminação à distância. A elevada mortalidade e a pequena proporção de casos de câncer de ovário diagnosticados em estágios clínicos iniciais tornam essencial a busca por meios de identificação precoce desta doença. (LINASMITA, PATTARAARCHACHAI e DAENGDEELERT, 2004).
A extensão da doença, a biologia intrínseca do tumor e a capacidade do paciente de tolerar o tratamento para a doença são fatores prognósticos diretamente relacionados à sobrevida da paciente. Outros fatores também podem impactar na sobrevida, tais como o tipo de tratamento recebido e o efeito da terapêutica sobre o tumor. Dentre todos estes fatores o estadiamento da FIGO (Federação Internacional de Ginecologia e Obstetrícia) pode ser considerado o mais importante (HORNUNG, URS, SERENELLA, EDWARD, URSULA, URS e DANIEL, 2004).
Com a intensão de realizar o diagnóstico precoce, vários marcadores tumorais ovarianos tem sido estudados. Os marcadores tumorais constituem importante recurso para a moderna oncologia. Embora sua aplicabilidade e interpretação ainda não tenham atingido amplo domínio, eles contribuem para a melhor abordagem e controle do processo neoplásico. A importância de definir um marcador tumoral no ovário ainda sem manifestações da doença ou com lesão tecidual inicial, proporcionará diagnóstico precoce e tratamento mais eficaz para as pacientes, reduzindo drasticamente a mortalidade do câncer de ovário. (PRADAL, MENEZES, DI DIO, BARBÉRO, 1999)
A possibilidade de detecção e quantificação de marcadores tumorais contempla o sangue ou outros fluídos orgânicos de portadores de neoplasias. Nos últimos o manuseio de marcadores sorológicos, histoquímicos e genéticos tem tido uma influência crescente nas decisões clínicas, para início de tratamento e posterior seguimento (MAZUREK, NICKLINSKI, LAUDANSKI e PLUYGERS, 1998).
O Ki-67 é um marcador nuclear definido por um anticorpo monoclonal associado com a proliferação celular encontrado em todo o ciclo celular (G1, S, G2, M) e ausente em G0. A técnica utilizada para caracterizar a proliferação celular é a imunohistoquímica (GERDES, 1991). O marcador tumoral CD 34 é anticorpo monoclonal, marcador de neovascularização e tem relevância prognóstica em pacientes com tumor ovariano (HEINBURG, 1999).
1.1 OBJETIVOS
a) Analisar e quantificar citofotometricamente a correlação e associação da expressão do marcador Ki-67 nos tumores malignos de ovário.
b) Analisar e quantificar citofotometricamente a correlação e associação da expressão do marcador CD34 nos tumores malignos de ovário.
c) Analisar a capacidade de leitura dos marcadores tumorais Ki-67 e CD34 em relação ao tempo de armazenamento dos blocos de parafina.
2 REVISÃO DA LITERATURA
2.1 MARCADOR TUMORAL KI-67 E TUMORES MALIGNOS DO OVÁRIO
BROWN e GATTER (1990) realizaram uma revisão sobre o Ki-67, que foi assim chamado por ter sido descrita a utilização em Kiel, Alemanha Oriental, na cultura de crescimento celular número 67. É usado na histopatologia como anticorpo, classe IgG1. Expresso em todas as fases da divisão celular, exceto G0, sofre variação com o padrão nutricional. Com menos nutrição a célula cresce mais devagar e existe menos Ki-67. Isto acontece nas áreas centrais de alguns tumores, onde se identifica áreas de padrão necrótico. Afirmam ser um marcador da proliferação qualitativa e quantitativa, porém sua relevância para prognóstico pode ser discutida. Dependendo do local do tumor que se colhe o material para análise, a quantidade de Ki-67 pode variar, como foi citado que a retirada de material do centro de um grande tumor, pode ter pouco antígeno em decorrência de fatores nutricionais; outro fator é que certos tumores são heterogêneos, variando a análise dependendo do local e da quantidade de material de biópsia. Já tumores como os linfomas, principalmente os não-Hodgkin, o Ki-67 pode auxiliar a classificar casos onde a histologia apresentou limitações.
ISOLA, KALLIONIEMI, KORTE, WAHLSTROM, AINE, HELLE e HELIN (1990) estudaram o Ki 67 como marcador imunohistoquímico de proliferação celular em 29 pacientes na peri-menopausa com tumor ovariano. A citometria de fluxo aplicada ao ADN nas células tumorais avaliou o prognóstico da paciente uma vez que os valores analisados serviram de base para a diferenciação celular. Concluíram que o Ki-67 poderia ser utilizado como marcador prognóstico para mulheres peri menopausadas com câncer de ovário.
HUETTNER, WEINBERG e LAGE (1992) estudaram prospectivamente a atividade proliferativa de setenta e quatro tumores ovarianos (malignos, benignos e limítrofes) com citometria de fluxo e estática. Esta atividade foi avaliada pela fase S (SPF) e pela avaliação imunohistoquímica de tecido com anticorpo Ki-67 comparada com fatores prognósticos e clínico – patológicos importantes. Observaram que as neoplasias malignas tiveram percentual de Ki-67 maior (27,6%) do que tumores limítrofes (12,3%) e benignos (2,7%). Simultaneamente as neoplasias malignas tiveram alta média de SPF (11,5%) maior que nos limítrofes (3,4%) e benignos (2,9%). Concluíram que há correlação de fase S com porcentagem de Ki-67, índice de ADN, idade e estágio, mas não há correlação de nenhum destes parâmetros nos tumores benignos e limítrofes.
HENRIKSEN R, STRANG P, BACKSTROM T, WILANDER E, TRIBUKAIT B e OBERG K (1994) realizaram estudos imunohistoquímicos através da citometria de fluxo do ADN de amostras de tumores ovarianos malignos, borderline e ovários normais, através da expressão do Ki-67, durante a fase “S”, para uma avaliação prognóstica. Chegaram à conclusão que quanto maior o índice de marcagem pior seria o prognóstico da paciente.
GARZETTI, CIAVATTINI, GOTERI, NICTOLIS, STRAMAZZOTTI, LUCARINI e BIAGINI (1995) estudaram o significado biológico da expressão do antígeno Ki-67 em tumores serosos de ovário, com a análise da reatividade do anticorpo monoclonal MIB1 nos cistoadenomas, nos tumores limítrofes e em cistoadenocarcinomas invasivos. Cinqüenta e quatro pacientes com tumores serosos de ovário foram usadas como população de estudo sendo: 10 cistoadenomas serosos, 16 limítrofes e 28 cistoadenocarcinomas invasivos. Concluíram que o Ki-67 era significativamente mais elevado nos cistoadenocarcinomas.
COSTA, WALLS, AMES e ROTH (1996) mostraram que os marcadores moleculares p53 e Ki-67 ajudam a predizer o comportamento dos tumores de células da granulosa do ovário, usaram blocos de parafina de 68 tumores de células da granulosa de 56 pacientes, sendo 53 primários e 15 recorrentes imunomarcados para Ki-67 e p53. Concluíram que o índice de proliferação de Ki-67 varia de 1 a 50% (média 12,2%) e 19% da imunorreatividade do p53 local foi exibida. O Ki-67 foi mais elevado nos tumores recorrentes (P<001) e correlacionado com a taxa mitótica (r=75; P<0001). O marcador p53 foi associado com o tipo juvenil de tumores de células da granulosa.
DIEBOLD J, SUCHY B, BARETTON GB, BLASENBREU S, MEIER W, SCHMIDT M, RABES H, LOHRS U (1996) demonstraram que a ploidia do ADN é um fator prognóstico em carcinomas de ovário Eles correlacionaram à expressão do p53 e o bcl-2, atividade proliferativa e prognóstico nos carcinomas ovarianos através da citofometria de fluxo. O marcador utilizado para avaliar a proliferação celular foi o Ki 67. Foram estudados 144 casos de tumores malignos ovarianos e o Ki-67 se mostrou um bom marcador para proliferação celular.
ROHLKE P, MILDE-LANGOSCH K, WEYLAND C, PICHLMEIER U, JONAT W e LONING T (1997), realizaram um estudo analisando o fator preditivo do p53 nos carcinomas de ovário, e em uma análise multifatorial incluíram o Ki 67. Foram analisados 104 casos de carcinoma de ovário, e nas ocasiões em que o Ki 67 apresentou contagem elevada, não houve associação com idade, estágio, e tipo de receptor hormonal.
DARAI, WALKER-COMBROUZE, DAUGE-GEOFFROY, VINCENT, FELDMANN, MADELENAT e SCOAZEC (1998), testaram a expressão diagnóstica e prognóstica do Ki-67 e ploidia ADN nos tumores de ovário. A reação das células tumorais com anticorpo monoclonal MIB1 e Ki-67 foi estudada com uma técnica de imunoperoxidase indireta aplicada em 25 tumores benignos de ovário, 35 limítrofes e 20 tumores malignos. Imunopositividade para Ki-67 foi detectada em 3 tumores benignos, 14 limítrofes e 14 carcinomas ovarianos. A diferença no estudo imunohistoquímico do Ki-67 foi encontrada entre carcinomas e tumores benignos e entre tumores limítrofes e carcinomas, mas não entre tumores benignos e limítrofes. A avaliação dos histogramas de ADN da citometria de fluxo foi feita em 96,2% dos tumores ovarianos. A diferença foi encontrada entre tumores limítrofes e carcinomas, mas não entre benignos e limítrofes. Concluíram que o Ki-67 não está correlacionado com nenhum parâmetro prognóstico e histológico, nem sobrevida e nem com ploidia ADN nos tumores limítrofes de ovário.
MAZUREK A, NIKLINSKI J, LAUDANSKI T e PLUYGERS E (1998) publicaram um artigo comentando que, em poucos anos de estudo, os marcadores tumorais para câncer de ovário tiveram uma influência crescente nas decisões clínicas sobre o tratamento e seguimento destes tumores. Os marcadores genéticos moleculares mais amplamente utilizados são o p53 e o Bcl-2 e o marcador imunohistoquímico para proliferação nuclear mais freqüentemente utilizado é o Ki 67, através da citometria de fluxo.
TANOGUCHI K, SASANO H, YABUKY N, KIKUCHI A, ITO K, SATO S e YAJIMA A (1998) avaliaram a significância biológica da Topo II alfa, que assim como o Ki 67, está associada a atividade de proliferação celular em pacientes com carcinoma de ovário. O estudo foi realizado em 99 pacientes, sendo examinada a expressão imunohistoquímica da proteína Topo II alfa, observando-se uma correlação entre o Ki 67 e a proteína em questão. A razão Topo II alfa / Ki 67 excedeu significativamente nos tumores de células germinativas do que nos carcinomas epiteliais.
ARIYOSHI K, KAWAUCHI S, KAKU T, NAKANO H e TSUNEYOSHI M (2000) realizaram um estudo clínico-patológico e imunohistoquímico de 23 casos de carcinosarcoma ovariano, utilizando como fatores prognósticos a proteína p53 e o Ki 67. Concluíram que os marcadores p53 e Ki67 não servem como fatores prognósticos sendo o carcinosarcoma um tumor maligno, raro e com prognóstico reservado devido sua clínica ser pobre e não existirem elementos para o diagnóstico precoce.
ABU-QARE e ABOU-DONIA (2001) relacionaram os marcadores biológicos tumorais diretamente com as transformações bioquímicas, histológicas e morfológicas em todo o organismo. O seu uso está convertendo-se em importante ferramenta para examinar os níveis de transformação celular e molecular, especialmente quando se trata de ácidos nucléicos e proteínas. São especialmente empregados para medir a exposição a determinados agentes, detectar a severidade de alguma resposta tóxica e predizer possíveis resultados.
FRUTUOSO, SILVA, AMARAL, MARTINS, De OLIVEIRA e De OLIVEIRA (2001), avaliaram o valor prognóstico do C-er-B2, do p53 e a expressão do Ki-67 e correlacionaram estes marcadores com os fatores prognósticos clássicos. Estudaram tumores em parafina de 81 pacientes com câncer epitelial de ovário, fazendo uma avaliação quantitativa por reação imunohistoquímica. Concluíram que estes marcadores têm uma expressão elevada no carcinoma de ovário e a correlação entre p53 e o C-er-B2 com o estágio e resíduos de doenças. Embora C er-B2 fosse associado com a sobrevida melhor, não se inclui para ser um fator prognóstico independente.
KARABURUM, KARAVELI, PESTERELI, SIMSEK e SARGIN (2001) avaliaram a significância prognóstica do Ki-67 e o conteúdo do ADN medido através da citometria de fluxo, estudaram 67 tumores ovarianos epiteliais em material de arquivo em parafina, utilizando métodos imunohistoquimicos. Concluíram não haver correlação significativa entre a ploidia do ADN e a atividade proliferativa determinada pelo Ki-67, quando comparados com os parâmetros histopatológicos conhecidos, em relação aos aspectos dos tumores ovarianos epiteliais.
SUO, KARBOVO, TROPPE, METOLIEV, NESLAND (2004) empregaram a imunohistoquímica com a finalidade de examinar as condições da atividade de proliferação usando anticorpos contra Ki-67 e BM 28 e as condições do EGFR em membros da família com anticorpos contra EGFR, CerbB2 e CerbB4, em 24 pacientes portadores de carcinoma papilar seroso de ovário. Observaram que ultraestruturalmente tumores pobremente diferenciados, freqüentemente revelam lâminas sólidas de células tumorais com desmossomas variáveis, conexões celulares complexas e microvilosidades. Concluíram que oligocílios, lisossomas secundários numerosos e inclusões citoplasmáticas bizarras são mais freqüentemente detectadas nos carcinomas serosos pobremente diferenciados e estes manifestam os mais altos níveis de proteínas Ki-67, BM 28, EGFR e CerbB-2.
ALI-FEHMI, MORRIS, BANDYOPADHYAY, CHE, SCHIMP, MALONE e MUNKARAH (2005) estudaram 118 pacientes com carcinoma seroso de ovário em alto grau e estágio avançado (III e IV), com o objetivo de examinar a expressão da ciclooxigenase, a proliferação do tumor, a apoptose e a angiogênese, através da ciclooxigenase-2, Ki-67, fator de crescimento vascular endotelial, Bcl-2 e CD-34. Concluíram que a expressão da ciclooxigenase-2 correlaciona-se com a proliferação e angiogênese do tumor, mas não com os marcadores apoptóticos no carcinoma seroso ovariano em estágio avançado.
ZARZOU, MARKAKI, RODALAKIS, KASTRITIS, BOZAS, DIMOPOULOS e PAPADIMITRIOU (2005) avaliaram os fatores prognósticos do ponto de vista clínico, patológico e imunohistoquímicos de pacientes portadoras de carcinoma ovariano tratadas com cirurgia radical e quimioterapia pós operatória, estudaram por 6 anos, revisando blocos de parafina e cortes contendo elementos carcinomatosos tratados com EMA (antígeno da membrana epitelial), vimentina, fator de crescimento endotelial vascular (VEGF), CD45, CerbB, CD34, Ki-67, S100, receptores estrogênicos e de progesterona. Observaram que cinco tumores apresentaram acentuada resposta ao p53 e quatro casos demonstraram coloração positiva para Ki 67. Concluíram que apenas a resposta ao p53 parece influenciar a sobrevida e, em virtude do pequeno número de pacientes estudadas, conclusões seguras não podem ser delineadas.
2.2 MARCADOR TUMORAL Ki-67 E TUMORES GENITAIS GINECOLÓGICOS
CHARPIN, ANDRAC, HABIB, DEVICTOR, LAVAUT, e TOGA (1988) estudaram 257 amostras de tecido mamário maligno e não maligno utilizaram a imuno-histoquímica para quantificar o índice do Ki-67 e a porcentagem da área de superfície nuclear marcada em relação à superfície total de núcleos celulares contados pelo SAMBA 2005. Nos 200 casos de carcinomas examinados, verificaram uma variação porcentual de área nuclear Ki-67 positiva de 17,5 a 76,4% com média de 26 %. Que o índice do marcador foi significativo para os tecidos malignos e estava relacionado com o grau de diferenciação celular, invasão vascular, linfática ou nodular. Concluem que a imunomarcação nuclear analisada pelo método é confiável e a atividade proliferativa medida pelo método pode dar informações para selecionar pacientes com maior índice de recidiva.
CHARPIN, HABIB, PIANA, RAMPAL, ANDRAC, VANCHERET, MARTINI, PEREZ-CASTILLO, LAVAUT e TOGA (1989) demonstraram a aplicação prática do SAMBA, um sistema computadorizado da análise de imagem através da imunohistoquímica em vários tecidos corporais tais como, mama, endométrio, ovário, colo uterino e bexiga, avaliando vários parâmetros da fração de crescimento em tumores intraepiteliais, borderline e tumores invasivos. Utilizaram o Ki 67 para avaliar o índice de proliferação celular, sugerindo utilizar seus valores como dados prognósticos e no auxílio na escolha da terapia a ser adotada no paciente.
CHARPIN, ANDRAC, LAVAUT, ANDONIAN, FRATERNO, PEREZ CASTILHO, BONNIER e PIANA (1990) estudaram o Ki-67 em 132 amostras de tecidos mamários com alterações histológicas de natureza maligna e benigna. Por processamento imuno-histoquímico e analisado pelo sistema SAMBA 2005, analisaram múltiplos parâmetros de natureza clínico e patológica. Observaram que a imuno marcação analisada pelo SAMBA teve imunopositividade significante para as lesões malignas com acurácia, confiabilidade, reprodução fácil. Os índices encontrados têm relação com grau de diferenciação, invasão e metástase à distância tumoral, podendo mostrar relevantes informações de pacientes de maior risco.
LEONARDI, GIRLANDO, SERIO, MAURI, PERRONE, SCAMPINI, DALLA PALMA e BARBARESCHI (1992) avaliaram 106 casos de câncer de mama, sendo 96 ductais e 10 lobulares estudando a presença do ki-67 e o PCNA (antígeno nuclear de proliferação celular) e a relação com variáveis clínicas e biológicas. Observaram que não existiu correlação entre o PCNA e o Ki-67 em nenhuma das variáveis, porém este último teve relação significante com a presença de um maior número de mitoses, grau histológico mais avançado na classificação de Bloom e Richardson, negatividade para receptores hormonais e presença do P53.
QUERZOLI, ALBONICO, FERRET, RINALDI, MAGRI, INDELI, e NENCI (1996) estudaram a relação entre a expressão do Ki-67 medida pelo anticorpo monoclonal MIB-1 e taxa de proliferação celular, em 871 amostras de carcinomas mamários infiltrativos através do processador de imagem CAS200, estudando variáveis de prognóstico. Selecionaram aleatoriamente pelo menos 15 campos de cada amostra sob objetiva de 40X com contagem de pelo menos 2000 núcleos, estabeleceram índice proliferativo do Ki-67 pela porcentagem de áreas de núcleos marcados positivamente e o número total contado. Verificaram índice proliferativo de 0,01 a 96,5% com média de 8,42%. Utilizando como ponto de corte ≥ 13% de porcentagem de área nuclear marcada, encontraram 36,4% nas amostras com altos índices proliferativos. A variedade ductal teve índice médio de 41,8%. Estudando um grupo de 170 pacientes, com seguimento médio de 65,5 meses e índice proliferativo baixo e nódulo negativo, foi verificado que viveram significativamente mais tempo livre da doença. Concluiram que o índice proliferativo expresso pelo MIB-1 é confiável e prático, sendo um método útil para mensurar atividade proliferativa e um importante preditor de comportamento clínico.
SCHOLZEN e GERDES (2000) observaram que a expressão da proteína humana Ki-67 é estreitamente associada com a proliferação celular. Durante a interfase o antígeno pode ser exclusivamente detectado com o núcleo, considerando-se que na mitose a maior parte das proteínas é recolocada na superfície dos cromossomas.
Estudaram também que o fato do Ki-67 estar presente durante todas as fases ativas do ciclo celular (G1, S, G2 e mitose), mas não estar nas células em repouso, faz dele um excelente marcador para determinar a fração estimulante de crescimento de uma conhecida população celular. Concluíram que a fração de ki-67 positiva da célula tumoral (o índice ki-67) é correlacionado com o curso clínico da doença. Observaram que nos carcinomas de próstata e de mama o valor prognóstico do marcador foi provado com avaliações estatísticas. YAZIJI H e GOWN AM, (2001) avaliaram através da imunohistoquímica, os seguintes tumores ginecológicos, ovário, colo uterino e endométrio, originados de blocos de parafina do serviço de patologia local. Entre os resultados obtidos, o mais significante foi em relação ao colo do útero e utilizando como marcador tumoral o Ki 67, o qual apresentou alterações quantitativas e qualitativas na displasia do colo uterino, sendo considerado um bom marcador tumoral.
LIZANKA, GRAUDENZ, RECKTENVALD, MEIRELLES e CALEFFI (2003) analisaram biópsias de mamas normais de pacientes pós-menopausadas antes e depois de 6 meses de tratamento, divididos em 2 grupos com terapia de reposição hormonal distinta, utilizando associação de estrogênio e progesterona (esquema cíclico) e estrógenos isoladamente. Foi feita análise imunohistoquímica com anticorpos anti-PCNA do tipo PC-10, anti-Ki-67 do tipo MIB-1, anti-receptor de estrogênio do tipo 1-D5 e anti-receptor de progesterona do tipo 1-A6. Não houve diferença significativa para os fatores de mediação (receptores) no grupo que utilizou o esquema cíclico (RE: P = 0,326; RP: P = 0,228). No grupo que utilizou apenas estrogênio, obteve-se um valor de P próximo ao limite de significância estatística para o RP (P = 0,053), mas não para o RE (P = 0,203). Com relação aos fatores de proliferação celular, não foi encontrada diferença estatisticamente significativa para o PCNA em ambos os grupos (esquema cíclico: P = 0,121; estrogênio isolado: P = 0,208). Houve tendência para elevação do Ki-67 no grupo que fez uso de estrogênio apenas (P = 0,084), o que não se observou no grupo que fez uso de esquema cíclico (P = 0,776). Estes resultados sugerem que a associação de progestágeno à terapia estrogênica nesse grupo de mulheres pós-menopausa, pode ter contribuído para uma possível redução na expressão do receptor de progesterona e a proliferação celular, estimada pelo marcador Ki-67, agindo como um fator moderador de proliferação celular.
FEITH, STEIN, MUELLER e SIEWERT (2004) analisaram 24 blocos de tumores ressecados, fixaram cortes de adenocarcinoma, metaplasia colunar com e sem displasia e epitélio normal, testaram o P53, E-caderina e o Ki-67. Evidenciaram que o Ki-67 está presente nas fases de proliferação celular (G1,S,G2 e metáfase), e ausente na G0; se localiza na base do epitélio (zona de proliferação), no epitélio normal e na metaplasia sem displasia. Na metaplasia com displasia é identificado na base, na superfície das criptas e na superfície do epitélio. No epitélio normal, metaplasia sem e com displasia e no adenocarcinoma foram identificados respectivamente: 20,4 +-6,4%; 39,4+-11,8%; 44,8+-8,9% e 60,8 +-17,9% de células com Ki-67.
2.3 MARCADOR TUMORAL CD34 E TUMORES MALIGNOS DO OVÁRIO
HEINBURG, OEHLER, KRISTEN, PAPADOULOS e CAFFIER (1997) realizaram um estudo demonstrando a relevância do CD 34 como método imunohistoquímico de quantificação da vascularização de tumores malignos em ovário, neste estudo foram analisados 30 blocos fixados em formol, e a conclusão dos autores foi que no futuro o CD 34 terá alguma relevância prognóstica, sendo necessários mais estudos.
CZEKIERDOWSKI, SZYMANSKI, SZUMILO e KOTARSKI (2003) estudaram a correlação do índice de fluxo vascular (Doppler) com a expressão do CD 34 em 105 mulheres com tumores anexiais benignos e malignos. Não foi possível correlacionar especificamente os altos índices de vascularização com o CD 34, entretanto pode-se sugerir relação entre a baixa resistência vascular e tumores ovarianos malignos.
KHALIFEH, MUNKARAH, LONARDO, MALONE, MORRIS, LAWRENCE e ALI-FEHMI (2004) estudaram a expressão tumoral de alguns marcadores (Cox-2, Bd-2, p53) inclusive o CD 34. Foi analisado se eles estariam relacionados com a sobrevida de 96 pacientes com carcinoma ovariano e carcinomas peritoneais primários. Sendo apenas os valores da Cox-2 relacionados a taxas mais baixas de sobrevida.
ZORZOU, MARKAKI, RODOLAKIS, KASTRITES, BOZAS, DIMOPOULOS e PAPADIMITRIOU (2005) realizaram um estudo com 9 pacientes com carcinoma de ovário submetidas a tratamento cirúrgico seguido de quimioterapia. O estudo tinha como objetivo elucidar fatores prognósticos clínico-patológicos e imunohistoquímicos das pacientes, utilizando marcadores tumorais como o CD 45RO, c-erB-2, p53, CD 34, Ki 67 e o S100. Concluíram que somente o p53 parecia influenciar na sobrevida (quanto maior a expressão, melhor a sobrevida), contudo devido uma casuística tão pequena, nenhuma conclusão segura poderia ser tomada.
2.4 MARCADOR TUMORAL CD34 E TUMORES GINECOLÓGICOS.
INGEHOLM, PEDERSEN e HOLCK (1999), avaliaram a variação entre dois observadores da quantificação da densidade da microvascularização de casos de tumores de mama, utilizaram 50 casos de câncer invasivo de mama, usando o fator VIII como marcador de angiogênese. Referem na discussão que são utilizados também outros como o CD34 e CD31, porém o Fator VIII é mais específico.
COSTA e GUINEE (2000) utilizaram o CD 34 como marcador imuno histoquímico em 43 blocos de parafina, estudando vários tipos histológicos de tumores do trato genital feminino, sendo sua expressão marcada mais expressivamente nos sarcomas epiteliais, demonstrando ser um excelente marcador tumoral neste tipo histológico de tumor.
GODDARD, SUTTON, FURNESS, KOCKELBERGH e O’BYRNE (2002) demonstraram a densidade da microvascularização de tumores sólidos, fizeram a leitura em blocos de tumores de bexiga, cólon, metástases hepáticas e pulmão, utilizando a imuno-histoquímica e análise de imagem computadorizada, empregando o antígeno monoclonal do CD34, e mostrando a vantagem destes em relação a métodos manuais, muito mais lentos e passíveis de erro.
UZZAN, NICOLAS, CUCHERAT e PERRET (2004) realizaram uma meta análise de 87 estudos publicados analisando a angiogênese, através da densidade da microvascularização intratumoral (MVD). Estabeleceram fatores de prognóstico em mulheres com câncer de mama. O MVD foi calculado por imunohistoquímica, usando anticorpos contra o fator VIII (27 estudos; n= 5265), CD31 (10 estudos; n=2296) ou CD34 (8 estudos; n= 1725). Grandes MVD predizeram significativamente uma pobre sobrevivência (risco padrão de 1,54). Observaram variação entre os resultados dos estudos, podendo ser revelado pelo critério de seleção dos pacientes, técnicas para marcar e contagem da microvascularização. E concluíram citando que o MVD era significante fator de prognóstico em mulheres com câncer de mama.
KILUK e CARTER (2006) abordaram a importância de marcadores da angiogênese em tumores de mama, que tem sido uma área da oncologia muito estudada nas últimas décadas. A presença do complexo processo de angiogênese pode ser relacionada a algumas condições clínicas, como: detecção de pacientes com lesões precoces, seleção de casos de tumores com comportamento mais agressivos, planejar a terapêutica de forma que ocorra melhores respostas, estabelecer estratégias que afetem o suprimento sanguíneo dos tumores. É considerada a chave no crescimento tumoral, sendo que os estudos utilizam a densidade micro-vascular através de métodos imunohistoquímicos. Nos últimos dez anos foram descobertos vários marcadores associados ao processo que podem guiar a avanços na abordagem terapêutica. Para os autores o fator endotelial de crescimento vascular (VEGF) é o marcador mais estudado e relacionado ao câncer de mama.
3 MATERIAL E MÉTODO
O presente estudo foi realizado no Instituto de Pesquisas Médicas do Hospital Universitário Evangélico de Curitiba / Faculdade Evangélica do Paraná e no Laboratório de Citologia e Histologia Ltda – CITOLAB, em Curitiba-Pr.
Aplicaram-se as Normas para a Apresentação de Trabalhos da Universidade Federal do Paraná (2001), as normas para referências bibliográficas (NBR-6023) e de abreviaturas de títulos e periódicos (NBR-6032) da Associação Brasileira de Normas Técnicas – ABNT de 1989 e a Nomina Histológica de 1975.
Este trabalho foi avaliado e aprovado pela comissão de ética em pesquisa da Faculdade Evangélica do Paraná – FEPAR.
3.1 AMOSTRA
O material de estudo foi constituído por 40 casos de tumores malignos de ovário, provenientes do arquivo do serviço de anátomo-patologia do Laboratório Micra, situado no Centro Médico do Hospital Brasília, em Brasília – DF, obtidos de pacientes submetidas à operação de ressecção ovariana, no periodo de 1998 a 2005, conforme descrito no anexo 1.
3.2 PREPARO DO MATERIAL DESTINADO ÀS ANÁLISES
3.2.1 Seleção dos blocos
Os blocos foram selecionados e escolhidos baseando-se nas melhores características físicas externas totalizando 40 blocos, os quais foram transportados para o Laboratório de Citologia e Histologia Ltda – CITOLAB, em Curitiba-Pr, onde foram novamente analisados de acordo com sua adequabilidade para a obtenção das lâminas.
3.2.2 Preparo dos cortes histológicos
Os blocos de parafina foram resfriados em congelador e cortados em micrótomo rotativo (figura 1), onde foram obtidos cortes histológicos de 2 a 5 micra de espessura. As fitas de parafina obtidas pela microtomia foram colocadas em banho-maria e os cortes depositados nas lâminas e levadas à estufa à 60ºC para melhor adesão dos tecidos.
Para cada bloco foram confeccionadas 03 lâminas: uma para hematoxilina eosina, a segunda para o marcador tumoral Ki-67 e a terceira para o marcador tumoral CD34.
FIGURA 1 – MICRÓTOMO ROTATIVO

3.2.3 Estudo das lâminas com a técnica convencional de hematoxilina-eosina
A hematoxilina é um corante básico que cora as estruturas em azul e em contato com as células identifica seus núcleos.
A eosina é um corante ácido que confere às estruturas uma coloração vermelho ou rosa e cora o citoplasma das células.
Tais lâminas foram submetidas à nova avaliação histopatológica, para confirmação dos diagnósticos.
Utilizou-se microscópio óptico NIKON ® e aumento de 400-1000 vezes.
3.2.4 Preparação das lâminas para a técnica de imunohistoquímica
As lâminas utilizadas na colocação dos cortes histológicos para análise imunohistoquímica passaram por preparação prévia de acordo com o seguinte protocolo com duração de 48 horas:
a) Mergulharam-se as lâminas em solução de detergente neutro a 0,5% por 30 minutos;
b) Lavou-se em água corrente até a remoção do detergente, por no mínimo 2 horas;
c) Lavaram-se as lâminas em água quente;
d) Foram secadas em estufa.
Após estarem secas, estas lâminas passaram pelo processo de silanização da seguinte forma:
a) Imersão das lâminas em acetona por 2 minutos. Esgotou-se o excesso; b) Imersão em silano a 4% (APTS ®) por 2 minutos. Esgotou-se o excesso; c) Imersão em acetona por 4 vezes. Esgotou-se o excesso;
d) Secagem em estufa.
Em seguida ao preparo, colocou-se as secções dos blocos de parafina dos casos e iniciou-se o preparo das lâminas para o estudo imunohistoquímico propriamente dito.
3.2.4.1 Processo de desparafinização
a) Colocaram-se as lâminas na cubeta; (figura 2)
b) Foram realizados 2 banhos em xilol de 10 minutos cada;(figura 3) c) Realizou-se 2 banhos em álcool 100% de 3 minutos cada; (figura 4) d) Realizou-se 1 banho em álcool 70% por 3 minutos;
e) Realizou-se a lavagem da lâmina com água destilada, 2 banhos por 1 minuto cada.
FIGURA 2 – COLOCAÇÃO DAS LÂMINAS NA CUBETA

FIGURA 3 – BANHO DAS LÂMINAS EM XILOL

FIGURA 4 – BANHO DAS LÂMINAS EM ÁLCOOL

3.2.4.2 Recuperação antigênica
O uso de fixadores à base de formaldeído pode alterar, destruir ou mascarar alguns antígenos, em razão de sua composição e processo de ligação às moléculas. Como recurso para recuperação destes antígenos pode-se utilizar tratamento com enzimas proteolíticas, irradiação por microondas ou desnaturação em calor úmido, a qual será utilizada neste trabalho.
A recuperação antigênica apresentou os seguintes passos:
a) Obtenção do tampão citrato: Utilizou-se 41 ml de tampão feito com citrato de sódio, 9 ml de tampão feito com ácido cítrico e 450 ml de água destilada;
b) A solução de tampão foi colocada em frascos;
c) Os frascos, aos pares, com tampão citrato, foram levados ao banho-maria (figura 5);
d) Os frascos, com tampão citrato, foram retirados do banho-maria, abertos e as lâminas foram colocadas nos referidos frascos (figura 6);
e) Após fechamento dos frascos, foram novamente levados ao banho-maria até atingir temperatura superior a 97ºC por 20 minutos;
f) Os frascos foram retirados do banho-maria, abertos cuidadosamente e deixados à temperatura ambiente, por 30 minutos, para resfriamento; g) Lavaram-se os frascos em água corrente, por 3 vezes, tomando-se o cuidado para que a água não atingisse diretamente os cortes;
h) Após lavagem, deixou-se os frascos repletos de água corrente.
FIGURA 5 – FRASCOS COM TAMPÃO CITRATO EM BANHO-MARIA

FGURA 6 – FRASCOS COM LÂMINAS E TAMPÃO CITRATO

3.2.4.3 Bloqueio da peroxidase endógena
Em virtude de alguns tecidos possuírem peroxidase endógena, o bloqueio serve para evitar a coloração de fundo, a qual ocorre quando a estreptoridina se liga à peroxidase endógena.
Para este bloqueio foram realizados dois banhos de água oxigenada a 2% por 5 minutos cada. Após, as lâminas foram lavadas em água corrente e colocadas em frascos com tampão PBS.
O tampão PBS foi constituído de: 5,52 g de fosfato dissódico monobásico, 22,72 g de fosfato dissódico bibásico e 1000 ml de água destilada.
3.2.4.4 Caneta hidrofóbica
As lâminas foram secadas uma a uma. Em seguida passou-se a caneta hidrofóbica Dako Cytomation ®, referência S200, lote 00018897 (figura 7) ao redor do corte, formando um círculo em volta do mesmo, como se fosse uma barreira.
FIGURA 7 – UTILIZAÇÃO DA CANETA HIDROFÓBICA

3.2.4.5 Incubação das lâminas com respectivo anticorpo
O anticorpo deve ser agitado antes da utilização. Utilizando-se pipeta, pingaram-se gotas da solução do anticorpo e do anticorpo diluente nas respectivas lâminas, de modo a cobrir todo corte (figura 8).
CD34: diluição de 1 microlitro de CD-34 para 500 microlitros do diluente (1:500);
Ki-67: diluição de 1 microlitro de Ki-67 para 100 microlitros do diluente (1:100).
As lâminas foram levadas para bandejas e colocadas na geladeira durante toda a noite (overnight).
FIGURA 8 – PIPETAGEM DO ANTICORPO NAS LÂMINAS

No dia seguinte as lâminas foram lavadas com água destilada, secadas uma a uma e colocadas em tampão PBS por 5 minutos. Foram novamente secadas e alinhadas em bandeja contendo água, com a finalidade de que o tecido não ressecasse.
Em seguida foi pipetado o 2º. antídoto, denominado Biotinylated link universal ®, o qual faz a ligação entre o 1º. anticorpo (Ki-67 ou CD34) e a estreptoridina. Deixou-se incubando por 30 minutos.
O passo seguinte foi pipetar uma gota de Diaminobenzidina (DAB), para que reagisse com a peroxidase da estreptoridina, que estava ligada à biotina e esta por sua vez acoplada ao anticorpo 1.
Aguardou-se até que os cortes de tecido ficassem escuros, secou-se o excesso com papel-toalha e depois se colocou em cuba com água por 20 minutos.
3.2.4.6 Coloração com Hematoxilina
Cada uma das lâminas foi corada com hematoxilina de acordo com a técnica descrita a seguir:
a) banho de hematoxilina por 35 segundos;
b) lâminas lavadas em água corrente até que fique transparente;
c) banho com álcool 100% por 1 minuto;
d) banho com álcool 70% por 1 minuto;
e) 2 banhos com xilol por 1 minuto cada;
f) secagem das lâminas com papel-toalha ao redor do círculo feito com a caneta hidrofóbica.
3.2.4.7 Colocação da lamínula e identificação das lâminas
Foi feito rastro de cola específica atrás da lamínula e esta foi cuidadosamente assentada sobre a lâmina, aderindo uma à outra. A etiqueta de identificação foi colocada na parte superior de cada uma das lâminas.
Esta etapa foi cumprida integralmente no laboratório Citolab e depois transportadas ao Instituto de Pesquisas Médicas (IPEM).
3.3 ANÁLISE QUANTITATIVA DA IMUNOHISTOQUÍMICA
Esta etapa foi feita no Instituto de Pesquisas Médicas em Curitba-Pr (IPEM), utilizando o sistema SAMBA 4000® (Systeme d’analyse microscopique à balayage automatique – Sistema de análise microscópica de busca automática), desenvolvido pela Alcatel (Grenoble – França). É constituído por hardware capaz de captar imagens microscópicas e por software que interpreta as imagens captadas. O hardware é composto por 6 unidades: microscópio (figura 9), câmara de vídeo (figura 10) , micro-computador com 2 monitores (figura 11) e impressora (figura 12). O microscópio utilizado no estudo é da marca Axioskop® (Zeiss / Alemanha) (figura 9). O fluxo luminoso oriundo da lâmpada de xenônio é controlado por um potenciômetro capaz de avaliar com precisão a quantidade de luz. Este feixe atravessa o condensador, a lâmina histológica, a objetiva em uso e, então, é separado em duas partes: uma via destinada à observação visual através da ocular do microscópio e a outra é a via de captação da imagem, pela câmera de vídeo, a qual é enviada ao monitor acoplado ao computador.
FIGURA 9 – MICROSCÓPIO
A câmara de vídeo foi a DXC – 970MD3CCD ® (Sony / Japão) (figura 10) que padroniza as cores verde, azul e vermelha, de forma que o sistema trabalha com o mesmo nível de captação determinado.
FIGURA 10 – CÂMARA DE VÍDEO UTILIZADA NO TRABALHO MODELO DXC – 970MD3CCD ® (SONY / JAPÃO)

O computador utilizado no estudo (figura 11) é Pentium III ®, com 16 Mb RAM e disco rígido de 12 gigabytes, que realizou as funções de importação das imagens do microscópio e da câmera de vídeo, de execução do software IMMUNO® do sistema SAMBA 4000 e a transferência dos dados para impressão.
FIGURA 11 – MICROCOMPUTADOR COM 2 MONITORES

FIGURA 12 – IMPRESSORA

O software utilizado foi o IMMUNO®. Antes de seu uso, foi realizada a calibração do sistema SAMBA 4000, de acordo com as seguintes etapas: – aquisição da imagem;
– processamento e digitalização da imagem;
– binarização da imagem;
– segmentação da imagem;
– identificação do objeto;
– seleção e reconhecimento do objeto de interesse;
– análise da imagem;
– resultados.
As Imagens analógicas, tais quais percebidas, foram captadas através da câmara e transformadas em imagens numéricas.
A análise teve por finalidade transformar as imagens coradas pelo marcador em matriz numérica. A partir desta, foram calculados parâmetros matemáticos que permitiram a análise numerizada das imagens microscópicas.
Estas imagens foram processadas pelo sistema SAMBA 4000 e digitalizadas em pontos de imagem (pixels).
A luz absorvida pelo tecido foi quantificada e expressa através de uma escala de variações de níveis de cinza que varia de 0 (preto) a 255 (branco). Este processo corresponde à numerização da imagem e envolve duas etapas: geração de matriz em níveis de cinza (figura 13) e transformação desta em matriz numérica binária (figura 14).
FIGURA 13 – ILUSTRAÇÃO DO PROCESSO DE NUMERIZAÇÃO DA IMAGEM EM NÍVEIS DE CINZA DE UM NÚCLEO CELULAR. 0 = PONTOS DE IMAGEM SEM DENSIDADE; PARTE NUMÉRICA = PONTOS DE IMAGEM COM DENSIDADE EM NÍVEIS DE CINZA, REPRESENTANDO UM NÚCLEO CELULAR.

FIGURA 14 – IMAGEM BINÁRIA (MATRIZ NUMÉRICA BINÁRIA). CADA CONJUNTO DE PONTOS IMAGEM 1, REPRESENTA UM NÚCLEO CELULAR. A AUSÊNCIA DE NÚCLEO (PONTO DE IMAGEM SEM DENSIDADE) CORRESPONDE AO VALOR 0.

Para melhor aproveitamento das imagens em cada lâmina utilizou-se os locais de maior ação do marcador, denominados hot spots.
O aumento utilizado foi de 20 vezes em todo tecido marcado e o resultado foi expresso em porcentagem.
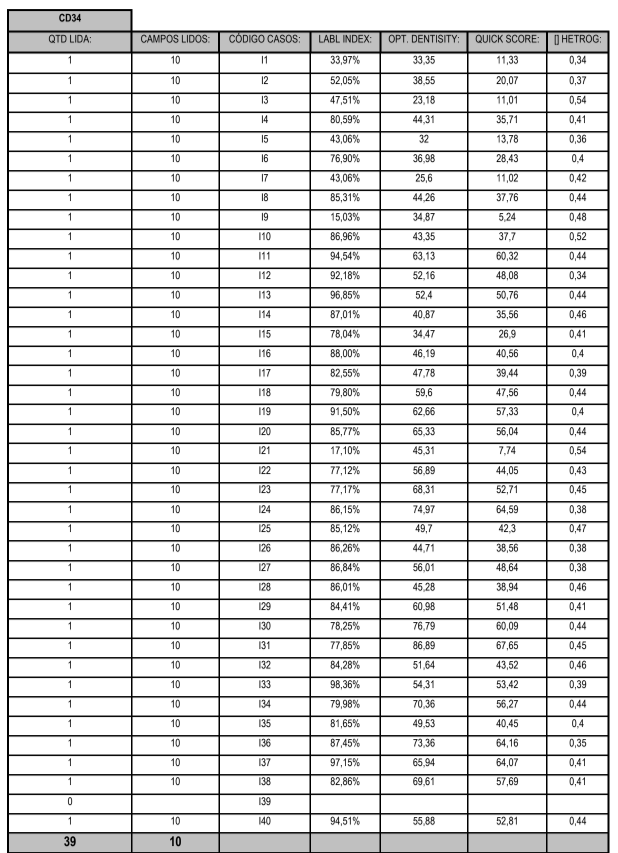
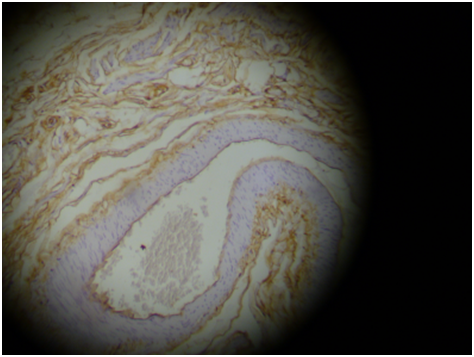
Neste estudo foram consideradas 40 lâminas provenientes de tumores malignos de ovário, nas quais foram analisados os índices de marcagem, densidade óptica e heterogenicidade dos marcadores Ki-67 (figura 15) e CD34 (figura 16).
FIGURA 15 – LÂMINA COM TECIDO TUMORAL OVARIANO NA QUAL FOI UTILIZADO O MARCADOR TUMORAL KI-67
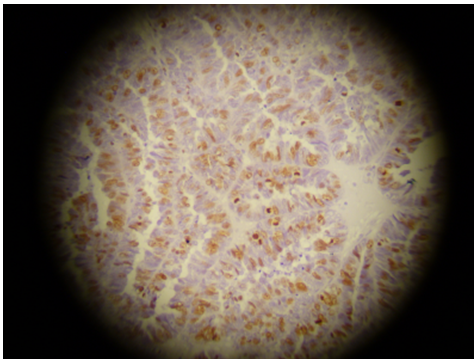
FIGURA 16 – LÂMINA COM TECIDO TUMORAL OVARIANO NA QUAL FOI UTILIZADO O MARCADOR TUMORAL CD34
3.4 ANÁLISE ESTATÍSTICA
Os resultados obtidos no estudo foram expressos por médias, medianas, valores mínimos, valores máximos e desvios padrões. A condição de normalidade das variáveis quantitativas foi investigada usando-se o teste de Shapiro-Wilks. Para avaliar o grau de associação entre a expressão dos marcadores, foi estimado o coeficiente de correlação de Pearson ou o coeficiente de correlação de Spearman. A comparação dos marcadores foi feita usando-se o teste t de Student para amostras pareadas. Valores de p < 0,05 indicaram significância estatística.
4 RESULTADOS
Das 40 lâminas selecionadas, 19 foram lidas quando se utilizou o Ki-67 e 39 foram lidas utilizando o CD34 e uma das lâminas não teve campos lidos para nenhum dos marcadores, conforme demonstram o anexo 2 e o anexo 3.
4.1 DESCRIÇÃO DA EXPRESSÃO DOS MARCADORES Ki-67 E CD34
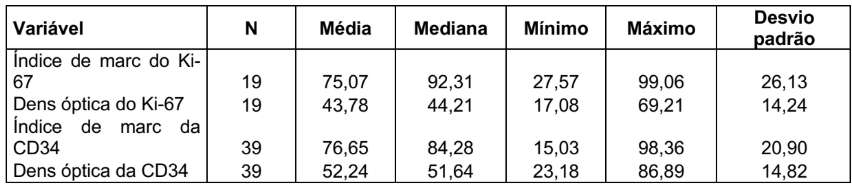
Na tabela 1 são apresentadas as variáveis índice de marcagem e densidade óptica, os números de casos que foram lidos para os marcadors Ki-67 e CD34, resultados de médias, medianas, valores mínimos, valores máximos e desvios padrões.
TABELA 1 – DESCRIÇÃO DA EXPRESSÃO DOS MARCADORES Ki-67 E CD34
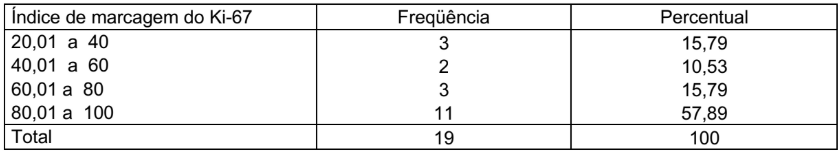
Na tabela 2 está demonstrado o índice de marcagem do Ki-67, que foi dividido em quatro grupos, de 20 a 40, onde 3 lâminas foram lidas, representando 15,79%, de 40,01 a 60, onde 2 lâminas foram lidas, representando 10,53%, de 60,01 a 80, onde 3 lâminas foram lidas, representando 15,79% e de 80,01 a 100, onde 11 lâminas foram lidas, representando 57,89%, totalizando 19 lâminas e 100%.
TABELA 2 – ÍNDICE DE MARCAGEM DO Ki-67
Condição de normalidade: p=0,002 (Teste de Shapiro-Wilks)
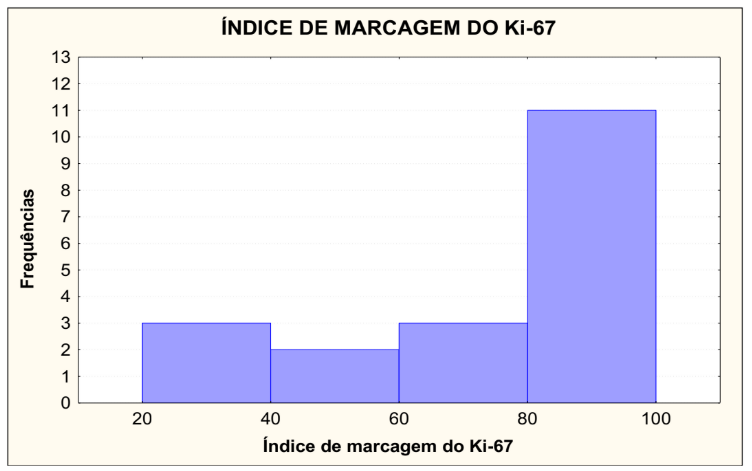
No gráfico 1 está demonstrado o índice de marcagem do Ki-67, que foi dividido em quatro grupos, de 20 a 40, onde 3 lâminas foram lidas, representando 15,79%, de 40,01 a 60, onde 2 lâminas foram lidas, representando 10,53%, de 60,01 a 80, onde 3 lâminas foram lidas, representando 15,79% e de 80,01 a 100, onde 11 lâminas foram lidas, representando 57,89%.
Testou-se a hipótese nula de que os dados têm distribuição normal, versus a hipótese alternativa de que os dados não têm distribuição Normal. Os resultados dos testes indicaram que, para Ki-67, não há normalidade dos dados para o índice de marcagem.
GRÁFICO 1 – ÍNDICE DE MARCAGEM DO Ki-67
Na tabela 3 está demonstrada Densidade Óptica do Ki-67, que foi dividida em 6 grupos, de 10,01 a 20, onde 1 lâmina foi lida, representando 5,26%de 20,01 a 30, onde 3 lâminas foram lidas, representando 15,79%, de 30,01 a 40, onde 21,05 lâminas foram lidas, representando 21,05%, de 40,01 a 50, onde 4 lâminas foram lidas, representando 21,05%, de 50,01 a 60, onde 4 lâminas foram lidas, representando 21,05%, e de 60,01 a 70, onde 3 lâminas foram lidas, representando 15,79%, totalizando 19 lâminas e 100%.
TABELA 3 – DENSIDADE ÓPTICA DO Ki-67

Condição de normalidade: p=0,990 (Teste de Shapiro-Wilks)
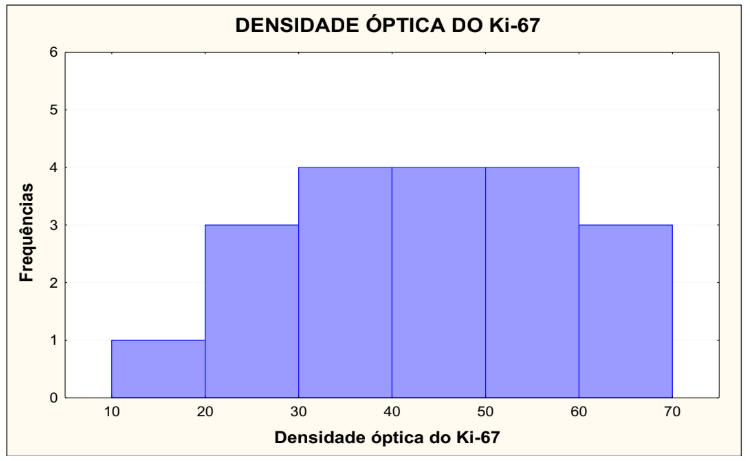
No gráfico 2 está demonstrado a densidade óptica do Ki-67, que foi dividida em 6 grupos, de 10,01 a 20, onde 1 lâmina foi lida, representando 5,26%de 20,01 a 30, onde 3 lâminas foram lidas, representando 15,79%, de 30,01 a 40, onde 21,05 lâminas foram lidas, representando 21,05%, de 40,01 a 50, onde 4 lâminas foram lidas, representando 21,05%, de 50,01 a 60, onde 4 lâminas foram lidas, representando 21,05%, e de 60,01 a 70, onde 3 lâminas foram lidas, representando 15,79%. Testou-se a hipótese nula de que os dados têm distribuição Normal, versus a hipótese alternativa de que os dados não têm distribuição Normal. Os resultados dos testes indicaram que, para o Ki-67, não há normalidade dos dados para a densidade óptica. Para a densidade óptica, não foi rejeitada a condição de normalidade dos dados.
GRÁFICO 2 – DENSIDADE ÓPTICA DO Ki-67
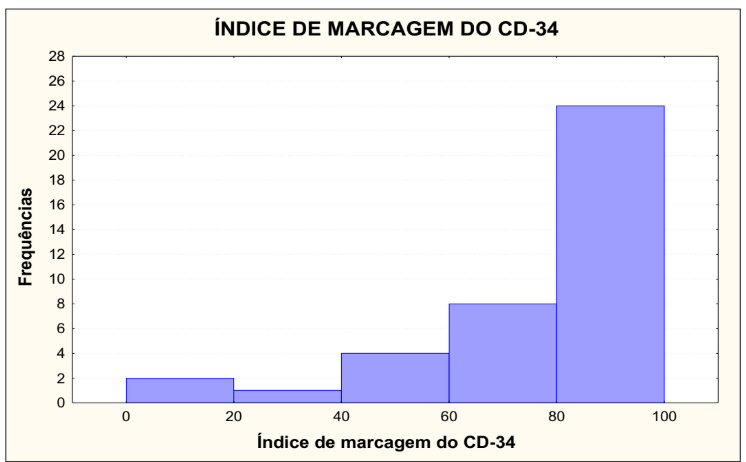
Na tabela 4 está demonstrado o índice de marcagem do CD34, que foi dividido em cinco grupos, de 0 a 20, onde 2 lâminas foram lidas, representando 5,13%, de 20,01 a 40, onde 1 lâmina foi lida, representando 2,56%, de 40,01 a 60, onde 4 lâminas foram lidas, representando 10,26%, de 60,01 a 80, onde 8 lâminas foram lidas, representando 20,51% e de 80,01 a 100, onde 24 lâminas foram lidas, representando 61,54%, totalizando 39 lâminas e 100%.
TABELA 4 – ÍNDICE DE MARCAGEM DA CD34
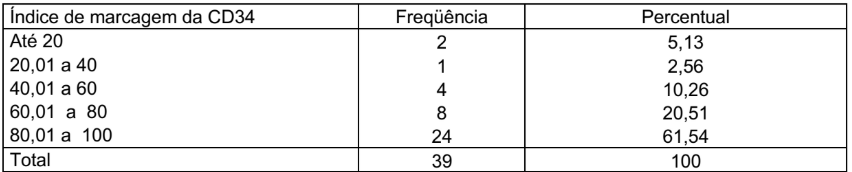
Condição de normalidade: p<0,001 (Teste de Shapiro-Wilks)
No gráfico 3 está demonstrado o índice de marcagem do CD34, que foi dividido em cinco grupos, de 0 a 20, onde 2 lâminas foram lidas, representando 5,13%, de 20,01 a 40, onde 1 lâmina foi lida, representando 2,56%, de 40,01 a 60, onde 4 lâminas foram lidas, representando 10,26%, de 60,01 a 80, onde 8 lâminas foram lidas, representando 20,51% e de 80,01 a 100, onde 24 lâminas foram lidas, representando 61,54%. Testou-se a hipótese nula de que os dados têm distribuição Normal, versus a hipótese alternativa de que os dados não têm distribuição Normal. Os resultados dos testes indicaram que, para CD34, não há normalidade dos dados para o índice de marcagem.
GRÁFICO 3 – ÍNDICE DE MARCAGEM DA CD34
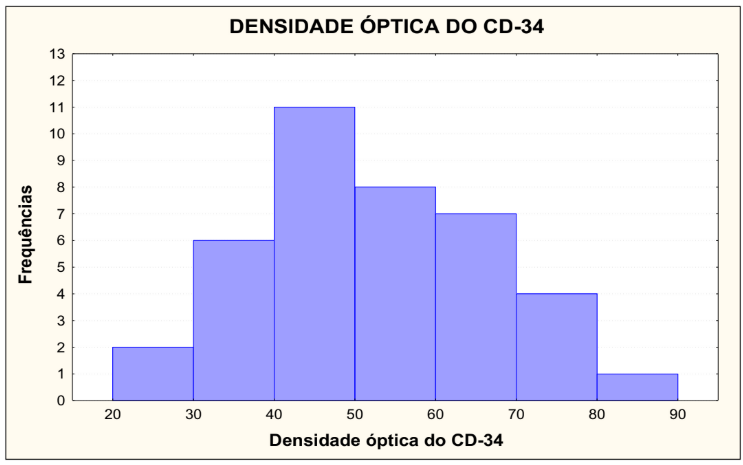
Na tabela 5 está demonstrada Densidade Óptica do CD34, que foi dividida em 7 grupos, de de 20,01 a 30, onde 2 lâminas foram lidas, representando 5,13%, de 30,01 a 40, onde 6 lâminas foram lidas, representando 15,38%, de 40,01 a 50, onde 11 lâminas foram lidas, representando 28,21%, de 50,01 a 60, onde 8 lâminas foram lidas, representando 20,51%, e de 60,01 a 70, onde 7 lâminas foram lidas, representando 17,95%, 70,01 a 80, onde 4 lâminas foram lidas, representando 10,26%, 80,01 a 90, onde 1 lâmina foi lida, representando 2,56%, totalizando 39 lâminas e 100%.
TABELA 5 – DENSIDADE ÓPTICA DA CD34
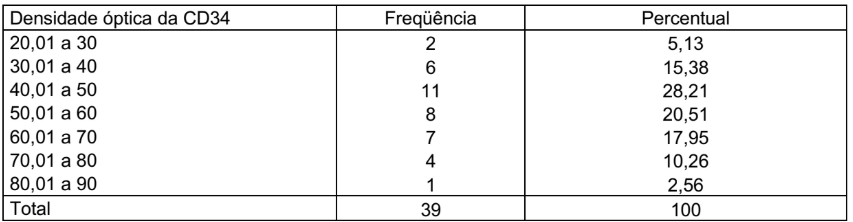
Condição de normalidade: p=0,966 (Teste de Shapiro-Wilks)
No gráfico 4 está demonstrada a densidade óptica do CD34, que foi dividida em 7 grupos, de de 20,01 a 30, onde 2 lâminas foram lidas, representando 5,13%, de 30,01 a 40, onde 6 lâminas foram lidas, representando 15,38%, de 40,01 a 50, onde 11 lâminas foram lidas, representando 28,21%, de 50,01 a 60, onde 8 lâminas foram lidas, representando 20,51%, e de 60,01 a 70, onde 7 lâminas foram lidas, representando 17,95%, 70,01 a 80, onde 4 lâminas foram lidas, representando 10,26%, 80,01 a 90, onde 1 lâmina foi lida, representando 2,56%.
Testou-se a hipótese nula de que os dados têm distribuição normal, versus a hipótese alternativa de que os dados não têm distribuição normal. Os resultados dos testes indicaram que, para CD34, não há normalidade dos dados para a densidade óptica.
GRÁFICO 4 – DENSIDADE ÓPTICA DA CD34
4.2 COMPARAÇÃO ENTRE OS MARCADORES:
4.2.1 Índice de marcagem do Ki-67 e índice de marcagem do CD34
Na tabela 6 testou-se a hipótese nula de que os resultados do índice de marcagem do Ki-67 são iguais aos resultados do índice de marcagem do CD34, versus a hipótese alternativa de resultados diferentes. Nesta tabela são apresentadas as variáveis, índice de marcagem do Ki-67 e índice de marcagem do CD34 e também da diferença entre eles, número de lâminas lidas para ambos marcadores, valores de média, mediana, mínimo, máximo e o valor de p. Foram consideradas somente as lâminas lidas por ambos os marcadores.
TABELA 6 – ÍNDICE DE MARCAGEM DO Ki-67 X ÍNDICE DE MARCAGEM DO CD34
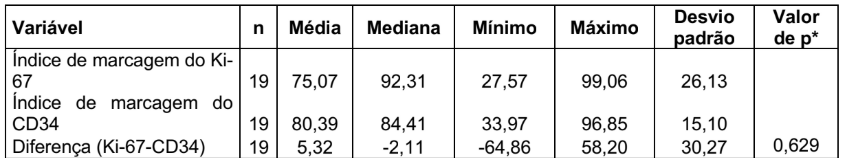
(*) Teste não-paramétrico de Wilcoxon
O resultado do teste indicou a não rejeição da hipótese nula (p = 0,629). Sendo assim, não podemos afirmar que existe diferença significativa entre Ki-67 e CD34 em relação ao índice de marcagem.
No gráfico 5 comparou-se os resultados do índice de marcagem do Ki-67 com os resultados do índice de marcagem do CD34. Neste gráfico estão representados os valores da mediana, mínimo e máximo. Sendo consideradas somente as lâminas lidas por ambos os marcadores.
GRÁFICO 5 – ÍNDICE DE MARCAGEM DO Ki-67 X ÍNDICE DE MARCAGEM DO CD34

4.2.2 Densidade óptica do Ki-67 e densidade óptica do CD-34
Na tabela 7 testou-se a hipótese nula de que as médias da densidade óptica do Ki-67 e da densidade óptica do CD34 são iguais, versus a hipótese alternativa de que as médias são diferentes. Nesta tabela são apresentadas as variáveis, densidade óptica do Ki-67 e densidade óptica do CD34 e também da diferença entre eles, número de lâminas lidas para ambos marcadores os valores de média, mediana, mínimo, máximo e desvio padrão da densidade óptica dos dois marcadores e o valor de p. Foram consideradas somente as lâminas lidas por ambos os marcadores.
TABELA 7 – DENSIDADE ÓPTICA DO Ki-67 X DENSIDADE ÓPTICA DO CD34
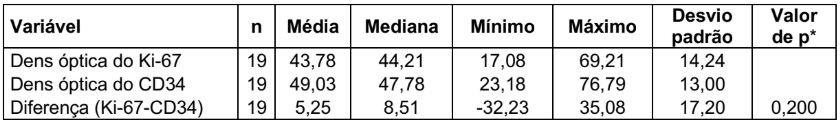
(*) Teste t de Student para amostras dependentes
O resultado do teste indicou a não rejeição da hipótese nula (p = 0,200). Sendo assim, não podemos afirmar que existe diferença significativa entre Ki-67 e CD34 em relação à média da densidade óptica.
No gráfico 6 comparou-se os resultados da densidade óptica do Ki-67 com os resultados da densidade óptica do CD-34. Neste gráfico são apresentados os valores de média, desvio padrão e erro padrão.
GRÁFICO 6 – DENSIDADE ÓPTICA DO Ki-67 E DENSIDADE ÓPTICA DO CD-34

4.3 ASSOCIAÇÃO ENTRE OS MARCADORES Ki-67 E CD34
Na tabela 8, foi avaliado o grau de associação entre as expressões dos marcadores e os coeficientes de correlação entre a expressão dos marcadores. Em cada situação, testou-se a hipótese nula de ausência de correlação entre as expressões dos marcadores, versus a hipótese alternativa de existência de correlação. Estando presente as variáveis: índice de marcagem do Ki-67 versus densidade óptica do Ki-67, índice de marcagem do CD34 versus densidade óptica do CD34, índice de marcagem do Ki-67 versus índice de marcagem do CD34, densidade óptica do Ki-67 versus densidade óptica do CD34, o número de lâminas lidas, o coeficiente de correlação e o valor de p representado a significância da amostra estudada.
TABELA 8 – ASSOCIAÇÃO ENTRE OS MARCADORES Ki-67 E CD34
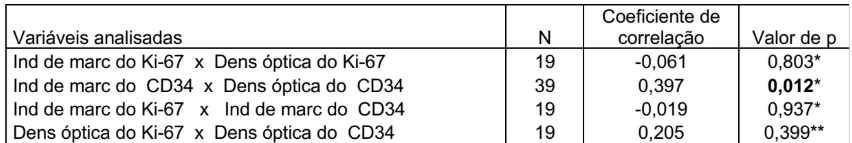
* Coeficiente de correlação de Spearman
** Coeficiente de correlação de Pearson
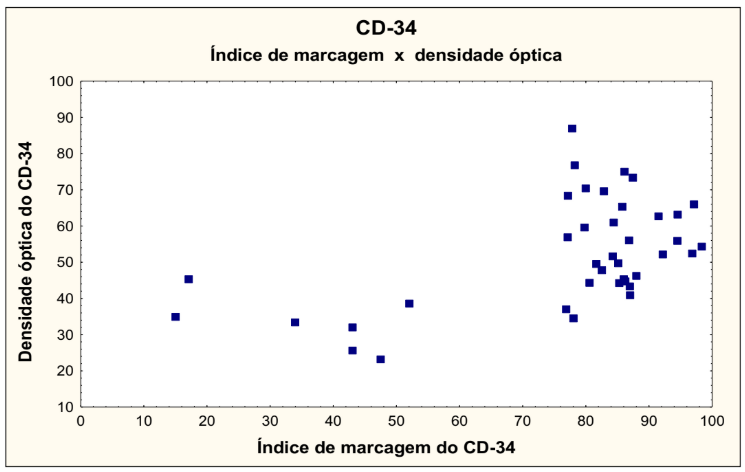
Os resultados indicam que, para o marcador CD34, existe correlação positiva e significativa entre o índice de marcagem e a densidade óptica (p=0,012). Não foram encontradas correlações significativas entre as demais expressões avaliadas.
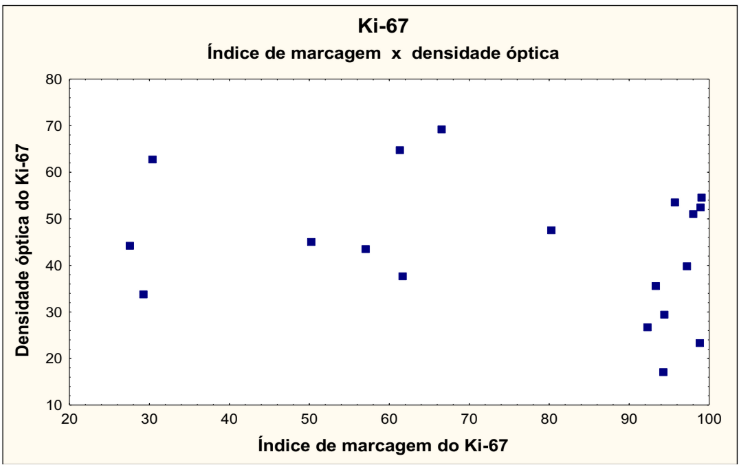
No gráfico 7 foram correlacionadas as variáveis índice de marcagem do Ki 67 versus densidade óptica do Ki-67, onde não houve significância estatística.
GRÁFICO 7 – ÍNDICE DE MARCAGEM DO Ki-67 X DENSIDADE ÓPTICA DO Ki-67
No gráfico 8 foram correlacionadas as variáveis índice de marcagem do CD34 versus densidade óptica do CD34, onde houve significância estatística.
GRÁFICO 8 – ÍNDICE DE MARCAGEM DO CD34 VERSUS DENSIDADE ÓPTICA DO CD34
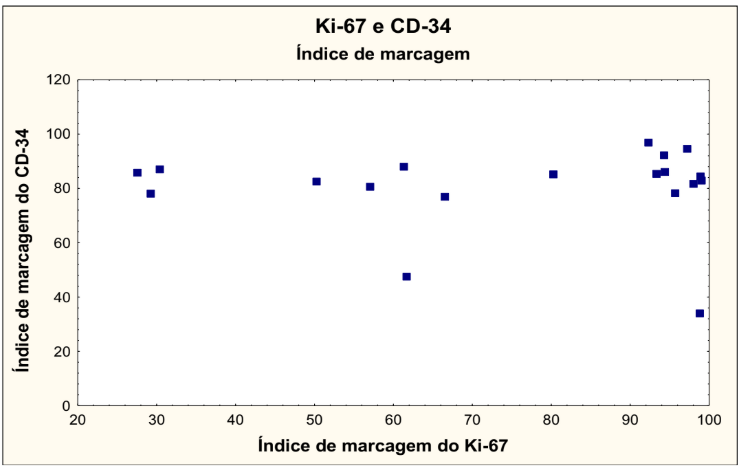
No gráfico 9 foram correlacionadas as variáveis índice de marcagem do Ki 67 versus índice de marcagem do CD34, onde não houve significância estatística.
GRÁFICO 9 – ÍNDICE DE MARCAGEM DO Ki-67 VERSUS ÍNDICE DE MARCAGEM DO CD34
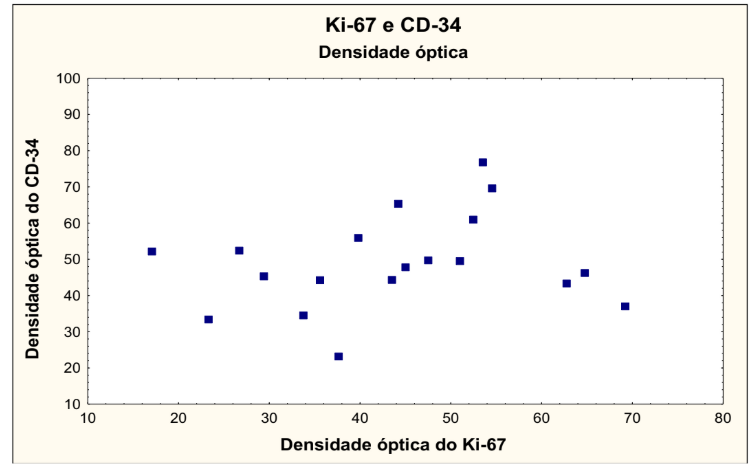
No gráfico 10 foram correlacionadas as variáveis densidade óptica do Ki-67 versus densidade óptica do CD34, onde não houve significância estatística.
GRÁFICO 10 – DENSIDADE ÓPTICA DO Ki-67 X DENSIDADE ÓPTICA DO CD34
4.4 ANÁLISE DA IDADE DAS PEÇAS E A LEITURA DAS LÂMINAS
Das 40 lâminas de tumores de ovário, 20 eram de 1998 a 2001 e outras 20 eram de 2002 a 2005.
4.4.1 Marcador: Ki-67
Conforme a tabela 9, das lâminas de 1998 a 2001, 12 (60%) foram lidas para análise de Ki-67 e 8 (40% ) não foram lidas, totalizando 20 lâminas. Das lâminas de 2002 a 2005, 7 (35%) foram lidas e 13 (65%) não foram lidas, totalizando 20 lâminas. Testou-se a hipótese nula de que a proporção de lâminas de 1998 a 2001 que são lidas é igual à proporção de lâminas de 2002 a 2005 que são lidas, versus a hipótese alternativa de proporções diferentes. O resultado do teste indicou a não rejeição da hipótese nula (p=0,2049). Sendo assim, para a análise da expressão de Ki-67, não podemos afirmar que existe diferença significativa entre lâminas do período de 1998 a 2001 e lâminas do período de 2002 a 2005, em relação à viabilidade da leitura.
TABELA 9 – CAPACIDADE DE LEITURAS DAS LÂMINAS PARA O Ki-67

4.4.2 Marcador: CD34
Conforme tabela 10, das lâminas de 1998 a 2001, todas as 20 lâminas foram lidas para análise do marcador CD34. Das lâminas de 2002 a 2005, 19 (95%) foram lidas e 1 (5%) não foi lida, totalizando 20 lâminas. Testou-se a hipótese nula de que a proporção de lâminas de 1998 a 2001 que são lidas é igual à proporção de lâminas de 2002 a 2005 que são lidas, versus a hipótese alternativa de proporções diferentes. O resultado do teste indicou a não rejeição da hipótese nula (p=1). Sendo assim, para a análise da expressão de CD34, não podemos afirmar que existe diferença significativa entre lâminas do período de 1998 a 2001 e lâminas do período de 2002 a 2005, em relação à viabilidade da leitura.
TABELA 10 – CAPACIDADE DE LEITURAS DAS LÂMINAS PARA O CD34

5 DISCUSSÃO
5.1 TUMORES MALIGNOS DE OVÁRIO
O câncer de ovário apresenta a maior taxa de mortalidade entre os tumores ginecológicos, uma vez que o diagnóstico em 60% das vezes é realizado nos estádios III e IV da FIGO (Federação Internacional de Ginecologia e Obstetrícia), o que piora muito o prognóstico e reduz drasticamente a sobrevida das pacientes, sabendo disto muitos pesquisadores investem em estudos que descubram um marcador tumoral com boa sensibilidade e especificidade, realizando um diagnóstico precoce e melhorando desta maneira a sobrevida das pacientes. O intuito do presente estudo foi justamente a investigação de marcadores precoces nos tumores malignos de ovário.
5.2 MARCADORES TUMORAIS
Os avanços no conhecimento da biologia molecular têm proporcionado melhor entendimento dos mecanismos fundamentais que regulam a proliferação e diferenciação e diferenciação celular, bem como o desenvolvimento de metástases tumorais. Os marcadores tumorais são substâncias presentes nos tumores, no sangue e em outros liquidos biológicos, produzidos primariamente pelo tumor ou secundariamente pelo paciente em resposta a presença do tumor.
Os marcadores devem ter como característica poderem ser utilizados para diferenciar tecidos normais de neoplásicos e que possam ser quantificados por procedimentos relativamente práticos.
Muitos marcadores já foram estudados, porém poucos apresentaram resultados dignos de nota, um dele foi o CEA, o antígeno carcinoembrionário, que foi isolado pela primeira vez por Gold e Freedman em 1965, no intestino de fetos e de doentes portadores de câncer colorretal. O CEA é uma imunoglobulina cuja principal função é promover a adesão molecular intercelular. Pesquisas que utilizam técnicas imunohistoquímicas revelaram que o CEA é um antígeno habitualmente presente nas células normais e nas de carcinoma colorretal. A principal diferença entre o conteúdo de CEA nas células normais e neoplásicas aparenta ser muito mais quantitativa do que qualitativa. Contudo, estudos ultraestruturais demonstraram que existem diferenças no padrão de distribuição celular do CEA quando se compara o tecido normal com o neoplásico.
A literatura mundial é rica em trabalhos mostrando que um dos melhores marcadores diagnósticos para os tumores malignos de ovário são a ultra-sonografia e o marcador sorológico CA-125. No trabalho feito em 2000 por Van Nagell et al., 14000 mulheres foram ratreadas através da ultra-sonografia e do CA-125, tanto para o diagnóstico precoce quanto para o acompanhamento pós-cirúrgico. Tanto a ultra sonografia quanto o CA-125 apresentaram sensibilidade e especificidade muito próximas. Entretanto um trabalho publicado em 1986 por Halila et al. demonstraram aumento sérico do marcador CA-125 em mulheres com doença inflamatória pélvica e em gestações ectópicas, diminuindo de forma importante a especificidade do marcador em pacientes jovens. Posteriormente, em 1996 Jacobs et al., demonstaram que o CA-125 é excelente nas mulheres pós-menopausadas, e como trata-se de um parâmetro clínico o qual não constava em nossa fonte de dados, não podemos correlacionar o Ki-67 e o CD 34 com este dado.
No estudo feito por Gadducci et al. em 1992 com 90 pacientes com tumores malignos de ovário e 254 com patologias benignas de ovário, os autores constataram uma especificidade de 86,6% e sensibilidade de 76,6% para o CA-125 na avaliação dos tumores malignos de ovário.
Os autores Berek e Bast em 1995 utilizaram os seguintes marcadores tumorais na detecção precoce do câncer de ovário, O CA-125, o CA 15-3, C19-9, o CA 54-61, o CA 72-4, CEA, HMFG2, IL-6, IL-10, LSA, M-CSF, NB70K, OVX1, PLAP, TAG72, TNF, TPA, e UGTF, tais marcadores foram estudados sozinhos e combinados, tendo o CA-125 uma sensibilidade de 83%, similar ao da ultrasonografia, e a especificidade de 99,7%.
Apesar do CA-125 e o CEA iniciarem o marco na literatura dos marcadores tumorais ovarianos, muitos outros marcadores são estudados frequentemente. Após intensa revisão da literatura não foram encontrados muitos trabalhos utilizando os marcadores tumorais Ki-67 e CD34 como fatores diagnóstico para os tumores malignos de ovário, sendo a grande maioria dos trabalhos relacionados a fatores prognósticos para tumores malignos de ovário utilizando tais marcadores tumorais, diferentemente do estudo aqui apresentado, que investiga marcadores tumorais diagnósticos para tumores malignos de ovário.
5.3 O MARCADOR TUMORAL Ki-67
Os autores Brown e Gatter, em 1990 descreveram o Ki-67 como um anticorpo monoclonal sendo um meio confiável e fácil de avaliar a fração de crescimento tumoral humano. Embora o número de estudos a longo prazo seja limitado, parece fornecer informações prognósticas valiosas, particularmente nas doenças linfoproliferativas. Desde que se observou que a fração de crescimento é somente um dos fatores que influenciam o comportamento tumoral, seria ingênuo acreditar que, essa medida seria um parâmetro isolado, para fornecer ao clínico, com exatidão, o prognóstio definitivo para todos os tumores. O anticorpo também é usado em pesquisas para fornecer meios de mensurar a atividade proliferativa em uma variedade das condições além da malignidade, podendo também servir no monitoramento após a terapia estabelecida pelo médico assistente.
Os autores Isola et al. em 1990 estudaram o Ki-67 como marcador imunohistoquímico de proliferação celular em pacientes na peri-menopausa com tumor ovariano. Concluíram que o Ki-67 poderia ser utilizado como marcador prognóstico para mulheres peri-menopausadas com câncer de ovário, diferente deste trabalho onde o Ki-67 foi utilizado como marcador diagnóstico e não prognóstico e onde não houveram parâmetros clínicos tais como a peri-menopausa.
Henriksen et al., assim como no presente trabalho, realizaram estudos imunohistoquímicos através da citometria de fluxo de amostras de tumores ovarianos malignos, através da expressão do Ki-67, entretanto o intuito foi uma avaliação prognóstica, e eles também investigaram os tumores ovarianos borderline e ovários normais. Chegaram a conclusão que quanto maior o índice de marcagem pior seria o prognóstico da paciente, no presente estudo, também usando o índice de marcagem e analisando apenas ovários acometidos por tumores malignos, foi observada significância estatística do Ki-67 como marcador tumoral diagnóstico para o câncer de ovário.
O estudo feito por Garzetti et al. em 1995 avaliou o significado biológico da expressão do antígeno Ki-67 em 54 pacientes, sendo 10 cistoadenomas serosos de ovário, 16 tumores limítrofes e 28 cistoadenocarcinomas invasivos. Concluíram que o Ki-67 era significativamente mais elevado nos cistoadenocarcinomas. No presente estudo o Ki-67 apresentou índice de marcagem significativamente estatístico para todos os tipos histológicos estudados.
Darai et al. testaram a expressão diagnóstica e prognóstica do Ki-67 em tumores de ovário. Sendo 25 tumores benignos de ovário, 35 limítrofes e 20 tumores malignos. A imunopositividade para Ki-67 foi detectada em 3 tumores benignos, 14 limítrofes e 14 carcinomas ovarianos. A diferença no estudo imunohistoquímico do Ki-67 foi encontrada entre carcinomas e tumores benignos e entre tumores limítrofes e carcinomas, mas não entre tumores benignos e limítrofes. Concluíram que o Ki-67 não está correlacionado com nenhum parâmetro prognóstico nos tumores limítrofes de ovário. No presente trabalho o Ki-67 está associado ao parâmetro diagnóstico e os tumores estudados foram somentes tumores malignos de ovário, não entrando na análise os tumores limítrofes.
O estudo feito por Querzoli et al. investigou a relação entre a expressão do Ki-67, em 871 amostras de carcinomas mamários infiltrativos, estudando variáveis de prognóstico. Selecionaram aleatoriamente pelo menos 15 campos de cada amostra sob objetiva de 40X com contagem de pelo menos 2000 núcleos, estabeleceram índice proliferativo do Ki-67 pela porcentagem de áreas de núcleos marcados positivamente e o número total contado. Verificaram índice proliferativo de 0,01 a 96,5% com média de 8,42%. Utilizando como ponto de corte ≥ 13% de porcentagem de área nuclear marcada, encontraram 36,4% nas amostras com alto índice proliferativos. A variedade ductal teve índice médio de 41,8%. Estudando um grupo de 170 pacientes, com seguimento médio de 65,5 meses e índice proliferativo baixo e nódulo negativo, foi verificado que viveram significativamente mais tempo livre da doença. Concluíram que o índice proliferativo é confiável e prático, sendo um método útil para mensurar atividade proliferativa e um importante preditor de comportamento clínico, diferente do presente estudo onde o tecido estudado foi o ovário e usou-se o Ki-67 como marcador diagnóstico. Entretanto ambos os trabalhos investigaram o índice de atividade proliferativa tumoral.
Piek et al. em 2001, estudaram a predisposição para o desenvolvimento do câncer de ovário, usando o Ki-67 como marcador tumoral, porém, os tecidos estudados foram as trompas. Foram separadas mulheres para um grupo controle e outras com predisposição ao câncer de ovário, e neste caso o Ki-67 mostrou aumentada sua expressão, assim como no presente trabalho, que também apresentou expressão aumentada para o Ki-67, entretanto o tecido estudado foi o ovário.
5.4 O MARCADOR TUMORAL CD34
Em 2000, Costa e Guinee utilizaram o CD 34 como marcador imunohistoquímico em 43 blocos de parafina, estudando vários tipos histológicos de tumores do trato genital feminino, sendo sua expressão marcada mais expressivamente nos sarcomas epiteliais, demonstrando ser um excelente marcador tumoral neste tipo histológico de tumor. No presente estudo também utilizando blocos de parafina, porém o objeto da análise sendo os tumores malignos ovarianos, o CD34 também foi utilizado como marcador imunohistoquímico.
A angiogênese, por ser fator independente e aplicável na prática para todos os tumores sólidos, é considerada como bom indicador de prognóstico. No carcinoma prostático, Wakui et al. mostram que a densidade de microvasos apresenta-se aumentada nos tumores de alto grau e nos casos metastáticos. No melanoma cutâneo e nevus displásico atípico grave, Barnhill et al. observaram que o número de microvasos era maior em relação ao nevus comum. Em carcinoma da mama, Horak et al. descrevem um número mais elevado de vasos em carcinomas com linfonodos axilares positivos e pouco diferenciados, bem como nos tumores associados a menor sobrevida. No trato genital, a angiogênese tumoral é bem estudada no colo uterino. Observou-se que a neoplasia intra-epitelial cervical grau III apresenta maior número de vasos quando comparada às lesões de baixo grau. No carcinoma de colo nos estádios clínicos IB e IIA, operados, há maior número de vasos quando os linfonodos pélvicos são positivos, o que se relaciona à menor sobrevida. Entre as neoplasias do ovário, Hollingsworth et al. citam que os tumores com densidade vascular mais alta apresentam maior risco para recidivas. Assim como a maioria dos artigos da literatura, ou seja, associando o marcador CD34 a prognóstico e não a diagnóstico, que é o caso do presente estudo, no qual o marcador tumoral é analisado como fator diagnóstico.
A maioria dos estudos a respeito da angiogênese utiliza, como marcador vascular imunohistoquímico, o fator VIII (fator de von Willebrand). Porém, Ramani et al., com esse marcador, notaram que o fundo estromal era intensamente corado, impossibilitando a avaliação correta da formação vascular. Ramani et al. e Sankey et al. valeram-se de um novo anticorpo monoclonal para endotélio, o anti-CD34, que pode ser usado em tecidos fixados em formalina e parafinados rotineiramente. O antígeno CD34 é encontrado nas células progenitoras hematopoéticas e na membrana citoplasmática de células endoteliais, sendo assim bom marcador vascular. As células endoteliais, quando tratadas pelo anti-CD34, são coradas na cor castanha. Neste estudo foi utilizado o anticorpo anti-CD34 para avaliar a angiogênese e observado que a sua caracterização é possível, pela coloração do vaso sangüíneo, distinguindo-o de todos os demais elementos estromais.
Ali-Fehmi et al. estudaram 118 pacientes com carcinoma seroso de ovário em alto grau e estágio avançado (III e IV), com o objetivo de examinar a expressão da ciclooxigenase, a proliferação do tumor, a apoptose e a angiogênese, através da ciclooxigenase-2, Ki-67, fator de crescimento vascular endotelial, Bcl-2 e CD34. Concluíram que a expressão da ciclooxigenase-2 correlaciona-se com a proliferação e angiogênese do tumor, mas não com os marcadores apoptóticos no carcinoma seroso ovariano em estágio avançado. No presente estudo o tumor ovariano teve sua angiogênese avaliada pelo marcador tumoral CD34.
5.5. A IMUNOHISTOQUÍMICA
As publicações científicas com aplicações da imunohistoquímica em patologia cirúrgica aumentaram significativamente desde a sua introdução, no início da década de 70. Fato este que apenas reflete a posição que a imunohistoquímica hoje ocupa em um laboratório de patologia cirúrgica, ou seja, a de técnica complementar na resolução de certos diagnósticos diferenciais de lâminas com a coloração de HE.
Os patologistas australianos, Leong e Wright, escreveram o primeiro artigo que avalia a contribuição da imunohistoquímica na área de diagnóstico de tumores. Dos 958 tumores da rotina cirúrgica que necessitaram de imuno-histoquímica no Instituto de Ciências Médicas e Veterinárias na cidade de Adelaide, em 1987, os autores escolheram 200 casos consecutivos e classificaram-nos em uma de cinco categorias: 1) a imunohistoquímica confirmou o diagnóstico suspeito nas lâminas coradas em HE; 2) a imunohistoquímica contribuiu para o diagnóstico definitivo a partir de uma lista de diagnósticos diferenciais; 3) a imunohistoquímica contribuiu por excluir algum diagnóstico diferencial; 4) a imunohistoquímica não foi de auxílio nenhum para o diagnóstico; e 5) a imunohistoquímica rendeu um diagnóstico não suspeitado previamente. Segundo os autores, a imunohistoquímica foi particularmente de grande auxílio nos diagnósticos diferenciais entre linfoma anaplásico e carcinoma, e na identificação de melanoma amelanótico; além disso, a escolha de um painel de anticorpos baseado nos diagnósticos presumidos nas lâminas coradas em HE é de grande ajuda para a diferenciação de tumores de células anaplásicas e fusiformes, bem como no presente estudo onde a imunohistoquímica contribuiu na confirmação diagnóstica, apesar do tecido estudado ter sido o ovário.
5.6 A ESCOLHA DOS MARCADORES
A fase de escolha dos anticorpos a serem testados, após a análise da lâmina corada em HE, é tão importante quanto o cuidado técnico necessário para que as reações imunohistoquímicas sejam de qualidade e possam ser interpretadas de maneira correta pelo patologista.
Vários autores concordam que não é a qualidade das reações, mas a escolha dos anticorpos, a interpretação das colorações e a integração dos resultados imunohistoquímicos ao diagnóstico suspeitado nas lâminas coradas em HE que são importantes para a formulação de um diagnóstico final pertinente. O que coincide com este trabalho, uma vez que os marcadores escolhidos, o Ki-67 e o CD34, estão direcionados para a imunohistoquímica.
6 CONCLUSÕES
a) Houve correlação do marcador Ki-67 nos tumores malignos de ovário em relação ao índice de marcagem e não houve correlação do marcador Ki-67 nos tumores malignos de ovário em relação à densidade óptica.
b) Houve correlação do marcador CD34 nos tumores malignos de ovário em relação ao índice de marcagem e não houve correlação do marcador CD34 nos tumores malignos de ovário em relação à densidade óptica.
c) A capacidade de leitura dos marcadores tumorais Ki-67 e CD34 não se alterou em relação ao tempo de armazenamento dos blocos de parafina com os quais foram confeccionadas as lâminas utilizadas no presente estudo.
REFERÊNCIAS
ABU-QARE, A.W.; ABOU-DONIA, M.B. Biomarkers of apoptosis: release of cytochrome c, activation of caspase-3, induction of 8-hydroxy-2´-deoxyguanosine, increased 3-nitrotyrosine, and alteration of p53 gene. J. Toxicol. Environ Health B. Crit. Rev. Jul-Sep; 4(3):313-32, 2001.
ALI-FEHMI R., MORRIS R. T., BANDYOPADHYAY S., CHE M., SCHIMP V., MALONE J. M. Jr e MUNKARAH A. R. Expression of cyclooxygenase-2 in advanced stage ovarian serous carcinoma: correlation with tumor cell proliferation, apoptosis, angiogenesis, and survival. Am J Obstet Gynecol., n.192, Mar, p.819-25. 2005.
ARIYOSHI K, KAWAUCHI S, KAKU T, NAKANO H e TSUNEYOSHI M. Prognostic factors in ovarian carcinosarcoma: a clinicopathological and immunohistochemical analysis of 23 cases. Histopathology, n.37, Nov, p.427-36. 2000.
BARNHILL R. L., FANDRAY K., LEVY M.A., MIHM M. C. JR, HYMAN B. Angiogenesis and tumor progression of melanoma. Qualification of vacularity in melanocytic nevi and cutaneus malignant melanoma. Lab Invest, n.67, Sep., p.331-7. 1992.
BEREK J. S., BEREK R. C. JR. Ovarian cancer screening. The uso of serial complementary tumor markers to improve sensitivity and specificity for early detection. Cancer, n.15, v. 76, Nov, p.2092-6. 1995.
BRASIL. MINISTERIO DA SAUDE. SECRETARIA NACIONAL DE ASSISTENCIA A SAUDE. INSTITUTO NACIONAL DE CÂNCER. Estimativa da Incidência e Mortalidade por Câncer no Brasil. 2006. Rio de Janeiro: INCA, 2006.
BROWN, D.C.; GATTER, K.C. Monoclonal antibody Ki-67: its use in histopathology. Histopathology. Dec. 17(6):489-503, 1990.
CHARPIN C., ANDRAC L., HABIB M. C., DE VICTOR B., LAVAUT M. N., e TOGA M. Multiparametric Study (SAMBA 200) of Estrogen Receptor Immunocytochemical Assay in 400 Human Breast Carcinomas: Analysis of Estrogen Receptor Distribution Heterogeneity in Tissues and Correlations with Dextran Coated Charcoal Assays and Morphological Data. Cancer Reaserchnt, n.48, Mar, p.1578-86. 1988.
CHARPIN C., ANDRAC L., LAVAUT M. N., ANDONIAN C., FRATERNO M., PEREZ CASTILHO M. , BONNIER P. e PIANA L.Image cytometry of aneuploidy, growth fraction (MoAb Ki-67) and hormone receptors (ER, PR) immunocytochemical assays in breast carcinomas. Anal Cell Pathol., n.2, v. 6, Oct, p.357-71. 1990.
CHARPIN C., HABIB M. C. , PIANA L., RAMPAL M., ANDRAC L., VANCHERETH., MARTINI P., PEREZ-CASTILLO M., LAVAUT M. N. e TOGA M. [Growth fraction (Ki-67), ploidy balance and proliferation index in tumours of the urogenital tract and breast]. Ann Pathol.., n.9, p.331-9. 1989.
CZEKIERDOWSKI A., SZYMANSKI M., SZUMILO J. e KOTARSKI J. Color Doppler blood flow measurements and microvessel density assessment in ovarian tumors. Gynekol Pol, n.74, Sep, p.695-700. 2003.
COSTA M. J. e GUINEE D. Jr. CD34 immunohistochemistry in female genital tract carcinosarcoma (malignat mixed mullerian tumors) supports a dominant role of the carcinomatous component. Appl Immunohistochem Mol Morphol., n.8, Dec, p.293-9. 2000.
COSTA M. J., WALLS J., AMES P. e ROTH L. M. Transformation in recurrent ovarian granulosa cel tumors: Ki-67 (MIB-1) and p53 immunohistochemistry demonstrates a possible molecular basis molecular basis for the poor histopathologic prediction of clinical behavior. Hum Pathol., n.27, Mar, p.274-81. 1996.
DARAI E., WALKER-COMBROUZE F., DAUGE-GEOFFROY M. C., VINCENT Y., FELDMANN G., MADELENAT P. e SCOAZEC J.Y. Ki-67 expression in 35 borderline ovarian tumors: relations with clinicopathologic parameters ploidy. Eur J Obstet Gynecol Reprod Biol., n.76, Fev, p.175-80. 1998.
DIEBOLD J, SUCHY B, BARETTON GB, BLASENBREU S, MEIER W, SCHMIDT M, RABES H, LOHRS U. DNA ploidy and MYC DNA amplification in ovarian carcinomas. Correlation with p53 and bcl-2 expression, proliferative activity and prognosis. Virchows Arch., n.429, Nov, p.221-7. 1996.
FEITH M., STEIN H. J., MUELLER J. e SIEWERT J. R. Malignant degeneration of Barrett’s esophagus: the role of the Ki-67 proliferation fraction, expression of E-cadherin and p53. Diseases of the Esophagus, n.4, v. 17, Dec, p.322. 2004.
FRUTUOSO C., SILVA M.R., AMARAL N., MARTINS I., De OLIVEIRA C. e De OLIVEIRA H. M. Prognosis value of p53, C-erB-2 and Ki-67 proteins in ovarian carcinoma. Acta Med Port., n.14, may-Jun, p.277-83. 2001.
GADDUCCI A, FERDEGHINI M, PRONTERA C, MORETTI L, MARIANI G, BIANCHI R, FIORETTI P. The concomitant determination of different tumor markers in patients with epithelial ovarian cancer and benign ovarian masses: relevance for differential diagnosis. Gynecol Oncol, n.44, Feb, p.147-54. 1992.
GARZETTI G. G., CIAVATTINI A., GOTERI G., NICTOLIS M., STRAMAZZOTTI D., LUCARINI G. e BIAGINI G. Ki-67 antigen immunostaining (MIB 1 monoclonal antibody) in serous ovarian tumors: index of proliferative activity with prognostic significance. Gyneco Oncol., n.56, Feb, p.169-74. 1995.
GERDES J., LI L., SCHLUETER C., DUCHROW M., WOHLENBERG C., GERLACH C., STAHMER I., KLOTH S., BRANDT E . FLAD H.D. Immunobiochemical and molecular biologic characterization of the cell proliferation-associated nuclear antigen that is defined by monoclonal antibody Ki-67. American Journal of Pathology, v.138, n.4, p.867-873. 1991.
GODDARD J.C., SUTTON C. D., FURNESS P.N. , KOCKELBERGH R. C. e O’BYRNE K. J. A computer image analysis system for microvessel density measurement in solid tumours. Angiogenesis, n.1-2, v. 5, Mar, p.15-20. 2002.
HALILA H., STENMAN U. H., SEPPALA M. Ovarian cancer antigen CA 125 levels in pelvic inflammatory disease and pregnancy. Cancer, n.57, Apr, p.1327-9. 1986.
HEINBURG S., OEHLER M. K., KRISTEN P., PAPADOULOS T. e CAFFIER H. The endothelial marker CD34 in the assessment of tumour vascularisation in ovarian cancer. Anticancer Res., n.17, Jul-Aug, p.3149-51; 1997.
HEINBURG S., OEHLER M. K., PAPADOULOS T., CAFFIER H e KRISTEN P. Prognostic relevance of the endothelial marker CD34 in ovarian cancer. Anticancer Res., n.19, Jul-Aug, p.2527-9. 1999.
HENRIKSEN R, STRANG P, BACKSTROM T, WILANDER E, TRIBUKAIT B e OBERG K. Ki-67 immunostaining and DNA flow cytometry as prognostic factors in epithelial ovarian cancers. Anticancer Res., n.14, Mar-Apr, p.603-8. 1994.
HOLLINGSWORTH H.C., KOHN E.C., STEINBERG S.M., ROTHENBERG M.L., MERINO M.J. Tumor angiogenesis in advanced stage ovarian carcinoma . American Journal of Pathology, v.147, p.33-41. 1995.
HORAK E.R., HARRIS A.L., STUART N., BICKNELL R. Angiogenesis in breast cancer. Regulation, prognostic aspects, and implications for novel treatment strategies. Ann NY Acad Sci, n.698, Nov, p.71-84. 1993.
HORNUNG, URS, SERENELLA, EDWARD, URSULA, URS e DANIEL. Analysis of potencial prognostic factors in 111 patients with ovarian cancer. Cancer Letters, v.206, p.97-106; 2004.
HUETTNER P. C., WEINBERG D.S. e LAGE J.M. Assessment of proliferative actiity in ovarian neoplasms by flow and static cytometry. Correlation with prognostic features. American Journal of Pathology, v.141, p.699-706. 1992.
INGEHOLM P., PEDERSEN L. e HOLCK S. Quantification of microvessel density of breast carcinoma: an assessment of the inter- and intraobserver variation. Breast., n.8, Oct, p.251-6. 1999.
ISOLA J., KALLIONIEMI O.P., KORTE J.M., WAHLSTROM T., AINE R., HELLE M. e HELIN H. Steroid receptors and Ki-67 reactivity in ovarian cancer and in normal ovary: correlation with DNA flow citometry, biochemical receptor assay, and patient survival J Pathol, n.162, Dec, p.295-301. 1990.
JACOBS I. J., SKATES S., DAVIES A. P., WOOLAS R. P., JEYERAJAH A., PRU WEIDEMANN, SIBLEY K., ORAM D. H. Risk of diagnosis of ovarian cancer after raised serum CA 125 concentration: a prospective cohort study. BMJ, n.313, Nov, p.1355-58. 1996.
JEMAL A., TIWARI R. C., MURRAY T., GHAFORR A., SAMUELS A., WARD E., FEUER E. J. e THUN M. J. Cancer Statistics. Cancer J Clin, n.54, p.8-29. 2004.
KARABURUM S., KARAVELI S., PESTERELI H.E., SIMSEK T. e SARGIN C. F. Proliferating cell nuclear antigen (PCNA) and Ki-67 in epithelial ovarian tumors: correlation with DNA flow cytometric analysis. Adv Clin Path., n.5, Jan, p.3-9. 2001.
KHALIFEH I., MUNKARAH A. R., LONARDO F., MALONE J. M., MORRIS R., LAWRENCE W. D. e ALI-FEHMI R. Expression of Cox-2, CD34, Bcl-2, and p53 and survival in patients with primary peritoneal serous carcinoma and primary ovarian serous carcinoma. Int J Gynecol Pathol., n.23, Apr, p.162-9. 2004.
KILUK J. e CARTER W. B. Makers of angiogenesis in breast cancer. MLO Med Lab Obs., n.38, v. 10, Aug, p.18-9. 2006.
LEONARDI E., GIRLANDO S., SERIO G., MAURI F.A., PERRONE G., SCAMPINI S., DALLA PALMA P. e BARBARESCHI M. PCNA and Ki67 expression in breast carcinoma: correlations with clinical and biological variables. J Clin Pathol., n.45, May, p.416-19. 1992.
LEONG A.S. E WRIGHT J.. THE CONTRIBUTION OF IMMUNOHISTOCHEMICAL STAINING IN TUMOUR DIAGNOSIS. HISTOPATHOLOGY, N.11, DEC, P.1295-305. 1987.
LIMA, G. R., GONÇALVES, W. J., e BARACAT, E. C. Carcinoma do ovário. Ginecologia de Consultório, 1ª Ed. EPM – editora de projetos médicos, p.285-296. 2003.
MAZUREK, A., NIKLINSKI, J., LAUDANSKI, T., PLUYGERS, E. Clinical tumour markers in ovarian cancer. Eur. J. Cancer Prev., v.7, n.1, p. 23-35. 1998.
PRADAL, M., MENEZES, A. M., DI DIO, R. e BARBÉRIO, J. C. Marcadores Tumorais – Breve Revisão. RSBC – Ver. da Soc. Bras. de Cancerologia, ano II, nº5, p. 20-29. 1º trim 1999.
ROHLKE, P., MILDE-LANGOSCH, K., WEYLAND, C., PICHMEIER, U., JONAT, W., LONING, T. p53 is a persistent and predictive marker in advanced ovarian carcinomas: multivariate analysis including comparison with Ki67 immunorcactivity. J. Cancer Res. Clin. Oncol., v.123, n.9, p. 496-501. 1997.
SCHOLZEU, T., GERDES, J. The Ki67 protein: from the known and unknwon. J. Cell. Physiol., v.182, n.3, p. 311-22. 2000.
SOUZA, J. H. K., KALIL, I. V., FARIA, G, A, C. Neoplasias Benígnas e malígnas do ovário e das trompas. Ginecologia e Obstetrícia, 3ª Ed. Editora Medsi, p.322-330. 2003.
TANOGUCHI, K., SASANO, H., YABUKI, N., KIKUCHI, A., ITO, K., SATO, S., YAJIMA, A. Immunohistochemical and two-parameter flow cytometric studies of DNA topoisomerase II alpha in human epithelial ovarian carcinoma and germ cell tumor. Mod. Pathol., v.11, n.2, p. 186-93. 1998.
ZORZOU, M.P., MARKAKI, S., RODOLAKIS, A., KASTRITES, E., BOZAS, G., DIMOPOULOS, M.A., PAPADIMITRIOU, C.A. Clinicopathological features of ovarian carcinosarcomas: a single instituition experience.. Gynecol Oncol. Jan., p. 136-42, 2005
APÊNDICES
APÊNDICE 1
APÊNDICE 2
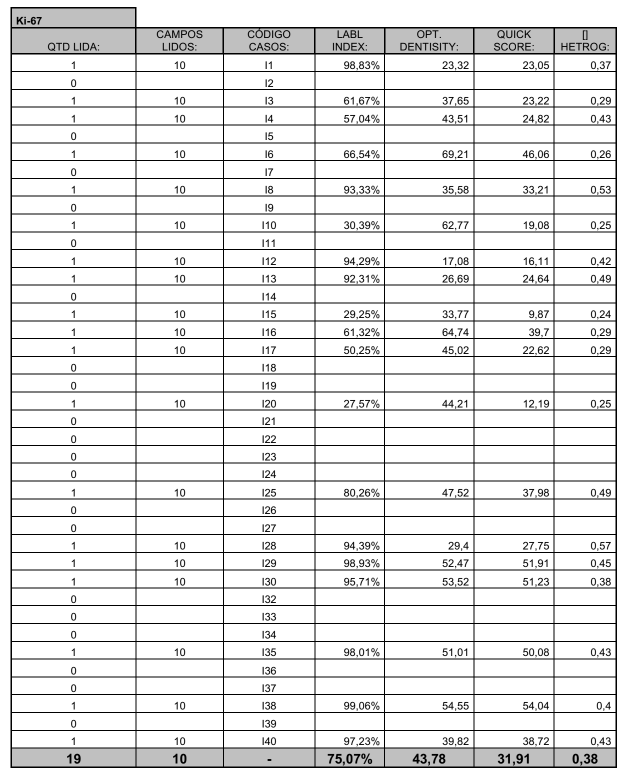
APÊNDICE 3