REGISTRO DOI: 10.5281/zenodo.10113502
Lorena Cunha Silva
Lucas Yuri Batista De Lira
Matheus Henrique De Medeiros Lessa
Celina Aparecida Bertoni Lugtenburg
RESUMO
O rim em suas funções normais realiza a filtragem do sangue, retirando as excretas e produzindo hormônios e urina. Entretanto, em alguns casos, pode haver prejuízos na função renal que, eventualmente, levam à morte sem o devido tratamento, sendo o transplante renal um dos principais métodos terapêuticos adotados. Este último, evoluiu com o passar dos anos, marcado por avanços científicos, sendo responsável por estabelecer uma melhor qualidade de vida para o os pacientes. No entanto, ainda é verificada uma sobrevida limitada do enxerto renal, provocando o retorno do receptor à hemodiálise ou levando ao óbito, sendo as causas mais comuns a rejeição crônica ou aguda, a reincidência da doença subjacente, e a morte dos rins funcionantes. Esta pesquisa objetivou mensurar quais são os fatores de risco determinantes para a perda do enxerto e a mortalidade dos receptores após o transplante. Foi realizada busca entre os meses de março e abril de 2022, em plataformas online, como: Public Medical Literature Analysis and Retrieval System Online (PubMed), Biblioteca Virtual da Saúde (BVS) e Scientific Eletronic Library Online (Scielo), de artigos entre os anos de 2016 e 2022, com as palavras-chave “Kidney Transplantation”, “Allograft”, “Graft Rejection”. Selecionou-se dez artigos enquadrados nos critérios da busca. Diante disso, constatou-se que existem duas categorias distintas de fatores que levam à rejeição do enxerto renal, as causas imunológicas, que envolvem a resposta de linfócitos T e de células B produtoras de aloanticorpos, além das causas não imunológicas, a exemplo da hipertensão arterial, diabetes de novo início e determinados hábitos de vida do receptor após o transplante. Portanto, contemplou-se durante a pesquisa que a utilização adequada de medicamentos imunossupressores, aliados a uma mudança no estilo de vida e adoção de hábitos mais saudáveis impactam positivamente na qualidade e sobrevida do enxerto renal.
Palavras-Chaves: TRANSPLANTE RENAL; REJEIÇÃO DO ENXERTO; PERDA DO ALOENXERTO.
ABSTRACT
The kidney, in its normal functions, filters the blood, removing excreta and producing hormones and urine. However, in some cases, there may be damage to kidney function that eventually leads to death without proper treatment, with kidney transplantation being one of the main therapeutic methods adopted. The latter has evolved over the years, marked by scientific advances, and is responsible for establishing a better quality of life for patients. However, limited renal graft survival is still observed, causing the recipient to return to hemodialysis or leading to death, with the most common causes being chronic or acute rejection, recurrence of the underlying disease, and death of functioning kidneys. This research aimed to measure the determining risk factors for graft loss and recipient mortality after transplantation. A search was carried out between the months of March and April 2022, on online platforms, such as: Public Medical Literature Analysis and Retrieval System Online (PubMed), Virtual Health Library (VHL) and Scientific Electronic Library Online (Scielo), for articles between the years 2016 and 2022, with the keywords “Kidney Transplantation”, “Allograft”, “Graft Rejection”. Ten articles that fit the search criteria were selected. Therefore, it was found that there are two distinct categories of factors that lead to kidney graft rejection: immunological causes, which involve the response of T lymphocytes and B cells that produce alloantibodies, in addition to non-immunological causes, such as hypertension. blood pressure, new-onset diabetes and certain lifestyle habits of the recipient after transplantation. Therefore, it was considered during the research that the appropriate use of immunosuppressive medications, combined with a change in lifestyle and the adoption of healthier habits have a positive impact on the quality and survival of the kidney graft.
Keywords: KIDNEY TRANSPLANT; CHRONIC KIDNEY DISEASE; ALLOGRAFT LOSS
1 INTRODUÇÃO
O rim em suas funções normais realiza a filtragem do sangue, retirando as excretas e produzindo hormônios e urina, a qual é drenada para a bexiga pelos ureteres, onde é armazenada. No entanto, em alguns casos, nos quais doenças renais em estágio mais avançado, como a insuficiência renal crônica (IRC), podem incapacitar a função renal e eventualmente levar à morte sem o devido tratamento, recursos terapêuticos mais incisivos como a diálise (utilização de uma máquina que exerce a função fisiológica dos rins) e o transplante renal (TR) devem ser abordados (SAWINSKI; POGGIO, 2021).
Este último, desde sua descoberta como tratamento, no ano de 1954 na cidade de Boston (EUA), evoluiu com o passar dos anos, marcado por avanços científicos, como no caso da descoberta do sistema HLA (Antígeno Leucocitário Humano), o qual apresenta antígenos às células do sistema imune, além de avanços clínicos, a exemplo do uso de imunossupressores, sendo reconhecido, atualmente, como o método terapêutico mais eficaz de tratamento da doença renal crônica (DRC), responsável por restabelecer uma melhor qualidade de vida para os pacientes, bem como aumentar as taxas de sobrevivência (TIMSIT; KLEINCLAUSS; THURET, 2016).
No entanto, apesar do avanço do TR em várias etapas, ainda é verificado uma sobrevida limitada do enxerto renal, provocando o retorno do receptor à hemodiálise ou levando este a óbito. Dentre as causas mais comuns da perda precoce do enxerto constata-se a rejeição crônica, aguda, reincidência da doença subjacente, e a morte com os rins funcionantes. Tratando-se das causas predominantes nos casos de óbitos de transplantados renais, em nível nacional, são notáveis a infecção, a doença cardiovascular e a neoplasia (REQUIÃO-MOURA et al., 2021).
Desse modo, este trabalho busca compreender as formas com que determinados fatores afetam o funcionamento adequado e a durabilidade do enxerto, assim como analisar suas relações com os casos de óbitos, discutindo, a partir disso, os impactos para a sociedade. Tal olhar analítico irá propiciar uma melhor visão sobre o panorama atual das complicações pós-transplante renal, fornecendo informações que possam incentivar o desenvolvimento de políticas públicas voltadas ao aperfeiçoamento do transplante como um todo, desde a doação até a análise clínica da perda do enxerto e dos óbitos.
2 REFERENCIAL TEÓRICO
2.1 O RIM: ANATOMIA E FISIOLOGIA
Os rins são órgãos vitais e complexos, os quais têm o objetivo de contribuir para a manutenção das funções normais do corpo. A contribuição destes para o funcionamento do organismo baseia-se primariamente na regulação do equilíbrio de fluidos, eletrólitos e ácido-base do corpo, com o intuito de estabelecer um ambiente estável ao metabolismo dos tecidos e das células. Desta forma, além da função primária de filtração de resíduos e conservação de solutos essenciais, o rim também contribui para a eritropoiese, regulação da pressão arterial, equilíbrio de cálcio e fosfato e metabolização da vitamina D (MELTZER, 2019).
O rim de um adulto normal localiza-se retroperitonealmente entre o nível da vértebra T12 e L3 (figura 1). O rim direito encontra-se ligeiramente mais baixo que o esquerdo, em razão de se posicionar abaixo do fígado. Os elementos funcionais dos rins baseiam-se em um córtex externo e uma medula interna, os quais são envolvidos por uma cápsula fibrosa. Em relação à medula, esta é dividida em uma série de 8 a 18 pirâmides renais, que se abrem nos cálices renais, sendo que estes últimos unem-se para formar a pelve renal. As colunas renais se estendem do córtex para baixo, entre as pirâmides renais. Os néfrons (figura 2) são as unidades básicas dos rins; com cerca de 1,2 milhão de néfrons compondo cada rim e formando a urina. Cada néfron é composto por cápsula de Bowman, túbulo contorcido proximal, alça de Henle e túbulo contorcido distal, desembocando nos ductos coletores (MELTZER, 2019).
Figura 1: Anatomia renal.
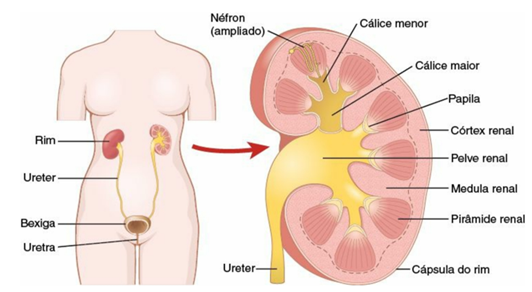
Fonte: GUYTON, A.C. e Hall J.E.- Tratado de Fisiologia Médica. Editora Elsevier. 13ª ed., 2017
Figura 2 : Néfron.
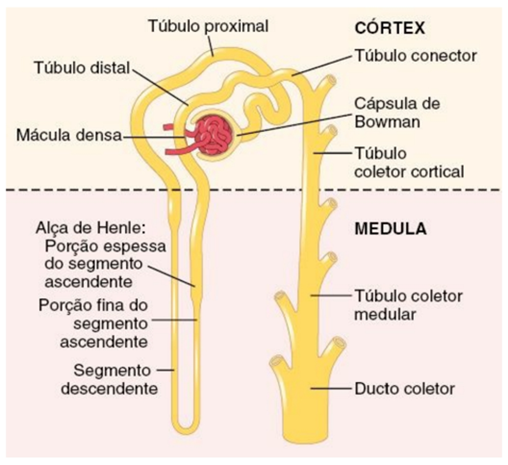
Fonte: GUYTON, A.C. e Hall J.E.- Tratado de Fisiologia Médica. Editora Elsevier. 13ª ed., 2017
2.2 TRANSPLANTE RENAL
O transplante de rim é uma operação cirúrgica, na qual há a transferência de um rim de um indivíduo para outro, com o intuito de substituir a perda da função renal original do receptor, segundo Sawinski e Poggio (2021). Nesse sentido, acrescenta que antes do transplante renal, os receptores apresentam um quadro de insuficiência renal crônica, a qual é provocada por inúmeras doenças, como a hipertensão arterial, diabetes, malformações do aparelho urinário e infecções urinárias de repetição.
Diante disso, Anand et al. (2017) destaca que o transplante renal é a melhor solução para os indivíduos com insuficiência renal crônica, pois em comparação com a diálise, o transplante renal tem a capacidade de substituir completamente as funções renais.
Segundo Augustine (2018), existem três tipos de doadores (figura 3), o doador vivo relacionado, sendo este um parente; o vivo não-relacionado, sendo aquele indivíduo sem nenhum grau de parentesco com o receptor; e por fim, o doador cadáver (morte encefálica e morte circulatória), o qual é mantido vivo por máquinas. Ademais, os transplantes renais podem apresentar consequentes complicações cirúrgicas e clínicas, sendo nesta última inclusa as rejeições imunológicas, infecções, distúrbios metabólicos e a ausência da função inicial do enxerto.
Figura 3: Tipos de doadores no transplante renal.
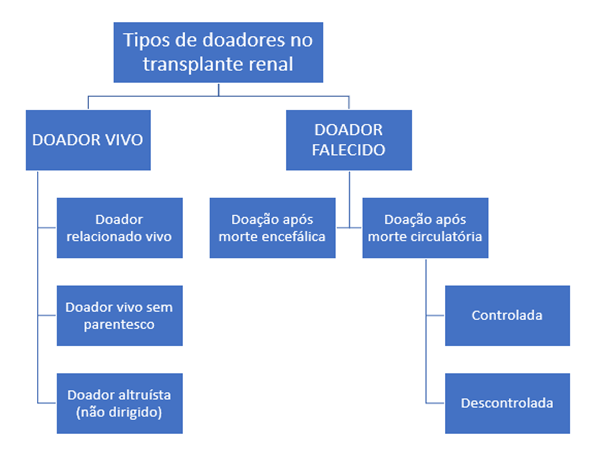
Fonte: PRÓPRIO AUTOR.
2.3 TIPOS DE ENXERTO
2.3.1 AUTÓLOGO
Também conhecido como auto-enxerto, ocorre quando um enxerto tecidual é transplantado de um indivíduo para si mesmo, onde não ocorrem reações de rejeição. Os principais exemplos deste tipo de enxerto são os enxertos de pele e a ponte de safena (ABBAS, 2019).
2.3.2 SINGÊNICO
É o enxerto transplantado entre dois indivíduos idênticos geneticamente, a exemplo de irmãos gêmeos univitelinos, não havendo desenvolvimento de resposta imunológica característica de rejeição (ABBAS, 2019).
2.3.3 XENOGÊNICO OU XENOENXERTO
Caracteriza-se pelo enxerto transplantado entre indivíduos de espécies diferentes, marcado por forte reação imunológica de rejeição. As moléculas antigênicas são conhecidas como xenoantígenos e os anticorpos reagentes são descritos como xenorreativos. Um exemplo a ser citado é a utilização de enxerto ósseo bovino para auxiliar o remodelamento de defeitos ósseos em procedimentos reconstrutivos do seio maxilar da face (LOYOLA, 2018).
2.3.4 ALOGÊNICO OU ALOENXERTO
O aloenxerto é caracterizado pelo transplante de um determinado tecido entre indivíduos que são geneticamente diferentes, porém da mesma espécie, no qual as moléculas reconhecidas como estranhas são conhecidas como aloantígenos e os anticorpos e células reagentes são alorreativos. O receptor do enxerto possui a capacidade de reconhecer as células do doador, executando uma resposta contra elas, por meio do complexo principal de histocompatibilidade (MHC) (ABBAS, 2019).
Nesse sentido, o enxerto alogênico é o tipo de transplante clinicamente mais comum do mundo, sendo o transplante renal, o mais realizado; bem como que também há rejeição diante do transplante com esse tipo de enxerto, havendo necessidade, portanto, de terapia de imunossupressão. O aloenxerto renal pode ser proveniente de doador vivo ou falecido, sendo este último, o mais praticado, tendo em vista uma maior durabilidade do tecido renal e uma menor sensibilidade à isquemia, em relação a outros órgãos (LORES, 2019).
2.4 DOENÇA RENAL CRÔNICA
A Doença Renal Crônica (DRC) consiste na lesão renal que leva à perda gradativa das funções glomerular e endócrina renais, o que, em sua fase mais agravada, pode acarretar Insuficiência Renal Crônica (IRC), na qual os rins perdem a sua capacidade de filtração e de manter a homeostase, fazendo-se necessária a realização de terapias renais substitutivas (TRS), a exemplo da diálise e do transplante renal. As principais causas de DRC são o diabetes mellitus e a hipertensão arterial, bem como a predisposição familiar, sendo que os dois primeiros foram identificados em 30% e 35%, respectivamente, do total de pacientes dialíticos no Brasil, no ano de 2013, segundo a Sociedade Brasileira de Nefrologia (PORTO, 2017).
A DRC é classificada em seis estágios, com base na graduação da função renal do paciente, sendo que o primeiro estágio indica função renal normal, sem lesões, e a última, indica fase terminal de IRC (MURTON, 2021).
Figura 4: Estágios de classificação da Doença Renal Crônica, de acordo com o grau de função renal.
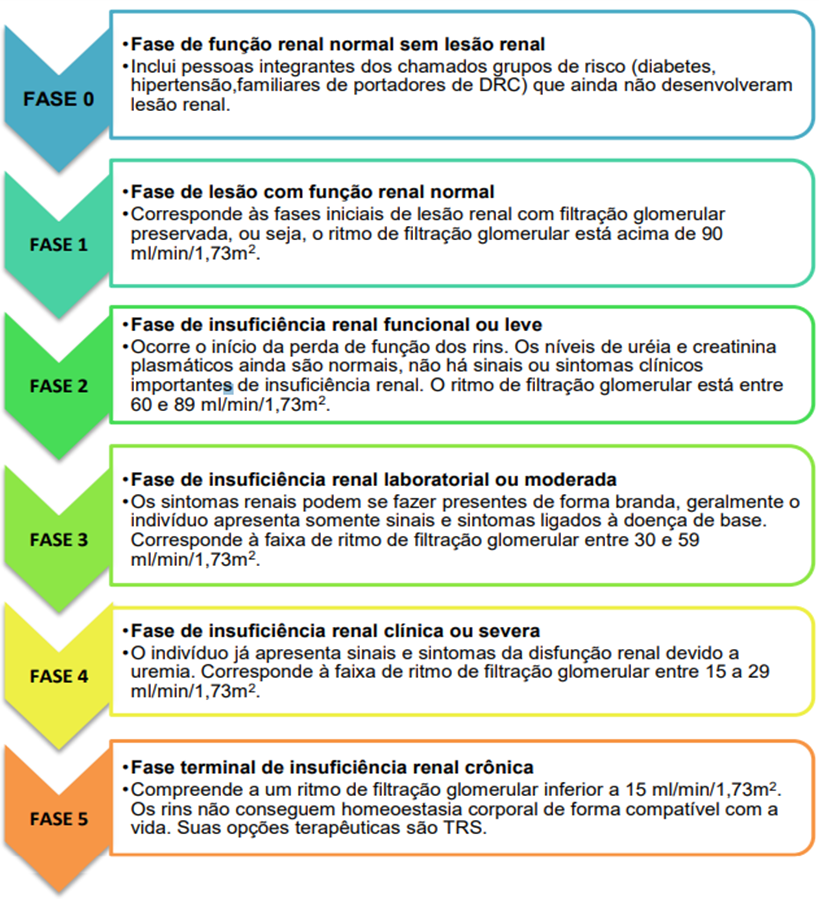
Fonte: Próprio autor.
“A doença renal crônica é um fardo de saúde global com alto custo econômico para a saúde e é um fator de risco independente para doenças cardiovasculares. Todas as etapas da DRC estão associadas ao risco aumentado de morbidade cardiovascular e diminuição da qualidade de vida.” (HILL et al., 2016).
2.5 REJEIÇÃO
2.5.1 HIPERAGUDA
Esta forma de rejeição ocorre em minutos ou horas depois do transplante. Um rim rejeitado de maneira hiperaguda rapidamente se torna cianótico, pintalgado e flácido, podendo excretar meras gotas de urina com sangue. Os neutrófilos rapidamente se acumulam no interior das arteríolas, glomérulos e capilares peritubulares. À medida que estas alterações se tornam difusas e intensas, os glomérulos sofrem oclusão trombótica dos capilares e ocorre necrose fibrinoide nas paredes arteriais. O córtex renal sofre então necrose clara (infarto), e tais rins não funcionantes têm que ser removidos (ROBBINS & COTRAN, 2021)
2.5.2 AGUDA
A rejeição aguda é um importante fator para a perda de enxerto, que envolve mecanismo celular e humoral. Quanto maior for a diferença imunohistoquímica entre doador e receptor, maior será a rejeição imunológica contra o órgão transplantado. No entanto, a rejeição não significa necessariamente a perda de enxerto, até certo ponto o enxerto pode ser recuperado, porém em caso de várias rejeições conseguintes ocorre a perda do órgão.
De acordo com Vugt e Schagen (2022), A rejeição do transplante renal continua sendo um problema clínico importante, apesar do desenvolvimento de terapia imunossupressora eficaz. Dois tipos principais de rejeição são reconhecidos, a rejeição mediada por células T (TCMR) e a rejeição mediada por anticorpos (ABMR), que têm uma fisiopatologia diferente e são tratadas de forma diferente. Infelizmente, os resultados a longo prazo tanto do TCMR como do ABMR permanecem insatisfatórios, apesar da terapia atual.
2.5.3 CRÔNICA
Nos últimos anos, a rejeição aguda tem sido significativamente controlada pela terapia com imunossupressores, e a rejeição crônica emergiu como causa importante de falência do enxerto. A rejeição crônica é dominada por alterações vasculares, fibrose intersticial e atrofia tubular, com perda do parênquima renal. As alterações vasculares consistem em densa fibrose obliterativa da íntima, principalmente nas artérias corticais. Estas lesões vasculares resultam em isquemia renal, manifesta por perda glomerular, fibrose intersticial e atrofia tubular, além de encolhimento do parênquima renal (ROBBINS & COTRAN, 2021)
Segundo Lai e Zheng (2021) A rejeição crônica do transplante renal (TRC) é frequentemente silenciosa clinicamente, mas um processo imunológico alogênico progressivo que leva à lesão cumulativa do enxerto, deterioração da função do enxerto. Embora melhorias significativas tenham sido feitas em direção a uma melhor compreensão dos mecanismos celulares e moleculares e das classificações diagnósticas da DRCT, a falta de detecção precoce, diagnóstico diferencial e terapias eficazes continuam a representar grandes desafios para o manejo a longo prazo. O que contribui para que esta seja a principal causa de rejeição dos aloenxertos.
Figura 5: Classificação dos tipos de rejeição.

Fonte: Próprio autor
2.6 PERDA DO ENXERTO
A perda do enxerto está intimamente relacionada à rejeição do órgão ou tecido transplantado, pois ocorre quando há uma reação por parte do sistema imunológico do receptor aos antígenos do transplante, visto que, mesmo que exista uma alta compatibilidade entre os tecidos do doador e do receptor, geralmente ocorre rejeição, a menos que medidas para evitá-la sejam tomadas.
Sendo assim, segundo NICKERSON (2020) a rejeição mediada por anticorpos (ABMR) no transplante renal é uma das principais causas de perda tardia do enxerto e, apesar de todos os esforços até o momento, o “padrão de tratamento” continua sendo plasmaférese, IVIg e esteróides, que por si só é baseado em evidências de baixa qualidade.
Nesse sentido, segundo Foroutan et al. (2019), após a realização do transplante, o principal fator a ser levado em consideração é a maximização da longevidade do enxerto renal, pois a perda do mesmo acarretará retorno à diálise por parte do receptor, retransplante ou a morte.
Figura 6: Fatores associados à perda de enxerto em 1 ano.

Fonte: Próprio autor
3 JUSTIFICATIVA
A transplantação oferece melhor sobrevida a um número crescente de pacientes com doença renal terminal. Porém, os receptores podem enfrentar desafios únicos devido a uma maior carga de comorbidade, maior risco cumulativo de complicações relacionadas à imunossupressão e crescente fragilidade. (PINTER et al., 2016).
Dessa forma, é relevante o desenvolvimento de estudos como esse, com o intuito de fornecer informações relevantes para o aumento da sobrevida do enxerto e maior expectativa de vida dos transplantados.
Nessa perspectiva, é importante avaliar a eficácia das doações principalmente no pós-operatório. Além disso, intervenções multicomponentes que incorporam planejamento de cuidados personalizados, educação, apoio psicossocial, auxílio à decisão e ferramentas de automonitoramento podem melhorar os resultados do transplante (JAMIESON NJ et al., 2016).
4 OBJETIVOS
4.1 OBJETIVO GERAL
- Mensurar quais são os fatores de risco determinantes para a perda do enxerto e a mortalidade dos receptores após o transplante renal.
4.2 OBJETIVOS ESPECÍFICOS
- Discutir as informações e dados levantados de pesquisa bibliográfica sobre o assunto.
- Determinar quais são os principais fatores envolvidos com a falha do processo, seja antes ou após o transplante.
- Determinar medidas e soluções terapêuticas para os principais fatores.
5 METODOLOGIA
O estudo em questão se caracteriza como uma revisão sistemática, ou seja, um estudo secundário, no qual buscará elaborar uma revisão e análise crítica em torno dos fatores que estão relacionados com as falhas do aloenxerto, bem como com o óbito dos receptores que passaram por transplante renal. Esse método selecionado tem o intuito de agrupar e sintetizar resultados de estudos sobre um tema ou assunto delimitado.
Os meios para a realização de revisões sistemáticas possuem variações, no entanto, apresentam padrões que devem ser cumpridos. Neste estudo, serão utilizadas as seguintes etapas: elaboração da pergunta norteadora de pesquisa; busca na literatura; separação dos artigos; extração dos dados; síntese dos dados; qualificação das evidências; e publicação dos resultados.
A busca dos artigos se deu nas principais plataformas online, como: Public Medical Literature Analysis and Retrieval System Online (PubMed), Biblioteca Virtual da Saúde (BVS) e Scientific Eletronic Library Online (Scielo); entre os meses de março e abril de 2022, com as palavras-chave “Kidney Transplantation”, “Allograft”, “Graft Rejection” e “Death”.
Os critérios de inclusão estabelecidos foram: artigos originais disponibilizados no formato eletrônico, publicados no idioma inglês e português; do tipo ensaio clínico, estudo observacional e ensaio clínico randomizado; entre os anos 2016 a 2022. Como critério de exclusão, foram delimitados teses, dissertações e artigos repetidos em diferentes bancos de dados.
A seleção dos artigos ocorrerá mediante leitura completa dos textos, a fim de selecioná-los conforme os critérios de inclusão e exclusão.
Na análise serão recolhidos dados referentes ao periódico (título, ano de publicação), aos autores e ao estudo (objetivo, vinculação acadêmica, referencial teórico, tipo de estudo, aspectos metodológicos, resultados e recomendações).
A interpretação dos dados foi fundamentada a partir da avaliação criteriosa dos artigos escolhidos. Nesse sentido, realizar-se-á uma comparação com o conhecimento teórico, identificação de conclusões e implicações da revisão sistemática.
6 RESULTADOS
A seleção de artigos para esta pesquisa constituiu-se de sessenta e nove publicações que se enquadram nos critérios levantados anteriormente, das quais dez estão de acordo com o tema principal do trabalho e foram utilizadas como base da escrita deste artigo, sendo descritos na tabela a seguir, classificados por autor, tipo de estudo, objetivo da pesquisa e ano de publicação. Com base nos resultados encontrados nessas referências, discute-se a problemática levantada nesta pesquisa.
Tabela 1: Distribuição dos estudos.
AUTOR TIPO DE ESTUDO OBJETIVO ANO Graversen et al. Estudo de Coorte O objetivo deste estudo de base populacional de abrangência nacional foi determinar a incidência de pielonefrite e identificar fatores de risco para pielonefrite pós-transplante em receptores de TxR e controles populacionais, bem como determinar o impacto na sobrevida e mortalidade do enxerto em receptores de TxR. 2016 Devresse A et al. Revisão Narrativa Revisar o conhecimento atual sobre o tema, detalhar os PCCs disponíveis e discutir sua aplicação para candidatos/receptores de KT fumante. 2021 Conte et al. Revisão sistemática Fornecer uma visão geral das evidências disponíveis sobre o manejo e a prevenção do DMPT, com foco nas opções terapêuticas disponíveis 2018 Chakkera et al. Revisão Sistemática Descrever os efeitos farmacológicos dos ICN em diferentes tecidos e o impacto na regulação da glicose. 2017 Ponticelli et al. Revisão Sistemática Avaliar como os distúrbios lipídicos são frequentes após o transplante renal (KT) e receptores de KT são considerados de alto ou altíssimo risco cardiovascular. 2020 Park et al. Estudo caso-controle Investigar diferenças nas características patológicas e nos resultados do enxerto da rejeição após transplante renal. 2019 Lai et al. Revisão sistemática Fornecer atualizações e insights sobre o desenvolvimento mais recente de novos biomarcadores promissores para o diagnóstico e novas intervenções terapêuticas para prevenir e tratar a CKTR (rejeição crônica do transplante renal). 2021 Ponticelli; Citterio. Revisão sistemática Listar e discutir as causas não imunes mais importantes de falência tardia do enxerto renal censurada por morte. 2022 Ponticelli; Campise. Revisão narrativa Delinear o papel dos eventos inflamatórios na prevalência de evento cardiovasculares em receptores de transplantes renal, bem como no favorecimento da fibrose renal. 2021 Tantisattamo et al. Revisão sistemática Explicar a patogênese da hipertensão pós-transplante, bem como as diferentes opções de manejo de acordo com a etiologia da hipertensão em diferentes cenários clínicos de receptores de transplante. 2020
Fonte: próprio autor.
7 DISCUSSÃO DOS RESULTADOS
Observou-se, por meio da pesquisa realizada e dos dez artigos selecionados, que os principais mecanismos responsáveis por ocasionar a rejeição crônica do enxerto renal (CKTR) envolvem fatores não imunológicos e fatores imunológicos, dentre os quais se destacam a rejeição crônica ativa mediada por anticorpos (ABMR) e a rejeição crônica mediada por células T (TCMR), que podem ou não coexistir e levarem à uma perda rápida e progressiva da função do enxerto. Estes mecanismos têm como base de sua patogênese a presença de aloanticorpos contra antígenos HLA específicos do doador, presentes, principalmente no endotélio microvascular, o que promove uma cascata de eventos que envolvem a resposta imune, produção e liberação de citocinas e ativação do sistema complemento, o que resulta em lesão endotelial, inflamação vascular e alteração morfológica irreversível da estrutura celular. A persistência dessas lesões provocadas pela ação dos anticorpos e células T levam à disfunções do aparelho renal, como tubulites e glomerulopatias, que, eventualmente, geram falência do enxerto (PARK, et al., 2019).
Dessa forma, o diagnóstico precoce da CKTR é fator determinante na conduta terapêutica inicial. Logo, os pacientes que passaram por um transplante renal devem ser submetidos periodicamente a exames laboratoriais que avaliem os parâmetros de função renal, sendo estes a creatinina sérica (sCr), a dosagem de cistatina C e de nitrogênio ureico no sangue (BUN), além de proteinúria e taxa de filtração glomerular. Concomitantemente, podem ser feitos exames de imagem não invasivos, a exemplo da ultrassonografia com Doppler e ressonância magnética, os quais auxiliam no diagnóstico precoce da rejeição do enxerto. Contudo, deve-se considerar como principal mecanismo de diagnóstico a biópsia de enxerto, considerada padrão-ouro na avaliação das micro-alterações de vasculatura renal que indiquem a instalação de uma rejeição aguda ou crônica precoce, impactando positivamente na prevenção da falha do enxerto e o óbito de receptores (LAI, et al., 2021).
Por outro lado, eventos não imunológicos fazem parte das causas mais frequentes de falência tardia do enxerto renal, destacando-se entre elas a qualidade do órgão doado, a toxicidade de medicações imunossupressoras, a adesão correta ao tratamento medicamentoso, bem como comorbidades associadas a uma piora da função renal, a exemplo da hipertensão arterial sistêmica, diabetes mellitus e dislipidemia, além de causas relacionadas ao estilo de vida do receptor e a susceptibilidade a infecções após o transplante (PONTICELLI; CITTERIO, 2022).
A respeito da qualidade do rim doado, verificou-se uma diferença significativa em diferentes origens do órgão transplantado. No caso de doador falecido, há uma maior presença de elementos inflamatórios nos tecidos renais, como citocinas pró-inflamatórias, as quais promovem um estado de lesão microvascular progressiva nos glomérulos renais e túbulo-intersticiais, especialmente IL-6, o que pode acarretar em diminuição da capacidade de filtração glomerular e uma consequente falência do rim doado. Além disso, em doadores vivos, verificou-se que a idade é um fator importante, visto que, a medida que envelhecemos, há uma diminuição progressiva do número de néfrons e da taxa de filtração glomerular (TFG), apesar de haver uma menor concentração de fatores inflamatórios quando comparado ao rim proveniente de doador falecido (PONTICELLI; CAMPISE, 2021).
Outro fator diz respeito a toxicidade dos medicamentos utilizados para imunossupressão após o transplante, como os inibidores de calcineurina (CNI) sendo que seus efeitos são dose-dependentes, ou seja, quão maior for a dose do medicamento, maiores são as chances de haver lesão microvascular renal, assim como de efeitos sistêmicos, a exemplo da hipertensão, que pode causar, indiretamente, falência renal. Ademais, a não adesão correta à prescrição de medicamentos que auxiliem na manutenção do órgão transplantado também deve ser levada em consideração (PONTICELLI; CITTERIO, 2022).
Dentre as comorbidades associadas à falência do enxerto renal, uma de principal destaque é a hipertensão arterial sistêmica, a qual é frequentemente observada em receptores de transplante renal, sendo que, na maior parte dos casos, sua patogenia é de origem multifatorial. A imunossupressão pode induzir o surgimento da hipertensão ou agravar um quadro prévio no receptor, por meio de hiperativação do sistema renina-angiotensina-aldosterona (SRAA), resultando em vasoconstrição arteriolar e redução da TFG. Ademais, observou-se que outros fatores levam a um quadro hipertensivo pós-transplante, como doença renal ativa, idade avançada do doador, estenose de artéria renal, rejeição crônica e a utilização de esteroides, que causam retenção de água e sódio, resultando em aumento na produção de renina e, consequentemente, do volume extracelular (TANTISATTAMO, et al., 2020).
Cabe destacar, também, que o quadro de dislipidemia é uma complicação comum entre os receptores pós transplante, contribuindo para o surgimento de doenças cardiovasculares com potencial disfunção renal, sendo mais comumente observada durante os 6 primeiros meses após o transplante, sendo sua causa multifatorial, envolvendo uma diminuição na frequência de exercício físico, distúrbios alimentares, maior ingestão de gorduras saturadas e hábitos mais sedentários, configurando uma mudança de estilo de vida, que pode favorecer o sobrepeso e/ou obesidade, associado ao surgimento de diabetes mellitus do tipo 2. Tais alterações geralmente têm relação com o uso de fármacos imunossupressores, como as ciclosporinas, a qual está relacionada ao aumento do colesterol total, além de glicocorticóides, responsáveis pelo aumento da produção de VLDL e inibição de lipases, resultando em um acúmulo de lipídeos com potencial nefrotóxico, com acometimento dos glomérulos e túbulos renais. Nesse cenário, o tratamento envolve medidas não farmacológicas, como atividade física regular e dieta hipocalórica, associado ao uso de estatinas, e, em casos graves, o uso de algumas classes de imunossupressores deve ser limitado (PONTICELLI, et al., 2020).
Outra complicação frequente em receptores é o diabetes que surge após o transplante, associado a fatores de risco anteriormente discutidos, como dislipidemia e imunossupressão, além do uso de glicocorticóides, que podem induzir resistência insulínica. Verificou-se, ainda, que o tratamento com inibidores de calcineurina (CNI), tacrolimus (TAC) e ciclosporinas possuem efeito diabetogênico, reduzindo a secreção de insulina pelas células beta-pancreáticas (CHAKKERA; KUDVA; KAPLAN, 2017). Nesse viés, podem ocorrer lesões tubulointersticiais, podendo evoluir para um quadro de nefropatia diabética e colocando em risco a vitalidade do enxerto renal. Logo, o manejo do diabetes em receptores deve envolver mecanismos anti-diabéticos, a exemplo da metformina e das incretinas, que se mantém como umas das melhores opções terapêuticas, com exceção de indivíduos com reduzida taxa de filtração glomerular, expressando vantagem em relação a outros agentes redutores da hiperglicemia, especialmente em relação ao risco de hipoglicemia e ganho de peso. Ademais, medidas não farmacológicas como reduzir ingestão calórica e prática regular de exercício físico são importantes na prevenção do diabetes (CONTE; SECCHI, 2018).
Dentre as causas não imunológicas de falha do enxerto renal após o transplante também se enquadram determinados hábitos de vida. O ato de fumar está associado a um risco mais acentuado de proteinúria irreversível, além de acelerar a progressão da insuficiência renal em indivíduos com doença renal pré-estabelecida, sendo que tais consequências podem ser revertidas com a cessação do tabagismo (DEVRESSE, et al., 2021).
Outra causa importante de perda do aloenxerto diz respeito a infecções que podem acometer o receptor após o transplante devido ao tratamento imunossupressor ao qual esses pacientes são submetidos, sendo que infecções graves podem danificar permanentemente o enxerto renal, além do tratamento relacionado aos agentes infecciosos, que é feito, geralmente, com medicações nefrotóxicas, como determinados antibióticos, antifúngicos e antivirais. Tais danos renais, se agudos, podem ser reversíveis caso a infecção seja controlada rapidamente, porém, podem induzir complicações que impactam diretamente na saúde e longevidade do enxerto. Dentre essas, a infecção do trato urinário é a doença infecciosa mais comum entre os receptores de transplante renal, que requer hospitalização, pois pode induzir pielonefrite aguda, associada a um risco elevado de disfunção renal (GRAVERSEN, et al., 2016).
8 CONCLUSÃO
O estudo em questão avaliou o processo de transplante renal, buscando compreender a falha do enxerto e o óbito de receptores após o procedimento, a fim de definir caminhos para melhorias na sobrevida do enxerto e melhor qualidade de vida para o transplantado. Nesse sentido, fatores intrínsecos e extrínsecos interferem diretamente e indiretamente no desfecho que o transplante proporcionará ao paciente a curto e longo prazo. Portanto, conclui-se que uma abordagem personalizada para o receptor deve ser realizada, abordando todos os sinais clínicos relevantes à manutenção da vitalidade do enxerto renal e suas correlações, os quais guiam o manejo da insuficiência renal de origem imunológica ou não imunológica, devendo serem incluídas medidas terapêuticas como: correta adesão à prescrição de drogas imunossupressoras, evitar a nefrotoxicidade desses medicamentos, controlar a pressão arterial e o nível glicêmico, além de tratar um possível quadro de dislipidemia e promover a adoção de um estilo de vida mais saudável, evitando, assim, um desfecho desfavorável ao paciente.
9 CRONOGRAMA DE EXECUÇÃO
| META EXECUTIVA 2022-2023 | MÊS JUN | MÊS JUL | MÊS AGO | MÊS SET | MÊS OUT | MÊS NOV | MÊS DEZ | MÊS JAN | MÊS FEV | MÊS MAR | MÊS ABR | MÊS MAI | MÊS JUN | MÊS AGO | MÊS SET | MÊS OUT | MÊS NOV |
| Pesquisa Bibliográfica | X | X | X | X | X | ||||||||||||
| Coleta de dados | X | X | X | X | X | X | X | ||||||||||
| Tabulação dos dados | X | X | X | X | |||||||||||||
| Análise dos dados | X | X | X | X | X | ||||||||||||
| Redação do Relatório Final | X | X | X | X | |||||||||||||
| Defesa do TCC | X |
REFERÊNCIAS
ABBAS, Abul K.; PILLAI, Shiv; LICHTMAN, Andrew H.. Imunologia celular e molecular. 9 Rio de Janeiro: Guanabara Koogan, 2019, 565 p.
ANAND, S. et al. Kidney Disease. Disease Control Priorities, Third Edition (Volume 5): Cardiovascular, Respiratory, and Related Disorders, p. 235–252, 17 nov. 2017.
AUGUSTINE, J. Kidney transplant: New opportunities and challenges. Cleveland Clinic journal of medicine, v. 85, n. 2, p. 138–144, 1 fev. 2018.
CHAKKERA, H. A.; KUDVA, Y.; KAPLAN, B. Calcineurin Inhibitors: Pharmacologic Mechanisms Impacting Both Insulin Resistance and Insulin Secretion Leading to Glucose Dysregulation and Diabetes Mellitus. Clinical pharmacology and therapeutics, v. 101, n. 1, p. 114–120, 1 jan. 2017.
CONTE, C.; SECCHI, A. Post-transplantation diabetes in kidney transplant recipients: an update on management and prevention. Acta diabetologica, v. 55, n. 8, p. 763–779, 1 ago. 2018.
DEVRESSE, A. et al. How to manage cigarette smoking in kidney transplant candidates and recipients? Clinical kidney journal, v. 14, n. 11, p. 2295–2303, 1 nov. 2021.
FOROUTAN, F., FRIESEN, E. L., CLARK, K. E., MOTAGHI, S., ZYLA, R., LEE, Y., KAMRAN, R., Ali, E., Snoo, M. de, Orchanian-Cheff, A., Ribic, C., TRELEAVEN, D. J., Guyatt, G., & MEADE, M. O. (2019). Risk factors for 1-year graft loss after kidney transplantation systematic review and meta-analysis. Clinical Journal of the American Society of Nephrology, 14(11). Disponivel em: <https://doi.org/10.2215/CJN.05560519> . Acesso em: 14/03/2022
GRAVERSEN, M. E. et al. Risk and outcome of pyelonephritis among renal transplant recipients. BMC infectious diseases, v. 16, n. 1, 10 jun. 2016.
GUYTON, A.C. e Hall J.E.– Tratado de Fisiologia Médica. Editora Elsevier. 13ª ed., 2017.
HILL, N. R. et al. Global Prevalence of Chronic Kidney Disease – A Systematic Review and Meta-Analysis. PLOS ONE, v. 11, n. 7, p. e0158765, 1 jul. 2016.
JAMIESON, N. J.; HANSON, C. S.; JOSEPHSON, M. A.; et al. Motivations, Challenges, and Attitudes to Self-management in Kidney Transplant Recipients: A Systematic Review of Qualitative Studies. American Journal of Kidney Diseases, v. 67, n. 3, p. 461–478, 2016. W.B. Saunders.
KUMAR, Vinay; ASTER, Jon C.; ABBAS, Abul K.. Robbins & Cotran Patologia: bases patológicas das doenças. 9 Rio de Janeiro: Guanabara Koogan, 2021, 1421 p.
LAI, X. et al. Tackling Chronic Kidney Transplant Rejection: Challenges and Promises. Frontiers in Immunology, v. 12, p. 661643, 20 maio 2021.
LORES, J. DA C.; ECKER, R.; LAVARDA, S. C. S. Transplante renal: relacionando tipo de enxerto e tempo de isquemia. Rev. enferm. UFPE on line, p. 1405–1411, 2019.
Loyola M, Ancoski T, Ramires MA, Mello F, Mello AMD. Enxertos ósseos autógenos e xenógenos como alternativa de manutenção do espaço alveolar. RGS. 2018;19(2):8-18.
MELTZER, J. S. Renal Physiology. Pharmacology and Physiology for Anesthesia: Foundations and Clinical Application, p. 782–794, 1 jan. 2019.
MURTON, M. et al. Burden of Chronic Kidney Disease by KDIGO Categories of Glomerular Filtration Rate and Albuminuria: A Systematic Review. Advances in Therapy, v. 38, n. 1, p. 180, 1 jan. 2021.
NICKERSON PW. What have we learned about how to prevent and treat antibody-mediated rejection in kidney transplantation? Am J Transplant. (2020) 20:12–22. 10.1111/ajt.15859 . Acesso em: 14/03/2022
PARK, W. Y. et al. Differences in Pathologic Features and Graft Outcomes of Rejection on Kidney Transplant. Transplantation proceedings, v. 51, n. 8, p. 2655–2659, 1 out. 2019.
PINTER, J. et al. ‘I feel stronger and younger all the time’—perspectives of elderly kidney transplant recipients: thematic synthesis of qualitative research. Nephrology Dialysis Transplantation, v. 31, n. 9, p. 1531–1540, 1 set. 2016.
PONTICELLI, C. et al. Treatment of dyslipidemia in kidney transplantation. Expert opinion on drug safety, v. 19, n. 3, p. 257–267, 3 mar. 2020.
PONTICELLI, C.; CAMPISE, M. R. The inflammatory state is a risk factor for cardiovascular disease and graft fibrosis in kidney transplantation. Kidney international, v. 100, n. 3, p. 536–545, 1 set. 2021.
PONTICELLI, C.; CITTERIO, F. Non-Immunologic Causes of Late Death-Censored Kidney Graft Failure: A Personalized Approach. Journal of personalized medicine, v. 12, n. 8, 1 ago. 2022.
PORTO, Janaína Rodrigues et al. Avaliação da função renal na doença renal crônica. RBAC, v. 49, n. 1, p. 26-35, 2017.
REQUIÃO-MOURA, L. R.; ALBINO, C. R. M.; BICALHO, P. R.; et al. Long-term outcomes after kidney transplant failure and variables related to risk of death and probability of retransplant: Results from a single-center cohort study in Brazil. (J. Gołębiewska, Org.) PLOS ONE, v. 16, n. 1, p. e0245628, 2021. Public Library of Science. Disponível em: <https://dx.plos.org/10.1371/journal.pone.0245628>. Acesso em: 8/4/2021.
SAWINSKI, D.; POGGIO, E. D. Introduction to kidney transplantation: Long-term management challenges. Clinical Journal of the American Society of Nephrology, v. 16, n. 8, p. 1262–1263, 1 ago. 2021.
SHENDI, A. M., WALLIS, G., PAINTER, H., HARBER, M., & COLLIER, S. (2018). Epidemiology and impact of bloodstream infections among kidney transplant recipients: A retrospective single-center experience. Transplant Infectious Disease, 20(1). Disponivel em: <https://doi.org/10.1111/tid.12815>. Acesso em: 14/03/2022
TANTISATTAMO, E. et al. Approach and Management of Hypertension After Kidney Transplantation. Frontiers in medicine, v. 7, 16 jun. 2020.
TIMSIT, M. O.; KLEINCLAUSS, F.; THURET, R. Histoire chirurgicale de la transplantation rénale. Progres en Urologie, 1. nov. 2016. Elsevier Masson SAS.
VAN VUGT, L. K. et al. Investigational drugs for the treatment of kidney transplant rejection. https://doi.org/10.1080/13543784.2022.2130751, 2022.
CENTRO UNIVERSITÁRIO APARÍCIO CARVALHO – CURSO DE MEDICINA
