ANALYSIS OF HEPATIC EFFECTS AND QUALITY OF LIFE IN PATIENTS WITH HEREDITARY HEMOCHROMATOSIS
REGISTRO DOI: 10.5281/zenodo.8283677
Bárbara Bemon Pozza1
Gabriela Mazzurana Cibulski 2
Marcel Pereira Rangel 3
Resumo
O ferro é um nutriente fundamental para o organismo, participando de distintos processos metabólicos e estruturais nas células. Deste modo, sua concentração deve ser mantida nos valores ideais para cada faixa etária, uma vez que, seu excesso está relacionado com processos oxidativos e desenvolvimento de patologias como a hemocromatose, que pode levar ao desenvolvimento de danos hepáticos, cardiovasculares e metabólicos quando não tratada, sendo causa frequente de óbito. Portanto, o objetivo desta pesquisa é analisar as manifestações hepáticas em pacientes diagnosticados com hemocromatose hereditária e seu impacto na qualidade de vida do indivíduo. Para isso, a amostra é constituída por pacientes diagnosticados com a doença, os quais foram convidados a responder o questionário (WHOQOL-BREF) para analisar a qualidade de vida. Em relação aos dados clínicos, os participantes foram convidados ao Unicesulab para coleta do sangue venoso e análise dos parâmetros de hemocromatose como: Ferro total, Ferritina, Transferrina e Capacidade de fixação do ferro, além dos marcadores de lesão hepática como: Transaminases (AST e ALT), Gama GT, Bilirrubina e suas frações e Glicose, sendo esses parâmetros analisados em equipamento Bioplus 2000 (metodologia de espectrofotometria). Diante da análise e discussões apresentadas, encontrou-se associação entre a doença e os níveis alterados dos marcadores hepáticos, bem como seu impacto na qualidade de vida do paciente. Dessa forma foi possível guiar alternativas que possam ser desenvolvidas visando melhorar a qualidade de vida destes indivíduos.
Palavras-chave: hemocromatose hereditária. Manifestações hepáticas. Sobrecarga de ferro.
1. INTRODUÇÃO
O ferro é um elemento essencial para o organismo humano, desempenhando função central no metabolismo energético celular. Para isso, o ferro deve se ligar à proteína transferrina e ser transportado, à medula óssea, baço, fígado e músculos. O ferro também pode ser encontrado armazenado sob a forma de ferritina ou de hemossiderina nas células do sistema mononuclear fagocitário (AYMONE et al., 2013). Em condições normais, o organismo não é capaz de aumentar a excreção de ferro, mesmo quando há sobrecarga dele, logo, o aumento progressivo por via gastrointestinal ou parenteral leva, impreterivelmente, à sobrecarga patológica de ferro (IGLESIAS, et al., 2018). Este excesso é conhecido como hemocromatose hereditária (HH), um distúrbio autossômico recessivo, caracterizado pelo aumento inapropriado da absorção de ferro pela mucosa gastrointestinal, resultando em um armazenamento excessivo, com posterior dano estrutural e funcional principalmente no fígado e pâncreas (CANÇADO; CHIATTONE, 2010; SANTOS et al., 2009).
O quadro clínico da HH é bastante variável e depende da quantidade de ferro em excesso, da velocidade em que é acumulado, do tempo em que o organismo é a ele exposto. A maioria dos doentes torna-se sintomática entre a 3ª e a 5ª décadas de vida. Os sintomas mais referidos, em ordem decrescente, são: fadiga, artralgia/artrite, dor abdominal, diminuição da libido ou impotência sexual, perda de peso. Já os sinais clínicos mais frequentes para o diagnóstico, também em ordem decrescente, são: hepatomegalia, hiperpigmentação da pele, hipogonadismo, artropatia, esplenomegalia, Diabetes Melittus, cirrose hepática, miocardiopatia e/ou arritmia. O risco de carcinoma hepático é cerca de vinte vezes maior nos pacientes com HH e é mais frequente em pacientes com cirrose hepática (SANTOS et al., 2009, WAHLBRINK, 2016).
Por sua vez, os achados laboratoriais mais encontrados em portadores de HH são: hipoalbuminemia, hiperglicemia, diminuição da concentração dos fatores de coagulação, e elevação das transaminases. Os primeiros exames a serem realizados após a suspeita clínica de HH são: ferritina sérica e saturação de transferrina (SOUTO et al., 2016). A genotipagem constitui-se no próximo exame a ser realizado se a saturação de transferrina for maior que 45% e se houver elevação de ferritina. Marcadores laboratoriais devem ser usados para avaliar a toxicidade do ferro, como o seu nível sérico e a sua capacidade total de ligação (TIBC). O TIBC se eleva após a saturação de proteínas carreadoras e o ferro livre se eleva quando em excesso (LEMOS et al., 2010). Quanto mais cedo o diagnóstico, maior é a expectativa e a qualidade de vida desses pacientes (HAHN et al, 2006). Os principais motivos que levam à morte, nos estados de sobrecarga de ferro, são as arritmias cardíacas, miocardiopatias e cirrose hepática (KROOT et al., 2011).
Deste modo, esse estudo buscou analisar os principais impactos hepáticos da hemocromatose e como estas alterações impactam diretamente na qualidade de vida do indivíduo, uma vez que, estudos voltados à essa temática são escassos principalmente em relação ao impacto na qualidade de vida do paciente, deste modo, é imprescindível esta análise.
2. METODOLOGIA
Trata-se de um estudo exploratório descritivo de abordagem quantitativa e qualitativa. Foram incluídos indivíduos diagnosticados com HH na cidade de Maringá-PR e excluídos indivíduos que não respeitaram tempo necessário de jejum para coleta e dosagem dos analitos, bem como sujeitos que apresentavam alguma condição que tornasse a participação inviável, como quadros demenciais.
Os dados foram coletados por estudantes do 2º ano do curso de Medicina da Unicesumar e docentes do curso. Para realização do trabalho, recolheu-se informações referentes a qualidade de vida pelo questionário “Estilo de vida fantástico”. e coletou-se amostra de sangue seguindo as recomendações das Diretrizes da OMS de Boas Práticas de Flebotomia de 2009 (OMS, 2009). Aos contribuintes foi solicitado jejum prévio de 8 horas para coleta de sangue venoso. Os materiais utilizados para coleta, a qual ocorreu na UniCesulab, foram aqueles utilizados em rotinas laboratoriais (agulhas, seringas, algodão, garrote, luvas, curativos pós-punção, álcool, testes bioquímicos). Os exames realizados foram: Ferritina; Ferro Sérico; Capacidade de fixação do ferro; Transaminase Oxalacética (AST); Transaminase Pirúvica (ALT); Gama-Glutamil Transferase (GGT); Bilirrubina e suas frações; Glicose. Os KITS utilizados foram fornecidos pela empresa GOLD ANALISA e quantificados utilizando o equipamento de espectofotometria alta performance BIOPLUS 2000.
A análise descritiva com tabelas de frequências univariadas, com distribuições percentuais para as variáveis qualitativas e com o cálculo de medidas de tendência central como medianas, médias e desvios-padrão para as variáveis quantitativas. A medida de proporcionalidade adotada foi a razão de prevalência (RP), que constitui um sucedâneo do risco relativo (RR), geralmente estimado em estudos de corte transversal. A pesquisa foi submetida e aprovada pelo Comitê de Ética e Pesquisa com Seres Humanos (CEP) da Universidade Centro Universitário de Maringá (UniCesumar), CAAE (44903221.6.0000.5539).
3.RESULTADOS E DISCUSSÕES
A partir da leitura de artigos e de dados próprios obtidos com a pesquisa, é possível observar alterações laboratoriais geradas pela evolução da HH, principalmente na função hepática, além de mudanças leves na qualidade de vida.
Figura 1: Avaliação do metabolismo do ferro. Ferro total (Fig. 1A), Ferritina (Fig. 1B) e Capacidade de ligação do Ferro – TIBC (Fig. 1C), (n=22).
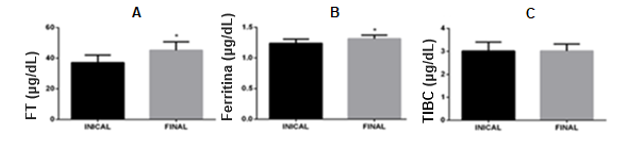
Na Figura 1, tem-se a representação da análise inicial do ferro e seus componentes. No gráfico correspondente ao ferro total (Fig. 1A), pode ser observado um aumento significativo dessa variável, fato importante de ser notado, uma vez que, com a deficiência de hepcidina, o organismo portador de HH passa a absorver mais ferro do que o normal. Essa absorção demasiada, com o passar do tempo, faz com que haja uma saturação de transferrina. A partir do aumento dos níveis séricos de ferro, as células parenquimatosas passam a armazenar o ferro na forma de ferritina com o intuito de manter a homeostasia. Contudo, devido à progressão da doença, já com um nível crítico de sobrecarga de ferro, a ferritina se torna incapaz de sequestrar todas as moléculas de ferro citoplasmáticas, fazendo com que o ferro fique acumulado no citoplasma. O ferro livre no citoplasma, então, atua como catalisador de reações oxidativas, destruindo as células em questão e liberando seu conteúdo intracelular, o que faz com que a quantidade de ferritina, antes presente nas células, se torne elevada no sangue. Esse processo pode ser observado no gráfico de ferritina (Fig. 1B), o qual demonstrou um aumento significativo nos seus valores quando analisados na segunda coleta. A razão entre a quantidade de ferro sérico circulante (Fig. 1A) e de TIBC (Fig. 1C), multiplicado por 100, fornece o índice de saturação da transferrina (IST). O IST corresponde ao percentual de transferrina ocupado pelo ferro e quando é maior que 45%, juntamente com o ferro sérico elevado, aumenta em 90% a chance do diagnóstico ser HH, pois o IST é mais estável que o ferro sérico e altera-se mais precocemente que outros marcadores. Na pesquisa, observou-se que o gráfico de TIBC se manteve constante, porém, como já dito, houve um aumento no valor de ferro total, o que faz com que aumente o valor de IST (GROTTO, 2008).
Figura 2: Avaliação da Glicemia (Fig. 2A), da Transaminase Oxalacética – AST (Fig. 2B), da Transaminase Pirúvica – ALT (Fig. 2C) e da Gama Glutil Transferase (Fig. 2D), (n=22).
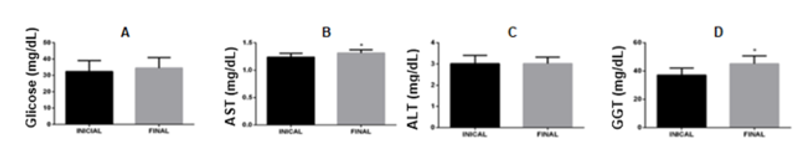
Seguindo a linha de raciocínio do trabalho, foi observado possíveis alterações no metabolismo glicêmico e hepáticas, representados na Figura 2. Os níveis de glicose (Fig. 2A) não sofreram alterações significativas, possivelmente, devido à lesão hepática ser inicial ainda. Em casos mais evoluídos da HH, o excesso de ferro gera um estresse oxidativo nas células, podendo gerar uma destruição das células β-pancreáticas e um agravamento da resistência insulínica periférica, o que faz com que haja um aumento do nível de glicose no sangue (GOUVEIA; RIBEIRO; CARRILHO, 2014). A transaminase oxalacética (AST) (Fig. 2B) e a transaminase pirúvica (ALT) (Fig. 2C), ambas consideradas biomarcadores de alta especificidade da lesão hepática, atuam catalisando, respectivamente, a conversão de aspartato e de alanina em oxalacetato e piruvato. No estudo, é possível observar um aumento significativo apenas no nível de AST (Fig. 2B). Porém, o nível de ALT também não demonstrou uma redução (Fig. 2C), o que não contradiz a literatura. O aumento de AST, provavelmente, está relacionado a destruição dos hepatócitos devido ao acúmulo de ferro intracelular, fazendo com que essa enzima seja liberada em maiores quantidades na circulação sanguínea (JESUS et al., 2014). Para a avaliação do ducto biliar, analisou-se os níveis gama glutamil transferase (GGT) (Fig. 2D), os quais apresentaram um aumento, indicando possível lesão biliar em decorrência da deposição de ferro, uma vez que a GGT é uma enzima fixada à membrana celular e é responsável pelo metabolismo extracelular da glutationa, o principal antioxidante das células. A GGT medida através do plasma é de origem hepática, atuando como indicativo de doença hepática e obstrução biliar (COSTA, 2021).
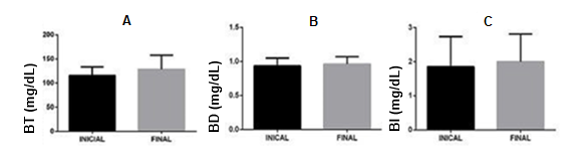
Ademais, foram avaliadas as dosagens bioquímicas da bilirrubina, representadas na Figura 3, onde observou-se um aumento discreto da bilirrubina total (Fig. 3A) e de suas frações direta (Fig. 3B) e indireta (Fig. 3C). O aumento da fração indireta se dá por uma elevação da hemólise, ao passo que a lesão hepática e a obstrução dos ductos biliares elevam a fração direta e, consequentemente, a bilirrubina total. No caso dos pacientes com hemocromatose hereditária, a deposição de ferro no fígado seguida por lesão hepática causa alteração nas frações, elevando seus valores (COSTA, 2021). Como o aumento dessas variáveis não foi tão significativo, pode-se inferir que a lesão hepática ainda não está tão intensa.
Figura 3: Avaliação da Bilirrubina e suas frações. Bilirrubina Total – BT (Fig. 3A), Bilirrubina Direta – BD (Fig. 3B) e Bilirrubina Indireta – BI (Fig. 3C), (n=22).
O impacto do estilo de vida foi analisado através do questionário “Estilo de vida fantástico”, visando correlacionar os domínios do instrumento com fatores de risco e agravos modificáveis do curso da HH. No domínio “Família” e “Amigos”, a metade dos pacientes quase sempre possui alguém para conversar, mas quanto ao critério dar e receber afeto, os resultados variam com relativa frequência. Estudos demonstraram haver uma interação entre a doença e a resposta somática do organismo para expressar suas emoções, fazendo com que os componentes “diálogo” e “afeto” sejam essenciais, auxiliando a compreender melhor o processo de saúde-doença (JÚNIOR, 2013). Quanto ao domínio de atividade física, os resultados apontam que 35% dos pacientes realizam atividade vigorosa por pelo menos 30 minutos por dia apenas 3 vezes por semana. Ao passo que 55% afirmam serem moderadamente ativos em menos de 1 vez por semana. Estudos demonstraram uma regulação positiva da hepcidina como uma resposta homeostática a estímulos inflamatórios da interleucina-6 e/ou níveis elevados de ferro causados pela hemólise pós-exercício. Além disso, treinamentos de longo prazo relataram uma associação a níveis séricos de ferritina mais baixos (PEELING, 2014).
Em relação ao domínio da “nutrição”, os pacientes raramente levam uma dieta balanceada, sendo que cerca de 35% ingerem, às vezes, excesso de açúcar, sal, gordura animal, bobagens e salgadinhos. É importante destacar a parcela de 20% dos pacientes que relatam quase sempre comer em excesso esses alimentos, uma vez que a composição da dieta é significativa no curso da hemocromatose hereditária (FISCHER, 2021). A ingestão de alimentos ricos em ácidos fíticos e polifenóis (grãos, nozes, café e chá), além de proteínas vegetais (proteína de soja), demonstraram ser inibidores da absorção do ferro não heme (inorgânico). Por outro lado, elementos que contenham ácido ascórbico, frutose, etanol e a própria proteína animal devem ser evitados por aumentar a absorção de ferro intestinal. Outro ponto a ser destacado é o consumo excessivo de alimentos ricos em gordura, pois aumentam o stress oxidativo e a longo prazo, ocorre o acúmulo de triglicerídeos dentro dos hepatócitos, causando lesão hepática (MILMAN, 2021).
No domínio “cigarro” e “drogas”, 15% dos pacientes afirma fumar mais de 10 cigarros por dia e 100% utiliza maconha e cocaína às vezes. A maior parte dos pacientes relata nunca abusar ou exagerar nos remédios, mas 35% ingere bebidas que contêm cafeína mais de 10 vezes por dia. Os efeitos tóxicos diretos da fumaça do tabaco advêm dos radicais livres que aumentam o estresse oxidativo que culmina em fibrose por ativação das células estreladas. Além disso, o tabagismo aumenta a produção de citocinas pró-inflamatórias que causam lesão nas células hepáticas e também pode alterar as atividades das enzimas antioxidantes(EL-ZAYADI, 2006); (KOCYIGIT, 2001). Os efeitos tóxicos indiretos advêm da ligação da hemoglobina com o monóxido de carbono, o que inviabiliza o transporte de oxigênio para os tecidos através dessas hemácias, resultando no aumento da carboxiemoglobina, há subsequentemente um aumento da eritropoiese, hemólise, ferro sérico e da eritropoetina, além da regulação negativa da hepcidina, contribuindo com o aumento da absorção de ferro no intestino. Também é importante destacar que a redução da perfusão hepática, estado inflamatório e oxidativo, fibrose e lesões nos hepatócitos advindos da hemocromatose hereditária, geralmente estão associados à atividade enzimática prejudicada, sendo as enzimas CYP as mais suscetíveis por um prejuízo na tradução do mRNA (COSTA, 2021). Quanto ao domínio do álcool, a maioria dos pacientes afirma ingerir uma média semanal de 0 a 7 doses de álcool e a mesma porcentagem (70%) refere nunca beber mais de quatro doses em uma ocasião. A ingestão excessiva e crônica de álcool causa danos hepáticos decorrentes dos efeitos bioquímicos da sua metabolização, como o aumento do stress oxidativo, redução da relação NAD+/NADH, regulação negativa da hepcidina, alteração da função mitocondrial, aumento de acetaldeído e de produtos da peroxidação lipídica, elevando os valores de AST, ALT, FA e GGT (POWELL, 2016).
Em relação ao domínio “comportamental”, 50% relata aparentar estar com pressa frequentemente, ao passo que, 70% refere quase nunca se sentir com raiva e hostil. Em relação ao sono, apenas 10% dos pacientes refere quase sempre dormir bem e se sentir descansado. Além disso, 40% dos pacientes relata quase nunca ser capaz de lidar com o estresse no dia a dia e 30% afirma quase sempre desfrutar do tempo de lazer. Quanto ao domínio “introspecção”, 30% relata quase sempre pensar de forma positiva e otimista, embora 35% quase sempre se sente tenso e desapontado e 40% sente-se triste e deprimido com relativa frequência.
4. CONCLUSÃO
Após o término do projeto, é válido afirmar que a HH é uma patologia que gera diretamente alterações hepáticas, as quais devem ser sempre monitoradas para evitar que a doença progrida para um estado mais crítico, tal como, um estado de cirrose hepática. Além disso, a HH é uma doença crônica que deve ser controlada através de hábitos de vida, sendo que, muitas vezes, esses hábitos não fazem parte da rotina dos pacientes, o que influencia na qualidade de vida dos mesmos.
REFERÊNCIAS
AYMONE, Cassuriaga et al. Hemocromatose hereditária. JBM, v. 101, n. 6, p. 101-110, 2013.
BRISSOT, Pierre; PIETRANGELO, Antonello; ADAMS, Paul C.; GRAAFF, Barbara de; MCLAREN, Christine E.; LORÉAL, Olivier. Haemochromatosis. Nature Reviews Disease Primers, [S.L.], v. 4, n. 1, p. 1-15, 5 abr. 2018. Springer Science and Business Media LLC. http://dx.doi.org/10.1038/nrdp.2018.16.
CANÇADO, Delfini, CHIATTONE, Sérgio. Visão atual da hemocromatose hereditária. Rev. Bras. Hematol. Hemoter,v. 32, n. 6, p. 469-475, 2010 .
COSTA, Taylla S. et al. Hereditary hemochromatosis associated with the development of liver cirrhosis. Jornal Brasileiro de Patologia e Medicina Laboratorial [online]. 2021, v. 57, e2842021. Disponível em: <https://doi.org/10.5935/1676-2444.20210017>. Epub 14 Maio 2021. ISSN 1678-4774. https://doi.org/10.5935/1676-2444.20210017.
EL-ZAYADI, Abdel-Rahman. Heavy smoking and liver. World Journal Of Gastroenterology, [S.L.], v. 12, n. 38, p. 6098, out. 2006. Baishideng Publishing Group Inc.. http://dx.doi.org/10.3748/wjg.v12.i38.6098.
FISCHER, Christine; et al. Dietary Iron Overload and Hfe−/− Related Hemochromatosis Alter Hepatic Mitochondrial Function. Antioxidants, [S.L.], v. 10, n. 11, p. 1818, 16 nov. 2021. MDPI AG. http://dx.doi.org/10.3390/antiox10111818.
GOUVEIA, Sofia; RIBEIRO, Cristina; CARRILHO, Francisco. Sobrecarga de ferro e diabetes mellitus. Revista Portuguesa de Endocrinologia, Diabetes e Metabolismo, [S.L.], v. 9, n. 1, p. 74-78, jan. 2014. Sociedade Portuguesa de Endocrinologia Diabetes e Metabolismo. http://dx.doi.org/10.1016/j.rpedm.2014.03.001.
GROTTO, Helena Z. W.. Metabolismo do ferro: uma revisão sobre os principais mecanismos envolvidos em sua homeostase. Revista Brasileira de Hematologia e Hemoterapia, [S.L.], v. 30, n. 5, p. 390-397, out. 2008. Elsevier BV. http://dx.doi.org/10.1590/s1516-84842008000500012.
HAHN Ju. et al. Evaluation of a diagnostic algorithm for hereditary hemochromatosis in 3,500 patients with diabetes. Diabetes Care, v.29, n.2, p. 464-6, 2006.
IGLESIAS, Kessler et al . Hemocromatose: Uma Causa Reversível de Insuficiência Cardíaca. Int. J. Cardiovasc. Sci, v. 31, n. 3, p. 308-311, 2018.
JESUS, Gisleide Cardoso de et al. Principais Patologias e Biomarcadores das Alterações Hepáticas. EVS, Goiânia, v. 41, n. 3, p. 525-537, set. 2014.
KOCYIGIT, Abdurrahim; EREL, Ozcan; GUR, Selahattin. Effects of tobacco smoking on plasma selenium, zinc, copper and iron concentrations and related antioxidative enzyme activities. Clinical Biochemistry, [S.L.], v. 34, n. 8, p. 629-633, nov. 2001. Elsevier BV. http://dx.doi.org/10.1016/s0009-9120(01)00271-5.
KROOT Joice et al. Hepcidin in human iron disorders: diagnostic implications. Clin Chem. V. 57, v.12, p. 1650-69, 2011.
LEMOS Andréa et al. A hepcidina como parâmetro bioquímico na avaliação da anemia por deficiência de ferro. Rev Assoc Med Bras. v. 56, v. 5. P 596-599, 2010.
MILMAN, Nils Thorm. Managing Genetic Hemochromatosis: an overview of dietary measures, which may reduce intestinal iron absorption in persons with iron overload. Gastroenterology Research, [S.L.], v. 14, n. 2, p. 66-80, abr. 2021. Elmer Press, Inc.. http://dx.doi.org/10.14740/gr1366.
PEELING, Peter; et al. Iron Status and the Acute Post-Exercise Hepcidin Response in Athletes. Plos One, [S.L.], v. 9, n. 3, p. 1-6, 25 mar. 2014. Public Library of Science (PLoS). http://dx.doi.org/10.1371/journal.pone.0093002.
POWELL, Lawrie W; SECKINGTON, Rebecca C; DEUGNIER, Yves. Haemochromatosis. The Lancet, [S.L.], v. 388, n. 10045, p. 706-716, ago. 2016. Elsevier BV. http://dx.doi.org/10.1016/s0140-6736(15)01315-x.
SANTOS, Paulo et al . Alterações moleculares associadas à hemocromatose hereditária. Rev. Bras. Hematol. Hemoter, v. 31, n. 3, p. 192-202, 2009.
SOUTO, Nathércia et al. Hereditary hemochromatosis: literature review. Revista Médica de Minas Gerais, [S.L.], v. 26, p. 1-8, 2016. GN1 Genesis Network. http://dx.doi.org/10.5935/2238-3182.20160091.
SOUZA Meirelles, et al. Hemocromatose hereditária: relato de caso e revisão da literatura. Arq. Gastroenterol, v. 38, n. 3, p. 194-202, 2001.
WAHLBRINK Daiane, et al. CARACTERÍSTICAS DA HEMOCROMATOSE: Uma revisão narrativa. Revista Saúde: Suplemento, v.2, n.4, p. 25-36, 2016.
1Discente do Curso Superior de Medicina do Instituto Universidade Cesumar Campus Maringá e-mail: barbarab-p@hotmail.com
2 Discente do Curso Superior de Medicina do Instituto Universidade Cesumar Campus Maringá e-mail: gabrielamazzurana@outlook.com
3 Docente do Curso Superior de Medicina do Instituto Universidade Cesumar Campus Maringá. Doutor em Ciências Farmacêuticas pela Universidade Estadual de Maringá (UEM). e-mail: marcel.rangel@docentes.unicesumar.edu.br
