CLINICAL AND EPIDEMIOLOGICAL PROFILE OF LLC PATIENTS SEEN AT A REFERRAL HOSPITAL IN BELÉM-PA AND ITS CORRELATION WITH BIOLOGICAL PROGNOSTIC MARKERS
REGISTRO DOI:
Lucas da Silva Lopes1
Natasha Melnik Gomes2
Patrícia Danielle Lima de Lima3
Camile Irene Mota da Silva4
Thiago de Carvalho Leopoldino5
Danilo Dantas Figueiredo6
João Augusto Gomes de Souza Monteiro de Brito7
Gilberto Emanoel Reis Vogado Filho8
Luiz Lima Bonfim Neto9
RESUMO
O estudo objetiva analisar o perfil clínico e laboratorial dos pacientes com LLC em hospital de referência em Belém-PA com a expressão de marcadores citogenéticos e de imunofenotipagem ao diagnóstico. Trata-se de um estudo transversal de 46 pacientes sob diagnóstico de LLC e tratamento efetivado nos períodos de 2017 a 2019. Os dados foram obtidos pela revisão de prontuários médicos e registrados via formulário eletrônico com aspectos demográficos, clínicos, parâmetros hematológicos, perfil citogenético e imunofenotípico. Calcularam-se as frequências absoluta e relativa da distribuição das variáveis, além das associações clínicas e laboratoriais com os marcadores citológicos e imunofenotípicos sendo feitas por testes de qui-quadrado. Observou-se que o sinal clínico mais frequente foi esplenomegalia e a linfocitose a alteração laboratorial de mau prognóstico. A ausência da del17q e a presença da deltp53 favoreceram melhor evolução da LLC, além de pacientes ausentes da del13q e da deltp53 cursarem sem hepatoesplenomegalia apesar da relevância estatística entre tais alterações e a plaquetopenia nos pacientes. Dos biomarcadores, o CD79b+ relacionou-se com a redução de óbitos (p<0,036) e com a ausência de linfadenopatia, além do CD38 participar no surgimento de linfadenopatia ao diagnóstico. O prolongamento de tratamento específico atrelou-se à trissomia do cromossomo 12 (p<0,02) mesmo sob impacto desconhecido na escolha terapêutica. Diante das evidências, o perfil epidemiológico e clínico relacionado às alterações genéticas dos marcadores da LLC culminaram em manifestações sintomáticas referentes tanto ao bom quanto ao mau prognóstico baseadas na análise qui quadrado.
INTRODUÇÃO
A Leucemia Linfocítica Crônica (LLC) é a neoplasia mais comum dentre as leucemias, cuja ocorrência se dá a partir expansão clonal de células B CD5 + maduras no sangue, medula óssea e tecidos linfóides, e que, em geral, não causa sintomas precocemente¹. Contudo, Ostasov² refere-se à sintomatologia dos pacientes como heterogênea: a progressão pode variar desde um quadro de início agressivo com necessidade de tratamento até um câncer de comportamento indolente sem necessidade de intervenção terapêutica por vários anos.
Em sua maioria, a LLC se apresenta em adultos, com predomínio em homens brancos e uma idade média no diagnóstico é de 65 anos. Esses pacientes geralmente são diagnosticados nas consultas de rotina devido à contagem elevada de linfócitos. Os primeiros sintomas consistem em linfadenopatia e astenia. Em estágios mais avançados, são relatadas infiltrações de outros órgãos não linfóides dos sistemas nervoso central, digestivo, geniturinário e respiratório³.
O diagnóstico de LLC é estabelecido por hemogramas, contagens diferenciais, esfregaço de sangue e imunofenotipagem de linfócitos B circulantes, que identificam uma população de células B clonais carregando o antígeno CD5, bem como marcadores de células B típicos como CD19, CD20 e CD23. Tal diagnóstico requer a presença de ≥ 5000 linfócitos B/μL no sangue periférico por pelo menos 3 meses. A clonalidade dos linfócitos B circulantes precisa ser confirmada por citometria de fluxo4.
O estadiamento da doença é realizado para definir a carga da doença, prever a sobrevida mediana e indicar o prognóstico. Para LLC, os sistemas principais usados são o RAI e BINET, desenvolvidos na década de 1970. Eles se baseiam apenas em informações clínicas, considerando o comprometimento dos gânglios linfáticos, baço e fígado, além da presença de baixos níveis de células sanguíneas (anemia e trombocitopenia)5. Atualmente, a análise do DNA, anomalias cromossômicas detectadas por hibridização fluorescente in situ (FISH) e a avaliação de marcadores no sangue têm grande significância na previsão do curso da doença para os pacientes6.
Nesse contexto, de acordo com Lemal e Tournilhac7, a avaliação prognóstica dos pacientes pode ser categorizada a partir de dois indicadores de mau prognóstico: as anormalidades genéticas referentes às alterações na proteína p53, as quais mutações no gene TP53, bem como deleções que levam a modificações na proteína p17, e cariótipos complexos com mais de 3 anormalidades. Tais alterações são responsáveis por comprometer a efetividade citotóxica do combate à reprodução da doença, além de dificultar a efetividade do tratamento devido ao grau de agressividade e de refratariedade da neoplasia.
Atualmente, o tratamento da LLC está ligado não apenas aos sinais clínicos, mas também aos padrões de anomalias genéticas, como as relacionadas às proteínas p53, p17 e à alteração da p11. Quanto aos medicamentos utilizados, os mais reconhecidos são o clorambucil, tanto em combinação quanto isoladamente com corticosteroides, e a imunoquimioterapia com rituximab. Embora cerca de 40% dos casos apresentam remissão do câncer, os pacientes com variantes de prognóstico desfavorável enfrentam dificuldades no tratamento, incluindo efeitos adversos de infecções secundárias e caráter não curativo, mesmo com a administração completa da terapia8.
Logo, este trabalho objetivou identificar a associação entre o perfil clínico e laboratorial dos pacientes com LLC atendidos em hospital de referência com a expressão de marcadores biológicos (alterações citogenéticas e de imunofenotipagem) ao diagnóstico. Ademais, foi realizada a caracterização dos pacientes com LLC em relação aos aspectos clínicos, laboratoriais e epidemiológicos, além de identificar o perfil de marcadores biológicos dos pacientes avaliados no estudo.
MÉTODOS
Aspectos Gerais
O presente trabalho trata-se de um estudo transversal realizado com quarenta e seis (46) pacientes com diagnóstico prévio de LLC, atendidos regularmente em hospital de referência no tratamento onco-hematológico de Belém – PA, no período de 2017 a 2019.
Questões Éticas
Este estudo foi submetido e aprovado (CAAE: 15025519.4.1001.5174) pelo Comitê de Ética em Pesquisa – CEP da Universidade do Estado do Pará – UEPA, Centro de Ciências Biológicas e da Saúde – CAMPUS II, como parte de um estudo mais amplo acerca da avaliação de marcadores tumorais no prognóstico clínico e terapêutico dos pacientes, pelo mesmo grupo de pesquisa.
Aquisição de dados
Os dados dos pacientes foram obtidos do Hospital Ophir Loyola, centro de referência para tratamento de neoplasias no Estado do Pará, a partir da revisão dos prontuários médicos e, posteriormente, registrados em formulário eletrônico contendo informações sobre aspectos demográficos e clínicos, parâmetros hematológicos, caracterização citogenética (FISH) e imunofenotípica (citometria de fluxo).
Procedimentos analíticos
A análise estatística dos dados foi realizada utilizando o software R versão 4.0 e PAST versão 4.0. O programa usado para a elaboração de gráficos e tabelas foi o Microsoft Excel® 2010. Calcularam-se as frequências absoluta e relativa quanto à distribuição de cada variável na população. Para verificar a associação dos aspectos clínicos e laboratoriais com os marcadores imunofenotípicos e as alterações citológicas, foram realizados testes de qui-quadrado considerando o intervalo de confiança de 95% (ou nível de significância de 0,05).
Área de naturalidade dos pacientes
Os pacientes pertencem às seguintes cidades e municípios: Belém, Abaetetuba, Barcarena, Altamira, Ananindeua, Moju, Pacajá, Marabá, Parauapebas, Vitória do Xingu, Porto de Moz, Breves, Itupiranga, Paragominas, Tomé-Açu, São Domingos do Capim, Irituia, Bragança, Acará, Salinópolis, Castanhal e Vigia. Todas as localidades são pertencentes ao estado do Pará, Brasil.
RESULTADOS
Quanto à idade de diagnóstico, observou-se que a grande maioria dos pacientes estava acima de 60 anos, com média de 61,23 anos (± 11,31) e um intervalo de 32 a 83 anos. Dentre esses, 58,70% eram homens, e 41,30% mulheres. Quanto à raça/etnia e à procedência, 19,57% se autodeclaram brancos, 26,09% pardos e 2,17% pretos, sendo 32,61% residentes em Belém/capital e 67,39% em outras localidades.
Das ocupações exercidas pelos pacientes, destacaram-se as de dona de casa e aposentado, com frequência de 17,39% cada, e o restante realizavam outras atividades diversificadas. Com relação ao histórico de câncer, quase 20% dos pacientes possuíam antecedente familiar positivo e apenas 4,35% antecedente pessoal positivo. A tabela 1 apresenta a caracterização geral do perfil epidemiológico e clínico da população em estudo. Ao diagnóstico, cerca de 78% desses apresentavam-se sintomáticos, sendo os sintomas B os mais encontrados.
Tabela 1
Características sociodemográficas e clínicas dos pacientes em estudo
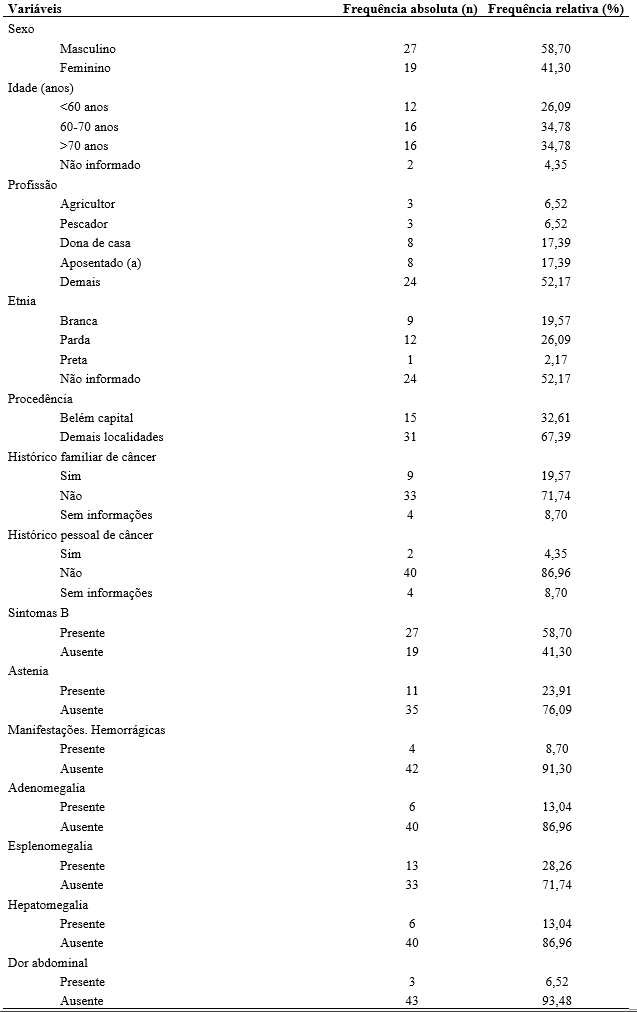
A maior parte dos pacientes analisados (50,00%) apresentava comorbidades e/ou complicações. Entre os 46 pacientes analisados, um percentual de 67,39% necessitou realizar tratamento para a LLC e 17,39% evoluíram para óbito.
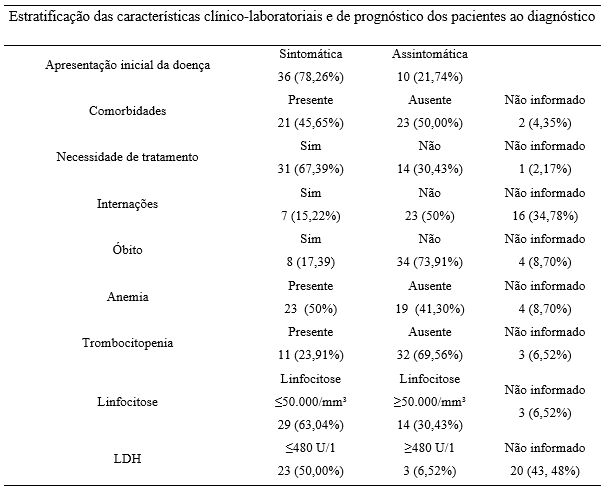
Os valores estatísticos das variáveis do hemograma, de LDH, bem como da presença de comorbidades, podem ser visualizados na Tabela 2. Quanto à concentração de hemoglobina, os dados mostraram que metade dos pacientes apresentava anemia no momento do diagnóstico, tomando-se como ponto de corte 11,5g/dL Avaliou-se também a prevalência de trombocitopenia, obtendo-se um percentual de 23,91% (n=11) com concentração de plaquetas abaixo do valor normal (150.000µL).
Tabela 2
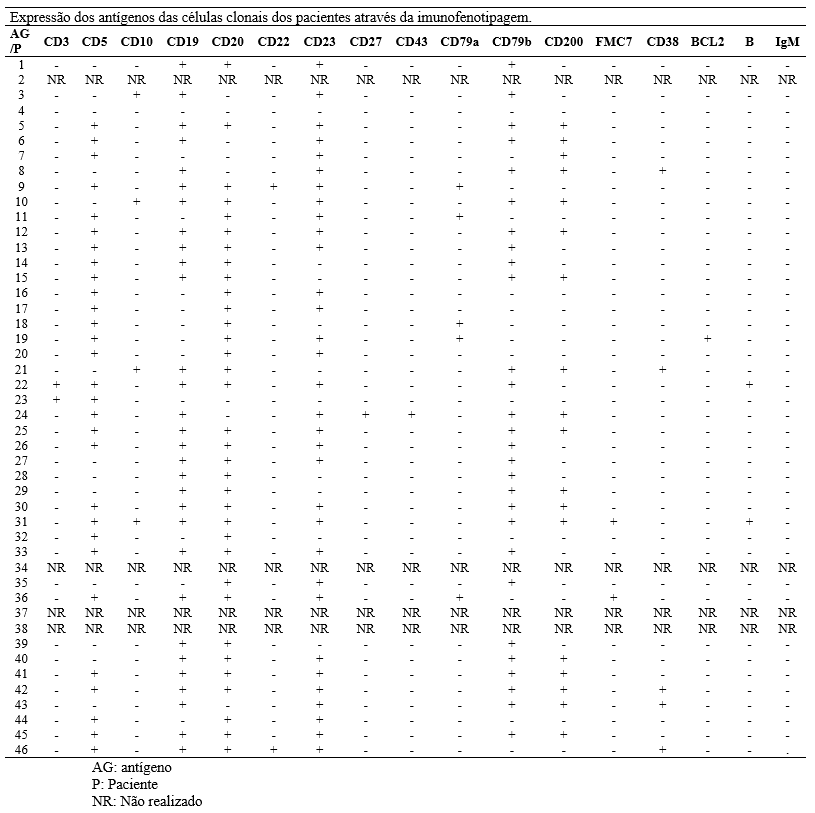
As características imunofenotípicas dos pacientes estão expressas na tabela 3. A análises dos exames de citometria de fluxo dos pacientes permitiu identificar que a maioria destes apresentavam expressão aumentada de CD23, CD19, CD5, CD20, CD200 e CD79b.
Tabela 3
Dos 46 pacientes incluídos na pesquisa, 42 possuíam o exame citogenético por FISH. Desses, 26 não apresentaram anomalias cromossômicas. Em 14 pacientes foi encontrada isoladamente uma alteração, sendo 7 pacientes com del13q, 2 pacientes com trissomia do cromossomo 12, 2 pacientes com deltp53, 2 pacientes com del11q e 1 paciente com del17p. Apenas 2 pacientes tinham dupla alteração citogenética, sendo 1 paciente com del17p e del13q e 1 paciente com del17p e deltp53. A mais frequente foi a del13q, identificada em 8 pacientes.
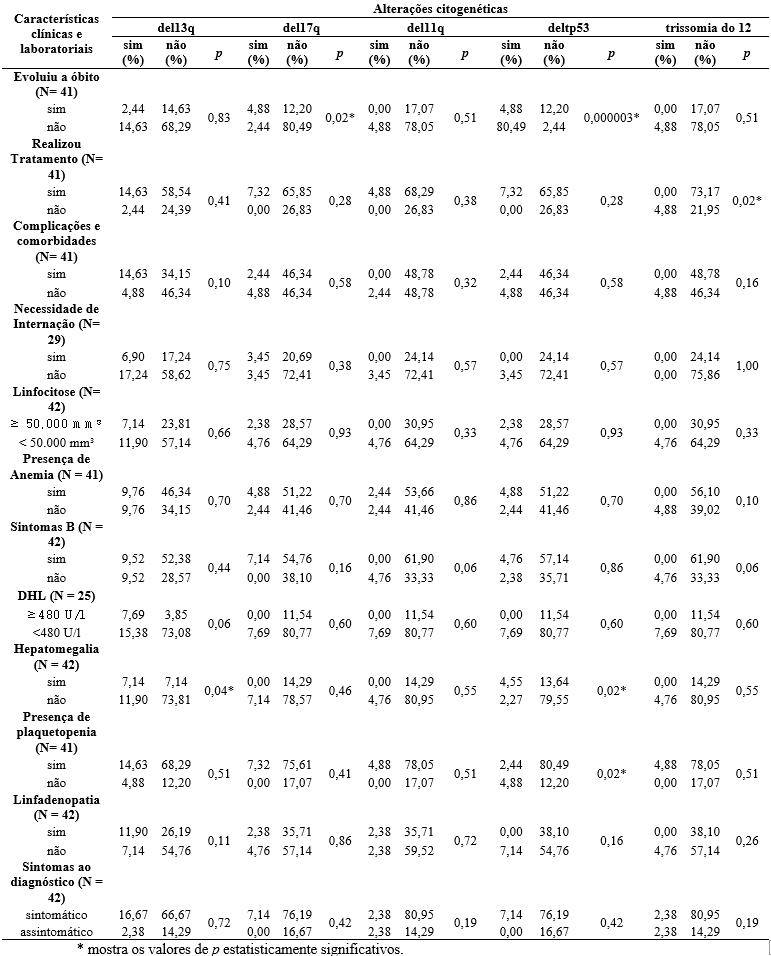
Os dados da associação entre as características clínicas e laboratoriais e marcadores imunofenotípicos e citogenéticos dos pacientes estão apresentados nas tabelas 4 e 5, utilizando o teste de qui-quadrado para análise de determinação de resultados estatisticamente significativos.
Tabela 4
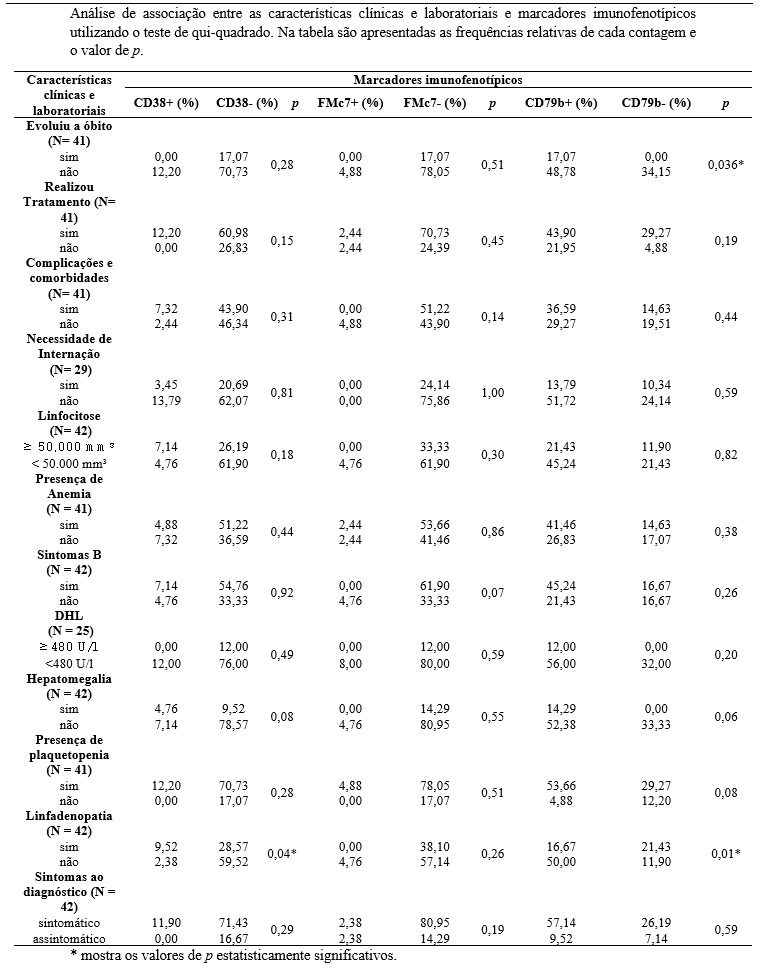
Tabela 5
DISCUSSÃO
Quanto à idade de diagnóstico, observou-se que a grande maioria dos pacientes estava acima de 60 anos, com média de 61,23 anos (± 11,31) e um intervalo de 32 a 83 anos. Dentre esses, 58,70% eram homens, e 41,30% mulheres. Dados em concordância com o registro brasileiro de LLC, divulgado recentemente, que mostrou mediana de idade de 66 anos, com 56% dos pacientes do sexo masculino, assim como em outras literaturas 9,10,11,12.
Houve leve predominância de pacientes da raça/etnia parda. Entretanto, mais da metade dos pacientes não possuíam essa informação nos prontuários. Segundo dados da The American Society of Hematology, cerca de 80% dos pacientes diagnosticados com LLC são da raça branca13.
Das ocupações exercidas pelos pacientes, destacaram-se as de dona de casa e aposentado, com frequência de 17,39% cada, e o restante realizavam outras atividades diversificadas. 32,61% residiam em Belém/capital e a grande maioria era proveniente de outras localidades.
Com relação ao histórico de câncer, quase 20% dos pacientes possuíam antecedente familiar positivo e apenas 4,35% antecedente pessoal positivo, porém sem especificação do tipo. Pesquisas apontam que a incidência de LLC é maior em indivíduos com histórico familiar para a doença14.
Em relação a apresentação clínica inicial, a grande maioria dos pacientes estavam sintomáticos, sendo os sintomas B os mais comuns, seguidos de esplenomegalia e astenia. Tal constatação é contrária à relatada na literatura, que mostra que até 70% dos pacientes apresentam-se inicialmente assintomáticos. Isso pode ser explicado pelo fato de que, segundo pesquisas, os pacientes de países em desenvolvimento costumam receber atendimento médico primário em estágios mais avançados. E pela qualidade e acesso aos sistemas de saúde, embora também haja influência de fatores ambientais e genéticos15,16,17.
Neste estudo, o sinal clínico mais frequente foi a esplenomegalia (28,26%), dado em consistência com os resultados encontrados no Registro Brasileiro de LLC9 (22%), mas inferior aos resultados mais elevados de Padaro et al18, Nwannadi et al19 e Hasan et al20 (71%, 72,2% e 64.8%, respectivamente). A hepatomegalia foi observada em 13,04% dos pacientes, semelhante aos dados do Registro Brasileiro de LLC (13%) e de Basabaeenet al21 (12,7%), mas inferior aos de Padaro et al18e Hasan et al20 (26% e 21,9%, respectivamente). Linfadenopatia foi observada em 13,04%, enquanto Tejaswi et al22 e Padaro et al18 relataram uma porcentagem maior em suas pesquisas (28% e 49%).
A frequência de anemia (50%) e plaquetopenia (23,91%) no estudo atual foi comparável à relatada em pesquisas anteriores em que o nível de hemoglobina e plaquetas abaixo de valores normais foi documentado em até 54,16% e 40%, respectivamente. Tais alterações hematimétricas são consideradas fatores de risco para uma evolução desfavorável e menor sobrevida, segundo Rai e Binet23,24.
Linfocitose acima de 50.000 foi encontrada em 30,43% dos pacientes. Estudo realizado na Nigéria demonstrou que pacientes com LLC que possuíam hiperleucocitose tiveram uma taxa de sobrevida mediana pior e estatisticamente significativa comparada aqueles com contagens de leucócitos mais baixas, sugerindo que uma alta carga tumoral é uma característica de mau prognóstico25.
A partir da confirmação do diagnóstico de LLC, torna-se de suma importância a análise da existência de comorbidades dos pacientes para prognóstico adequado. Dentro do presente estudo, 45,65% dos pacientes apresentaram comorbidades e complicações. Um estudo de base populacional com 400 pacientes com LLC identificou que 99,5% dos pacientes apresentaram pelo menos uma comorbidade ao diagnóstico. Um escore elevado de comorbidades influenciou negativamente na sobrevida relativa dos pacientes, mas sem efeito estatisticamente significativo na mortalidade26. Outroestudo semelhante, no entanto, identificou que pacientes idosos com disfunções renais possuíram mau prognóstico sob tratamento com fludarabina27.
As análises dos exames de citometria de fluxo dos pacientes permitiram traçar o perfil imunofenotípico destes. Os dados encontrados foram semelhantes aos referidos na literatura, tendo em vista que as células da LLC B tipicamente expressam CD5, CD19, CD23 e CD20028.
As características clínicas também estão ligadas com o padrão citogenético dos pacientes analisados. Constatou-se que a mais encontrada foi a del13q e a frequência foi semelhante à relatada na literatura (cerca de 48%). Foi identificado também significância estatística entre os indivíduos sem deleção 13q (del13q) e que não apresentaram hepatomegalia. Apesar disso, tal deleção quando encontrada está associada a uma resposta favorável, presença de sintomas leves e sobrevida mais longa. Isso pode variar se houver envolvimento de locus RB1 do gene, com progressão para formas mais graves29, 30.
Em pacientes com ausência da deleção do gene 17p (del17p) houve uma diminuição estatisticamente significativa dos óbitos (p<0,02). Tal resultado é elucidado por Sales31 ao averiguar a relação da del17p e seu acometimento especificamente na banda 17p13 do gene supressor tp53 corrobora para prognóstico desfavorável do paciente, sendo a interação genética mais ligada aos óbitos. Em contrapartida, a presença da deleção do gene tp53 (deltp53) relacionou-se com a diminuição dos óbitos nos pacientes (p<0,000003), dado contrário ao relatado na literatura. Isso pode ter ocorrido pela hipótese de que nem todos os pacientes foram submetidos a testes de mutação TP53, bem como ao fato de que a del17p resulta na perda de TP53, sendo necessária a análise conjunta de ambas as alterações como um marcador de prognóstico associado a resultados ruins36.
A ausência de hepatomegalia também foi averiguada em pacientes sem a deltp53. Contudo, a não presença dessa alteração foi estatisticamente associada à presença de plaquetopenia em 80,49% dos pacientes. Complicações autoimunes secundárias à LLC que alteram a hemodinâmica são conhecidas no quadro clínico do paciente: a trombocitopenia é comum inclusive na fase ativa da doença, podendo resultar na púrpura trombocitopênica idiopática32.
Em relação à expressão de CD79b, verificou-se relevância estatística entre sua presença e a diminuição de óbitos (p<0,036). Além disso, os pacientes acometidos por tal alteração não cursaram com linfadenopatia (p<0,01), a qual é considerada um dos fatores de mau prognóstico. No, entanto, o marcador CD79b possui papel fundamental no curso de neoplasias de células B, cuja presença está associada aos marcadores MY88D e NOTCH 1, responsáveis por resistência ao tratamento da LLC.Contudo, essa interação imunofenotípica é mais letal em pacientes acometidos por linfomas33.
Ainda sobre a relação linfadenopatia e CD79b, Onaindia33refere que esse marcador, principalmente sob presença de CD23, de CD200 e de FM7, é responsável por fazer diferenciação entre a imunofenotipagem da LLC com o Linfoma Linfocítico de Pequenas Células (LLPC), cuja interação entre estes quatro biomarcadores corroboram para o LLPC. Em contrapartida, Wierda et al6analisa que, além da interação dos marcadores pelo CD79b, o paciente precisa ter a linfadenomegalia acompanhada ou não de esplenomegalia provocada pela proliferação de linfócitos B na LLPC, cujos critérios não são obrigatórios para a LLC.
A expressão de CD38 nos pacientes foi estatisticamente associada a maior apresentação de linfadenopatia ao diagnóstico (p<0,04), sem relação com outras características clínicas. A super expressão de CD38 pode piorar o prognóstico da LLC e causar a progressão do curso da doença, resultando em apresentação de vários sintomas graves29. Estudo de caso-controle realizado com pacientes de LLC demonstrou que a positividade para CD38 estava relacionada a uma carga tumoral mais elevada. Assim, os marcadores sorológicos têm sido considerados preditores da carga tumoral e da progressão da doença34.
Quanto à necessidade de terapia específica, 31 pacientes a realizaram durante o período de estudo. A presença de trissomia do 12 foi estatisticamente associada a uma necessidade maior de tratamento nesses pacientes (p<0,02). Essa alteração é a segunda aberração cromossômica mais frequente na LLC, considerada de risco intermediário. Esses pacientes apresentam heterogeneidade clínica e biológica, porém seu impacto nas escolhas terapêuticas ainda é desconhecido35, 36.
A caracterização dos pacientes estudados contribui para um melhor esclarecimento acerca da evolução clínica e sua relação com alterações biológicas da LLC. Estes dados poderão contribuir para o aperfeiçoamento da análise prognóstica dos pacientes e decisão terapêutica. No entanto, o presente estudo apresenta algumas limitações importantes como: o pequeno número de pacientes avaliados e a ausência de alguns dados que não foram encontrados nos registros dos pacientes, impossibilitando uma análise mais precisa dos dados e suas associações.
Embora esta pesquisa não tenha possibilitado inferir causalidade entre a maioria das variáveis, os achados podem servir de base para estudos futuros sobre o assunto, sobretudo na região em questão, que carece de estudos que estabeleçam relações precisas entre os fatores clínicos e de patogênese da LLC.Nesse contexto, recomenda-se que os marcadores imunofenotípicos e citogenéticos sejam cada vez mais estudados em pesquisas multicêntricas e utilizados na prática clínica.
CONCLUSÃO
Diante das evidências, este estudo conseguiu determinar o perfil clínico-epidemiológico dos pacientes. Houve preponderância de indivíduos acima de 60 anos, pardos e negros, com discreto predomínio do sexo masculino, sendo provenientes do interior do estado. Em geral, não possuíam histórico familiar ou pessoal de câncer.A maioria dos pacientes apresentou sintomas B e anemia ao diagnóstico da LLC.
O estudo também visava analisar o impacto das alterações cromossômicas e dos biomarcadores moleculares nos parâmetros clínicos e hematológicos dos pacientes.A ausência de del17p na LLC conferiram menor ocorrência de óbito. No entanto, a presença de deltp53 esteve relacionada a diminuição de óbitos, menor ocorrência de plaquetopenia e maior ocorrência de hepatomegalia, diferente do relatado na maioria das literaturas.Não foi identificada a relação entre a presença da alteração citogenética de bom prognóstico (deleção 13q14) com o status clínico dos pacientes.
A presença de trissomia do 12 foi estatisticamente associada a uma necessidade maior de tratamento nesses pacientes.
O perfil imunofenotípico demonstrado nos exames dos pacientes com expressão de CD5, CD23 e CD19 foi o classicamente evidenciado na literatura. A presença de CD38 foi estatisticamente associada à ocorrência de linfadenopatia. O CD79b, por sua vez, foi relacionado a diminuição da ocorrência de óbitos e de linfadenopatia.
A limitação do presente estudo foi que avaliou a expressão de CD38 em apenas 50 pacientesse apenas uma vez durante o acompanhamento
REFERÊNCIAS
- Kikushige Y. Pathogenesis of chronic lymphocytic leukemia and the development of novel therapeutic strategies. J Clin Exp Hematop. 2020 Dec 15; 60(4):146-158. doi: 10.3960/jslrt.20036. Epub 2020 Nov 4. PMID: 33148933; PMCID: PMC7810248.
- Ostasov P, Robertson H, Piazza P, Datta A, Apperley J, Houdova L, et al. Evolution of Advanced Chronic Lymphoid Leukemia Unveiled by Single-Cell Transcriptomics: A Case Report. Front Oncol. 2020 Oct 30; 10:584607. doi: 10.3389/fonc.2020.584607. PMID: 33194728; PMCID: PMC7664833.
- Blanco DP, Segura MS, Marsán Suárez V, Hernández IC, & Abraham CM. Aspectos generales de algunas entidades dentro de los síndromes linfoproliferativos crónicos: la leucemialinfoide crónica. Instituto de Hematología e Inmunología. 2017; 33(4):15-24.
- Hallek M, Cheson BD, Catovsky D, Caligaris-Cappio F, Dighiero G, Döhner H, et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood. 2018 Jun 21; 131(25):2745-2760.
- Rodrigues CA, Gonçalves MV, Ikoma MR, Lorand-Metze I, Pereira AD, Farias DL, et al. Diagnosis and treatment of chronic lymphocytic leukemia: recommendations from the Brazilian Group of Chronic Lymphocytic Leukemia. Rev Bras Hematol Hemoter. 2016 Oct-Dec; 38(4):346-357. doi: 10.1016/j.bjhh.2016.07.004. Epub 2016 Aug 20. Erratum in: Rev Bras Hematol Hemoter. 2017 Jan – Mar; 39(1):93-94. PMID: 27863764; PMCID: PMC5119662.
- Wierda WG, Byrd JC, Abramson JS, Bilgrami SF, Bociek G, Brander D, et al. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma, Version 4.2020, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2020 Feb; 18(2):185-217.
- Lemal R, Tournilhac O. State-of-the-art for CAR T-cell therapy for chronic lymphocytic leukemia in 2019. Journal for immunotherapy of cancer. 2019; 7(1), 1-6.
- Parikh SA, Gale RP, Kay NE. Chronic lymphocytic leukemia in 2020: a surfeit of riches? Leukemia. 2020 Aug; 34(8):1979-1983.
- Gonçalves MV, Rodrigues CA, Lorand Metze IGH, Lacerda MP, de Lourdes Lopes Ferrari Chauffaille M, Azevedo A, Machado C, et al. Chronic lymphocytic leukemia in Brazil: A retrospective analysis of 1903 cases. Am J Hematol. 2017 Aug; 92(8):E171-E173
- Chan TS, Lee YS, Del Giudice I, Marinelli M, Ilari C, Cafforio L, Guarini A, Tan D, Phipps C, Goh YT, Hwang W, Goh AZ, Siu LL, Wu S, Ha CY, Lin SY, Kwok CH, Lau CK, Wong KF, Foà R, Kwong YL, Tse E. Clinicopathological features and outcome of chronic lymphocytic leukaemia in Chinese patients. Oncotarget. 2017 Apr 11; 8(15):25455-25468. doi: 10.18632/oncotarget.16037. PMID: 28424415; PMCID: PMC5421943.
- Santoyo-Sánchez A, Ramos-Peñafiel CO, Saavedra-González A, González-Almanza L, Martínez-Tovar A, Olarte-Carrillo I, et al. Frecuencias de edad y género de pacientes con leucemia en dos centros de referencia del Valle de México. Gaceta médica de México. 2017. 153(1):44-48.
- Lopes GS. Avaliação clínico-epidemiológica e molecular de pacientes com leucemia linfocítica crônica atendidos no Hospital Universitário Walter Cantídio. [Dissertação]. Fortaleza: Universidade Federal do Ceará; 2019.
- Narra RK, Atallah EL, Hamadani M, & Guru Murthy GSG. Population Level Outcomes of Chronic Lymphocytic Leukemia in the Era of Targeted Agents-Analysis of Surveillance Epidemiology and End Results (SEER) Database. Blood 2019; 134 Suppl 1:1757.
- Rai KR, Jain P. Chronic lymphocytic leukemia (CLL)-Then and now. Am J Hematol. 2016 Mar; 91(3):330-40. doi: 10.1002/ajh.24282. PMID: 26690614.
- Condoluci A, Terzi di Bergamo L, Langerbeins P, Hoechstetter MA, Herling CD, De Paoli L, et al. International prognostic score for asymptomatic early-stage chronic lymphocytic leukemia. Blood. 2020 May 21; 135(21):1859-1869.
- Miranda-Filho A, Piñeros M, Ferlay J, Soerjomataram I, Monnereau A, Bray F, et al. Epidemiological patterns of leukaemia in 184 countries: a population-based study. Lancet Haematol. 2018 Jan; 5(1):e14-e24.
- Payandeh M, Sadeghi E, Sadeghi M. Survival and Clinical Aspects for Patients with Chronic Lymphocytic Leukemia in Kermanshah, Iran. Asian Pac J Cancer Prev. 2015; 16(17):7987-90.
- Padaro E, Layibo Y, Kueviakoe IDM, Agbétiafa K, Magnang H, Koudokpo NDA, et al. Caractéristiques de la leucémie lymphoïde chronique au Togo [Characteristics of chronic lymphocytic leukemia in Togo]. Pan Afr Med J. 2019 Oct 11; 34:84. French. doi: 10.11604/pamj.2019.34.84.18752. PMID: 31934227; PMCID: PMC6945677.
- Nwannadi AI, Onoja MA, Mke A. Epidemiology and Clinical Profile of Patients with Chronic Lymphocytic Leukaemia in a Tertiary Hospital in Nigeria. J Res Bas Clin Sci. 2019 Mar; 1(1):36-40.
- Hasan KM. Clinical Aspects, Immunophenotypic Analysis and Survival Rate of Chronic Lymphocytic Leukaemia Patients in Erbil City, Iraq. Sultan Qaboos Univ Med J. 2018 Nov; 18(4):e461-e467. doi: 10.18295/squmj.2018.18.04.006. Epub 2019 Mar 28. PMID: 30988964; PMCID: PMC6443287.
- Basabaeen AA, Abdelgader EA, Babekir EA, Eltayeb NH, Altayeb OA, Fadul EA, et al. Clinical presentation and hematological profile among young and old chronic lymphocytic leukemia patients in Sudan. BMC research notes. 2019; 12(1): 202.
- Tejaswi V, Lad DP, Jindal N, Prakash G, Malhotra P, Khadwal A, et al. Chronic Lymphocytic Leukemia: Real-World Data From India. JCO Glob Oncol. 2020 Jun; 6:866-872. doi: 10.1200/GO.20.00032. PMID: 32579486; PMCID: PMC7328099.
- Binet JL, Auquier A, Dighiero G, Chastang C, Piguet H, Goasguen J, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer. 1981 Jul 1; 48(1):198-206.
- Ayman FA, Sabry AS, Atef M, Mahmoud A. Clinico-Hematologic Profile of Chronic Lymphocytic Leukemia inEgypt: A Three-Center Experience. The Medical Journal of Cairo University. 2021 Mar; 89: 9-17.
- Korubo, K. I., Okite, U. P., & Ezeugwu, S. I. (2021). Chronic Lymphocytic Leukemia: Prognostic Factors at Presentation in a Resource-Limited Center. JCO Global Oncology. 2021; 7:56-62.
- Villavicencio A, Solans M, Zacarías-Pons L, Vidal A, Puigdemont M, Roncero JM, et al. Comorbidities at Diagnosis, Survival, and Cause of Death in Patients with Chronic Lymphocytic Leukemia: A Population-Based Study. Int J Environ Res Public Health. 2021 Jan 15; 18(2):701. doi: 10.3390/ijerph18020701. PMID: 33467494; PMCID: PMC7830671
- Soares TB. Impacto da Função Renal na Sobrevida Global dos Pacientes Portadores de Leucemia Linfocítica Crônica Tratados no Hospital de Clínicas de Porto Alegre [Dissertação]. Porto Alegre: Universidade Federal do Rio Grande do Sul; 2018. 37 p. Mestrado em Medicina.
- Kipps TJ, Stevenson FK, Wu CJ, Croce CM, Packham G, Wierda WG, et al. Chronic lymphocytic leukaemia. Nat Rev Dis Primers. 2017 Jan 19;3:16096.
- Patkar N, Rabade N, Kadam PA, Mishra F, Muranjan A, Tembhare P, et al. Immunogenetics of chronic lymphocytic leukemia. Indian J Pathol Microbiol. 2017 Jan-Mar; 60(1):38-42.
- Tari K, Shamsi Z, Reza Ghafari H, Atashi A, Shahjahani M, Abroun S, et al. The role of the genetic abnormalities, epigenetic and microRNA in the prognosis of chronic lymphocytic leukemia. Exp Oncol. 2018 Dec;40(4):261-267.
- Sales SB. Alterações Genéticas na Leucemia Linfocítica Crônica [Tese]. Brasília: Academia de Ciência e Tecnologia; 2020. 9 p. Especialização em hematologia e Banco de Sangue.
- Paul S, Jain N, Ferrajoli A, O’Brien S, Burger J, Keating M, Wierda W. A phase II trial of eltrombopag for patients with chronic lymphocytic leukaemia (CLL) and thrombocytopenia. Br J Haematol. 2019 May; 185(3):606-608.
- Onaindia A, Medeiros LJ, Patel KP. Clinical utility of recently identified diagnostic,prognostic, and predictive molecularbiomarkers in mature B-cell neoplasms. Modern Pathology [Internet]. 2017 Jun 30 [cited 2021 May 11]:1-29. DOI 10.1038/modpathol.2017.58. Available from: https://www.nature.com/articles/modpathol201758
- Attia HRM, Ibrahim MH, El-Aziz SHA, Abdelrahman AH, Sobeih ME, Hagag HAA, et al. Avaliação de variáveis prognósticas na leucemia linfocítica crônica e associação com o estágio da doença. Mol Clin Oncol. Maio de 2021; 14 (5): 100. doi: 10.3892 / mco.2021.2262. Epub 2021 13 de março. PMID: 33796290; PMCID: PMC8010509.
- Roos-Weil D, Nguyen-Khac F, Chevret S, Touzeau C, Roux C, Lejeune J, et al. Mutational and cytogenetic analyses of 188 CLL patients with trisomy 12: A retrospective study from the French Innovative Leukemia Organization (FILO) working group. Genes Chromosomes Cancer. 2018 Nov; 57(11):533-540. doi: 10.1002/gcc.22650. Epub 2018 Sep 11. PMID: 30203893.
- CLL Society. Prognostic Factors in CLL. 2017. Disponível em: https://cllsociety.org/2017/09/prognostic-factors-cll/ (acessado em 11/05/2021).
1Médico, Fundação Santa Casa de Misericórdia do Pará, Belém, Pará, Brasil.
2Médica pela Universidade do Estado do Pará – UEPA, campus Belém, Pará, Brasil.
3Biomédica, Drª em Genética e Biologia Molecular. Docente da Universidade do Estado do Pará – UEPA, campus Belém, Pará, Brasil.
4Biomédica, Mestranda do Programa de Pós-Graduação em Biologia parasitária da Amazônia da Universidade do Estado do Pará/Instituto Evandro Chagas.
5Médico, Fundação Santa Casa de Misericórdia do Pará, Belém, Pará, Brasil.
6Médico, Fundação Santa Casa de Misericórdia do Pará, Belém, Pará, Brasil.
7Universidade do Estado do Pará, Centro de Ciências Biológicas e da Saúde
8Médico, Universidade do Estado do Pará – UEPA, campus Belém, Pará, Brasil.
9Médico, Fundação Santa Casa de Misericórdia do Pará, Belém, Pará, Brasil.
