REGISTRO DOI: 10.5281/zenodo.7830037
Kaê Duarte Gonçalves
Profª. D. SC. Tania Maria Cavalcanti Nogueira
RESUMO
Segundo a literatura a ser apresentada, a diferença entre os mecanismos de corrosão das ligas binárias Al-Cu e Al-Si, torna possível a variação do mecanismo de resistência à corrosão das ligas ternárias Al-Cu-Si, devido o fenômeno da macrossegregação do Cu. O presente projeto avaliará essa afirmação por meio da análise de composições químicas e da determinação da densidade de corrente de corrosão de superfícies de corpos de prova retirados ao longo de amostra da liga ternária Al-6Cu-3Si e Al-6Cu-1Si.
Palavras-chave: Al-Cu; Al-Si; Al-6Cu-3Si; Al-Cu-Si; Al-6Cu-1Si; macrossegregação inversa; mecanismo resistência à corrosão.
ABSTRACT
According to the literature, the difference between the corrosion’s resistance mechanism present on the binaries, Al-Cu and Al-Si alloys, provides its variation as the micro structural development of the ternaries Al-Cu-Si alloys, due to the copper‘s macro segregation. This project is going to value the affirmative above, analyzing the chemical compositions and corrosion’s current densities of the surfaces along the sample of the ternary Al-6Cu-3Si and Al 6Cu-1Si alloys.
Keywords: Al-Cu; Al-Si; Al-6Cu-3Si; Al-Cu-Si; Al-3Cu-1Si; inverse macrosegregation; corrosion’s resistance mechanism.
- INTRODUÇÃO
Como objetivo do projeto, avaliamos o comportamento frente à corrosão de da liga ternária de Al6Cu3Si e Al6Cu1Si, própria para a fundição em meio, é claro, a uma série de restrições – parâmetros a serem detalhados na revisão bibliográfica – que tornará a análise, passível de comparação com os resultados obtidos na literatura, sem deixar de discutir qualquer não conformidade com o esperado.
- REVISÃO BIBLIOGRÁFICA
2.1. Fundamentos da Corrosão
O termo corrosão era usado, até pouco tempo, para descrever um determinado tipo de deterioração dos metais, não se aplicando a materiais não metálicos, conforme explica o Prof. H. H. Uhlig, um dos pioneiros americanos do estudo da corrosão, no Departamento de Metalurgia do Instituto Tecnológico de Massachusetts (M.I.T.) [1].
Entretanto, na conceituação mais moderna, entende-se por corrosão a deterioração dos materiais pela ação química ou eletroquímica do meio ambiente associada ou não a esforços mecânicos. Expresso dessa forma, o conceito abrange materiais metálicos e não metálicos [1].
Em geral, nos processos de corrosão, os metais reagem com os elementos não metálicos presentes no meio, particularmente o oxigênio e o enxofre, produzindo compostos semelhantes aos encontrados na natureza, dos quais foram extraídos. Conclui-se, portanto, que nestes casos, a corrosão corresponde ao inverso dos processos metalúrgicos. Com exceção dos metais nobres, ouro, platina, prata, mercúrio e cobre que existem no estado combinado, ou seja, na forma de minerais ou minérios – forma termodinamicamente mais estável [1].
2.1.1. Tipos de corrosão segundo a forma de desgaste
A forma de desgaste é muito importante nos processos corrosivos, deste modo é comum caracterizar processos corrosivos sem uma causa característica, mas pela própria morfologia da perda de material [2].
Os principais processos corrosivos associados à forma de desgaste são: a corrosão uniforme ou generalizada, a corrosão localizada alveolar e a corrosão por pites [2].
2.1.1.1. Corrosão uniforme
Consiste no ataque de toda a superfície metálica em contato com o meio corrosivo de maneira aproximadamente uniforme, o que não significa que possa ser negligenciada, pois pode levar o equipamento ou instalação a falhas significativas [2].
Esse tipo de corrosão ocorre em geral devido a micropilhas de ação local e é, provavelmente, o mais comum dos tipos de corrosão, principalmente nos processos corrosivos de estruturas expostas à atmosfera e outros meios que ensejam uma ação uniforme sobre a superfície metálica [2].
2.1.1.2. Corrosão localizada
Caracteriza-se pelo desgaste em pontos ou regiões determinadas, enquanto outras não apresentam desgaste ou mostram um desgaste muito pouco pronunciado [2].
2.1.1.2.1. Corrosão alveolar
É uma forma de corrosão localizada que consiste na formação de cavidades de pouca profundidade. Ocorre em determinados pontos da superfície, enquanto o restante apresenta pouco desgaste. É característica de materiais heterogêneos ou de meios que apresentam heterogeneidade. Pode ser acelerada por frestas e outros fatores geradores de heterogeneidades como cordão de solda, acúmulo de água e etc. [2].
2.1.1.2.2. Corrosão por pites
É uma forma de corrosão localizada que consiste na formação de cavidades de pequena extensão e razoável profundidade. Ocorre também em determinados pontos da superfície, enquanto o restante pode permanecer praticamente não atacado. Característica dos materiais metálicos formadores de películas protetoras, passiváveis, resulta de modo geral, da atuação da pilha ativa / passiva nos pontos os quais a camada passiva é rompida [2].
Esse tipo de corrosão é de mais difícil acompanhamento quando no interior de equipamentos e instalações, uma vez que o controle da perda de espessura não caracteriza o desgaste verificado [2].
Nos materiais passiváveis, a quebra da passividade ocorre, em geral, pela ação dos chamados íons halogenetos (Cl –, Br –, I –, F –) e esta dissolução localizada da película gera uma área ativa que, diante do restante passivado, provoca uma corrosão muito intensa e localizada. Uma grandeza importante neste caso é o potencial de formação dos pites, ou seja, o potencial em que haja a quebra da passividade [2].
Outro aspecto importante é o mecanismo de formação dos pites, já que a falha se inicia em um ponto de fragilidade da película passivadora. Resulta daí que a pequena área ativa formada diante de uma grande área catódica provoca a corrosão intensa e localizada [2].
2.2. Fundamentos da Eletroquímica
Do ponto de vista químico, oxidação é quando um elemento perde ou doa elétrons para outro elemento. Ao processo inverso dá-se o nome de redução. Assim um elemento A se oxida doando elétrons a outro elemento B e age como redutor deste. O elemento B se reduz pelo ganho de elétrons oriundos de A e age como um oxidante deste [4].
Sendo A e B metais, imergindo A em uma solução condutora surge uma diferença de potencial de natureza elétrica e química, isto é, uma diferença de potencial eletroquímico. Se B for inserido, este formará uma diferença de potencial eletroquímico com o meio diferente do formado com A. Colocando-os em contato elétrico dar-se-á uma diferença entre seus potenciais e os elétrons irão fluir do metal com potencial de redução mais negativo, para o potencial de redução mais positivo [4].
A partir da descrição acima temos a célula galvânica. O metal que fornece elétrons é o eletrodo negativo, chamado ânodo, onde ocorrem as reações de oxidação. Conforme o metal libera os elétrons ele se oxida e forma cátions que são liberados na solução. O metal que recebe os elétrons é o eletrodo positivo, chamado cátodo, onde ocorrem as reações de redução. [4].
Para melhor classificar a tendência de um elemento em se reduzir com relação a outro foi criada a tabela de potenciais de eletrodo padrão, que referencia o potencial necessário para um material se reduzir ou se oxidar com relação ao eletrodo padrão de hidrogênio, definido como potencial zero [4].
Assim, o potencial de eletrodo padrão de um elemento é a diferença de potencial expressa entre o elemento e uma solução de 1 mol/L de seus íons em relação ao eletrodo padrão de hidrogênio, porém os meios aos quais um metal é exposto são variados e seu potencial efetivo será diferente dos encontrados nas tabelas , potencial de corrosão [4].
Um eletrodo de hidrogênio consiste de um eletrodo de platina imerso em uma solução de íons hidrogênio na qual o hidrogênio gasoso a uma atmosfera é borbulhado. Devido à dificuldade de confecção e uso do eletrodo de hidrogênio, outros eletrodos de referência, como o eletrodo de calomelano, são frequentemente preferidos na prática e os potenciais de equilíbrio medidos com a ajuda desses eletrodos de referência podem ser facilmente convertidos para a escala de hidrogênio (caso seja requerido) [1].
2.2.1. Polarização
Polarização é a modificação do potencial de um eletrodo devido a variações de concentração, sobrevoltagem de um gás ou variação de resistência ôhmica (mecanismos que controlam as reações eletroquímicas) [2].
Quando as reações de corrosão são controladas predominantemente por polarização nas áreas anódicas, diz-se que a reação é controlada anódicamente e que o eletrodo está sob efeito de uma polarização anódica. Da mesma forma, quando as reações de corrosão são controladas predominantemente por polarização nas áreas catódicas, diz-se que a reação é controlada catodicamente e que o eletrodo está sob efeito de uma polarização catódica e quando ela é controlada pelo aumento da resistência de contato das áreas anódicas e catódicas, diz-se que a reação é controlada ohmicamente. De um modo geral tem-se um controle misto das reações de corrosão [2].
2.2.1.1. Tipos de polarização
2.2.1.1.1. Polarização ôhmica
Consequência da resistência elétrica oferecida pela presença de uma película de produtos sobre a superfície do eletrodo, a qual diminui o fluxo de elétrons para a interface, onde se dão as reações com o meio [3].
2.2.1.1.2. Polarização por Concentração
É causada pelo retardamento das reações ou de fases das reações na superfície anódica e da rarefação de H2 sobre a superfície catódica. Logo, a velocidade de difusão dos ânions para longe do ânodo é menor do que a velocidade com que os elétrons advindos do cátodo chegam à superfície anódica, o que acarreta a mudança de potencial [3].
Caso o eletrólito possua movimentação, ambas as situações têm pouca probabilidade de acontecer [3].
2.2.1.1.3. Polarização por Ativação
Este tipo de polarização ocorre devido à sobrevoltagem de gases no entorno dos eletrodos. Os casos mais importantes no estudo são aqueles em que há liberação de H2 no entorno do cátodo ou de O2 no entorno do ânodo [2].
A liberação de H2 no entorno do cátodo é denominada polarização catódica e assume particular importância como fator de controle dos processos corrosivos [2].
Em eletrólitos pouco aerados, o H2liberado e absorvido na área catódica provoca uma sobretensão ou sobrevoltagem de hidrogênio capaz de reduzir sensivelmente a agressividade do meio, podendo-se considerar por esse fato a corrosão do aço como desprezível na presença de água doce ou salgada, totalmente desaerada [2].
2.2.2. Curvas de polarização
Quando em uma célula galvânica dois metais são expostos em contato elétrico, estabelece-se uma diferença de potencial inicial, igual à diferença entre os potenciais iniciais de corrosão dos metais individuais. Com o passar do tempo o potencial do cátodo diminui e o potencial do ânodo aumenta até se encontrarem em um determinado potencial, o potencial de corrosão da célula. A corrente que circula também pode variar até um valor máximo chamado corrente de corrosão. Esse comportamento pode ser obtido através do levantamento de curvas de polarização, se utilizando um potenciostato ajustado para os seguintes métodos [4].
2.2.2.1. Método galvanostático
Método de obtenção das curvas de polarização que utiliza a corrente como a variável de controle que circula no sistema. A variação da corrente é procedida por meio de uma resistência variável acoplada ao circuito. [2].
2.2.2.2. Método potenciostático
No método potenciostático a variante é o potencial aplicado ao corpo de prova, que pode ser variado tanto no sentido anódico como no catódico (potencial do metal com relação ao eletrodo de referência) e cada valor de potencial imposto ao sistema demanda certa corrente a ser suprida pelo próprio potenciostato. [2].
2.2.3. Equação de Butler-Volmer e Equação de Tafel
No estudo da cinética eletroquímica, a equação geral que relaciona a densidade de corrente resultante i com o sobrepotencial aplicado ɳ – é a equação de Butler-Volmer, válida apenas dentro dos limites do mecanismo de polarização por ativação (trabalha-se com a hipótese de que a velocidade do processo é determinada por uma barreira energética de ativação) [5].
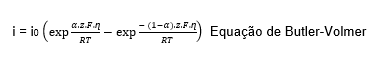
Na qual:
i – Densidade de corrente ( A.cm-2 );
i0 – Densidade de corrente de troca ( A.cm-2 );
α – Coeficiente de transferência;
z – Número de elétrons;
F – Constante de Faraday ( 96487 C );
ɳ – Sobrepotencial ( V );
R – Constante universal dos gases perfeitos ( 8,314 J.mol-1. K-1 );
T – Temperatura absoluta ( K ).
A equação de Butler-Volmer ainda pode ser simplificada para módulos de sobrepotencial maiores que 0,118 V/n, a partir do qual em uma polarização anódica, o termo referente à densidade de corrente catódica é desprezível e em uma polarização catódica o termo referente à densidade de corrente anódica é desprezível [5].
n- número de elétrons envolvidos na reação.
A essa equação simplificada dá-se o nome de equação de Tafel e ainda pode ser modificada para a sua equiparação com uma equação do primeiro grau ɳ = a + blog |i| [5]
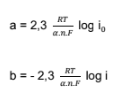
.Figura 1. Gráfico representativo da curva de polarização anódica (azul) e catódica (preta) [4].
Ao ser traçada a relação entre os potenciais aplicados ao material, pelo potenciostato, e as densidades de corrente correspondentes, obtém-se a curva de polarização, na qual se pode retirar o potencial de corrosão (potencial para o qual a densidade de corrente é nula) e em posse dessa informação, com a transformação da curva de polarização, de E x i para E x Log|i|, determinar a densidade de corrente de corrosão [5].
2.3. Ligas de interesse
2.3.1. Liga Alumínio-Cobre
São ligas de alta resistência mecânica, boa resistência à corrosão (contudo, limitada se comparada às demais ligas de Al) e alta fundibilidade, o que as torna de grande aproveitamento nas fundições [6].
Algumas das maiores aplicações das ligas de Al-Cu são pistões, hélices de aviões, rebites, peças forjadas para estrutura em geral, parafusos e cabeçotes de motores [7].
Figura 2. Diagrama Al-Cu
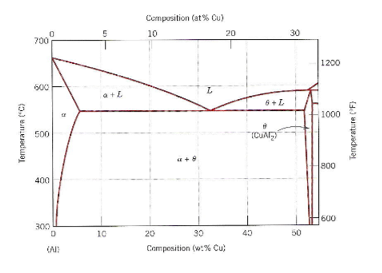
Fase α: Corresponde a uma solução sólida primária substitucional, CFC, macia e dúctil, na qual o teor máximo de Cu é de 5,65% a 548°C. Na temperatura ambiente a solubilidade do Cu é inferior a 0,25% [7].
Fase Θ: corresponde ao composto CuAl2 [7].
As principais ligas de Al e Cu são as que contêm entre 6 e 8% de Cu, utilizadas em fundição e as que contém até 4 % de Cu, utilizadas tanto para fundição como raramente para serem trabalhadas. [8].
Quanto à corrosão, uma microestrutura refinada hipoeutética é mais resistente devido maior homogeneidade na distribuição de CuAl2 (responsável pelo aumento da resistência mecânica, porém funciona como catodo frente à matriz rica em alumínio, aumentando a susceptibilidade à pites de corrosão).
2.3.2. Liga Alumínio-Silício
São as ligas binárias mais importantes depois das ligas de Al-Cu. Possuem baixa densidade, baixo coeficiente de expansão térmica e pouca contração de solidificação. Além disso, apresentam boa resistência à corrosão, elevadas condutibilidades elétrica e térmica e boa fundibilidade [7].
Figura 3. Diagrama Al-Si
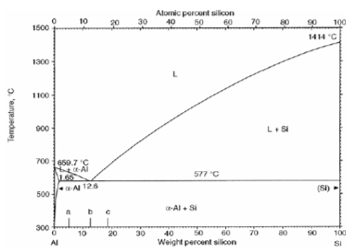
As fases envolvidas no sistema Al-Si são:
α – CFC, macia e dúctil, rica em alumínio.
β – Estrutura cúbica tipo diamante, muito dura e frágil, rica em silício.
Na temperatura ambiente, em condições de resfriamento muito lento, as ligas Al-Si são constituídas de Al e Si praticamente puros [7].
Normalmente as ligas Al-Si são utilizadas como peças fundidas – Ligas com teor de Si variando, geralmente, entre 8 a 12% [7].
As vantagens em se trabalhar com ligas de maiores teores de Si são que a resistência e o alongamento são aumentados. Todavia, à medida que o teor de Si cresce, sua usinagem torna-se mais difícil, devido à presença do constituinte [6].
Quanto à corrosão, é favorecida por microestrutura hipoeutética na qual exista coerência entre a matriz α, rica em alumínio, e as partículas de Si, garantam maior quantidade da fase rica em Si, mistura eutética, de crescimento suave e facetado, em detrimento da fase rica em alumínio, α, de superfície grosseira, áspera e contornos não muito bem conformados que favorecem a ação corrosiva [10].
2.3.3. Liga Alumínio-Cobre-Silício
São ligas para fundição, possuindo excelente moldabilidade, boa estanqueidade (ideal para fundir peças que devam resistir à pressão) e melhores propriedades mecânicas que as ligas binárias simples e boa resistência à corrosão [6].
O sistema de ligas Al-Cu-Si é amplamente utilizado, tanto na indústria automobilística quanto aeronáutica, principalmente como materiais estruturais leves ou também como pequenos conectores em sistemas microeletrônicos [10].
A análise da corrosão do sistema ternário mencionado acima não é facilmente encontrada na literatura, contudo sabe-se que a corrosão não será só dependente da composição química como também da microestrutura encontrada nessas ligas [10].
Figura 4. Constituintes das ligas ternárias Al-Cu-Si [10].
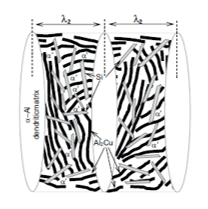
Dendritas (α) – Rica em Al
Região interdendrítica – α’ + Si + CuAl2
α’ – Rica em Al
2.4. Literatura base
A diferença no mecanismo de resistência à corrosão das ligas binárias: Al-Cu e Al-Si torna interessante o estudo do mecanismo de resistência à corrosão presente nas ligas ternárias Al-Cu-Si, devido à sua possível variação, conforme o desenvolvimento microestrutural da liga fundida [10].
Foi encontrado, em solidificação direcional, que a porcentagem de silício e cobre, conforme a posição da amostra fundida estudada variou segundo fenômeno de macrossegregação inversa de Cu e Si, do Cu principalmente – Maiores porcentagens desses elementos na região primeiramente solidificada – E que, como consequência, variou-se o mecanismo de resistência à corrosão no sistema [10].
Para a região resfriada mais rapidamente, região cujo predomínio foi da macrossegregação inversa de cobre, o elemento teria servido como força motriz ao decréscimo da resistência à corrosão em direção a estruturas mais grosseiras até que sua quantidade se reduziu o suficiente para a influência do Si fosse predominante e o mecanismo de resistência à corrosão fosse o mesmo presente nas ligas binárias Al-Si [10].
2.4.1. Solidificação direcional
Em uma solidificação direcional, o recipiente ou molde a receber o material fundido é desenhado de maneira que o calor seja extraído somente pela base resfriada com água, promovendo uma solidificação em direção vertical [10].
2.4.2. Macrossegregação inversa
Em alguns casos, particularmente nas ligas com grande intervalo de solidificação, o líquido presente entre as dendritas é bombeado para trás da frente de solidificação. Portanto a concentração de soluto diminui da periferia para o centro da peça. Há casos em que o líquido (rico em impurezas) chega a sair pelas paredes da peça (a peça “transpira”), sendo tal fenômeno denominado exsudação [10].
2.5. Microscopia eletrônica de Varredura (MEV)
O microscópio eletrônico de varredura é um equipamento capaz de produzir imagens de alta ampliação (até 300.000x) e alta resolução. As imagens fornecidas pelo MEV possuem um caráter virtual, pois o que é visualizado no monitor do aparelho é a transcodificação da energia emitida pelos elétrons, ao contrário da radiação de luz a qual estamos habitualmente acostumados [9].
Basicamente o MEV pode ser subdividido em duas partes principais: a coluna e a câmara de amostras [9].
A coluna é mantida sob vácuo inferior a 10-4 Torr, contém em sua porção superior um canhão de elétrons e, abaixo deste, lentes magnéticas para a focalização de um fino feixe de elétrons sobre a amostra. A quantidade de corrente no feixe de elétrons incidente sobre a amostra determina a intensidade dos sinais a serem emitidos, a qual, por sua vez, é diretamente proporcional ao diâmetro do feixe, implicando no ajuste dos controles do microscópio para a otimização da condição de operação desejada: alta resolução (feixe de 3 a 10 nm de diâmetro), elevada profundidade de foco ou microanálise (feixe de 0,2 a 1 μm de diâmetro). A fonte mais usual de elétrons corresponde à emissão termo-iônica gerada a partir de um filamento de tungstênio aquecido a 2700 K e mantido em um potencial negativo de 5 a 40 kV. Alternativamente, pode-se recorrer a um filamento de LaB6 que fornece uma maior densidade de corrente, em temperatura inferior à do tungstênio (1800 K). Além de um brilho de 5 a 10 vezes superior e vida útil substancialmente maior, cerca de 700 a 100 horas, contra 20 a 50 horas do filamento de tungstênio. [9].
A câmara de amostras conta com diferentes tipos de detectores para captar os sinais gerados na interação elétrons-amostra e um suporte, motorizado ou não, que possibilita a movimentação das amostras em três eixos (x.y e z), além de rotação e inclinação lateral. Duas concepções construtivas são adotadas no que se refere às condições de vácuo: alto vácuo equivalente àquele existente na coluna, e baixo vácuo (10-2 Torr); esta última necessitando o emprego de um detector especial para a coleta de imagens de topografia [9].
2.6. Espectroscopia por energia dispersiva de raios X (EDS)
É um acessório essencial no estudo de caracterização microscópica de materiais. Quando o feixe de elétrons incide sobre um mineral, os elétrons mais externos dos átomos e os íons constituintes são excitados, mudando de níveis energéticos. Ao retornarem para sua posição inicial, liberam a energia adquirida a qual é emitida em comprimento de onda no espectro de raios-x. Um detector instalado na câmara de vácuo do MEV mede a energia associada a esse elétron. Como os elétrons de um determinado átomo possuem energias distintas, é possível, no ponto de incidência do feixe, determinar quais os elementos químicos se fazem presentes naquele local e assim identificar a composição química do que está sendo observado [9].
- MATERIAIS E MÉTODOS
3.1. A preparação da amostra e dos corpos de prova
▪ Metais comercialmente puros – Al (99,72 wt%), Cu (99,92 wt%) e Si (99,68 wt%) ▪ Lixas d’água para metais NORTON
Abrasivo: Carbureto de Silício
Granulometrias: 200, 400, 600, 800, 1000 e 1200 mesh
▪ Panos para polimento de não ferrosos
▪ Pasta de diamante de 6, 3 e 1 μm
A amostra da liga fundida de interesse utilizada no projeto foi obtida a partir de metais comercialmente puros em suas devidas proporções, através de solidificação direcional imposta por resfriamento rápido com água.
O molde, recipiente onde foi vazado o material fundido, possuía diâmetro de 50 mm, comprimento de 110 mm e espessura da parede lateral e do fundo de 3 mm. Os materiais da lateral e do fundo do recipiente eram, respectivamente, aço inoxidável revestido com alumina para minimizar a perda de calor radial e aço ao carbono para separar fisicamente o fluido refrigerante do fluido refrigerado.
Cada amostra foi dividida em 11 corpos de prova de 10 mm de espessura com auxílio de máquina de corte refrigerada à água para que não houvesse modificação microestrutural por inconveniente aumento de temperatura.
As superfícies das quais foram concebidas as curvas de polarização foram preparadas com lixamento em sequência granulométrica até 600 mesh.
Para a análise da composição química procedeu-se lixamento em sequência granulométrica até 1200 mesh, seguido de polimento com pasta de diamante de 6 μm, 3 μm e 1 μm.
3.2. A obtenção das composições químicas
▪ Microscópio eletrônico de varredura EVO MA10 da Carl Zeiss
▪ Espectrômetro por energia dispersiva
Vide 2.6.
Maiores detalhes não serão abordados, pois os procedimentos não foram executados, mas fornecidos ao projeto.
3.3. A obtenção das curvas de polarização
▪ Corpos de prova da liga ternária Al-6Cu-3Si (Eletrodos de Trabalho)
▪ NaCl – Proveniente da empresa ISOFAR, indústria e comércio de produtos químicos Ltda. Massa molar de NaCl – 58,44g/mol
▪ Água do tipo Millipore filtrada por aparelho Direct-Q UV3.
▪ Balança de precisão da empresa Marte balanças e equipamentos carga mínima = 0,02g.
▪ Potenciostato – Marca EG & G Princeton modelo 273ª
▪ Eletrodo de referência – Eletrodo de calomelano saturado
▪ Contra eletrodo – eletrodo de platina
Como ainda não foi mencionado: Tem a função de receber a corrente no lugar do eletrodo de referência de modo que embora o eletrodo de referência seja mais resistente à polarização, se elimina completamente a possibilidade dessa ocorrência indesejável que resultaria em leituras de potencial equivocadas.
▪ Célula eletrolítica
Material: Acrílico
Tampa para apoio de eletrodos
Vedação de laterais: Cola Super Bonder e reforço com silicone.
Vedação Célula/Amostra: Placa de apoio e pressionamento com parafusos, borboletas e oring.
Área restrita pelo oring: 1,16 cm²
Figura 5. Fotografia da célula eletrolítica utilizada no projeto.

Para a análise do comportamento eletroquímico, a curva de polarização referente a cada superfície dos corpos de prova foi determinada em solução de NaCl 0,5 Molar, pH neutro e à temperatura de aproximadamente 25 °C.
Utilizou-se potenciostato em método potenciostático. As alterações elétricas provocadas foram interpretadas e enviadas para armazenamento pelo dispositivo Spider8 600 HZ no software Catman. Os dados armazenados, valores de corrente e voltagem, foram convertidos adequadamente para a construção das retas de Tafel, das quais foram retirados os valores dos potenciais e correntes de corrosão com o auxílio do programa Origin 8.0.
A velocidade de varredura de potencial imposta pelo potenciostato foi de 1mV s-1 e as faixas de potenciais anódicos impostos poderão ser identificadas para cada amostra conforme os gráficos apresentados no tópico resultados e discussões.
- RESULTADOS E DISCUSSÕES
4.1. Resultados
4.1.1. Curvas de polarização
Nas curvas de polarização se encontram os potenciais de corrosão (potenciais para i = 0μA/cm²), porém para os cálculos das densidades de corrente de corrosão, os potenciais foram retirados diretamente das coordenadas (E,I), fornecidas pelo programa Catman – maior precisão.
4.1.1.1. Superfícies da liga Al-6Cu-3Si
Figura 6. Curvas de polarização das superfícies P1; A1; P2; A2. – Al6Cu3Si.
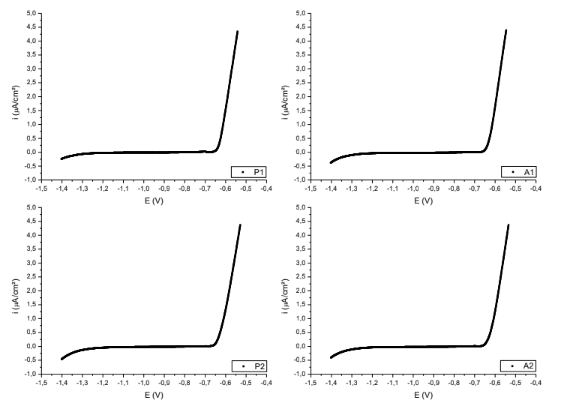
Figura 7. Curvas de polarização das superfícies P3; A3; P4; A4; P5; A5. – Al6Cu3Si
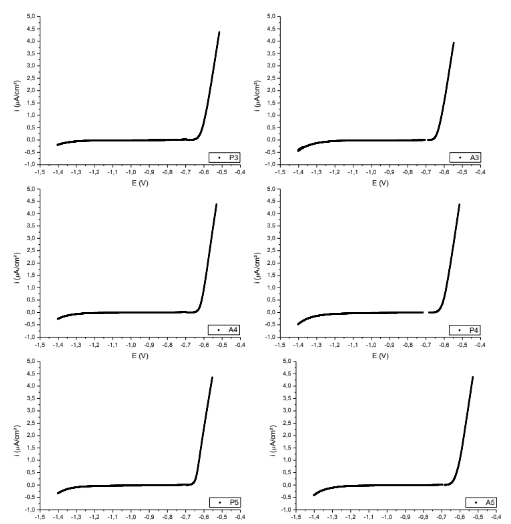
Figura 8. Curvas de polarização das superfícies P6; A6; P7; A7; P8; A8. – Al6Cu3Si
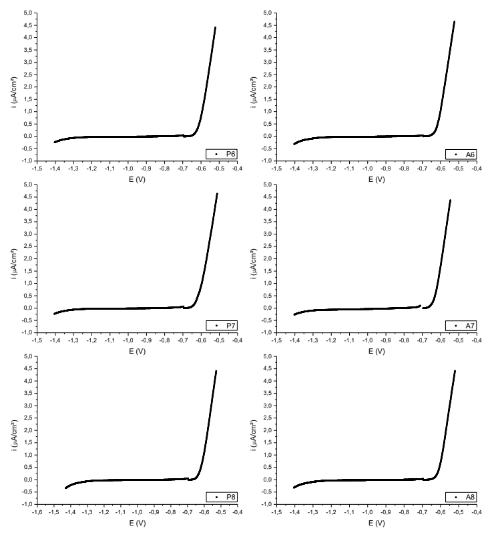
Figura 9. Curvas de polarização das superfícies P9; A9; P10; A10. – Al6Cu3Si
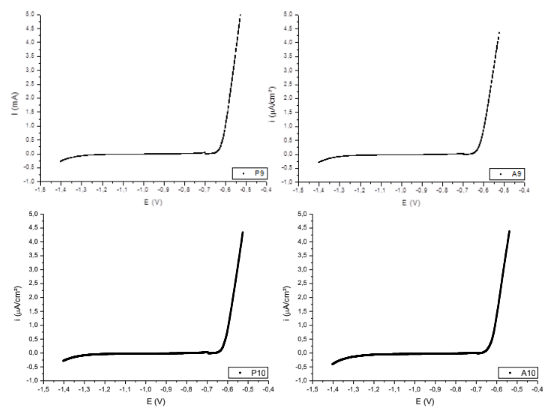
4.1.1.2. Superfícies da liga Al-6Cu-1Si
Figura 10. Curvas de polarização das superfícies P2; A2; P4; A4; P5; A5 – Al6Cu1Si
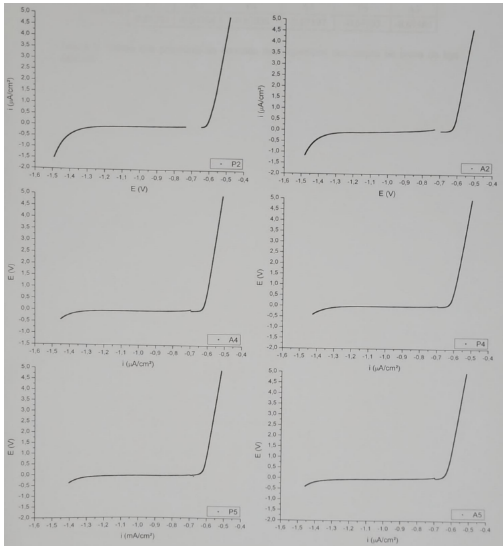
Tabela 2. Tabela dos potenciais de corrosão das superfícies dos corpos de prova da liga Al6Cu1SI.
Ecorr ( V ) Al6Cu1Si P2 A2 P4 A4 P5 A5 -0,64243 -0,67104 -0,67038 -0,67197 -0,69503 -0,69384
4.1.2. Determinação das retas de Tafel
4.1.2.1. Superfícies da liga Al-6Cu-3Si
Figura 11. Curvas para obtenção das retas de Tafel P1; A1. – Al6Cu3Si
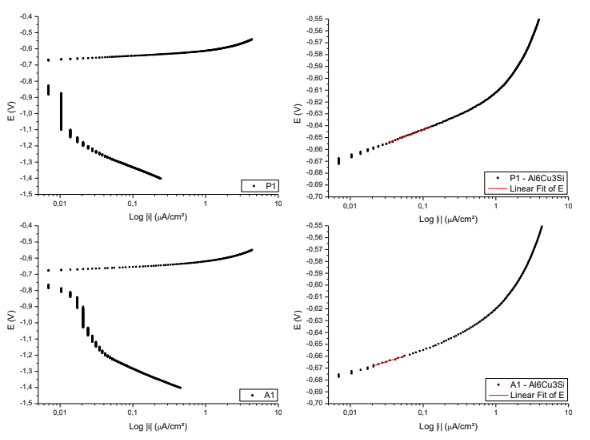
Equação da reta de Tafel da superfície P1
E( V )=-0,61099 + 0,02353*Log |i|
Coeficiente de correlação = 0,99785
Equação da reta de Tafel da superfície A1
E( V )=-0,63585 + 0,01911*Log |i|
Coeficiente de correlação = 0,98314 ]
Figura 12. Curvas para obtenção das retas de Tafel P2; A2. – Al6Cu3Si.
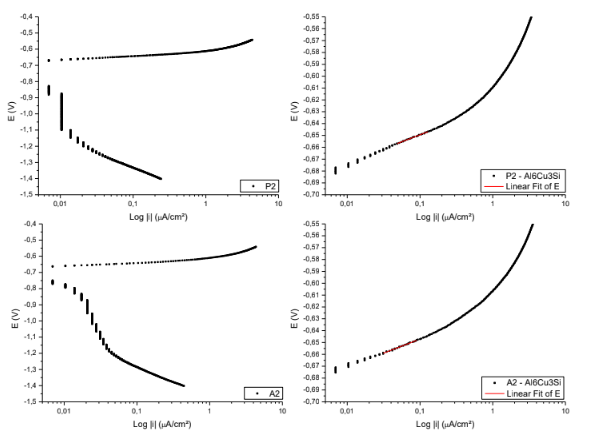
Equação da reta de Tafel da superfície P2
E( V )=-0,62586 + 0,02359*Log |i|
Coeficiente de correlação = 0,99581
Equação da reta de Tafel da superfície A2
E( V )=-0,62359 + 0,02356*Log |i|
Coeficiente de correlação = 0,99410
Figura 13. Curvas para obtenção das retas de Tafel P3; A3. – Al6Cu3Si.
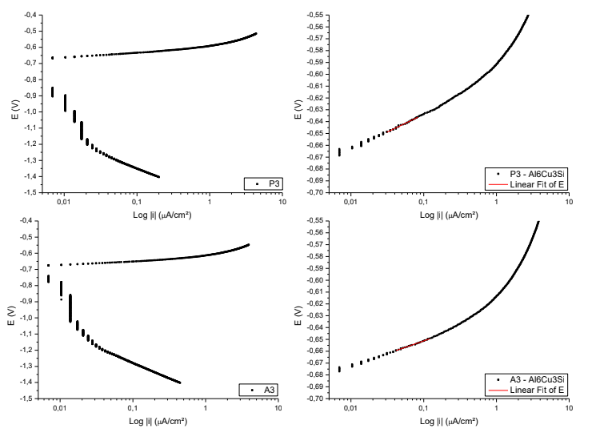
Equação da reta de Tafel da superfície P3
E( V )=-0,60429 + 0,02962*Log |i|
Coeficiente de correlação = 0,9889
Equação da reta de Tafel da superfície A3
E( V )=-0,62983 + 0,02141*Log |i|
Coeficiente de correlação = 0,99324
Figura 14. Curvas para obtenção das retas de Tafel P4; A4. – Al6Cu3Si.
Equação da reta de Tafel da superfície P4
E( V )=-0,60465 + 0,02424*Log |i|
Coeficiente de correlação = 0,98880
Equação da reta de Tafel da superfície A4
E( V )=-0,62621 + 0,02796*Log |i|
Coeficiente de correlação = 0,99146
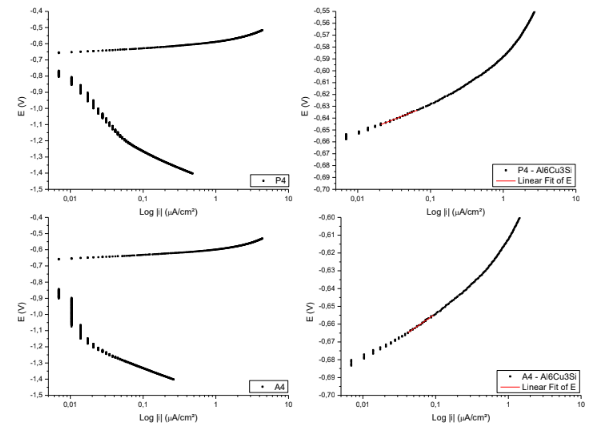
Figura 15. Curvas para obtenção das retas de Tafel P5; A5. – Al6Cu3Si.
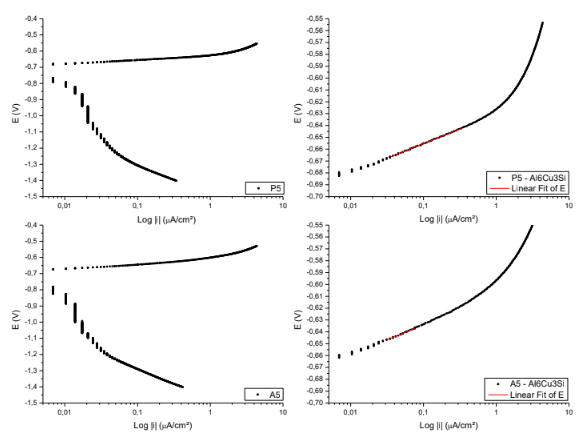
Equação da reta de Tafel da superfície P5
E( V )=-0,63059 + 0,02475*Log |i|
Coeficiente de correlação = 0,99917
Equação da reta de Tafel da superfície A5
E( V )=-0,60895 + 0,02518*Log |i|
Coeficiente de correlação = 0,99225
Figura 16. Curvas para obtenção das retas de Tafel P6; A6. – Al6Cu3Si.
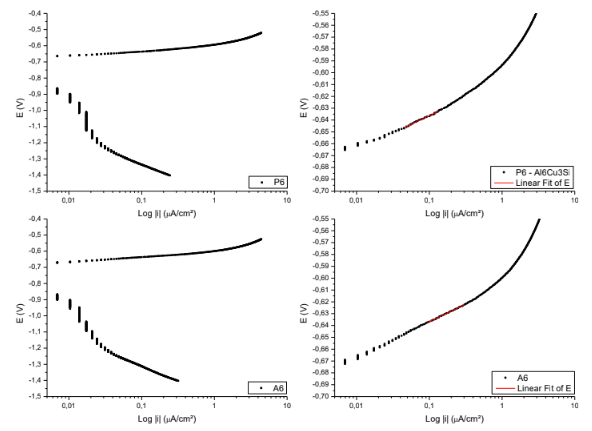
Equação da reta de Tafel da superfície P6
E( V )=-0,60688 + 0,0294*Log |i|
Coeficiente de correlação = 0,99493
Equação da reta de Tafel da superfície A6
E( V )=-0,60733 + 0,02945*Log |i|
Coeficiente de correlação = 0,99895
Figura 17. Curvas para obtenção das retas de Tafel P7; A7. – Al6Cu3Si.
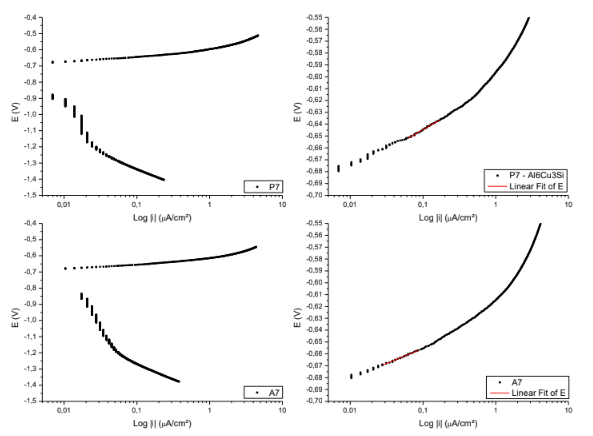
Equação da reta de Tafel da superfície P7
E( V )=-0,60889 + 0,03573*Log |i|
Coeficiente de correlação = 0,99589
Equação da reta de Tafel da superfície A7
E( V )=-0,60032 + 0,02514*Log |i|
Coeficiente de correlação = 0,99265
Figura 18. Curvas para obtenção das retas de Tafel P8; A8. – Al6Cu3Si.
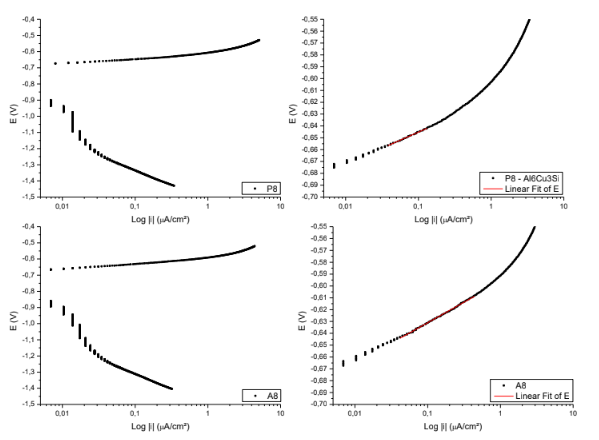
Equação da reta de Tafel da superfície P8
E ( V ) = -0,59641 + 0,03463*Log |i|
Coeficiente de correlação = 0,99818
Equação da reta de Tafel da superfície A8
E ( V ) = -0,61806 + 0,02714*Log |i|
Coeficiente de correlação = 0,99671
Figura 19. Curvas para obtenção das retas de Tafel P9; A9. – Al6Cu3Si.
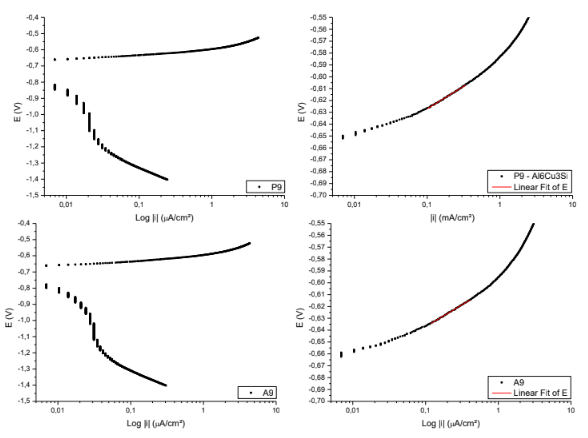
Equação da reta de Tafel da superfície P9
E ( V ) = -0,58924 + 0,03779*Log |i|
Coeficiente de correlação = 0,99794
Equação da reta de Tafel da superfície A9
E ( V ) = -0,60017 + 0,03692*Log |i|
Coeficiente de correlação = 0,99879
Figura 20. Curvas para obtenção das retas de Tafel P10; A10. – Al6Cu3Si.
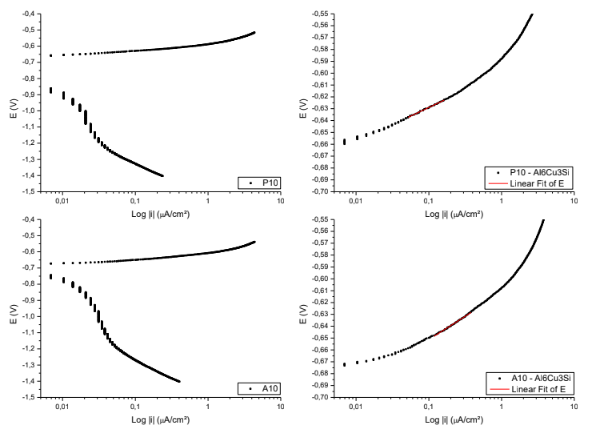
Equação da reta de Tafel da superfície P10
E ( V ) = -0,59974 + 0,02921*Log |i|
Coeficiente de correlação = 0,99675
Equação da reta de Tafel da superfície A10
E ( V ) = -0,61193 + 0,03937*Log |i|
Coeficiente de correlação = 0,99656
4.1.2.1. Superfícies da liga Al-6Cu-1Si
Figura 21. Curvas para obtenção das retas de Tafel P2; A2. – Al6Cu1Si
Equação da reta de Tafel da superfície P2
E ( V ) = -0,59160 + 0,02237*Log |i|
Coeficiente de correlação = 0,98353
Equação da reta de Tafel da superfície A2
E ( V ) = -0,60227 + 0,02801*Log |i|
Coeficiente de correlação = 0,99342
Figura 22. Curvas para obtenção das retas de Tafel P4; A4. – Al6Cu1Si
Equação da reta de Tafel da superfície P4
E ( V ) = -0,60676 + 0,0180*Log |i|
Coeficiente de correlação = 0,99512
Equação da reta de Tafel da superfície A4
E ( V ) = -0,60229 + 0,02622*Log |i|
Coeficiente de correlação = 0,98993
Figura 23. Curvas para obtenção das retas de Tafel P5; A5. – Al6Cu1Si
Equação da reta de Tafel da superfície P5
E ( V ) = -0,60809 + 0,02287*Log |i|
Coeficiente de correlação = 0,99584
Equação da reta de Tafel da superfície A5
E ( V ) = -0,61021 + 0,03667*Log |i|
Coeficiente de correlação = 0,99776
4.2. Discussões
4.2.1. Densidade de corrente de corrosão
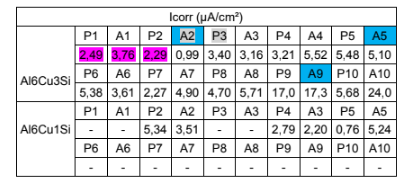
Tabela 3. Tabela das densidades de corrente das superfícies dos corpos de provas da liga de interesse.
4.2.2. Composições químicas
Tabela 4. Tabela de composição química das superfícies dos corpos de prova das ligas de interesse.
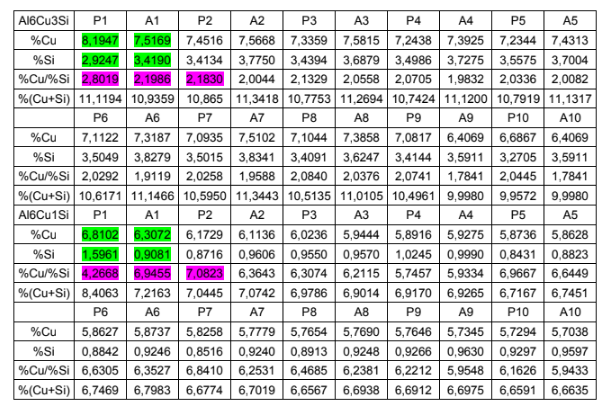
1. Entre as seções transversais P1 e A1 (destaque em verde na tabela 4): Verifica-se a macrossegregação inversa do cobre em ambas as ligas e do silício na liga Al6Cu1Si.
2. Entre os trechos P1, A1 e P2 (destaque em rosa na tabela 4):
Confirma-se a influência da macrossegregação inversa no mecanismo de resistência à corrosão da liga Al6Cu3Si com Cu/Si variando de 2,8019 em P1 para 2,1986 em P2.
O mecanismo de resistência à corrosão passou do típico para as ligas Al-Cu para o das ligas Al-Si. Portanto, a mínima resistência à corrosão foi atingida entre P1 e A1;
Com a manutenção da relação Cu/Si de A1 para P2, a diminuição da densidade de corrente de corrosão encontrada em P2 se deve à sua microestrutura grosseira devido a uma taxa de resfriamento mais lenta em relação ao de A1 (mesmo mecanismo de resistência à corrosão das ligas binárias de Al-Si).
O corpo de prova de superfícies P1 e A1 liga Al6Cu1Si não foi fornecido, porém ficou evidente o aumento da resistência à corrosão das superfícies seguintes, com exceção de A5 devido à introdução da variável porosidade.
Ainda que faltam alguns corpos de prova, percebe-se que o mecanismo de resistência à corrosão de toda a amostra da liga Al6Cu1Si permanece igual ao das ligas binárias de Al-Si, devido aos menores valores para a razão Cu/Si.
3. A partir dos trechos A2 e P3 da amostra de Al6Cu3Si (destaque em cinza na tabela 3) e de A5 da amostra de Al6Cu1Si: Além de perceptível nos resultados de densidade de corrente de corrosão, a porosidade é macroscopicamente perceptível a partir de P3 para a amostra da liga Al6Cu3Si e de A5 para a amostra da liga Al6Cu1Si.
4. Em Azul e cinza na tabela 3, observa-se a grande influência da porosidade na resistência à corrosão da liga, devido à menor área de contato para uma mesma intensidade de corrente. Constata-se a variação de densidade de corrente devido à porosidade dos corpos de prova que demoraram mais para se solidificarem. Maior porosidade gera maior densidade de corrente e é possível que esta porosidade seja advinda de aprisionamento gasoso durante o processo de solidificação.
5. Ao introduzir a variável porosidade, a análise das variações de densidade de corrente se tornou mais complexa. Existiram regiões nas quais o ganho em resistência à corrosão devido à microestrutura mais robusta se sobrepôs à perda na resistência devido ao aumento de porosidade (exemplo, de P6 para A6 – Liga Al6Cu3Si) e regiões nas quais o ganho em resistência à corrosão por causa do “engrossamento” microestrutural não compensou o aumento de porosidade (exemplo, de A2 para P3 – Liga Al6Cu3Si).
Figura 24. Visualização macroscópica de porosidade a partir de P3/direita – Al6Cu3Si (à esquerda A2 sem apresentar poros).
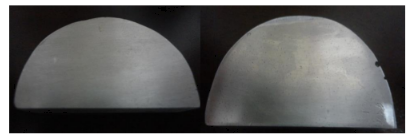
Figura 25. Aumento da porosidade a amostra de Al6Cu3Si-superfícies A2, A5 e A9
- CONCLUSÕES
1. Confirmou-se a ocorrência do fenômeno de macrossegregação inversa para ambas as ligas.
2. A variação do mecanismo de resistência à corrosão ocorreu apenas ao longo da amostra da liga ternária Al-6Cu-3Si.
3. Constatou-se a existência de regiões nas quais a variável porosidade se superpõe e outras nas quais ela foi sobreposta pelo engrossar da microestrutura.
4. Com os dados obtidos não foi possível determinar a razão pela qual a liga Al6Cu3Si apresentou região na qual seu mecanismo de resistência à corrosão é igual ao das ligas binárias Al-Cu enquanto que a liga Al6Cu1Si foi inteiramente comandada pelo mecanismo de resistência à corrosão das ligas binárias Al-Si.
- SUGESTÃO PARA TRABALHOS FUTUROS
Correlacionar os resultados obtidos com análise microestrutural das amostras a fim de:
1. Entender o porquê da liga Al6Cu3Si apresentarem região cujo mecanismo de resistência à corrosão é igual ao presente nas ligas binárias Al-Cu, se a liga Al6Cu1Si que aparentemente deveria ser menos influenciada pelo Si foi inteiramente comandada pelo mecanismo de resistência à corrosão das ligas binárias Al-Si.
2. Verificar se para um mesmo espaçamento interdendrítico médio, a liga Al6Cu1Si apresenta menor resistência à corrosão que a liga Al6Cu1Si em resposta a uma maior quantidade de elementos de liga.
- REFERÊNCIAS BIBLIOGRÁFICAS
[1]. GENTIL, V., Corrosão, 2a Ed., LTC S.A., 1996.
[2]. NUNES, L. P., Fundamentos de Resistência à Corrosão, Editora Interciência, 2007
[3]. DUTRA, A. C. & NUNES, P. L., Proteção Catódica. Técnica de combate à Corrosão, Editora McKlausen, 1987.
[4]. LUCENA, M. P. P., Trabalho de conclusão de curso – Estudo de parâmetros de processo de pregos comuns visando melhor resistência à corrosão, UFRGS, dezembro de 2010.
[5]. DIAS, CRISTIANE., Dissertação de mestrado em ciências na área de reatores nucleares de potência e tecnologia do combustível nuclear, IPEN CNEN-SP, 2002.
[6]. GOMES, M. R.; Filho, E. B., Propriedades e Usos de metais não ferrosos, edição revista ABM, 1985.
[7]. ASM Handbook, Volume 2 – Properties and Selection: Nonferrous Alloys and Special Purpose Materials, ASM International, 1990.
[8]. SANTIAGO, A. V.; PEREIRA, R. L., Metais não Ferrosos e suas Ligas, Editora EDUSP, Universidade de São Paulo Escola de Engenharia de São Carlos, 1984.
[9]. GOLDSTEIN, J. I., ET al – Scanning Electron Microscopy and X-ray Microanalysis – A Textebook for Biologist, Materiais Scientists Ang Geologists. 1992. Plenum Press. New York.
[10]. OSÓRIO, W. R.; MOUTINHO, D. J.; PEIXOTO, L. C.; FERREIRA, I. L.; GARCIA, A. Macrosegregation and microstructure dendritic array affecting the electrochemical behaviour of ternary Al–Cu–Si alloys Electrochimica Acta JCR, v.56, p.8412-8421,2011.
[11]. OSÓRIO, W. R.; MOUTINHO, D. J.; PEIXOTO, L. C.; FERREIRA, I. L.; GARCIA, A.; GOMES, L. G. Corrosion resistance of directionally solidified Al-6Cu-1Si ande Al-8Cu-3Si alloys castings. Materials in Engineering (Cessou em 1982. Cont. ISSN 0264-1275 Materials and Design) JCR, p.3832-3837,2011.
