COMPARATIVE ANALYSIS OF THE MORPHOLOGY OF BLOOD VESSELS AT THE BASE OF THE HEART BETWEEN HUMANS AND RATS
REGISTRO DOI: 10.69849/revistaft/th10248251610
Antônio Carlos Guilherme Rocha[1]
Lívia Karen Barbosa de Brito[2]
João Arthur Silva de Macêdo Araújo[3]
Lucas Leonardo Cronemberger de Carvalho[4]
Sérgio Paulo Lima Guerra[5]
Zulmira Lúcia Oliveira Monte[6]
Kelly Palombit[7]
Karinn de Araújo Soares Bastos[8]
Resumo
A Morfologia estuda a forma, estrutura e organização dos tecidos, órgãos e sistemas dos organismos de humanos e animais, sendo a histologia um ramo indispensável para o estudo de células e tecidos. Esta pesquisa tem o objetivo de realizar uma análise comparativa e descritiva entre os vasos da base do coração de humanos e de ratos. Estudo do tipo experimental, exploratório, descritivo, qualitativo, observacional e transversal. Foram utilizados dois ratos Wistar e dois cadáveres humanos, feito análise macroscópica e microscópica. Foi observado que em ambas as espécies, a parte ascendente da a. aorta emerge do coração passando anteriormente à a. pulmonar direita e dela emergem dois ramos de aa. coronárias. As túnicas de humanos diferenciam-se gradativamente, enquanto no tecido animal há forte diferenciação em coloração e composição tecidual. Houve diferenças significativas em relação ao tamanho, calibre e organização dos tecidos e células, o que torna esta pesquisa importante por mostrar como essas características podem influenciar no funcionamento do organismo e como as possíveis alterações ou anormalidades podem estar associadas a condições de saúde.
Palavras-chave: Morfologia. Humanos. Ratos. Artérias.Veias.
1 INTRODUÇÃO
O conhecimento da anatomia humana e suas variações, constituem-se como objetos de grande relevância, sendo o corpo humano o seu objeto de trabalho, permitindo estudar tanto as estruturas macroscópicas, que podem ser vistas a olho nu, como as microscópicas que necessitam do auxílio de instrumentos tecnológicos. Para Braz (2019), anatomia humana é uma disciplina básica que cada estudante tem de aprender ao entrar em qualquer curso relacionado com as ciências da saúde.
O estudo da anatomia, se torna possível por meio da utilização de modelos artificiais ou cadáveres, deve-se atentar quanto aos princípios éticos e normas legais, o uso desses cadáveres humanos para o estudo e dissecação de estruturas anatômicas é de fundamental importância para a formação acadêmica do futuro profissional da área da saúde. As instituições de ensino que possuem licença para o trabalho com peças humanas devem garantir ao corpo docente, discente e aos demais pesquisadores material suficiente para o aprendizado e desenvolvimento de estudos e pesquisas científicas, respeitando a legislação vigente (VIEIRA, 2001). Leis como a 8.501/92 e o Artigo 14 da Lei 010.406.2002 do Código Civil dispõem sobre a utilização de cadáveres não reclamados e a doação espontânea de corpos por parte da sociedade, respectivamente. Assim, esta pesquisa tem um cunho premente de seguir todas as recomendações éticas e legais sobre os cuidados e uso de cadáveres humanos e animal em todas suas etapas. Os cadáveres humanos a serem estudados nesta pesquisa encontram-se fixados e estão localizados no Laboratório de Anatomia Humana (LAH) situado no prédio do Departamento de Morfologia (DMOR), Campus Ministro Petrônio Portella (CMPP) da Universidade Federal do Piauí (UFPI).
Para que o estudo morfológico de fato seja viável, faz-se necessário o estudo microscópico das células e tecidos, assim, a histologia é uma peça indispensável para o estudo destes tecidos, uma vez que permite ter uma visão mais aprofundada do organismo, sua construção morfológica, funcionalidade e eventuais anormalidades. Esta ciência (histologia) é um dos ramos da morfologia, inclusive conhecida como anatomia microscópica, também faz parte da grade curricular de todos os cursos da área da saúde, assim como fisiologia, embriologia, parasitologia e outras (CHAPMAN; LEE; SWAILES, 2020). Ela estuda quatro tecidos básicos: tecido epitelial, conjuntivo, muscular e nervoso. E para que seja viável o estudo histológico é necessário o uso de microscópios, que permitem a visualização por meio da transluminação, ou seja, a imagem é formada a partir da iluminação do espécime com fótons. A luz que chega aos olhos para formar a imagem atravessa primeiro o tecido em estudo. Por isso, o material biológico a ser observado não pode ser opaco, mas deve ser fino o suficiente para permitir a passagem da luz e, consequentemente, ser mais bem visualizado no microscópio. Para isso, faz-se necessário a fabricação de lâminas histológicas, para que seja oportuno a visualização de células (VIEIRA, 2008).
Ratos e outros modelos animais são bastante utilizados em pesquisas científicas que necessitem de cobaias, assim se tornam um recurso importante e útil, que fornece uma ampla base de conhecimento em relação à sua fisiologia e patogênese, porém nem tudo pode ser reproduzido no ser humano (SLONE; FLEMING, 2014). Para Porto (2010), embora muitos resultados não possam ser extrapolados para humanos por causa das diferenças entre as espécies, eles podem dar origem a novas ideias sobre o tratamento de um grande número de doenças.
Com isso, esta pesquisa foi desenvolvida no Departamento de Morfologia da Universidade Federal do Piauí (DMOR-UFPI). Motivado pela necessidade de ampliar o acervo de material didático histológico, bem como, de adequá-los às necessidades específicas dos cursos de graduação da área da saúde humana, utilizando amostras de tecido humano e animal no preparo das lâminas histológicas, pois com o passar dos anos as lâminas do referido departamento necessitam ser repostas, visto que estas possuem um tempo de vida reduzido, perdendo nitidez, ou ainda, podem quebrar devido ao grande manuseio por parte do corpo discente, docente, técnicos de laboratório e demais membros que hoje atendem aos cursos de Enfermagem, Nutrição, Odontologia, Medicina, Farmácia, Ciências Biológicas, Educação Física e Medicina Veterinária. Com isso, o objetivo desta pesquisa é realizar uma análise comparativa descritiva entre a morfologia dos vasos da base do coração de humanos e de ratos Wistar.
2 FUNDAMENTAÇÃO TEÓRICA
O sistema circulatório é composto de pequena circulação e grande circulação. A grande circulação conduz o sangue do coração para os demais tecidos, enquanto a pequena circulação fica responsável por encaminhar o sangue do coração em direção ao pulmão, para que ocorra a troca gasosa nos alvéolos, hematose. Os vasos coronarianos ficam responsáveis pela nutrição própria do coração. Os vasos do sistema circulatório podem ser divididos em: artérias, arteríolas, capilares, vênulas e veias; os grandes vasos compreendem artéria aorta, artéria pulmonar, veias pulmonares e as veias cavas superior e inferior. Tanto em roedores quanto nos seres humanos o sangue oxigenado sai do coração pelo ventrículo esquerdo, passando pela válvula aórtica e sendo distribuído a partir das bifurcações e ramificações da artéria aorta. O sangue volta para o coração através das veias cavas e desembocam no átrio direito. No rato possui veias cavas cranianas esquerda e direita e uma veia cava caudal. E no humano, como já se sabe, veia cava superior e inferior. Aqui, observa-se uma alteração de nomenclatura, quando comparado ambas espécies, tais mudanças podem ocorrer até mesmo entre outros roedores (TREUTING et al. 2017).
Para a realização deste estudo foi necessário revisar na literatura além da morfologia, também a histotécnica e etapas necessárias para o tratamento dos tecidos, em especial os vasos sanguíneos. Para Junqueira e Carneiro (2017), o procedimento mais usado nos estudos de tecidos ao microscópio de luz consiste na preparação de cortes histológicos. No entanto, na maioria dos casos os tecidos e órgãos são espessos e não permitem a passagem adequada da luz para formação de uma imagem; sendo assim, antes de serem examinados no microscópio eles devem ser fatiados em cortes histológicos, corados e colocados sobre lâminas de vidro. Os cortes são obtidos por meio de instrumentos de grande precisão chamados micrótomos, que fracionam o tecido e a parafina em fitas com espessura extremamente finas (normalmente se usa uma espessura que varia de 3 a 6µm). Porém, antes de serem fatiados, estes tecidos e órgãos necessitam passar por uma série de tratamentos histológicos, como: coleta, fixação, clivagem, desidratação, inclusão, entre outros. Além disso, após o corte, as fitas podem ainda ser coloridas por meio de corantes e assim montadas em lâminas de vidro, permitindo a visualização minuciosa dos constituintes do tecido.
O sistema cardiovascular é formado pelos vasos sanguíneos e pelo coração, sendo responsável pela circulação do sangue, transportando os nutrientes e oxigênio por todo o organismo e removendo gás carbônico e metabólitos (DUTRA et al., 2019). As artérias consistem em uma série de vasos que se tornam menores (capilares) à medida que se ramificam e se distanciam do coração, sua função é levar o sangue, rico em nutrientes e oxigênio, do coração para os demais órgãos e tecidos, podem ainda serem divididas entre elásticas e musculares. Para Spence (1991), com a progressiva transformação de artérias para capilares, há uma diminuição no diâmetro do vaso, na espessura de suas paredes, na pressão em seu interior e na velocidade com a qual o sangue os atravessa. Os vasos capilares são vasos sanguíneos muito delgados que constituem uma rede complexa de tubos muito delgados, é através de suas paredes que ocorre grande parte do intercâmbio entre o sangue e os tecidos adjacentes. As veias resultam da convergência dos vasos capilares em um sistema de canais que se torna cada vez mais calibroso à medida que se aproxima do coração, para onde transporta o sangue proveniente dos tecidos (JUNQUEIRA; CARNEIRO, 2013).
A parede dos vasos sanguíneos é formada pelo endotélio, tecido muscular e o tecido conjuntivo. A associação desses tecidos formam as túnicas dos vasos sanguíneos, que podem ser entendidas como camadas (túnica íntima, túnica média e túnica adventícia). A quantidade e a organização desses tecidos no sistema circulatório são influenciadas por diferentes fatores. Os vasos da grande circulação que estão localizados mais próximos do coração são mais calibrosos e os mais distantes são mais delgados, isso se justifica por conta da pressão sanguínea que é evidencialmente mais potente quando mais próxima do eixo apical, sobretudo quando vai ao encontro dos tecidos. Porém, deve-se também a outros fatores, sejam mecânicos ou metabólicos, que se estruturam de acordo com a necessidade dos tecidos. O tecido muscular nem sempre está presente em todo o trajeto dos vasos, como é o caso dos capilares e das vênulas pós-capilares, os únicos elementos estruturais presentes são o endotélio junto com sua membrana basal (JUNQUEIRA; CARNEIRO, 2013).
A relação de orientação anatômica entre humanos e ratos são análogas, mas devem ser interpretadas com atenção, para que não se aponte uma diferença morfológica apenas por ter uma nomenclatura diferente. Para o ser humano, cranial e caudal estão relacionadas a cabeça e pés, respectivamente, assim como para ratos, porém o caudal se refere a própria cauda do animal e não aos pés. Neste mesmo sentido, anterior e posterior para o humano refere-se às costas e ao ventre, para os ratos seriam as costas e a região ventral também, porém deve ser estudado antecipadamente a posição didática anatômica do rato, que não consiste na posição de quatro pés. Estes roedores são estudados em placa, ou seja, de forma horizontal, com os membros esticados, membros superiores (MMSS) direcionados para cima e membros inferiores (MMII) direcionados para baixo. Já no modelo humano todos os membros são direcionados para baixo. (TREUTING et al. 2017).
O arco aórtico no rato se inclina para a esquerda, como de costume em outros mamíferos, e diverge nas artérias braquiocefálica, carótida comum esquerda e subclávia esquerda. O tronco braquiocefálico se divide na articulação esternoclavicular em artérias carótida comum direita e subclávia direita. Fazendo uma breve análise observamos que o suprimento de sangue no sistema cardiovascular do rato é muito semelhante com o do ser humano.
Esta pesquisa baseia-se nestas análises morfológicas e comparativas dos vasos da base do coração, mais precisamente, artéria aorta (o vaso mais calibroso do sistema circulatório, que aqui representa um vaso que sai do coração para os demais tecidos) e veia cava superior (que junto a veia cava inferior representam os mais calibrosos vasos que chegam ao coração), de ratos e humanos. A escolha por estes dois vasos se deu pela localização anatômica,dispõem de uma melhor visualização macroscópica e por se tratarem dos mais calibrosos vasos da base do coração. Não excluindo o grau de importância dos demais vasos da base, como é o caso da veia cava inferior e das veias pulmonares.
2.1 Visão histológica dos vasos sanguíneos:
Além de serem consideravelmente mais pequenos nos roedores, a anatomia microscópica dos vasos sanguíneos é geralmente semelhante em humanos e ratos, pois possuem os mesmos constituintes, embora distribuídos de forma diferente, de acordo com sua localização e função. (TREUTING et al. 2017). Segundo Junqueira e Carneiro (2017), como visto anteriormente, as camadas dos vasos sanguíneos são divididas em:
- Túnica íntima: Apresenta uma camada de células endoteliais apoiada em uma camada de tecido conjuntivo frouxo. Em artérias, a túnica íntima está separada da túnica média por uma lâmina elástica interna que geralmente apresenta um aspecto ondulado nos cortes histológicos;
- Túnica média: Consiste principalmente de células musculares lisas organizadas helicoidalmente. Estas células são as responsáveis pela produção das moléculas da matriz extracelular;
- Túnica adventícia: Consiste principalmente em colágeno do tipo 1 e fibras elásticas. A camada adventícia torna-se gradualmente contínua com o tecido conjuntivo do órgão pelo qual o vaso sanguíneo está passando.
No organismo humano, a largura da parede da artéria elástica é muito espessa, o que torna a difusão difícil, assim as porções interiores da parede são sustentadas por vasa vasorum (pequenos vasos) que surgem na túnica adventícia. Porém, nos roedores, vasa vasorum são vistos com pouca quantidade na túnica adventícia. Outro achado é que nas arteríolas, a camada muscular é mais fina do que em artérias musculares. Já as veias, possuem camadas mais delgadas, ou seja, são mais finas por terem menos músculo liso e fibras elásticas. Seu principal diferencial é a presença de válvulas, o que auxilia no retorno venoso e garantindo que o sangue percorra um trajeto unidirecional. A característica única das veias pulmonares de roedores é que estão rodeadas de músculo cardíaco, uma característica normalmente não presente nos seres humanos. (TREUTING et al. 2017).
3 METODOLOGIA
Pesquisa do tipo experimental, exploratória, descritiva, qualitativa, observacional e transversal. Vinculada a um projeto de pesquisa macro, intitulado: Morfologia Comparada dos Sistemas Orgânicos de Humanos e Ratos (Rattus Novergicus Linhagem Wistar): Viabilidade, Forma e Função, o qual foi submetido para apreciação e aprovação pela Comissão de Ética no Uso de Animais (CEUA no 730/2022) e pelo Comitê de Ética em Pesquisa Humana (CEP no 055907/2022) da Universidade Federal do Piauí, através do plataforma brasil (CAAE: 59101822.0.0000.5214). Para o CEP, por se tratar de um projeto que irá manusear cadáveres utilizados em aulas de anatomia humana, será solicitada a dispensa do Termo de Consentimento Livre e Esclarecido – TCLE e apresentado o Termo de Compromisso de Utilização de Dados – TCUD. Os procedimentos realizados com animais neste estudo estão em conformidade com as diretrizes éticas para experimentação animal preconizadas no European Communities Council Directive de 24 de novembro de 1986 (86/609/EEC) sobre as recomendações dos cuidados e uso de animais de laboratório.
Considerando que a anatomia humana é uma disciplina básica para todos os estudantes ingressantes na área da saúde, bem como nas áreas do ensino, extensão e pesquisa, o seu processo de ensino-aprendizagem exige o emprego de certas metodologias, dentre elas, a utilização de cadáveres dissecados. Leis como a 8.501/92 e o Artigo 14 da Lei 010.406.2002 do Código Civil dispõem sobre a utilização de cadáveres não reclamados e a doação espontânea de corpos por parte da sociedade, respectivamente. Assim, esta pesquisa tem um cunho premente de seguir todas as recomendações éticas e legais sobre os cuidados e uso de cadáveres humanos em todas suas etapas.
Os experimentos foram realizados nos laboratórios de Anatomia Humana e no Laboratório de Pesquisa em Ciências Morfológicas (LABCIM) do Departamento de Morfologia, da Universidade Federal do Piauí. Foram utilizados 02 ratos Wistar (Rattus novergicus albinus) – um macho e uma fêmea, com aproximadamente três meses de idade, obtidos do Biotério do Centro de Ciências Agrárias (CCA) da Universidade Federal do Piauí (UFPI), e 02 cadáveres (um masculino e um feminino) utilizados nos laboratórios de anatomia humana do Departamento de Morfologia. Os ratos foram transportados do Biotério Central da UFPI para o LABCIM do Departamento de Morfologia. Os animais foram eutanasiados com uma superdose de anestésico (cloridrato de cetamina/ketamina 1,5 ml, administrado via intramuscular e depois cloreto de potássio intracardíaco), e em seguida realizada a perfusão intracardíaca do fixador (solução de formol tamponado 10%), o qual tem a função de alcançar o interior dos tecidos rapidamente pelos vasos sanguíneos, resultando em uma fixação melhor dos órgãos. Os animais perfundidos foram armazenados imersos na mesma solução fixadora e só após 48 horas os tecidos foram coletados para o processamento histológico.
As amostras dos vasos sanguíneos do humano foram obtidas de peças cadavéricas anatômicas humanas naturais (cadáveres) fixadas em solução de formalina 10% utilizadas nos laboratórios de Anatomia Humana do Departamento de Morfologia. Para a análise macroscópica, todas as regiões dos vasos da base do coração foram fotografadas e, posteriormente, realizada análise microscópica, descritiva e comparativa entre as amostras de ratos e humanos. Para a análise microscópica, foi realizada análise histológica descritiva e comparativa entre as mesmas regiões dos vasos da base do coração, objetos de estudo desta pesquisa, entre ratos e humanos.
O tamanho da amostra foi definido de acordo com a qualidade do tecido e tamanho suficiente para ser processado histologicamente. As amostras fixadas passaram pelo processo de inclusão, que consiste em impregnar os tecidos com parafina que proporcionará uma consistência rígida às amostras. Nesse processo, os tecidos foram desidratados e clareados. Inicialmente, os fragmentos passaram por diversos banhos de soluções de concentrações crescentes de álcool (álcool 70% até álcool 100%). Após a desidratação, o álcool dos fragmentos foi substituído por um solvente orgânico, o xilol, tornando os fragmentos transparentes ou translúcidos.
Espera-se, com este estudo, realizar análise comparativa descritiva entre a morfologia dos vasos da base do coração de humanos e de ratos Wistar, considerando seus aspectos macro e microscópicos, contribuindo, desta maneira, para a disseminação do conhecimento e do entendimento anátomo-funcional.
4 RESULTADOS E DISCUSSÕES
Os experimentos foram realizados nos laboratórios de Anatomia Humana e no Laboratório de Pesquisa em Ciências Morfológicas (LABCIM) do Departamento de Morfologia, da Universidade Federal do Piauí, sob orientação da coordenação do projeto e dos técnicos de laboratório. As reuniões foram marcadas com antecedência, de acordo com a disponibilidade dos membros. Os tecidos humanos já estavam fixados, por fazer parte do acervo do Laboratório de Anatomia Humana da UFPI, já os ratos, foram solicitados com antecedência ao Biotério Central da UFPI (localizado no Centro de Ciências Agrárias – CCA-UFPI). Assim, a pesquisa foi iniciada apenas com um cadáver humano, visto que este encontrava-se à disposição dos pesquisadores. Os cadáveres escolhidos foram aqueles que possuíam mínima manipulação (por parte dos discentes, docentes e técnicos da universidade), ou seja, possuíam tecidos viáveis a serem estudados.
O processo histotécnico foi realizado em três momentos distintos: 1. Em novembro de 2022 foi dado início a parte prática da pesquisa, onde foi coletado a artéria aorta (parte ascendente) e a veia cava superior do cadáver humano do sexo feminino. A escolha de começar pelo modelo humano se deu pela facilidade de obter outro fragmento de tecido no próprio laboratório de anatomia, caso apresentasse algum eventual erro na pesquisa, dessa forma, teríamos a possibilidade de refazê-la ou corrigi-la nos próximos encontros. Após análise do produto final desta fase da pesquisa (lâminas histológicas) no modelo humano feminino, pôde-se observar que algumas lâminas ficaram com artefatos histológicos, ou seja, apresentaram tecido esgarçado, sujidades, bolhas de ar, sobreposição de tecido e outros. Assim, a equipe pesquisou as possíveis causas e/ou erros que prejudicaram a visualização microscópica destes vasos sanguíneos. Foi realizado um aprofundamento nas bases teóricas, melhoramento e adequação de técnicas histológicas. O tecido esgarçado possivelmente esteve associado ao fato de que o cadáver humano encontra-se muito tempo em fixação; as sujidades e bolhas estão ligadas a falhas na etapa de montagem, além do uso de produtos químicos que auxiliam na colocação da lamínula sobre o tecido/lâmina, que nesse primeiro momento foi verniz acrílico, o mesmo usado para dar proteção e acabamento em pinturas, proteção de madeira e artesanato em geral; já a sobreposição de tecido esteve associada às etapas de microtomia dos blocos e/ou na pescagem do tecido na bacia de banho maria. 2. Após estudo e correção dos possíveis erros, a segunda etapa do trabalho deu início em fevereiro de 2023, agora com os tecidos do roedor do sexo masculino e também com o cadáver humano masculino. O verniz de acrílico foi substituído por bálsamo do Canadá, que é utilizado rotineiramente nas pesquisas histológicas na etapa de montagem, pois além de prender a lamínula na lâmina, auxilia na preservação do tecido, aumentando o tempo de vida da peça. 3. E a terceira etapa ocorreu em junho e agosto de 2023, com a eutanásia e processamento histotécnico dos vasos do roedor do sexo femino.
Ao todo, obteve-se 28 lâminas, que estão distribuídas da seguinte forma: 08 lâminas dos vasos do cadáver humano do sexo feminino e 07 do sexo masculino, 08 lâminas do rato do sexo masculino e 05 do sexo feminino. A quantidade de lâminas para cada tecido foi conforme a necessidade, embora quanto maior o número, maior a probabilidade de obter lâminas livres de artefatos e consequentemente, mais nítidas. Assim como descrito por Sobotta (2007), a maioria dos preparados histológicos apresentam apenas uma fatia do tecido, que não significa representar o todo, e sim apenas o fragmento fixado. Assim, quanto mais lâminas são feitas do mesmo tecido é possível obter um melhor espelho deste, pois nem sempre determinada estrutura ou processo patológico está presente em todo o órgão/tecido, podendo aparecer simplesmente em algumas destas lâminas.
4.1 Coleta e preparo das amostras biológicas
A coleta é o primeiro passo frente a um protocolo histotécnico, ela pode ser feita em seres vivos (como no caso das biópsias), prévia-autanásia (Figura 1) ou em cadáveres (Figura 2). Os cadáveres humanos encontravam-se fixados, submerso em tanque com solução de formaldeído, no laboratório da instituição. Já o modelo animal, foi necessário fazer autanásia, por meio de perfusão cardíaca, o que é bastante utilizado nas pesquisas médicas veterinárias, pois simula o funcionamento do sistema circulatório, levando (através dos vasos sanguíneos) preparados químicos capazes de causar a morte do animal, além de fixar os tecidos. Após a coleta, o material foi identificado e registrado em livro histotécnico, cada órgão/tecido recebe um código numérico, que acompanha-o em todas as etapas seguintes (SANTOS et al. 2021). Todas as estruturas foram fotografadas, permitindo a realização de análise descritiva e comparativa entre os tecidos de ratos e humanos, tanto a nível macroscópico, quanto e microscópico.

4.1.1 Amostras biológicas de animais
Os ratos estavam com 03 meses de vida. Foram transportados do biotério para o LABCIM do Departamento de Morfologia. Receberam uma dose de analgésico (Ketamina), administrado via intramuscular, no músculo vasto lateral e uma superdosagem de Cloreto de Potássio, até ser observado parada cardiorrespiratória e óbito. Em seguida foi realizada a perfusão intracardíaca do fixador (solução de formol tamponado 10%), o qual, tem função de alcançar o interior dos tecidos rapidamente pelos vasos sanguíneos, resultando em uma fixação melhor dos órgãos. Os animais perfundidos foram armazenados imersos na mesma solução fixadora por no mínimo 48h. As amostras coletadas foram artéria aorta (Figura 3) e veia cava superior (Figura 4). Tanto no rato macho quanto na fêmea foram coletados fragmentos de tamanhos parecidos. Uma particularidade na eutanásia da fêmea foi a necessidade de exanguinação, para que a morte do animação fosse mais rápida. Foi administrado heparina intracardíaca (anticoagulante), que agiu impedindo a formação de coágulos nos vasos e demais tecidos. Após a exsanguinação foi perfundido a solução fixadora, intracardíaca, o fármaco distribui-se através dos vasos sanguíneos até que seja observado o gotejamento de líquidos pela narina do animal, certificando que a perfusão atingiu a maior parte do roedor.

4.1.2 Amostras biológicas do humano
As amostras de material biológico humano foram obtidas de peças cadavéricas humanas naturais, também fixadas em solução de formalina 10%. Foi colhido a parte ascendente da artéria aorta(Figura 5 e 6) e a veia cava superior (Figura 7), uma vez que estas estruturas possuem fácil visualização anatômica macroscópica tanto no ser humano, quanto animal. Ainda, foram utilizados modelos didáticos anatômicos artificiais para melhor correlação sobre a organização estrutural dos vasos (Figura 8), servindo ainda para revisar e comparar os órgãos e tecidos das diferentes espécies.
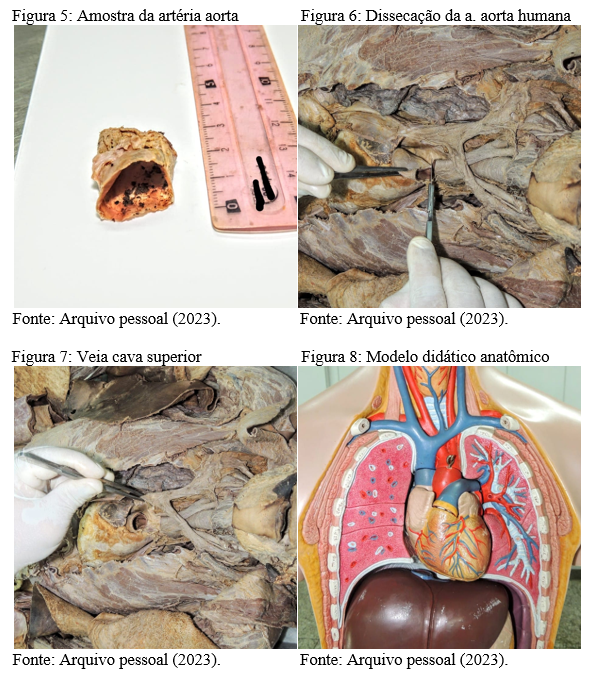
4.2 Análise comparativa e descritiva da macroscopia
Em ambas espécies, a parte ascendente da artéria aorta sai do coração passando anteriormente à artéria pulmonar direita e emergem dois ramos de artérias coronárias, direita e esquerda, que servem para nutrir a própria musculatura cardíaca. Segundo Treuting, Dintzis e Montine (2017), as estruturas anatômicas e histológicas do sistema circulatório entre humanos e ratos compartilham muitas semelhanças, a maior diferença está na espessura das paredes das artérias dos ratos, que é mais delgada, esta diferença pode ter relação em função do peso corporal, idade, sexo e tensão.
Em nenhum momento a espessura da parede das veias foi maior do que a das artérias, mesmo que o calibre seja equivalente nos diferentes tipos de vasos. O calibre da parte ascendente da artéria aorta nos cadáveres humanos foi cerca de 25 vezes maior que o calibre desses mesmos vasos nos roedores, conforme a comparação feita nos tecidos coletados. Isso pode estar associado não apenas às diferenças nos tamanhos e estatura das diferentes espécies, como também na potência da pressão arterial submetida nestes vasos, pois tende a se diferenciar devido a adoção da posição funcional destes seres, uma vez que o ser humano evoluiu para uma locomoção bípede, sobre os MMII, enquanto os ratos são mamíferos quadrúpedes, ou seja, caminham sobre os quatro membros. Estes fatos podem influenciar também na distribuição do sangue, uma vez que o ser humano necessita de uma potência maior do coração para que o sangue chegue equilibrado em todos os tecidos, sobretudo à cabeça e pescoço, que se encontra acima do nível do órgão. A diferença no calibre do vaso também foi notada quando comparado a veia cava superior dos tecidos humanos, em relação aos ratos.
A aorta ascendente dos humanos mediram cerca de 5cm de comprimento, enquanto a dos ratos variaram entre 1,5cm e 2cm. Já a veia cava superior, mediu cerca de 2cm de diâmetro e 7cm de comprimento nos humanos e 4mm de diâmetro e 2cm de comprimento nos ratos, sendo que metade desse comprimento situava-se dentro do saco pericárdico e coberta pelo pericárdio seroso.
A veia cava do rato parece ser diferente comparada a outros mamíferos. Existem duas pré-cavas, a pré-cava direita une-se diretamente ao átrio direito e a pré-cava esquerda estende-se caudalmente, unindo-se à veia ázigos, depois une-se à pós-cava e, finalmente, une-se ao átrio direito (SUCKOW et al., 2019). Ademais, não foram encontradas diferenças significativas entre os vasos sanguíneos de mesma espécie, quando comparado masculino e feminino, apenas no tamanho em comprimento por conta da diferença de estatura. Os modelos do sexo masculino, tanto humano quanto animal, foram maiores que os do sexo feminino, o que não pode ser diagnósticado como uma diferença marcante entre os sexos, pois indivíduos de uma mesma espécie podem ter tamanho corporal diferente, inclusive seres vivos do sexo feminino podem ser maiores que os mesmos do sexo masculinos, assim como outras difereças inerentes ao sexo, sejam anatômicas, fisiológicas ou genéticas.
4.3 Etapas do processamento histológico:
Além da revisão bibliográfica prévia a respeito das etapas para a fabricação de lâminas, foi utilizado o protocolo do próprio laboratório de histologia da UFPI, visto a realidade e disponibilidade de insumos físicos e materiais de cada laboratório. Os procedimentos realizados, além da eutanásia descrita anteriormente, incluem: coleta do material, fixação, clivagem, processamento, inclusão, microtomia e coloração.
- Coleta: Consiste em remover amostras de tecido de um determinado organismo, no caso desta pesquisa foi coleta já em organismos mortos e fixados. Após a coleta, o material foi armazenado em potes individuais de vidro com sistema de vedação, e registrado em livro de protocolo, com a identificação da peça: órgão, número, data e nome dos pesquisadores. Para que a coleta fosse possível no modelo animal, os ratos (já eutanasiados) foram presos na calha (estrutura de madeira) pelos membros, com uso de fio de algodão (Figura 9) e em seguida dissecado (Figura 10), iniciando pela remoção da cabeça, seguida pela retirada do tecido epitelial e exposição dos músculos. Todo material oriundo de ser vivo deve ser tratado como infectante, dessa forma foram feitas medidas de proteção por meio do uso de equipamentos de proteção individual (máscara cirúrgica, avental, luvas de procedimento, óculos de proteção e outros).
- Fixação: O objetivo da fixação é prevenir autólise, foi utilizado um fixador do tipo aldeído, ou seja, o próprio formaldeído tamponado a 10%, visto ser de fácil acesso e de baixo custo financeiro. O mesmo é comumente utilizado em laboratórios de toda a área de morfologia. Sobotta (2017), afirma que na etapa de fixação os tecidos ficam preservados e estáveis, em condições o mais semelhante possível da condição em vida, evitando a decomposição e putrefação (processo de apodrecimento), além de promover endurecimento do tecido, que facilitará o corte.
- Clivagem: Consiste em reduzir o tamanho do fragmento coletado, neste caso foi necessário reduzir as dimensões apenas dos vasos dos cadáveres humanos, não havendo necessidade de reduzir o tamanho do fragmento coletado dos vasos dos ratos, pois suas dimensões já eram compatíveis com o tamanho do cassete histológico e do molde de emblocamento. O corte foi feito com uso de navalha ou bisturi, em corte único. Assim, os tecidos foram depositados em cassetes (também pode ser utilizado cápsulas histológicas de metal), acompanhadas do código do tecido que foi registrado em livro.
- Processamento: O objetivo do processamento é retirar os líquidos do tecido e difundir outros, para isso, é utilizado alguns reagentes capazes de penetrar no interior destes tecidos. Esta etapa torna o fragmento mais maleável à secção pelo micrótomo. Na UFPI o processamento utiliza parafina, para isso, as etapas foram: 1. Desidratação: consiste na remoção da água dos tecidos, onde foi necessário fazer brevemente as concentrações de álcoois com o uso do densímetro, o tecido passou então por banhos em concentrações crescentes de álcool (70%, 80%, 90%, Absoluto I e Absoluto II); 2. Clarificação: Visa remover o álcool e substituir por xilol, passando por dois potes (xilol I e xilol II) com mesma concentração química, por um hora em cada, pois a parafina não se mistura completamente com o álcool, conforme o xilol entra no tecido ele fica mais translúcido; 3. Impregnação: Os tecidos foram colocados na parafina líquida, dentro de uma estuda por 1h, em parafina I e 1h na parafina II. A temperatura da estufa depende da qualidade da parafina, o objetivo aqui é que ela esteja em um ambiente capaz de mudá-la do estado sólido para o líquido, para que ela penetre no tecido.
- Inclusão: Nesta etapa é retirado o tecido da estufa e moldado em blocos. Para isso, ao manipular o tecido, é usado pinças aquecidas em chama de fogo, para que a parafina não volte ao estado sólido rapidamente (prevenindo o tecido de bolhas de ar). É importante colocar a superfície (do tecido) a ser cortada voltada para baixo, e em cima colocar um fino papel manteiga com a identificação acima do bloco. Após o resfriamento, os blocos de parafina com o material incluído são obtidos.
- Microtomia: São produzidas películas muito finas através de cortes no aparelho chamado micrótomo giratório, o ideal é ter espessuras entre 3 a 6 micrômetros. A navalha é individual para cada tecido e precisa estar sempre nova, afiada e livre de dentes. O bloco é colocado no aparelho e em seguida é rotacionado a alavanca, fabricando cortes precisos e delgados. No início é preciso desgastar um pouco o bloco, para que a maior parte da parafina saia e exponha o tecido. Após isto, as fitas são colocadas flutuando sobre a água na bacia em banho maria, ambientada em 40% a 50%. As fitas ficam na superfície da água, assim elas podem ser pescadas com a lâmina histológica previamente albunizada (a albumina facilita a adesão do tecido na lâmina). Após a microtomia, o preparado histológico está pronto para ser corado.
4.4 Coloração
A utilização de corantes é essencial para uma melhor visualização em microscópio, pois permite que as células se apresentem em tons e cores diferentes, de acordo com o objetivo da análise. Na rotina geral dos laboratórios (assim como no laboratório de histologia da UFPI), para se observar os componentes teciduais, a técnica utilizando Hematoxilina e Eosina (um corante básico e outro ácido, respectivamente) é muito indicada. Já para estudos mais específicos pode haver uma necessidade de trabalhar com outros corantes. (SANTOS et al. 2021).
Sobotta (2007), afirma que a hematoxilina e eosina (HE) são os corantes mais utilizados nas pesquisas biomédicas, visto que a hematoxilina cora muito bem, em tonalidade azul ou violeta, os núcleos de células e área de citoplasma. E a eosina, cora regiões citoplasmáticas e outros componentes extracelulares fibrosos, na cor vermelho e rosa. A coloração carrega o intuito de proporcionar um melhor contraste, de acordo com os corantes utilizados, favorecendo a diferenciação e destaque entre os componentes celulares.
Assim, foi revisado na literatura o procedimento operacional padrão para coloração usando HE, porém, houve adaptação e seguimento conforme protocolo da própria UFPI, seguindo uma bateria de coloração, que consiste em:
- Desparafinização: Ocorre a retirada da parafina do tecido, as lâminas são organizadas em um berço histológico (recipiente que organiza e dão suporte às lâminas) e colocadas dentro da estufa aquecida, para derreter parte da parafina. Após isso, as lâminas passam por três potes de xilol (I, II e III), 5 minutos em cada;
- Hidratação: É feito o caminho reverso da etapa de desidratação, ou seja, as lâminas passam por uma sequência de álcoois, dessa vez no sentido contrário, decrescente. Sucedendo pelos álcoois absolutos I, II e III, depois pelos álcoois de 100% até o álcool 70%, passando 3 minutos em cada, seguida por banho em água corrente por 10 min.
- Coloração: Etapa no qual as lâminas são submersas nos corantes hematoxilina e eosina, para a posterior visualização em microscópio. Na hematoxilina é necessário passar 45 segundos, seguida de banho em água corrente, para retirar o excesso do corante. Em seguida, 30 segundos na eosina e finaliza com 6 mergulhos em água parada;
- Desidratação e clarificação rápida: As lâminas já coradas recebem 6 mergulhos no álcool 70% e banhos de 5 minutos em álcool absoluto, seguida de banhos em xilol I, II e III;
- Montagem: O tecido é coberto por uma lamínula. Na primeira fase da pesquisa foi colocado uma pequena quantidade de verniz acrílico para auxiliar na aderência da lamínula. Já nas demais fases da pesquisa foi utilizado bálsamo do Canadá, reduzindo assim o aparecimento de artefatos histológicos relacionados a etapa de montagem.
4.5 Análise comparativa e descritiva da microscopia
Possuem dois tipos de artérias, as elásticas e as musculares. A artéria aorta (Figuras 11 e 12) é do tipo elástica, possui as três túnicas (íntima, média e adventícia), sendo que a túnica média é bastante espessa, com um maior número de fibras musculares lisas e fibras elásticas, que auxiliam no comportamento do vaso durante a sístole e diástole do coração, regulando também a pressão arterial no interior desses vasos (Spence, 1991).
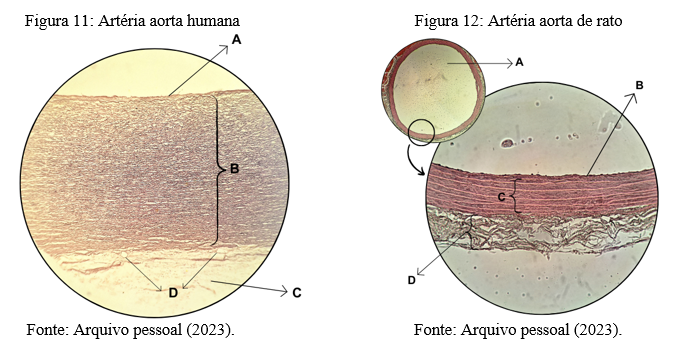
A fotografia da lâmina apresentada na figura 11 é um corte histológico transversal da parte ascendente da artéria aorta de um cadáver humano feminino. Ampliada 10X em microscópio óptico. Observe a típica demonstração das camadas de uma artéria: túnica íntima (A), túnica média (B) e túnica adventícia (C). Além da presença de vasa vasorum (D). Nota-se também numerosas fibras musculares lisas (coradas em rosa) e fibras elásticas (coradas em violeta escuro) na camada mais espessa, compondo a túnica média.
Já nas imagens da figura 12, observe duas imagens em círculos: a menor é um corte transversal da parte ascendente da artéria aorta de um rato, ampliada 10X em microscópio óptico. Note que a circunferência da artéria encontra-se intacta, com lúmen bastante dilatado (A) e mantendo o formato da artéria. A imagem maior da figura 12 é uma ampliação em 40X de um campo da parede deste mesmo vaso, onde pode ser visto as túnicas íntima (B), média (C) e adventícia (D).
Comparando estas duas lâminas, notamos que a túnica média no modelo humano é muito espessa, comparada às demais camadas. Já no modelo animal, esta mesma túnica possui espessura equivalente à túnica adventícia. Por outro lado, a túnica adventícia de rato encontra-se morfologicamente mais organizada e nítida do que no tecido humano.
Estas observações vão de encontro com as afirmações de Spence (1991): A túnica íntima é a camada mais interna, possui uma camada de epitélio pavimentoso simples, o endotélio, que está presente em todos os vasos sanguíneos e é uma continuidade do endocárdio. A túnica média costuma ser mais espessa e contém fibras musculares lisas e fibras elásticas. A túnica externa (ou adventícia), possui tecido conjuntivo com fibras elásticas e colágenas. Ainda, as artérias possuem uma lâmina elástica interna entre a túnica íntima e a média, e uma lâmina elástica externa entre as túnicas média e adventícia, e também uma de camada de tecido conjuntivo, e uma membrana basal.
As diferenças histológicas entre artérias e veias são fáceis de serem identificadas quando se tem um vaso ao lado do outro, o que pode ser observado por meio da figura 13, que mesmo não sendo objeto de estudo desta pesquisa, apresenta diferenças significativas quando comparado estes dois tipos de vasos sanguíneos.
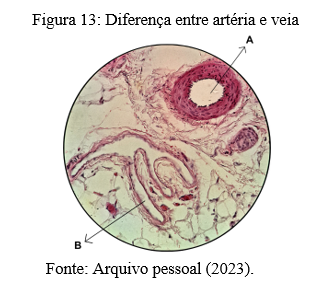
Esta lâmina foi obtida por um aumento de 40X da região circunvizinha da veia cava superior de um rato (macho). Veja que a espessura da parede dos vasos são totalmente diferentes uma da outra. A pequena artéria (A) possui paredes bem espessas, lúmen circular, dilatado e a circunferência encontra-se mantida. Inclusive, pode ser visualizado o epitélio pavimentoso simples do endotélio. Já na veia (B), a parede do vaso é bem mais fina e de estrutura mais frouxa, encontra-se colabada, chegando a fazer pregas em si própria.
A veia cava superior (Figuras 14 e 15) possui as mesmas estruturas das artérias, porém a túnica média é menos espessa e possui poucas fibras musculares. A maior parte de sua estrutura é composta de túnica externa (adventícia), mesmo apresentando poucas fibras elásticas. Além disso, não possuem lâminas elásticas interna e externa. Em geral as veias possuem lúmen maior, paredes mais delgadas, válvulas (pregas na túnica íntima) que direcionam sangue ao coração. E sua nutrição ocorre por meio de difusão e presença de vasa vasorum (Spence, 1991).
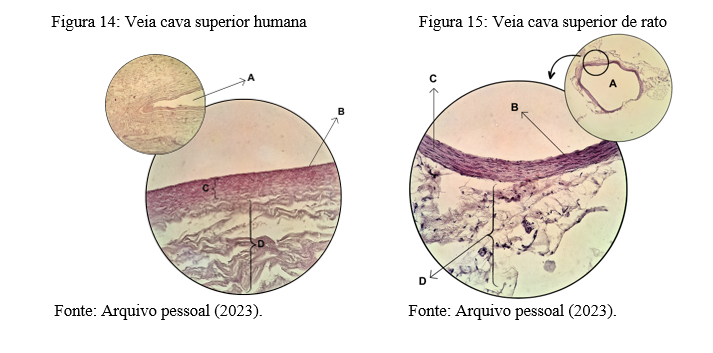
A figura 14 também é composta por duas imagens, a menor é uma secção transversal da veia cava superior de um cadáver do sexo feminino, ampliada em 10X, onde pode ser visto o lúmen do vaso (A). Note que a circunferência não é um círculo perfeito, como no caso das artérias, mas sim achatada. Isso se dá ao fato das veias possuírem essa característica de colabar, ou seja, as paredes se aproximam por conta da própria morfologia das veias, que possuem menos fibras musculares e elásticas, que dariam sustentação ao vaso. A imagem maior desta mesma fígura consiste em um campo da parede de uma veia cava superior de um cadáver humano do sexo masculino, apliada em 40X. As túnicas íntima, média e adventícia estão representadas pelas letras B, C e D, respectivamente.
A figura 15 também é um corte transversal da veia cava superior, porém de uma rata fêmea, a imagem menor encontra-se em um aumento de 10X, e a maior em 40X. Observe o lúmen do vaso pela letra A, onde as paredes do vaso mostram-se tortuosas, porém, não colabadas. As túnicas estão representadas pelas letras B, C e D, orientadas da interna para a mais externa.
Ao comparar estas duas imagens microscópicas, veja que a células das túnicas do ser humano se diferenciam gradativamente, montando uma espécie de degradê, onde as células da camada interna estão mais unidas, enquanto as da camada mais externa encontram-se mais frouxas, sendo difícil apontar precisamente onde acaba uma camada e começa a outra, justamente por não haver uma lâmina que cumpra o papel de delinear estas estruturas. Já quando analisamos as camadas do tecido animal, é facilmente notório a diferenciação de túnica média para a adventícia,tanto em termos de coloração como composição dos tecidos. Em ambas espécies a túnica externa é mais desenvolvida que as demais. Além disso, não foi possível obter cortes histológicos que mostrassem os vasos de nutrição.
Os vasos chamados vasa vasorum (vaso dos vasos), servem para nutrir o próprio tecido vascular e estão localizados em maior parte na túnica mais externa de vasos calibrosos. São originados do próprio vaso ou de outros vasos que passam próximo a este (Spence, 1991).
5 CONSIDERAÇÕES FINAIS
A presente investigação buscou analisar, comparar e descrever a morfologia macro e microscópica dos vasos sanguíneos entre humanos e ratos wistar, em especial a artéria aorta ascendente e a veia cava superior. Pode-se concluir que há semelhanças entre as espécies, porém, houve diferenças muito significativas em relação ao tamanho, calibre e organização dos tecidos e células.
Modelos animais como coelhos, porquinho-da-índia, ratos e camundongos são muito utilizados pela indústria para testar produtos e terapêuticas, antes que estes sejam aplicados em humanos, porém, cabe aos órgãos competentes investirem em estudos minuciosos, como este, que comparar espécies distintas, pois a absorção de produtos e/ou drogas é diferente e comporta-se conforme a proporção e número de células disponíveis em cada órgão/tecido.
O estudo permitiu que o discente tivesse mais contato com as ciências morfológicas e poder colocar em prática os conhecimentos adquiridos nas disciplinas de anatomia, embriologia e histologia, ao mesmo tempo, conhecer o processamento histotécnico para produção de lâminas e criar vínculo com os profissionais técnicos de laboratórios, além de compartilhar conhecimento com discentes de outros cursos, como biologia, medicina humana e medicina veterinária.
A manipulação de animais para pesquisa foi enriquecedora e aproximou o acadêmico do meio científico e futuro ingresso em um programa de pós-graduação na área. Somando-se a isso, não há na literatura estudos consistentes descrevendo a morfologia dos vasos da base do coração de ratos. Portanto, é de suma importância o estudo morfológico comparativo dos vasos da base do coração entre seres humanos e animais, como os ratos. Espera-se que mais pesquisas deste nível sejam realizadas, com objetivo de gerar ciência e contribuir com a saúde.
REFERÊNCIAS
BATISTA, A. V. S.; PORTO, E. A.; MOLINA, G. P. Estudo da anatomia da artéria coronária esquerda e suas variações: perspectivas de nova classificação. Revista Saúde & Ciência, vol.1, n.2, p.55-65; 2011.
BRASIL. Presidência da República. Lei nº 5.501, de 30 de novembro de 1992. Dispõe sobre a utilização de cadáver não reclamado, para fins de estudos ou pesquisas científicas e dá outras providências. Brasília, DF. Disponível em: L8501 (planalto.gov.br) . Acesso em: 29 mar. 2023.
BRAZ, P. R. P. Método didático aplicado ao ensino da anatomia humana. Anuário da produção acadêmica docente, v. 3, n. 4, p. 303-310, 2009.
CHAPMAN, J. A.; LEE, L. M. J., SWAILES, N. T. From Scope to Screen: The Evolution of Histology Education. Adv Exp Med Biol., v. 1260, p. 75-107, 2020.
DUTRA, A. F.; NICOLA, A. L. P.; SOUSA, L. A.; YAMAGUTI, S. T. F.; SILVA, A. P. L. Anatomia e Fisiologia Cardiovascular. In: Enfermagem em Cardiologia Intervencionista. 1a ed., Editora dos editores, Rio de Janeiro, 2019.
JUNQUEIRA, L. C.; CARNEIRO, J. Histologia Básica – Texto e Atlas. 12ª edição. Rio de Janeiro: Guanabara-Koogan. p. 200-216. 2013.
JUNQUEIRA, L. C.; CARNEIRO, J. Histologia Básica – Texto e Atlas. 13ª edição. Guanabara-Koogan. 2017.
PORTO, G. G.; VASCONCELOS, B. C. E.; ANDRADE, E. S. S.; SILVAJUNIOR, V. A. Comparison between human and rat TMJ: anatomic and histopathologic features. Acta Cirúrgica Brasileira, v. 25, n. 3, 2010.
SANTOS, K. R. P. S., et al., Manual de técnica histológica de rotina e de colorações. Universidade Federal de Pernambuco. Vitória de Santo Antão, 23 ed., 2021.
SLONE, E. A.; FLEMING, S. D. Membrane lipid interactions in intestinal ischemia/reperfusion-induced Injury. Clin Immunol., v. 153, n. 1, n. 228-40, 2014.
SOBOTTA, J.; Atlas de histologia: citologia, histologia e anatomia microscópica. 7ª edição. Rio de Janeiro: Guanabara Koogan, 2007.
SPENCE, A. P.; Anatomia Humana Básica. 2ª edição, São Paulo: Editora Manole, 1991.
SUCKOW, M.A.; HANKENSON, F.C.; WILSON, R.P.; FOLEY, P.L. (Ed.). The laboratory rat. Elsevier, 3ed. 2019.
TREUTING, P. M.; DINTZIS, S.; MONTINE, K. S. (Ed.). Comparative anatomy and histology: a mouse, rat, and human atlas. Academic Press, 2ed, p. 163-189, 2017.
VIEIRA, F. S.; Introdução à microscopia. São Cristóvão: Universidade Federal de Sergipe – CESAD, 2008.
VIEIRA, P. R.; A utilização do cadáver para fins de estudo e pesquisa científica no Brasil. Revista Brasileira de Educação Médica. v.25. nº 2. Rio de Janeiro, 2001.
[1] Discente do Curso de Enfermagem da Universidade Federal do Piauí, Campus Ministro Petrônio Portela, e-mail: carlosguilherme178@gmail.com
[2] Discente do Curso de Enfermagem da Universidade Federal do Piauí, Campus Ministro Petrônio Portela, e-mail: liviakarenbb@gmail.com
[3] Discente do Curso de Medicina da Universidade Federal do Piauí, Campus Ministro Petrônio Portela, e-mail: joaoarthur@ufpi.edu.br
[4] Discente do Curso de Medicina da Universidade Federal do Piauí, Campus Ministro Petrônio Portela, e-mail: lucasleo21@hotmail.com
[5] Técnico de Laboratório da Universidade Federal do Piauí, Campus Ministro Petrônio Portela, e-mail: guerrapsergio@gmail.com
[6] Professora Associada de Anatomia Humana da Universidade Federal do Piauí, Campus Ministro Petrônio Portela, e-mail: zulmira@ufpi.edu.br
[7] Professora Adjunta de Anatomia Humana da Universidade Federal do Piauí, Campus Ministro Petrônio Portela, e-mail: kpalombit@gmail.com
[8] Professora Adjunta de Anatomia Humana da Universidade Federal do Piauí, Campus Ministro Petrônio Portela, e-mail: karinnsoares@yahoo.com.br
