PATHOLOGY LABORATORY ACCREDITATION
REGISTRO DOI: 10.5281/zenodo.12740358
Afonso Cândido de Lima Júnior
Orientador: Maiko Ramos Maia
RESUMO
Este trabalho aborda a acreditação hospitalar, com um enfoque específico em laboratórios de patologia, destacando sua importância para a padronização, segurança e qualidade dos serviços de saúde. A pesquisa se desdobra em várias seções principais. A introdução introduz a acreditação como um processo educativo e não punitivo, destacando seu papel na melhoria contínua dos procedimentos hospitalares e laboratoriais. Discute o histórico da acreditação hospitalar, seu desenvolvimento global e a implementação no Brasil, enfatizando o crescente número de hospitais acreditados e a importância dessa certificação para laboratórios de patologia. A História da Acreditação traça a evolução dos sistemas de qualidade em laboratórios, desde os primeiros padrões europeus e ISO até as práticas atuais. Discute a adoção de padrões como ISO 15189 e o papel de organizações internacionais e nacionais na promoção da acreditação. A preparação para a acreditação laboratorial detalha os passos necessários para laboratórios se prepararem para a acreditação, incluindo a escolha de padrões, o comprometimento da gestão, e a importância da autoavaliação e da consultoria profissional. Descreve-se também as principais entidades desenvolvedoras de padrões e acreditadoras, como a ISO, CAP, ONA, e outras, destacando suas contribuições específicas para a acreditação de laboratórios de patologia. Por fim, o trabalho reflete sobre a cultura de qualidade nos laboratórios brasileiros, destacando a acreditação como um diferencial estratégico e a necessidade de superar resistências à implementação de sistemas de qualidade. Discute as limitações do estudo, como o número de participantes entrevistados, e sugere direções para futuras pesquisas. O trabalho enfatiza a acreditação como uma ferramenta crítica para garantir a competência técnica e a qualidade dos serviços em laboratórios de patologia, destacando os desafios, as adequações necessárias e o impacto educativo e qualitativo que a acreditação promove no ambiente de saúde.
Palavras-Chave: Acreditação Hospitalar. Qualidade em Laboratórios. Padrões ISO
ABSTRACT
This paper addresses hospital accreditation, with a specific focus on pathology laboratories, highlighting its importance for standardization, safety, and quality of healthcare services. The research unfolds across several main sections. The introduction presents accreditation as an educational and non-punitive process, emphasizing its role in the continuous improvement of hospital and laboratory procedures. It discusses the history of hospital accreditation, its global development, and implementation in Brazil, stressing the increasing number of accredited hospitals and the significance of this certification for pathology laboratories. The History of Accreditation traces the evolution of quality systems in laboratories, from the first European and ISO standards to current practices. It discusses the adoption of standards such as ISO 15189 and the role of international and national organizations in promoting accreditation. The preparation for laboratory accreditation details the necessary steps for laboratories to prepare for accreditation, including the choice of standards, management commitment, and the importance of self-assessment and professional consultancy. It also describes the main standard-developing and accrediting entities, such as ISO, CAP, ONA, and others, highlighting their specific contributions to the accreditation of pathology laboratories. Finally, the paper reflects on the quality culture in Brazilian laboratories, highlighting accreditation as a strategic differentiator and the need to overcome resistance to the implementation of quality systems. It discusses the study’s limitations, such as the number of interviewed participants, and suggests directions for future research. The paper emphasizes accreditation as a critical tool to ensure technical competence and the quality of services in pathology laboratories, highlighting the challenges, necessary adjustments, and the educational and qualitative impact that accreditation promotes in the healthcare environment.
Keywords: Hospital Accreditation. Laboratory Quality. ISO Standards
1 INTRODUÇÃO
A acreditação hospitalar pode ser entendida como um meio para assegurar a padronização e uniformização dos protocolos de atendimento e segurança do paciente nos hospitais, na medida em que avalia e certifica a qualidade dos serviços de saúde. Para tanto, não assume caráter punitivo, e sim educativo, buscando atingir a melhoria contínua dos procedimentos (ONA, 2019).
Caracteriza-se por ser um processo é pautado por três princípios: voluntariado – nenhum hospital é obrigado a ser acreditado; periodicidade – é uma avaliação contínua; e sigilo – as informações coletadas no processo da avaliação não são divulgadas (ONA, 2019). Desta forma, a acreditação busca certificar que o hospital que possui procedimentos adequados e dignos de atendimento e, por isso, deve ser entendida como um benefício para o estabelecimento, sendo de extrema importância a sua implantação. De fato, ela vem ganhando espaço na comunidade técnica e científica.
A década de 1990 pode ser considerada um marco para o início da acreditação hospitalar com destaque para I Seminário da Organização Panamericana de Saúde (OPAS), quando foram iniciadas as discussões acerca do sistema de qualidade americano e canadense. Em 1991, aconteceu um seminário em Washington que serviu como referência para a construção de um manual de acreditação da OPAS para a América Latina.
No Brasil, já no ano de 1995, o Ministério da Saúde (MS) formou um grupo de estudos para discutir a implantação da acreditação no Brasil. Desse encontro, nasceu o primeiro Manual Brasileiro de Acreditação Hospitalar. Com a criação da Organização Nacional de Acreditação (ONA) em 1999, os estudos em acreditação começaram a intensificar-se e as instituições certificadoras buscaram a ONA para iniciar o processo de definição de um sistema de avaliação. No Brasil, atualmente, existem 348 hospitais acreditados (ONA, 2019).
Nesse cenário, por meio da acreditação hospitalar acredita-se ser possível estabelecer critérios que minimizem as dificuldades enfrentadas pelos hospitais alagoanos. Do ponto de vista da produção do conhecimento, a acreditação é um tema que vem sendo estudado em diversas modalidades de trabalho acadêmico, incluindo teses, dissertações e trabalhos de conclusão de curso, corroborando a aproximação entre academia e organizações hospitalares e a necessidade de modernização dos processos em saúde e controle da qualidade das ações de assistência prestadas (Sousa et al., 2015).
Entretanto, observa-se ainda a lacuna apontada por Manzo (2009) por trabalhos que se proponham a dar voz a um dos grupos que está diretamente relacionado ao processo da acreditação hospitalar, qual seja, o dos trabalhadores de organização.
Sabe-se que o laboratório de patologia necessita definir suas prioridades, tais como precisão diagnóstica, organização e integração extra institucional. A busca pela qualidade visa melhorar os índices de erros diagnósticos e diminuir o tempo de resposta com rastreabilidade de amostras entre os procedimentos realizados dentro do laboratório.
Laboratórios médicos serão o centro da atenção no que diz respeito a qualidade devido a seu amplo impacto no cuidado médico no diagnóstico, tratamento e ações preventivas. A acreditação é o processo de reconhecimento formal e voluntário feito por um organismo de acreditação de que certa instituição prestadora de serviços, além de ter um bom sistema de gestão da qualidade, apresenta capacidade técnica para desempenhar suas atividades específicas com segurança para os consumidores através da comprovação de competências e de atividades de fortalecimento institucional (Guzel, 2009).
As demandas de mercado têm exigido diferenciação da qualidade dos serviços prestados. Padrões assistenciais são perseguidos e aplicados em vários países e a acreditação tem sido usados como marcadores de qualidade e, consequentemente, reputação. Neste contexto, o presente trabalho tem como objetivo verificar os principais desafios e adequações necessárias para a acreditação em laboratórios de patologia. Participaram desta pesquisa 7 (sete) gestores de laboratórios públicos de anatomia do Estado do Amazonas, que responderam um questionário via Google Forms, composto por 67 questões. O intuito desta pesquisa é contribuir para a melhoria da qualidade dos laboratórios do Estado.
2 REVISÃO DE LITERATURA
2.1 HISTÓRIA DA ACREDITAÇÃO
Sistemas de qualidade em laboratórios começou há muitas décadas. Os primeiros passos exigidos são a implementação de sistemas internos e externos de controle de qualidade e seus princípios básicos na prática diária do laboratório.
Um importante passo dos sistemas de acreditação foi a elaboração do padrão europeu EN 45 001, que especificava critérios gerais a operação de laboratórios. O passo seguinte para a acreditação foi o padrão ISO 17025 (Requisitos gerais para a competência de laboratórios de teste e calibração). Este padrão foi amplamente utilizado em laboratórios de testes na indústria, também contemplando serviços médicos.
Outros padrões nacionais ou internacionais como Joint Commission International (JCI), SLIPTA –WHO, Clinical Pathology Accreditation (CPA) no Reino Unido, College of American Pathologists (CAP) nos EUA, Código de Prática CCKL na Holanda ou padrões, baseados no International Society for Quality in Healthcare (ISQUa) também são usados em alguns países para acreditação.
As principais organizações acreditadoras reconhecem o padrão ISO 15189 como sendo o mandatório a ser utilizado em laboratórios. A primeira edição se deu em 2003 e atualmente está em vigor a terceira, ISO 15189:2012 (Laboratórios médicos – Requisitos para qualidade e competência), que enumera todos os processos necessários à política de qualidade e requisitos ao usuário.
Na Europa, a European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) criou o Comitê de Qualidade e Regulação com Grupo de Trabalho – Credenciamento e normas ISO / CEN (WGA / ISO) que cooperam com a EA, Comitê Técnico da Organização Internacional de Normalização 212 (ISO / TC 212) e Comitê Técnico do Comitê Europeu de Normalização 140 (CEN / TC140 ) com o objetivo de harmonizar a acreditação de laboratórios médicos. No ano de 2000, metade das instituições acreditadoras encontravam-se instaladas na Europa (THURNEYSEN, 2016).
Nos EUA, em 1951, em busca de redução de desperdícios de recursos e melhora do gerenciamento, criou-se a Joint Commission on Accreditation of Healthcare Organizations (JCAHO), posteriormente rebatizado como Joint Commission International (JCI).
A experiência norte-americana inspirou o Programa Brasileiro de Acreditação Hospitalar, desenvolvido pelo Ministério da Saúde, dentro do Programa de Garantia e Aprimoramento da Qualidade em Saúde, foi criado através da Portaria GM/MS n.º 1.107, de 14 de junho de 1995.
O pioneirismo norte-americano na acreditação hospitalar resultou em 88% de hospitais acreditados no ano de 2018 (JHA, A.K., 2018). Os dados de pesquisa mostram que 50% dos países europeus usam apenas ISO 15189, 31% ISO 15189 (de preferência) e ISO 17025, 15% ISO 15189 e ISO 17025 e 4% apenas ISO 17025, para acreditação de laboratórios médicos. No Brasil, em 01/01/2021, um total de 321 dos cerca de 6000 hospitais brasileiros encontravam-se acreditados, ou seja, cerca de 5% (ORGANIZAÇÃO…, 2021). As principais áreas (mais de 80%) para acreditação são bioquímicas, hematologia, microbiologia, imunologia e genética molecular.
Um dos parâmetros mais críticos para a melhoria de qualidade em laboratórios são as atividades de educação continuada dentro e fora dos laboratórios, que são pontos chave no processo de acreditação e sistemas gestão de qualidade.
A acreditação é uma importante ferramenta para demonstrar competência do laboratório de patologia em todo o mundo. Sua realização está vinculada a auditorias periódicas a fim de estimular a manutenção e melhoria da qualidade de serviços prestados, levando a serviços de alto padrão fornecidos a pacientes e serviços de saúde.
Schneideret al (2017) citam como metas da acreditação laboratorial:
- Criar sistemas que sejam tão resistentes a falhas quanto possível, onde os erros são detectados antes que se tornem um problema e reduzir os erros acertando as coisas da primeira vez;
- Identificar oportunidades de melhoria em todos os momentos;
- Envolver e capacitar sua equipe, envolvendo-os na solução de problemas e a implementação de soluções.
Em alguns países a acreditação é ou será obrigatória (ex. França e China) e em outros alguns serviços específicos devem ser acreditados (ex. Alemanha) ou laboratórios acreditados têm melhor reembolso ou contrato com seguradoras de saúde (por exemplo, Suécia, Bélgica, República Tcheca, EUA e Brasil). De acordo com a Lei Francesa nº 2013-442 de 30 de maio de 2013, instituiu a obrigatoriedade de todos os laboratórios em 1º de novembro de 2020 (Boursier G et el, 2016).
2.2 PREPARAÇÃO PARA A ACREDITAÇÃO LABORATORIAL
Sistemas de qualidade para laboratórios podem ser baseados em diferentes padrões ou protocolos e o laboratório deve decidir a qual deles deve se submeter. A gerência máxima do laboratório candidato necessita comprometimento ao processo de acreditação e dar suporte completo a sua equipe em todos os aspectos. A coordenação de atividades pode ser muito ampla e detalhada para apenas um administrador. Uma pessoa deve ser devotada pelo desenvolvimento e manutenção da documentação de sistemas de qualidade.
Fundamental é o entendimento dos padrões de qualidade. Seus critérios devem ser discutidos com o máximo número de pessoas da equipe. Pontos fortes e fracos na prática vigente devem ser identificados. Todas as fraquezas devem ser revisadas.
Arranjos organizacionais, procedimentos e práticas devem ser esmiuçadas e reestruturados de maneira a atender requisitos dos padrões. Melhorias têm de ser feitas com base em avaliação. A autoavaliação é o passo mais crítico do processo de acreditação. Poucos laboratórios não necessitam de consultoria profissional nesta etapa.
2.3 PRINCIPAIS INSTITUIÇÕES DE ACREDITAÇÃO
O desenvolvimento dos programas de acreditação leva em conta setores abrangentes a específicos, envolvendo os setores hospitalares, laboratórios, laboratórios médicos e outras que o fazem especificamente aos laboratórios de patologia.
São consideradas, pela Resolução Normativa 405, de 09 de maio de 2016, como entidades acreditadoras pelo Qualis as pessoas jurídicas que têm reconhecimento de competência ou de metodologia emitidos pelo INMETRO e ou pela ISQua.
Entre as principais entidades desenvolvedoras de padrões estão:
A Organização Internacional de Padronização (ISO), segue como instituição mais conhecida entre as desenvolvedoras de padrões voltados a diversas áreas, incluindo serviços de saúde e, mais especificamente, laboratórios médicos, através do padrão ISO 15189:2012, que é considerado o padrão-ouro.
O Colégio Americano de Patologia (CAP) é a principal instituição acreditadora internacional com atuação específica em patologia. Seu checklist leva em conta todos os critérios vigentes ISO e adiciona a estes, itens específicos da área desenvolvidos através da colaboração de cerca de 500 patologistas. A obtenção de tal acreditação é passo importante rumo à certificação ISO.
A Organização Nacional de Acreditação (ONA) é uma organização não-governamental (ONG), fruto do Programa Brasileiro de Acreditação Hospitalar e abrange, também laboratórios, com intenso foco administrativo. Atualmente segue padrões e sua metodologia é reconhecida pela Sociedade Internacional para Qualidade em Saúde (ISQua).
O Programa de Acreditação e Controle de Qualidade da Sociedade Brasileira de Patologia (PACQ-SBP) foi iniciado a partir do ano de 2017 e cumpre papel semelhante ao CAP no âmbito nacional. O programa também cumpre com as determinações da RN 405-2016 da ANS.
Estas instituições podem ou não estar ligadas a outras responsáveis pela auditoria em campo naquelas unidades que se submetem ao processo de acreditação.
2.4 ETAPAS PARA A ACREDITAÇÃO LABORATORIAL
Os corpos de acreditação seguem os mesmos princípios para a acreditação ISO 15189:2012, sendo seus principais passos:
1) Obtenção de cópia oficial do padrão a qual a instituição será submetida.
2) Contrato inicial entre partes envolvidas.
3) A entidade acreditadora envia o checklist e lista de documentos necessários. O laboratório pode desempenhar a autoavaliação para verificar a conformidade com todos os requisitos do padrão usando tais checklists.
4) A inscrição do laboratório se completa e então reenvia o formulário e outros documentos exigidos com os pagamentos de taxas necessárias.
5) A instituição acreditadora revisa os formulários. Caso estes satisfaçam os itens para a continuidade do processo, auditores são designados conforme o escopo do processo.
6) Agendamento de visita in loco é decidido entre o laboratório e auditor chefe.
7) A pré-avaliação é realizada dependendo da solicitação do laboratório.
8) O laboratório necessita realizar um ensaio geral para a avaliação de acreditação. Os resultados da auditoria interna e análises da gestão devem ser verificados para garantir que os arranjos e procedimentos descritos nos manuais de qualidade estejam condizentes à situação real do laboratório.
2.5 PADRÕES DE ACREDITAÇÃO LABORATORIAL
Acreditação é o processo pelo qual um corpo competente dá reconhecimento formal a entidade ou pessoa de competência em determinado processo. Cada instituição acreditadora formula seus manuais e checklists de acordo com as metas de gerenciamento de qualidade a serem alcançados. O padrão ouro e mais reconhecida norma é a ISO 15189 para acreditação em laboratórios médicos. Sua última versão é de 2012 e tem melhores definições ligadas a segurança do paciente e estruturado via processos, apresentando variadas notas e exemplos, incluindo também gerenciamento de informação, conduta ética e normativa.
Entre requisitos de gerenciais estão enumerados processos de triagem, avaliação e transporte, devendo ser descritas precisamente as responsabilidades. O manejo de riscos é parte importante para se identificar ameaças à segurança do paciente e que processos devem ser desenvolvidos para eliminá-los. A quantificação de indicadores e revisão regular dos mesmos deve ser demostrada.
Entre itens avaliados ISO 15189: 2012 estão:
- Organização e gerenciamento de responsabilidade
- Ética em medicina laboratorial
– Princípios, coleta de informações e amostras
– Garantia de confidencialidade de informações
– Cumprimento de códigos éticos
- Avaliação por laboratório externo
- Resolução de queixas
- Identificação de conformidades e não-conformidades
- Ações corretivas
- Procedimentos, relevância e tipos de não-conformidades
- Ações preventivas
– Identificação de possíveis não-conformidades
– Procedimentos para identificação de causas-raiz
- Melhoria continuada
– Sistematização de processos
– Educação e treinamento
O laboratório deve melhorar continuamente o sistema de controle de qualidade, incluindo todos os processos do laboratório, ações corretivas e preventivas. Atividades de melhora devem ser direcionadas em áreas de alta prioridade baseada em avaliação de riscos.
- Controle de histórico
- Avaliações e auditorias
– Requisitos de avaliação periódica
– Avaliação do feedback de usuários
– Sugestões da equipe
A administração deve acionar mais a equipe para fazer sugestões de melhorias nos laboratórios e feedback fornecido à equipe.
- Auditorias internas
- Manejo de riscos
O laboratório deve avaliar seus processos e potenciais falhas em resultados de exames e deve atualizá-los para reduzir ou eliminar riscos identificados.
- Indicadores de qualidade
- Avaliação da administração
Requisitos técnicos:
Para os funcionários é importante a designação precisa de funções, suas competências e responsabilidades com avaliação da efetividade de melhora profissional contínua
- Recursos humanos
– Qualificação, educação e treinamento, descrição de função, administração
– Responsabilidades, competências, educação continuada e em gerenciamento de qualidade
– Confidencialidade de informação
– Reavaliação periódica
– Planejamento e sistema de educação
- Educação continuada e desenvolvimento profissional
– Programas de educação profissional devem ser disponibilizados ao pessoal que participa em gerenciamento e processos técnicos. A efetividade de processos contínuos de educação deve ser revisada periodicamente.
- Acomodações e condições ambientais.
– Local seguro para pacientes e equipe: espaço adequado
– Minimização de riscos de ferimentos
– Local para correta realização de procedimentos
– Implantação de políticas de combate a incêndios
- Equipamento laboratorial, reagentes e insumos
– Capacidade de se adequar, programar para a correta calibração, funções de instrumentos, reagentes, sistemas analíticos e insumos.
- Processos pré-analíticos
O laboratório é responsável pela fase pré-analítica
- Acomodações e condições ambientais.
– O formulário de solicitação de exame: identificação de paciente, sexo, data de nascimento, detalhes de localização e contato, identificador único (ex. número de biópsia), informações clínicas relevantes para realização do exame e propósitos de interpretação diagnóstica.
– Manual de coleta de amostras
– Transporte de amostras (ex. temperatura de amostras)
– Critérios para aceitação ou rejeição de amostra.
- Processo de exame
– Processos de exame adequados
– Identificação de pessoas executando atividades no processo de examine
– Processo de validação – documentação
– Calibração, materiais de referência
– Métodos de caracterização analítica
- Garantia de qualidade dos procedimentos de exame
– Sistema de controle de qualidade interno – materiais de controle
– Programação/plano de calibração de sistemas de medidas
– Parâmetros analíticos: reprodutibilidade, reprodutibilidade, veracidade, incerteza.
– Resultados rastreáveis
- Processos pós-exame
– Revisão de resultados, conformidade com informação clínica e resultados de laudos.
– Pessoal autorizado à liberação de laudos
- Confecção de laudos
- Liberação de laudos
Laboratórios devem ter acesso a dados e informações necessárias ao provimento do serviço que atenda necessidades e requisitos dos usuários.
As responsabilidades e autoridades pelo gerenciamento de informação devem ser definidas, incluindo manutenção e modificação de sistemas de informação que podem afetar o cuidado com o usuário: o acesso a dados dos pacientes, mudança de seus dados e informações, autorização de liberação de laudos e relatórios são definidas.
Todos os processos dentro de um laboratório devem estar descritos em manuais, os procedimentos operacionais padrão (POPs). A grande desvantagem, segundo pesquisas envolvendo equipes de trabalho de laboratórios acreditados é a grande carga de trabalho com documentação (VERSTRAETE, 2018).
Iniciar o processo de acreditação representa o interesse em melhorar a qualidade do serviço no laboratório de patologia através da melhor documentação de processos e responsabilidades. O primeiro passo antes da acreditação é construir, junto a sua equipe, a cultura de qualidade, aprimoramento profissional, seleção de métodos de acreditação, descrição de processos do laboratório, desenvolvimento e melhoria de sistemas de qualidade, definição e estruturamento de documentos, preparação de manuais de qualidades e procedimentos operacionais padrão (YANIKKAYA-DEMIREL, 2009).
2.6 VISITA DE INSITUIÇÕES ACREDITADORAS.
Durante a visita de auditoria das instituições acreditadoras, todas as pessoas chave no processo devem estar disponíveis para o processo de avaliação. Os avaliadores podem requisitar dos laboratórios a realização de testes como parte do processo de avaliação.
Avaliadores, em geral, realizam reunião prévia e então seguem para a avaliação de documentação. Todos os procedimentos e documentos relatados são examinados do recebimento de amostras até a liberação do laudo. Manuseio de amostras, entrevistas com técnicos, demonstração de técnicas, revisão de documentação de qualidade, avaliação de calibração de equipamentos, manutenção de equipamentos, sistema de gerenciamento de documentos e todos outros critérios do padrão devem ser avaliados. Uma das técnicas de auditoria consiste em rastrear todas as etapas através de paciente aleatório
Após a auditoria do laboratório, é fornecido relatório da equipe de avaliação. O laudo inclui recomendações para a garantia de qualidade de todas as partes avaliadas. Toas as não-conformidades devem ser avaliadas no relatório de avaliação. Então, prazos de adequação são determinados e explicados. Ao final, todos os envolvidos na reunião inicial devem realizar reunião de encerramento a fim de concluir a avaliação de acreditação.
Consequente a avaliação, o laboratório deve realizar todas as ações remediadoras indicadas pelo relatório de avaliação. Novas visitas são necessárias na maioria dos casos. Uma vez que todas as ações indicadas tenham sido tomadas, segue o processo de indicação da certificação da acreditação, normalmente emitida no prazo de três a quatro meses. Toda a informação fornecida pelo laboratório a instituição acreditadora deve ser mantida em sigilo.
Reavaliações e recertificação devem ser realizadas a cada dois anos após as certificações. A exceção é a certificação ONA nível 3, certificação com excelência, com validade por três anos. O propósito desta validade é garantir que os critérios necessários a avaliação continue a ser atendidos após o período de acreditação.
Todo laboratório está sujeito a erros e auditoria é ferramenta útil para a melhoria de qualidade. Todo laboratório deve educar sua equipe da importância de auditorias e motivá-los a aprender o máximo possível do processo.
CUSTOS DA ACREDITAÇÃO
Processo de acreditação podem ser bastante custosos, uma vez que, a fim de se acreditar o laboratório, podem ser necessários mais investimentos em equipamentos, instalações, sistemas de gestão de qualidade ou educação, gastos com órgãos de acreditação e consulta e tempo gasto de cada funcionário. Há grande variabilidade nestes custos uma vez que estes estão ligados a despesas externas (junto às instituições acreditadoras) e internas (readequação de serviços). Fazem parte dos custos externos a obtenção de manuais, padrões e/ou checklists, a inscrição em programas, custos relacionados a honorários, traslados e hospedagem de auditores.
Cabe ressaltar que a emissão de alvarás, licenças, situação fiscal, adequação de normas sanitárias e legais não faz parte do processo de acreditação, este processo deve ser resultante de auditoria interna prévia, sendo recomendado que instituições candidatas ao processo de acreditação o façam através de educadores em acreditação. É exigido dos candidatos que cumpram tais requisitos com excelência, comprovando, inclusive, os meios utilizados para monitoramento de renovação de licenças e outros critérios legais. A não-comprovação de conformidade desqualifica o serviço ao processo de acreditação (ALASTICO et al, 2013).
A SBP vincula inscrição ao PACQ está ao pagamento de anuidade, sendo a obtenção do Manual de Acreditação (MAC) gratuito no site da instituição. O valor dispensado varia conforme o tamanho do laboratório e foi estruturado a qualificar laboratórios junto à ANS com o menor investimento, citando em seu site o valor aproximado de dez salários-mínimos.
O CAP cobra US$ 1500,00 pela inscrição de empresas fora dos EUA. A aquisição de checklists está cotada em 1050,00 por checklist, conforme área de abrangência de cada um destes.
O processo de certificação ISO inclui a compra do padrão ISO 15189:2012, no valor de 178 Francos suíços (R$ 1043,10 em 01/01/2021) e contratação de empresa credenciada, com valores bastante variados conforme porte do contratante. De acordo com Thurneysen, os custos de acreditação ISO e readequação de um grande hospital está estimado em 870.000 Francos suíços (R$ 5.098.304,40 em 01/01/2021). Custos tão elevados estão associados às mudanças internas e externas necessárias ao processo.
A ONA adota processo semelhante à ISO, custando a obtenção de seu Manual de acreditação R$ 100,00. A contratação de empresas acreditadoras tem custo semelhante ao da SBP quando o laboratório se encontra baseado na mesma cidade que o laboratório a ser acreditado. Atualmente a ONA conta com três níveis de acreditação: Instituição acreditada (nível 1), acreditada plena (nível 2) e acreditada com excelência (nível 3). As demais instituições definem apenas instituição acreditada ou não. A validade dos certificados de acreditação é de dois anos, com exceção do nível 3 ONA, com três anos de validade.
Os custos financeiros totais tendem a ser proporcionais ao tamanho da organização, uma vez que as despesas dependem da quantidade de auditores e tempo de auditoria necessários a avaliação completa de seu escopo. O nível de acreditação (industrial, hospitalar, laboratorial, nacional, internacional etc.) a qual a instituição escolhe ser submetida também tende a ser proporcional conforme o mercado ocupado pelas empresas e a pressões as quais é submetida.
2.7 BENEFICIOS DA ACREDITAÇÃO
Os benefícios incluem padronização de todos os processos, responsabilidade de cada membro da equipe, demonstrabilidade de resultados, avaliação sistemática de fornecedores, prestígio na gestão de riscos, melhor comunicação com os parceiros, reconhecimento público de qualidade, segurança ao paciente, economia de recursos ao se evitar repetição de tarefas, ambiente de trabalho mais seguro, maior segurança profissional aos recursos humanos devido a adequações de política pessoal, menor risco de litígio, abertura de mercados a prestadores que exigem acreditação e aperfeiçoamento profissional contínuo.
Verstraete (2018), ao fornecer questionários a funcionários de laboratórios que passaram pelo processo de acreditação, recebeu relatos de melhorias nos seguintes itens (Possível marcar mais de uma alternativa):
- Melhor documentação de todas as manipulações 83%
- Mais certeza sobre os procedimentos 62%
- Mais responsabilidades 42%
- Melhor conhecimento das análises 42%
- Mais envolvimento na redação de procedimentos 25%
- Melhor qualidade 46%
- Mais motivador 12%
- Menos responsabilidades 0%
- Sem vantagens 0%
Quanto à segurança do paciente, é observada a redução na quantidade de erros e melhoria na qualidade dos cuidados em saúde. A maior parte dos erros médicos é prevenível e sua maioria tem pouca relação com o trabalho realizado em laboratórios. Planejamento de controle de qualidade da fase pré-analítica, analítica e pós-analítica são elementos chave da segurança do paciente. Cada passo tem papel crítico. Resultados de exames podem ser inúteis ou danoso se o exame não é realizado em uma amostra válida. A amostra deve ser coletada do paciente correto, nas condições corretas, em recipiente correto, com identificação correta e manuseio correto (VERSTRAETE, 2018).
O credenciamento de laboratórios melhora a medicina laboratorial e todos os processos em laboratórios, que incluem – redução de erros nos processos pré-analíticos, analíticos e pós-analíticos, facilitação de diagnósticos precisos e rápidos, participação na aceleração e eficiência do tratamento, facilitação da medicina personalizada desenvolvimento e estimula a melhoria contínua. A patologia será o centro das atenções quanto à qualidade devido ao seu amplo impacto no atendimento ao paciente para a correta decisão médica no diagnóstico e tratamento e na ação preventiva. A acreditação é mais um instrumento do que a finalidade de aumentar a qualidade dos serviços prestados aos clientes – pacientes, médicos.
Instituições acreditadas poderão negociar junto às operadoras da saúde suplementar reajuste na remuneração junto às operadoras. O percentual pode chegar até 115% do Índice de Preço ao Consumidor Amplo (IPCA), situação em que, um dos critérios exigidos é o Certificado de Acreditação em nível máximo.
Há escassez de dados formais da rentabilidade econômica devido à ausência de dados formais e não comprovação relação clara entre a acreditação e os resultados medidos nos estudos, tornando difícil projetar e conduzir tais avaliações sem uma compreensão mais robusta e explícita dos custos e benefícios envolvidos.
Mesmo aquelas empresas e serviços que não conseguem obter acreditação ou renová-la, mas que visem a adequação a critérios constantes em manuais de acreditação obtêm, ainda que lentamente, resultados positivos com adequação de processos.
2.8 PRINCIPAIS DIFICULDADES DE IMPLEMENTAÇÃO DA ACREDITAÇÃO
Apesar do interesse de negócios em gerenciamento de qualidade, em países onde a acreditação é menos predominante, as barreiras econômicas e culturais têm se apresentado como as principais à adesão a tais sistemas. Concorrência escassa é um dos principais motivos para a falta de inovação e de atividades de melhoria. A preparação e implementação da acreditação pode requerer dois anos de trabalho tedioso e frustrante e empresas muito bem estabelecidas também acabam por inibir pensamento estratégico quando estas se veem como consolidadas em determinado mercado ao ver tal processo como tedioso e frustrante.
Pouco interesse de instituições públicas é atribuído à escassa pressão por parte do mercado e do próprio governo (AL-ZAMANY, 2001). O envolvimento de pessoal em gerenciamento de qualidade é fator essencial em determinar objetivos de determinada organização. Sistemas de qualidade dizem a respeito de pessoas, feito por pessoas e para pessoas. A maneira tradicional de gerenciar está focada em funções de diferentes departamentos e resolver problemas aflorados constantemente, sendo pouco o tempo dado a administradores para planejamento e definição de metas.
Entre empregados, é patente a dificuldade destes em descrever seus alvos e objetivos da organização que fazem parte, fazendo com que eles criem hábitos de mínimo esforço para a realização de suas tarefas.
Atividades de avaliação pela administração de toda a situação organizacional mediante empregados, clientes, concorrentes quanto a tecnologia, desempenho e qualidade deve estar vinculada a determinação de missão, metas e valores.
Reuniões anuais, como é de costume entre empresas familiares, tendem a se mostrar incompatíveis com o processo contínuo e incessante em busca de altos padrões. O foco intenso em avaliação de situação financeira acaba por suprimir a visão de qualidade, ficando esta atividade deixada nas mãos de diretores e sujeitas quase exclusivamente ao seu julgamento. Por vezes, a diretoria confia-se apenas em relatórios de diferentes setores.
Nas organizações governamentais a política de apagar fogo dificulta aos administradores alocar tempo para encontros regulares. A avaliação de qualidade é vista como ameaçadora devido ao fato de determinado gerente ter a si atribuídos resultados indesejados. Apesar de dados mais robustos, em geral, carece-se de métodos estruturados para utilização destes no processo de avaliação.
Zairi (2011) lista como hábitos dificultadores de implantação da cultura de qualidade:
- Falar em mudança sem ação real ou abordagem efetiva;
- Enxergar como fim de jornada de aprendizado a conquista de cargos de gestão;
- Dificuldade em aceitar críticas, quando estas devem ser vistas como motivadoras de mudança e oportunidade de melhoria;
- O senso de responsabilidade de gerentes na iniciativa pública e de como melhorar.
- Foco voltado apenas em exercer suas atividades diárias e resolução de problemas;
- Ausência de atividades de avalição acaba por coibir ideias de melhoria;
- A ausência de ação efetiva visando forçar melhorias de pessoal através da avaliação.
A falta de comunicação com objetivo de manter empregados cientes de quaisquer readequações institucionais que importem a seus cargos e funções. A comunicação deve ser estimulada para motivar a equipe e melhorar o entendimento do papel de cada um na melhoria de qualidade.
Existe resistência em compartilhar informação no setor público devido à falta de confiança entre gerentes e subordinados devido o sistema poder conflitar com interesses pessoais. Em organizações familiares, estas informações tendem a manter-se restritas aos membros familiares.
A falta de envolvimento da equipe na maioria das organizações tende a ser consequência da maneira autocrática de gerenciamento. A dificuldade de argumentar ou discutir com gerentes tende a desencorajar empregados de discordar de seus chefes ao considerar tais situações como desrespeitosas.
Atividades de reconhecimento de desempenho ou prêmios a indivíduos ou grupos por desempenho tendem a ser negligenciadas devido a alguns administradores sentirem-se ameaçados por pessoas com pensamento inovador, vendo estas como potenciais ocupantes de seus cargos. A não-abordagem de coleta de estudos de sugestões sobre inovação entre empregados resulta em não os reconhecer ou premiá-los por suas ideias. Instituições públicas tendem a ter dificuldades no reconhecimento de seus funcionários pelo orçamento limitado e por impeditivos legais.
A falta de contato, direto ou indireto, com a clientela deve-se ao não apreço pela pelos princípios de satisfação da clientela, estando a equipe voltada a focar na satisfação de seus superiores. O baixo impacto da opinião de clientes/pacientes em laboratórios de patologia tende a ser fruto de foco voltado a pressão exercida por médicos solicitantes, contratantes e concorrentes, havendo pouca efetividade em transmitir suas necessidades às empresas (Ehigie, Akpan. 2005).
A falta de concorrência no mercado tende a resultar a limitadas alternativas aos clientes, fazendo que estes tenham que aceitar os serviços como o são.
3 MATERIAIS E MÉTODOS
Para o presente estudo utilizou-se a metodologia de pesquisa quantitativa, com abordagem descritiva. Tem-se como sujeitos da pesquisa, 7 (sete) gestores de laboratórios públicos de anatomia patológica do estado do Amazonas. De pronto, destaca-se que a finalidade desta pesquisa é contribuir para a melhoria da qualidade dos laboratórios do Estado.
Cabe ressaltar que, por se tratar de estudo de gestão e melhoria de processos, com foco em processos administrativos, sem foco no ser humano, este estudo está isento de avaliação por Comitê de Ética em Pesquisa. Conforme destacado anteriormente, participaram desta pesquisa 7 indivíduos (5 homens e 2 mulheres). Dentre as profissões destes respondentes, tem-se: patologista, gerente de laboratório de patologia, professor adjunto do departamento de patologia e medicina legal e gerente de laboratório, portanto, profissionais com grande aptidão para responder questionamentos inerentes a temática.
O critério para a escolha destes indivíduos se deu pelo fato de, serem pessoas que tiveram um certo convívio com o pesquisador, portanto, mais suscetíveis a participação. É importante destacar que, está pesquisa não visa apresentar nomes e nem dados pessoais, conforme previamente combinado as respostas serão expostas de forma anônima, com o intuito de verificar a ótica da acreditação de acordo com o ponto de vista dos profissionais que vivem isso na rua rotina.
Os participantes atuam em hospitais localizados no Estado do Amazonas, sendo estes: Fundação de Medicina Tropical Heitor Vieira Dourado, Universidade do Estado do Amazonas, Universidade Federal do Amazonas e Fundação Hospitalar Alfredo de Matta, portanto, locais renomados que prestam atendimento gratuito a população. As informações aqui apresentadas visam contribuir para a melhoria da qualidade dos laboratórios do Estado, proporcionando mais conforto, qualidade e segurança para a população que utilizada destes serviços, e também para seus colaboradores.
O questionário foi enviado via Google Forms, e é composto por 67 questões de múltipla escolha, cujas opções resposta são: atende; não atende; e não se aplica. Justifica-se a vasta gama de perguntas pois, as evidências visam contribuir para a melhoria dos serviços, bem como, verificar o estadiamento dos Laboratórios de Anatomia Patológica do Sistema Público do Estado do Amazonas em relação às necessidades do processo de Acreditação segundo a Organização nacional de acreditação (ONA).
4 RESULTADOS E DISCUSSÃO
Para facilitar a compreensão, tornando a análise dos dados mais agradável e explicativa, as respostas serão apresentadas através de gráficos e tabelas, que serão confrontados com a literatura existente, visando analisar as opiniões com base em estudos que forneçam subsídios para ajudar no correto andamento dos processos internos.
Para os laboratórios de desejam garantir a qualidade dos seus processos e se destacar no mercado, a acreditação laboratorial pode trazer uma série de vantagens. Trata-se de uma avaliação realizada pelos órgãos especializados, de modo a adequar todos os processos e práticas do laboratório. A acreditação laboratorial é basicamente um processo de avaliação de qualidade dos serviços de um laboratório, realizado por órgãos autorizados e especializados.
Neste contexto, a primeira pergunta feita aos participantes da pesquisa, visou identificar se os laboratórios onde os mesmos atuam divulgam a sua missão e identidade para o público-alvo. Com base nas respostas apresentadas no gráfico 1, nota-se que 100% dos respondentes (7) identificam essa política nas organizações.
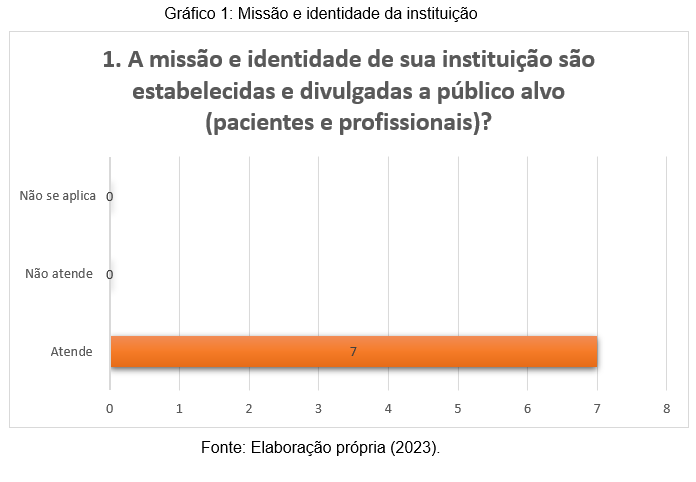
É comum escutar as pessoas afirmarem “não se deve julgar pelas aparências”, porém, em muitos casos, a apresentação é que determina se uma relação irá seguir adiante. Afinal, é a primeira impressão que fica. Daí a importância de eleger elementos que realmente representem a proposta do laboratório, o que ele quer oferecer ao mercado e aos seus usuários, que “falem” por ele, dando ênfase ao que importa.
No Brasil, o Instituto de Metrologia (INMETRO) é o órgão responsável pela Coordenação Geral de Acreditação. Entretanto, existem ainda outros órgãos que possuem autorização para realizar a acreditação, como o Programa de Acreditação de Laboratórios Clínicos (PALC), o Sistema Nacional de Acreditação (DICQ) e o Colégio Americano de Patologia (CAP), que fornece uma certificação internacional.
Entre os requisitos para a acreditação de um laboratório estão a excelência técnica na realização dos exames, capacitação dos profissionais e atendimento de normas reguladoras. Por meio da acreditação os negócios da área conseguem identificar falhas em seus processos e promover o aperfeiçoamento dos serviços. A segunda pergunta (gráfico 2), visou analisar se os laboratórios em questão possuem os documentos necessários para serem acreditados.
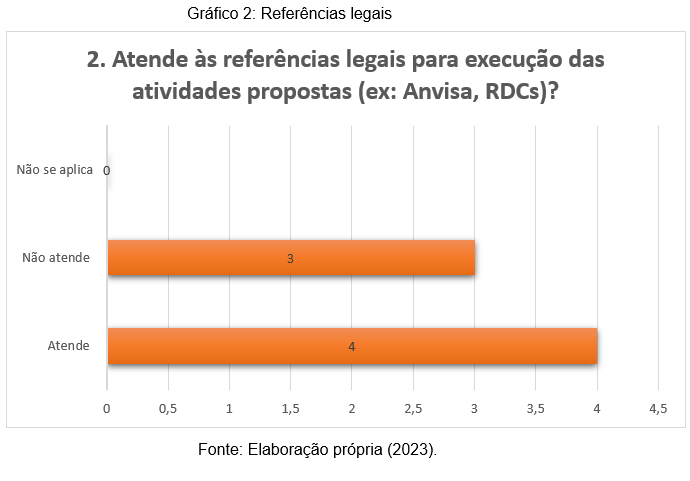
Nota-se que, 3 (42%) dos respondentes afirmam que o laboratório não atende aos requisitos legais necessários para a acreditação. Portanto, é importante que estas instituições busquem subsídios para serem incluídos neste programa, que só tem a agregar para todos os contextos organizacionais, uma vez que, o laboratório acreditado atua com eficiência, além de seguir as legislações e recomendações dos órgãos competentes.
Sabe-se que um laboratório acreditado trabalha em conformidade com as melhores práticas da área, em relação a questões como o manuseio de materiais imunobiológicos, químicos e imunológicos, entre outros. Comprova também que a empresa atende aos critérios de qualidade definidos pela norma ABNT NBR ISO 15189.
A tabela 1 traz a organização de alguns questionamentos, bem como, o quantitativo de respostas para cada questão. Portanto, cabe destacar alguns pontos relevantes. As perguntas de número 4 e 5, buscam verificar se o laboratório estabelece uma política de gestão da qualidade documentada. Neste contexto, obteve-se os seguintes resultados: em 5 (71%) dos laboratórios atendem a estes requisitos, enquanto 1 laboratório não possui e em outro laboratório não se aplica.
Destaca-se a relevância desta política organizacional, pois, logo no início do requisito, a norma pede para as organizações manterem as informações documentadas referentes aos requisitos da norma. Neste caso deve-se analisar os requisitos para saber quais são os que exigem a retenção ou manutenção de informação documentada.
As falhas humanas inerentes à atividade hospitalar e da saúde em geral, são quase inevitáveis. Mas por mais que não consigamos eliminá-las, podemos sim avaliar melhor as razões de tais equívocos, a fim de projetar resultados mais seguros. O número de processos por erro médico cresceu mais de 100%, sendo a maioria deles resultado de erros de laudos e de diagnósticos. Há erros de laudos e diagnósticos, de tratamento, equívocos preventivos, que englobam falhas na profilaxia e na negligência na monitorização, além de erros de comunicação, bugs de sistema e assim por diante. Neste contexto, a pergunta de número 6 trata da comunicação para liberação de laudos, verifica-se que 5 (71%) dos laboratórios estabelecem está política, enquanto 2 laboratórios não aplicam esse processo. No que tange a pergunta 7, observa-se que 5 laboratórios estabelecem comunicação acerca dos atrasos em exame complementar, enquanto 2 laboratórios não aplicam essa metodologia. Neste processo, destaca-se a tecnologia como facilitadora destes processos. Por exemplo, no caso dos laudos laboratoriais, as ferramentas tecnológicas fazem com que esse tipo de documento seja mais confiável e fácil de ser emitido. A tecnologia garante que os laboratórios tenham capacidade de realizar exames em larga escala, sem reduzir a qualidade. Equipamentos modernos fazem com que a rotina laboratorial seja muito mais fluente, diminuindo consideravelmente o tempo de espera do paciente para ter os resultados em mãos. Em consequência, o laudo laboratorial pode ficar pronto com rapidez. Assim, será possível agilizar o tratamento de patologias, especialmente as graves, assim que o laudo estiver disponível. Já na pergunta 8, vê-se que 5 laboratórios possuem comunicação adequada via digital, enquanto 2 laboratórios não aplicam este meio.
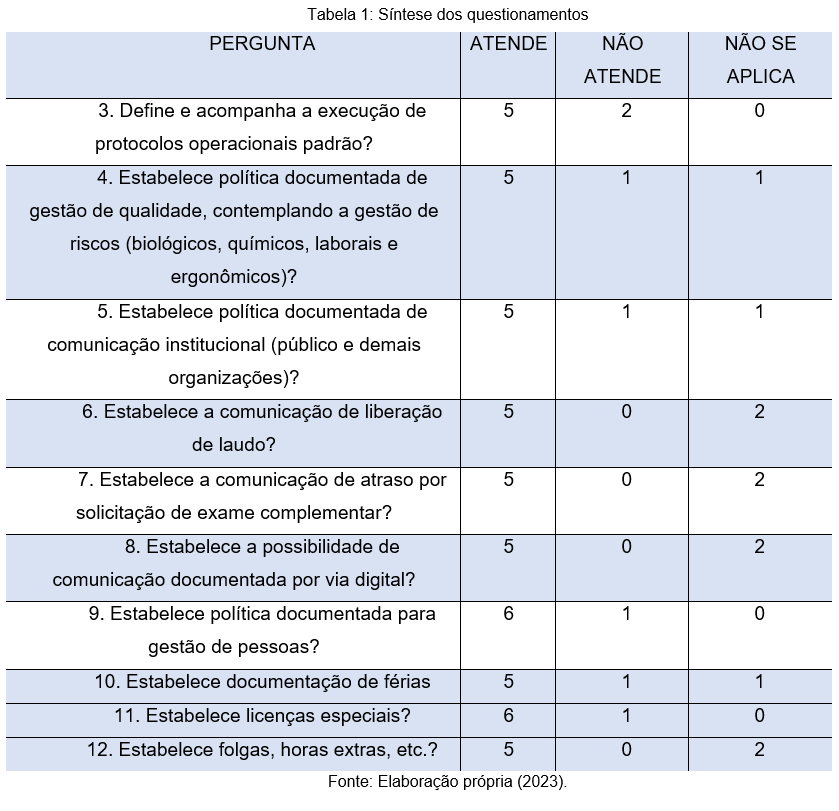
As perguntas 9,10,11 e 12 tratam especificamente de contextos inerentes à gestão de pessoas. De acordo com os participantes, 6 (86%) dos laboratórios estabelecem uma política documentada para gestão de pessoas. Ainda que a maior parte das instituições ofereçam documentações de férias, licenças especiais, folgas e horas extras, trata-se de um fato preocupante, por que ainda que estas políticas sejam fundamentais, alguns laboratórios ainda resistem às suas práticas.
O Manual ONA para OPSS versão 2022, possui na subseção 1.1 Liderança Organizacional, nível 1, item 8 a exigência “Estabelece política documentada da gestão da qualidade”, e na coluna de orientações descreve o respectivo conceito: “A Política de gestão da qualidade estabelece um compromisso, por escrito, com a qualidade e segurança visando à melhoria contínua dos seus processos. Este compromisso pode ser compreendido como diretrizes para padronização (mapeamento de processos, gestão de documentos, gestão de protocolos) e gerenciamento (demais itens) dos processos.
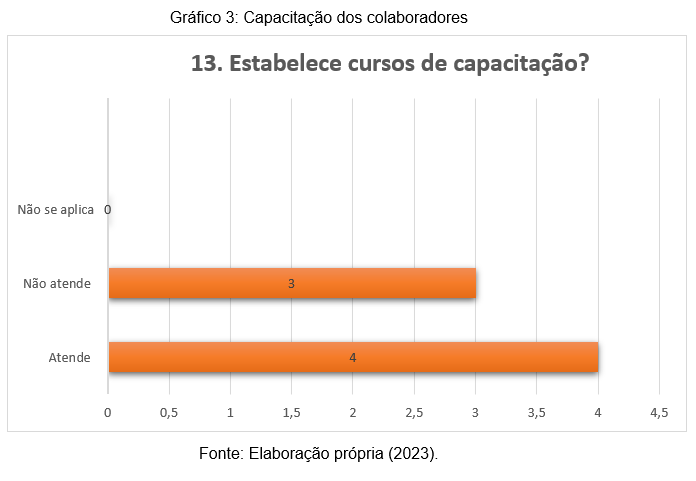
Em relação a pergunta de número 13, apresentada no gráfico 3, cabe destacá-la de forma isolada, uma vez que, os funcionários são a parte mais importante de uma organização. Quando a empresa investe na capacitação dos seus colaboradores, ela possibilita o desenvolvimento de todos os seus setores. Através dela é possível garantir o treinamento de toda a equipe e contribuir com o alcance dos objetivos estabelecidos (SILVA, 2020).
Para Silva (2020) ela possibilita que o profissional possa adquirir novas características, aprender novas técnicas e aperfeiçoar o seu trabalho. A capacitação também evita a rotatividade de pessoal, torna a empresa mais competitiva e favorece o aumento da produtividade.
Com base nas respostas inerentes aos questionários, é possível observar que laboratórios têm deixado a desejar nesse quesito tão importante. Enquanto 4 (57%) das organizações oferecem cursos de capacitação para seus colaboradores, outras 3 (43%) não estabeleceu uma política de capacitação. Tal fato é um grande problema para instituições que almejam serem acreditadas.
O processo de acreditação hospitalar requer que os envolvidos tenham o conhecimento necessário para sua aplicação, além de contarem com as ferramentas necessárias para seu desenvolvimento. E isso envolve uma capacitação específica com a equipe, objetivando que sejam treinados para aplicar práticas como gerenciamento de risco, estratégias e procedimentos, e liderança (Costa et al., 2018).
A tabela 2 apresenta uma síntese de questionamentos relacionados à gestão de orçamento. Ao analisar os dados, nota-se a necessidade de modificações nas políticas de gestão e investimento de todos os laboratórios relacionados à pesquisa, por exemplo: nas perguntas de número 14 e 21, 3 respondentes afirmam que as instituições não possuem uma política documentada para gestão de custos, ou ainda, que não estabelecem planilha orçamentária do departamento.
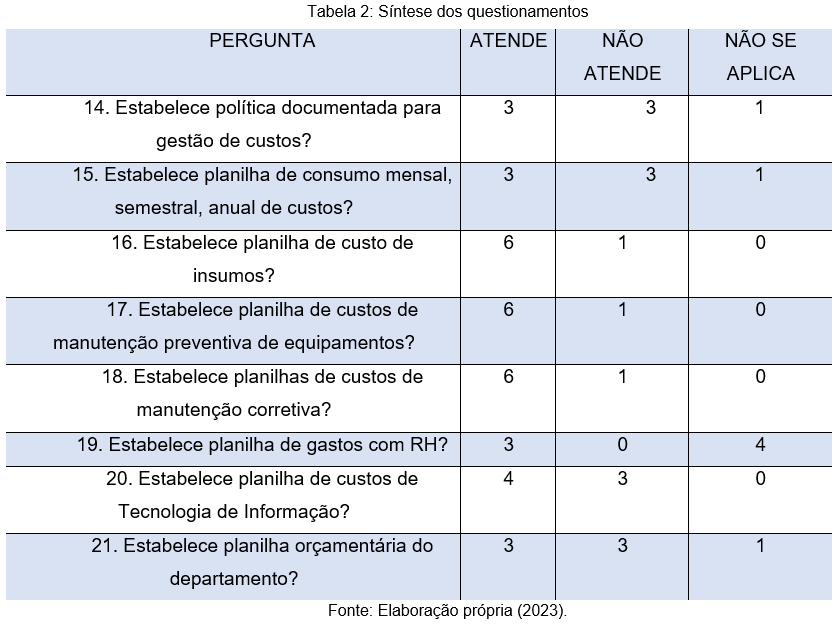
Em geral, vê-se que as instituições participantes apresentam dificuldades no processo de gerenciamento das suas atividades, especialmente para atingir a excelência na prestação de serviços. Isso pode ocorrer, principalmente, a partir da complexidade da estrutura organizacional, além de restrições financeiras, humanas e tecnológicas que enfrentam.
A gestão de custos se apresenta como uma importante resposta aos desafios da gestão hospitalar. Propor indicadores de desempenho e padrões nos processos da assistência hospitalar é um caminho para garantir a qualidade dos serviços, sendo o cumprimento desses padrões um pré-requisito para o desenvolvimento dos programas (Manzo et al., 2013).
De acordo com Camilo et al., (2016) a acreditação hospitalar tem ainda a função de otimizar a utilização de insumos, aumentar a produtividade dos profissionais, e desenvolver o entendimento estratégico, tendo como meta a melhoria da qualidade do atendimento. Essa auditoria voluntária auxilia ainda na elaboração de uma metodologia de gestão, fomentando processos produtivos multiprofissionais, racionalizando a utilização de insumos, e otimizando processos no ambiente hospitalar.
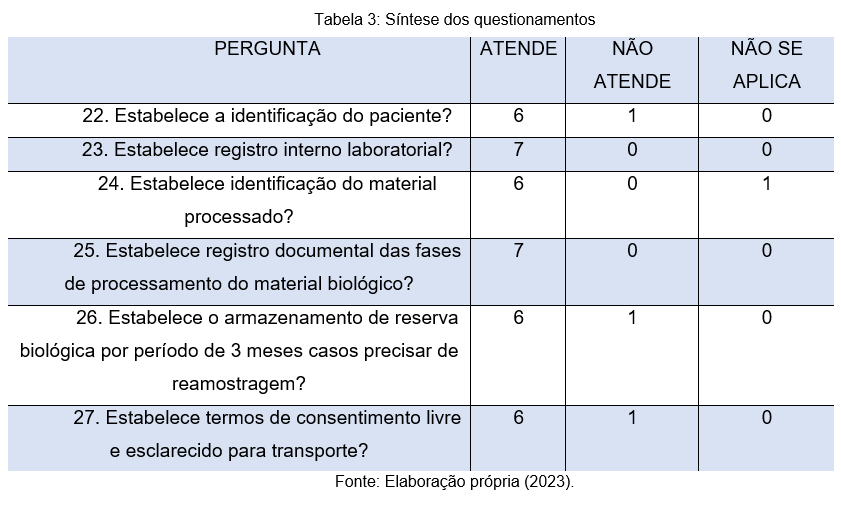
No que tange aos questionamentos apresentados na tabela 3, cabe destacar que, o controle de qualidade laboratorial é um processo contínuo de melhoramento que passa a identificar as necessidades e as expectativas dos clientes. Com as etapas de um programa de qualidade a serem seguidas, é possível coordenar, controlar e dirigir os Princípios da Gestão da Qualidade para serem incorporados em todas as atividades executadas pelo laboratório. Portanto, o controle de qualidade em laboratórios funciona como um importante diferencial competitivo. Ela possibilita o controle efetivo, a rastreabilidade de todos os procedimentos executados e o aumento da produtividade, uma vez que passa a fazer melhor uso do tempo ao empregar processos padronizados (Santos; Trevisa, 2021).
Neste contexto, as respostas mostram-se satisfatórias nesse quesito, através da pergunta de número 22, por exemplo, foi possível constatar que 6 instituições estabelecem a identificação do paciente, sendo que, apenas uma não atende esse quesito. Na pergunta 23, nota-se que todos os participantes confirmam a existência de um registro interno laboratorial, assim como, na pergunta 25, onde todos os respondentes também afirmam que as fases de processamento do material biológico são registradas documentalmente.
Cabe destacar ainda que, conforme pergunta 27, que dentre os 7 participantes, 6 (86%) destacam a existência de termos de consentimento livre e esclarecido para o transporte, tal fato é de grande relevância, pois, essas informações são indispensáveis para que o material coletado passe por todo o processo com as melhores condições possíveis
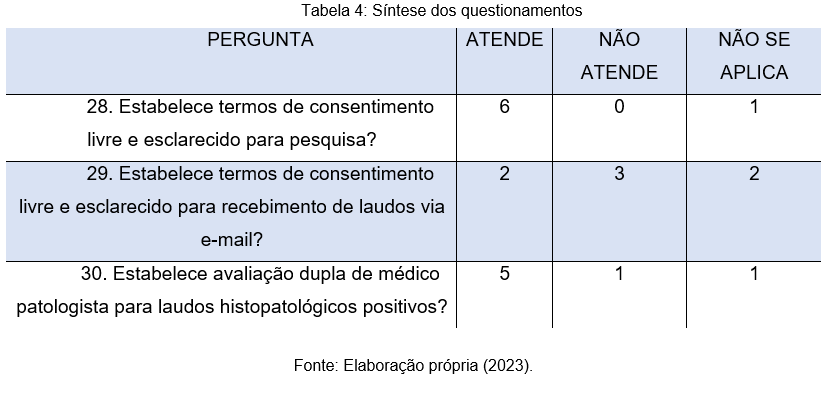
Com base na tabela 4, vê-se também que, a maioria dos laboratórios, de acordo com 6 respondentes, estabelece termo de consentimento livre e esclarecido para pesquiso, isso é muito importante para que os pacientes possam compreender de forma mais clara todas as etapas inerentes ao processo, além disso, é possível se resguardar de possíveis processos judiciais, o que é muito prejudicial nas organizações que não oferecem informações claras e completas. Porém, 3 (43%) dos participantes destacam que esses termos não são enviados via e-mail, isso pode ser justificado pelo fato de que, os termos são impressos, assinados e armazenados no arquivo físico.
Com base na pergunta de número 30, nota-se que 5 (72%) dos laboratórios oferecem avaliação médica dupla em laudos histopatológicos positivos, tal fato é de grande relevância para os pacientes, que podem ter seu atendimento otimizado, buscando assim, por um tratamento de forma mais rápida.
Sabe-se que, na prática, para obter a acreditação laboratorial é preciso garantir um sistema capaz de proporcionar uma melhoria contínua da qualidade dos serviços prestados e atender aos requisitos das normas. Esse processo demanda a mudança da cultura organizacional e a ampliação do controle de qualidade laboratorial com o uso de ferramentas digitais (Gonçalves, 2020).
Para Gonçalves (2020) o uso de sistemas nos laboratórios, possibilita uma gestão completa e eficaz da rotina dinâmica e complexa dos laboratórios. Garantindo maior controle dos processos realizados e dos resultados que possam apresentar falhas. Dessa forma, as ferramentas digitais nos laboratórios atendem com excelência todas as necessidades da instituição e proporcionam máxima produtividade. Além de auxiliar no cumprimento dos critérios de avaliação e normas para acreditação laboratorial.
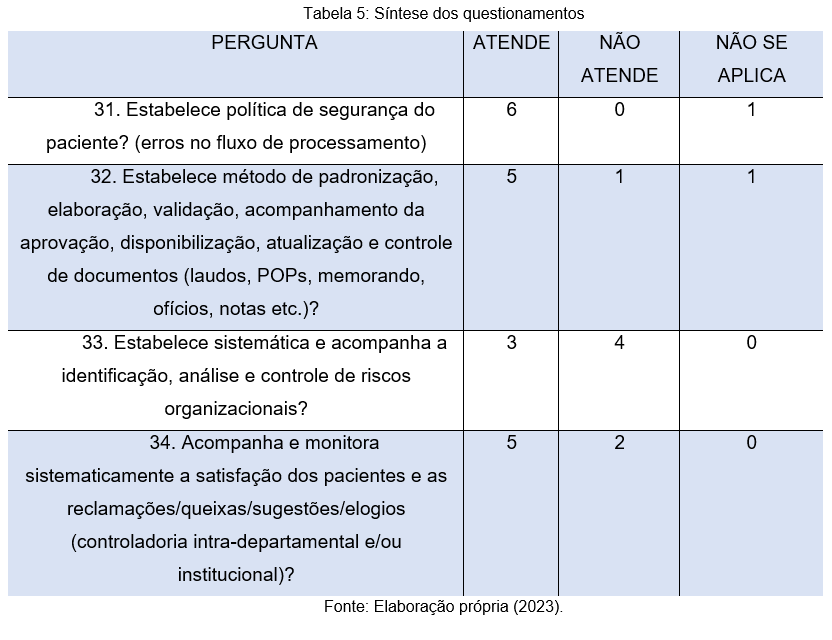
Na tabela 5, abordar-se-á os questionamentos sobre aspectos relacionados à segurança dos pacientes. Através da questão 31, nota-se que 6 (86%) dos respondentes afirmam que o laboratório em que laboram estabelece política de segurança para o paciente, apenas 1 respondente relatou que no local em que atua, essa política não é aplicada.
No que tange a pergunta de número 32, que visa abordar a metodologia de prestação de serviços, vê-se que, 5 participantes afirmam que a instituição adota essa prática de padronização, enquanto 2 instituições não aplicam ou não atendem. Cabe destacar a importância das instituições de saúde manterem métodos de padronização, validação, dentre outros que pode organizar os seus processos internos, principalmente para reduzir o risco de erros médicos e trazer a qualidade na assistência médica, gerando satisfação e segurança na realização dos procedimentos, tanto para profissionais de saúde, quanto para pacientes.
A pergunta de número 33, visa analisar quesitos relacionados ao controle de riscos organizacionais, qual seja, um dos pontos de mais destaque quando se trata da acreditação laboratorial em patologia. Neste ponto, destaca-se que apenas 3 dos laboratórios estabelecem uma sistemática para a identificação e controle de riscos, enquanto 4 não atendem a esse quesito tão relevante.
O portal Academia de Ciência e Tecnologia realizou uma pesquisa que aponta o maior risco em um laboratório: materiais perfurocortantes (seringas, agulhas etc.), que são responsáveis por 80% a 90% dos acidentes. Esse tipo de situação que envolve os riscos no laboratório de análises clínicas não somente ameaçam a saúde ou integridade física do profissional, como também diminui a qualidade do trabalho e do serviço prestado ao cliente. Compreendê-los e atuar para minimizá-los ou eliminá-los é, assim, importante para preservar o trabalhador e para atender melhor ao cliente. Essa importância está traduzida, inclusive, em algumas normas (Autolac, 2023).
É muito comum nos laboratórios que os profissionais não recebam treinamento ou orientação sobre como proceder diante de um acidente de trabalho (ainda que saibam como agir). Esse fato só retrata que, apesar de a equipe “se virar” quando um imprevisto ocorre, a preocupação com a conscientização não parte do gestor. E isso pode ser um fator que influencia negativamente nas avaliações do negócio (Autolac, 2023).
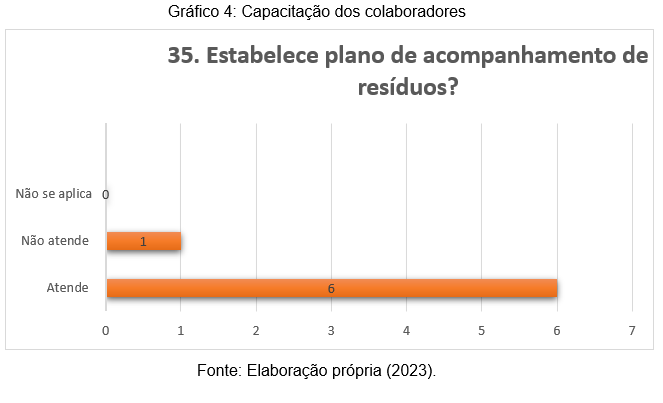
O gráfico 4 apresenta respostas inerentes ao questionamento sobre gestão de resíduos. Os resultados são positivos, uma vez que, apenas um participante relatou que o laboratório não atende a este quesito, enquanto 6 laboratórios possuem seu plano de acompanhamento de resíduos, o que já é um grande ponto para laboratórios que almejam serem acreditados. O gerenciamento dos resíduos hospitalares tem por objetivo minimizar a sua geração e proporcionar uma gestão e destinação segura e eficiente, visando à proteção dos profissionais que realizam o seu manejo, a preservação da saúde pública e do meio ambiente (Andrade, 2021).
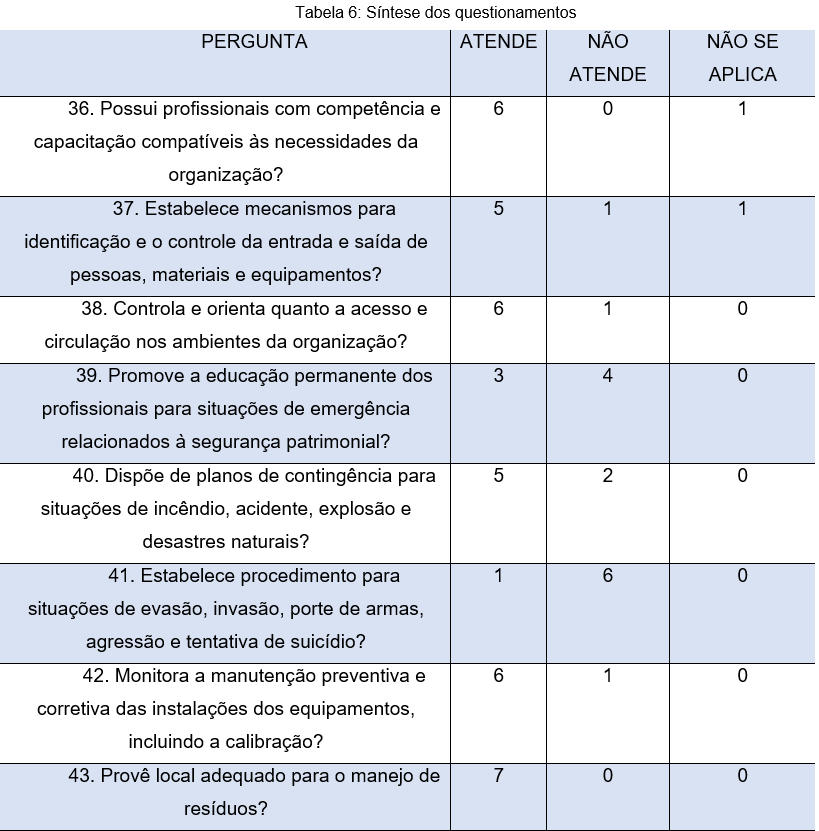
A tabela 6, visa compreender aspectos inerentes à gestão de pessoas. Especificamente na pergunta 36, questiona-se acerca da competência e capacitação dos colaboradores, se esta atende às necessidades organizacionais. Neste contexto, 6 (86%) dos respondentes afirmam que suas instituições possuem profissionais qualificados para as funções que exercem.
Com base nestes números, é perceptível que as instituições se preocupam com a educação continuada e com a atualização dos seus funcionários e isso é um ponto positivo para que a cultura da segurança do paciente possa ser sensibilizada de forma educativa. É importante resgatar que a acreditação hospitalar contribui para o aumento da qualificação dos profissionais de saúde e estimula a realização de atividades de treinamento e educação (Mendes; Mirandola, 2015).
Com base na pergunta de número 37, vê-se que 5 dos participantes afirmam que a instituição estabelece mecanismos para controlar e identificar entrada e saída de pessoas, materiais e equipamentos, além disso, conforme pergunta 38, 6 (86%) dos respondentes relatam que a instituição controle e orienta em relação a circulação no ambiente organizacional.
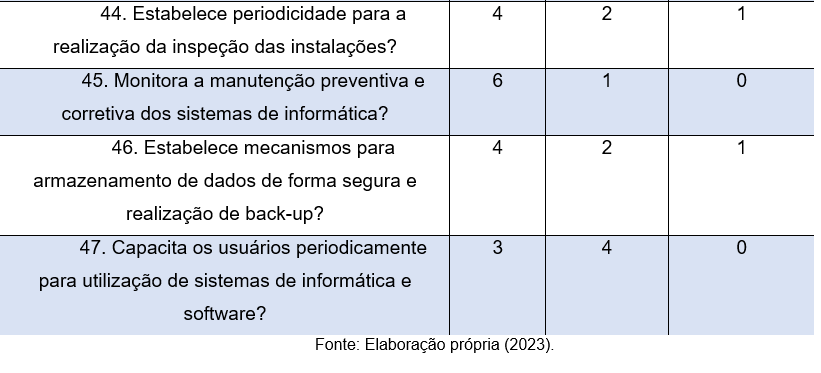
Na pergunta de número 40, analisar-se-á se as organizações dispõem de plano de contingência para situações atípicas, como incêndio, acidentes, etc. o resultado é deveras preocupantes, uma vez que, 2 (38%) participantes relatam a não existência de um plano, ainda que este seja indispensável e permeado de normatizações e padrões que visam manter os ambientes hospitalares em perfeito funcionamento, com segurança.
Em relação a manutenção preventiva e corretiva (pergunta 42), nota-se que a maior parte dos laboratórios (6) realizam as devidas manutenções, o que diminui significativamente as possibilidades de erros. A manutenção é a atividade da assistência técnica que irá evitar que o equipamento laboratorial pare de funcionar em momentos inadequados, sem planejamento, ou irá recuperar sua condição de trabalho, o mais próximo possível de um equipamento de laboratório novo. A manutenção preventiva de um equipamento laboratorial é aquela que visa mantê-lo em funcionamento por mais tempo, evitando uma parada inesperada, sem planejamento, aumentando assim sua vida útil (Oliveira, 2016).
A pergunta 43, demonstra que todos os participantes (7) afirmam que o laboratório em que atuam, possui local adequado para manejo de resíduos. Porém, 3 respondentes relatam que a instituição não realizada a inspeção das instalações periodicamente (pergunta 44), portanto, ao mesmo tempo em que as instituições evoluem em algumas práticas de segurança, percebe-se que alguns quesitos importantes são deixados de lado, e neste ponto, a acreditação hospitalar pode contribuir, padronizando os processos.
Os questionamentos 45,46 e 47 visam analisar aspectos relacionados à informática nas organizações, com base nas respostas, é possível constatar que 6 (86%) das organizações, monitora a manutenção preventiva e corretiva dos equipamentos de informática. Porém, quando se trata da segurança dos dados armazenados, apenas 4 (58%) realizam backups periodicamente. Além disso, apenas 3 participantes relatam que o laboratório em que atuam capacita os usuários para a utilização dos sistemas de software e informática. Nesse sentido, destaca-se que a capacitação profissional reflete positivamente na qualidade operacional do negócio, sendo o aperfeiçoamento técnico chave para uma maior produtividade, eficiência e redução de erros e outros problemas nas atividades.
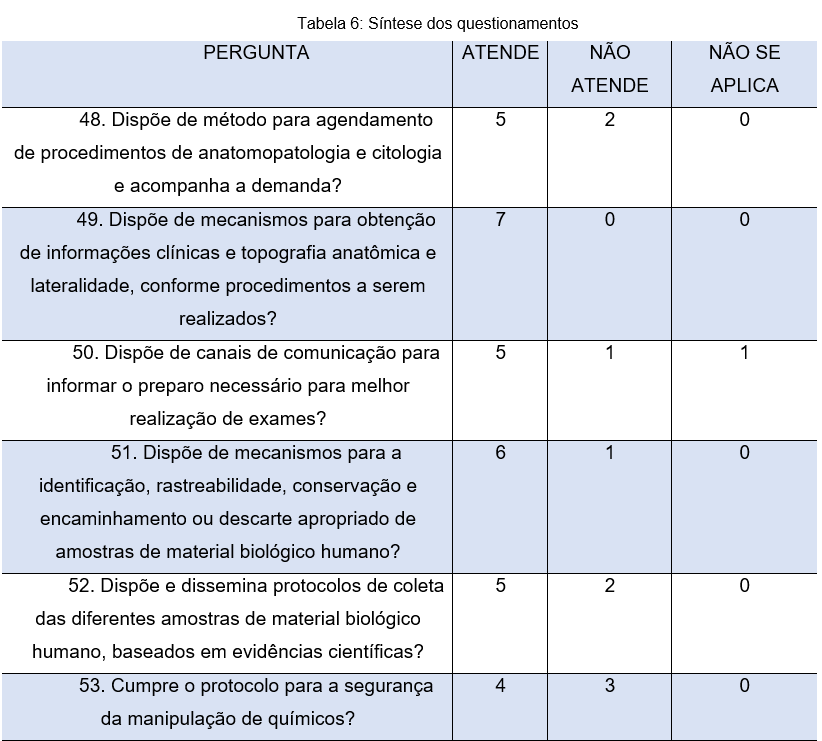
Parte-se para a análise da tabela 6, através da pergunta de número 48, vê-se que 5 participantes destacam a existência de métodos para agendamento de procedimentos específicos, enquanto 2 afirmam que a organização não atende esse critério. Por outro lado, todos os participantes (7) corroboram afirmando que existem mecanismos para obtenção de informações importantes, de acordo com o procedimento a ser realizado (pergunta 49).
A pergunta de número 50, visa analisar acerca dos canais de comunicação, neste contexto, apenas 5 respondentes destacam a existência destes canais, que são fundamentais para a melhor realização de exames, proporcionando assim, um melhor fluxo destes processos.
O Procedimento Operacional Padrão (POP), para laboratório de análises clínicas é uma ferramenta essencial para uma boa gestão. Se você pretende ter o reconhecimento de órgãos, como ISO 9002, Colégio Americano de Patologistas (CAP), Programa Nacional de Controle de Qualidade (PNCQ), Organização Nacional de Acreditação (ONA) e Programa de Acreditação de Laboratórios Clínicos/SBPC (PALC), sabe que é fundamental padronizar procedimentos internos (Andrade, 2021).
Neste contexto, a pergunta de número 51 objetivou analisar se os laboratórios envolvidos na presente pesquisa dispõem de mecanismos para padronizar todo o processo até o descarte de amostras biológicas. Com base nas respostas, vê-se que 6 participantes responderam que a organização atende a esse critério, enquanto 1 participante respondeu que não atende.
Esse é, inclusive, o primeiro passo para obter a certificação dos procedimentos e a Acreditação de Serviços e Programas de Saúde. É também a melhor forma de mostrar para seu cliente que suas atividades estão em pleno funcionamento e que são confiáveis.
A biossegurança é um aspecto fundamental no ambiente laboratorial, que visa proteger colaboradores, o meio ambiente e a comunidade da exposição aos agentes presentes nestes locais. Desta forma a pergunta 53 visou analisar se organizações cumprem o protocolo para segurança e manipulação dos químicos. Dentre os 7 respondentes, 4 relatam que o laboratório atende a esse quesito, enquanto 3 afirmam que o local não atende. Tal número é de certa forma preocupante, uma vez que, a vida de todos que transitam pelo local (funcionários, clientes, visitantes, dentre outros), pode ser colocada em risco, devido a manipulação errônea de produtos perigosos.
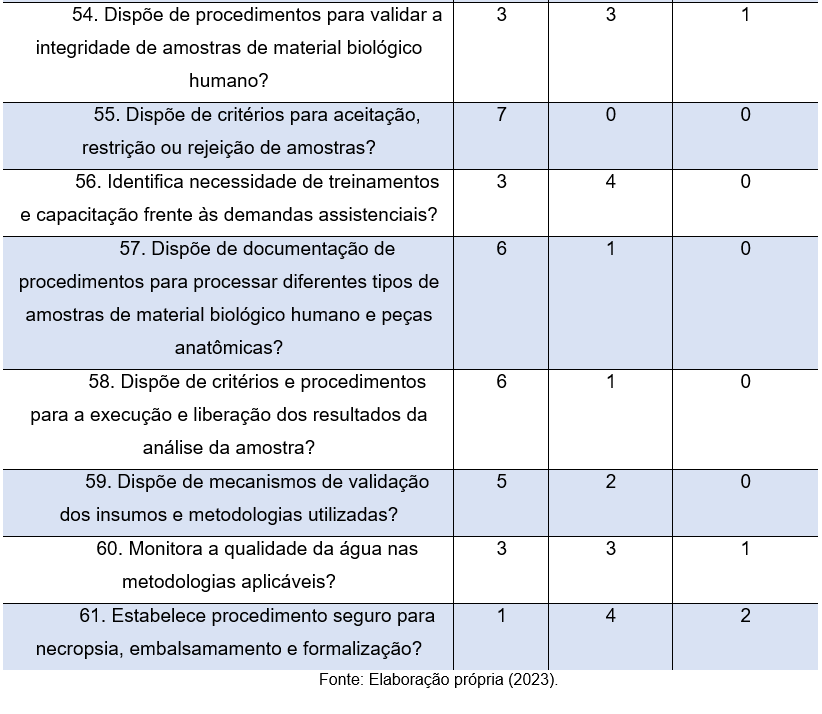
Além disso, vide pergunta 54, é possível observar que 3 (43%) colaboradores relatam que o local não possui procedimentos para validar a integridade de amostras de material biológico, por sua vez, 3 colaboradores afirmam que o local possui e apenas 1 colaborador relata que este critério não se aplica.
A pergunta 55 visa compreender se os locais dispõem de critérios relacionados aos recebimentos de amostras. Cabe destacar que, estabelecer critérios de rejeição de amostra é assegurar uma melhor correlação clínico-laboratorial. No próprio recebimento, o profissional responsável deve conferir se a amostra clínica não apresenta os critérios de rejeição estabelecidos pelo laboratório. Neste quesito tão importante, as respostas são positivas, uma vez que, todos os respondentes (7) afirmam que o local atende a esse critério tão importante, principalmente para instituições que almejam a acreditação.
As empresas querem profissionais competentes, eficientes e efetivamente envolvidos com os objetivos da organização. Como o ser humano é o principal insumo responsável pela competência e sucesso das empresas, torna-se necessário entender como extrair das pessoas seus mais altos níveis de criatividade, inovação, participação e engajamento (RODRIGUES, 2014). Neste contexto, dada a relevância da qualificação profissional, já destacada anteriormente, com base na questão de número 56, é possível observar que apenas 3 (43%) participantes relatam que a organização se preocupa em identificar a necessidade de treinamento e capacitação dos seus colaboradores, em contrapartida, 4 (57%) destacam a não observância deste critério.
Em relação a pergunta 58 e 59, que objetiva compreender acerca de procedimentos para liberação dos resultados e mecanismos de validação dos insumos, nota-se que as organizações têm se preocupado com a organização inerente aos procedimentos técnicos, sendo que, em ambas as questões, mais da metade dos participantes relatam a existência de procedimentos padronizados. Em relação a qualidade da água, analisada na questão de número 60, cumpre ressaltar que, a água contaminada com contaminantes químicos e/ou microbiológicos têm impacto direto na qualidade dos resultados analíticos, visto que a contaminação resulta na alteração da qualidade dos reagentes utilizados. Os resultados laboratoriais de qualidade dependem da confiabilidade da instrumentação e da qualidade da água. Fatores analíticos precisam ser controlados e otimizados para reduzir o número de possíveis falhas que possam se refletir nos resultados. Além disso, a água é um reagente muito suscetível a contaminações mesmo após a etapa de purificação (SANCHES, 2017). Neste quesito tão relevante, vê-se a baixa aderência das organizações em relação a critérios em prol da qualidade da água, visto que, 4 (57%) dos respondentes afirmam que os laboratórios em que atuam, não atendem ou não aplicam esse critério.
Parte-se, portanto, para a análise da última tabela, onde as perguntas 62, 63 e 64 visam compreender aspectos inerentes aos mecanismos de interpretação e entrega de resultados dos exames. A sistematização desses procedimentos é de grande importância, pois, os mesmos são fundamentais para que a instituição possa suprir a demanda de forma adequada.
Todavia, vê-se que os referidos quesitos não têm sido completamente explorados pelas instituições. Com base na resposta dos participantes, é possível compreender o quanto os laboratórios precisam aprimorar suas práticas e aderir a um procedimento padrão, eliminando assim, a possibilidade de falhas.
Já na questão 66, que trata dos critérios e prazos para arquivamento de termos e laudos relacionados a guarda de blocos e lâminas, foi possível constatar que 6 laboratórios possuem um procedimento padrão para tal, apenas 1 não atende a esse quesito, o que pode causar uma série de prejuízos futuramente.
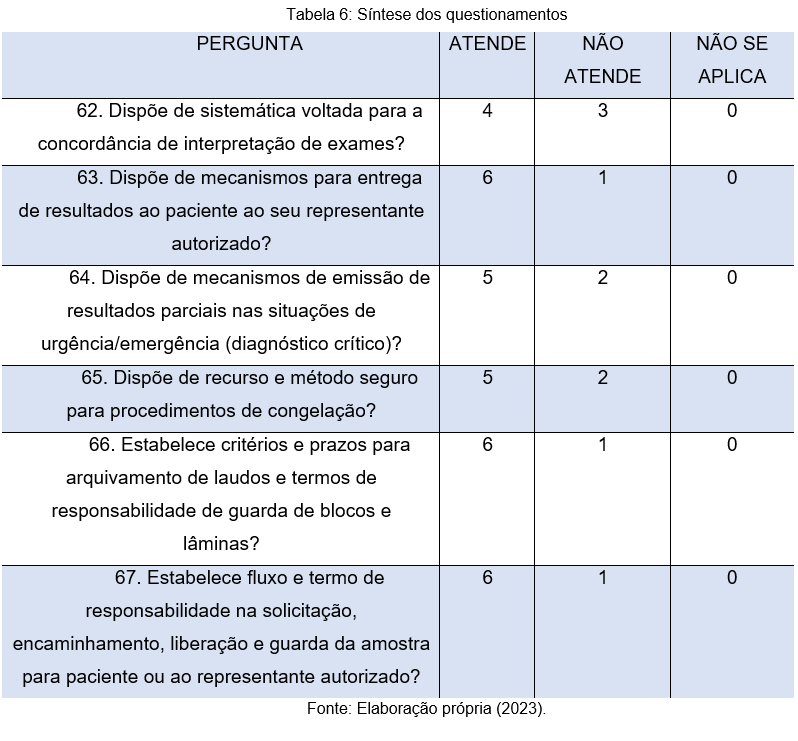
Por fim, a questão 67 visou compreender se as organizações estabelecem um fluxo e termo de responsabilidade relacionada a amostra, para o paciente ou seu representante autorizado. Com base nas respostas, vê-se que 6 (86%) das organizações possuem procedimentos para tal, enquanto apenas uma não atende esse quesito.
Uma pesquisa realizada por Santos e França (2016) investigou quais eram as principais causas de insucesso em programas de qualificação e os resultados indicaram os seguintes fatores: não-envolvimento da alta direção; ansiedade por resultados; desinteresse do nível gerencial; planejamento inadequado; treinamento precário; falta de apoio técnico; sistema de remuneração inconsistente; escolha inadequada de multiplicadores e descuido com a motivação. De forma geral, o insucesso de programas de qualidade é causado por mais que um fator.
Todavia, cada um dos fatores apontados apresenta soluções relativamente simples, é o descuido com a solução que leva ao fracasso. Pelo prisma do sucesso, se pode afirmar que as empresas que se empenham e persistem colhem os frutos provenientes da qualidade de seus serviços.
CONCLUSÃO
A cultura de qualidade no Brasil iniciou-se com atraso de quase cinco décadas em relação a Europa e EUA, onde a acreditação está deixando de ser diferencial e tornando-se mandatória. Em pior situação encontram-se instituições públicas, que não sofrem pressões de mercado e governamental.
A adesão a sistemas de acreditação de controle de qualidade é enxergada como desnecessária por grande parcela dos gestores, uma vez que, são vistos como custosos e com poucos benefícios financeiros. Mercados com pouca concorrência tendem à cultura do status quo nos procedimentos e relação com clientes e resistência a submissão a avaliação e validação externa. A ruptura de vícios gerenciais e culturais da equipe de trabalho, aumento da carga de trabalho burocrático podem se mostrar dolorosos inicialmente.
Aderir à acreditação no Brasil representa colocar à frente no mercado com crescente concorrência, adiantar-se a tendências mundiais e demonstrar apreço com seus pacientes. A melhoria do sistema de qualidade em laboratórios deve ser uma história ambiciosa e sem fim.
Em relação às dificuldades encontradas no estudo, têm-se como limitações o número de participantes entrevistados. Com um número maior de participantes outras percepções poderiam ser analisadas, além do horário de agendamento das entrevistas que muitas vezes entrava em conflito com o horário de expediente dos funcionários.
Além do mais, é interessante identificar quais as percepções de outras instituições públicas e particulares para disseminar os estudos acerca da temática no estado. A pesquisa teve como objetivo colaborar para que futuros estudos a respeito da implantação da acreditação em laboratórios públicos possam ser realizados, além de provocar a comparação da efetividade dessa ferramenta tanto em hospitais públicos quanto privados, medindo seu alcance a nível de instituição e de usuários em geral.
Como contribuição, entende-se que o estudo realizado pode enfatizar a importância da certificação da acreditação em ambientes laboratoriais e o quanto a gestão pública precisa se esforçar para disseminar esse conteúdo aos seus funcionários e para proporcionar aos usuários um atendimento de excelência a nível de qualidade.
Além disso, buscou-se destacar o grande potencial educativo de um hospital universitário, que é uma organização complexa e que forma profissionais de diversas áreas, para o estudo da ferramenta em questão, a fim de modernizar a gestão e formar profissionais cada vez mais preparados para o cumprimento de suas funções.
Em relação às dificuldades encontradas no estudo, têm-se como limitações o número de participantes entrevistados. Espera-se que essa pesquisa tenha colaborado na intenção de sensibilizar as instituições públicas de saúde a debaterem mais o assunto e adotarem medidas eficazes de assistência ao paciente, que possam modernizar a gestão pública com práticas de qualidade hospitalar cada vez mais assertivas.
REFERÊNCIAS
ALASTICO, Gabriel Pedro. TOLEDO, José Carlos de. Acreditação Hospitalar: proposição de roteiro para implantação. Gest. Prod. [online]. 2013, vol.20, n.4, pp.815-831. Epub Nov 22, 2013. ISSN 0104-530X. http://dx.doi.org/10.1590/S0104-530X2013005000011.
AL-ZAMANY, Y. DULAMY, M. HODDEL, S. SAVAGE, B. (2001). “Examining the cultural acceptability of EBEM in Yemen”, The 6th International Conference of ISO 9000 and TQM (ICIT), Ayr.
ANDRADE, Fernando. Resíduos hospitalares: a importância do gerenciamento e como reduzir os riscos com a destinação. Aterraambiental, 2021. Disponível em: https://aterraambiental.com/residuos-hospitalares-como-reduzir-riscos-com-a-destinacao/. Acesso em: 20 mar. 2023.
AUTOLAC. 5 principais riscos em laboratório de análises clínicas e como evitá-los. Autolac, 2023. Disponível em: https://autolac.com.br/blog/riscos-em-laboratorio-de-analises-clinicas/. Acesso em: 20 mar. 2023.
BEASTALL GH. Shaping the Future of Laboratory Medicine: The Great Debate’ IFCC.
Benjamin Osayawe Ehigie, Regina Clement Akpan. 2005. Psycho‐social factors influencing practice of total quality management in some Nigerian organizations. Journal of Managerial Psychology 20:5, 355-379.
Boursier G, Vukasovic I, Mesko Brguljan P, Lohmander M, Ghita I, Bernabeu FA, Barrett E, Brugnoni D, Kroupis Ch, Sprongl L, Thelen MHM, Vanstapel F, Vodnik T, Huisman W, Vaubourdolle M. Accreditation process in European countries – an EFLM survey. Clin Chem Lab Med 2016; 54(4): 545–51.
CAMILO, Nádia Raquel Suzini; OLIVEIRA, João Lucas Campos; BELLUCCI JÚNIOR, José Aparecido; CERVILHERI, Andressa Hirata; HADDAD, Maria do Carmo Fernandes Lourenço; MATSUDA, Laura Missue. Accreditation in a public hospital: perceptions of a multidisciplinary team. Rev Bras Enferm [Internet], v. 69, n. 3, p. 423-30, 2016.
COSTA, Fernando Soares. Acreditação hospitalar – entenda o que é e seus processos. CM Tecnologia, 2018. Disponível em: https://blog.cmtecnologia.com.br/processo-acreditacao-hospitalar/. Acesso em: 20 mar. 2023.
EN ISO 15189:2012 – Medical laboratories – Require ments for quality and competence.
GONÇALVES, Ana. A importância do Qualiex na Acreditação PALC. Qualidade para a saúde. Qualidade para a saúde, 2020. Disponível em: https://qualidadeparasaude.com.br/a-importancia-do-qualiex-na-acreditacao-palc/. Acesso em: 25 mar. 2023.
Guzel O, Guner EI. ISI 15189 Accreditation: Requirements for quality and competence of medical laboratories, experience of a laboratory I. Clinical Biochemistry 2009; 42: 274–8.
GUZEL O, GUNER. Accreditation: Requirements for quality and competence of medical laboratories, experience of a laboratory I. Clinical Biochemistry 2009; 42: 274–8.
JHA AK. Accreditation, Quality, and Making Hospital Care Better. JAMA. 2018;320(23):2410–2411. doi:10.1001/jama.2018.18810
MANZO, Bruna Figueiredo. O Processo de Acreditação Hospitalar na perspectiva de profissionais de saúde. 2009. 98 f. Dissertação (Mestrado em Saúde e Enfermagem) – Escola de Enfermagem, Universidade Federal de Minas Gerais, Belo Horizonte, 2009.
MANZO, Bruna Figueiredo; BRITO, Maria José Menezes; ALVES, Marília. Influência da comunicação no processo de acreditação hospitalar. Revista brasileira de enfermagem, v. 66, n. 1, p. 46-51, 2013.
MENDES, Glauco Henrique de Souza; MIRANDOLA, Thayse Boucinha de Souza. Acreditação hospitalar como estratégia de melhoria: impactos em seis hospitais. Gestão e Produção: São Carlos. v. 22. p. 636-648. 2015.
OLIVEIRA, Simone da Silva. A Influência do Médico-Gestor na Gestão Hospitalar: Estudo de Caso em um Hospital Universitário. Dissertação de Mestrado: Lisboa, 2016.
ONA. ORGANIZAÇÃO NACIONAL DE ACREDITAÇÃO. O que é acreditação, 2019. Disponível em: https://www.ona.org.br/. Acesso em: 20 mar. 2023.
SANCHES, Cristina. Como manter a qualidade da água nos laboratórios. LabNetwork, 2017. Disponível em: https://www.labnetwork.com.br/especiais/como-manter-a-qualidade-da-agua-nos-laboratorios/. Acesso em: 20 mar. 2023.
SANTOS, S.; FRANÇA, S. (2016). Modelo de autoavaliação com enfoque em gestão de pessoas para a melhoria da qualidade dos serviços de saúde. Sistemas & Amp; Gestão, 11(3), 299–309.
Schneider, Frank & Maurer, Caroline & Friedberg, Richard. (2017). International Organization for Standardization (ISO) 15189. Annals of Laboratory Medicine. 37. 365. 10.3343/alm.2017.37.5.365.
SILVA, Mariana Dias. Treinamento e Desenvolvimento de pessoas: o que é e como criar uma estratégia de sucesso. Gupy, 2020. Disponível em: https://www.gupy.io/blog/treinamento-e-desenvolvimento. Acesso em: 20 mar. 2023.
SOUSA, D. P. B; MACHADO-TAYLOR, M. D. L.; ROCHA, L. L. Impact of Accreditation Programs and Quality Management in Public and Private Hospitals in Brazil and in the World: Study of Integrative Review. BJSCR v. 13. n. 4. p. 122–152, 2015.
Standards for Medical Laboratory. Accreditation for medical laboratories. CPA, Clinical Pathology Accreditation (UK) Ltd. PD-LAB Standards. 2007. (www.ukas.com/accreditation/cpa)
THURNEYSEN, N., Plank, T. & Boes, S. Analysis of costs and benefits of a re-accreditation of a Swiss acute care hospital. Saf Health 2, 2 (2016). https://doi.org/10.1186/s40886-016-0013-x
Verstraete, A., van Boeckel, E., Thys, M. and Engelen, F. (1998), “Attitude of laboratory personnel towards accreditation”, International Journal of Health Care Quality Assurance, Vol. 11 No. 1, pp. 27-30. https://doi.org/10.1108/09526869810199629
Virginia Mumford, Kevin Forde, David Greenfield, Reece Hinchcliff, Jeffrey Braithwaite, Health services accreditation: what is the evidence that the benefits justify the costs?, International Journal for Quality in Health Care, Volume 25, Issue 5, October 2013, Pages 606–620, https://doi.org/10.1093/intqhc/mzt059
Yanikkaya-Demirel G. ISO 15189 accreditation: Requirements for quality and competence of medical laboratories, experience of a laboratory II. Clinical Biochemistry 2009; 42: 279–83.
Zairi, M., & Alsughayir, A. A. (2011). The adoption of excellence models through cultural and social adaptations: An empirical study of critical success factors and a proposed model. Total Quality Management & Business Excellence, 22(6), 641–654. doi:10.1080/14783363.2011.580654
ZIMA T. Accreditation in clinical laboratories. Biochemia Medica 2010; 20/2: 215–20.
