REGISTRO DOI:10.5281/zenodo.10426055
José Carlos Batalha Borges
Pedro Paulo Albuquerque Braga
Orientador: Prof. Me. Marcos do Prado Sotero.
RESUMO
O Colossoma macropomum, popularmente conhecido como tambaqui, é uma espécie crucial na ictiofauna amazônica, representando uma parte significativa da produção de piscicultura no Amazonas. No entanto, a sobrepesca de estoques naturais e problemas sanitários, como a infestação pelo acantocéfalo Neoechinorhynchus buttnerae, têm impactado a produção. Este verme, identificado nos anos 1990, tem causado danos ao desempenho produtivo dos tambaquis, afetando o crescimento e peso dos peixes. O trabalho visa explorar alternativas para controlar a infestação por N. buttnerae na piscicultura de tambaquis, considerando a importância econômica e social dessa espécie na região amazônica. A infestação pelo N. buttnerae, apesar de raramente levar à mortalidade, resulta em queda no desempenho produtivo, causando perda de peso e, em casos severos, caquexia nos peixes. As infestações maciças afetam morfologicamente os tambaquis, causando alterações na região dorsal e coloração pálida. A falta de métodos específicos de diagnóstico prévio torna a detecção desafiadora, sendo muitas vezes realizada apenas post mortem. A pesquisa destaca a necessidade de estratégias de controle, incluindo o uso de antiparasitários como o Albendazol e o cloridrato de Levamisol. Além disso, medidas preventivas, como o manejo adequado da qualidade da água, quarentena para alevinos, desinfecção de equipamentos e rodízio de espécies, são cruciais para evitar ou reduzir a ocorrência da infestação. O controle eficaz da infestação por N. buttnerae em tambaquis na aquicultura amazônica requer uma abordagem integrada. Eliminar hospedeiros intermediários, adotar o rodízio de peixes e garantir a qualidade da água são medidas essenciais. Conhecer a procedência dos alevinos e realizar práticas de manejo adequadas emergem como componentes-chave para preservar a saúde e a produtividade dos tambaquis na região amazônica.
Palavras-chave: Neoechinorhynchus buttnerae. Tratamento para acantocéfalos. Parasita em tambaqui.
Colossoma macropomum, popularly known as tambaqui, is a crucial species in the Amazonian fish fauna, representing a significant part of fish farming production in Amazonas. However, overfishing of natural stocks and health problems, such as infestation by the acanthocephalan Neoechinorhynchus buttnerae, have impacted production. This worm, identified in the 1990s, has caused damage to the productive performance of tambaquis, affecting the growth and weight of the fish. The work aims to explore alternatives to control N. buttnerae infestation in tambaqui fish farming, considering the economic and social importance of this species in the Amazon region. Infestation by N. buttnerae, despite rarely leading to mortality, results in a drop in production performance, causing weight loss and, in severe cases, cachexia in fish. Massive infestations affect tambaquis morphologically, causing changes in the dorsal region and pale coloring. The lack of specific prior diagnosis methods makes detection challenging, and it is often performed only post-mortem. The research highlights the need for control strategies, including the use of antiparasitics such as Albendazole and Levamisole hydrochloride. Furthermore, preventive measures, such as adequate management of water quality, quarantine for fry, disinfection of equipment and species rotation, are crucial to avoid or reduce the occurrence of infestation. Effective control of N. buttnerae infestation in tambaquis in Amazonian aquaculture requires an integrated approach. Eliminating intermediate hosts, adopting fish rotation and ensuring water quality are essential measures. Knowing the origin of fry and carrying out appropriate management practices emerge as key components for preserving the health and productivity of tambaquis in the Amazon region.
ABSTRACT
Keywords: Tambaqui, treatment, prevention, acanthocephalans Neoechinorhynchus buttnerae, financial.
- INTRODUÇÃO
Colossoma macropomum é uma das espécies de peixes mais importantes da ictiofauna amazônica sendo conhecido popularmente como tambaqui. Distribui-se amplamente nas bacias dos rios Orinoco e Amazonas, vivendo em lagos e áreas marginais alagadas associadas às calhas dos rios principais. Pode alcançar mais de um metro de comprimento e atingir 30 kg e é considerado o segundo maior peixe de escamas da bacia amazônica (GOULDING; CARVALHO 1982).
Colossoma macropomum representou 262.370 toneladas em 2021, é a espécie mais produzida na piscicultura do Amazonas (EMBRAPA,2022). Sua produção em cativeiro é importante devido à sobrepesca dos estoques naturais, o que acarretou numa diminuição do desembarque pesqueiro no estado do Amazonas (BATISTA; PETRERE 2003).
Outro motivo para o aumento de sua produção é o custo da alimentação, que pode ser reduzido utilizando proteínas vegetais alternativas ao milho, como a farinha de babaçu ou a crueira de mandioca, mantendo a mesma eficácia das rações comerciais (LOPES ET AL. 2010; PEREIRA JUNIOR ET AL. 2013).
Os primeiros casos de problemas sanitários na criação de Tambaqui (Colossoma macropomum), causados pelo verme Acanthocephala Neoechinorhynchus buttnerae surgiram no estado do Amazonas no final da década de 1990. Desde então, essa verminose tem se disseminado entre os estados da região amazônica e áreas de transição deste bioma, incluindo Rondônia, Roraima, Mato Grosso e Maranhão. A fonte de infecção para esse verme possivelmente foi a partir de animais portadores do ambiente natural ou por peixes invasores. A infecção por esse acantocéfalo dificilmente causa a morte dos peixes parasitados, contudo, promove queda expressiva no desempenho produtivo dos animais, podendo ocasionar perda de peso e até mesmo caquexia em casos mais severos (AQUA CULTURE BRASIL.2016).
Em alguns casos ocorre infestação maciça por esses parasitas, o que acaba obstruindo a luz do intestino. Essas condições causam alterações na morfologia externa dos jovens de Colossoma macropomum e indivíduos parasitados crescem menos que os saudáveis, com achatamento da região dorsal anterior do corpo, e cor mais pálida (MALTA ET AL. 2001). Estas infestações maciças causam alterações histopatológicas no intestino, afetando a mucosa, submucosa e tecido muscular, provocando inflamações e granulomas (JERÔNIMO ET AL. 2017; MATOS ET AL. 2017).
Os peixes podem apresentar enfermidades de diversas origens em sistemas de criação intensiva, com destaque para as doenças parasitárias (MARTINS ET AL., 2010; PÁDUA ET AL., 2013; MOREIRA ET AL., 2013; VALLADÃO ET AL., 2014).
- REVISÃO DE LITERATURA
O tambaqui é o segundo maior peixe de escama da América do Sul (ISAAC; RUFFINO, 2000) e é encontrado em estado silvestre nas bacias dos rios Solimões/Amazonas e Orinoco e seus afluentes (ARAÚJO-LIMA; GOULDING, 1998). O tambaqui foi a primeira espécie de peixe nativo amazônico que atraiu um número relativamente grande de pesquisadores (ecólogos, biólogos pesqueiros, fisiologistas) e aquicultores (ARAÚJO-LIMA; GOULDING, 1998). Descrito pela primeira vez por Barão George Von Cuvier no início do século XIX, atualmente pertence à ordem dos Characiformes e a família Characidae a qual abrange 963 espécies descritas (REIS et al, 2003).
A classificação taxonômica do tambaqui é distribuída por Reino Animalia, Filo Chordata, Classe Actinopterygii, Ordem Characiformes, Família Characidae, Subfamília Serrasalminae, Gênero Colossoma, Espécie Colossoma macropopum, e apresenta os nomes populares em alguns países. Tambaqui no Brasil, Gamitana no Peru, Canhama na Venezuela, Cachama negra na Colômbia, e Black-pacu no USA.
Durante o seu desenvolvimento até chegar à idade adulta, o tambaqui passa por grandes mudanças principalmente na sua forma e coloração. Segundo ARAÚJO-LIMA; GOULDING (1998). Nos lagos, os adultos e jovens são capturados na água aberta e na floresta alagada (ARAÚJO-LIMA e GOULDING, 1998; CORREDOR, 2004) e os alevinos, na vegetação aquática (ARAÚJO-LIMA; GOULDING, 1998).
O consumo de pescado possui grande relevância econômica e social na região Amazônica, sendo uma das principais fontes de proteína para seus moradores, sendo que esse produto é o alicerce da economia na região amazônica, se destacando não só pela riqueza de espécies que abriga, mas também pela quantidade de peixes que é capturado todos os anos podendo assim constatar a sua importância econômica para a região (FERREIRA, 2019).
Segundo (JERÔNIMO ET AL. 2017) a parasitose massiva por Neoechinorhynchus buttnerae em tambaquis pode levar a redução no crescimento e emagrecimento dos peixes cultivados, uma vez que apresentam falta de apetite (hiporexia) e perda excessiva de peso (caquexia). Este parasito causa severas patogenias, entre elas o enrijecimento e espessamento da parede do intestino, devido a ação mecânica de sua fixação, que ocasiona um processo intenso inflamatório predominantemente formado por macrófagos, células de Langerhans e linfócitos.
2.1 Acantocéfalo Neoechinorhynchus buttnerae
A infecção por este acantocéfalo dificilmente causa a morte dos peixes parasitados, contudo, promove queda expressiva no desempenho produtivo dos animais, podendo ocasionar perda de peso e até mesmo caquexia em casos mais severos (AQUA CULTURE BRASIL. 2016). No entanto, o que deve ser feito é a análise para diagnóstico da infecção intestinal por este parasito, sendo facilmente detectado a partir da necropsia e abertura de intestino anterior e médio, podendo em casos mais severos, ocorrer infestação em praticamente todo o tubo digestivo a partir da região pilórica (válvula após o estômago) (AQUA CULTURE BRASIL. 2016). A diminuição do desempenho dos animais infectados por esta verminose ocorre devido à competição pelos nutrientes da ração, bem como pela diminuição da área funcional responsável pela absorção intestinal. Além disso, este acantocéfalo penetra as camadas do intestino, que por sua vez, induz a ocorrência de um processo inflamatório severo e ocasiona a dilaceração da mucosa intestinal por meios de seus espinhos de fixação (AQUA CULTURE BRASIL. 2016).
O filo Acantocephala é monofilético e é um dos dois únicos filos conhecidos que as espécies são exclusivamente parasitas, sem nenhuma fase de vida livre. Este grupo possui pouca variação de ciclo de vida, e de estruturas corporais, tornando o trabalho dos sistemas muito difícil. Todas as espécies de Acantocephala possuem um ovo de vida livre com o acântor, um artrópode é hospedeiro intermediário para a fase de acantela e cistacanto, um vertebrado é o hospedeiro definitivo (KENNEDY 2006).
As espécies de Acantocephala podem ser utilizadas como indicadoras de poluição orgânica. Os seus hospedeiros intermediários sofrem declínio em águas poluídas, o que acarreta numa menor intensidade de parasitismo nos hospedeiros definitivos (KUSSAT 1969; OVERSTREET E HOWSE 1977; VIDAL-MARTINEZ ET AL. 2003).
O acantocéfalo Neoechinorhynchus buttnerae pertencente à família Neoechinorhynchidae, é um helminto intestinal específico do tambaqui (Colossoma macropomum), e tem sido responsável por perdas econômicas no cultivo desta espécie (TAVARES DIAS; MARTINS, 2017). Este parasito possui como característica principal a probóscide, estrutura provida de espinhos que, ao fixar-se na parede intestinal pode causar injúrias severas como dilacerações teciduais no intestino, metaplasia e perda de vilos intestinais (JERÔNIMO et al., 2017). Devido à ausência do sistema digestório, os acantocéfalos se alimentam por difusão, através de poros presentes na parede do corpo, absorvendo açúcares, nucleotídeos, aminoácidos e triglicerídeos do intestino do hospedeiro (NUÑEZ; DRAGO, 2017), competindo por nutrientes e podendo levar a caquexia e até morte nos peixes em casos mais severos (MALTA et. al., 2001; JERÔNIMO et al., 2017).
Estes parasitos possuem como característica principal uma probóscide retrátil provida de espinhos que é utilizada como mecanismo de fixação, cujo 15 movimento de invaginação se dá a partir da pressão hidráulica proveniente da contração da musculatura do saco da probóscide, o que está diretamente relacionado com o sistema nervoso do parasito (NUÑEZ e DRAGO, 2017).
As espécies de Acanthocephala são mundialmente conhecidas por não causarem danos em criações de peixes por terem alta especificidade e por serem heteróxenas. Na Amazônia, as criações de Colossoma macropomum vêm sofrendo sérios problemas com o N. (N.) buttnerae. Nestes ambientes confinados o ciclo de vida N. (N.) buttnerae têm se completado com a presença dos hospedeiros intermediários e definitivos ocasionando uma explosão nas populações de N. (N.) buttnerae. Em alguns casos ocorre infestação maciça por esses parasitas, o que acaba obstruindo a luz do intestino. Essas condições causam alterações na morfologia externa dos jovens de Colossoma macropomum e indivíduos parasitados crescem menos que os saudáveis, com achatamento da região dorsal anterior do corpo, e cor mais pálida (MALTA ET AL. 2001).
- Sinais clínicos
Nos tambaquis acontecem infestações maciças que causam alterações histopatológicas no intestino, afetando a mucosa, submucosa e tecido muscular, provocando inflamações e granulomas. Causam com frequência anorexia, crescimento heterogêneo, caquexia, o crescimento e o peso são observados (Brazilian Journals,2020). Macroscopicamente, os intestinos apresentavam hiperemia, endurecimento, espessamento da parede intestinal, secreção mucosa amarelada e aspecto de língua azul. A alta infestação por acantocéfalos é responsável pela oclusão parcial e total do trato intestinal, prejudicando a capacidade de absorção e competindo diretamente com o alimento ingerido (EMBRAPA, 2020). Nos casos de penetração no tecido muscular podem ocorrer metaplasias, com substituição do tecido muscular por tecido conjuntivo frouxo, com presença de macrófagos, linfócitos, eosinófilos e fibroblastos (MATOS ET AL. 2017).
No tambaqui, alguns animais exibem caquexia, mas sem mortalidade. Na necropsia, em severa infecção por N. buttnerae, observa-se enrijecimento e espessamento da parede do intestino, também associada com secreção intestinal mucosa de aspecto catarral e coloração amarelada. Os efeitos patogênicos de acantocéfalos adultos decorrem da ação mecânica do parasito ao fixar sua probóscide na parede intestinal (JERÔNIMO, G.T.; PÁDUA, S.B.; BELO, M.A.A.; CHAGAS, E.C.; TABOGA, S.R.; MACIEL, P.O.; MARTINS, M.L, 2017)
- Diagnóstico
Como não tem um exame específico para detectar os parasitas antes que eles se proliferem, é possível detectar através de anamnese do animal, verificação do score corporal e também por meio da avaliação post mortes dos peixes, quando parasitos adultos são encontrados no trato intestinal (JERÔNIMO et al., 2017).
Antes da realização do processo de despesca, é recomendado que se faça o planejamento da operação, reunindo todos os equipamentos (desinfetados) a serem utilizados, definindo a função de cada trabalhador de modo a tornar a operação rápida, eficiente e causando menos estresse e ferimentos aos peixes, a despesca deve ser realizada de forma convencional, com rede de arrasto (NUTRIZOM 2014).
Os peixes são capturados e mortos por coleta com rede de arrasto, posteriormente necropsiados para análise parasitológica. Utilizando placas de Petri e analisadas com auxílio de microscópio. Para quantificação de helmintos parasitos, foram utilizadas placas de Petri marcadas e analisadas com auxílio de estereomicroscópio, e os protozoários foram quantificados com auxílio de câmera Sedgewick Rafter (JERÔNIMO ET AL. 2011).
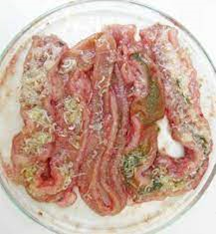
Figura 1: Secção longitudinal do intestino anterior exibindo inúmeros acantocéfalos (AC) e espessamento da parede intestinal (asterisco). Foto: Patricia Oliveira Maciel.
- Tratamento
Embora ainda não tenha um tratamento específico e bem definido, os antiparasitários de amplo espectro como Albendazol (CORDEIRO ET AL, 2022). e uma outra substância amplamente utilizada é o cloridrato de Levamisol (MELO ET AL. 2013; TAVARES, 2014; PAHOR-FILHO, 2017), que, além desta ação, também atua na produção e migração de neutrófilos, na atividade fagocítica de leucócitos e mieloperoxidase, nos níveis de lisozima sérica, nos linfócitos T e células “natural killer” (BILLER-TAKAHASH 2010; TAVARES, 2014; PAHOR-FILHO ET AL. 2017). Tem mostrado resultados satisfatórios, além disso, infestações uma medida que vem sendo adotada mais recentemente em algumas pisciculturas da região consiste no rodízio de espécies, alternando ciclos de produção entre tambaqui e matrinxã, ou outra espécie, visando com isso quebrar o ciclo de vida do parasito.
Para (LEMOS ET AL, 2006) as medidas para se evitar ou reduzir a ocorrência dessas enfermidades são: manejo adequado da qualidade da agua e boa nutrição, controlar a introdução de novos peixes, adquiri-los de fornecedor idôneo, providenciar local adequado para quarentena e realizar desinfecção dos equipamentos, caixas e utensílios usados no transporte para evitar a transferência de patógenos de uma propriedade a outra, utilizar ainda filtros e telas para controlar a entrada de peixes indesejáveis, remoção diariamente de peixes mortos do sistema e conscientização dos trabalhadores do cultivo.
- CONSIDERAÇÕES FINAIS
Portanto o melhor controle está na eliminação dos hospedeiros intermediário (artrópodes), rodízio de peixes, alternando ciclos de produção entre tambaqui e matrinxã visando com isso quebrar o ciclo de vida do parasito, uma vez que estes são espécie específicos, conhecer a procedência dos alevinos, realizar quarentena a cada lote adquirido, proceder a desinfecção de equipamentos utilizados nos viveiros, e monitorar os parâmetros de qualidade da água durante o cultivo.
- REFERÊNCIAS BIBLIOGRÁFICAS
AQUACULRE BRASIL, Neoechinorhynchus buttnerae (Acanthocephala): verminose emergente em peixes redondos
ARAÚJO-LIMA, C.A.; GOULDING, M. (1998): Os frutos do tambaqui: ecologia, conservação e cultivo na Amazônia. Sociedade Civil Mamirauá. Brasília CNPq, Tefé, Amazonas. 186p. 1998.
BATISTA V.S.; PETRERE M. JR. 2003 Characterization of the commercial fish production landed at Manaus, Amazonas State, Brazil. Acta Amazonica. 33: 53–66.
BILLER-TAKAHASHI, J. D. 2010. Imunomodulação por levamisol na imunidade inata e adquirida de pacu (Piaractus mesopotamicus). Tese de doutorado, Faculdade de Ciências Agrárias e Veterinárias – UNESP – Câmpus de Jaboticabal, Jaboticabal – SP. 131p.
CORREDOR, M. C. F. Influência das variações temporais da disponibilidade relativa de hábitats sobre a comunidade de peixes em um lago de várzea da Amazônia Central. 2004. 89 f. Dissertação (Mestrado em Biologia de Água Doce e Pesca Interior) – Instituto Nacional de Pesquisas da Amazônia, Manaus, Amazonas, 2004.
DE MATOS, L.V.; DE OLIVEIRA, M.I.B.; GOMES, A.L.S.; DA SILVA, G.S. 2017. Morphological and histochemical changes associated with massive infection by Neoechinorhynchus buttnerae (Acanthocephala: Neoechinorhynchidae) in the farmed freshwater fish Colossoma macropomum Cuvier, 1818 from the Amazon State, Brazil. Parasitology Research, 1-9.
FERREIRA, V. C. Estudo da comercialização e condições de armazenamento do pescado em duas feiras da cidade de Parintins/am. Monografia, Trabalho de Conclusão de Curso, Curso de Licenciatura em Ciências Biológicas, Centro de Estudos Superiores de Parintins, Universidade do Estado do Amazonas, 2019.
GOULDING, M.; CARVALHO, M.L. 1982. Life history and management of the tambaqui (Colossoma macropomum, Characidae) an important Amazonian food fish. Revista Brasileira de Zoologia, 1: 107-133.
ISAAC, V. J.; RUFFINO, M. L. Informe estatístico do desembarque pesqueiro na cidade de Santarém, PA: 1992 – 1993. In.: Fischer, C. F. (Ed.). Recursos pesqueiros do Médio Amazonas: biologia e estatística pesqueira. IBAMA/GTZ/GOPA, Brasília, 2000, 225-280 p.
JERÔNIMO, G. T.; DE PÁDUA, S. B.; BELO, M. A. A., CHAGAS, E. C.; TABOGA, S. R.; MACIEL, P. O.; MARTINS, M. L. Neoechinorhynchus buttnerae (Acanthocephala) infection in farmed Colossoma macropomum: a pathological approach. Aquaculture, v. 469, p. 124-127, 2017.
JERÔNIMO, G.T et al. Neoechinorhynchus buttnerae (Acanthocephala) infection in farmed Colossoma macropomum: a pathological approach. Aquaculture, v. 469, p. 124-127, 2017.
JERÔNIMO, G.T.; DE PÁDUA, S.B.; DE ANDRADE BELO, M.A.; CHAGAS, E.C.; TABOGA, S. R.; MACIEL, P. O.; MARTINS, M. L. 2017. Neoechinorhynchus buttnerae (Acanthocephala) infection in farmed Colossoma macropomum: A pathological approach. Aquaculture, 469, 124-127.
KENNEDY, C.R. 2006. Ecology of the Acanthocephala. Cambridge University Press. New York, USA. 249p.
KUSSAT, R.H. 1969. A comparison of aquatic communities in the Bow River above and below sources of domestic and industrial wastes from the city of Calgary. Canadian Fisheries and Cultures, 40: 3-31.
LEMOS, J. B. Diagnostico de ectoparasitas e bacterias em tilapias (oreochromis niloticus) cultivadas na regiao de Paulo Afonso, Bahia. Revista Brasileira de Engenharia de Pesca. 2006.
LOPES, J.M.; PASCOAL, L.A.F.; SILVA FILHO, F.P.D.; SANTOS, I.B.; WATANABE, P.H.; ARAUJO, D.M.; PINTO, D.C; OLIVEIRA, P.D.S. 2010. Farelo de babaçu em dietas para tambaqui. Revista Brasileira de Saúde e Produção Animal, 11: 519-526.
MALTA JCO, GOMES ALS, ANDRADE SMS, VARELLA AMB. Massive infestation by Neoechinorhynchus buttnerae Golvan, 1956 (Eoacanthocephala: Neochinorhynchidae) in young “tambaquis” Colossoma macropomum (Cuvier, 1818) cultured in the Central Amazon. Acta Amazonica 2001; 31 (1): 133–143.
MALTA, J.D.O.; GOMES, A.L.S.; DE ANDRADE, S.M.S.; VARELLA, A.M.B. 2001. Massive infestation by Neoechinorhynchus buttnerae Golvan, 1956 (Eoacanthocephala: Neochinorhynchidae) in young” tambaquis” Colossoma macropomum (Cuvier, 1818) cultured in the Central Amazon. Acta Amazonica, 31: 133-143.
MELO, L. R. B.; VILELA, V. L. R.; FEITOSA, ALMEIDA NETO, T. F; J. L.; MORAIS, D. F. 2013. Anthelmintic resistance in small ruminants from the semiarid of Paraíba State, Brazil. ARS Veterinária. Jaboticabal-SP. 29(2): 104-108p.
NÚÑEZ, V.; DRAGO, F.B. Phylum Acanthocephala. In: Drago, F. B. Macroparásitos: Diversidad Y Biología, 8: 112-125, 2017
NUTRIZON – Departamento de Pesquisa e Desenvolvimento em Aquicultura Alimentos Ltda. Manual de boas pratica de produção em piscicultura, 2014.
OVERSTREET, R.M.; HOWSE, H.D. 1977. Some parasites and diseases of estuarine fishes in polluted habitats of Mississippi. Annals of the New York Academy of Sciences, 298: 427-462.
PAHOR-FILHO, E.; PEREIRA JÚNIOR, J.; PILARSKI, F.; URBINATI, E. C. 2017. Levamisole reduces parasitic infection in juvenile pacu (Piaractus mesopotamicus). Aquaculture. 470:123-128p.
PEREIRA-JUNIOR, G.P.; DE OLIVEIRA PEREIRA, E.M.; PEREIRA-FILHO, M.; DE SOUSA BARBOSA, P.;SHIMODA, E.; BRANDÃO, L.V. 2013. Desempenho produtivo de juvenis de tambaqui (Colossoma macropomum Cuvier, 1818) alimentados com rações contendo farinha de crueira de mandioca (Manihot esculenta, Crantz) em substituição ao milho (Zea mays). Acta Amazonica, 43: 217-226.
REIS, R. E.; KULLANDER, S. O.; FERRARIS, JR. Check list of the freshwater of South and Central America. Porto Alegre, EDIPUCRS, 2003, 729 pp.
RIBEIRO, J. L. P. Revisão de investigação e evidência científica. Psicologia, Saúde & Doenças, v.15 n.3, p. 671–682, 2014.
Tavares, W. 2014. Drogas anti-helmínticas. In: Antibióticos e quimioterápicos para o clínico. 455-493.
TAVARES-DIAS, M; MARTINS, ML. An overall estimation of losses caused by diseases in the Brazilian fish farms. Journal of parasitic diseases, v. 41, n. 4, p. 913-918, 2017.
THATCHER, V.E. 2006. Aquatic Biodiversity in Latin America: Amazon Fish Parasites. 2nd edition, Pensoft Publishers, Praga, Bulgaria, 508p.
VIDAL-MARTÍNEZ, V.M.; AGUIRRE-MACEDO, M.L.; NOREÑA-BARROSO, E.; GOLD-BOUCHOT, G.; CABALLERO-PINZÓN, P. I. 2003. Potential interactions between metazoan parasites of the Mayan catfish Ariopsis assimilis and chemical pollution in Chetumal Bay, Mexico. Journal of Helminthology, 77: 173-184.
