REGISTRO DOI: 10.69849/revistaft/ra10202509220747
Danielle Domingues de Oliveira
Orientadora: M.ª Bruna Scalzilli Luzes
RESUMO
Os sarcomas de tecidos moles são as principais neoplasias malignas de origem mesenquimal em felinos, destacando-se os fibrossarcomas e os sarcomas indiferenciados. O tratamento é complexo e pode envolver cirurgia, quimioterapia e radioterapia, sendo o prognóstico influenciado pelo grau histopatológico, estadiamento clínico e margens cirúrgicas. Relata-se o caso de um felino com neoformação em região facial, acometendo a têmpora e o globo ocular direito, cuja ressecção foi dificultada pela proximidade do conduto auditivo. Optou-se pela exenteração orbitária associada à reconstrução com retalho de avanço subdérmico, permitindo margens amplas e fechamento adequado. A análise histopatológica confirmou sarcoma de tecidos moles grau II com comprometimento das margens profundas, motivo pelo qual foi indicada radioterapia adjuvante, enquanto a reintervenção cirúrgica foi considerada inviável devido à localização da lesão.
Palavras-chave: Sarcoma de tecidos moles. Exenteração. Cirurgia reconstrutiva. Gato.
ABSTRACT
Soft tissue sarcomas are the main malignant mesenchymal neoplasms in cats, with fibrosarcomas and undifferentiated sarcomas being the most common types. Treatment is complex and may involve surgery, chemotherapy, and radiotherapy, with prognosis influenced by histopathological grade, clinical staging, and surgical margins. This report describes the case of a cat with a facial mass affecting the temporal region and the right eye, where surgical excision was hindered by the proximity to the auditory canal. Orbital exenteration combined with subdermal advancement flap reconstruction was performed, allowing wide margins and adequate closure. Histopathological analysis confirmed a grade II soft tissue sarcoma with deep margin involvement, for which adjuvant radiotherapy was indicated, while surgical reintervention was deemed unfeasible due to the lesion’s location.
Keywords: Soft tissue sarcoma. Exenteration. Reconstructive surgery. Cat.
Introdução
Os sarcomas de tecidos moles (STMs) em felinos são neoplasias malignas de origem mesenquimal, representando uma parcela significativa das neoplasias cutâneas em gatos, com comportamento localmente invasivo e alto risco de recorrência⁵,⁹. Apesar da baixa incidência de metástases, essas neoplasias apresentam “alta” agressividade local, o que torna o manejo clínico e cirúrgico desafiador⁵,⁹. A etiologia dos STMs felinos inclui fatores genéticos, ambientais e, em alguns casos, relacionados à vacinação, como observado nos sarcomas associados a vacinas⁷. Essas neoplasias podem ocorrer em diversas regiões do corpo, sendo mais comuns no tronco e membros, embora a cabeça e a região orbital apresentem desafios cirúrgicos significativos devido à complexidade anatômica⁶,⁸,¹⁴. O diagnóstico precoce e a classificação histológica adequada são fundamentais para orientar o manejo clínico. Estudos recentes destacam a importância da avaliação da atividade mitótica, do grau histológico e da extensão tumoral para prever o comportamento agressivo da doença e o risco de recorrência⁵,⁹.
O tratamento padrão dos STMs felinos envolve ressecção cirúrgica ampla com margens livres, frequentemente associada a terapias adjuvantes, como radioterapia, quimioterapia ou eletroquimioterapia¹,²,¹¹,¹²,¹³. A eletroquimioterapia combina a aplicação local de pulsos elétricos com agentes citotóxicos, aumentando a penetração do medicamento nas células tumorais e promovendo maior controle locorregional, especialmente em tumores de difícil ressecção. Em regiões anatômicas complexas, técnicas reconstrutivas, incluindo retalhos subdérmicos, são essenciais para garantir fechamento seguro do defeito cirúrgico, preservando tanto a função quanto a estética³,⁶,⁸,¹³,¹⁴.
Diante desse contexto, este trabalho objetiva relatar um caso clínico de sarcoma de tecidos moles em felino, localizado na região orbital, abordando a exenteração orbitária associada à reconstrução com retalho de avanço subdérmico.
Relato de caso
Foi atendido em hospital veterinário um felino, sem raça definida (SRD), macho, castrado, com 11 anos de idade, apresentando como queixa principal uma neoformação localizada na região temporal, com acometimento do globo ocular direito e relato de crescimento progressivo. O paciente não apresentava alterações clínicas em outros sistemas, no exame físico e na anamnese. Foram realizados exames complementares, incluindo hemograma completo, bioquímica sérica, citologia da lesão, radiografia torácica e ultrassonografia abdominal, com o objetivo de avaliar o estado geral do paciente e investigar a presença de possíveis metástases.
Ao exame físico, observou-se massa em topografia temporal direita, com envolvimento do globo ocular direito, consistência firme, parcialmente aderida, sem planos de clivagem palpáveis, medindo aproximadamente 3 × 3 cm, próxima à base do conduto auditivo direito (Figura 1). A citologia aspirativa indicou lesão de origem mesenquimal (células fusiformes, pleomorfismo acentuado e elevado índice mitótico). A ultrassonografia abdominal evidenciou raros pontos ecogênicos em suspensão e alguns aderidos à parede vesical ventral, sugestivos de sedimento/celularidade, compatíveis com cistite discreta. A radiografia torácica mostrou padrão intersticial leve, sem sinais de metástase, e o ecocardiograma não apresentou alterações relevantes. Diante dos achados, planejou-se exenteração orbitária com reconstrução por retalho de avanço de plexo subdérmico.
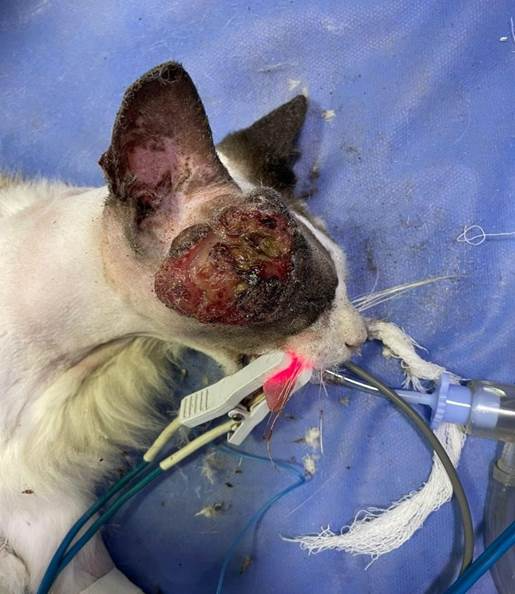
Figura 1. Presença de neoformação temporal animal Pipoca. (Fonte acervo pessoal)
O procedimento de exenteração orbitária associado à reconstrução com retalho cutâneo (flap) foi realizado sob anestesia geral. O protocolo anestésico incluiu pré-medicação com metadona (0,15 mg/kg, IM), indução com propofol (3 mg/kg) associado à cetamina (1 mg/kg), ambos por via intravenosa, e manutenção com isoflurano em oxigênio (O₂) associada à infusão contínua de fentanil (5 µg/kg). Foi realizado bloqueio regional do nervo trigêmeo com bupivacaína a 0,5% na dose de 0,1 mL/kg. Durante o procedimento, os parâmetros cardiorrespiratórios permaneceram estáveis, sem intercorrências O procedimento transcorreu sem intercorrências.
O paciente foi posicionado em decúbito lateral esquerdo, com o lado direito da face (região afetada) voltado para cima. Após tricotomia ampla da região realizou-se antissepsia com solução degermante de clorexidina a 2%, seguida de solução alcoólica de clorexidina a 0,5%.
Uma incisão elíptica ampla foi realizada envolvendo toda a região orbitária e a neoformação, com margens de segurança baseadas na avaliação clínica e citológica pré-operatória. Ressecção com margens de aproximadamente 2 cm, limitadas pela anatomia local. Procedeu-se à exenteração orbitária, removendo o globo ocular direito, tecidos periorbitários, musculatura extrínseca ocular e conteúdo orbitário adjacente, respeitando as estruturas anatômicas vizinhas. A hemostasia foi obtida com eletrocautério e ligaduras com fio absorvível ( poliglactina 910) (Figura 2).
Devido à extensão do defeito cirúrgico e à necessidade de cobertura com mínima tensão, optou-se pelo uso de retalho cutâneo de avanço do plexo subdérmico, desenhado na região dorsotemporal da cabeça, respeitando a vascularização subdérmica predominante opção viável para cobertura extensa com mínima tensão. A dissecação foi realizada cuidadosamente, preservando os vasos subdérmicos e permitindo mobilidade suficiente para cobrir o defeito sem tensão excessiva (Figura 3).
O retalho foi posicionado sobre o leito cirúrgico e fixado em dois planos: subcutâneo com fio absorvível (vicryl 4-0) em padrão simples contínuo, e pele com fio monofilamentar não absorvível (NylonⓇ 4-0) em padrão sultan. Foi posicionado dreno tubular em porção inferior do retalho, removido após 72h sem complicações.(Figura 5).
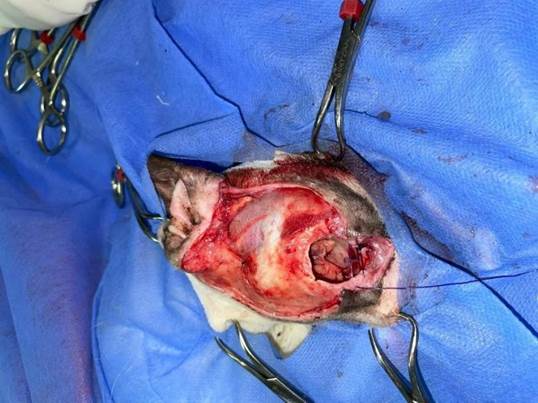
Figura 2. Realização de excisão de neoformação e exenteração. (Fonte acervo pessoal).
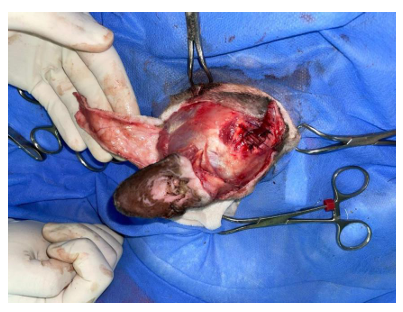
Figura 3. Obtenção de flap de padrão subdérmico (Fonte acervo pessoal)
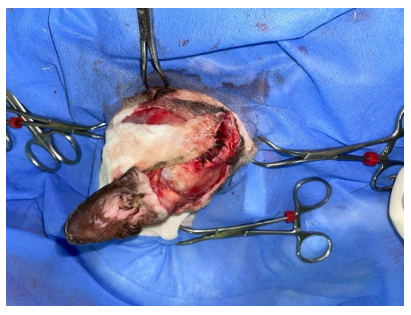
Figura 4. Realização de flap de padrão subdermico. (Fonte acervo pessoal)
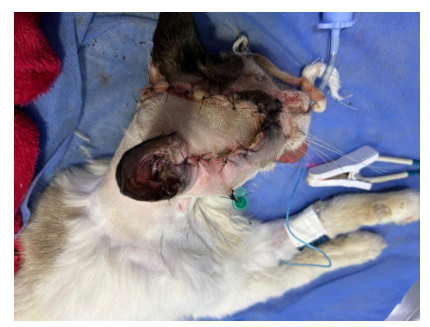
Figura 5. Aspecto final da exenteração, evidenciando a dermorrafia do animal Pipoca (Fonte acervo pessoal)
No pós-operatório imediato, foram administrados cefalotinaᵃ (30 mg/kg, intravenoso), dexametasonaᵇ (0,2 mg/kg, IV), dipironaᶜ (25 mg/kg, intravenoso) e metadonaᵈ (0,15 mg/kg, intravenoso) para analgesia e controle da inflamação. Foram prescritos: amoxicilina com clavulanatoᵉ (22 mg/kg, via oral, a cada 12 horas, durante 7 dias), tramadolᶠ (3 mg/kg, via oral, a cada 12 horas, durante 5 dias), dipironaᶜ (12,5 mg/kg, via oral, a cada 12 horas, durante 7 dias), prednisolonaᵍ (1 mg/kg, via oral, a cada 24 horas, durante 3 dias) e uso do colar elizabetanoʰ.
Após 21 dias, realizou-se a retirada dos pontos. O exame histopatológico revelou sarcoma de tecidos moles felino grau II, com índice mitótico moderado (18 mitoses por 0,237 mm²) e infiltração da musculatura palpebral. Observou-se necrose em menos de 50% da área tumoral, com infiltrado inflamatório mínimo. As margens cirúrgicas estavam comprometidas, indicando ressecção incompleta e alto risco de recidiva, reforçando a necessidade de terapias adjuvantes, como radioterapia.
Foi recomendada radioterapia adjuvante, porém não realizada devido a limitações financeiras. O prognóstico foi considerado reservado, com alto risco de recidiva local, e a paciente foi encaminhada para acompanhamento oncológico.
Discussão
Os sarcomas de tecidos moles (STMs) em felinos são neoplasias mesenquimais de comportamento localmente agressivo e elevada taxa de recidiva, especialmente após ressecções incompletas. Embora a taxa metastática seja baixa, a dificuldade em obter margens amplas na região da cabeça e órbita representa um desafio terapêutico importante⁹,¹¹.
A ressecção incompleta, observada neste caso, está associada a pior prognóstico. Estudos demonstram que a associação entre cirurgia e radioterapia oferece maior controle local e prolonga o tempo livre de doença em felinos com STMs¹,²,⁶. Entretanto, a radioterapia não pôde ser realizada neste paciente por limitações financeiras, o que pode comprometer o sucesso terapêutico a longo prazo.
Em defeitos extensos da região orbitária, a reconstrução é desafiadora. Retalhos de plexo subdérmico são amplamente descritos como uma opção eficaz, garantindo boa viabilidade tecidual e cicatrização satisfatória, com baixa taxa de complicações³,⁷,¹³. No presente caso, o uso desse retalho permitiu o fechamento adequado, sem intercorrências.
O grau histológico e o índice mitótico são parâmetros prognósticos relevantes. Tumores grau II com índice mitótico elevado, como observado neste caso, apresentam risco aumentado de recidiva e sobrevida reduzida⁴,⁵,⁸, reforçando a necessidade de terapias complementares.
A quimioterapia adjuvante pode ser considerada quando há margens comprometidas. A doxorrubicina é o agente mais estudado, promovendo aumento no tempo livre de doença, especialmente quando combinada à radioterapia¹,¹⁰,¹¹. A carboplatina também tem mostrado resultados promissores²,¹¹. Protocolos metronômicos com ciclofosfamida oral associada a anti-inflamatórios não esteroidais (AINEs) têm se mostrado úteis como terapia de manutenção, apresentando baixa toxicidade⁴,¹¹. Além disso, o uso de doxorrubicina em regime neoadjuvante já foi relatado, resultando em redução tumoral e intervalos livres de doença superiores a 250 dias, especialmente em tumores localizados em regiões de difícil acesso¹⁰.
Além disso, a utilização da doxorrubicina em regime neoadjuvante já foi relatada, resultando em redução tumoral e intervalos livres de doença superiores a 250 dias, sendo útil em tumores localizados em áreas de difícil acesso, como a órbita¹⁰.
O manejo ideal dos STMs felinos envolve abordagem multimodal, associando ressecção cirúrgica ampla, reconstrução adequada e, sempre que possível, terapias adjuvantes como radioterapia, quimioterapia e eletroquimioterapia⁵,⁹,⁷,¹¹,¹⁴. Estudos recentes indicam que a eletroquimioterapia, combinando agentes citotóxicos com pulsos elétricos locais, pode aumentar a eficácia do tratamento, promovendo maior controle locorregional em tumores de difícil ressecção.
O paciente apresentou boa recuperação no pós-operatório imediato, com analgesia eficaz e evolução clínica satisfatória nas primeiras semanas. Entretanto, o comprometimento das margens cirúrgicas indicou alto risco de recidiva, motivo pelo qual foi encaminhado ao serviço de oncologia veterinária para acompanhamento e avaliação de terapias adjuvantes. O seguimento oncológico frequente é essencial para a detecção precoce de recidivas e a adoção de terapias complementares, contribuindo para a manutenção da qualidade de vida do paciente.
Considerações finais
O caso relatado demonstra que, em regiões anatômicas de difícil acesso, como a órbita, o planejamento reconstrutivo com retalho de plexo subdérmico viabiliza a exenteração orbitária e o fechamento adequado da ferida, com boa evolução clínica. Entretanto, o comprometimento das margens cirúrgicas reforça a necessidade de terapias adjuvantes e de acompanhamento oncológico frequente, a fim de reduzir o risco de recidiva e preservar a qualidade de vida do paciente.
Referências bibliográficas
1. BAILEY, D. B. et al. Evaluation of radiotherapy alone or in combination with doxorubicin chemotherapy for the treatment of cats with incompletely excised soft tissue sarcomas: 71 cases (1989–1999). Journal of the American Veterinary Medical Association, v. 231, n. 5, p. 742–747, 2007. Disponível em: https://pubmed.ncbi.nlm.nih.gov/17764436/. Acesso em: 8 set. 2025.
2. BOSTON, S. E. et al. Preoperative radiotherapy for vaccine-associated sarcoma in 92 cats. Veterinary Radiology & Ultrasound, v. 43, n. 5, p. 473–479, 2002. Disponível em: https://pubmed.ncbi.nlm.nih.gov/12375783/. Acesso em: 8 set. 2025.
3. BRAVO, M. et al. Reconstrução de defeito cutâneo em região de cabeça em cão utilizando retalho de padrão subdérmico. Revista de Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP, v. 20, n. 3, p. 23–29, 2022. Disponível em: https://revistascrmvsp.gov.br/recmvz/article/view/6821. Acesso em: 8 set. 2025.
4. CHOW, E. et al. Metronomic therapy with cyclophosphamide and piroxicam effectively delays tumor recurrence in dogs with incompletely resected soft tissue sarcomas. Journal of Veterinary Internal Medicine, v. 23, n. 5, p. 1163–1171, 2009. Disponível em: https://pubmed.ncbi.nlm.nih.gov/18976288/. Acesso em: 8 set. 2025.
5. DOBROMYLSKYJ, M. Feline soft tissue sarcomas: a review of the classification and histological grading, with comparison to human and canine. Animals (Basel), v. 12, n. 20, p. 2736, 2022. DOI: 10.3390/ani12202736. Disponível em: https://pmc.ncbi.nlm.nih.gov/articles/PMC9597747/. Acesso em: 9 set. 2025.
6. GOLDSCHMIDT, M. H.; SHOFER, F. S. Skin Tumors of the Dog and Cat. 2. ed. Oxford: Elsevier Saunders, 2013.
7. HARTMANN, K. Feline injection-site sarcoma: ABCD guidelines on diagnosis and management. Journal of Feline Medicine and Surgery, v. 17, n. 7, p. 594–604, 2015. DOI:
10.1177/1098612X15588451. Disponível em: https://journals.sagepub.com/doi/full/10.1177/1098612X15588451. Acesso em: 9 set. 2025.
8. MONNET, E. (ed.). Small Animal Soft Tissue Surgery. 2. ed. Hoboken: Wiley-Blackwell, 2023.
9. RHOADES, J. W.; GOLDSCHMIDT, M. H. Soft tissue sarcomas in cats: an updated review. Journal of Feline Medicine and Surgery, v. 22, n. 8, p. 659–672, 2020. DOI: 10.1177/1098612X20942813.
10. RICHARDSON, R. C. Soft tissue sarcomas in cats. Veterinary Clinics of North America: Small Animal Practice, v. 27, n. 1, p. 77–93, 1997. DOI: https://doi.org/10.1016/S0195-5616(97)50007-7.
11. SPUGNINI, E. P. et al. Electrochemotherapy for the treatment of feline soft tissue sarcomas. Veterinary and Comparative Oncology, v. 18, n. 3, p. 370–378, 2020.
12. TORRIGIANI, F. et al. Neoadjuvant and adjuvant doxorubicin chemotherapy in a case of feline soft tissue sarcoma. Journal of Feline Medicine and Surgery Open Reports, v. 5, n. 2, 2019. DOI: 10.1177/2055116919857870. Disponível em: https://pubmed.ncbi.nlm.nih.gov/31308956/. Acesso em: 8 set. 2025.
13. VAIL, D. M.; THAMM, D. H.; LIPTAK, J. M. (ed.). Withrow & MacEwen’s Small Animal Clinical Oncology. 6. ed. St. Louis: Elsevier, 2019.
14. ZEROES, J.; LIPTAK, J. M.; MONNET, E. Surgical techniques for resection and reconstruction of facial tumors in small animals. In: MONNET, E. (ed.). Small Animal Soft Tissue Surgery. 2. ed.Hoboken: Wiley-B lackwell, 2023.
