THE RELATIONSHIP OF OVERWEIGHT TO FOOD CONSUMPTION AND SEROTONIN LEVELS
REGISTRO DOI: 10.5281/zenodo.8159323
Brenda Ludmilla Braga Vieira1
Fabricio Oliveira Pacheco2
Weliton dos Santos Lima3
Zandleme Birino de Oliveira4
Elianderson Emanoel Monteiro de Melo5
Lidiane Cruz Garcia6
Jhwllyane Ramos Moraes Almeida7
Érika Marcilla Sousa de Couto8
Thiago Eric do Monte Borges9
Yasmim Pâmela Feitosa Alencar10
RESUMO
A relação dos níveis de serotonina, como forte fator modulador, através do perfil alimentar de cada indivíduo, principalmente em indivíduos obesos. O objetivo deste trabalho foi avaliar a relação do excesso de peso com o consumo alimentar e os níveis de serotonina. Este trabalho teve como estudo o tipo descritivo, retrospectivo, realizado de setembro de 2017 a julho de 2018, com dados de 18 prontuários de pacientes do Centro de Referência em Obesidade, de ambos os sexos e com idades entre 24 a 60 anos. Foram aceitos, para este estudo, pacientes diagnosticados com sobrepeso e obesidade, segundo a OMS (1997), com dados de Recordatório de 24 horas (R24h) e o resultado do exame de serotonina realizado no período de julho a agosto de 2016, considerando os níveis de normalidade de 30 a 200 ng/dL. Para análise do Recordatório 24 horas, foi utilizado o Software DietSmart versão 8.5.1, onde foram obtidos os valores de energia, macronutrientes e aminoácidos neutros. Os resultados demonstraram que dos 18 prontuários: 8 (44,4%) foram de pacientes do sexo feminino e 10 (55,6%) do sexo masculino. Do total: 2 (11,1%) pacientes apresentaram sobrepeso, 4 (22,3%) obesidade grau I, 6 (33,3%) obesidade grau II e 6 (33,3%) obesidade grau III. A avaliação dos níveis de serotonina sanguíneo apresentaram resultados dentro da normalidade (30-200 ng/dL), no entanto, os níveis tendem a aumentar com o aumento do grau de obesidade dos pacientes: nos obesos grau I (76,33±26,48 ng/dL), grau II (105,78±47,16 ng/dL) e no grau III (118,68±63,47 ng/dL) e apresentou maior nível em pacientes com sobrepeso (183,93±12,06 ng/dL), levando em consideração que esse resultado é de apenas dois pacientes, portanto, um dado que deve ser melhor investigado. O consumo médio de proteína (128,3±62,7 g), lipídeo (83,6±60,5 g) e energia (2156,0±779,9 kcal) foi maior em pacientes com obesidade grau I e carboidrato (234,0±192,5 g) maior com obesidade grau II. O consumo médio de valina (2459,2±1622,3 mg), isoleucina (2386,4±1722,6 mg), fenilalanina (1967,7±1456,2 mg), leucina (3614,1±2496,2 mg) e triptofano (647,4±284,6 mg) apresentaram maiores em pacientes com obesidade grau I e tirosina (764,4±0 mg) com obesidade grau III. Como conclusão observou-se que os níveis de serotonina aumentam conforme aumenta os graus de obesidade e que o consumo médio de macronutrientes (proteína e lipídeo), energia e aminoácidos neutros se apresentaram maiores em pacientes com obesidade grau I. Ao analisar os níveis de serotonina com obesidade grau I, observou-se que estes participantes se encontram como o mais baixo nível de serotonina, justificando que após refeições ricas em proteína e baixas em carboidratos estes aminoácidos competem com o triptofano para cruzar a barreira hematoencefálica e devido a isso, menor disponibilidade de triptofano, assim, diminuição da produção de serotonina. Logo, podemos constatar que a dieta possui relação com os níveis de serotonina sérica destes participantes.
Palavras-chave: Serotonina, Obesidade, Ingestão alimentar, Aminoácidos.
ABSTRACT
To evaluate the relationship of overweight with food consumption and serotonin levels. A descriptive, retrospective study was carried out from September 2017 to July 2018, with data from 18 patient records of the Centro de Referencia em Obesidade, of both sexes and age between 24 and 60 years. Patients diagnosed as overweight (BMI 25.0 – 29.9 kg / m²) and obesity (BMI> 30 kg / m²), according to the WHO (1997), with 24- hour recall data, were accepted for this study. R24h) and the serotonin test results from July to August 2016, considering normal levels of 30 to 200 ng / dL. For analysis of the 24-hour Reminder, DietSmart Software version 8.5.1 was use, where the values of energy, macronutrients and neutral amino acids were obtain. Results: Of the 18 charts: 8 (44.4%) were female and 10 (55.6%) were male. Of the total, 2 (11.1%) patients were overweight, 4 (22.3%) were grade I, 6 (33.3%) were obese and 6 (33.3%) were obese. Blood levels of serotonin levels showed normal results (30-200 ng / dL); however, levels has tended to increase with increasing levels of obesity: in grade I obese patients (76.33 ± 26 , 48), grade II (105.78 ± 47.16) and grade III (118.68 ± 63.47) and presented a higher level in overweight patients (183.93 ± 12.06), taking into account that this result is only two patients, therefore, a data that should be better investigated. The mean intake of protein (128.3 ± 62.7), lipid (83.6 ± 60.5) and energy (2156.0 ± 779.9) was higher in patients with grade I and carbohydrate obesity (234.0 ± 192.5) higher with grade II obesity. The mean intake of valine (2459.2 ± 1622.3), isoleucine (2386.4 ± 1722.6), phenylalanine (1967.7 ± 1456.2), leucine (3614.1 ± 2496.2) and tryptophan ( 647.4 ± 284.6) presented higher in patients with grade I obesity and tyrosine (764.4 ± 0) with degree III obesity. Conclusion: Serotonin levels has increased as obesity levels increased and mean intake of macronutrients (protein and lipid), energy and amino acids (valine, isoleucine, phenylalanine, leucine and tryptophan) were higher in obese patients grade I, it was observed that these participants are the lowest level of serotonin, justifying that after meals rich in protein and low in carbohydrate these amino acids compete with tryptophan to cross the hematoencephalic barrier and due to this, lower availability of tryptophan, thus, decreased serotonin production. Therefore, we can verify that the diet is related to the serum serotonin levels of these participants.
Keywords: Serotonin, Obesity, Food intake, Amino acids.
INTRODUÇÃO
O excesso de peso, sobrepeso e a obesidade, tendem aumentar significativamente ao longo dos anos na atual realidade populacional, estima-se em torno de 2,2 bilhões de pessoas (30% da população mundial) estão com excesso de peso, destes, 700 milhões são obesos e 1,5 milhões estão com sobrepeso (1).
De modo geral em nível fisiopatológico, o excesso de tecido adiposo na obesidade gera um ciclo vicioso, onde, o excesso alimentar desenvolve hipertrofia dos adipócitos e aumenta a invasão de macrófagos e assim a inflamação, que produz acentuado número de citocinas pró-inflamatórias (TNF-alfa e IL – 6) que induzem a lipólise, resultando num quadro de resistência à insulina, onde libera ácidos graxos livres alterando a secreção de substâncias benéficas como da leptina, adiponectina e proteína ligadora de retinol (RBP4) no hipotálamo. Essas substâncias podem atuar de forma parácrina ou autócrina, acentuando a inflamação do tecido adiposo e facilitando o ganho de peso (3).
A via homeostática controla o balanço de energia, aumentando a motivação para comer, após o esgotamento dos estoques de energia. Em contraste, a regulação hedônica ou baseada em recompensas pode anular a via homeostática durante os períodos de relativa abundância de energia, aumentando o desejo de consumir alimentos altamente palatáveis (6).
O sistema de recompensa cerebral também exerce importante função na ingestão alimentar. Os alimentos de elevada palatabilidade por apresentarem grandes quantidades de carboidratos simples e gorduras saturadas modulam a expressão de sinais metabólicos de fome e de saciedade, a fim de estender o período da ingestão. Por outro lado, ativam o sistema de recompensa cerebral, logo maximizam a motivação na busca e obtenção de alimentos (7).
Há mecanismos centrais e periféricos que regulam o balanço energético, estes balanços são complexos e envolvem a energia consumida e gasta. Estes processos ocorrem no núcleo arqueado do hipotálamo em que possui duas populações de neurônios que apresentam fundamental importância no controle do balanço energético que são os neurotransmissores orexígenos (estimulantes do apetite), neuropeptídeo Y (NPY) e peptídeo relacionado ao gene agouti (AgRP), enquanto outra população de neurônios expressa os seguintes neurotransmissores anorexígenos: transcrito regulado por cocaína e anfetamina (CART) e pró-opiomelanocortina (POMC). Ambos invadem o núcleo paraventricular e mandam sinais para outras áreas do cérebro (8).
Destes neurotransmissores, vem discutindo a relação dos níveis de serotonina, como forte fator modulador, através do perfil alimentar de cada indivíduo. A serotonina ou 5-hidroxitriptamina (5HT), produzida a partir da ingestão de triptofano, é dividida em serotonina cerebral e periférica onde em torno de 95% é produzida na região periférica e 5% a nível cerebral. A maior parte da serotonina no organismo é produzida pela enzima triptofano- hidroxilase (9,10).
A mesma tem relação com a fome, apetite, saciedade, gordura corporal, ingestão alimentar e pode desenvolver problemas de excesso de peso chegando ao quadro de obesidade por meio da desregulação dos receptores serotoninérgicos ou diminuição da 5HT a nível cerebral (10,11, 12,13,14).
Estudos mostram que receptores de serotonina específicos atuam no aumento da serotonina cerebral inibindo a ingestão de alimentos, enquanto o esgotamento da serotonina cerebral promove hiperfagia e ganho de peso (15). Os receptores serotoninérgicos como o 5HT2a (receptor 2a da 5 – hidroxitriptamina ou serotonina) cerebral estão fortemente relacionados com o ato de comer e com Índice de Massa Corporal (IMC) (16).
Evidências científicas relatam que a regulação de macronutrientes pelo consumo alimentar são alterados segundo as dosagens de serotonina. O aumento de neurotransmissores pode levar a inibição da ingestão de carboidratos em maior número comparado a proteínas e lipídeos favorecendo o gasto energético (17,18).
A quantidade de proteína, que se ingere na dieta, que resulta em aminoácidos de triptofano controla os níveis de serotonina séricos. Caso haja redução de triptofano dietético há indicações de redução de 5HT recorrente da baixa ingesta de proteína, entretanto, observou-se redução de triptofano e de serotonina no encéfalo por diversas horas, após refeições ricas em proteínas (19).
Wurtman e colaboradores (11) estudaram outros aminoácidos neutros como a tirosina, fenilalanina, leucina, isoleucina e valina e observaram que estes aminoácidos competem com o triptofano para atravessar a barreira hematoencefálica, logo reduzindo a biodisponibilidade de triptofano (20,21).
Assim sendo, é necessário entender a relação dos aminoácidos no organismo, buscando relacionar com os dados de consumo alimentar da pesquisa a fim de entender como a competição entre estes aminoácidos neutros para cruzar a barreira hematoencefálica influencia na disponibilidade de 5HT na corrente sanguínea. Baseado no exposto, tendo em foco gerar estudos que busquem compreender a relação consumo alimentar e os níveis de serotonina em pacientes com excesso de peso, este trabalho investiga a hipótese de Wurtmam sob nova abordagem e tem como objetivo avaliar o excesso de peso e a influência do consumo alimentar nos níveis de serotonina de pacientes atendidos no Centro de Referência em Obesidade do Hospital Universitário Bettina Ferro de Sousa.
METODOLOGIA
Tipo de estudo
Estudo do tipo retrospectivo, de natureza descritiva, quantitativo realizado no período de outubro de 2017 a julho de 2018, com análise de prontuário de pacientes acompanhados no Centro de Referência em Obesidade do Hospital Universitário Betttina Ferro.
Amostra
Foram estudados 18 prontuários datados de julho a agosto de 2016, de pacientes com idades entre 24 a 60 anos, de ambos os sexos. Este estudo coletou variáveis de avaliação nutricional: Índice de Massa Corporal (IMC), porcentagem de gordura (PG), gordura corporal (GC), Relação Cintura-Quadril (RCQ) e de consumo alimentar de macronutrientes (proteína, carboidrato e lipídio), aminoácidos neutros (triptofano, tirosina, fenilalanina, leucina, valina, isoleucina) e energia relacionados aos exames dos níveis de serotonina sérica (10,12,21; 22; 23,24).
Critérios de Inclusão e Exclusão
Foram incluídos na pesquisa, prontuários de pacientes do ambulatório do Centro de Referência em Obesidade, diagnosticados com sobrepeso (IMC 25,0 – 29,9 kg/m²) e obesidade (IMC≥30 kg/m²), segundo a OMS (1997), através de exame de Bioimpedância elétrica (BIA) e que haviam realizado o exame de coleta de serotonina nos períodos de julho a agosto de 2016 seguindo todas as recomendações do laboratório conveniado. Além disso, os prontuários deveriam conter informações de consumo alimentar por uso de Recordatório 24 horas (R24h), entre os meses de julho a agosto do ano de 2016. Foram excluídos, todo os prontuários de pacientes que não continham todos os dados importantes para os objetivos deste estudo, como prontuários sem R24h dos retornos das consultas, do período da pesquisa, ou que estivessem com prontuários incompletos em relação aos dados mencionados acima.
Avaliação do estado nutricional
Para avaliar o estado nutricional foram estudadas variáveis de massa de gordura e percentual de gordura corporal (MG/PGC), Índice de Massa Corporal (IMC) e a Relação Cintura-Quadril (RCQ), obtidas por exame de Bioimpedância elétrica (BIA) InBody 230 e o Estadiômetro Compacta Seca, todos usados segundo as recomendações para avaliação antropométrica (25).
A BIA é mensurada através da diferenciação da condução da corrente elétrica nos tecidos expostos a frequências de correntes segundo o manual. Para mensurar a Massa de Gordura (MG) utiliza-se o parâmetro de 15% do peso ideal para homens e 23% do peso ideal para mulheres com a faixa da normalidade variando entre 80% e 160% da massa de gordura ideal.
Os parâmetros de normalidade para avaliação da RCQ foram de <0,90 cm para homens e de <0,85 cm para mulheres. Para diagnosticar excesso de peso, utilizou-se o IMC, segundo a classificação da Organização Mundial Saúde (1997), com categorização de 25 – 29,9 kg/m² para sobrepeso, de 30 – 34,9 kg/m² com obesidade grau I, 35 – 39,9 kg/m² com obesidade grau II e acima de 40 kg/m² com obesidade grau III.
Consumo Alimentar
A avaliação do consumo alimentar foi realizada a partir de informações obtidas por um formulário de Recordatório de 24horas (R24h) realizado nos retornos do mês de julho e agosto de 2016, no mesmo período que foi realizado a coleta de sangue para o exame de serotonina. Devido ao serviço hospitalar realizar apenas um recordatório foi avaliado o consumo alimentar com o que pode ser obtido.
O R24h é um método utilizado para avaliar quantitativamente a ingestão das refeições ao dia. É um método de rápida aplicação e pouco altera a ingestão alimentar em relação a outros inquéritos alimentares (27). O modelo de R24h aplicado na entrevista com os pacientes foi dividido em: Refeição/hora, alimento, medida caseira, quantidade (g) e ingesta hídrica (ml) (Referência).
Os valores de energia, macronutrientes (proteína, carboidrato e lipídeo) e aminoácidos neutros (valina, leucina, isoleucina, tirosina, fenilalanina e triptofano) foram calculados com o Software Dietsmart versão 8.5.1 e mensurados os valores da dieta consumida pelos pacientes com todas as tabelas de composição de alimentos contidos no programa (26).
Serotonina Sérica
Os participantes foram encaminhados para um laboratório conveniado ao Centro de Referência em Obesidade onde receberam orientações de preparo para o exame do próprio laboratório, tais como: necessidade de jejum de 8 horas e ficar 24 horas sem ingerir alimentos específicos, como: abacate, ameixa, banana, berinjela, chocolate, frutos secos, mexilhões, nozes, picles conservas de vegetais em vinagres e tomate. Era necessário que os participantes informassem se faziam uso de alguns medicamentos, nos últimos 7 dias até a data da coleta. Caso não fossem atendidas estas orientações, os resultados dos níveis de triptofano poderiam alterar e, consequentemente, de 5HT no sangue. Não foram relatados nos prontuários pacientes que não tenham seguido as orientações. Os valores de normalidade utilizados pelo laboratório e utilizados para esta pesquisa foram de 30 – 200 ng/dL para ambos os sexos.
Comitê de Ética
O estudo foi aprovado pelo Comitê de Ética em Pesquisa do Instituto de Ciências da Saúde da Universidade Federal do Pará, sob o parecer nº 825.074/2014 conforme resolução nº 466/2012. Todos os voluntários assinaram o Termo de Consentimento Livre e Esclarecido.
Análise estatística
Foi realizada estatística descritiva, de dados quantitativos, para avaliar os níveis de serotonina a partir do IMC, a média de consumo de macronutrientes e energia e a média da ingestão de aminoácidos neutros. O estudo foi tabulado e analisado com o programa Microsoft Office Excel 2016.
RESULTADOS
Este estudo contou com o total de 18 prontuários de pacientes, com idade entre 24 a 60 anos, onde 8 (44,4%) foram do sexo feminino e 10 (55,6%) do sexo masculino. Os resultados de IMC foram categorizados de sobrepeso e em graus de obesidade, segundo OMS (1997), com resultados de 2 (11,1%) pacientes com sobrepeso, 4 (22,3%) com obesidade grau I, 6 (33,3%) com obesidade grau II e 6 (33,3%) com obesidade grau III.
Quanto à avaliação dos níveis de serotonina sanguíneo, todos os resultados de exames mostraram que os pacientes apresentaram níveis de serotonina dentro dos níveis de normalidade (30 – 200 ng/dL), considerados pelo laboratório responsável.
Para avaliação do estado nutricional, as medidas antropométricas de RCQ, GC e %GC se relacionam conforme o aumento do IMC em todos os pacientes, mostrando aumento em suas médias. No entanto, pacientes do sexo feminino com obesidade grau I apresentaram maior média de %CG em relação aos outros graus de obesidade, desconfigurando o padrão de relação direta com IMC (Tabela 1).
Quando avaliados os níveis de serotonina com IMC dos pacientes (Tabela 2), os resultados mostraram que nos pacientes com obesidade (I, II e II) os níveis de serotonina também mostraram aumento direto com o aumento da obesidade: grau I (76.33±26.48 ng/dL), grau II (105.78±47.16 ng/dL) e grau III (118.68±63.47 ng/dL), ainda que todos apresentassem níveis dentro dos padrões de normalidade, considerados pelo laboratório responsável. Nos pacientes com sobrepeso, os níveis de serotonina se mostraram com médias maiores e comparadas aos pacientes de obesidade grau III, não mostrando o padrão de relação anterior com os demais níveis de obesidade (183.93±12.06), no entanto, temos que destacar, que estes resultados se relacionam apenas a dois pacientes, dado que necessita ser melhor investigado e discutido.
A Tabela 3, apresenta os resultados em média e desvio padrão do consumo alimentar de macronutrientes (proteína, carboidrato, lipídeo) e energia de acordo com o excesso de peso dos pacientes (sobrepeso e obesidade I, II e III). As análises mostraram que houve um maior consumo de proteína (128,3±62,7 g), lipídeo (83,6±60,5 g) e energia (2156,0±779,9 kcal) em pacientes com obesidade grau I, enquanto obesos de grau II consumiram mais carboidratos (234,0±192,5 g). Vale destacar que pacientes com obesidade de grau III, neste estudo, mostraram a menor média de consumo de energia (1274,5±761,9 g), em comparação com as demais categorias de excesso de peso.
A Tabela 4, descreve os resultados de consumo médio de aminoácidos essenciais comparados entre pacientes com excesso de peso. O consumo médio dos aminoácidos valina (2459,2±1622,3 mg), isoleucina (2386,4±1722,6 mg), fenilalanina (1967,7±1456,2 mg), leucina (3614,1±2496,2 mg) e triptofano (647,4±284,6 mg) foram sempre maiores entre os pacientes com obesidade grau I, a única exceção foi na média de consumo do aminoácido tirosina (764,4± – mg) em que o consumo maior foi entre os pacientes com grau III de obesidade. Interessante notar que quando avaliado o menor nível de consumo, entre todos os aminoácidos, os menores níveis de consumo se encontram entre os pacientes com sobrepeso, sem exceção.
Tabela 1 – Comparação das variáveis antropométricas (RCQ, GC e %G) nos grupos de pacientes com excesso de peso divididos por sexo representado em médias e desvio-padrão.
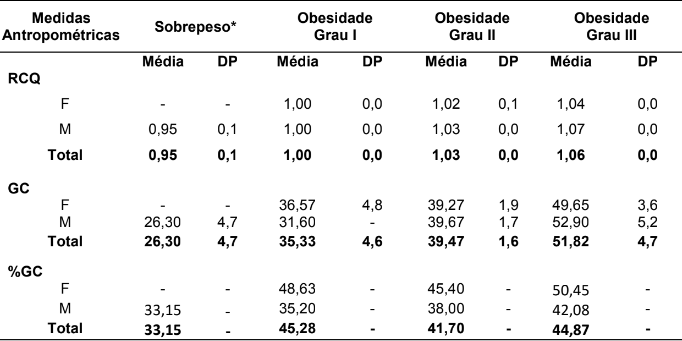
Fonte: Protocolos de pacientes acompanhados no HUBFS no período de julho a agosto de 2016. F: Sexo feminino; M: Sexo masculino. *Não há pacientes do sexo feminino com sobrepeso nessa amostra.
Tabela 2 – Resultados dos níveis de Serotonina sérica entre os pacientes com excesso de peso representado em médias e desvio-padrão.
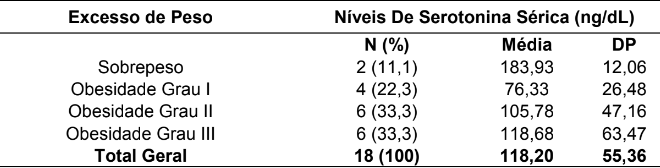
Fonte: Protocolos de pacientes acompanhados no HUBFS no período de julho a agosto de 2016.
Tabela 3 – Resultados do consumo de macronutrientes (proteína, carboidratos, lipídeos) e energia em relação ao excesso de peso descrito em média e desvio-padrão.
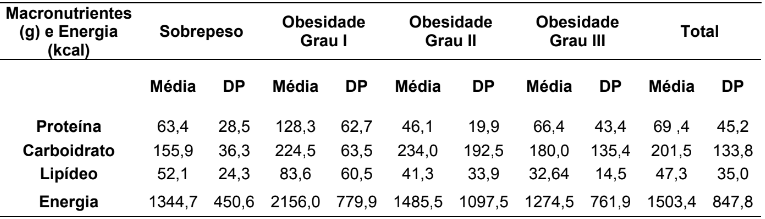
Fonte: Protocolos de pacientes acompanhados no HUBFS no período de julho a agosto de 2016.
Tabela 4 – Resultados dos níveis de consumo de Aminoácidos neutros entre os pacientes com excesso de peso (Sobrepeso e Obesidade grau I, II e III), descritos em média e desvio-padrão.
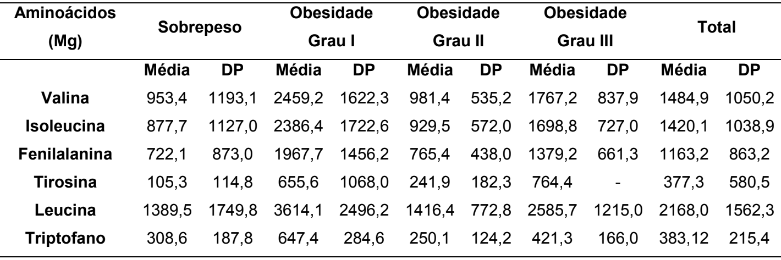
Fonte: Protocolos de pacientes acompanhados no HUBFS no período de julho a agosto de 2016.
DISCUSSÃO
Em estudos realizados com obesos, assim como neste estudo, onde se avaliaram parâmetros antropométricos para mensurar a relação da obesidade com a serotonina, tais como a circunferência da cintura (CC), Relação Cintura-Quadril (RCQ), gordura corporal e porcentagem de gordura corporal (%GC), e principalmente o IMC (Índice de Massa Corporal). E ainda, o consumo alimentar de macronutrientes, aminoácidos neutros e energia apresentam relações significativas que exercem influência sobre a produção de serotonina.
O aumento de %GC nas mulheres em relação aos homens é relatado de diversas maneiras, dentre eles questões estruturais e hormonais são os principais fatores associados. Nesse estudo foi observado que um aumento seguiu na obesidade grau 1 em mulheres, este aumento foi maior em relação às médias de mulheres grau 3, podemos inferir segundo estudos que a transição de um estado de sobrepeso para o primeiro estágio de obesidade gera, principalmente em mulheres, uma desordem metabólica na tentativa do corpo responder aos vários mecanismos de recompensa devido a situação obesogênica pré-estabelecida, o que pode desenvolver, dentre vários fatores, doenças coronarianas (44).
Pode ser observado que segundo o IMC (Tabela 2), os resultados mostraram que nos pacientes com obesidade (I, II e II) os níveis de serotonina aumentam conforme o grau de obesidade cresce.
No estudo de Zhao e colaboradores (24), analisaram a região de genes transportadores de serotonina em níveis sanguíneos, mais precisamente, na região periférica e obesidade. Para isso, foram utilizadas medidas antropométricas como o IMC, peso corporal, CC e RCQ, e os resultados foram semelhantes ao observado nesse estudo, em que o nível médio da metilação de genes transportadores de serotonina, a nível sanguíneo, foi positivamente correlacionado ao IMC (r = 0,29; P = 0,0002), peso corporal (r = 0,31; P <0,0001) e CC (r = 0,20; P = 0,009), mas não com RCQ. Claramente, ao se avaliar genes é diferente de avaliar níveis sanguíneos, entretanto os genes transportadores são os precursores para a produção de serotonina, visto ainda, conforme varia o tipo de estudo, a metodologia aplicada entre outros fatores, na literatura há maiores indícios que comprovam os níveis de serotonina correlacionam com a obesidade.
Nos últimos 30 anos, vários estudos vêm demonstrando que a serotonina está também envolvida no controle da ingestão de alimento (29) com altos níveis de serotonina diminuindo a ingestão energética total, ou diminuindo a seleção de carboidratos em relação à proteína, e consequentemente interfere no metabolismo de ganho de peso (6).
Mesmo assim, essa relação das anomalias envolvidas na serotonina no organismo, na regulação alimentar e na obesidade não está bem definida. Há estudos que divergem em relação a fatores relacionados à produção e transporte de 5HT no quadro da obesidade. Entretanto, há achados tanto em humanos como em animais, baseado em evidências de que a produção de serotonina do cérebro pode ser modulada dieteticamente através da oferta de macronutrientes, destacando-se principalmente a ingestão de carboidratos, de proteínas e de aminoácidos isolados, especificamente o triptofano (30, 10,31).
Neste estudo foi observado que o maior consumo de proteína, lipídeo e energia esteve presente em pacientes obesos grau I (tabela 3). Analisando os níveis de serotonina (tabela 2) estes estão com os mais baixos níveis. Este fato pode estar relacionado ao consumo de dietas com teor protéico elevado e baixo consumo de carboidrato, segundo estudo realizado por Schweiger e colaboradores (32).
Isso seria devido a competição entre aminoácidos neutros obtidos da dieta para a produção dos seus produtos. A baixa afinidade entre a enzima de síntese do triptofano (triptofano hidroxilase) seria um dos limitantes para disponibilidade de serotonina devido a baixos níveis de triptofano no encéfalo (20).
Outros estudos como de Carr e colaboradores (33) destacam que polimorfismos nos receptores de 5HT como 5HT2a e 5HT2c estão correlacionados com a influência da ingestão de energia e obesidade (27). Essa pesquisa mostrou que vários fenótipos comportamentais, incluindo restrição dietética e desinibição (28) e impulsividade (29, 30) influenciam a modelação do reforço de alimentos (motivação para comer) no Índice de Massa Corporal (IMC) e/ou na ingestão de energia.
Quanto aos aminoácidos, estes necessitam ser melhor analisados e estudados, levando em consideração que estão envolvidos em vários processos fisiológicos e cerebrais do organismo. Sabe-se que a serotonina desenvolve importante papel na regulação da saciedade e da fome (34).
Em um estudo de Choi e colaboradores (2009) (35), os dados obtidos afirmaram que as concentrações de triptofano e a síntese de serotonina nos neurônios cerebrais são notavelmente sensíveis a qual proteína está presente em uma refeição. Para isso, analisaram 5 tipos de proteínas diferentes em que foram analisadas amostras de sangue do córtex cerebral para triptofano e aminoácidos neutros. Um grande aumento no triptofano do córtex ocorreu após o consumo de lactalbumina e aumentos menores após a proteína de soja ou carboidrato (sem proteína) nas regiões cerebrais examinadas, ocorreu uma variação de 4-8 vezes maior da síntese de serotonina.
Um dos fatores para o triptofano apresenta-se baixo, como já discutido, pode ser devido à baixa afinidade enzimática para ser catalisado torna pouco eficiente o seu transporte devido os outros aminoácidos serem encontrados na dieta em boas quantidades quando estas estão ricas em proteína acabam suprimindo a entrada do triptofano para atravessar a barreira hematoencefálica (35).
Os carboidratos complexos podem reverter essa situação. Com a liberação de insulina pelo pâncreas em detrimento a ingesta de carboidrato diminui os níveis desses aminoácidos com exceção do triptofano (32).
A serotonina, a adrenalina, noradrenalina e a dopamina, por exemplo, são neurotransmissores que possuem grupos funcionais que modulam importantes vias do metabolismo, estas são produzidas a partir de processos de metilação de descarboxilação de aminoácidos como fenilalanina, tirosina e o triptofano (35).
Segundo “Technical Report” (2007), indivíduos adultos e saudáveis possuem necessidade média de proteínas totais de 0,66 g/kg peso corporal/dia. Assim, a necessidade média de aminoácidos essenciais seria de 0,48 g/kg peso corporal/dia (37). Logo, a quantidade de proteínas, aminoácidos constituintes, ou ambos, deve ser obtida a partir da dieta, para atender a demanda metabólica e, com isso, manter o equilíbrio nitrogenado. No geral, a necessidade acaba sendo maior que a demanda metabólica devido a fatores que exercem influência sobre a proteína, como a digestão, absorção e a biodisponibilidade celular dos aminoácidos absorvidos relacionado a necessidade, e como consequência de perda de compostos nitrogenados nas fezes diárias (24, 33).
No sobrepeso apresentam os maiores níveis de serotonina e os demais aminoácidos apresentam baixa representatividade também em relação ao triptofano. Este estudo corrobora com a achados de Wutman et al (1986), constatando assim, que a maior biodisponibilidade dos demais aminoácidos que não são precursores de serotonina influenciam no triptofano para atravessar a barreira hematoencefálica, e com isso, menor produção do neurotransmissor de serotonina.
Vale destacar que a FAO relata não haver níveis ótimos de ingestão de proteínas e aminoácidos que estabeleçam danos à saúde ou de diminuição do risco de desenvolvimento de doenças crônicas (28,37).
CONCLUSÃO
Foi observado que os níveis de serotonina aumentam conforme aumentam os graus de obesidade, apesar da exceção neste estudo para pacientes com sobrepeso. O consumo médio de macronutrientes (proteína e lipídeo), energia e aminoácidos essenciais (valina, isoleucina, fenilalanina, leucina e triptofano) apresentavam maior representatividade em pacientes com obesidade grau I. Ao analisar os níveis de serotonina da obesidade grau I, observa-se que estes participantes se encontravam como o mais baixo nível de serotonina, achados indicam que estes aminoácidos competem com o triptofano para cruzar a barreira hematoencefálica e devido a isso, menor disponibilidade de triptofano, assim, diminuição da produção de serotonina. Logo, podemos constatar que a dieta tem relação com os níveis de serotonina sérica destes participantes.
REFERÊNCIAS
1.The GBD 2015 Obesity Collaborators. Health effects of overweight and obesity in 195 countries over 25 years. N Engl J Med. 2017, 377(1):13–27.
2.Ribeiro G, Santos O. Recompensa alimentar: mecanismos envolvidos e implicações para a obesidade. Revista Portuguesa de Endocrinologia, Diabetes e Metabolismo. 2013, 8(2): 82-88.
3.Cozzolino, Cominetti. Bases bioquímicas e fisiológicas da nutrição 1ª Ed. 2013.
4.Lutter M., Nestler E.J. Homeostatic and Hedonic Signals Interact in the Regulation of Food Intake. The Journal of Nutrition. 2009, 39(3): 629–632.
5.Landeiro F.M., Quarantini L.C. Obesidade: Controle Neural e Hormonal do Comportamento Alimentar. R. Ci. med. biol., Salvador. 2011,10(3):236-245.
6.Egecioglu, E., Skibicka, K.P., Hansson, C. et al. Hedonic and incentive signals for body weight control. Rev Endocr Metab Disord . 2011, 12(141).
7.Batista S.M.M.; Assis M.A.A; Teixeira E.; Damiana E. Avaliação da resposta glicêmica, saciedade e palatabilidade após o consumo de dietas de alto e baixo índice glicêmico. Alim. Nutr., 2007, 18(3):315-323.
8.Ribeiro Mrf, Moises Rs. Obesidade. Moreira Jr. Editora, 2006.
9.Blundell JE. Serotonin and the biology of feeding. Am J Clin Nutr. 1992 Jan; 55 (1): 155-159.
10.WutmanRJ, Wutman JJ. Carbohydrates and depression. Sci Am. 1989 Jan;260(1):68-75.
11.Leibowitz Sf, Alexander Jt. Hypothalamic serotonin in control of eating behavior, meal size, and body weight. Biol Psychiatry. 1998; 44(9):851-64.
12.Blundell JE , Lawton CL , Halford JC. Serotonina, comportamento alimentar e ingestão de gordura. Obes Res. 1995 Nov; 3 (4): 471S-476.
13.Nefti W, Chaumontet C, Fromentin G, Tomé D, Darcel N.A high-fat diet attenuates the central response to within-meal satiation signals and modifies the receptor expression of vagal afferents in mice.Am J Physiol Regul Integr Comp Physiol. 2009 Jun;296(6).
14.Lam D D, Garfield A S, Marston O J., Shaw J, Heisler L K., Brain serotonin system in the coordination of food intake and body weight. Pharmacology Biochemistry and Behavior. Novembro 2010; 97(1):84-91.
15.Erritzoe D , Frokjaer VG , Haugbo S , Marner L , Svarer C , Holst K , Baaré WF , Rasmussen PM , Madsen J , Paulson OB , Knudsen GM . Brain serotonin 2A receptor binding: relations to body mass index, tobacco and alcohol use. Neuroimage. 2009 May 15;46(1):23-30.
16.Leibowitz Sf, Alexander Jt. Hypothalamic serotonin in control of eating behavior, meal size, and body weight. Biol Psychiatry. 1998; 44(9):851-64.
17.Spadaro P A, Helen L. Naug, Eugene F. Du Toit, Daniel Donner, Natalie J. Colson. A refined high carbohydrate diet is associated with changes in the serotonin pathway and visceral obesity. Genet. Res., Camb. 2015, 97(23) 1-6.
18.Bear M. F, Connors BW, Paradiso M A. Neurociências: desvendando o Sistema nervoso. 2ed. Porto Alegre: Artmed, 2002.
19.Pardridge WM, Choi TB. Neutral amino acid transport at the human blood brain barrier. Federation Proc 1986;45:2073-8.
20.Van Der Mast RC, Fekkes D. Serotonin and amino acids: partners in delirium pathophysiology?, Semin Clin Neuropsychiatry. 2000 Apr;5(2):125-31.
21.Hodge S, Bunting B, P, Carr E, Strain J, J, Stewart-Knox B, J, Obesity, Whole Blood Serotonin and Sex Differences in Healthy Volunteers. Obes Facts 2012;5:399-407.
22.Chih-Hsing, Chang C-S, Yang YK, Shen L-H, Yao W-J. Comparison of brain serotonin transporter using [I-123]-ADAM between obese and non-obese young adults without an eating disorder. Alemany M, ed. PLoS ONE. 2017;12(2):170886.
23.Zhao J, Goldberg J, Vaccarino V. Promoter methylation of serotonin transporter gene is associated with obesity measures: a monozygotic twin study. International Journal of Obesity (2005). 2013;37(1):140-145.
24.Cervi A, Franceschini S C C; Prior S E. Critical analysis of the use of the body mass index for the elderly. Rev. Nutr.2005,18(6)
25.Fernandes M. Tabela de medidas caseiras e índices dos alimentos. Trabalho de Conclusão de Curso, Ijuí, 2016.
26.Fisberg R M, Marchioni D M L, Colocci A C A. Avaliação do consumo alimentar e da ingestão de nutrientes na prática clínica. Arq Bras Endocrinol Metab. 2009, 53(5).
27.[FAO/WHO/UNU] Food And Agriculture Organization Of The United Nations. World Health Organization. United Nations University. Protein and Amino Acid Requirements in Human Nutrition. WHO Technical Report Series 935, 2007.
28.Breisch ST, Zemlan FP, Hoebel BG. Hyperphagia and obesity following serotonin depletion by intraventricular p-chlorophenylalanine. Science. 1976, 23;192(4237):382-5.
29.Cunliffe, A.; Obeid, O.A; Powell Tuck, J. Post-prandial changes in measures of fatigue: effect of a mixed or a pur e carbohydrate or pure fat meal. Eur. J. Clin. Nutr. 1997, 1:831-838.
30.Lyons, P.M.; Truswell, A.S. Serotonin precursor influenced by type of carbohydrate meal in healthy adults. Am. J. Clin. Nutr. 1988, 47:433-439.
31.Schweiger U, Warnhoff M, Pahl J, Pirke KM. Metabolism.Effects of carbohydrate and protein meals on plasma large neutral amino acids, glucose, and insulin plasma levels of anorectic patients. 1986;35(10):938-43.
32.Carr K, Henry Lin, and Kelly D. Fletcher, Lara Sucheston and Prashant K. Singh, Robbert J. Salis, Richard W. Erbe, Myles S. Faith, David B. Allison, Eric Stice, Leonard H. Epstein. Two functional serotonin polymorphisms moderate the effect of food reinforcement on BMI. Behavioral Neuroscience. American Psychological Association. 2013, 127(3) 387–399.
33.Feijó F.M., Bertoluci M.C, Reis C. Serotonina e controle hipotalâmico da fome: uma revisão. Rev Assoc Med Bras 2011; 57(1):74-77.
34.Choi S, Disilvio B, Fernstrom MH, Fernstrom JD. Meal ingestion, amino acids and brain neurotransmitters: effects of dietary protein source on serotonin and catecholamine synthesis rates. Physiol Behav. 2009, 4;98(1-2):156-62.
35.Marchini JS, Vannucchi H, Marques V, Suen M, Cunha SFC. Aminoácidos. Brasil International Life Sciences Institute do Brasil, 2016.
36.[FAO] Food And Agriculture Organization Of The United Nations. Dietary protein quality evaluation in human nutrition. FAO Food and Nutrition paper 92.Report of an FAO Expert Consultation. Rome, 2013.
37.Associação Brasileira para o Estudo da Obesidade e da Síndrome Metabólica (BR). Diretrizes Brasileiras de Obesidade 2016. São Paulo: ABESO; 2016.
38.Hinderberger P., Rullmann M., Drabe M., Luthardt J., Becker G.A., Blüher M., Regenthal R., Sabri O., Hesse S. The effect of serum BDNF levels on central serotonin transporter availability in obese versus non-obese adults: A [11C] DASB positron emission tomography study. Neuropharmacology. 2016, 110:530-536.
39.Epstein LH, Lin H, Carr KA, Fletcher KD. Food reinforcement and obesity: Psychological Moderators. Appetite. 2012, 58:157–162.
40.Appelhans BM, Woolf K, Pagoto SL, Schneider KL, Whited MC, Liebman R. Inhibiting food reward: Delay discounting, food reward sensitivity, and palatable food intake in overweight and obese women. Obesity (Silver Spring) 2011, 19, 2175–2182.
41.Rollins BY, Dearing KK, Epstein LH. Delay discounting moderates the effect of food reinforcement on energy intake among non-obese women. Appetite. 2010, 55420–425.
42.Rogero M.M, Tirapegui J. Aspectos atuais sobre aminoácidos de cadeia ramificada e exercício físico. Revista Brasileira de Ciências Farmacêuticas Brazilian Journal of Pharmaceutical Sciences. 2008 44(4).
43.Marchioni D.M.L., Mendes A., Gorgulho B., Stella R. H., Fisberg R.M. Densidade energética da dieta e fatores associados: como está a população de São Paulo? Arq Bras Endocrinol Metab. 2012;56(9): 638-45.
44.Canoy D. Distribution of body fat and risk of coronary heart disease in men and women. Curr Opin Cardiol. 2008;23:591-8
1Nutricionista Especializada em Nutrição Clínica pela Faculdade Metropolitana.
2Nutricionista Residente em Atenção ao Câncer pelo Programa de Residência Multiprofissional em Atenção ao Câncer pela Universidade do Estado do Pará.
3Mestrando no Programa de Pós-Graduação em Sociedade, Ambiente e Qualidade de Vida (PPGSAQ), Instituto de Formação Interdisciplinar e Intercultural (IFII), Universidade Federal do Oeste do Pará (UFOPA).
4Nutricionista formado pelo Centro Universitário da Amazônia- UNAMA.
5Nutricionista formada pela Universidade Federal de Pernambuco (UFPE).
6Nutricionista Especializada em Nutrição Clínica e Esportiva formada pela Facuminas.
7Nutricionista Especializada em Nutrição Clínica formada pelo SENAC – SP.
8Enfermeira, Mestre em Ensino em Saúde pela Universidade do Estado do Pará.
9Enfermeiro e Advogado, Mestre em Justiça Administrativa e Estado de Direito pela Faculdade de Direito da UFF/Niterói.
10Nutricionista Especializada em Nutrição Funcional pela Faculdade Metropolitana.
