REGISTRO DOI: 10.5281/zenodo.10851048
João Vitor Ernica Gomes1; Joyce Medeiros Araújo Tusthler2; Lara Fabian Guimarães3; Régia de Lourdes Ferreira Pachêco Martins4
RESUMO
A doença de Chagas, causada pelo parasita Trypanosoma cruzi, é um grave problema de saúde na região norte brasileira. Nas últimas décadas, o perfil epidemiológico da doença mudou devido a novos padrões de imigração e controle bem-sucedido de sua transmissão, levando à urbanização e globalização da doença. Nos últimos anos, o Brasil apresentou milhares de casos confirmados pela DCA, e a região Norte foi a região mais acometida pela doença, visto que é uma área endêmica de DCA desde a década de 90, que tem pela sua prevalência a classificação de uma enfermidade negligenciada e geralmente, a transmissão oral está relacionada ao consumo de alimentos regionais. Dados recentes coletados na Amazônia brasileira descreveram a ocorrência de um surto de doença de Chagas aguda (DCA) envolvendo dez pacientes cuja fonte suspeita de contaminação foi a ingestão de polpa de açaí. Considerando que os mecanismos de controle adotados nas áreas de transmissão clássicas do Brasil não são totalmente aplicáveis na Amazônia, é importante entender o comportamento da doença nessa região, tanto nos casos agudos quanto nos crônicos. Nessa perspectiva, o presente estudo busca especificar a distribuição da doença de chagas na região norte, de forma a realizar um estudo epidemiológico descritivo. Para a elaboração deste trabalho, atribui-se a utilização de leitura crítica e de consultas de materiais epidemiológicos publicados. As buscas foram realizadas através da principal plataforma de dados e censos relacionados a saúde pública Brasileira, o DATASUS, no período anual de 2010 a 2020. Diante disso, visualizaremos a incidência desta doença parasitaria de maneira a analisar os dados da saúde pública e o cotidiano das populações nortistas, em especial, daquelas que habitam em áreas propícias para disseminação do parasito, que geralmente, as pessoas mais afetadas são as que possuem pouco acesso a informação, educação em saúde e saneamento básico.
Palavras Chave: Epidemiologia de Chagas, Região Norte, Distribuição regional.
ABSTRACT
Chagas disease, caused by the parasite Trypanosoma cruzi, is a serious health problem in northern Brazil. In recent decades, the epidemiological profile of the disease has changed due to new patterns of immigration and successful control of its transmission, leading to urbanization and globalization of the disease. In recent years, Brazil has had thousands of confirmed cases of ACD, and the North region was the region most affected by the disease, since it has been an endemic area of ACD since the 90s, which is classified as a disease due to its prevalence. neglected and usually, oral transmission is related to the consumption of regional foods. Recent data collected in the Brazilian Amazon described the occurrence of an outbreak of acute Chagas disease (ACD) involving ten patients whose suspected source of contamination was the ingestion of açaí pulp. Considering that the control mechanisms adopted in classical transmission areas in Brazil are not fully applicable in the Amazon, it is important to understand the behavior of the disease in this region, both in acute and chronic cases. From this perspective, the present study seeks to specify the distribution of Chagas disease in the northern region, in order to carry out a descriptive epidemiological study. For the elaboration of this work, the use of critical reading and consultation of published epidemiological materials is attributed. The searches were carried out through the main platform of data and censuses related to Brazilian public health, DATASUS, in the annual period from 2010 to 2020. Therefore, we will visualize the incidence of this parasitic disease in order to analyze public health data and daily life. of northern populations, especially those who live in areas conducive to the spread of the parasite, that generally, the most affected people are those who have little access to information, health education and basic sanitation.
Keywords: Chagas Epidemiology, Northern Region, Regional Distribution.
1 INTRODUÇÃO
A Doença de Chagas é uma enfermidade transmissível ocasionada por um parasito, protozoário do gênero Trypanosoma cruzi, transmitida principalmente pelo inseto que possui hábito de realizar as picadas na região da face, ficando assim conhecido popularmente como “barbeiro”. O processo de contágio e transmissão ocorre pelo contato das fezes depositadas pelo vetor sobre a pele do indivíduo, enquanto realiza a hematofagia.
Nos seres humanos, o parasito reside no sangue periférico e nas fibras musculares, com favoritismo para as células cardíacas e digestivas. Gerando sintomas que se diferenciam em duas fases, sendo elas: fase aguda, gerando hepatoesplenomegalia e cardiomegalia, sem muitas manifestações clínicas, dificultando o diagnóstico precoce e o tratamento. Enquanto na fase crônica, a doença pode se alastrar acometendo diversos sítios ativos do corpo, comprometendo a integralidade de um tratamento eficaz (MALAFAIA, 2010).
No Brasil, em especial na região norte, a doença sofre negligência, por não ser tão evidente como a malária e a cólera, embora, provoque ao paciente árduos quadros irreversíveis e persistentes de sofrimento e aflição. O monitoramento e prevenção da doença são de difícil êxito devido às diversas formas de disseminação da doença na região. Podendo ser em decorrência das estruturas das habitações regionais, que apresentam fenestrações e locais propícios para o abrigo do inseto vetor, as chamadas casas de “pau- a pique”. Como também, pode ser disseminada a partir da moenda inconsciente do inseto juntamente do fruto típico da região, o açaí, contaminando todos aqueles que o ingerirem, muitas vezes está relacionada com a falta de vigilância sanitária, que deixa a desejar em algumas áreas dos locais de preparo e consumo do açaí (ARGOLO, 2014).
A DCA na região Norte do Brasil, durante os anos de 2010 a 2020, apresentou situação preocupante. (FERREIRA, 2021). Nas últimas décadas, o perfil epidemiológico da doença mudou devido a novos padrões de imigração e controle bem-sucedido de sua transmissão, levando à urbanização e globalização da doença (NUNES,2013). Deste modo, este trabalho teve como seu objetivo principal analisar o perfil epidemiológico da Doença de Chagas, na Região Norte, de 2010 a 2020.
2 REFERENCIAL TEÓRICO
2.1 HISTÓRICO DA DOENÇA DE CHAGAS
A Doença de Chagas foi descoberta em 1909, pelo médico brasileiro e sanitarista pesquisador do Instituto Oswaldo Cruz (IOC) Carlos Chagas, enquanto investigava a incidência da malária no pequeno povoado de Lassance, no interior de Minas Gerais. Foi analisada pelo instituto de Manguinhos, onde se identificou que se tratava de uma nova doença humana, causada por um protozoário até então desconhecido uma nova espécie de tripanossoma, batizada então por ele de Trypanosoma cruzi, em homenagem a Oswaldo Cruz (KROPF, 2009).
Na década de 80, diversos autores estipulavam que a doença atingia cerca de 18-20 milhões de indivíduos nas áreas endêmicas da América Latina. No Brasil, os estudos e os relatos de caso tornaram a doença compulsória de notificação obrigatória (casos agudos da Doença de Chagas) segundo a Portaria 5 de 21 de fevereiro de 2006 da Secretaria de Vigilância em Saúde do Ministério da Saúde que regulamenta essa ação (FIOCRUZ, 2017).
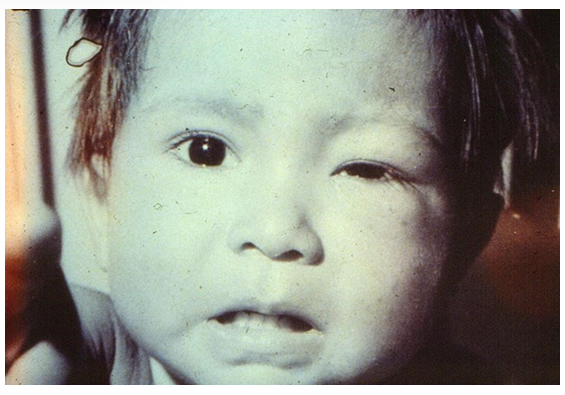
O primeiro diagnóstico ocorreu a partir dos relatos sintomáticos de febre, edema nos olhos, lesões de pele arredondada, dura e circundada por inchaço, assemelhando-se a um furúnculo na paciente Berenice Soares de Moura (Figura 01), criança moradora de Lassance, munícipio no interior de Minas Gerais. O relato do caso entrou para a história da medicina brasileira quando teve seu quadro clínico e patológico descritos pelo mesmo cientista. Na qual o referido relatou uma nova doença humana, seu agente (o protozoário Trypanosoma cruzi) e o vetor (percevejo hematófago, que ficou popularmente conhecido como barbeiro) pelo pesquisador Carlos Ribeiro Justiniano das Chagas, em 1909. A enfermidade descrita, que foi batizada com seu nome, é endêmica na América Latina continental e vai do sul dos Estados Unidos, até o Chile e Argentina (ROCHA, 2019).
Chagas conheceu os insetos hematófagos que co-habitam as moradias da população humilde e que, conhecidos por “barbeiros”. Naquele mesmo ano, detectou a presença de novos protozoários no intestino dos “barbeiros” e formulando a hipótese de que poderiam estar relacionados à doença misteriosa que afligia a população da região, com sintomas predominantemente cardíacos. Em 1909, ele examinou uma criança, chamada Berenice e no seu sangue encontrou os protozoários que observara no intestino de “barbeiros” no ano anterior, descobrindo assim, uma nova doença, que denominou Tripanosomíase americana. Chagas publicou em agosto de 1909, um extenso e muito bem redigido artigo no Instituto Oswaldo Cruz, onde relata a morfologia e o ciclo de vida do tripanosoma (GARCIA, 2010).
FIGURA 1. Primeira paciente diagnosticada
2.2 AGENTE TRANSMISSOR
As principais espécies de barbeiro que transmitem a doença de Chagas no Brasil são: T. brasiliensis, Panstrongylus megistus, T. pseudomaculata e T. sordida. (Rhodnius robustus; Rhodnius pictipes; Panstrongylus geniculatus; Eratyrus mucronatus; Rhodnius montenegrensis; Rhodnius stali; Panstrongylus megistus; Rhodnius neglectus; Triatoma sordida; Panstrongylus lignarius; Panstrongylus rufotuberculatus). O conhecimento das novas espécies facilita o tratamento e a cura (PINHEIRO,2022).
A classificação da espécie se divide em três gêneros: Gênero Triatoma, que apresenta cabeça tamanho médio, com a inserção das antenas na metade da distância entre os olhos e o ápice da cabeça (Tabela 1). O Gênero Panstrongylus, apresenta cabeça curta, de aspecto robusto com inserção das antenas na região imediatamente anterior aos olhos. E o Gênero Rhodnius, apresenta cabeça alongada com a inserção das antenas bem próximo ao ápice da cabeça (JORGE, 2000).
TABELA 1. Distribuição geográfica das espécies.
Espécie Distribuição geográfica Triatoma infestans Bahia, Goiás, Maranhão, Mato Grosso, Mato Grosso do Sul, Minas Gerais, Paraíba, Paraná, Pernambuco, Piauí, Rio de Janeiro, Rio Grande do Sul, Santa Catarina, São Paulo, Sergipe, Tocantins. Panstrongylus megistus Acre, Alagoas, Bahia, Ceará, Distrito Federal, Espírito Santo, Goiás, Maranhão, Mato Grosso, Mato Grosso do Sul, Minas Gerais, Pará, Paraíba, Pernambuco, Piauí, Rio de Janeiro, Rio Grande do Norte, Rio Grande do Sul, Santa Catarina, São Paulo, Sergipe, Tocantins. Triatoma brasiliensis Alagoas, Bahia, Ceará, Goiás, Maranhão, Minas Gerais, Paraíba, Pernambuco, Piauí, Rio Grande do Norte, Sergipe, Tocantins. Triatoma sordida Acre, Bahia, Distrito Federal, Goiás, Maranhão, Mato Grosso, Mato Grosso do Sul, Minas Gerais, Paraná, Pernambuco, Piauí, Rio Grande do Sul, Santa Catarina, São Paulo, Tocantins. Triatoma pseudomaculata Alagoas, Bahia, Ceará, Distrito Federal, Goiás, Maranhão, Mato Grosso do Sul, Minas Gerais, Paraíba, Pernambuco, Piauí, Rio Grande do Norte, Sergipe, Tocantins.
FONTE: (JORGE, 2000).
FIGURA 2. Espécies transmissoras e onde habitam.
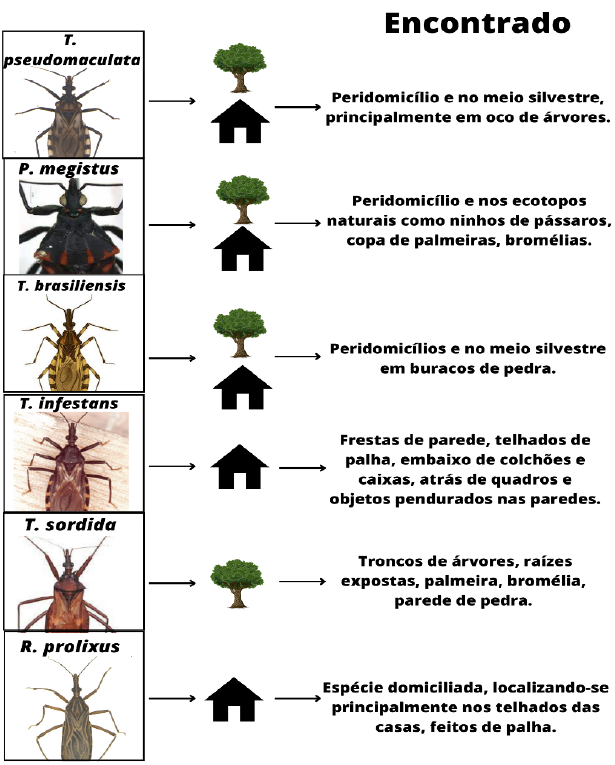
FONTE: (JORGE, 2000).
A doença é transmitida por um inseto hematófago popularmente conhecido como ‘barbeiro’ (Figura 02) (devido ao costume do inseto picar as pessoas na região do rosto) (KROPF, 2009).
O inseto vetor é muito comum no interior das casas de pau-apique típicas da população pobre das áreas rurais do Brasil, principalmente da região norte, como também se abrigam em locais muito próximos à fonte de alimento e podem ser encontrados na mata, escondidos em ninhos de pássaros, toca de animais, casca de tronco de árvore, montes de lenha e embaixo de pedras. Nas casas escondem-se nas frestas, buracos das paredes, nas camas, colchões e baús, além de serem encontrados em galinheiro, chiqueiro, paiol, curral e depósitos (KIFFER, 2016).
FIGURA 3. Inseto Panstrongylus megistus.

2.3 CICLO BIOLÓGICO
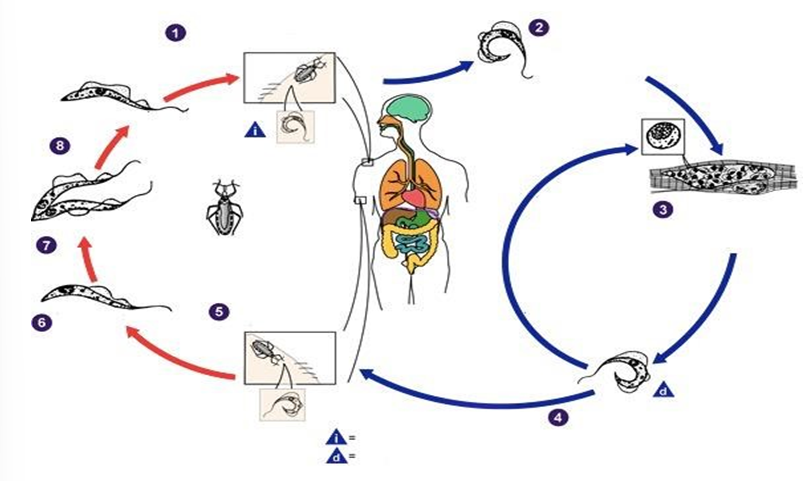
O ciclo biológico do Tripanossoma cruzi consiste em: 1) Um inseto vetor da família dos triatomíneos é infectado e ao ingerir sangue, elimina pelas secreções, tripomastigotas próximo do local da picada. Os tripomastigotas entram no hospedeiro através do ferimento da picada ou pelas áreas de mucosas. 2) No interior do hospedeiro, os tripomastigotas se inserem nas células circundantes do local da picada onde diferenciam-se em amastigotas, sua forma intracelular. 3) Os amastigotas multiplicam-se por divisão binária. 4) Se diferenciando então em tripomastigotas e são liberados na circulação sanguínea. Os tripomastigotas ao infectarem células de uma extensa variedade de tecidos transformam-se em amastigotas intracelulares, gerando então um ciclo contínuo de infecção. 5) O barbeiro infecta-se ao ingerir sangue de um hospedeiro vertebrado contaminado com parasitas circulantes. 6) Os tripomastigotas ingeridos transformam-se em epimastigotas no intestino médio do vetor. 7) Multiplicando-se por divisão binária. 8) No intestino posterior o parasita se diferencia na forma infectante, o tripomastigota metacíclico (Figura 4) (NOGUEIRA, 2009).
FIGURA 4. Ciclo de vida do Trypanosoma cruzi.
2.4 FISIOPATOLOGIA
Trata-se de uma enfermidade que ataca principalmente o coração dos trabalhadores rurais e, numa evolução lenta, silenciosa e progressiva, esgota a capacidade produtiva de suas vítimas, levando-as à morte, muitas vezes subitamente (KROPF, 2009).
A partir do processo de contágio com o hospedeiro, o protozoário Trypanosoma cruzi causa diversas alterações no sistema cardíaco humano, em evidência o comprometimento do miocárdio e do pericárdio são os mais frequentes, podendo manifestar-se de diversas maneiras. Dentre elas, causando doenças inflamatórias como: miocardites e/ou cardiomiopatias. Resultando em um processo de fibrose miocárdica e arritmias ventriculares (GOMES, 2021).
A infecção aguda causada pelo parasita é um estágio raro da doença, e pode levar o individuo a ter denervações autonômicas cardíacas, anormalidades de perfusão e fibroses miocárdicas, além disso, com o decorrer da doença o miocárdio pode ser invadido por parasitas que desencadeiam respostas inflamatórias locais (GOMES, 2021).
As células infectadas com os amastigotas liberam os tripomastigotas para infectar outras células, e também secretam produtos que ativam enzimas como: polipeptídeos, citocinas, prostaglandinas e diversos mediadores potenciais da inflamação. Que também atuam como antígenos ou geradores de novos antígenos, assim causando variadas e complexas respostas do sistema imune do hospedeiro. O ser humano, uma vez infectado, permanece como tal por toda a vida (SILVEIRA, 2000).
2.5 TRANSMISSÃO
A transmissão ocorre pelo contato com as secreções que o “barbeiro” deposita sobre a pele do indivíduo, enquanto o próprio suga o sangue. Geralmente, a picada provoca coceira e o ato de coçar facilita a penetração e infecção do tripanossomo pelo local da picada. O parasita contido nas fezes do “barbeiro” pode penetrar no organismo humano, também pela mucosa dos olhos, nariz e boca ou através de feridas ou cortes recentes existentes na pele (MACHADO, 2004).
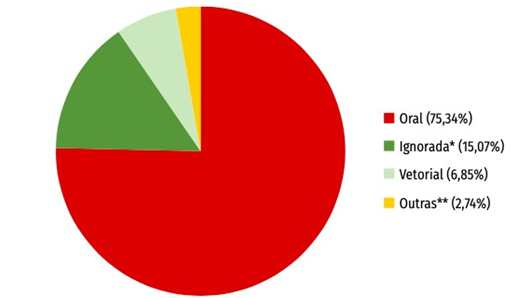
Podem existir também outros mecanismos de transmissão através de: transmissão congênita da mãe chagásica, para o filho via placenta, e transfusão de sangue, caso o doador seja portador da doença e o ocorra acidentalmente em laboratórios e a ingestão de alimentos contaminados. Um clássico exemplo da ingesta do parasita, é o consumo da típica fruta da região norte, o açaí, que também serve de moradia para o inseto e quando passa por seu processo de debulhamento e moenda de forma anti-higiênica pode resultar na trituração do vetor juntamente com o açaí e contaminando aqueles que o ingerir (Figura 5) (FERREIRA, 2014).
No Brasil, a contaminação oral responde pela maioria dos novos casos ocorridos na última década e a doença alterou seu perfil geográfico, expandindo na região amazônica e em especial no estado do Pará. Por conta da globalização das últimas décadas com seus grandes fluxos migratórios, nos países não endêmicos, como nos Estados Unidos da América e na Europa, a transfusão sanguínea e o transplante de órgãos são uma problemática na saúde pública no país (MORENO, 2017).
FIGURA 5. Distribuição de casos de doença de chagas aguda, segundo provável forma de transmissão. Brasil, 2020.
2.6 PERÍODO DE INCUBAÇÃO
O período de incubação da doença e a manifestação sintomática dependem da variação do modo de transmissão. Se a transmissão ocorrer de forma vetorial, estimasse de 4 a 15 dias. Para casos de transmissão oral, são estipulados 3 a 22 dias, e na transmissão transfusional: em média, 30 a 40 dias. Ademais, no processo de transmissão vertical, pode-se transmitir em qualquer período da gestação ou durante o parto (SESAU-PR, 2020).
2.7 ASPECTOS CLÍNICOS
Os sintomas podem variar entre os sintomáticos e os assintomáticos e ambos estão relacionados com o estado imunológico do indivíduo contaminado. A doença se manifesta em diferentes fases, sendo elas: aguda, crônica (assintomática e sintomática). A fase aguda ocorre manifestações locais, quando o cruzi penetra na conjuntiva, as lesões aparecem de 4 à 10 dias após a picada do barbeiro em 50% dos casos agudos, regredindo em 1 ou 2 meses, as manifestações gerais são representadas por febre, edema localizado e generalizado, poliadenia, hepatomegalia, esplenomegalia e, às vezes, insuficiência cardíaca e perturbações neurológicas (são raras em decorrência da meningoencefalite ocorrendo apenas em crianças muito jovens e em imunossuprimidos) (Figura 6) (COURA,2023).
FIGURA 6. Taxa de incidência padronizada por doença de chagas aguda e previsão região norte – 2009 a 2020.
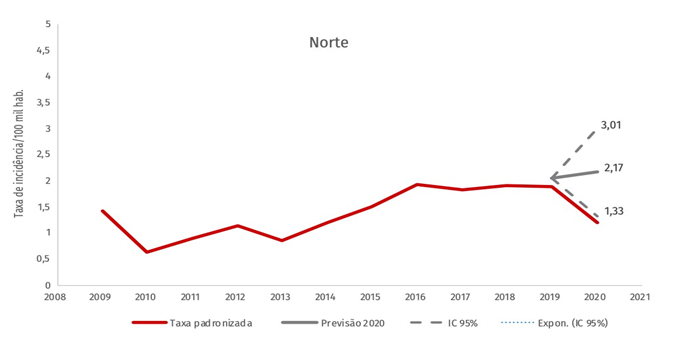
Excepcionalmente, alguns pacientes apesar de apresentarem diminuição da parasitemia, desaparecimento dos edemas e dos sinais de porta de entrada, não normalizam o eletrocardiograma (ECG), apresentando continuamente alguma sintomatologia cardíaca de maior ou menor grau. Na fase crônica assintomática as pessoas passam por um longo período assintomático (10 à 30 anos), essa fase é caracterizada por quatro parâmetros: positividade de exames sorológicos e/ou parasitológicos, ausência de sintomas e/ou sinais da doença, eletrocardiograma convencional normal e coração, esôfago e cólon radiologicamente normais. Apesar de assintomáticos e de apresentarem lesões muito discretas, tem sido registrado morte súbita de pacientes com esta forma da doença. A fase crônica sintomática pode se manifestar com sintomas relacionados com sistema cardiocirculatório (forma cardíaca), digestivo (forma digestiva) ou ambos (forma cardiodigestiva), isso acontece devido a alteração anatômica do miocárdio e do tubo digestivo (NEVES, 2005).
Na forma cardíaca a principal característica é a insuficiência cardíaca congestiva (ICC) que se dá devido a diminuição da massa muscular que se encontra muito destruída devido a substituição por áreas de fibrose interrompendo fibras e fascículos, e quando os mecanismos de compensação cardíacos tornam-se incapazes de superar as deficiências de sua força de contração, surge o quadro de ICC, que se traduz clinicamente por dispnéia de esforço, insônia, congestão visceral e edema dos membros inferiores evoluindo em dispnéia continua, anasarca e morte ( pacientes com este quadro apresentam cardiomegalia intensa). Já a forma digestiva se caracteriza pela presença do megaesôfago (observada entre 20 e 40 anos, com maior incidência no sexo masculino) e do megacólon (adulto entre 30 e 60 anos e prevalência em homens), e os principais sintomas são: disfagia, odinofagia, dor retroesternal, regurgitação, pirose, soluço, tosse e sialose (SIMÕES, 2023).
Já durante a forma nervosa, no estágio agudo da doença apresentasse encefalite, que é caracterizada, principalmente, pela presença de edema cerebelar, infiltrados inflamatórios e formas amastigotas do T. cruzi. O parasita é encontrado no cérebro e medula espinhal, assim como lesões características de meningoencefalomielite, com focos inflamatórios perivasculares ricos em macrófagos e dispersos pela substância branca e cinzenta, mas sem área preferencial (SILVA, 2017).
2.8 DIAGNÓSTICO
No período da fase aguda da doença, devido há grande quantidade de parasita presentes no sangue, pode-se identificar facilmente ao realizar uma analisar de uma gota de sangue no microscópio. Na fase crônica, o diagnóstico é concluído por meio de métodos de sorologia (PINHEIRO, 2022).
O diagnóstico de contaminação pelo protozoário Trypanosoma cruzi, assim como em outras doenças infectocontagiosas, possui três parâmetros como base: manifestações clínicas, que quando presentes, permitem ao médico suspeitar da infecção. Os antecedentes epidemiológicos, também induzem o profissional a suspeitar, e os métodos de diagnóstico laboratoriais permitem confirmar ou excluir a suspeita diagnóstica na maioria das situações. Caberá ao médico, com as informações acima, decidir se o indivíduo está infectado ou não. Na infecção pelo T. cruzi, foi constatado que a maioria dos infectados apresenta cardiopatias, megaesôfago e também megacólon, as principais manifestações da doença de Chagas. Nesses casos em particular, o diagnóstico é sugerido pelos antecedentes epidemiológicos e confirmado ou excluído pelos resultados dos exames laboratoriais (OSTERMAYER, 2017).
2.9 TRATAMENTO
O Benzonidazol é o fármaco utilizado no tratamento da doença de Chagas na fase aguda. Tendo como duração de 60 dias e a dose varia de acordo com o peso do paciente. E em caso de intolerância ao Benzonidazol, é utilizado Nifurtimox e o tratamento ocorre durante 90 dias. A forma precoce do tratamento é a mais indicada e se objetiva em curar a infecção pelo T. cruzi, com o intuito de prevenir lesões nos órgãos como: coração e intestinos. E também diminuir a possibilidade de transmissão do protozoário. Os pacientes que apresentam a forma crônica, com lesões graves nos órgãos apresentam pouco ou nenhum benefício com o tratamento (PINHEIRO, 2022).
2.10 MEDIDAS PREVENTIVAS
Na tentativa de combater o contágio e a transmissão, são estipulados os métodos profiláticos de prevenção. Na transmissão vetorial, visa-se controlar a domiciliação do barbeiro, melhoria das moradias, evitar a degradação ambiental, monitoramento e investigação entomológica de vetores e de reservatórios, realizar exames laboratoriais em humanos quando houver caso positiva de T. cruzi em vetores. Nos processos de transmissão oral, objetiva-se intensificar as medidas da vigilância sanitária para manipulação alimentar, investigação entomológica em casos suspeitos ou positivos de contaminação oral, a iluminação deve ter seu foco distanciado dos equipamentos de processamento de alimentos, afim de evitar contaminação acidental de vetores atraídos pela luz. Providenciar o cozimento acima de 45°C, a pasteurização ou a liofilização. Na transmissão fetal ou vertical o diagnóstico e acompanhamento de gestantes infectadas, juntamente com juntamente com o monitoramento pré-natal pode-se proporcionar a cura da grande maioria dos casos, além de exames laboratoriais na mãe e familiares. Por fim, na profilaxia de transplantes, transfusões e transmissões acidentais se tem a inspeção sanitária e retrovigilância, além da utilização apropriada de Equipamentos de Proteção Individual (EPI) (SESAU-PR, 2020).
3 JUSTIFICATIVA
A tripanossomíase por Trypanosoma cruzi na Região Norte tem sido motivo de preocupação ao longo dos tempos, dada a grande dispersão de vetores infectados e crescentes migrações humanas (NUNES, 2002).
A transmissão para seres humanos pode ocorrer de várias formas: vetorial, transfusão sanguínea, congênita incluindo transmissão oral, e também por meio de transplantes de órgãos de pessoas infectadas, acidentes laboratoriais e relações sexuais (SAMPAIO, 2020).
A doença apresenta duas fases: a inicial ou aguda (DCA), que perdura por 4 à 8 semanas, muitas vezes assintomática, caracterizada pela presença do tripomastigota no sangue do hospedeiro; e a segunda fase que pode perdurar por anos ou décadas, quando há evolução para a forma crônica, que é caracterizada pelo comprometimento dos tecidos cardíaco e/ou digestório do doente, com difícil detecção de parasitos circulantes. Em indivíduos cuja doença evolui para a fase crônica, pode haver o aparecimento de problemas cardíacos, megaesôfago e megacólon, porém, entre os sintomas crônicos, o principal é a insuficiência cardíaca, que pode conduzir à morte súbita. As complicações mais severas afetam aproximadamente 30% dos pacientes e causam cerca de 50 a 100 mil mortes por ano (FERREIRA, 2014).
O principal local de contaminação foi associado ao ambiente domiciliar, com 1.551 casos. 1.176 casos ocorreram em zonas urbanas. O mês que mais houve número de contaminações foi outubro, com 353 casos. A DCA na região Norte do Brasil, durante os anos de 2007 a 2018, apresentou situação preocupante. A patologia acomete principalmente o sexo masculino, declarados de raça/cor parda, de 20 a 39 anos (FERREIRA, 2021).
A contaminação da doença chagásica de forma passiva (principalmente por meio da transmissão oral), tem uma significativa importância nos últimos anos. Uma vez que pequenas epidemias estavam associadas ao consumo de polpas de açaí contaminadas seja pela contaminação do fruto ou da polpa em si, através de dejetos de animais reservatórios ou dos insetos vetores infectados pelo parasito (oral, extradomiciliar e domiciliar sem colonização vetorial). Evidenciando a justificativa da ocorrência de casos em uma região com baixos quantitativos de vetores nas áreas urbanas (PINTO, 2016).
Nas últimas décadas, o perfil epidemiológico da doença mudou devido a novos padrões de imigração e controle bem-sucedido de sua transmissão, levando à urbanização e globalização da doença (NUNES,2013)
A doença de Chagas (DC), também conhecida como Tripanossomíase Americana, é uma doença parasitária negligenciada, que apesar de não ser tão conhecida como a malária e a cólera, afeta cerca de 8 milhões de pessoas, matando mais de 12.500 por ano. Os milhões de pessoas infectadas e negligenciadas no mundo exigem que os conhecimentos atuais sobre a doença sejam traduzidos em políticas públicas efetivas e inclusivas como resposta a esse problema secular (VELASCO, 2018).
4 OBJETIVOS
4.1 OBJETIVO GERAL
Analisar o perfil epidemiológico da doença de Chagas, na Região Norte, de 2010 a 2020.
4.2 OBJETIVOS ESPECÍFICOS
– Analisar a distribuição espacial da doença de Chagas por Estado, na Região Norte, de 2010 a 2020.
– Identificar os fatores que determinam a transmissão da doença de Chagas na Região Norte.
– Apresentar o perfil epidemiológico da doença de Chagas na região Norte, segundo a faixa etária, sexo, raça, critérios de confirmação e evolução dos casos.
5 METODOLOGIA
5.1 TIPO DE PESQUISA
O estudo da ocorrência da doença de Chagas na região Norte, no período de 2010 a 2020, é um estudo epidemiológico observacional descritivo populacional, com identificação da distribuição relacionando-os com os casos da doença de Chagas, com ênfase nas áreas endêmicas, onde a transmissão da doença é mais alta.
5.2 LOCAL DA PESQUISA
A região Norte do Brasil é composta pelos estados do Acre, Amapá, Amazonas, Pará, Rondônia, Roraima e Tocantins. Tendo uma extensão territorial de 3.853.322,2 quilômetros quadrados, correspondendo a 45% da área total do país, sendo a maior região do território brasileiro.
A região possui clima predominante é o equatorial, apresentando temperaturas elevadas e altos índices pluviométricos e de umidade. A vegetação é composta em sua maioria pela floresta Amazônica. Sua hidrografia é composta pelas bacias Amazônicas e do Tocantins.
O relevo da região norte é formado por planícies e planaltos. As planícies, áreas mais baixas de seu relevo são divididas entre: igapós, tesos e os platôs.
Igapós: áreas mais baixas que são inundadas pelos rios da região durante o período de cheia. Os Tesos: também chamados de terraços fluviais, são as várzeas, que podem ser inundadas durantes grandes cheias, e os platôs: áreas que não sofrem inundações e podem chegar a 350 metro de altitude.
A economia da Região Norte se baseia no extrativismo mineral, vegetal, e principalmente agropecuária e indústria.
Na extração mineral, destacamos a extração de diamante, ouro, ferro, estanho, alumínio, manganês e níquel. O estado do Pará é o grande destaque, pois apresenta vastas áreas de mineração. A agropecuária, por sua vez, avança à medida que o desmatamento cresce. Áreas de devastação dão lugar a novas culturas e propriedades de criação de bovinos. Destaca-se o cultivo de soja, café, cacau, arroz, mandioca e milho.
Quanto à atividade industrial, Manaus e Belém possuem os maiores e mais sofisticados parques industriais. A Zona Franca de Manaus reúne cerca de 500 indústrias diversificadas. O cenário industrial apresenta bastante crescimento nas últimas décadas devido à vasta mão de obra que se apresenta no local e matéria-prima abundante.
Uma característica da população dessa região é a concentração de pessoas nas margens dos rios, os quais sobrevivem da pesca. Além desses ribeirinhos – nome que essas pessoas recebem –, a região é habitada por comunidades indígenas, caboclas, extrativistas e negras, remanescentes de quilombos, e das populações que vivem nas cidades.
5.3 POPULAÇÃO E AMOSTRA
Conforme a estimativa do censo demográfico de 2020, pelo Instituto Brasileiro de Geografia e Estatística (IBGE), a população total é de 17.834.762 habitantes, dos quais 73,5% residem em áreas urbanas. O Norte é a Região menos povoada do território nacional, visto que a sua densidade demográfica é a menor: 4,12 habitantes/Km2. Sendo que a amostra deste estudo será de 2.700 casos.
5.4 CRITÉRIOS DE INCLUSÃO E EXCLUSÃO
Foram atribuídos como critério de inclusão: os censos dentro do período de 2010 a 2020, contemplando os descritores de pesquisa e a temática abordada. Como critérios de exclusão foram: todos os que tinham acesso restrito, os que estavam fora do período estimado e aqueles que não contemplavam a região estudada nesta pesquisa.
5.5 PROCEDIMENTOS E INSTRUMENTOS
É um estudo epidemiológico descritivo observacional, realizado mediante a coleta de dados na plataforma de livre acesso do Ministério da Saúde, referente aos anos de 2010 a 2020.
A coleta e consulta dos dados foi realizada na plataforma digital DATASUS, e seu funcionamento se relaciona à ação produtora, receptora, ordenadora e disseminadora de informações.
Optou-se por consultar o banco de dados DATASUS, por ser de livre acesso, rápida e eficiente para a obtenção de dados e informação em saúde e que está ao alcance de qualquer gestor, profissional ou pesquisador, garantindo que o material obtido está constantemente atualizado de acordo com os censos e dados epidemiológicos.
Analisou-se o perfil epidemiológico da doença de Chagas, na Região Norte, de 2010 a 2020, serão acessados os números de casos, por ano, no banco de dados do Ministério da Saúde, o DATASUS e assim também a população da região, no site do IBGE, para fazer os cálculos das taxas de incidência. Essas taxas serão organizadas em tabelas e depois analisadas.
Para analisar a distribuição espacial da doença de Chagas por estado, na Região Norte, de 2010 a 2020, foi descrita a ocorrência da doença, segundo local de ocorrência e transmissão, acessando os dados do DATASUS.
Para identificar os fatores que determinam a transmissão da doença de Chagas na Região Norte, utilizou-se o banco de dados do DATASUS, para coletar dados epidemiológicos referentes a transmissão, quanto ao local (unidade de hemoterapia, domicílio, laboratório e outro) e modo (transfusional, vetorial, vertical, acidental, oral e outros) provável da fonte de infecção.
E por conseguinte, para apresentar o perfil epidemiológico da doença, segundo a faixa etária, sexo, raça, critérios de confirmação e evolução dos casos, também foram acessados no DATASUS, conforme cada variável segundo pessoa.
5.6 ANÁLISE DOS DADOS
Realizou-se uma análise descritiva, através da elaboração de tabelas, visando análises estatísticas, dos casos de Chagas ocorridos no período de 2010 a 2020. Para as análises estatísticas foi também utilizado o programa EXCEL.
6 RESULTADOS ESPERADOS
A Doença de Chagas embora historicamente associada principalmente a áreas rurais e regiões de baixa renda, atualmente tem se mostrado uma preocupação crescente também em áreas urbanas.
A transmissão da doença ocorre principalmente pela picada do vetor triatomíneo, além da sua transmissão por transfusão sanguínea, transplante de órgãos, ingestão de alimentos contaminados e transmissão vertical (de mãe para filho durante a gestação).
Diante da importância de compreender a distribuição espacial da doença, foi realizado um levantamento dos casos confirmados por região de notificação, segundo a Unidade Federativa (UF) de notificação, na região Norte do Brasil. Os dados coletados foram organizados em uma tabela para melhor visualização e análise dos resultados.
A seguir, apresentamos as tabelas com os dados encontrados:
TABELA 2: Casos confirmados por Região de notificação segundo UF de notificação 2010 2020.
UF de notificação Região Norte Rondônia 6 Acre 67 Amazonas 143 Roraima 5 Pará 2.214 Amapá 154 Tocantins 48 Total 2.637
Mediante a coleta dos dados por Região de notificação (UF), aferiu-se que o estado do Pará é a localidade que possui maior incidência de casos, enquanto o estado de Roraima lidera o menor quantitativo com 5 casos registrados de 2010 a 2020.
A partir da análise teórica das ocorrências dos casos regionais, foram selecionados perfis para a busca das incidências em questão. Objetivando identificar as variações referente aos critérios avaliativos de: faixa etária, sexo, raça, critério de confirmação e evolução dos casos. Visando identificar as alterações e as singularidades dos parâmetros selecionados.
Diante disso, foram elaboradas as seguintes tabelas, que são constituídas por dados coletados na plataforma pública DATASUS.
TABELA 3: Casos confirmados por Região de notificação segundo faixa etária de 2010-2020
Faixa Etária N°de casos <1 Ano 32 1-4 109 5-9 201 10-14 229 15-19 226 20-39 904 40-59 646 60-64 102 65-69 67 70-79 91 80 e + 30 Total 2.637
De acordo com a coleta de faixa etária, identificou-se que os maiores índices de contágio de acordo com a faixa etária, ocorrem nos indivíduos entre 20-39 anos, e uma menor incidência nos pacientes acima de 65 anos. Informação pertinente para se avaliar as manifestações epidemiológicas de contágio relacionadas ao fator etário.
TABELA 4: Casos confirmados por Região de notificação segundo sexo de 20102020
Sexo N° de casos Masculino 1.448 Feminino 1.189 Ignorado 0 Em branco 0 Total 2.637
De acordo com os dados analisados rerente ao sexo, evidenciou-se que as maiores taxas percentuais de casos foram nos indivíduos do sexo masculino, em contraponto, aquelas do sexo feminino apresentam uma diferença percentual de apenas 259 casos na sua contabilidade total.
TABELA 5: Casos confirmados por Região de notificação segundo raça de 2010-2020
Raça N°de casos Branco 255 Preto 96 Pardo 2.087 Indígena 36 Amarelo 10 Ignorado 153 Total 2.637
No que se refere aos casos de contágio confirmados mediante ao critério de seleção raça, foi identificado que os indivíduos de cor parda possuem grande insurgência sobre as demais raças.
TABELA 6: Casos confirmados por Região de notificação segundo critério de confirmação de 2010-2020
Critérios de confirmação N°de casos Ign/Branco 53 Laboratorial 2.511 Clínico epidemiológico 64 Em investigação 9 Total 2.637
Para avaliar o método de diagnóstico da patologia, foram identificados os critérios de confirmação: laboratorial, clínico epidemiológico, em investigação e ignorados. Onde foi identificado que o maior número de casos confirmados foram os que utilizam o diagnóstico laboratorial. Correspondendo a 94% dos diagnósticos totais.
TABELA 7: Casos confirmados por Região de notificação segundo Evolução dos casos de 2010-2020
Evolução dos casos N°de casos Ign/Branco 306 Vivo 2.284 Óbito pelo agravo notificado 40 Óbito por outra causa 7 Total 2.637
Por conseguinte, evidenciou-se no critério evolutivo dos casos que 86% dos casos diagnosticados evoluem para um bom prognóstico com a manutenção da vida do paciente.
7 CONCLUSÃO
Diante disso, vemos que esta doença parasitária incide negativamente nos dados da saúde pública e no cotidiano das populações nortistas, em especial, daquelas que habitam em áreas propícias para disseminação do parasito, e geralmente, as pessoas mais afetadas são as que possuem pouco acesso à informação, educação em saúde e saneamento básico.
Por tanto, cabe analisar a distribuição da doença de chagas na região norte, com a finalidade de compreender a doença e as suas manifestações, com o propósito de estipular medidas que proporcionem o enfrentamento da situação, através da criação de protocolos e projetos e assim, realizar campanhas estratégicas para produzir melhor qualidade de vida e diminuir a disseminação da doença.
REFERÊNCIAS
ARGOLO, A ,A. Doença de Chagas e seus principais vetores. 1°ed, Rio de Janeiro, Fundação Oswaldo Cruz, 2008.
BARROSO FERREIRA, R. T.; BRANQUINHO, M. R.; CARDARELLI-LEITE, P. Transmissão oral da doença de Chagas pelo consumo de açaí: um desafio para a Vigilância Sanitária. Vigilancia Sanitaria em Debate, [S. l.], v. 2, n. 4, p. 4-11, 2014. DOI: 10.3395/vd.v2n4.358. Disponível em: https://visaemdebate.incqs.fiocruz.br/index.php/visaemdebate/article/view/358Acess o em: 24 mar. 2022.
CHAVES, LÉO. Focos de barbeiro na cidade de São Paulo. Pesquisa Fapesp, 2019. Disponível em: https://revistapesquisa.fapesp.br/focos–de–barbeiro–na–cidadede–sao–paulo/#&gid=1&pid=1 Acesso em: 01 jun. 2022.
COURA, JOSÉ RODRIGUES. Tripanossomose, doença de Chagas. Ciênc. Culto. , São Paulo , v. 55, n. 1, pág. 30-33, janeiro de 2003 . Disponível em <http://cienciaecultura.bvs.br/scielo.php?script=sci_arttext&pid=S0009672520030001 00022&lng=en&nrm=iso>.Acesso em 22 de maio de 2023.
DIAS, JOÃO CARLOS PINTO ET AL . II Consenso Brasileiro em Doença de Chagas, 2015. Epidemiol. Serv. Saúde, v. 25, n. esp, p. 7-86, jun. 2016 . Disponível em:http://scielo.iec.gov.br/scielo.php?script=sci_arttext&pid=S167949742016000500007&lng=pt&nrm=iso>. DOI: http://dx.doi.org/10.5123/s1679-49742016000500002.Acesso em 27 fev. 2023.
DISTRITO FEDERAL, SECRETARIA DE SAÚDE. Controle dos vetores da doença de chagas. GDF, 2022. Disponível em: https://www.saude.df.gov.br/controle-dosvetores-da-doenca-de-chagas Acesso em: 01 jun. 2022.
doença de Chagas pelo consumo de açaí: um desafio para a Vigilância
ERQUERIA, WAGNER. A região Norte. PreParaEnem Disponível em: https://www.preparaenem.com/geografia/aregiaonorte.htm#:~:text=Quanto%20aos% 20aspectos%20f%C3%ADsicos%2C%20o,pelos%20grandes%20rios%20das%20ba cias Acesso em 27 fev. 2023
FERREIRA, R. T. B.; BRANQUINHO, M. R.; LEITE, P. C. Transmissão oral da doença de Chagas pelo consumo de açaí: um desafio para a Vigilância Sanitária. Vigilância Sanitária em Debate, Rio de Janeiro, v. 2, n. 4, p. 4-11, 2014.
FIOCRUZ. História. Portal da Doença de Chagas. Pesquisa e Coleções Biológicas 2017 Disponível em: http://chagas.fiocruz.br/sessao/historia/ Acesso em: 26 maio. 2022.
GARCIA, SÉRGIO BRITTO. Doença de Chagas: os 100 anos da descoberta e a atualidade do pensamento de seu descobridor. Arquivos de Gastroenterologia 2009. DOI: https://doi.org/10.1590/S0004-28032009000400001. Disponível em: https://books.scielo.org/id/48jg4/pdf/kropf–9788575413159.pdf Acesso em: 26 maio. 2022.
GOMES, J. V. E. .; TUSTHLER, J. M. A. .; GUIMARÃES, L. F. .; SANTOS, A. D. O. D. .ALTERAÇÕES CARDÍACAS EM DECORRÊNCIA DA DOENÇA DE CHAGAS. Revista Multidisciplinar em Saúde, [S. l.], v. 2, n. 4, p. 62, 2021. DOI: 10.51161/rems/2205. Disponível em: https://editoraime.com.br/revistas/index.php/rems/article/view/2205. Acesso em: 23 maio. 2023.
JORGE, TCA., and CASTRO, SL., orgs. Doença de chagas: manual para experimentação animal. Rio de Janeiro: Editora FIOCRUZ, 2000. 368 p. Antropologia e Saúde collection. ISBN 85- 85676-75-2.Disponível em: http://books.scielo.org.Acesso em: 26 maio. 2022.
KIFFER.D.Doença de Chagas e o barbeiro: informação é a melhor forma de erradicação. 2016. FAPERJ-Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro.Disponível em: https://siteantigo.faperj.br/?id=3297.2.4 Acesso em: 26 maio. 2022.
KROPF, S. Doença de Chagas, doença do Brasil: ciência, saúde e nação, 19091962. Rio de Janeiro: Editora FIOCRUZ, 2009, 596 p. ISBN 978-85-7541-315-9. DOI: https://doi.org/10.7476/9788575413159.Disponível em: https://books.scielo.org/id/48jg4/pdf/kropf–9788575413159.pdf Acesso em: 26 maio. 2022.
MACHADO, ALFREDO. Manual de orientações técnicas para elaboração de projeto de melhoria habitacional para o controle da doença de Chagas /Fundação Nacional de Saúde. – Brasília: Funasa, 2003.
MD saúde. Universidade Federal do Rio de Janeiro (UFRJ). Disponível em: https://www.mdsaude.com/doencas-infecciosas/parasitoses/doenca-dechagas/Acesso em: 26 maio. 2022.
MALAFAIA, G.; RODRIGUES, A. S. DE L.. Centenário do descobrimento da doença de Chagas: desafios e perspectivas. Revista da Sociedade Brasileira de Medicina Tropical, v. 43, n. 5, p. 483–485, set. 2010.
MÉDICO SEM FRONTEIRAS, Atividades médicas, Doenças de Chagas. Médicos sem fronteiras, 2022. Disponível em: https://www.msf.org.br/o-que fazemos/atividades-medicas/doenca-de chagas/?utm_source=adwords_msf&utm_medium=&utm_campaign=doencas_geral_ comunicacao&utm_content=_exclusaosaude_brasil_39923&gclid=CjwKCAjwo_KXB hAaEiwA2RZ8hAyForRs8mF-SLVuVIZR7xTGFyvjDLALgwv5zZ-hhpCZHBsCFn6jxoC1_4QAvD_BwE Acesso em: 17 Agos. 2022
MINISTÉRIO DA SAÚDE, Doença de Chagas. BVS, 2005. Disponível em: https://bvsms.saude.gov.br/doenca–de–chagas–10/ Acesso em: 17 Agos. 2022 MINISTÉRIO DA SAÚDE. Secretaria de Vigilância em Saúde. Doença de Chagas: 14 de abril – Dia Mundial. Bol Epidemiol. 2021 abr 51:1-43. Disponível em: http://www.saude.gov.br/boletins–epidemiologicos Acesso em: 01 jun. 2022.
MORENO, ALEJANDRO M. HASSLOCHER. Mecanismos de transmissão da doença de Chagas. 2017. Laboratório de Pesquisa Clínica em doenças de Chagas/ Instituto Nacional de Infectologia Evando Chagas/Fiocruz.Disponível em: http://chagas.fiocruz.br/doenca/transmissao/ Acesso em: 26 maio. 2022.
NEVES, DP. Parasitologia Humana, 11ª ed, São Paulo, Atheneu, 2005.
NOGUEIRA, FB. Estudo dos genes que codificam as proteínas antioxidantes em populações do trypanosoma cruzi sensíveis e resistentes ao benzonidazol. 2009. 151 f. Dissertação (Mestrado em Biologia Celular e Molecular) – Fundação Oswaldo Cruz, Centro de Pesquisas Renê Rachou, Belo Horizonte, 2009.Disponível em: https://www.arca.fiocruz.br/handle/icict/3745Acesso em: 26 maio. 2022.
NOGUEIRA, FERNANDA. Estudo dos genes que codificam as proteínas antioxidantes em populações de Trypanosoma cruzi sensível e resistentes ao benzonidazol. Fundação Oswaldo Cruz, 2009. Disponível em: http://www.cpqrr.fiocruz.br/texto–completo/T_9.pdf Acesso em: 01 jun. 2022.
NUNES, M. C., DONES, W., MORILLO, C. A., ENCINA, J. J., RIBEIRO, A. L., & Council on Chagas Disease of the Interamerican Society of Cardiology (2013). Chagas disease: an overview of clinical and epidemiological aspects. Journal of the American College of Cardiology, 62(9), 767–776. DOI: https://doi.org/10.1016/j.jacc.2013.05.046Disponível em: https://pubmed.ncbi.nlm.nih.gov/23770163/.Acesso em: 24 mar. 2022.
NUNES, M. C., GUIMARÃES JÚNIOR, M. H., DIAMANTINO, A. C., GELAPE, C. L., & FERRARI, T. C. (2017). Cardiac manifestations of parasitic diseases. Heart(British Cardiac Society), 103(9), 651–658. DOI: https://doi.org/10.1136/heartjnl2016-309870. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28285268/ Acesso em: 24 mar. 2022.
OSTERMAYER, ALEJANDRO. História dos métodos de diagnóstico para a doença de Chagas. Portal da Doença de Chagas. 2017Disponível em: http://chagas.fiocruz.br/doenca/diagnostico/#diagnostico Acesso em: 26 maio. 2022.
PINHEIRO, P. Doença de Chagas: causas, sintomas e tratamento. 2022 ROCHA, MANOEL. 14/04 DIA MUNDIAL DA DOENÇA DE CHAGAS.
UNIVERSIDADE FEDERAL DE MINAS GERAIS – MG. 2019 Disponível em: https://www.medicina.ufmg.br/chagas/ Acesso em: 26 maio. 2022.
SAMPAIO, G., SILVA, A., BRITO, C., HONORATO, N., OLIVEIRA, L. M., CÂMARA, A., & GALVÃO, L.(2020). Epidemiological profile of acute Chagas disease in individuals infected by oral transmission in northern Brazil. Revista da Sociedade Brasileira de Medicina Tropical, 53, e20200088. DOI: https://doi.org/10.1590/0037-8682-0088-2020 . Disponível em: https://www.scielo.br/j/rsbmt/a/rF3gMScH6KM6GcWRBPbnr9v/?lang=en . Acesso em:24 mar. 2022.
SANITÁRIA. Vigilância Sanitária em Debate, Rio de Janeiro, v. 2, n. 4, p. 4-11,
SAÚDE-PR, SECRETÁRIA. Doença de Chagas. Secretaria de Saúde do Paraná. 2020Disponível em: https://www.saude.pr.gov.br/Pagina/Doenca–de–Chagas Acesso em: 26 maio. 2022.
SILVA, ANDRÉA. A forma cardíaca da doença de Chagas – Realidade atual e avaliação funcional. Departamento de Patologia, Faculdade de Medicina, Universidade Federal Fluminense. 2017.Disponível em: http://chagas.fiocruz.br/doenca/patologia/#forma–nervosa Acesso em: 26 maio. 2022.
SILVEIRA, ANTONIO CARLOS. Situação do controle da transmissão vetorial da doença de Chagas nas Américas. Cadernos de saúde Pública, v. 16, p. S35-S42, 2000.Disponível em:https://www.scielo.br/j/csp/a/3dGQ3NWJhWjwzdypZzSDrZP/?format=pdf&la ng=pt Acesso em: 26 maio. 2022.
SIMÕES, M. V. et al.. Chagas Disease Cardiomyopathy. International Journal of Cardiovascular Sciences, v. 31, n. 2, p. 173–189, mar. 2018. Disponível em: https://doi.org/10.5935/2359–4802.20180011. Acesso em 22 de maio de 2023.
VELASCO, A., & MORILLO, C. A. (2020). Chagas heart disease: A contemporary review. Journal of nuclear cardiology: official publication of the American Society of Nuclear Cardiology, 27(2), 445–451. DOI: https://doi.org/10.1007/s12350–018–1361–1Disponível em: https://pubmed.ncbi.nlm.nih.gov/30022404/ Acesso em: 24 mar. 2022.
1Acadêmico de Medicina do Centro Universitário Aparício Carvalho (FIMCA), Jvegernica@gmail.com,
2Acadêmica de Medicina do Centro Universitário Aparício Carvalho (FIMCA), joycetusthler@hotmail.com,
3Acadêmica de Medicina do Centro Universitário Aparício Carvalho (FIMCA), laraguima40@gmail.com,
4Docente do Centro Universitário Aparício Carvalho (FIMCA), prof.martins.regia@fimca.com.br.
