REGISTRO DOI: 10.5281/zenodo.7817814
Barbara dos Santos Muniz
Caroline Barbosa do Nascimento
Isabella Moreira Alves
Orientadora: Profª Izabela Alves Gomes
RESUMO
A síndrome de ovários policísticos (SOP) é a endocrinopatia mais comum nas mulheres em idades reprodutivas. Os principais sinais e sintomas da doença são o hiperandrogenismo, irregularidade menstrual e anovulação. Além disso, a SOP é frequentemente associada a outras comorbidades, tendo maior prevalência resistência insulínica, obesidade, risco de doença cardiovascular e doença hepática gordurosa não alcoólica. Tendo em vista o quadro geral da doença, este trabalho tem como objetivo revisar a literatura disponível dos últimos dez anos sobre a contribuição da alimentação na qualidade de vida em mulheres com SOP, bem como as estratégias que estão sendo estudadas como primeira linha de tratamento. Com base nos dados analisados, pôde-se concluir que a alimentação associada ao tratamento medicamentoso e exercício físico trazem uma melhora no quadro geral da doença, bem como o controle ou até mesmo remissão das comorbidades associadas; à mudança do estilo de vida de um modo geral pode ser considerada uma linha de tratamento quando levada a sério, e devendo ser acompanhada por uma equipe multiprofissional.
Palavras-chave: síndrome dos ovários policísticos, alimentação, comorbidades
ABSTRACT
Polycystic ovary syndrome (PCOS) is the most common endocrinopathy in women of reproductive age. The main signs and symptoms of the disease are hyperandrogenism, menstrual irregularity and anovulation. In addition, PCOS is frequently associated with other comorbidities, with a higher prevalence of insulin resistance, obesity, risk of cardiovascular disease and non-alcoholic fatty liver disease. In view of the general picture of the disease, this study aims to review the literature available over the past ten years on the contribution of food to quality of life in women with PCOS, as well as the strategies being studied as the first line of treatment. Based on the analyzed data, it was concluded that the food associated with drug treatment and physical exercise improves the general condition of the disease, as well as the control or even remission of the associated comorbidities; lifestyle change in general can be considered a line of treatment when taken seriously, and must be monitored by a multidisciplinary team.
Key Words: ovarian polycystic syndrome, food, comorbidities
INTRODUÇÃO
A Síndrome dos Ovários Policísticos (SOP) é considerada a endocrinopatia mais frequente em mulheres em idade reprodutiva, acometendo cerca de 6 a 19% dessa população, dependendo do critério diagnóstico adotado (SIRMANS; 2013). Em 1935, o Dr. Stein e Dr. Leventhal observaram que sete pacientes, sendo quatro delas obesas, apresentavam amenorréia, hirsutismo, infertilidade e ovários com volume aumentado. Essas pacientes foram submetidas à cirurgia de retirada de uma parte de seus ovários, que foram enviados para estudo microscópico. Então perceberam que havia múltiplos cistos foliculares nessas superfícies estudadas, e após a sua retirada, as pacientes voltaram a menstruar com regularidade e conseguiram engravidar (STEIN, 1935).
Somente em 1990 foi elaborado pela National Institutes of Health (NIH) o primeiro consenso com relação ao diagnóstico desse distúrbio. Segundo o NIH, era necessária a presença de dois critérios para diagnóstico da SOP sendo eles a presença clínica e/ou bioquímica de hiperandrogenismo e disfunção menstrual.
Em 2003, o critério de Rotterdam adicionou o aparecimento de ovários policísticos confirmados por ultrassom como o terceiro critério, pois considerava que o distúrbio ocorria em virtude da produção aumentada de andrógenos pelo ovário. Esse consenso sugere que a presença de dois dos três critérios definidos anteriormente é suficiente para diagnóstico (MARCONDES et.al, 2011). Ainda que considerado controverso por diversos estudos, o critério de Rotterdam é o método mais adotado por diferentes diretrizes (TEEDE et.al, 2011), (LEGRO et.al, 2013), (SPRITZER, 2014) e muito utilizado por ginecologistas e outros especialistas.
O consenso de 2006 da The Androgen Excess and PCOS Society sugeriu que o excesso androgênico deve estar obrigatoriamente presente para o diagnóstico da síndrome, adicionando a ele a disfunção menstrual e/ou ovários policísticos (MARCONDES et.al, 2011).
A síndrome é um distúrbio multifatorial que surge das interações entre fatores genéticos, ambientais e até mesmo intrauterinos, como sugerem alguns estudos (MELO, 2015;FEBRASGO, 2018). Por sua etiologia não estar totalmente esclarecida, e não haver teste específico para esta condição, o seu diagnóstico é realizado por exclusão de outras doenças (MELO, 2015).
As principais características clínicas desta síndrome são a presença de hiperandrogenismo, que pode se manifestar por: hirsutismo, acne, alopecia, seborréia, irregularidade menstrual, cistos ovarianos e a anovulação crônica e infertilidade (CALIXTO, 2012). As principais manifestações metabólicas relatadas são: obesidade, estima-se que pelo menos metade dessas mulheres possuem índice de massa corporal (IMC) maior do que 25; resistência insulínica, detectada em 50 a 90% das portadoras de SOP; acanthosis nigricans, manifestação associada à resistência à insulina (RI); apnéia obstrutiva do sono e elevação da relação hormônio luteinizante / folículo estimulante (LH/FSH) (FEBRASGO, 2018;CONITEC, 2019)
Embora não façam parte dos critérios diagnósticos, a resistência à insulina e obesidade são frequentes nessas mulheres e potencializam as diferentes manifestações da síndrome (CONITEC, 2019). A RI ocorre com maior prevalência entre as pacientes com obesidade associada, apesar de ser detectada independente da massa corporal (MAHAN E RAYMOND, 2018).
A SOP é conhecidamente uma patologia de mulheres adultas, porém alguns estudos demonstraram que a síndrome pode manifestar-se em qualquer fase da vida, desde a infância até a fase adulta. Apesar disso, a prevalência da SOP em crianças ainda permanece desconhecida (KAMANGAR et al., 2015). Alguns fatores fazem com que a síndrome seja comum na adolescência, como as alterações hormonais e alterações morfológicas ovarianas (FARIA, 2013), porém, existem algumas características normais da puberdade que se assemelham aos sintomas clínicos da SOP, como acne e menstruação irregular (HAYEK et al, 2016). A presença de RI e obesidade tem estado cada vez mais presente na população adolescente. Essas comorbidades provocam efeitos deletérios à saúde e podem perpetuar-se ao longo da vida. Os dados reforçam a necessidade de adotar estratégias de prevenção para a SOP nesta fase da vida, tendo em vista a diminuição dos fatores de risco para a SOP, uma vez que poderão refletir na vida adulta (FARIA, 2013).
Os tratamentos envolvem o controle das manifestações clínicas, regularização dos ciclos menstrual e hormonal, reduzindo o hiperandrogenismo (CONITEC, 2019).
A primeira escolha de tratamento medicamentoso é geralmente o uso dos anticoncepcionais hormonais combinados (AHC), principalmente em mulheres que não têm o desejo de gestar. Porém deve-se levar em consideração a presença de comorbidades metabólicas e fatores de risco cardiovasculares que podem contraindicar o uso de AHC (WHO, 2015). A metformina é recomendada como agente sensibilizador da ação da insulina, além disso, estudos evidenciam seu efeito paralelo na redução de da secreção de androgênios pelos ovários e melhora na ciclicidade menstrual. Os efeitos são mais evidentes se associados a medidas de alterações de estilo de vida (NADERPOOR, et al, 2015).
Em 2013, a Endocrine Society publicou a diretriz global de diagnóstico e tratamento da SOP. Apesar de a maioria das diretrizes serem medicamentosas, exercícios e intervenção dietética com objetivo de perda de peso eram sugeridos para mulheres com sobrepeso ou obesas, por seus benefícios na saúde reprodutiva e disfunções metabólicas, redução do risco cardiovascular (RCV) e de diabetes (LEGRO, 2013).
O tratamento não medicamentoso consiste na modificação do estilo de vida. A diretriz brasileira, aprovada em 2019 pelo Ministério da Saúde, recomenda a modificação do estilo de vida para todas as pacientes, contemplando as seguintes medidas: cessação do tabagismo e do uso abusivo de álcool, prática de atividade física regular e alimentação saudável. Em caso de sobrepeso ou obesidade, principalmente associados à comorbidades metabólicas, recomenda-se a redução de peso corporal (CONITEC, 2019). Essa redução de massa corporal propiciada pela modificação de estilo de vida, especialmente a prática de atividade física e alimentação saudável, é capaz de melhorar a RI, diminuir a quantidade de androgênios, atenuar o hirsutismo, e, em alguns casos, restaurar a ovulação (MAHAN E RAYMOND, 2018).
Por isso, a escolha da alimentação como abordagem principal nesse trabalho é de extrema importância. Intervenções alimentares apropriadas nestas mulheres baseadas em ingestão energética adequada e conteúdo adequado de macronutrientes não apenas melhoram os distúrbios metabólicos, mas também podem contribuir para a normalização da hiperandrogenia (KOWALIK; RACHON, 2014). A fim de conscientizar, minimizar os sintomas clínicos e melhorar a qualidade de vida dessas mulheres, serão apresentadas, de forma simplificada e acessível, as principais estratégias nutricionais que estão sendo estudadas como primeira linha de tratamento.
Sendo assim, os objetivos deste trabalho foram avaliar a contribuição da alimentação na qualidade de vida em mulheres com síndrome dos ovários policísticos, avaliar, em mulheres com síndrome do ovário policístico, a influência dos hábitos alimentares, no desenvolvimento e tratamento da doença, na qualidade de vida, no controle dos sintomas e no controle de comorbidades associadas.
MATERIAIS E MÉTODOS
Trata-se de estudo elaborado a partir da revisão de publicações de artigos, protocolos e orientações clínicas referentes ao distúrbio da Síndrome dos Ovários Policísticos. A busca bibliográfica foi realizada nas bases de dados PubMed, SciELO, e em sites e publicações do Ministério da Saúde e Federação Brasileira das Associações de Ginecologia e Obstetrícia. Foram selecionados artigos publicados entre 2010 e 2020, nos idiomas inglês e português. As palavras-chave utilizadas foram “síndrome do ovário policístico”, “hábitos alimentares” “resistência insulínica”, e seus equivalentes em inglês “ovarian polycystic syndrome”, e “insuline resistance”.
RESULTADOS E DISCUSSÃO
Um total de 107 publicações foram identificadas nas bases de dados pesquisadas. Após analisar títulos e resumos, 29 foram excluídas por discordância do assunto. Os 78 restantes foram examinados para avaliar sua elegibilidade, e entre eles, 15 foram excluídos por não corresponderem à discussão proposta por este trabalho.
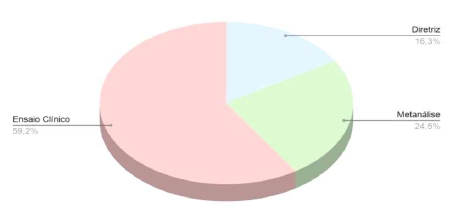
Para a montagem dessa revisão, foram utilizados 63 artigos, dentre os quais diretrizes nacionais e internacionais. Somente 12 artigos dentre os selecionados se tratavam de revisão de literatura, e 8 se tratavam de diretrizes nacionais e internacionais; todos os demais foram oriundos de ensaios clínicos.
O gráfico 1 mostra o percentual das diferentes abordagens de estudo utilizadas:
Gráfico 1 – Percentual dos tipos de estudo utilizados para esta revisão.
Para a discussão da mudança no estilo de vida e impacto da alimentação, foram selecionados 48 artigos que faziam parte da temática. Esses artigos analisaram ou revisaram dados sobre aproximadamente 48.391 mulheres, a maioria portadoras de SOP: 38 foram realizados somente com mulheres com SOP, 6 foram realizados utilizando mulheres sem SOP para o grupo controle e 5 deles não se aplicam a nenhum desses critérios.
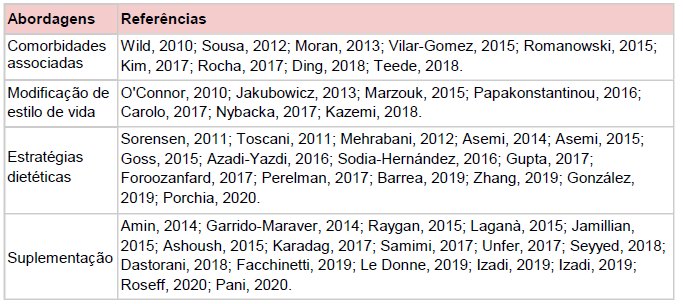
Dentre os artigos discutidos, foram identificadas diferentes abordagens, as quais se destacam: estratégia dietética, modificação de estilo de vida, comorbidades associadas e suplementação. Os temas principais e suas respectivas referências podem ser vistos na Tabela 1:
Tabela 1 – Principais temas e suas referências.
A partir dos temas principais, nas tabelas seguintes foram apresentados os temas mais específicos discutidos neste artigo.
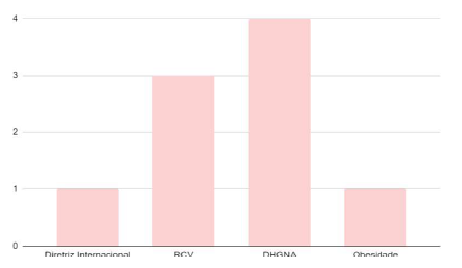
A quantidade de publicações que tinha como objetivo analisar as diferentes comorbidades que associadas à SOP pode ser consultada no Gráfico 2, assim como qual das comorbidades foi tema do estudo:
Gráfico 2 – Estudos que abordaram comorbidades associadas à doença.
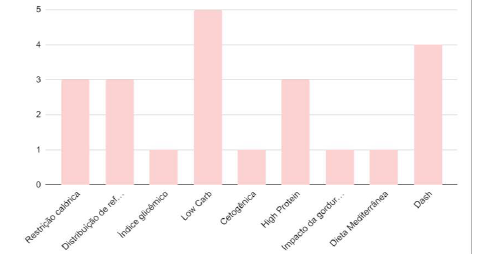
No Gráfico 3 foram incluídos os artigos referentes à pesquisa sobre os impactos da modificação de estilo de vida e suas diferentes abordagens dietéticas. Os variados temas podem ser conferidos abaixo:
Gráfico 3 – Estudos que abordaram intervenções dietéticas.
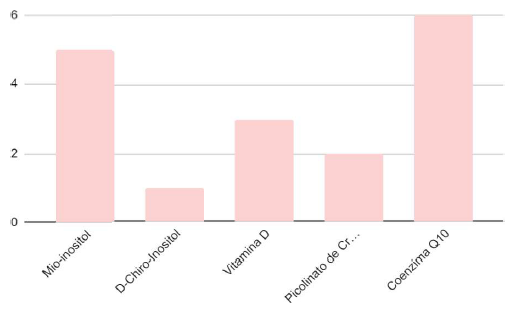
A última abordagem desse estudo se referiu à pesquisas sobre utilização de diferentes tipos de suplementação por portadoras de SOP, como pode ser visualizado abaixo no Gráfico 4:
Gráfico 4 – Estudos que abordaram suplementação.
No que se refere à massa corporal, nos ensaios clínicos com mulheres com SOP foi visto que em 12 deles o IMC médio indicou que as participantes possuíam sobrepeso ou obesidade, 2 foram realizados em mulheres com IMC eutrófico e em 35 deles o IMC não foi utilizado como critério de seleção.
Entre os 9 artigos que analisaram as comorbidades associadas, 4 se tratavam de doença hepática gordurosa não alcoólica (DHGNA), e 3 de riscos cardiovasculares (RCV) e 1 de obesidade e 1 se tratou de análise de diferentes comorbidades.
Tratando especificamente de mudança de estilo de vida como tratamento para SOP, 7 ensaios clínicos analisaram o impacto de restrição calórica e/ou redistribuição de refeições nas mulheres participantes, e incentivo de exercício físico. Todos verificaram o impacto da mudança de hábitos alimentares e de estilo de vida em sintomas clínicos e exames bioquímicos das mulheres portadoras de SOP. Dos 15 estudos em que a principal abordagem foi dietética, foram revisadas as seguintes estratégias: restrição de carboidratos (Low Carb), abordagem dietética DASH (Dietary Approaches to Stop Hypertension), dieta com alta proteína (High Protein), dieta mediterrânea, dieta cetogênica, controle do índice glicêmico e impacto da gordura saturada.
Foram 17 os artigos selecionados sobre suplementação, sendo distintos os temas abordados. Dentre eles, 6 analisaram o uso da Coenzima Q10 (CoQ10) no controle de comorbidades associadas à SOP, 6 verificaram o impacto do uso de mio-inositol associado ou não a outros medicamentos, 3 verificaram a influência da utilização de vitamina D no controle da SOP em pacientes que possuíam deficiência da vitamina, e 2 verificaram a eficácia do picolinato de cromo na diminuição da resistência insulínica.
A fim de encontrar o tratamento que melhor atenda as pacientes com SOP, os estudos relacionados têm sido cada vez mais frequentes. Devido ao perfil metabólico quase sempre alterado nessas pacientes, o cuidado com alimentação pode ser um fator determinante para a melhora da saúde. Comportamentos relacionados a um estilo de vida saudável devem ser recomendados para todas as portadoras de SOP. A intervenção no estilo de vida deve buscar auxiliar o controle ou perda de peso corporal, especialmente em casos de excesso de peso, resistência à insulina e obesidade central. De acordo com as diretrizes internacionais, a obesidade tende a piorar a apresentação clínica da SOP, e esse controle do peso deve ser uma das principais estratégias de tratamento nesses casos (TEEDE et al, 2018).
As manifestações metabólicas associadas à SOP têm sido interesse de estudos, já que as comorbidades acometem mulheres de variados índices de massa corporal. Em um estudo observacional, foi avaliada a associação entre a SOP e o risco de doença arterial coronariana (DAC), levando em conta os fatores de risco tradicionais. A população foi selecionada aleatoriamente do National Health Insurance Research Database, obedecendo aos seguintes critérios: mulheres entre 15 e 49 anos, recém-diagnosticadas com SOP, sem histórico de DAC. Após a avaliação dos dados coletados, foi observado que não somente incidência geral de DAC como de outros distúrbios metabólicos como obesidade, hirsutismo, menstruação irregular, infertilidade, diabetes e hipertensão foram mais prevalentes nas mulheres com SOP do que no grupo controle, e que a DAC pode aumentar ainda mais nas pacientes com comorbidades associadas. Com base nesses dados, o estudo destaca a importância de intervenções preventivas para reduzir o risco de desenvolvimento de doenças cardiovasculares (DING, 2018).
Em um estudo transversal com 78 mulheres diagnosticadas com SOP, estratificadas segundo o IMC, foram avaliadas variáveis que pudessem indicar risco cardiovascular (RCV). Após coleta de dados inicial, foi verificada a média de idade de 26,3 anos, 79,5% foram classificadas como sedentárias e 68% com hiperandrogenismo,Os resultados indicaram que a presença de marcadores de RCV foi diretamente proporcional ao IMC, enquanto que os níveis de lipoproteína de alta densidade (HDL) e de globulina ligadora de hormônios sexuais (SHBG) foram inversamente proporcionais ao IMC, sugerindo que o perfil metabólico das mulheres obesas com SOP tende a ser mais desfavorável do que em mulheres que não possuem a síndrome (SOUSA, 2013). O gerenciamento do estilo de vida é recomendado para prevenção primária de doenças cardiovasculares, com associação de medicamentos se os fatores de risco persistirem (WILD, 2010).
Outra condição clínica associada frequentemente à SOP é a doença hepática gordurosa não alcoólica (DHGNA). Assim como a SOP, a DHGNA está associada à diabetes mellitus, resistência à insulina, obesidade e síndrome metabólica. Estudos demonstram que a DHGNA em mulheres não obesas é mais prevalente se associada à SOP, e que a hiperandrogenemia pode ser um fator de risco para não obesos (KIM, 2017). Em mulheres com obesidade, a prevalência de DHGNA é maior se associada à SOP, e também à síndrome metabólica, RI e/ou hiperandrogenismo (ROMANOWSKI, 2015, ROCHA 2017). Apesar de não ser claro como a perda de peso afeta as características histológicas do fígado, foi observado em um estudo prospectivo que os participantes que foram encorajados a adotar mudança de estilo de vida com objetivo de redução de peso obtiveram melhora nas características histológicas da DHGNA. Após as 52 semanas do estudo, houve regressão da fibrose e melhora na DHGNA, com a redução de peso de cada participante variando entre 5% a 10% do peso corporal total (VILLAR- GOMEZ, 2015).
A composição da dieta ideal depende de muitos fatores, nem todas as portadoras da síndrome apresentam os mesmos sintomas clínicos e distúrbios hormonais. Porém, em um estudo de revisão, foi indicado que a perda de peso deve ser direcionada para todas as mulheres com sobrepeso e com SOP através da diminuição da ingestão de energia dietética no contexto de ingestão nutricional adequada e escolhas alimentares saudáveis, independentemente da composição da dieta (MORAN et al, 2013).
Modificações na dieta habitual e no estilo de vida podem ser muito vantajosas em qualquer estágio dos sintomas, são mudanças consideradas seguras e possuem poucos efeitos colaterais (O’CONNOR, 2010).
A redução de peso corporal por meio da restrição de energia demonstrou exercer influências positivas nos aspectos metabólicos e hormonais de mulheres portadoras de SOP (O’CONNOR, 2010). Em ensaios clínicos realizados com adolescentes classificadas com sobrepeso ou obesidade, o objetivo era avaliar os efeitos da orientação nutricional sobre os hábitos alimentares (CAROLO, 2017) e investigar o efeito da perda de peso sobre a regularidade menstrual nessas adolescentes (MARZOUK, 2015). Foram observados em ambos os estudos uma boa aderência às orientações nutricionais, e pelo menos metade das adolescentes orientadas perderam peso, por meio da mudança de estilo de vida, adoção de dietas hipocalóricas e maior fracionamento das refeições ao dia, o que resultou em diminuição significativa de circunferência da cintura (CC), apesar da diminuição não significativa de peso (CAROLO, 2017). Quanto à avaliação de regularidade menstrual, as adolescentes que seguiram a dieta orientada com restrição de energia registraram redução de peso corporal e mais episódios menstruais em comparação ao grupo controle, e também diminuição significativa de IMC, CC e pontuação de hirsutismo (MARZOUK, 2015).
Sabemos o quão difícil pode ser introduzir ou até mesmo modificar padrões alimentares no dia a dia. Então, um grupo de pesquisadores decidiu avaliar o efeito da frequência das refeições nos níveis de glicose e insulina em uma dieta de manutenção de peso. O estudo foi randomizado, cruzado, de 24 semanas, em mulheres com SOP. Seis refeições tiveram um efeito mais favorável na sensibilidade à insulina após o teste oral de tolerância à glicose em mulheres com SOP, em comparação com as três refeições isocalóricas (PAPAKONSTATINOU et al, 2016).
Além da frequência, a organização com relação à distribuição de energia ao longo do dia pode significar pequenos benefícios em mulheres com SOP. Um estudo randomizado avaliou exatamente isso: se a ingestão calórica cronometrada influência diferencialmente a resistência à insulina e o hiperandrogenismo em mulheres magras com SOP. Dois grupos foram randomizados entre duas dietas de manutenção isocalórica. Com a distribuição de horário de refeição diferente, uma concentrando a maior parte das calorias no almoço e o outro grupo no jantar, durante 90 dias. O grupo que ficou com a alta ingestão calórica no período da manhã resultou em melhores índices de sensibilidade à insulina e redução da atividade do citocromo P450c17α, que melhora o hiperandrogenismo e melhora a taxa de ovulação (JAKUBOWICZ et al, 2013). Mais uma vez, um estudo demonstrou que a mudança nos hábitos alimentares influencia significativamente a qualidade de vida em mulheres com SOP.
Em um ensaio clínico com 57 mulheres com SOP e com IMC acima de 27 kg/m², as participantes foram aleatoriamente divididas em três grupos: dieta(1), exercício(2) ou dieta e exercício(3). O grupo 1 recebeu aconselhamento nutricional para redução de 600 kcal/dia, o grupo 2 recebeu orientações para exercícios e o grupo 3 recebeu ambas as intervenções. Ao final das 16 semanas, os grupos 1 e 3 apresentaram os melhores resultados de redução de peso corporal e distúrbios metabólicos, indicando que o aconselhamento nutricional e diminuição da ingestão calórica são claramente eficazes em mulheres com SOP e com sobrepeso ou obesas (NYBACKA, 2017).
O objetivo principal dos primeiros estudos de hábitos alimentares na SOP, eram referentes à perda de massa corporal; e o interesse na composição da dieta na SOP é relativamente recente (RODRIGUES, 2009). Ainda hoje, a composição dietética mais adequada para essas pacientes permanece controversa, e mesmo as recentes diretrizes internacionais carecem de evidências ou possuem evidências limitadas sobre a composição alimentar específica para melhorar a qualidade de vida e sinais e sintomas das mulheres portadoras da síndrome (KAZEMI, 2018).
Com o objetivo de avaliar se o índice glicêmico (IG) alimentar impactaria no processo ovulatório das mulheres portadoras de SOP, um ensaio clínico se dividiu aleatoriamente em um grupo participantes que receberam uma dieta com baixo IG, e em outro grupo para receber dieta com IG normal. Foi observado que 14 de 57 dos ciclos do grupo que recebeu a dieta com baixo IG foram ovulatórios, contra 4 de 54 no grupo controle. O consumo de índice glicêmico controlado pareceu melhorar a RI, auxiliando no perfil hormonal e proporcionando o aumento da ovulação nas pacientes (SORDIA-HERNÁNDEZ, 2016).
Em uma metanálise foram analisados vinte e cinco estudos para avaliar os efeitos de uma dieta com baixos níveis de carboidratos (CHO) em relação a melhora da sensibilidade à insulina, e o efeito que o grau de sensibilidade inicial tem na redução da resistência insulínica induzida por dieta em mulheres com SOP. Foram considerados os estudos de mulheres que receberam apenas o tratamento dietético sem receber qualquer outro tipo de tratamento. Diante dos resultados, estima-se que as dietas hipocalóricas por si só podem melhorar a RI; no entanto, este efeito foi mais proeminente para sujeitos com RI severa ou dieta prescritas com baixo percentual de carboidratos, sugerindo que as dietas têm maior probabilidade de melhorar a RI nas mulheres com SOP e com RI grave (PORCHIA et al, 2020).
Em um outro projeto controlado, realizado com 30 mulheres em 8 semanas, teve como principal objetivo comparar o efeito de uma dieta baixa em carboidratos (CHO) em relação à dieta padrão, ambas para manutenção de peso. A principal descoberta neste estudo foi que a intervenção dietética onde o consumo de uma dieta para manutenção de peso baixa em CHO obteve melhorias na composição corporal e distribuição de gordura, especialmente em depósitos adiposos ectópicos, que são considerados fatores de risco para o desenvolvimento de RI. No geral, os resultados fornecem evidências substanciais de que a estratégia alimentar de redução de carboidratos pode ser benéfica para mulheres com SOP (GOWE e tal, 2013).
Em uma metanálise de ensaios clínicos randomizados que analisam os efeitos da dieta baixa em carboidratos em pacientes com SOP, os resultados demonstraram diminuição no IMC, melhora no metabolismo da glicose, no perfil lipídico e no perfil hormonal em comparação ao grupo controle. Os dados analisados indicam que a dieta baixa em carboidrato e baixa em teor de gordura pode ser recomendada para redução do IMC e da RI no tratamento da SOP (ZHANG, 2019).
Alguns estudos que utilizaram de intervenções com dieta reduzida em carboidratos concluíram que o baixo CHO resultou em perda preferencial de tecido adiposo e diminuição de peso corporal, mudanças benéficas no perfil lipídico e diminuição dos níveis de insulina, se comparados a dieta normoglicídica utilizada pelo grupo controle (GOSS, 2015; PERELMAN, 2017).
Outra estratégia bastante utilizada como paliativa ao tratamento medicamentoso tem sido a dieta cetogênica, que consiste em uma dieta rica em gordura, proteína adequada e baixo teor de carboidratos. A revisão teve como objetivo atualizar as perspectivas da estratégia em doenças endócrinas. Nas mulheres com SOP, baixo teor de carboidratos são evidenciados por melhorias no peso corporal, porcentagem de testosterona livre, razão de LH/FSH e níveis de insulina em jejum. Isso leva à diminuição da secreção de andrógenos e aumento de SHBG, melhorando a sensibilidade à insulina e, assim, contribuindo para a normalização das funções endócrinas (GUPTA et al, 2017).
Estudos têm sugerido que dietas com baixo teor de carboidratos e alto teor de proteínas possuem vantagens metabólicas que contribuem na perda de peso corporal e na diminuição da resistência à insulina. Com o objetivo de comparar o efeito das dietas ricas em proteínas com dietas normoproteicas, um estudo foi conduzido por 6 meses, onde as mulheres foram divididas em um grupo com proteína alta, e um grupo controle. Ambos os grupos receberam aconselhamento dietético mensal, e dietas sem restrição calórica. Ao final do estudo, foram constatadas mudanças corporais e metabólicas mais favoráveis no grupo que fez a dieta com proteína elevada, do que no grupo controle, confirmando que a maior oferta de proteína parece proporcionar um melhor tratamento para mulheres com SOP (SORENSEN et al, 2011).
Já em outro estudo realizado com mulheres do sul do Brasil, a estratégia utilizada foi de oferecer dietas hipocalóricas para dois grupos: um grupo recebeu uma dieta rica em proteínas, e o outro recebeu uma dieta normoproteica. Houve a diminuição significativa do peso corporal, IMC, e testosterona total em ambos os grupos. A conclusão foi de que a redução de calorias, e não a proteína ofertada, contribuiu para a composição corporal e o perfil hormonal neste estudo de curto prazo (TOSCANI et al, 2011).
Apesar dos trabalhos sugerirem que as dietas hipocalóricas por si só já trazem benefícios como a redução de peso e redução dos níveis de androgênio, em mulheres com sobrepeso e obesas, em grande parte dos estudos, é importante ressaltar que a combinação de alimentos com alta proteína e baixa carga glicêmica pode causar um aumento significativo na sensibilidade à insulina e uma diminuição no nível de proteína C reativa quando comparada com uma dieta convencional (MEHRABANI et al, 2013).
O estado de saúde, assim como marcadores inflamatórios em mulheres com SOP pode variar bastante. Observar a rotina dessas mulheres assim como traçar recordatórios alimentares, pode ser o início de um tratamento não medicamentoso e muito eficaz, já que determinados alimentos pró-inflamatórios podem comprometer de maneira negativa um quadro não grave. Entre esses alimentos, podemos mencionar a gordura saturada, que promove inflamação mediada por lipopolissacarídeo (LPS) e RI. Mulheres que apresentam SOP por sua vez já se encontram em um estado próoxidante e pró-inflamatório. A ingestão de gordura saturada, em particular, promove alterações no microbioma intestinal em relação ao observado na obesidade e aumenta a permeabilidade intestinal a nível de LPS, um componente solúvel em gordura, abundante na membrana externa das bactérias gram-negativas relacionadas ao intestino. Na verdade, níveis elevados de LPS circulante têm sido observados na obesidade e estão associados a componentes da síndrome metabólica. Na SOP, a inflamação provocada pela ingestão de gordura saturada pode aumentar diretamente o hiperandrogenismo, e o aumento dos níveis circulantes de LPS foram maiores em mulheres obesas quando a SOP estava presente (GONZÁLEZ et al, 2018).
Indo na contramão das dietas ocidentais tradicionais, ricas em gorduras saturadas, que fazem parte da realidade da maioria das pessoas, encontramos a dieta mediterrânea. A dieta mediterrânea consiste em um padrão alimentar anti- inflamatório, rica em carboidratos complexos e fibras, e rica em gordura monoinsaturada. Dentre as diferentes estratégias nutricionais, a dieta mediterrânea é comumente reconhecida como um padrão alimentar promotor da saúde devido às suas características peculiares, incluindo o consumo regular de gorduras insaturadas, carboidratos de baixo índice glicêmico, fibras, vitaminas, antioxidantes e uma quantidade moderada de proteínas derivadas de animais. É claro que um padrão alimentar baseado nesses alimentos pode favorecer a todos. No entanto, não existem evidências robustas na literatura sobre a associação entre a adesão à dieta mediterrânea e a gravidade da SOP (BARREA et al, 2019).
Foi realizado um estudo randomizado e controlado para avaliar a intervenção da Dieta Para Combater a Hipertensão (DASH) em mulheres com sobrepeso ou obesas e com SOP e seus efeitos nos perfis metabólicos das pacientes. Ambos os grupos receberam dietas equicalóricas, com proporção de macronutrientes aproximadas; entretanto, a dieta DASH foi desenvolvida para ser rica em frutas, vegetais, grãos inteiros, laticínios com baixo teor de gordura, bem como pobre em gorduras saturadas, colesterol, grãos refinados e doces. (AZADI- YAZDI, 2016). Foram observados resultados satisfatórios no grupo de intervenção, com redução significativa do IMC, melhora no perfil hormonal e no metabolismo da glicose. Muitos mecanismos podem explicar o efeito favorável da dieta DASH em indivíduos com SOP, como a menor ingestão de açúcar simples e maior ingestão de fibras, arginina, vitamina C, magnésio e cálcio (FOROOZANFORD et al, 2017).
É sabido que a maioria dos benefícios dos efeitos da dieta DASH são mediados por seu efeito no peso. No entanto, quando controlamos a perda de peso, descobrimos que o efeito da dieta DASH na sensibilidade à insulina permaneceu significativo, indicando que o efeito da dieta DASH na resistência à insulina foi independente de seu efeito no peso corporal (ASEMI et al, 2015). A dieta DASH também contém grandes quantidades de alimentos ricos em arginina, incluindo peixe, soja, feijão, lentilhas, grãos inteiros e nozes, salsa e manjericão fresco. Essa concentração de arginina em quantidade mais elevada pode ser atribuída na participação de nutrientes para promover ganho de músculo em vez de gordura, e pode, por sua vez, fornecer um tratamento útil para melhorar o perfil metabólico. O alto teor de arginina da dieta DASH pode explicar seus efeitos benéficos na resistência à insulina e nos níveis de triglicerídeos séricos (ASEMI et.al, 2014).
Em termos de suplementação, é comum associar alguns nomes ao tratamento da SOP, como é o caso dos produtos à base de inositol. O inositol é um importante constituinte celular, está presente em diferentes processos bioquímicos, e é encontrado de modo mais abundante na forma de mio-inositol. O mio-inositol (MI) pode ser convertido em D quiro-inositol (DCI), dependendo das necessidades específicas do tecido requisitante. Diferentes tecidos demandam diferentes taxas de conversão, e apresentam diferentes relações MI/ DCI: nos ovários, por exemplo, a relação é de 100:1 (UNFER, 2017). O recomendado é que, em caso de necessidade, seja suplementado MI em combinação com DCI na proporção de 40:1 (ROSEFF, 2020), mas outras investigações podem ser necessárias. Há evidências de que a taxa de conversão é prejudicada em pacientes com SOP, e ainda pior se associada à diabetes, aumentando a RI e a hiperinsulinemia compensatória (LAGANÀ, 2015). A administração de DCI com MI pode ter um efeito benéfico maior quando essa taxa é prejudicada em tecidos resistentes à insulina, mas, diferente dos outros tecidos, os ovários nunca se tornam resistentes. A partir disso, foi especulado que pacientes com SOP e com hiperinsulinemia poderiam ter conversão acelerada de MI para DCI, ocasionando em uma superprodução de DCI, e deficiência de MI. Por isso existe a hipótese de que apenas o MI teria um efeito benéfico sobre os ovários (UNFER, 2017).
Um ensaio clínico randomizado buscou avaliar se o tratamento com DCI seria efetivo na síndrome: 48 mulheres com SOP, com características biofísicas homogêneas e irregularidades menstruais foram submetidas ao tratamento com suplementação de 1g de DCI e 400 µg de ácido fólico por via oral, durante 6 meses. As avaliações clínicas e bioquímicas evidenciaram redução da pressão arterial sistólica, relação LH/FSH, testosterona total, testosterona livre, androstenediona, prolactina e índice HOMA e o aumento significativo do SHGB e da razão glicemia/insulinemia. Além disso, houve a regularização do ciclo menstrual pós tratamento. Sendo assim, o DCI se mostrou eficaz na melhora da função ovariana e do metabolismo nas mulheres afetadas pela SOP (LAGANÀ, 2015). Mais estudos são necessários para confirmar a eficácia da suplementação individual de DCI na função ovariana.
Um estudo randomizado com 27 mulheres com SOP e com diagnóstico de sobrepeso ou obesidade avaliou os efeitos do tratamento de MI na função ovariana e composição corporal. As pacientes foram divididas em 3 grupos e receberam as seguintes orientações: o primeiro recebeu exclusivamente orientação dietética, o segundo recebeu dieta e 1000mg/dia de metformina, e o terceiro foi tratado com dieta, 500mg/dia de metformina, 4g de mio-inositol e 400µg de ácido fólico. O tratamento teve duração de 3 meses, e ao final foi constatada redução de peso corporal, IMC e CC nos três grupos, sendo a perda de peso maior nos grupos que receberam metformina. A regularidade menstrual somente foi observada no terceiro grupo, o qual foi adicionado ao tratamento a suplementação com mio- inositol (LE DONNE, 2012).
Mais uma vez com objetivo de avaliar o desempenho do meio inositol sozinho ou associado a outros tratamentos no controle da SOP, uma metanálise selecionou para revisão apenas ensaios clínicos randomizados. Nos nove estudos selecionados, 247 mulheres receberam MI sozinho ou combinado com DCI ou ácido fólico, e 249 mulheres receberam outros tratamentos, como DCI, ácido fólico ou AHC. Diminuições significativas na insulina em jejum e no índice HOMA foram identificados após a suplementação de MI, assim como uma pequena redução nos níveis de testosterona, em comparação aos outros tratamentos. Não houve mudança significativa nos níveis circulantes de androstenediona. Houve aumento significativo dos níveis séricos de SHBG nos ensaios que suplementam MI por pelo menos 24 semanas, e em geral os resultados demonstraram efeito benéfico do uso de MI no perfil endócrino e metabólico das mulheres avaliadas (UNFER,2017). Até o momento, os dados avaliados confirmam a hipótese do mio inositol ter um papel fundamental no bom funcionamento das funções ovarianas, regulando o ciclo menstrual, a ovulação e contribuindo para a fertilidade.
Dessa vez buscando traçar o desenvolvimento da alteração glicêmica em mulheres com SOP, uma metanálise avaliou diversas estratégias medicamentosas e de mudanças de estilo de vida no tratamento da SOP e constatou que, nessas mulheres, a suplementação de MI foi a melhor associada à menores níveis de insulina, glicose e RI, quando comparada com placebo, metformina e estrogênio (PANI, 2020). Em outra revisão de literatura, foram comparados os efeitos do tratamento com metformina ou com mio-inositol nas mulheres com SOP, e o resultado de ambas as linhas se mostrou similar tanto nos marcadores bioquímicos quanto no perfil metabólico. Porém, houveram fortes evidências de risco de efeitos adversos aumentados nas pacientes que fizeram uso da metformina, em comparação com as que receberam mio-inositol (FACCHINETTI, 2019).
Outra suplementação bastante estudada é a vitamina D. A sua deficiência pode estar associada ao desenvolvimento de RI, impactar negativamente no perfil metabólico, aumentar a gordura visceral e diminuir a chance de gravidez em mulheres com diagnóstico de SOP (DASTORANI, 2018; SEYYED, 2018)
Um estudo controlado por placebo foi realizado em mulheres com SOP e deficiência de vitamina D, candidatas à fertilização in vitro. As participantes receberam 50.000 UI de vitamina D ou placebo a cada duas semanas, por 8 semanas. O grupo que recebeu a suplementação teve melhora no metabolismo da insulina e do perfil lipídico (DASTORANI, 2018). Outro ensaio clínico randomizado e controlado por placebo, também em mulheres com SOP e deficiência de vitamina D, utilizou a dose oral de 50.000 UI de suplementação, uma vez por semana, por 8 semanas. O grupo de intervenção também apresentou melhora na resistência à insulina e gordura visceral em comparação ao grupo controle (SEYYED, 2017).
Com o objetivo de identificar se a suplementação de vitamina D possui um papel realmente relevante na SOP, um estudo prospectivo comparou os efeitos da suplementação em um grupo composto por indivíduos com SOP, e um grupo controle composto por indivíduos sem SOP, ambos os grupos com deficiência de vitamina D. Todos os participantes receberam 50.000 UI por semana de suplementação oral, durante 8 semanas, e 1.500 UI por dia durante 4 semanas. Ao final do estudo, foi observado que o grupo SOP aumentou significativamente a sensibilidade à insulina e diminui os níveis de androgênio, enquanto no grupo controle não houve nenhuma alteração significativa, confirmando um possível papel importante da vitamina D em mulheres com SOP (KARADAG, 2017). Porém, como avaliado anteriormente, a suplementação de vitamina D nessas pacientes só parece ser significativa caso haja deficiência nos níveis séricos da vitamina.
O picolinato de cromo foi outra suplementação que demonstrou exercer influência no aumento da sensibilidade à insulina. Em um estudo prospectivo, 64 mulheres foram selecionadas aleatoriamente para receber 200 µg de suplemento de picolinato de cromo ou placebo por 8 semanas. Ao final do estudo, a suplementação teve efeitos favoráveis sobre os marcadores do metabolismo da insulina e perfil lipídico das mulheres (JAMILIAN, 2015).
Um segundo ensaio clínico, também duplo-cego randomizado e controlado por placebo, corroborou com o resultado apresentado anteriormente. Dessa vez, as participantes selecionadas foram divididas em dois grupos, e receberam 1000 μg de picolinato de cromo ou placebo durante 6 meses. Também foram acompanhados mensalmente para encorajamento de mudança de hábitos alimentares e planos de exercícios físicos. Ao final dos 6 meses, o uso da suplementação foi associado à redução significativa do IMC e insulina sérica em jejum, aumento significativo nas chances de ovulação e menstruação regular (ASHOUSH, 2015). O uso de picolinato de cromo se mostrou interessante como estratégia para auxiliar a redução da resistência à insulina em ambos os estudos.
A Coenzima Q10 (CoQ10) é conhecida por seu papel fundamental na bioenergética mitocondrial, por sua presença em membranas celulares e no plasma sanguíneo, e seu papel antioxidante. O tratamento oral com CoQ10 não causa efeitos adversos graves em humanos, e tem sido utilizado como energizante mitocondrial e estratégia antioxidante em diversas doenças (GARRIDO- MARAVER, 2014).
Muito se tem estudado sobre um possível efeito benéfico da suplementação de CoQ10 no metabolismo de pacientes com síndrome metabólica e diabetes mellitus 2 (RAYGAN, 2015; AMIN, 2014), o que justifica o crescente interesse em abordagens que avaliem o impacto desse suplemento em relação à SOP.
Nesse ensaio clínico randomizado, duplo-cego e controlado por placebo, 60 mulheres portadoras de SOP, entre 18 e 40 anos, classificadas com sobrepeso ou obesidade, foram divididas entre o grupo que recebeu a suplementação diária de 100 mg de coenzima Q10, e o grupo controle. O estudo durou 12 semanas, e marcadores do metabolismo da insulina e perfil lipídico foram avaliados na primeira e última semana após a intervenção. Em comparação ao grupo controle, os indivíduos que receberam suplementos de CoQ10 diminuem significativamente a glicose plasmática em jejum, níveis séricos de insulina, HOMA-IR, HOMA-B, níveis séricos de colesterol total e LDL; sugerindo que a suplementação de CoQ10 provocou efeitos benéficos no metabolismo da glicose, e nos níveis séricos de colesterol total e LDL (SAMIMI, 2017).
Outros dois ensaios mediram os efeitos da suplementação de CoQ10 sozinha ou em combinação com vitamina E, em comparação com o placebo. A todas as pacientes foi orientado o uso de 1500mg de metformina diário, independente do grupo ao qual foram designados. Participaram do ensaio clínico mulheres com idade entre 20 e 40 anos, e IMC classificado como sobrepeso ou obesidade grau I. Os resultados demonstraram que a suplementação de CoQ10, sozinha ou em combinação com a vitamina E, teve efeitos significativos sobre a glicemia em jejum, reduzindo significativamente o índice HOMA-IR (IZADI, 2019). Também levaram à diminuição dos níveis séricos da testosterona total, e dos triglicerídeos. Apenas a co-suplementação melhorou significativamente os níveis da globulina ligadora de hormônio sexual (SHBG), e também apenas combinação resultou em uma redução significativa do colesterol total, do LDL, e aumento do HDL (IZADI, 2019).
CONCLUSÃO
O desenvolvimento da presente revisão nos possibilitou discorrer mais sobre diversos temas dentro do principal assunto abordado. A SOP é uma síndrome multifatorial que pode acarretar em diferentes comorbidades metabólicas, dependendo da individualidade da mulher, como vimos ao decorrer do estudo. Resistência à insulina, sobrepeso e obesidade, são as principais queixas dessas mulheres.
A alimentação pode ser considerada uma das alternativas mais eficazes aliada ao tratamento medicamentoso para melhora do quadro nas mulheres que apresentam a síndrome. Entre todas as estratégias exploradas nesta revisão, a restrição calórica é a que mais destaca nos estudos, obtendo a melhora nos fatores bioquímicos e de perda de peso.
A distribuição dos macronutrientes em horários estratégicos, assim como o fracionamento das refeições, também mostraram algum benefício, pois o objetivo principal era avaliar se havia ou não relação entre a melhora da sensibilidade à insulina nesses pacientes, mesmo sem alterar a composição da dieta. Os dois modelos podem ser muito bem-vindos quando adotados em mulheres sedentárias que relatam maior dificuldade na mudança para um estilo de vida mais saudável.
O controle dos carboidratos em diversos estudos sugeriu melhora na RI em mulheres com SOP e com RI grave, mas não se mostrou superior a uma restrição calórica convencional. Porém, quando aplicamos a redução de carboidratos em dietas de manutenção de peso, a intervenção demonstrou melhorar a composição corporal e a distribuição de gordura, sendo assim, a redução de carboidratos pode ser uma boa estratégia para mulheres com SOP.
Quando falamos de diminuição de carboidratos e aumento da quantidade de proteínas, podemos chegar a algumas vantagens metabólicas. O aumento de proteínas indica mudanças corporais e metabólicas mais favoráveis, como diminuição de peso corporal, IMC e testosterona. Porém, mais estudos são necessários.
Os marcadores inflamatórios em mulheres com SOP devem ser observados e podem variar bastante. Alimentos com poder pró inflamatório devem ser evitados. Vimos que a gordura saturada pode ser considerada inflamatória, e, dependendo do contexto alimentar, pode causar permeabilidade a nível intestinal. Com base no estudo abordado, a ingestão de gordura saturada ajuda no aumento do hiperandrogenismo, o que justamente desejamos controlar.
Por outro lado, dietas anti-inflamatórias também foram avaliadas, como é o caso da dieta mediterrânea e dieta para combater a hipertensão (DASH). Ambas estratégias podem promover melhora no perfil metabólico, através da ingestão de maior quantidade de alimentos ricos em antioxidantes, baixo índice glicêmico, baixo consumo de gordura saturada e pobre em doces. Especialmente na dieta DASH, os estudos demonstraram redução significativa do IMC, melhora no perfil hormonal e no metabolismo da glicose das pacientes avaliadas.
Em termos de suplementação, foram destacados os que mais são utilizados no auxílio do tratamento da SOP. O inositol, por exemplo, costuma ser deficiente em mulheres com SOP, principalmente se houver prevalência de RI ou diabetes. A sua suplementação auxilia na diminuição de peso corporal, na restauração da regularidade menstrual e ovulação, e na fertilidade. Também possui a vantagem de desencadear menos efeitos colaterais do que os medicamentos comumente utilizados para a mesma finalidade.
Outra suplementação bastante estudada é a vitamina D. Sua deficiência pode impactar negativamente no perfil metabólico, aumentar a gordura visceral e diminuir a chance de gravidez em mulheres com diagnóstico de SOP. A manipulação da suplementação parece ser eficiente caso haja deficiência nos níveis séricos da vitamina. Os estudos apontam melhora significativa da sensibilidade à insulina e diminuição dos níveis de androgênio.
O picolinato de cromo também demonstrou exercer influência no aumento da sensibilidade à insulina. Da mesma forma que a Coenzima Q10, que além disso é conhecida por seu papel fundamental na bioenergética mitocondrial e por sua ação antioxidante. Os estudos mostram que o uso da suplementação melhora a RI e o perfil metabólico em mulheres que apresentam síndrome metabólica. De maneira geral, podemos dizer que todas as suplementações revisadas resultaram em melhora da resistência insulínica.
Além da mudança nos hábitos alimentares, a prática de atividade física deve ser incentivada. A redução do peso corporal em casos de sobrepeso e obesidade devem ser criteriosamente avaliados, devido sua significativa importância no controle da síndrome. Como vimos ao longo da revisão, o controle dos sintomas e a melhora na qualidade de vida através da alimentação é possível para as mulheres portadoras de SOP. As diferentes estratégias alimentares podem ser muito bem articuladas, respeitando a individualidade de cada mulher e a fase em que a SOP se encontra. Para o sucesso no tratamento, o trabalho deve ser realizado por uma equipe multiprofissional e qualificada.
REFERÊNCIAS
Amin M. M., Asaad G. F., Abdel Salam R. M., El-Abhar H. S., Arbid M. S. Novel CoQ10 antidiabetic mechanisms underlie its positive effect: modulation of insulin and adiponectin receptors, Tyrosine kinase, PI3K, glucose transporters, RAGE and visfatin in insulin resistant/diabetic rats. Rer. Plos one. v.9, n.2; p.89-96. 2014.
Asemi Z., Esmaillzadeh A. DASH Diet, Insulin Resistance, and Serum hs-CRP in Polycystic Ovary Syndrome: A Randomized Controlled Clinical Trial. Hormone and Metabolic Research. Rev. Horm Metab Res. v.47, n.3; p.232–238. 2015.
Asemi, Z., Samimi, M., Tabassi, Z., Shakeri, H., Sabihi, S. S., Esmaillzadeh, A. Effects of DASH diet on lipid profiles and biomarkers of oxidative stress in overweight and obese women with polycystic ovary syndrome: a randomized clinical trial. Nutrition. v.30, n.11-12; p.1287–1293; 2014.
Ashoush S., Abou-Gamrah A., Bayoumy H., Othman N. Chromium picolinate reduces insulin resistance in polycystic ovary syndrome: Randomized controlled trial. J Obstet Gynaecol Res; v.42, n.3; p.279-285. 2016.
Azadi-Yazdi M., Karimi-Zarchi M., Salehi-Abargouei A., Fallahzadeh H., Nadjarzadeh A. Effects of Dietary Approach to Stop Hypertension diet on androgens, antioxidant status and body composition in overweight and obese women with polycystic ovary syndrome: a randomised controlled trial. J Hum Nutr Diet. v.30, n.3; p.275-283. 2017.
Barrea L., Arnone A., Annunziata G., Muscogiuri G., Laudisio D., Salzano C., Pugliese G., Colao A., Savastano S. Adherence to the Mediterranean Diet, Dietary Patterns and Body Composition in Women with Polycystic Ovary Syndrome (PCOS). Nutrients. v.11, n.10; p. 2278. 2019.
Calixto, C., Domingues T., Cândido A. L., Rodrigues A. M., Santos L., Ferreira A. Estado nutricional e consumo alimentar de pacientes portadoras de síndrome de ovários policísticos. Rev. Mineira de Enfermagem. v.16, n.2; p.159-165. 2012.
Carolo, A. L., Mendes M. C., Silva A. C.,Sales C., Silva M. F., Alberto R., Reis R. M. Aconselhamento nutricional promove mudanças nos hábitos alimentares de adolescentes com sobrepeso e obesos com síndrome dos ovários policísticos. Bras. Ginecol. Obstet. v.39, n.12; p.692-696. 2017.
CONITEC – Protocolo Clínico e Diretrizes Terapêuticas para Síndrome dos Ovários Policísticos, 2019
Dastorani M., Aghadavod E., Mirhosseini N., Foroozanfard F., Zadeh Modarres S., Amiri S. M., Asemi Z. The effects of vitamin D supplementation on metabolic profiles and gene expression of insulin and lipid metabolism in infertile polycystic ovary syndrome candidates for in vitro fertilization. Reprod Biol Endocrinol. v.16, n.1; p.94. 2018.
De Melo A. S., Dias S. V., Cavalli R. C., Cardoso V. C., Bettiol H., Barbieri M. A., Vieira C. S. Pathogenesis of polycystic ovary syndrome: multifactorial assessment from the foetal stage to menopause. Reproduction. v.150, n.1; p.11–24. 2015.
Ding D. C., Tsai I. J., Wang J. H., Lin S. Z., Sung F. C. Coronary artery disease risk in young women with polycystic ovary syndrome. Res. Oncotarget. v.9, n.9; p.8756-8764. 2018
El Hayek S., Bitar L., Hamdar L. H., Mirza F. G., Daoud G. Polycystic Ovarian Syndrome: An Updated Overview. J. Frontiers in Physiology. v.7; p.124-174. 2016.
Facchinetti F., Orrù B., Grandi G., Unfer V. Short-term effects of metformin and myo-inositol in women with polycystic ovarian syndrome (PCOS): a meta-analysis of randomized clinical trials. Gynecol Endocrinol. v.35, n.3; p.198-206. 2019.
Franciane R. F., Laís S. G., Eliane R. F., Vivian S. S. G., Roberta S. C., Sylvia C. C. F., Silvia E. P. Síndrome do ovário policístico e fatores relacionados em adolescentes de 15 a 18 anos. Rev. Associação Médica brasileira. v.59, n.4; p.341-346. 2013.
Foroozanfard F., Rafiei H., Samimi M., Gilasi HR., Gorjizadeh R., Heidar Z., Asemi
Z. The effects of dietary approaches to stop hypertension diet on weight loss, anti- Müllerian hormone and metabolic profiles in women with polycystic ovary syndrome: A randomized clinical trial. Clin Endocrinol (Oxf). v.87, n.1; p.51-58. 2017.
Garrido-Maraver J., Cordero MD., Oropesa-Avila M., Vega A. F., de la Mata M., Pavon A. D., Alcocer-Gomez E., Calero C. P., Paz M. V., Alanis M., de Lavera I., Cotan D., Sanchez-Alcazar J. A. Clinical applications of coenzyme Q10. Rer. Front Biosci. v.19; p.619-633. 2014.
González F., Considine R., Abdelhadi O., Acton A. Saturated Fat Ingestion Promotes Lipopolysaccharide-Mediated Inflammation and Insulin Resistance in Polycystic Ovary Syndrome. The Journal of Clinical Endocrinology & Metabolism. v.104, n.4 p 934–946. 2019.
Goss A. M., Chandler-Laney P. C., Ovalle F., Goree L. L., Azziz R., Desmond R. A., Wright B. G., Gower B. A. Effects of a eucaloric reduced-carbohydrate diet on body composition and fat distribution in women with PCOS. Metabolism. v.63, n.10; p.1257-1264. 2014.
Gupta L., Khandelwal D., Kalra S., Gupta P., Dutta D., Aggarwal S. Ketogenic diet in endocrine disorders: Current perspectives. J Postgrad Med. v..63, n.4; p.242- 251; 2017.
Izadi A., Ebrahimi S., Shirazi S., Taghizadeh S., Parizad M., Farzadi L., Gargari B.
P. Hormonal and Metabolic Effects of Coenzyme Q10 and/or Vitamin E in Patients With Polycystic Ovary Syndrome. J Clin Endocrinol Metab. v.10, n.2; p.319-327. 2019.
Izadi A., Shirazi S., Taghizadeh S., Gargari BP. Independent and Additive Effects of Coenzyme Q10 and Vitamin E on Cardiometabolic Outcomes and Visceral Adiposity in Women With Polycystic Ovary Syndrome. J Arch Med Res. v.50, n.2; p.1-10. 2019.
Jamilian M., Asemi Z. Chromium Supplementation and the Effects on Metabolic Status in Women with Polycystic Ovary Syndrome: A Randomized, Double-Blind, Placebo-Controlled Trial. Ann Nutr Metab. v.67, n.1; p.42-48. 2015.
Kamangar F., Okhovat J.-P., Schmidt T., Beshay A., Pasch L., Cedars M. I., Shinkai
K. Polycystic Ovary Syndrome: Special Diagnostic and Therapeutic Considerations for Children. Pediatric Dermatology. v.32, n.5; p.571–578. 2015.
Karadağ C., Yoldemir T., Yavuz DG. Effects of vitamin D supplementation on insulin sensitivity and androgen levels in vitamin-D-deficient polycystic ovary syndrome patients. J Obstet Gynaecol Res. v.44, n.2; p.270-277. 2018.
Kazemi M., McBreairty LE., Chizen DR., Pierson RA., Chilibeck PD., Zello GA. A Comparison of a Pulse-Based Diet and the Therapeutic Lifestyle Changes Diet in Combination with Exercise and Health Counselling on the Cardio-Metabolic Risk Profile in Women with Polycystic Ovary Syndrome: A Randomized Controlled Trial. Nutrients. v.10, n.10. p.1387; 2018
Kim JJ., Kim D., Yim JY., Kang JH., Han KH., Kim SM., Hwang KR., Ku 37
SY., Suh CS., Kim SH., Choi YM. Polycystic ovary syndrome with hyperandrogenism as a risk factor for non-obese non-alcoholic fatty liver disease. Rev. Aliment Pharmacol Ther. v.45, n.11; p.1403-1412. 2017.
Laganà A.S., Barbaro L., Pizzo A. Evaluation of ovarian function and metabolic factors in women affected by polycystic ovary syndrome after treatment with D- Chiro-Inositol. Arch Gynecol Obstet. v.291, n.5; p.1181-1186. 2015.
Le Donne M., Metro D., Alibrandi A., Papa M., Benvenga S. Effects of three treatment modalities (diet, myoinositol or myoinositol associated with D-chiro- inositol) on clinical and body composition outcomes in women with polycystic ovary syndrome. Eur Rev Med Pharmacol Sci. v.23, n.5; p.2293-2301. 2019.
Legro R. S., Silva A. A., Ehrmann D. A., Hoeger M. K., Murad H. M., Pasquali R., Welt K. C. Diagnostic and treatment of polycystic ovary syndrome: An Endrocrine Society practice guideline. The journal of clinical Endrocrinology & Metabolism. v.98, n.12; p.4565-4592. 2013.
MAHAN L.K. e RAYMOND, J.L. Krause – Alimentos, Nutrição e Dietoterapia.14ª Edição, Ed. Elsevier, 2018. p.626
Marcondes J. A. M., Barcellos C. R. G., Rocha M. P. Dificuldades e armadilhas no diagnóstico da síndrome dos ovários policísticos. Arq Bras Endocrinol Metab. v.55, n.1; p.6-15. 2011.
Marzouk TM., Sayed A. WA. Effect of Dietary Weight Loss on Menstrual Regularity in Obese Young Adult Women with Polycystic Ovary Syndrome. Rev. J Pediatr Adolesc Gynecol. v.28, n.6; p.457-461. 2015.
Mehrabani HH., Salehpour S., Amiri Z., Farahani SJ., Meyer BJ., Tahbaz F. Beneficial effects of a high-protein, low-glycemic-load hypocaloric diet in overweight and obese women with polycystic ovary syndrome: a randomized controlled intervention study. Rev. J Am Coll Nutr. v.31, n.2; p.117-125. 2012.
Moran L. J., Ko H., Misso M., Marsh K., Noakes M., Talbot M., Frearson M., Thondan M., Stepto N., Teede H. J. Dietary composition in the treatment of polycystic ovary syndrome: a systematic review to inform evidence-based guidelines. J Acad Nutr Diet. v.113, n.4; p.520-545. 2013.
Naderpoor N. S.S., Courten B., Misso M. L., Moran L. J., Teede H. J. Metformin and lifestyle modification in polycystic ovary syndrome: systematic review and meta- analysis. Human reproduction update. v.21, n.5; p.560-574. 2015.
Nybacka Å., Hellström P. M., Hirschberg A. L. Increased fibre and reduced trans fatty acid intake are primary predictors of metabolic improvement in overweight polycystic ovary syndrome-Substudy of randomized trial between diet, exercise and diet plus exercise for weight control. Rev. Clin Endocrinol. v.87, n.6; p.680-688. 2017.
O’Connor A., Gibney J., Roche H. M. Metabolic and hormonal aspects of polycystic ovary syndrome: the impact of diet. Proc Nutr Soc. v.69; p.628–635. 2010.
Pani A., Gironi I., Di Vieste G., Mion E., Bertuzzi F., Pintaudi B. From Prediabetes to Type 2 Diabetes Mellitus in Women with Polycystic Ovary Syndrome: Lifestyle and Pharmacological Management. Int J Endocrinol. v.2020. 2020.
Papakonstantinou E., Kechíibaíi I., Mitíou P., ľíakakis E., Vassiliadi D., Geoígousopoulou E., Zampelas A., Kontogianni M. D., Dimitíiadis G. Effect of meal frequency on glucose and insulin levels in women with polycystic ovary syndrome: a randomized study. Eur J Clin Nutr. v.70, n.5; p.588–594; 2016.
Perelman D., Coghlan N., Lamendola C., Carter S., Abbasi F., McLaughlin T. Substituting poly- and mono-unsaturated fat for dietary carbohydrate reduces hyperinsulinemia in women with polycystic ovary syndrome. Gynecol Endocrinol. v.33, n.4; p.324-327. 2017.
Porchia L. M., Hernandez-Garcia S. C., Gonzalez-Mejia M. E., López Bayghen E. Diets with lower carbohydrate concentrations improve insulin sensitivity in women with polycystic ovary syndrome: A meta-analysis. Rev.Eur J Obstet Gynecol Reprod Biol. v.248; p.110-117. 2020.
Raygan F., Rezavandi Z., Dadkhah T. S., Farrokhian A., Asemi Z. The effects of coenzyme Q10 administration on glucose homeostasis parameters, lipid profiles, biomarkers of inflammation and oxidative stress in patients with metabolic syndrome. Rer. Eur J Nutr. v.55, n.8; p.2357-2364.2016.
Rocha A. L. L., Faria L. C., Guimarães T. C. M., Moreira G. V., Cândido A. L., Couto C. A., Reis F. M. Non-alcoholic fatty liver disease in women with polycystic ovary syndrome: systematic review and meta-analysis. Rev. J Endocrinol Invest. v. 40, n.12; p.1279-1288. 2017.
Rodrigues F., Cremonezi C., Troncon R., Wanda R., Garcia P. Metabolic and nutritional interfaces in polycystic ovary syndrome: considerations regarding obesity and dietary macronutrients. Rev Chil Nutr. v.36, n.3; p.278–284. 2009.
Romanowski M.D., Parolin M.B., Freitas A.C., Piazza M.J., Basso J., Urbanetz A.
A. Prevalence of non-alcoholic fatty liver disease in women with polycystic ovary syndrome and its correlation with metabolic syndrome. Rev. Arq Gastroenterol. v. 52, n.2; p.117-123. 2015.
Roseff S, Montenegro M. Inositol Treatment for PCOS Should Be Science-Based and Not Arbitrary. Int J Endocrinol. v.2020. 2020.
Samimi M., Zarezade M. M., Foroozanfard F., Akbaíi H., Jamilian M., Ahmadi S., Asemi Z. The effects of coenzyme Q10 supplementation on glucose metabolism and lipid profiles in women with polycystic ovary syndrome: a randomized, double- blind, placebo-controlled trial. Rer. Clin Endocrinol. v..86, n.4; p.560-566. 2017.
Seyyed A. M., Ayremlou P., Behroozi-Lak T., Nourisaeidlou S. The effect of vitamin D supplementation on insulin resistance, visceral fat and adiponectin in vitamin D deficient women with polycystic ovary syndrome: a randomized placebo-controlled trial. Gynecol Endocrinol; v.34, n.6; p.489-494. 2018.
Sirmans S. M., Kristen A. P. Epidemiology, diagnosis, and management of polycystic ovary syndrome. Clinical epidemiology. v.6; p.1-13. 2013.
Sordia-Hernández L. H., Ancer R. P., Saldivar R. D., Trejo G. S., Servín Z. E.S., Guerrero G. G., Ibarra P. R. Effect of a low glycemic diet in patients with polycystic ovary syndrome and anovulation – a randomized controlled trial. Clin Exp Obstet Gynecol. v.43, n.4; p.555-559. 2016.
Sousa R., Chein M. B., Silva D., Dutra M., Navarro P., Figueiredo J. N., Brito L. Perfil metabólico em mulheres de diferentes índices de massa corporal com síndrome dos ovários policísticos. Rev. Bras. Ginecol. Obstet. v.35, n.9, p.413- 420. 2013.
Spritzer P. M. Polycystic ovary syndrome: reviewing diagnosis and management of metabolic disturbances. Arq Bras Endocrinol Metab. v. 58, n.2; p.182-187. 2014
Stein I. F., Leventhal M.L. Amenorrhea associated with bilateral polycystic ovaries. Am J Obstet Gynecol. v.29, n.2; p.181-91. 1935.
Teede H. J., Misso M. L., Costello M. F., Dokras A., Laven J., Moran L., Piltonen T., Norman R. J. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Human reproduction. v.33, n.9; p.1602–1618. 2018.
Teede H.J., Misso M.L., Deeks A.A., Moran L.J., Stuckey B.G.A., Wong J.L.A., Norman R.J., Costello M.F. Assessment and management of polycystic ovary syndrome: summary of an evidence‐based guideline. Medical Journal of Australia. v.195, n.6; p.65-112. 2011.
Toscani M. K., Mario F. M., Radavelli-Bagatini S., Wiltgen D., Matos M. C., Spritzer
P. M. Effect of high-protein or normal-protein diet on weight loss, body composition, hormone, and metabolic profile in southern Brazilian women with polycystic ovary syndrome: a randomized study. Gynecol Endocrinol. v.27, n.11; p.925-930. 2011.
Unfer V., Facchinetti F., Orrù B., Giordani B., Nestler J. Myo-inositol effects in women with PCOS: a meta-analysis of randomized controlled trials. Endocr Connect. v.6, n.8; p.647-658. 2017.
Wild R. A., Carmina E., Diamanti-Kandarakis E., Dokras A., Escobar Morreale H. F., Futterweit W., Lobo R., Norman R. J., Talbott E., Dumesic D. A. Assessment of cardiovascular risk and prevention of cardiovascular disease in women with the polycystic ovary syndrome: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome (AE-PCOS) Society. J Clin Endocrinol Metab. v. 95, n.5; p.2038-2049. 2010.
World Health Organization. Medical Eligibility Criteria for Contraceptive Use, 5th edition. 5th ed. Geneva: World Health Organization; 2015.
Vilar G. E., Martinez P. Y., Calzadilla B. L., Torres G. A., Gra-Oramas B., Gonzalez
F. L., Friedman L. S., Diago M., Romero G. M. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. Rev. Gastroenterology. v.149, n.2; p.367-378. 2015.
Zhang X., Zheng Y., Guo Y., Lai Z. The Effect of Low Carbohydrate Diet on Polycystic Ovary Syndrome: A Meta-Analysis of Randomized Controlled Trials. Int J Endocrinol. v.2019; p.1-15. 2019.
LISTA DE ABREVIATURAS
AHC – Anticoncepcionais Hormonais
Combinados CC – Circunferência da Cintura
CHO – Carboidratos
CoQ10 – Coenzima Q10
DAC – Doenças Arterial Coronariana
DASH – Dietary Approaches to Stop
Hypertension DHGNA – Doença Hepática Gordurosa Não Alcoólica
HDL – Lipoproteína de alta densidade
HOMA – Modelo de Avaliação da Homeostase
HOMA-B – Modelo de Avaliação de Atividade das células Beta pancreáticas
HOMA-IR – Modelo de Avaliação de Resistência à Insulina
IG – Índice Glicêmico
IMC – Índice de Massa Corporal
LDL – Lipoproteína de baixa densidade
LH/FSH – Hormônio luteinizante/Folículo estimulante
LPS – Lipopolissacarídeo
NIH – National Institutes of Health
RCV – Risco Cardiovascular
RI – Resistência à Insulina
SHBG – Globulina ligadora de hormônios sexuais
SOP – Síndrome dos Ovários Policísticos
