MULTISYSTEM INFLAMMATORY SYNDROME IN PEDIATRIC PATIENTS
REGISTRO DOI: 10.5281/zenodo.10056238
Fabrícia Teixeira de Souza 1
Alana Anjos da Rocha 2
Manuela Naiane Lima Barreto 3
Marina Dantas Freire 4
Thayná Bezerra Lima 5
Maria Julia Nardelli 6
Sonia Oliveira Lima 7
Resumo
Este artigo tem por objetivo realizar uma revisão sistemática médica vigente sobre a síndrome inflamatória multissistêmica em pacientes pediátricos, conhecida como SIM-P, é uma condição rara, mas grave, que tem sido associada à infecção prévia por COVID-19 em crianças e adolescentes. Este estudo aborda essa síndrome, seus principais sintomas, diagnóstico e tratamento. A metodologia consistiu em busca de dados nas bases eletrônicas PubMed, Scielo, BVS, UpToDate, Boletins Epidemiológicos Especiais e Protocolos internacionais e nacionais. Discute-se a importância do reconhecimento precoce, uma vez que a SIM-P pode levar a complicações graves. O artigo destaca a necessidade contínua de pesquisa para melhor compreender essa condição e seu impacto na saúde pediátrica.
Palavras-chave: Síndrome Inflamatória Multissistêmica. Pacientes Pediátricos. COVID-19. SIM-P.
1 INTRODUÇÃO
Reportando para dezembro de 2019, a comunidade médica chinesa entrou em alerta com um número crescente de casos de pneumonia infectada pelo Coronavírus Disease 2019 (COVID-19), inicialmente identificado em Wuhan, no centro da China (1). A etiologia era desconhecida e as manifestações clínicas caracterizam-se por febre (≥ 38°C), evidência radiográfica de pneumonia, contagem baixa ou normal de leucócitos e nenhuma melhora sintomática após o tratamento antimicrobiano. A infecção disseminou rapidamente e em 11 de março de 2020, a Organização Mundial da Saúde (OMS) elevou a classificação da infecção à pandemia por COVID-19, provocada pela exposição a uma nova cepa da espécie Coronavírus, altamente infecciosos, relacionado à síndrome respiratória aguda grave, e o designa como SARS-CoV-2 (3).
Inicialmente, pensava-se que em crianças, o envolvimento respiratório parecia ter um curso mais benigno, com quase nenhuma fatalidade relatada nessa faixa etária (4, 5, 7, 49). No Brasil, até agosto de 2020 apenas 2,2% dos casos confirmados de COVID-19 foram relatados em pacientes com menos de 20 anos (5). No entanto, em abril de 2020, relatórios apresentados pela Europa e América do Norte descreveram grupos de crianças e adolescentes que necessitaram de internação em unidades de terapia intensiva após exposição ao coronavírus (11, 12, 13, 14). Alguns estudos mostraram uma resposta imune tardia, com envolvimento de um ou mais órgãos, devido a uma resposta inflamatória maciça que foi chamada de Síndrome Inflamatória Multissistêmica Pediátrica (SIM-P) (6,7, 54).
Essa síndrome ocorre em 2 a 6 semanas após a infecção aguda por SARS-CoV-2 e afeta principalmente crianças em idade escolar e adolescentes. É considerada uma resposta desregulada ao SARS-CoV-2 com subsequente tempestade de citocinas em indivíduos suscetíveis e elevações significativas de marcadores de lesão cardíaca. Apresenta amplo espectro clínico, com acometimento multissistêmico e os sintomas podem incluir: febre persistente, sintomas gastrointestinais, conjuntivite bilateral não purulenta, sinais de inflamação mucocutânea e envolvimento cardiovascular frequente (9, 10). Além disso, também pode apresentar quadro semelhante a outras afecções, principalmente a doença de Kawasaki (DK), definida por uma vasculite de vasos médios de etiologia indeterminada, mas que provoca importantes aneurismas coronários (8,9, 54).
O Centro de Controle e Prevenção de Doenças (CDC) e a Organização Mundial da Saúde (OMS) desenvolveram definições de casos a fim de padronizar dados epidemiológicos, apresentações clínicas e tratamento. No Brasil a SIM-P associado à COVID-19 entrou para a Lista Nacional de Notificação Compulsória de doenças, agravos e eventos de saúde pública, nos serviços de saúde públicos e privados em todo o território nacional, sendo que a notificação deve ser realizada em até 24 horas do atendimento (56), seguindo o formulário eletrônico padronizado (55).
Segundo o boletim epidemiológico do Ministério da Saúde foram confirmados 2.064 casos confirmados de SIM-P no Brasil, com 140 óbitos, perfazendo uma letalidade de 6,8% no período de janeiro de 2020 a setembro de 2023 (16, 57). Dentre os diversos sinais e sintomas, os mais comumente relatados nos casos confirmados de SIM-P destacam-se: febre, sintomas gastrointestinais, respiratórios, cardiovasculares, rash cutâneo, neurológicos, conjuntivite, hipotensão arterial, linfadenomegalia e oligúria. Em relação à terapêutica adotadas nos hospitais é onerosa pois envolve: imunoglobulina, corticosteróide, UTI, anticoagulante, uso de drogas vasoativas, ventilação invasiva e antivírico, porém tem surtido efeito positivo na sobrevida dos pacientes, uma vez que neste ano de 2023 não ocorreu óbitos provocada pela SIM-P (16, 57).
Diante de outras doenças pediátricas em que o conhecimento era acumulado ao longo do tempo, a pandemia do COVID-19 provocou a urgência de estudos criteriosos e de atualizações essenciais que norteiam a sociedade, os profissionais da saúde e os órgãos governamentais na promoção de políticas de saúde publica, de controle da COVID-19 bem como das suas complicações. Nesse contexto, esta revisão tem como objetivo descrever a SIM-P associada à complicação do COVID-19, com ênfase aos dados epidemiológicos, sinais clínicos, diagnóstico e os principais protocolos de tratamento.
2 METODOLOGIA
O estudo apresentado trata-se de uma revisão sistemática. As principais perguntas que nortearam essa pesquisa foram: qual a prevalência da SIM em pacientes pediátricos? Quais os sinais clínicos desse quadro? Qual protocolo para diagnóstico da doença? Qual conduta terapêutica quando essa afecção é confirmada? As etapas de busca, seleção, extração de dados de interesse e análise dos resultados observados nos artigos incluídos seguiram as normas do Preferred Reporting Items for Reviews and Meta-Analyses (PRISMA). As bases eletrônicas pesquisadas foram PubMed, Scielo, BVS, UpToDate, Boletins Epidemiológicos Especiais e Protocolos internacionais e nacionais.
O período de abrangência foi entre janeiro de 2020 a setembro de 2023, para busca de artigos foram usadas as palavras-chave: “Síndrome Inflamatória Multissistêmica em pacientes pediátricos” ou “SIM-P” ou “MIS-C” ou “COVID-19”, ou “SARS-CoV-2” com uma combinação do seguinte grupo de palavras: sintomas, manifestações clínicas, epidemiologia, etiologia, diagnóstico, prognóstico e tratamento.
O critério de seleção geral foi determinado pela estratégia “PVOS”: “População”: Pacientes pediátricos pós-exposição ao COVID-19; “Variável”: desenvolvimento de sinais clínicos compatíveis com a SIM-P; “Outcomes (Desfechos)”: Prevalência da SIM-P e protocolo de definição de caso, assim como seu tratamento; “Study (estudo)”: estudos observacionais analíticos, artigos de pesquisa publicados, estudos de caso, revisões sistemáticas e estudos de vigilância epidemiológica. Os critérios de inclusão foram todos os estudos que abordam acerca da SIM-P associada ao COVID-19, de maneira geral, dados epidemiológicos, protocolo de diagnóstico e tratamento. Os critérios de exclusão foram artigos incompletos, duplicados e pagos. A busca incluiu pesquisa em bases eletrônicas de citações nas publicações inicialmente identificadas.
3 RESULTADOS E DISCUSSÕES
Após o processo de triagem, remoção de artigos duplicados e análises dos critérios de inclusão e exclusão, 57 artigos foram identificados como elegíveis para esta revisão sistemática (Figura 1).
Figura 1. Seleção de estudos que abordaram a temática da revisão sistemática.
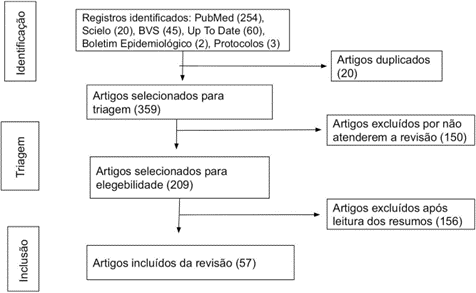
Fonte: Autor (2023).
3.1. Dados epidemiológicos
Segundo o Ministério da Saúde de 2020 a setembro de 2023 ocorreram 2.062 casos de SIM-P, que predominaram nas regiões sul, sudeste e no estado da Bahia, desse total 1.749 tiveram alta hospitalar, porém 140 foram a óbito e 136 casos ainda estavam em desfechos abertos. No Brasil, houve um caso de SIM-P a cada 2.078 casos de COVID-19 em crianças e adolescentes até 19 anos, notificados no e-SUS Notifica. A letalidade foi de 8,6% no ano de 2022, maior do que nos anos anteriores. O quantitativo de casos e óbitos por SIM-P foi maior no sexo masculino, representando 58,0% dos casos e 52,8% dos óbitos. O gênero masculino correspondeu a 58%, as raças branca e parda (72,84%) e faixa etária de 1 a 9 anos de idade (68,18%) (57).
Atualmente, a SIM-P se distribui mundialmente, mas há diferenças em relação à região demográfica, ao quadro socioeconômico e à variante viral (23, 25, 26, 42). A problemática da SIM-P é o número de casos subestimados, pois era uma doença desconhecida antes do surgimento da COVID-19, assim, nem todos os casos foram relatados e os casos no início da pandemia podem não ter sido reconhecidos. É um desafio estimar a incidência de SIM-P por criança infectada com SARS-CoV-2, porque durante a infecção aguda esses indivíduos geralmente são assintomáticos e, portanto, podem não ser testados (17, 18, 19, 20).
Grande parte dos estudos apresentados nesta revisão associam uma maior prevalência de SIM-P em crianças em idade escolar e adolescentes, em média 8 anos de idade, sendo o sexo masculino mais afetado (20, 21, 22, 42, 50). Dados revelam que a população negra e hispânica são as mais afetadas pela SIM-P e aqueles que têm disparidade econômica, devido à falta de acesso à hospitalização, ao tratamento adequado e às imunizações, surgindo assim um problema de esfera social significativo (23, 42, 50).
Na América Latina, a SIM-P foi mais amplamente relatada em comparação com outros países em desenvolvimento, talvez devido a opiniões políticas divergentes em relação à abordagem da pandemia e às políticas de bloqueio que tornam as crianças mais expostas à infecção durante as atividades diárias, o que reforça ainda mais o ponto de vista de que as crianças da etnia hispânico-latina correm maior risco de desenvolver SIM-P (24).
Os sintomas mais comuns apresentados foram febre, sintomas gastrointestinais, dor abdominal, eritema e erupção cutânea e conjuntivite não purulenta (16, 20, 22, 23, 57). Diferentemente da COVID-19 grave, a SIM-P, geralmente, apresenta acometimento sistêmico extrapulmonar e ausência de problemas respiratórios graves. Comorbidades cardíacas, obesidade e história prévia de asma são comumente observadas (16, 27, 28, 29) .
A epidemiologia da SIM-P também pode mudar devido à exposição generalizada na população pediátrica com ondas subsequentes de COVID-19, especialmente a variante Omicron, bem como o aumento das taxas de vacinação. Alguns dados sugerem que SIM-P é menos comum e menos grave com a variante Omicron em comparação com variantes anteriores (25, 26).
3.2. Manifestações clínicas
A fisiopatologia dessa afecção ainda não é bem compreendida, contudo, há o conhecimento de que a superexpressão de vias imunológicas inatas levam ao surgimento da SIM-P, assim como aumento da gravidade e complicações. O IFN-γ foi identificado como uma citocina chave, com níveis aumentados associados à gravidade da doença e envolvimento do sistema de órgãos. Além disso, o aumento da interleucina 6 (IL-6) é responsável pela “tempestade de citocinas” e, consequentemente, pela inflamação sistêmica que pode desenvolver a síndrome respiratória aguda (25, 35, 42, 44).
Diante disso, a SIM-P apresenta um amplo espectro clínico, muitas vezes, dificultando a identificação desta. O início dos sintomas aparecem 2 a 6 semanas, após exposição ao SARS-CoV-2. No entanto, casos raros de SIM-P ocorrendo > 6 semanas após a infecção aguda por SARS-CoV-2 foram relatados. Nesses casos, uma investigação completa para outras causas da apresentação precisa ser realizada (26). Devido ao alto índice de desregulação de fatores imunológicos, os pacientes pediátricos apresentam febre persistente como principal sintoma associado em todos estudos relatados, geralmente a aferição é maior ou igual a 38 graus, com duração média de 4 a 5 dias (43, 44, 48, 52).
No Brasil os sintomas mais comuns incluíram febre persistente em 100% dos casos, distúrbios gastrointestinais ocorreram em 80% seguidos dos respiratórios (70%), cardiológico (60%), rash cutâneo (55%), neurológico (50%), conjuntivite (40%), hipertensão arterial (35%) , linfadenomegalia (20%) e oligúria (15%) (57). Os achados laboratoriais revelaram proteína significativa de marcadores inflamatórios, como a proteína C reativa (PCR) e a IL-6. A ecocardiografia comprovou anormalidades cardíacas em cerca de 80% dos pacientes, sendo a disfunção ventricular esquerda a alteração mais frequente (27, 29).
O envolvimento gastrointestinal foi comumente proeminente nos estudos. Segundo o Boletim Epidemiológico 153, cerca de 82% dos pacientes pediátricos apresentaram sintomas gastrointestinais apresentando dor abdominal, vômitos e diarreia. Há relatos de dores abdominais tão intensas que se assemelhavam a quadro de apendicite e tiveram que ser submetidas a cirurgia de urgência por suspeita de peritonite ou apendicite que resultou no diagnóstico de SIM-P (22, 38, 43, 44, 48, 52). A imagem abdominal pode mostrar ascite, linfonodos mesentéricos aumentados, inflamação do apêndice e espessamento da parede do trato intestinal (27). Apesar de sintomas gastrointestinais serem elevados, há poucos relatos em relação à conduta terapêutica desse sistema.
Sintomas dermatológicos ou mucocutâneos ocorrem em 85% das crianças de 0 a 5 anos de idade, mas apenas 60% dos adolescentes de 13 a 20 anos de idade (28). Segundo estudos, são sintomas/sinais semelhantes aos observados na DK, com o surgimento de hiperemia conjuntival, lábios vermelhos e fissurados, língua em morango, linfadenopatia cervical, erupções cutâneas, edema palmar/plantar e eritema, e descamação de dígitos. Além disso, uma variedade de erupções cutâneas foi descrita como maculopápulas eritematosas, placas anulares, erupções morbiliformes, eritrodermia e lesões semelhantes à urticária que podem se localizar em todas as partes do corpo e estar associadas a descamações (27, 30, 48, 52).
Os mecanismos subjacentes à lesão cardiovascular no SIM-P não são completamente compreendidos, mas acredita-se que resultem da toxicidade direta do cardiomiócito viral, disfunção microvascular e/ou inflamação. Evidências de envolvimento cardiovascular são relatadas em 40% a 80% dos pacientes e incluem peptídeo natriurético cerebral elevado e troponina, disfunção ventricular, derrame pericárdico, dilatação ou aneurisma da artéria coronária e arritmias (28, 29, 40, 43, 46, 48, 52).
3.3. Diagnóstico
A utilização de critérios clínicos, associados a exames laboratoriais e de imagem, tem sido crucial para o diagnóstico preciso da SIM-P. Diante disso, foram desenvolvidos sistemas de identificação para definição de caso cujo protocolos do CDC e da OMS são os mais utilizados pelo mundo, mas divergem em poucos aspectos. No Brasil, o Ministério da Saúde em parceria com a Organização Pan-Americana de Saúde (OPAS) e com a Sociedade Brasileira de Pediatria (SBP) foram responsáveis pela definição de critérios de estabelecimento dos sinais e sintomas, achados laboratoriais, a fim de identificar precocemente casos de SIM-P e orientar quanto à conduta terapêutica (tabela 1).
Tabela 1. Protocolos e condutas segundo organizações mundiais e nacionais entre os anos de 2020 a 2023.
CDC OMS MINISTÉRIO DA SAÚDE BRASIL Indivíduos < 21 anos Crianças e adolescentes (0-19 anos) Crianças e adolescentes (0-19 anos) Febre ≥ 38°C ou febre subjetiva por ≥ 24 h Febre > 3 dias Febre > 38°C e > 3 dias Um ou mais dos seguintes: PCR, VHS, fibrinogênio, procalcitonina, D-dímero, ferritina, LDH ou IL-6 elevados; neutrófilos elevados ou linfócitos reduzidos; albumina baixa Marcadores elevados de inflamação, como ESR*, proteína C-reativa ou procalcitonina Marcadores inflamatórios elevados VHS, PCR ou procalcitonina, entre outros ≥2 sistemas: cardíaco, renal, respiratório, hematológico, gastrointestinal, dermatológico, neurológico ≥2 manifestações: 1. erupção cutânea, conjuntivite, sinais mucocutâneos; 2. hipotensão/choque; 3. disfunção miocárdica, pericardite, valvulite, anormalidades coronárias; 4. coagulopatia (por PT, PTT, d-dímeros); 5. problemas gastrointestinais agudos (diarréia, vômito, dor abdominal) ≥ 2 sinais ou sintomas: conjuntivite não purulenta ou lesão cutânea bilateral ou sinais de inflamação mucocutânea; hipotensão ou choque; manifestações de disfunção miocárdica, pericardite, valvulite ou anormalidades coronárias; evidência de coagulopatia; manifestações gastrointestinais agudas
Fonte: Autor (2023).
Em relação aos achados laboratoriais, há destaque para o aumento dos marcadores inflamatórios, como a proteína C reativa (PCR) e a velocidade de hemossedimentação (VHS), utilizados para avaliar a presença e a intensidade da resposta inflamatória sistêmica (38). Além disso, os marcadores imunológicos, incluindo a contagem de linfócitos, a dosagem de imunoglobulinas e a pesquisa de autoanticorpos, têm um símbolo na caracterização da resposta imune no SIM-P. Os parâmetros hematológicos, como a contagem de plaquetas e os níveis de hemoglobina, também foram avaliados como indicadores de disfunção hematológica associados à síndrome (43).
A confirmação da infecção prévia pelo SARS-CoV-2 também é necessária por meio de testes sorológicos ou de PCR. Exames de imagem, como ecocardiograma e ressonância magnética, podem ser realizados para avaliar a função cardíaca e a presença de anormalidades vasculares (40, 43).
É importante destacar que não existe um marcador único que seja específico e sensível o suficiente para o diagnóstico exclusivo do SIM-P. Portanto, a interpretação clínica dos resultados laboratoriais deve ser realizada de forma integrada, considerando o contexto clínico e outros achados clínicos e radiológicos.
3.4. Diagnóstico diferencial
O diagnóstico diferencial da SIM-P é complexo, devido às sobreposições de sintomas e das manifestações clínicas com outras doenças inflamatórias. A doença de Kawasaki (DK) é frequentemente confundida com a SIM-P devido a semelhança de sintomas, como febre persistente e envolvimento cardiovascular. A sepse e outras condições infecciosas, como a própria COVID-19, também podem apresentar sinais clínicos sobreponíveis à SIM-P. Além disso, doenças inflamatórias como a síndrome do choque tóxico podem ter manifestações semelhantes, mas requerem abordagens terapêuticas diferentes (Tabela 2).
Tabela 2. Principais apresentações dos diagnósticos diferenciais da SIM-P em escala mundial do ano de 2020 a 2023.
SIM-P Doença de Kawasaki Choque tóxico Crianças entre 8-10 anos de idade Crianças < 5 anos de idade Crianças > 10 anos de idade A sorologia pode ser positiva para Sars-COV-2 ou há histórico de contato com o vírus Sem etiologia identificada Infecção estafilocócica ou estreptocócica Maior prevalência em meninos Maior prevalência em meninos Maior prevalência em meninas Manifestações gastrointestinais presentes na maioria dos pacientes Os sintomas gastrointestinais não são comuns Predomínio de erupção cutânea e hipotensão Níveis aumentados de marcadores inflamatórios Leucocitose neutrofílica Leucocitose neutrofílica Instabilidade hemodinâmica e necessidade de suporte em UTI Menos de 5% necessita de suporte em UTI Geralmente necessita de suporte em UTI
Fonte: Autor (2023).
Embora compartilhe alguns sintomas com a DK, como febre alta, erupção cutânea e conjuntivite, o SIM-P tende a apresentar uma inflamação mais sistêmica, afetando órgãos como o coração, pulmões e sistema gastrointestinal. Além disso, os pacientes com SIM-P podem apresentar marcadores inflamatórios mais elevados e necessitar de suporte intensivo, como ventilação mecânica. Aproximadamente 5% dos pacientes com doença de Kawasaki desenvolvem choque cardiovascular, necessitando de suporte inotrópico, em comparação com aproximadamente > 50% dos pacientes SIM-P que desenvolvem choque cardiogênico requerendo tratamento na UTI (38, 40,43, 45, 46, 47).
O choque tóxico é uma reação grave e potencialmente fatal do sistema imunológico em resposta à toxina produzida por certas cepas de bactérias, como Staphylococcus aureus e Streptococcus pyogenes. Esta condição resulta em uma resposta inflamada aguda e sistêmica, levando a sintomas como febre alta, hipotensão, erupções cutâneas, disfunção de órgãos e, possivelmente, choque. Portanto, apesar das sobreposições de alguns sintomas clínicos, o choque tóxico é uma emergência médica que requer tratamento imediato com antibióticos e terapia de suporte. Já o tratamento da SIM-P, associada à infecção prévia pelo vírus SARS-CoV-2, envolve cuidados hospitalares intensivos, incluindo terapias anti-inflamatórias e suporte à função cardíaca (39, 40).
3.5. Manejo clínico
O tratamento da SIM-P visa controlar a inflamação, fornecer suporte para a função orgânica comprometida e prevenir complicações graves, com apoio de uma equipe multidisciplinar envolvendo o pediatra, infectologista, cardiologista, reumatologista e intensivista. Devido à raridade e complexidade da doença, o manejo clínico é baseado em evidências limitadas e na experiência clínica de cada profissional de saúde.
Em relação à terapêutica instituída no Brasil, é constituída de uso de imunoglobulina endovenosa (64%), de corticosteroides (60,7%), UTI (59,1%), anticoagulante (36,9%), uso de drogas vasoativas (24,7%), ventilação invasiva (19,8%) e antivírico em 7,8% dos casos (57).
As medidas de suporte são fundamentais e incluem suporte terapêutico, hidratação adequada, suporte cardiovascular e manejo da disfunção orgânica, seguindo o protocolo inicial de estabilização do paciente, semelhante ao manejo de choque (51, 52). A terapia anti-inflamatória, como o uso de imunoglobulina intravenosa e corticosteróides, tem sido amplamente aceita para modular a resposta inflamatória exacerbada. A imunomodulação através do agente Tocilizumabe tem sido investigada como uma opção terapêutica, devido a função de anticorpo monoclonal humanizado que atua bloqueando receptores de IL-6 (31, 39, 43, 44).
Em relação ao uso de corticosteróides, deve ser considerado junto com a IgEV nos casos graves e nos que foram refratários a sua infusão. Pode ser administrado em forma de pulsoterapia (10–30 mg/kg/dia de metilprednisolona por um a três dias consecutivos), seguida de 2 mg/kg/dia por cinco dias, devendo sua dose ser diminuída gradualmente ao longo de duas a três semanas (32, 37, 51). Essa associação também pode resultar no menor risco de febre, menor incidência de recebimento de tratamentos adjuvantes e um menor risco de disfunção cardiovascular (33 ,34).
Estudos sugeriram que a aspirina pode atuar no controle da inflamação sistêmica e na melhora dos sintomas associados à síndrome. Acredita-se que sua propriedade anti-inflamatória, inibindo a produção de prostaglandinas e outras emissões inflamatórias, pode exercer efeitos expressivos nesses pacientes (47, 52, 53). Contudo, é importante ressaltar que a dosagem e o protocolo de tratamento com aspirina em crianças devem ser cuidadosamente ajustados, levando em consideração a idade, o peso e a gravidade do quadro clínico de cada paciente. Ademais, quando há o envolvimento o acompanhamento de longo prazo desses pacientes é necessário após a alta através de exames com ecocardiograma ou ressonância magnética da área cardíaca, além de continuidade do tratamento medicamentoso (46, 51, 52).
Até o momento, há relatos limitados de casos de SIM-P em pacientes pediátricos após a vacinação contra a COVID-19. A maioria desses relatos ocorreu após a vacinação com as vacinas de mRNA, como as vacinas Pfizer-BioNTech e Moderna. Os casos relatados foram geralmente leves a moderados, com sintomas semelhantes à SIM-P relacionados à infecção por SARS-CoV-2. No entanto, a ocorrência desses casos é extremamente rara, considerando-se o grande número de indivíduos vacinados em todo o mundo. Os benefícios da vacinação contra a COVID-19, incluindo a redução do risco de infecção grave e complicações associadas, superam em muito os riscos potenciais de desenvolver SIM-P após a vacinação. Além disso, as características clínicas e a gravidade dos casos de SIM-P após a vacinação parecem ser semelhantes à SIM-P relacionadas à infecção pelo vírus (36).
É fundamental monitorar e avaliar continuamente a segurança da vacinação, especialmente em relação ao SIM-P e outras condições adversas, por meio de monitoramento epidemiológico e estudos clínicos bem controlados. A educação dos profissionais de saúde e do público em geral é fundamental para promover uma compreensão adequada dos benefícios e riscos da vacinação contra a COVID-19.
4 CONCLUSÃO/CONSIDERAÇÕES FINAIS
A síndrome inflamatória multissistêmica pediátrica (SIM-P) é uma condição rara e complexa que tem se tornado um desafio crescente para a comunidade médica. Este artigo abordou a investigação, diagnóstico e tratamento da SIM-P, buscando aprofundar o entendimento sobre seus aspectos clínicos e imunológicos.
A coleta de dados sobre a SIM-P enfrenta desafios, incluindo a falta de consenso em critérios diagnósticos, subnotificação e variabilidade na identificação da síndrome. A vigilância epidemiológica contínua é fundamental para monitorar e responder às mudanças na incidência e na distribuição geográfica dessa afecção. Assim, a melhora da qualidade dos dados epidemiológicos é crucial para uma compreensão mais exata da prevalência da síndrome.
As análises detalhadas revelaram que a SIM-P se caracteriza por uma resposta inflamatória desregulada e sistêmica em crianças previamente expostas ao SARS-CoV-2, causando manifestações clínicas diversas que podem afetar múltiplos sistemas do organismo. O diagnóstico precoce e acurado é essencial para evitar complicações graves e permitir uma intervenção terapêutica adequada.
Ao longo deste estudo, identificou-se padrões distintos de apresentação clínica e laboratorial, bem como alterações imunológicas peculiares, que podem contribuir para a fisiopatologia da síndrome. Dessa forma, destacamos a importância de uma abordagem multidisciplinar para o manejo desses pacientes, envolvendo pediatras, infectologistas, imunologistas e outros especialistas.
As opções terapêuticas disponíveis têm evoluído à medida que o conhecimento sobre a SIM-P avança. O tratamento imunomodulatório, como o uso de corticosteróides e imunoglobulinas intravenosas, tem se mostrado eficaz para reduzir a inflamação e melhorar os desfechos clínicos. No entanto, a individualização do tratamento é essencial, considerando as particularidades de cada paciente.
Concluímos que a síndrome inflamatória multissistêmica pediátrica é uma condição clínica emergente e complexa, cujo entendimento ainda está em constante evolução. É fundamental que os profissionais de saúde estejam atentos aos sinais e sintomas sugestivos dessa síndrome, a fim de realizar um diagnóstico precoce e instituir uma terapêutica adequada, visando melhorar a sobrevida e a qualidade de vida desses pacientes. Além disso, a pesquisa contínua é imprescindível para compreender a natureza multifacetada acerca da SIM-P e suas implicações na saúde pediátrica.
REFERÊNCIAS
- LI, Q. et al. Early transmission dynamics in Wuhan, China, of novel Coronavirus–infected pneumonia. The New England journal of medicine, v. 382, n. 13, p. 1199–1207, 2020. Disponível em: https://www.nejm.org/doi/pdf/10.1056/NEJMoa2001316?articleTools=true. Acesso em 05 de maio de 2023.
- DONG, E.; DU, H.; GARDNER, L. An interactive web-based dashboard to track COVID-19 in real time. The Lancet infectious diseases, v. 20, n. 5, p. 533–534, 2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7159018/. Acesso em 05 de maio de 2023.
- CORONAVIRIDAE STUDY GROUP OF THE INTERNATIONAL COMMITTEE ON TAXONOMY OF VIRUSES et al. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nature Microbiology, v. 5, n. 4, p. 536–544, 2020. Disponível em: https://scholarlypublications.universiteitleiden.nl/access/item%3A3453615/view. Acesso em 05 de maio de 2023.
- VERDONI, L. et al. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet, v. 395, n. 10239, p. 1771–1778, 2020. Disponível em: https://www.sciencedirect.com/science/article/pii/S014067362031103X. Acesso em 05 de maio de 2023.
- DE SOUZA, W. M. et al. Epidemiological and clinical characteristics of the COVID-19 epidemic in Brazil. Nature human behaviour, v. 4, n. 8, p. 856–865, 2020. Disponível em: https://www.nature.com/articles/s41562-020-0928-4. Acesso em 05 de maio de 2023.
- SOARES, A. M.; SOARES, B. M. What have we Learned about the Different COVID-19 Phenotypes in the Pediatric Population so Far? Int J Cardiovasc Sci , v. 34, n. 5, p. 570–574, 2021. Disponível em: https://ijcscardiol.org/wp-content/plugins/xml-to-html/include/lens/index.php?xml=2359-4802-ijcs-34-05-0570.xml&lang=en. Acesso em 05 de maio de 2023.
- WHO. Case Report Form for suspected cases of multisystem inflammatory syndrome (MIS) in children and adolescents temporally related to COVID-19. Disponível em: https://www.who.int/publications/i/item/WHO-2019-nCoV-MIS_Children_CRF-2020.2. Acesso em 06 de maio de 2023.
- AHA. Kawasaki disease. Disponível em: https://www.heart.org/en/health-topics/kawasaki-disease. Acesso em 06 de maio de 2023.
- DA SAÚDE, O. P.-A. Síndrome inflamatória multissistêmica em crianças e adolescentes com a doença causada pelo novo coronavírus (COVID-19). Resumo científico, 15 de maio de 2020. 2020. Disponível em: https://iris.paho.org/handle/10665.2/52176. Acesso em 06 de maio de 2023.
- FERREIRA, B. C. et al. Pediatric Multisystemic Inflammatory Syndrome (MIS-P) temporarily associated with COVID-19: a survey of clinical and epidemiological characteristics. Research, Society and Development. V.10, n.3, p.2-5, 2021. Disponível em: https://rsdjournal.org/index.php/rsd/article/view/13020. Acesso em 06 de maio de 2023.
- JONES, V. G. et al. COVID-19 and Kawasaki disease: Novel virus and novel case. Hospital Pediatrics, v. 10, n. 6, p. 537–540, 2020. Disponível em: https://doi.org/10.1542/hpeds.2020-0123. Acesso em 06 de maio de 2023.
- RIPHAGEN S., et al. Choque hiperinflamatório em crianças durante a pandemia de COVID-19. Lanceta. 2020. Epub 2020/05/11. Disponível em: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)31094-1/fulltext. Acesso em 06 de maio de 2023.
- DEBIASI, R.L., et al. COVID-19 grave em crianças e jovens adultos na região metropolitana de Washington, DC. J Pediatr. 2020. Disponível em https://repositorio.uniceub.br/jspui/bitstream/prefix/14537/1/21502838%20-%20MARIA%20FERNANDA%20BUENO%20LORIA.pdf. Acesso em 06 de maio de 2023.
- WHO. Síndrome inflamatória multissistêmica em crianças e adolescentes relacionada temporalmente à COVID-19. Disponível em: https://www.who.int/news-room/commentaries/detail/multisystem-inflammatory-syndrome-in- children-and-adolescents-with-covid-19. Acesso em 06 de maio de 2023.
- BRASIL, Ministério da Saúde, Nota Técnica, julho de 2020. Disponível em: https://portaldeboaspraticas.iff.fiocruz.br/biblioteca/nota-tecnica-no-16-2020-cgpni-deidt-svs-ms/. Acesso em 06 de maio de 2023.
- BRASIL, Ministério da Saúde. Boletim Epidemiológico Nº 149- Boletim COE Coronavírus. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/covid-19/2023/boletim-epidemiologico-no-149-boletim-coe-coronavirus. Acesso em 09 de maio de 2023.
- BARROS, L. A. F. et al. Pediatric inflammatory multisystemic syndrome in Brazil: sociodemographic characteristics and risk factors to death. Jornal de pediatria, v. 99, n. 1, p. 31–37, 2023. Disponível em: https://www.scielo.br/j/jped/a/LBNFxDXC4WyT7dcpM5mbYsR/?lang=en. Acesso em 09 de maio de 2023.
- MUHAMMAD WASEEM, M. et al. Multisystem inflammatory syndrome in children. The Journal of Emergency Medicine, v. 62, n. 1, p. 28–37, 2022. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34538678/. Acesso em 10 de maio de 2023
- MICHAEL GOTTLIEB, M. et al. Multisystem inflammatory syndrome in children with COVID-19. The American Journal of Emergency Medicine, v. 49, p. 148–152, 2021. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8185530/. Acesso em 10 de maio de 2023.
- ELILARASI ELILARASI, S. et al. Pediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2. Indian Journal of Pediatrics, v. 89, n. 9, p. 879–884, 2022. Disponível em: https://pesquisa.bvsalud.org/bvsms/resource/pt/mdl-34817811. Acesso em 11 de maio de 2023.
- RAMCHARAN, T. et al. Paediatric inflammatory multisystem syndrome: Temporally associated with SARS-CoV-2 (PIMS-TS): Cardiac features, management and short-term outcomes at a UK tertiary paediatric hospital. Pediatric Cardiology, v. 41, n. 7, p. 1391–1401, 2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7289638/. Acesso em 12 de maio de 2023.
- MONICA O SANTOS SANTOS, M. O. et al. Multisystem inflammatory syndrome (MIS-C): a systematic review and meta-analysis of clinical characteristics, treatment, and outcomes. Jornal de Pediatria, v. 98, n. 4, p. 338–349, 2022. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9432310. Acesso em 12 de maio de 2023.
- JAVALKAR, K. et al. Socioeconomic and racial and/or ethnic disparities in multisystem inflammatory syndrome. Pediatrics, v. 147, n. 5, 2021. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8086000/ . Acesso em 12 de maio de 2023.
- ASGHAR, Z. et al. A global review of racial, ethnic and socio-economic disparities in multisystem inflammatory syndrome in children related to COVID-19. Frontiers In Public Health, v. 10, 2022. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9632619/ . Acesso em 12 de maio de 2023.
- FILIPPATOS, F.; TATSI, E.-B.; MICHOS, A. Immunology of multisystem inflammatory syndrome after COVID-19 in children: A review of the current evidence. International Journal Of Molecular Sciences, v. 24, n. 6, p. 5711, 2023. Disponível em: https://pubmed.ncbi.nlm.nih.gov/36982783. Acesso em 12 de maio de 2023.
- FILHO F., M.F., K. F. COVID-19: Características clínicas, avaliação e diagnóstico da síndrome inflamatória multissistêmica em crianças (MIS-C). Disponível em: https://www.uptodate.com/contents/covid-19-multisystem-inflammatory-syndrome-in-children-SIM-P-clinical-features-evaluation-and-diagnosis?search=pediatric%20multi-system%20inflammatory%20syndrome&source=search_result&selectedTitle=2~67&usage_type=default&di splay_rank=2 Acesso em 12 de maio de 2023.
- LEE, P.-I.; HSUEH, P.-R. Multisystem inflammatory syndrome in children: A dysregulated autoimmune disorder following COVID-19. Wei mian yu gan ran za zhi [Journal of microbiology, immunology, and infection], v. 56, n. 2, p. 236–245, 2023. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9841678/. Acesso em 20 de maio de 2023.
- DIONNE, A.; SON, M. B. F.; RANDOLPH, A. G. An update on multisystem inflammatory syndrome in children related to SARS-CoV-2. The Pediatric Infectious Disease Journal, v. 41, n. 1, p. e6–e9, 2022. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8658063/. Acesso em 21 de maio de 2023.
- FELDSTEIN, L. R. et al. Multisystem inflammatory syndrome in U.s. children and adolescents. The New England journal of medicine, v. 383, n. 4, p. 334–346, 2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7346765/. Acesso em 02 de junho de 2023.
- MARTÍNEZ, N. et al. Síndrome multisistémico post COVID-19 y dificultad en su diagnóstico etiológico: a propósito de un caso clínico. Arch. pediatr. Urug, p. e313–e313, 2022. Disponível em: https://pesquisa.bvsalud.org/portal/resource/pt/biblio-1393876. Acesso em 03 de junho de 2023.
- CARTER, M. J.; SHANKAR-HARI, M.; TIBBY, S. M. Paediatric inflammatory multisystem syndrome temporally-associated with SARS-CoV-2 infection: An overview. Intensive care medicine, v. 47, n. 1, p. 90–93, 2021. Disponível em: https://link.springer.com/article/10.1007/s00134-020-06273-2. Acesso em 08 de junho de 2023.
- GASPAR, A. D. et al. Síndrome inflamatória multissistêmica pediátrica: análise de uma série de casos. Revista Paulista de Pediatria: órgão oficial da Sociedade de Pediatria de São Paulo, v. 40, p. e2021046, 2022. Disponível em: https://www.scielo.br/j/rpp/a/Xz6xcsknXZQzGNcD9HFxJmB/?lang=pt#ModalTutors. Acesso em 20 de junho de 2023.
- BELHADJER, Z. et al. Addition of corticosteroids to immunoglobulins is associated with recovery of cardiac function in multi-inflammatory syndrome in children. Circulation, v. 142, n. 23, p. 2282–2284, 2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7717473/. Acesso em 01 de julho de 2023.
- SON, M. B. F. et al. Multisystem inflammatory syndrome in children — initial therapy and outcomes. The New England Journal of Medicine, n. NEJMoa2102605, 2021. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8220972/. Acesso em 01 de julho de 2023.
- BENAMAR, M. et al. The Notch1/CD22 signaling axis disrupts Treg function in SARS-CoV-2–associated multisystem inflammatory syndrome in children. The Journal of Clinical Investigation, v. 133, n. 1, 1 2023. Disponível em: https://www.jci.org/articles/view/163235. Acesso em 01 de julho de 2023.
- DE PARIS, K.; PERMAR, S. R. Routine SARS‐CoV‐2 vaccination for all children. Immunological reviews, v. 309, n. 1, p. 90–96, 2022. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35799475/. Acesso em 01 de julho de 2023.
- CAVALLI, G. et al. Interleukin-1 blockade with high-dose anakinra in patients with COVID-19, acute respiratory distress syndrome, and hyperinflammation: a retrospective cohort study. The Lancet. Rheumatology, v. 2, n. 6, p. e325–e331, 2020. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7252085/. Acesso em 15 de julho de 2023.
- PATEL, J. M. Multisystem inflammatory syndrome in children (MIS-C). Current allergy and asthma reports, v. 22, n. 5, p. 53–60, 2022. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35314921/. Acesso em 20 de julho de 2023.
- ROSAS, I. O. et al. Tocilizumab in hospitalized patients with severe covid-19 pneumonia. The New England Journal of Medicine, v. 384, n. 16, p. 1503–1516, 2021. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7953459/. Acesso em 20 de julho de 2023.
- KABEERDOSS, J. et al. Severe COVID-19, multisystem inflammatory syndrome in children, and Kawasaki disease: immunological mechanisms, clinical manifestations and management. Rheumatology International, v. 41, n. 1, p. 19–32, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33219837/. Acesso em 20 de julho de 2023.
- JIANG, L. et al. COVID-19 and multisystem inflammatory syndrome in children and adolescents. The Lancet infectious diseases, v. 20, n. 11, p. e276–e288, 2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32818434/. Acesso em 08 de agosto de 2023.
- TORAIH, E. A. et al. Multisystem inflammatory syndrome in pediatric COVID-19 patients: a meta-analysis. World Journal of Pediatrics: WJP, v. 17, n. 2, p. 141–151, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33608839/. Acesso em 08 de agosto de 2023.
- ALGARNI, A. S. et al. Clinical practice guidelines in multisystem inflammatory syndrome (MIS-C) related to COVID-19: a critical review and recommendations. World Journal Of Pediatrics: WJP, v. 18, n. 2, p. 83–90, 2022. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34982402/. Acesso em 08 de agosto de 2023.
- ROWLEY, A. H. Understanding SARS-CoV-2-related multisystem inflammatory syndrome in children. Nature Reviews. Immunology, v. 20, n. 8, p. 453–454, 2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32546853/. Acesso em 10 de agosto de 2023.
- LOKE, Y.-H.; BERUL, C. I.; HARAHSHEH, A. S. Multisystem inflammatory syndrome in children: Is there a linkage to Kawasaki disease? Trends in cardiovascular medicine, v. 30, n. 7, p. 389–396, 2020. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32702413/. Acesso em 10 de agosto de 2023.
- EMEKSIZ, S. et al. Algorithm for the diagnosis and management of the multisystem inflammatory syndrome in children associated with COVID‐19. International Journal Of Clinical Practice, v. 75, n. 9, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34107136/. Acesso em 11 de agosto de 2023.
- ZHANG, Q.-Y.; XU, B.-W.; DU, J.-B. Similarities and differences between multiple inflammatory syndrome in children associated with COVID-19 and Kawasaki disease: clinical presentations, diagnosis, and treatment. World Journal Of Pediatrics: WJP, v. 17, n. 4, p. 335–340, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34013488/. Acesso em 11 de agosto de 2023.
- RAFFERTY, M. S. et al. Multisystem inflammatory syndrome in children (MIS-C) and the coronavirus pandemic: Current knowledge and implications for public health. Journal Of Infection and Public Health, v. 14, n. 4, p. 484–494, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/33743370/. Acesso em 11 de agosto de 2023.
- KALYANARAMAN, M.; ANDERSON, M. R. COVID-19 in children. Pediatric Clinics of North America, v. 69, n. 3, p. 547–571, 2022. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35667761/. Acesso em 20 de agosto de 2023.
- SAVORGNAN, F. et al. Social and demographic disparities in the severity of multisystem inflammatory syndrome in children. The Pediatric Infectious Disease Journal, v. 41, n. 6, p. e256–e258, 2022. Disponível em: https://pubmed.ncbi.nlm.nih.gov/35537132/. Acesso em 20 de agosto de 2023.
- ENSINCK, G. et al. Consenso sobre el tratamiento del síndrome inflamatorio multisistémico asociado a COVID-19. Archivos Argentinos de Pediatria, v. 119, n. 4, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/34309328/. Acesso em 20 de agosto de 2023.
- NOGUEIRA-DE-ALMEIDA, C. A. et al. Pediatric multisystem inflammatory syndrome associated with COVID-19: urgent attention required. Revista da Associação Médica Brasileira (1992), v. 67, n. suppl 1, p. 115–120, 2021. Disponível em: https://www.scielo.br/j/ramb/a/7sBkR4fSsDQLG5RrWhyd9yc/?lang=en. Acesso em 20 de agosto.
- SPEROTTO, F. et al. Cardiac manifestations in SARS-CoV-2-associated multisystem inflammatory syndrome in children: a comprehensive review and proposed clinical approach. European journal of pediatrics, v. 180, n. 2, p. 307–322, 2021. Disponível em: https://pubmed.ncbi.nlm.nih.gov/32803422/. Acesso em 20 de agosto de 2023.
- CAMPOS, L. R. et al. Síndrome Inflamatória Multissistêmica Pediátrica (SIM-P) Temporalmente Associada à COVID-19: atualização. Residência Pediátrica. v. 11, n. 1, 2021. Disponível em: https://cdn.publisher.gn1.link/residenciapediatrica.com.br/pdf/rp310821a07.pdf. Acesso em 08 de setembro de 2023.
- BRASIL, Ministério da Saúde. Ficha de notificação para casos da Síndrome Inflamatória Multissistêmica Pediátrica, temporalmente associada à COVID-19. 2020. Disponível em: https://redcap.saude.gov.br/surveys/index.php?s=TDHEXK9HDR. Acesso em 08 de setembro de 2023.
- BRASIL, Ministério da Saúde. Portaria GM/MS Nº 1.102, de 13 de maio de 2022. Disponível em: https://bvsms.saude.gov.br/bvs/saudelegis/gm/2022/prt1102_16_05_2022.html. Acesso em 08 de setembro de 2023.
- BRASIL, Ministério da Saúde. Boletim Epidemiológico Nº 153 – Boletim COE Coronavírus. 2023. Disponível em: https://www.gov.br/saude/pt-br/centrais-de-conteudo/publicacoes/boletins/epidemiologicos/covid19/2023/boletim_covid_153_julho_11set23.pdf/view. Acesso em 08 de setembro de 2023.
1 Discente do Curso Superior de Medicina da Universidade Tiradentes Campus Farolândia e-mail: fabricia.teixeira@souunit.com.br
2 Discente do Curso Superior de Medicina da Universidade Tiradentes Campus Farolândia e-mail: alarocha2205@gmail.com
3 Discente do Curso Superior de Medicina da Universidade Tiradentes Campus Farolândia e-mail: marinafreired@gmail.com
4 Discente do Curso Superior de Medicina da Universidade Tiradentes Campus Farolândia e-mail: manuela.naiane@gmail
5 Discente do Curso Superior de Medicina da Universidade Tiradentes Campus Farolândia e-mail: thayna.bezerra@souunit.com.br
6 Docente do Curso Superior de Medicina da Universidade Tiradentes Campus Farolândia e-mail: maria.julia@souunit.com.br
7 Docente do Curso Superior de Medicina da Universidade Tiradentes Campus Farolândia e-mail: sonialima.cirurgia@gmail.com
