REGISTRO DOI: 10.5281/zenodo.8357558
Marcelo Fernando do Nascimento1
Orientadora: Dra. Juliana Monte Real
RESUMO
A Síndrome do Desconforto Respiratório Agudo (SDRA) é definida por um quadro agudo, progressivo e associado à hipóxia. Costuma se desenvolver em pacientes portadores de condições que predispõem a indução de resposta inflamatória sistêmica, principalmente a sepse. Apesar desta forte relação e do conhecimento de que o prognóstico é pior quando a sepse está associada à SDRA, pouco se sabe a respeito das diferenças entre sepse relacionada ou não relacionada à SDRA. É possível distinguir quando a sepse está associada ou não à SDRA através de diferenças moleculares encontradas no sangue, portanto, a busca por biomarcadores ajudaria a esclarecer os diferentes mecanismos patofisiológicos da SDRA. Atualmente apenas alguns poucos biomarcadores estão clinicamente disponíveis para diferenciar doenças e condições similares a SDRA. Entretanto, para o nosso conhecimento, até hoje não existem estudos sobre microvesículas de origem endossomal (exossomos) descritos na SDRA. As respostas inflamatórias locais e sistêmicas que acompanham a SDRA e a sepse são aparentemente coordenadas pelas microvesículas produzidas por leucócitos, plaquetas e células endoteliais em resposta ao processo de interação entre eles. Por esse motivo, o estudo realizado avaliou a utilização deste biomarcador para a SDRA associada à sepse. A pesquisa avaliou amostras de 36 amostras de sangue de 19 pacientes com evidências de infecção e SDRA, provenientes do Biobanco UTI do Hospital Sírio Libanês. Pela primeira vez na literatura científica foi demonstrado que existem microRNAs transportados por microvesículas circulantes, que possivelmente influenciam a via de imuno trombose e que claramente distinguem pacientes com sepse quando apresentam SDRA
Palavras-chave: Microvesículas circulantes; exossomos; biomarcadores; sepse; síndrome do desconforto respiratório agudo. Diagnóstico
ABSTRACT
Acute Respiratory Discomfort Syndrome (ARDS) is defined as acute, progressive, and associated with hypoxia, which can develop after several conditions associated with the systemic inflammatory response. It usually develops in patients with conditions that predispose to the induction of systemic inflammatory response, the most common of these conditions being sepsis. Despite this strong relationship, little is known about the differences between sepsis related or unrelated to ARDS, although it is known that the prognosis is worse when sepsis is associated with ARDS. The search for biomarkers would help to clarify the different pathophysiological mechanisms of ARDS when related or not to sepsis. It is possible to distinguish when sepsis is associated or not with ARDS through molecular differences found in the blood. Currently, only a few biomarkers are clinically available to differentiate diseases and similar conditions from ARDS, however, to our knowledge, to date, there are no studies on endosomal microvesicles (exosomes) described in ARDS. The local and systemic inflammatory responses that accompany ARDS and also sepsis are apparently coordinated by the microvesicles produced by leukocytes, platelets, and endothelial cells in response to the interaction between them. For this reason, we conducted a study evaluating the use of this biomarker for ARDS associated with sepsis. For this, samples of 36 blood samples from 19 patients with evidence of infection and ARDS, from the ICU Biobank of Hospital Sírio Libanês, were evaluated. For the first time in the literature, it has been demonstrated that microorganisms are being transported by circulating microvesicles, which are possibly influencing the immunothrombosis pathway and which are clearly distinguishing patients with sepsis when they have ARDS.
Keywords: SDRA; Sepsis; Microvesicles; Biomarkers.
1 INTRODUÇÃO
O presente estudo buscou apresentar o potencial de microvesículas como possíveis biomarcadores da Síndrome do Desconforto Respiratório Agudo (SDRA) na sepse. Tal síndrome costuma se desenvolver em pacientes portadores de condições com predisposição a induzir resposta inflamatória sistêmica, o que incluiu pneumonias, pancreatite aguda e, principalmente, a sepse.
Nesse contexto a presente pesquisa realizada comprovou o transporte de microRNAs por microvesículas e exossomos circulantes, fato que diferencia portadores de sepse quando apresentam SDRA ou não. Para a realização do presente estudo, foram utilizadas 36 amostras de sangue, coletadas de 19 pacientes. Amostras de pessoas sadias e pacientes sob ventilação mecânica sem doença pulmonar também foram utilizados como controles. A pesquisa compreendeu amostras provenientes do Biobanco UTI do Hospital Sírio Libanês e pacientes internados na unidade de terapia intensiva do Instituto do Câncer do Estado de São Paulo (ICESP).
O presente estudo foi realizado com o intuito de apresentar a distinção entre SDRA em portadores e não portadores de sepse por meio de microvesículas e exossomos, visto que o tema foi poucas vezes abordado na literatura científica. Ainda, o estudo contribui na elaboração e desenvolvimento de pesquisas futuras a respeito de microvesículas e sua relação com sepse e outras enfermidades.
2 FUNDAMENTAÇÃO TEÓRICA
2.1 Microvesículas e Exossomos
Microvesículas extracelulares (MVs) são pequenas vesículas secretadas por uma grande variedade de células que representam um importante meio de comunicação intercelular, pois servem como veículo para transferência de proteínas, lipídeos, diferentes tipos de RNAs1,2 e até mesmo DNA3 entre as células. As MVs contêm o citosol da célula secretora encapsulada por uma bicamada lipídica4 e transferem seu conteúdo para célula-alvo por meio de interação entre ligante/receptor, fusão e/ou internalização1. Tais MVs compreendem os exossomos (30-150nm), microvesículas/micropartículas (100-1000nm) e corpos apoptóticos (100-1200nm)1. O que as difere, além de seu tamanho, é também sua densidade e origem.
As microvesículas são formadas a partir da evaginação/protusão direta da membrana plasmática enquanto os exossomos são originados a partir de uma maquinaria mais complexa dentro da célula, onde o conteúdo proteico ou molecular é colocado por invaginação dentro de endossomos multivesiculares (corpos multivesiculares, MVBs = multivesicularbodies) presentes no citoplasma. Posteriormente, os endossomos multivesiculares se fundem à membrana plasmática e liberam os exossomos para o meio extracelular.
Proteínas associadas à membrana (triângulos), proteínas transmembrana (retângulos) e RNAs (símbolos curvados) são seletivamente incorporados para dentro dos corpos multivesiculares (MVEs) para formar os exossomos ou são incorporados em microvesículas originadas a partir do brotamento da membrana plasmática. Os MVEs se fundem com a membrana plasmática para liberar os exossomos no meio extracelular. As microvesículas e exossomos podem se aderir da célula-alvo, se fundir diretamente à membrana ou ainda serem endocitado. As microvesículas endocitadas podem então se fundir com a membrana delimitante do compartimento endocítico liberando as proteínas e RNAs ao citosol da célula-alvo2.
Um desafio atualmente enfrentado por pesquisadores é a definição de métodos que permitam discriminar entre exossomos e microvesículas. Pelo fato de ser impossível discerni-los baseado apenas em tamanho, estrutura ou densidade flutuante, a comunidade científica está à procura de novos métodos de isolamento e purificação. Além disso, nem todos os mecanismos sobre a biogênese e secreção dos exossomos são conhecidos4.
Os exossomos são enriquecidos em certos tipos de proteínas e lipídeos que, após o isolamento das microvesículas no laboratório, ajudam a identificá-los de outros tipos de vesículas extracelulares, organelas ou debriscelulares. As proteínas que aparentam estar envolvidas na gênese ou tráfico de vesículas (como TSG101, ALIX, anexinas e proteínas RAB), transdução de sinal (quinases e proteínas G), organização de citoesqueleto (actina e tubulina), transporte e apresentação de antígeno (MHC classe I e II, proteínas heatshock), e proteínas organizadas em micro- domínios na membrana (proteínas da família das tetraspaninas, como CD9, CD63 e CD81), têm auxiliado na identificação dos exossomos.5
Microvesículas e o Sistema Imunológico
As microvesículas extracelulares produzidas tanto por células imunes como por células não imunes possuem importante papel na regulação de atividades imunológicas. O papel imunoestimulatório das MVs tem sido amplamente estabelecido no contexto da apresentação de antígenos. As células dendríticas podem apresentar peptídeos ligados aos complexos MHC originários dos exossomos. Uma vez que MVs mantém a topologia da célula apresentadora de antígeno de origem, carregam em sua superfície moléculas de MHC classe I e II, e podem estimular de modo direto os linfócitos T CD8+ e CD4+, respectivamente. Carregam antígenos que podem ser originados por células infectadas por patógenos ou por células neoplásicas5.
Em células dendríticas e macrófagos já foi demonstrado que MVs secretadas podem conter interleucina 1 beta (IL-1b) em seu interior. Algumas outras citocinas também já foram evidenciadas sendo transportadas na superfície das MVs. Membros da família de fator de necrose tumoral (TNF), incluindo o ligante CD95 (CD95L / também conhecido como FASL), ligantes indutores de apoptose relacionados à TNF (TRAIL; também conhecido como TNFS10) e o ligante CD40, são sortidos para compor a membrana do exossomo. Linfócitos T citotóxicos, células natural killer (NK) e células dendríticas são capazes de eliminar células-alvo através da liberação de suas MVs polarizadas que carregam CD95L. A promoção da resposta inflamatória também já foi demonstrada nas MVs produzidas por células dendríticas e macrófagos, que transportam enzimas responsáveis pela síntese de leucotrienos B4 (LTB4) e C4 (LTC4). Em sítios de inflamação, o instável LTA4, liberado por neutrófilos, pode ser convertido em LTB4 e LTC4 pró-inflamatório por meio das vesículas derivadas de células apresentadoras de antígenos (APCs)5.
A secreção de microvesículas é, portanto, modulada pelo contexto celular. Por exemplo, células B e células dendríticas aumentam a liberação de exossomos após interação com linfócitos T, que secretam vesículas extracelulares após ativação dos receptores de células T (TCR). Já os mastócitos aumentam a secreção após ligação de IgE com receptor Fc5.
Por outro lado, as funções imunossupressoras das MVs já foram observadas em vírus e tumores. O herpes vírus humano 4 (HHV4), também conhecido como Epstein–Barr Virus (EBV), codifica pequenos RNAs não-codificantes (microRNAs), que podem ser transferidos de uma célula infectada para células vizinhas não- infectadas. Na chegada das MVs às células recipientes, os microRNAs são capazes de regular negativamente RNAs mensageiros-alvo específicos, possivelmente contribuindo para um estado permanente de infecção do vírus7,8.
As MVs derivadas de tumores foram recentemente implicadas na imunossupressão por transportarem proteínas específicas, incluindo Fas ligante (FasL) e TRAIL, para células imunes. Os monócitos, por exemplo, podem ter sua diferenciação em célula dendrítica prejudicada, favorecendo o crescimento tumoral por meio da presença de prostaglandina E2, TGF-beta, HSP72 ou ainda microRNAs presentes nas vesículas derivadas de tumor5.
Em melanoma, foi demonstrado que antes de ocorrer a metástase, MVs induzem aumento da permeabilidade vascular em sítio pré-metastático e reprogramam células progenitoras da medula óssea para um fenótipo pró- vasculogênico, a fim de influenciar o microambiente para favorecer a chegada de células neoplásicas9.
As MVs parecem exercer um papel relevante também em doenças autoimunes. No soro de pacientes com artrite reumatoide, já foi demonstrado que as MVs possuem maiores níveis da forma membranosa do TNF, um alvo-chave no tratamento da doença, quando comparado com MVs de indivíduos sadios utilizados como controle. Interessantemente, as MVs TNF-positivas tornam células T ativadas resistentes à apoptose, o que poderia contribuir para patogênese da doença5.
2.2 Síndrome do Desconforto Respiratório Agudo (SDRA)
A Síndrome do Desconforto Respiratório Agudo (SDRA) é definida por um quadro agudo, progressivo e com hipóxia caracterizado por infiltrado bilateral no raio- X ou tomografia computadorizada. A SDRA pode se desenvolver após diversas condições associadas à resposta inflamatória sistêmica, desde que não haja disfunção cardíaca asssociada10. Apesar de décadas de pesquisa, a única terapia que se mostrou eficiente em reduzir a mortalidade foi a ventilação mecânica com baixo volume corrente11.
Recentemente, o mesmo grupo de pesquisa brasileiro mostrou que o parâmetro ventilatório mais importante para proteger o pulmão e aumentar as taxas de sobrevivência seria controlar a pressão de distensão pulmonar, o que possivelmente deve alterar a conduta clínica no tratamento dos pacientes12. Apesar dos esforços à beira-leito, a mortalidade da SDRA em adultos ainda permanece superior a 40%13.
A patofisiologia da SDRA é essencialmente determinada pelo aumento da permeabilidade microvascular pulmonar em que a perda da barreira alvéolo-capilar acarreta extravasamento de fluído rico em proteínas para o espaço alveolar, influxo de neutrófilos e macrófagos, deposição de fibrina como resultado da ativação da coagulação, e ainda inibição da fibrinólise. Todas essas mudanças podem se desenvolver em poucas horas ou até poucos dias após o início do evento, e frequentemente se prolongam por dias ou semanas até sua resolução14.
Outro fator importante na patofisiologia da doença refere-se ao sistema imune inato e inflamação. Na imunidade inata, existem receptores de reconhecimento de padrões (RRPs), presentes na superfície celular ou no citosol das células do sistema imune, que tem ganhado importância cada vez maior na literatura. Esses receptores reconhecem moléculas exógenas com padrões moleculares associados a patógenos (PAMPs), ou a fatores liberados pela presença de dano tecidual (DAMPs). Quando esses receptores são ativados, o fator de transcrição NF-kb se transloca para o núcleo, principalmente por meio de um mecanismo dependente de MyD88, que leva à transcrição de citocinas pró-inflamatórias como IL-1b, IL-8 e TNFa. Alguns RRPs já descritos relacionados à SDRA incluem toll-likereceptor2,toll-likereceptor4,receptor for advanced glycation end products (RAGE) e high-mobility group box 1 protein (HMGB1).
A histona, uma proteína nuclear, é liberada para circulação após trauma e pode induzir inflamação e lesão pulmonar aguda em modelos animais15. Os mediadores inflamatórios classicamente descritos na SDRA incluem TNFa e IL-1b, que podem induzir à lesão pulmonar aguda quando administrados em animais, cujos níveis encontram-se aumentados nos pacientes. A IL-8 (CXCL8), importante quimiocina para o recrutamento de neutrófilos, encontra-se aumentada no pulmão dos pacientes com SDRA e o tratamento com anti-IL8 é capaz de proteger o desenvolvimento da doença em modelos animais. Outras proteínas inflamatórias incluindo a IL-18 e IL-33, assim como IL-1b, são reguladas pela via de inflamassoma/caspase-115.
O processo de desenvolvimento da SDRA é altamente complexo. Anteriormente, a evolução da doença era separada em duas fases distintas: uma fase inicial pró-inflamatória e, em seguida, uma fase fibrótica posterior, conceito que atualmente aparenta ser muito simplista. As evidências atuais demostram que essas duas fases coexistem, pois, a resposta pró-inflamatória que causa danos ao hospedeiro, a resposta imune pouco efetiva de combate aos patógenos, o reparo tecidual e a fibrose estão todos presentes no contexto clínico da SDRA. Segundo Mairead Hayes e colaboradores, esse pode ser um dos motivos pelo qual as estratégias terapêuticas com alvo em apenas um desses aspectos não apresentem resultado. Isso sugere a necessidade de se considerar abordagens clínicas mais complexas que visem reduzir a injúria inicial, enquanto mantêm a competência do sistema imune, e que facilitem (ou pelo menos não inibam) a regeneração do tecido pulmonar16.
2.3 Síndrome do Desconforto Respiratório Agudo e a Sepse
Usualmente, a SDRA se desenvolve em pacientes com condições que predispõem a indução de resposta inflamatória sistêmica, como: pneumonia, traumas, múltiplas transfusões, aspiração e pancreatite aguda. Dentre todas essas condições, a sepse é a causa mais comum de predisposição à SDRA17. Até o presente momento, não há evidências de nenhum tratamento que impeça o desenvolvimento de SDRA em pacientes com sepse18.
A sepse é definida como uma resposta inflamatória sistêmica a uma infecção. A doença não é diagnosticada com base na localização da infecção ou pelo nome do micro-organismo, mas sim a partir de uma lista de sintomas que inclui anormalidades na temperatura do corpo, na frequência cardíaca e respiratória e na contagem de leucócitos no sangue19, 20. A infecção pode estar localizada em apenas um órgão, mas provoca em todo o organismo uma inflamação em resposta à infecção. Essa inflamação pode desencadear disfunção orgânica19, 20.
Durante a resposta imune inata, que desempenha papel chave na patofisiologia da sepse, os vasos sanguíneos se dilatam no tecido infectado, aumentando a circulação e permitindo a chegada de células imunes. Normalmente, a reação inflamatória permanece localizada. A sepse se desenvolve quando a reposta imune inata se torna amplificada e desregulada, levando ao desbalanço entre as respostas pró e anti-inflamatórias. Nesse contexto, citocinas regulam uma variedade de repostas inflamatórias, inclusive a migração de células imune ao sítio de infeção, um passo crucial para conter a infecção localizada e preveni-la de se tornar sistêmica. Entretanto, uma liberação desregulada de citocinas pode levar a excessiva vasodilatação e aumento da permeabilidade vascular. Esse vazamento pode resultar em hipotensão, hemoconcentração, extravasamento de macromoléculas e edema, achados frequentemente encontrados em pacientes com sepse21.
Os pacientes com sepse frequentemente apresentam elevada frequência cardíaca e respiratória. A taquipnéia (respiração acelerada) costuma ser o primeiro sinal clínico de desenvolvimento de sepse. Esse aumento da frequência pode ocorrer devido à febre, acidose láctica e edema pulmonar. O pulmão é frequentemente o primeiro órgão a entrar em disfunção durante a sepse devido ao seu envolvimento precoce no processo inflamatório. Esse processo pode então resultar em injúria pulmonar aguda ou síndrome do desconforto respiratório agudo (SDRA)22.
A incidência da sepse apresentou aumento nos últimos anos, fato preocupante em decorrência da morbi-mortalidade extremamente alta da síndrome. Em seu espectro mais grave, o de choque séptico, a mortalidade varia em torno de 40 a 60% nas diversas casuísticas23,25. A SDRA é bastante comum e se desenvolve em aproximadamente metade de todos os severa ou choque séptico.
As maiores taxas de mortalidade da SDRA ocorrem quando ela está associada à sepse (>50%) e são menores quando a SDRA ocorre secundariamente a outras causas como a aspiração gástrica, múltiplos traumas ou embolismo (30-40%). Uma maior incidência de SDRA está presente em pacientes que desenvolvem choque séptico e cuja sepse é causada por uma fonte infecciosa pulmonar ao contrário de uma fonte não-pulmonar18.
Apesar desta forte relação, pouco se conhece a respeito das diferenças entre sepse relacionada ou não relacionada à SDRA. Em uma avaliação clínica feita em 2.786 pacientes. Sheu e colaboradores mostram que quando a Sepse está associada à SDRA, existe uma pior taxa de mortalidade em 60 dias, menor chance de sucesso na extubação e menor número de dias livres de ventilação mecânica e UTI. Os autores chegaram a propor que possivelmente existam duas síndromes diferentes na SDRA, e que a busca por biomarcadores ajudaria a esclarecer os diferentes mecanismos patofisiológicos da SDRA quando relacionada ou não a sepse17.
Alguns estudos recentemente publicados avaliaram as diferenças moleculares encontradas no sangue quando a sepse está ou não associada à SDRA. Kangelaris e colaboradores avaliaram por microarray o perfil de expressão de genes no sangue total, e verificaram que quando a sepse está associada à SDRA, os genes mais diferencialmente hiperexpressos encontrados correspondem à resposta inicial dos neutrófilos à infecção (olfactomedin 4, lipocalin 2, CD24, bactericidal/permeability-increasingprotein)26.
Os neutrófilos quando ativados liberam metaloproteinases na circulação. Hsu e colaboradores mediram diariamente a concentração no plasma de 38 pacientes em UTI sob ventilação mecânica. Quanto ao MM-9, os autores notaram um aumento significativo de MMP-9 no dia em que houve uma diminuição na razão PaO2/FiO2, sugerindo que a ativação dos neutrófilos pode ser preditiva para o desenvolvimento de SDRA em pacientes críticos27.
Também em busca por biomarcadores, Ware e colaboradores dosaram diferentes proteínas no plasma comparando 100 pacientes com sepse e SDRA versuspacientes com sepse sem SDRA (n=100). Os níveis circulantes de três proteínas biomarcadoras de injúria do epitélio pulmonar (proteína surfactante D, RAGE e CC16 – conhecida como “Claracellsecretoryprotein”), e as citocinas IL6 e IL8, discriminaram pacientes com diagnóstico de SDRA (n=100) nos primeiros 4 dias de UTI28.
2.4 Biomarcadores atuais na SDRA
Para a maioria dos pacientes admitidos na UTI, o diagnóstico é feito antes de sua admissão, mais comumente no departamento de emergência. Apesar disso, a incerteza de um diagnóstico correto é frequentemente enfrentada pelos médicos uma vez que muitos pacientes irão desenvolver novos sintomas e sinais durante a sua permanência na UTI, como insuficiência respiratória e a febre29. O diagnóstico da SDRA é baseado apenas na caracterização clínica considerando os critérios clínicos de Berlin definidos em 201230.
Atualmente apenas alguns poucos biomarcadores estão clinicamente disponíveis para diferenciar doenças e condições similares da SDRA. Dentre eles encontram-se o peptídeo natriurético atrial (BNP) que é utilizado para diferenciar SDRA de edema pulmonar hidrostático (edema causado por pressão capilar aumentada de origem cardiogênica), porém sua utilidade ainda é controversa. A procalcitonina está aumentada na infecção bacteriana, mas não em infecções virais ou fúngicas, e pode ser útil para discriminar entre pneumonia bacteriana e SDRA. Entretanto, a sensibilidade é de 70% e pelo fato da pneumonia bacteriana e a sepse serem causas comuns de SRDA, sua utilidade é limitada. Predizer a gravidade da doença é também importante para desenvolver uma estratégia diagnóstica específica para cada paciente com SDRA, mas o único parâmetro clínico utilizado para este propósito é a razão de PaO2/FIO2 da gasometria (pressão parcial de oxigênio no sangue / fração inspirada de oxigênio)15.
A proteína C-reativa (PCR) é utilizada para auxiliar o diagnóstico e resposta terapêutica a antimicrobianos, pois seus níveis refletem o grau de um processo inflamatório31. Ainda em âmbito de pesquisa, a proteína Pentraxina 3 (PTX3), outro membro da família da PCR, tem sido apontada como um novo marcador de inflamação sistêmica, uma vez que seus níveis sanguíneos aumentam mais rapidamente do que a PCR. Interessantemente, foi demonstrado que a hiperexpressão da PTX3 em camundongos transgênicos exacerbou a resposta inflamatória e os animais desenvolveram lesão pulmonar induzida pelo ventilador mais rapidamente32. Em pacientes com SDRA em ventilação mecânica, o aumento de PTX3 no sangue foi o único parâmetro que diferenciou sobreviventes dos não- sobreviventes33.
Uma análise secundária de um grande estudo clínico chamado “Network’s(ARDSnet)activatedproteinCstudy” analisou vários biomarcadores circulantes candidatos para SDRA. O estudo mostrou que o inibidor 1 do ativador do plasminogênio (PAI-1) e IL-6 estiveram correlacionados com parâmetros de oxigenação. O número de dias livres de ventilação mecânica foi significativamente menor em pacientes que apresentavam altos níveis de IL-6, IL-8 e trombomodulina34. Em 2014, uma meta-análise buscou avaliar os biomarcadores encontrados no plasma, já publicados em pacientes com SDRA. Os autores avaliaram 54 estudos englobando 3.753 pacientes e encontraram que KL-6, lactato desidrogenase, RAGE solúvel e fator von Willebrand estão fortemente associados ao diagnóstico da SDRA.
Considerando a predição, os autores encontraram IL-4, IL-2, Ang-2, e KL-6 como os fatores mais fortemente associados à mortalidade35.
2.5 Microvesículas e a Síndrome do Desconforto Respiratório Agudo
As respostas inflamatórias locais e sistêmicas que acompanham a SDRA e a sepse são aparentemente coordenadas pelas microvesículas produzidas por leucócitos, plaquetas e células endoteliais em resposta a interação entre eles16. São escassos os estudos a respeito do tema. Entretanto, nos últimos anos o tema passou a ser mais explorado em pesquisas61.
A ativação da coagulação sistêmica é uma característica inicial da SDRA que contribui para a trombose microvascular e disfunção de órgãos. AS microvesículas são centrais para a ativação e propagação da trombose através da exposição de fosfolipídios carregados negativamente em sua superfície e entrega de fator tecidual ao local da trombose, como foi descrito e experimentado por Shaver, etal68.
A maioria dos trabalhos que avaliaram microvesículas circulantes em pacientes com insuficiência respiratória grave, focaram em micropartículas derivadas de plaquetas (Anexina V positivas, 100-1000 nm) de origem não-endossomal. Em 20 pacientes com hipertensão pulmonar, uma condição muito presente em pacientes com SDRA, foi observado um aumento do número de micropartículas circulantes transportando Tissue factor ativo quando comparado a indivíduos sadios, parâmetro correlacionado com a gravidade da doença36. Essas micropartículas contendo Tissuefactortambém podem ser encontradas no edema pulmonar37.
No lavado broncoalveolar de 52 pacientes com SDRA, Guervilly e colaboradores detectaram a presença de microvesículas originadas de leucócitos, neutrófilos e células endoteliais. Neste estudo, os maiores níveis no sangue de microvesículas derivadas de leucócitos, detectadas ao primeiro dia de SDRA, foram associados a uma melhor taxa de sobrevida38.
As células endoteliais de pulmão humanas também produzem micropartículas (anexina 5 positivas, 0.1-1 μm) quando expostas à endotoxina (LPS) ou em resposta ao estresse mecânico in vitro, um modelo que mimetiza a distensão patológica do pulmão causada por excesso de volume entregue pela ventilação mecânica às células. A depender do estímulo, as micropartículas produzidas carregam conteúdos diferentes de proteínas na análise proteômica39.
Segundo Hunter e colaboradores, no sangue periférico de indivíduos sadios, dois terços das microvesículas circulantes são derivadas das plaquetas, enquanto a segunda maior população de microvesículas circulantes é derivada da linhagem fagocítica mononuclear40. As microvesículas derivadas de plaquetas induzem resposta imune por meio da regulação de expressão gênica em células hematopoiéticas, endoteliais e monocíticas. Especialmente na sepse, as micropartículas derivadas de plaquetas encontram-se em níveis aumentados no sangue. Um trabalho recente (ainda não publicado) demonstrou que a maioria das microvesículas circulantes encontradas em pacientes com sepse é originada de leucócitos41.
Já foi demonstrado que microvesículas derivadas de tecido pulmonar de camundongos quando co-cultivadas com células da medula óssea induzem as mesmas a expressarem proteínas e RNAs mensageiros específicos da célula epitelial pulmonar, aparentemente por meio da transferência de microRNA ou proteínas de fator de transcrição contidos dentro das microvesículas42,43. Quando transplantadas em camundongos letalmente irradiados, as microvesículas que modificam as células da medula preferencialmente se alojam no pulmão funcionando como pneumócitos tipo 2 (dados não publicados citados pelo autor)44.
Interessantemente, foi demonstrado que microvesículas provenientes de células-tronco mesenquimais possuem potencial terapêutico em modelo de hipertensão pulmonar em ratos45 e em modelo de lesão pulmonar aguda induzida por
E. coli em camundongos46. Nesses contextos, as microvesículas proporcionaram melhora dos parâmetros clínicos associados à disfunção do pulmão. Acredita-se que as microvesículas injetadas derivadas das células tronco ou das células tronco residentes do tecido podem reprogramar as células danificadas através da entrega de mRNA e/ou microRNA que induzem a de-diferenciação, a produção de mediadores parácrinos solúveis e estimulam as células entrarem novamente no ciclo celular, favorecendo assim a regeneração tecidual47. Estudos clínicos de fase I com microvesículas derivadas de células dendríticas para imunoterapia em câncer avançado mostraram que essa terapia é factível e segura. Por este motivo, acredita- se que essa possa ser uma abordagem promissora e efetiva para diversas doenças inflamatórias do pulmão48.
Segundo Takei e colaboradores, doenças que causam SDRA, como a sepse, provocam inflamação sistêmica grave, resultando em lesões vasculares sistêmicas. Portanto, analisar essas microvesículas circulantes que expressam um antígeno específico do endotélio microvascular pulmonar é fundamental para distinguir lesão microvascular pulmonar de lesão capilar sistêmica e podem ser utilizadas como biomarcadores da SDRA67.
2.6 Exossomos e Microvesículas em doenças pulmonares
Alguns estudos recentes revisaram o comportamento das microvesículas em diversos tipos de mecanismo, dentre eles podemos ressaltar a importância nos processos pulmonares, mostraram que tanto as microvesículas quanto os miRNAs promovem a migração de macrófagos e infiltração in vitro e in vivo. Após a exposição a algum agente agressor, os miR-17 e miR-221 por exemplo, exercem os efeitos na promoção da migração de macrófagos através da modulação do integrin β175. Após a exposição à hiperóxia, os miR-221 e miR-320 ativam os macrófagos, estimulando a secreção de citocinas pró-inflamatórias69. Com isso podemos afirmar que após estímulos específicos, diferentes miRNAs contido nas microvesículas, exercem funções específicas.
Estudos adicionais abordaram o papel funcional de microvesículas derivadas da sepse. Mostefai e cols., demonstraram que microvesículas isoladas de pacientes sépticos quando injetados por via intravenosa em camundongos aumentam a contração da aorta do rato em resposta a LPS e serotonina, e aumentam a produção do tromboxano vasoconstrictor A2. Essas observações sugerem que essas microvesículas podem ter efeitos protetores na sepse76.
Um estudo recente, prospectivo sobre o tratamento do COVID-19 demonstrou que o produto derivado da medula óssea, ExoFlo, foi administrado com segurança através de infusão intravenosa. O resultado demonstrado foi a profunda reversão da hipóxia e a reconstituição imunológica, sem efeitos adversos. Com tudo, a aplicação de exosóis derivados da medula óssea pode se estender muito além do SARS-CoV- 2 SDRA ou COVID-19, abrangendo uma enorme quantidade de doença inflamatória, incluindo SDRA clássico, doença pulmonar obstrutiva crônica, sepse, doença autoimune e câncer77.
2.7 MicroRNAs transportados por Exossomos e Microvesículas em doenças pulmonares
Estudos recentes demonstram que microvesículas e exossomos transportam conteúdo biologicamente ativo especialmente em doenças pulmonares, como doença pulmonar obstrutiva crônica (DPOC), asma, hipertensão pulmonar e lesão pulmonar aguda (ALI) como foi descrito por Chen e cols74. A Tabela abaixo traz um resumo dos principais achados já descritos na literatura referente aos efeitos biológicos dos microRNAs transportados pelas MVs no contexto de doenças e/ou modelos experimentais das doenças que envolvem o pulmão.
Tabela1– Revisão dos estudos funcionais de microvesículas transportando microRNAs em doenças pulmonares
Célula deorigemda Microvesícula Doença estudada /modeloexperimental microRNA Tipo deMicrovesícula Desfecho Referência Célula epitelial pulmonar (camundongo) Lesão pulmonar induzida por hiperóxia miR-320a miR-221 Microvesícula Ativação de macrófagos e efeitos pró-inflamatórios Lee, H. e cols 69 Tratamento com microvesículasisoladas de células tronco mesenquimal humana, ou transfectadas com inibidorde miR-100 Lesões pulmonar induzida por bleomicina em ratos miR-100 Microvesícula Microvesículas diminuiem inflamação,apoptose e fibrose, e oefeito éreduzidoquando mir-100 estáinibido Chen,W.X. e cols71 Microvesículas de lavado broncoalveolar transfectado com miR223 emiR142 Infecção bacteriana por Klebsiella pneumoniaeou LPS miR-223 miR-142 Microvesículas Inibição da ativação de macrófagos e redução da inflamação Zhang, D. e cols72 Células epiteliais, dentriticas e células tronco mesenquimaishumanas Doenças pulmonares miR-210 miR-200miR-17 miR-146a miR-155 Células pulmonares humanas Melhora significativa da resposta anti- inflamatória pulmonar Chen, J. e cols74
2.8 Microvesículas e Exossomos como Ferramenta Terapêutica em doenças pulmonares e como biomarcadores
Alguns estudos pré-clínicos têm demonstrado favoráveis efeitos terapêuticos de exossomos derivados da medula óssea quando entregues em modelos de animais, na lesão pulmonar aguda (ALI), SDRA, asma e outras doenças inflamatórias, com análises revelando inflamação alveolar reduzida, maior desobstrução do edema, restauração epitelial de membranas e outras sequências de liberação de citocinas59.
Park J. e cols. 73, por exemplo, demonstraram em um estudo experimental utilizando pulmão humano ex vivo perfundido após pneumonia severa por E coli, que ao tratar o pulmão com microvesícula derivada de célula tronco mesenquimal humana, acontece uma redução da lesão pulmonar bacteriana. A utilização de microvesículas no tratamento de doenças pulmonares, pode ser considerada de grande valia, já que pode evitar o risco de embolia pulmonar e tumorigênese, como pode ocorrer no caso de utilização de células vivas. Esses estudos elucidaram alguns dos mecanismos subjacentes aos efeitos benéficos das microvesículas em termos de suprimir inflamação e promover a integridade da barreira pulmonar e a resolução de edema pulmonar78.
Interessantemente, um estudo de 2020 sobre a utilização dessa forma de tratamento em COVID em humanos já foi testado. Pacientes classificados como estado respiratório moderado a grave de SDRA receberam uma única dose intravenosa de 15 mL de ExoFlo (exossomos derivados de células tronco mesenquimais de medula óssea). Nenhum evento adverso foi observado dentro de 72 horas da administração do ExoFlo. Observou-se uma taxa de sobrevivência de 83%. No total, 17 dos 24 (71%) pacientes se recuperaram, 3 dos 24 (13%) pacientes permaneceram gravemente doentes, embora estáveis, e 4 de 24 (16%) pacientes expiraram por razões não relacionadas ao tratamento. Embora seja um estudo preliminar avaliando a segurança, o autor considera que esta terapia pode ser promissora para melhorar a oxigenação e a chuva de citocinas na qual esses pacientes enfrentam77.
As MVs são fisiologicamente secretadas e o aumento dos níveis circulantes no plasma tem sido correlacionado com situações fisiopatológicas. Por serem encontradas em fluídos corporais de fácil acesso como sangue, urina e saliva, as microvesículas passaram a ser considerados como uma preciosa ferramenta biomédica. As MVs trazem em seu conteúdo molecular uma “impressão digital” da célula que os liberou e refletem seu status. Comparados a outros biomarcadores, ao serem isolados da circulação, possuem como vantagem o enriquecimento de proteínas raras que poderiam estar diluídas no sangue total, facilitando a sua detecção. Além disso, o seu conteúdo interno está protegido por uma membrana tornando-os mais estáveis, impedindo a ação de proteases presentes no sangue, por exemplo53.
Exossomos e outras vesículas extracelulares têm sido apontados como possíveis biomarcadores para detecção e estadiamento de câncer, e provavelmente de distúrbios metabólicos, inflamatórios e imunológicos5. Uma pesquisa recente mostrou o grande potencial das MVs como ferramenta diagnóstica54,55. O artigo demonstra que exossomos circulantes de pacientes com câncer de pâncreas transportam uma proteína chamada glypican-1. A presença desta proteína nos exossomos foi capaz de discriminar pacientes com lesões pré-cancerosas pancreáticas daqueles com doenças benignas no pâncreas, com 100% de assertividade. Como uma prova de conceito, o RNA mensageiro de KRAS mutado (frequente em tumor de pâncreas) foi encontrado nos exossomos circulantes, mas somente entre os pacientes que tinham o tumor primário com a mesma mutação54.
A partir de tais estudos, fica evidente a possibilidade de utilizar exossomos e outras MVs como potenciais biomarcadores no diagnóstico de diversas doenças, tanto oncológicas quanto infecciosas, como já demonstrado por estudos anteriores na área62,64.
3 MATERIAIS E MÉTODOS
As amostras foram coletadas diretamente de pacientes internados na Unidade de Terapia Intensiva do Hospital do Câncer do Estado de São Paulo (ICESP) ou obtidas a partir do Biobanco UTI do Hospital Sírio-Libanês. Foram coletados 20 ml de sangue periférico em tubos EDTA em cada coleta, realizada dentro das primeiras 24 horas após admissão na UTI e outra após 72 horas. Todos os pacientes ou responsáveis assinaram termo de consentimento esclarecido ao serem internados na UTI. O presente projeto foi submetido para aprovação aos Comitês de Ética em Pesquisa em Seres Humanos do ICESP e do Instituto Sírio-Libanês de Ensino e Pesquisa.
3.1 Critérios de Inclusão
- Evidência de infecção;
- Critérios de Síndrome Resposta Inflamatória Sistêmica (SIRS) (três ou mais dos seguintes): Febre (temperatura central maior que 38°C ou menor que 36°C); taquicardia (acima de 90 batimentos por minuto), taquipnéia (acima de 20 incursões por minuto ou PaCO2 menor que 32 mmHg), leucocitose (leucometria maior que 12000/mm3 ou menor que 4000/mm3 ou mais que 10% de formas jovens no sangue periférico);
- Sepse grave: para caracterizar a sepse grave, os pacientes devem apresentar além dos critérios acima uma das disfunções orgânicas abaixo, de forma aguda e relacionada à sepse;
- Lesão pulmonar aguda devido à sepse e associada à hipoxemia grave com relação PaO2/FiO2< ou = 300;
- Aumento significativo no nível de bilirrubina ( >2 vezes o valor de referência) no soro ou icterícia;
- Oligúria (diurese < 0,5 mL/Kg/h durante 1 hora, mesmo com ressuscitação adequada de fluidos) ou necessidade de terapia de substituição renal, como resultado da sepse grave;
- Trombocitopenia, com contagem de plaquetas < 100.000/mm3 ou redução de 50% no número de plaquetas em relação ao maior valor registrado nos últimos 3 dias;
- Acidose láctica com lactato > 1.5 vezes o valor normal e excesso de base > 5.0;
- Choque Séptico: Critérios acima associados a pressão arterial sistólica menor que 90 mmHg e/ou pressão arterial média menor que 65 mmHg com necessidade de uso de drogas vasoativas para manter esses valores de pressão arterial.
3.2 Critérios de Exclusão
- Pacientes cuja família se recusaram a assinar o termo de consentimento;
- Expectativa de vida provável não maior que 24 horas pela gravidade da condição clínica;
- Pacientes com neoplasias ativas em qualquer estágio;
- Pacientes com doenças crônicas avançadas (ex. cirrose hepática Child-Pugh C, doenças respiratórias com dependência de oxigênio suplementar, demência avançada, ICC CF III e IV, IRC dialítica etc.);
- Doenças plaquetárias conhecidas, bem como condições sabidamente causadoras de plaquetopenia (por exemplo, trombocitopenia induzida por heparina, quimioterapia ou até mesmo crônica), pois se sabe que se as plaquetas estiverem com a função alterada, irá também afetar as medições das microvesículas provenientes dessas plaquetas, portanto não terá o resultado esperado;
- Pacientes em vigência de uso pleno de heparina (heparina de baixo peso molecular ou não-fracionada) ou de qualquer outra medicação que interfira com a função plaquetária;
- Pacientes que estivessem recebendo alguma terapia experimental;
- Ter participado nos últimos 30 dias de outro estudo com uma droga investigacional, aparelho, prótese ou órtese em pesquisa;
- Gestantes.
3.3 Definição de SDRA
Os pacientes com SDRA foram definidos segundo a classificação atual de Berlim. Com base no grau de hipoxemia, foram categorizados em leve (200 mmHg < PaO2/FIO2 ≤ 300 mmHg), moderado (100 mmHg < PaO2/FIO2 ≤ 200 mmHg), ou grave (PaO2/FIO2 ≤ 100 mmHg)30.
3.4 Dados Clínicos e Laboratoriais Coletados
Foram coletados diversos dados clínicos, que foram armazenados em prontuário eletrônico ou prontuário físico. Dados relativos à epidemiologia, comorbidades, escores prognósticos, uso de recursos de saúde na UTI, tempo de permanência na UTI e hospitalar e desfechos foram recuperados e analisados no estudo. Dados laboratoriais para estimar a gravidade da sepse e das disfunções orgânicas também foram coletados diariamente na fase aguda da doença para elaborar escores prognósticos SAPS3 (Escore fisiológico agudo simplificado) e SOFA (Avaliação sequencial da insuficiência de órgãos) e facilitar a classificação de risco dos dados coletados.
3.5 Processamento das Amostras de Sangue do Biobanco UTI
As amostras foram mantidas refrigeradas e foram processadas em no máximo 2 horas57. O sangue foi centrifugado a 2.500 xg à 4ºC, e o plasma foi acondicionado em criotubos. Após a separação do plasma, a camada leuco-plaquetária (buffy coat) também foi coletada. Todas as amostras foram armazenadas em freezer -80ºC.
3.6 Isolamento de Microvesículas do Plasma
Após descongelamento, o plasma foi filtrado em membrana de 0.22 uM e ultracentrifugado por 140.000 xg por 150 min à 4ºC (SW28Ti Rotor, Optima L-90K
Ultracentrifugue, Beckman Coulter)49. Após a ultracentrifugação, o sobrenadante foi descartado.
Neste protocolo obtivemos uma população de microvesículas de tamanho inferior a 220nm que compreendem exossomos (30-100nm) e microvesículas de origem não-endossomal (100-1000nm) menores do que 220nm. Em trabalho prévio do grupo, foi observado que este protocolo isola exossomos devido à marcação positiva de Flotilina-1, específica de exossomos, detectada por Western Blot83.
3.7 Quantificação do Número e Tamanho das Microvesículas
O perfil de tamanho dos exossomos e microvesículas bem como a concentração foram feitos a partir de vinte microlitros das vesículas isoladas e diluídas em 280 ul de PBS ultrapuro. As MVs foram analisadas pela técnica de Nanoparticle tracking analysis (NTA), um método para visualizar e analisar partículas em líquidos que relaciona a taxa de movimento Browniano ao tamanho da partícula, através de um microscópio acoplado a laser. Este método é considerado padrão ouro para quantificação e análise de tamanho. Três vídeos de 60 segundos foram gravados e analisados pelo equipamento NanoSight LM10 Ltd® e software NanoSight NTA® versão 3.2. O valor da concentração de microvesículas de cada amostra foi subtraído do branco (apenas PBS). Os experimentos foram feitos no Hospital AC Camargo.
3.8 Extração de microRNA das Microvesículas
Após ultracentrifugação, o precipitado (pellet) obtido foi ressuspendido em 1,4 mL do reagente Qiazol e homogeneizado (Tissue Ruptor, Qiagen®) para lisar os exossomos e microvesículas. A extração do microRNA e RNA total foi feita pelo método de coluna seguindo as instruções do fabricante (miRNAeasy Mini Kit, Qiagen #217004). A quantidade e pureza do RNA obtido foram determinadas em espectrofotômetro (NanoVue –GE). A qualidade foi determinada por eletroforese em microchip no equipamento Bioanalyzer.
3.9 Transcrição Reversa do microRNA em cDNA
O microRNA extraído foi convertido para DNA complementar (cDNA) por meio do kit “TaqMan MicroRNA Reverse Transcription Kit” e dos primers “Megaplex RT”. Foram utilizados 48 primers, sendo que cada primer é complementar a um único miRNA maduro. Durante a reação, os primers assumem uma configuração em grampo (“stemloop”) ao hibridizarem no miRNA-alvo e promovem um alongamento das moléculas que foram sintetizadas. As moléculas de cDNA resultantes da reação de transcrição reversa foram mais longas que os miRNAs e puderam então ser utilizadas como moldes para a PCR.
3.10 Pré-amplificação do cDNA
A fim de favorecer a detecção dos miRNAs expressos em baixos níveis, o cDNA foi pré-amplificado por PCR convencional. O uso do “miScript PreAMP PCR Kit” em combinação com primers para os 48 microRNAs específicos permitiu a amplificação prévia do cDNA em reações multiplex.
3.11 Escolha dos 48 microRNAs estudados
O conhecimento científico sobre microRNAs é relativamente novo na literatura, e, dois anos após a escrita do projeto, novas publicações sobre a biogênese e a função dos microRNAs nas mais diversas doenças surgiram. No projeto anterior, 86 microRNAs foram apontados como sendo importantes na sepse83. Na metodologia proposta para o atual projeto, 48 microRNAs deveriam ser escolhidos para contemplarem o estudo numa placa de PCR array customizada. Uma vez que a pergunta principal do projeto foi investigar a SDRA na sepse, uma revisão realizada em 2017 sobre quais microRNAs seriam expressos pelo tecido pulmonar foi realizada.
Para tanto, foi utilizada uma ferramenta de bioinformática online chamada Tissue microRNA (http://ophid.utoronto.ca/mirDIP/searchTissueMir.jsp), a qual faz uma busca em 11 bancos de dados diferentes existentes e traz uma lista de quais microRNAs já foram descritos como expressos pelo órgão de interesse, no caso, o pulmão. Dos 86 microRNAs, 52 foram indicados como apresentando expressão no tecido pulmonar. Foram então selecionados os microRNAs cuja razão de expressão previamente encontrada foi maior ou menor do que 3.
Alguns dos microRNAs encontrados no projeto anterior cuja função ainda era completamente desconhecida, mas que apresentavam níveis de expressão muito elevados ou diminuídos na sepse, não deixaram de ser incluídos para análise deste projeto, mesmo sem descrições à época de alguma relação com o tecido pulmonar (ex.: miR-1298-5p, miR-1262, miR- 520d-5p e miR-1233-3p). A Tabela 8 Anexa traz a análise completa considerando o estudo anterior e os 48 microRNAs escolhidos.
3.12 Análise dos dados de PCR em tempo real
As intensidades de fluorescência produzidas a cada ciclo da reação de PCR foram coletadas e registradas no programa SDS 2.4 (Applied BioSystems®). Para cada um dos microRNAs foi determinado o Ct (“ciclo limiar” ou “ciclos até o limiar”), referente ao número de ciclo da PCR em que a fluorescência mensurada atingiu um limiar (threshold) (Expression Suíte Software, Life Technologies®). A quantidade de fluorescência detectada em um determinado ciclo foi diretamente proporcional ao número de moléculas-alvo na reação. Os valores de Ct foram exportados e analisados no Software OmicsOffice qPCR (Integromics, Perkin Elmer®). Valores de Ct maiores do que 32 foram considerados como indetectáveis e excluídos das análises subsequentes. As razões de expressão foram calculadas pelo método de quantificação relativa DDCt58. Baseado no estudo anterior, os microRNAs hsa-miR- 106a, hsa-miR-17 e hsa-miR-20a apresentaram menor variação entre as amostras e foram novamente considerados para normalização dos dados.
3.13 Detecção e Dosagem de Proteínas Exclusivas do Tecido Pulmonar nas Microvesículas
Um mililitro de plasma foi filtrado e ultracentrifugado. O pellet de microvesículas ficou ressuspendido inicialmente em 280 ul de PBS. Uma alíquota foi destinada a quantificação do número de vesículas no equipamento Nanosight. No restante do volume, foi utilizado 50 ul das microvesículas isoladas para a quantificação de surfactant protein D (SP-D) (R&D Systems #DY1920) e club cell secretory protein (CC- 16) (uteroglobina R&D Systems #DY4218) por ELISA (ng/ml). Cinquenta microlitros de plasma puro de cada paciente também foram utilizados para realização das mesmas quantificações proteicas.
3.14 Análise Estatística
Os valores dentro de cada grupo experimental foram testados quanto a sua distribuição normal pelo teste de Shapiro-Wilk. Para comparações entre dois ou mais grupos foi aplicado o teste de one-way ANOVA (única variável) ou teste de two-way ANOVA (duas variáveis). Avaliações entre 2 grupos com amostras coletadas em dois momentos diferentes do mesmo paciente foi considerado o Teste T pareado. (GraphPad Prism Software®, versão 7).
4 RESULTADOS
4.1 Amostras incluídas no projeto
A principal pergunta do projeto envolveu a busca de microvesículas possivelmente produzidas pelo tecido pulmonar. Por este motivo, pacientes que apresentavam doença prévia pulmonar, sepse causada por foco infeccioso pulmonar, ou ainda tumor de pulmão, não foram selecionados para este projeto. As inclusões de pacientes no ICESP começaram em setembro/2018. Pelo fato dos pacientes do ICESP serem oncológicos, inicialmente optamos por incluir apenas pacientes com sepse com tumor de origem gastrointestinal. Como o número de pacientes estava abaixo do esperado, resolvemos então ampliar para todos os tipos tumorais. Entre setembro/2018 e janeiro/2019, foram rastreados 90 pacientes, sendo que destes, três pacientes foram incluídos no projeto. Na revisão de prontuários, observamos que os três apresentavam algum tipo de doença pulmonar e por este motivo não puderam ser incluídos.
O Biobanco do hospital Sírio-Libanês, que iniciou suas atividades em 2015, possui uma coleção de amostras de pacientes da UTI. Dezoito pacientes com sepse admitidos na UTI do estudo entre junho de 2016 e setembro de 2017 foram incluídos. Por estudarmos dados de expressão gênica que são bastante variáveis, foram escolhidos apenas pacientes que tivessem 2 coletas (primeiras 24 horas de internação e 72h após) para uma interpretação mais confiável dos dados. Cada prontuário foi individualmente revisado por médico intensivista para seleção dos casos elegíveis (Figura 2). Pacientes com sepse de origem pulmonar não foram considerados. Coletamos sangue de voluntários sadios de idade e gênero similares (Grupo Controle; n=12) aos pacientes do estudo para servirem como controles.
Figura 2 – Seleção dos casos do Biobanco UTI do hospital Síro-Libanês.
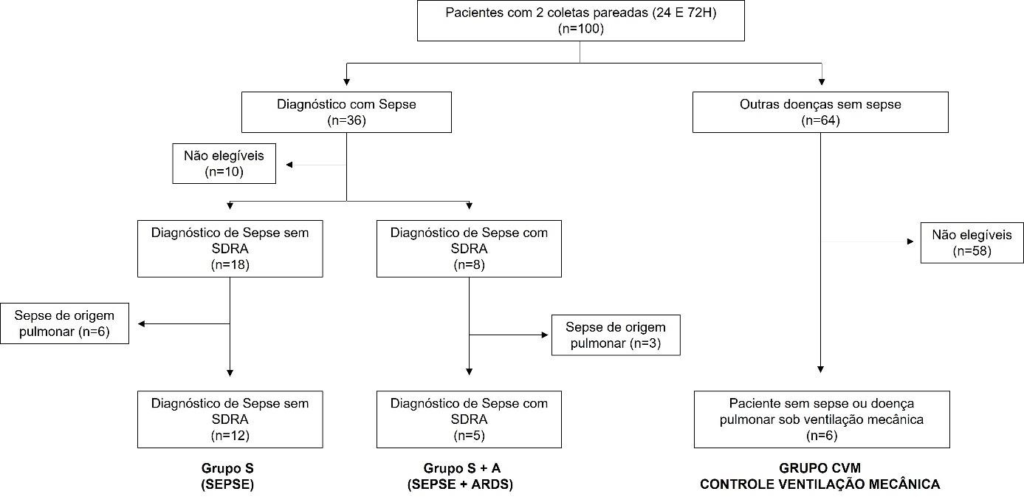
O número de amostras compreendeu 13 pacientes com Sepse (26 amostras) e 5 pacientes com Sepse + SARA (10 amostras) em coletas pareadas; 5 pacientes em ventilação mecânica sem doença pulmonar coletados nas primeiras 24 horas de internação na UTI (5 amostras); 12 voluntários sadios (12 amostras). Neste projeto, avaliamos experimentalmente 53 amostras ao todo. Como será demonstrado mais a frente, 2 amostras não amplificaram durante a PCR e foram excluídas de algumas análises de expressão dos miRNAs (Controle 3 e Sepse 4056 A). Desta forma, a Figura 2 abaixo resume as amostras finais utilizadas no estudo.
4.2 Dados Clínicos dos Participantes
A Tabela 2 mostra os dados demográficos e as principais características dos pacientes incluídos, bem como a permanência na UTI, no hospital e a mortalidade. Os voluntários saudáveis tinham idade média de 55 ± 23 anos, eram do sexo feminino em 67% dos casos e não apresentavam doenças prévias. De maneira compatível com o primeiro episódio séptico, a média de idade desses pacientes foi menor que o habitual, a maioria dos pacientes não apresentava comorbidades e veio da sala de emergência (37%). Sua mortalidade (20%) também é compatível com essas características.
Tabela 2. Dados clínicos dos pacientes incluídos no estudo
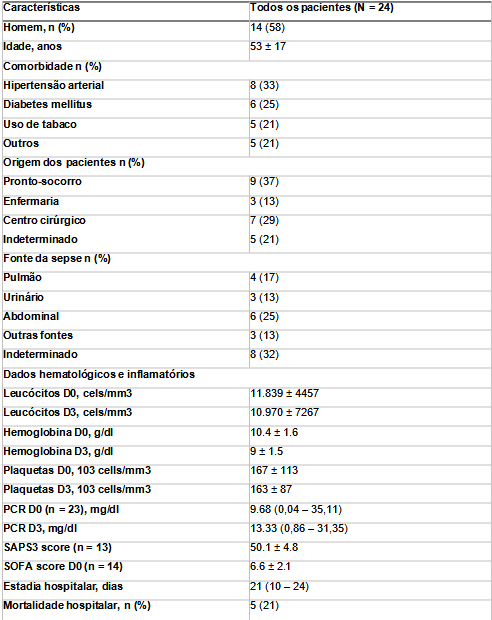
CRP: proteína C reativa, SAPS3 Simplified Acute Physiology Score III, SOFA Sequential Organ Failure Assessment. Dados expressos como número (%), média ± desvio padrão, ou mediana (25–75 percentuais).
4.3 Quantificação e caracterização do tamanho das microvesículas
A Tabela 3 apresenta a média e o desvio padrão da concentração do número de microvesículas circulantes. Nenhuma diferença estatística entre todos os grupos estudados e os controles, observamos que as quantidades dosadas foram similares (Figura 3A, p=0,1349; one-way ANOVA). Considerando apenas os grupos com Sepse ou Sepse associada à Síndrome do Desconforto Respiratório Agudo (Sepse+SDRA) e as coletas feitas em dois momentos (24 e 72h) de internação na UTI, a quantidade de microvesículas e exossomos circulantes permanece similar (p>0,05 ; two-way ANOVA). Entretanto, quando consideramos apenas os pacientes com Sepse + SDRA (n=5), os dados já indicam uma diminuição estatisticamente significativa após 3 dias de internação na UTI (p=0,0175, Teste T pareado).
Tabela 3 – Concentração plasmática de microvesículas circulantes.
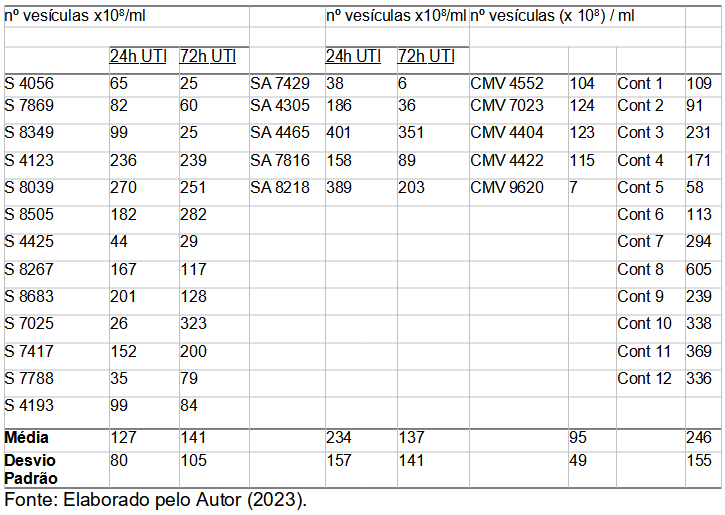
*S = Sepse; SA = Sepse+SDRA; CMV = Controle ventilação mecânica; Cont = Controle sadio.
Figura 3 – Concentração de microvesículas circulantes no plasma.
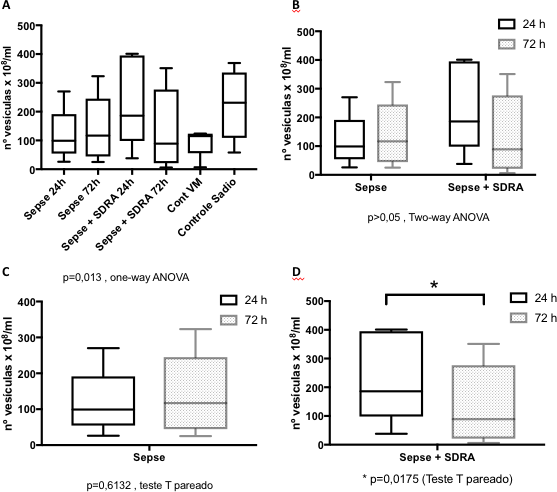
Pacientes com diagnóstico de Sepse (n= ou Sepse associada à Síndrome do Desconforto Respiratório Aguda (SDRA), tiveram amostras de sangue coletadas nas primeiras 24h e 72 horas após admissão na unidade de terapia intensiva. Como controles foram considerados pacientes sob ventilação mecânica (Cont VM) ou voluntários sadios. Não foram considerados pacientes com sepse de origem pulmonar ou com alguma doença prévia no pulmão. As microvesículas foram isoladas por ultracentrifugação e quantificadas pelo equipamento NanoSight. Os resultados estatísticos são indicados.
Outra informação importante obtida pela técnica de NTA é o perfil de tamanho das microvesículas em cada amostra. Como podemos observar na Figura 4, o tamanho das microvesículas isoladas pela ultracentrifugação varia de 60 a 260 nanômetros (nm) de tamanho, conforme esperado e já observado no estudo anterior81. A principal população de MVs isoladas em todos os grupos foi de 155 e 165nm. Aparentemente, a quantidade de microvesículas circulantes de diferentes tamanhos parece ser menor nos pacientes com sepse quando comparado aos pacientes com síndrome do desconforto respiratório aguda associada à sepse ou quando comparados aos demais grupos.
Figura 4 – Perfil de distribuição de tamanho das microvesículas na sepse ou na sepse associada à insuficiência respiratória.
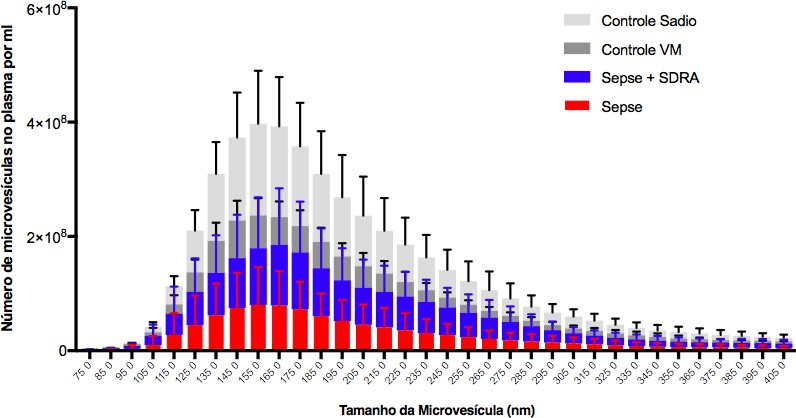
O gráfico representa a concentração de microvesículas plasmáticas de acordo com o tamanho. Os exossomos foram isolados do plasma por ultracentrifugação e avaliados pelo equipamento Nanosight.
4.4 Extração de microRNA das microvesículas e exossomos
Devido a menor quantidade de plasma utilizada neste projeto, alguns ajustes no protocolo de extração precisaram ser feitos para obter massa de RNA suficiente, conforme descrito em material e métodos.
A quantidade e pureza do RNA obtido foram determinadas em espectrofotômetro (NanoDrop) e são apresentadas na Tabela 4. A qualidade e tamanho dos RNAs obtidos foram avaliadas no equipamento Bioanalyzer 2100 (Agilent) com o chip RNA Pico 6000 (Agilent #5067-1513). A Figura 5 mostra que os RNAs extraídos dos exossomos são ricos em RNA curto, com tamanho de 25 a 200 nucleotídeos (nt), sugerindo a presença de microRNAs e RNAs mensageiros nas amostras. A imagem do gel mostra ainda que os exossomos não possuem nenhuma quantidade de RNA ribossomal (18S e 28S rRNA). Esses resultados vão de encontro a dados previamente publicados que relatam que a presença de RNA nós exossomos humanos contém RNA com pouco ou nenhum RNA ribossomal.3
Tabela 4. Espectrofotometria dos RNAs extraídos de exossomos e microvesículas do plasma
Volume Plasma Ultracentrifugado(ml) Concentração[ng/ul] 260/ 280nm 260/ 230nm 1 S 4056 A 5,4 15,9 2,59 0,03 2 S 4056 B 5,4 15,2 0,191 0,02 3 S 4193 A 5,4 17,2 2,21 0,03 4 S 4193 B 5,4 21,4 1,44 0,13 5 S 4123 A 5,4 18,1 2,2 0,01 6 S 4123 B 5,4 15,8 1,49 0,25 7 SA 4305 A 5,4 16,9 2,78 0,04 8 SA 4305 B 5,4 15,3 1,41 0,19 9 S 4425 A 5,4 25,5 1,38 0,07 10 S 4425 B 5,4 23,2 1,47 0,1 11 SA 4465 A 5,4 20,5 1,44 0,18 12 SA 4465 B 5,4 14,9 1,63 0,04 13 CMV 4552 5,4 16,2 1,44 0,16 14 CMV 7023 5,4 14,6 1,64 0,03 15 CMV 4404 5,4 16 1,5 0,19 16 CMV 4422 5,4 18,5 1,55 0,09 17 SA 7816 A 5,4 13,7 1,7 0,03 18 SA 7816 B 5,4 14,3 1,99 0,02 19 S 7869 A 5,4 15,1 1,64 0,08 20 S 7869 B 5,4 16,1 2,22 0,03 21 S 8039 A 5,4 17,2 1,47 0,13 22 S 8039 B 5,4 17,1 1,56 0,07 23 SA 8218 A 5,4 15,9 1,77 0,03 24 SA 8218 B 5,4 15,7 2,27 0,03 25 S 8267 A 5,4 22,2 1,47 0,07 26 S 8267 B 5,4 14,3 1,46 0,3 27 S 8349 A 5,4 12,5 1,47 0,23 28 S 8349 B 5,4 14,5 1,44 0,19 29 S 8505 A 5,4 15,8 1,54 0,06 30 S 8505 B 5,4 14,6 1,53 0,08 31 S 8683 A 5,4 70,8 0,9 0,15 32 S 8683 B 5,4 21 1,52 0,07 33 CMV 9620 5,4 14,6 1,61 0,03 34 CMV 9892 5,4 17,5 1,6 0,05 35 S 10595 A 5,4 13,7 1,61 0,04 36 S 10595 B 5,4 18,6 1,48 0,13 37 S 7025 A 1.8 17,7 1,45 0,15 38 S 7025 B 1.8 10,7 1,52 0,06 39 S 7417 A 1.8 15,3 1,49 0,23 40 S 7417 B 1.8 14,5 1,51 0,17 41 S 7788 A 1.8 24,3 0,84 0,23 42 S 7788 B 1.8 13,9 1,58 0,05 43 Cont 1 5.4 14,4 1,52 0,05 44 Cont 2 5.4 12,5 2,05 0,02 45 Cont 3 5.4 16,9 1,64 0,03 46 Cont 4 5.4 14,2 1,91 0,02 47 Cont 5 5.4 11,2 1,74 0,02 48 Cont 6 5.4 84,3 0,94 0,14 49 Cont 7 5.4 13,2 1,69 0,05 50 Cont 8 5.4 15,7 1,61 0,08 51 Cont 9 5.4 13,1 1,49 0,22 52 Cont 10 5.4 13,8 1,51 0,17 53 Cont 11 5.4 15,4 1,66 0,06 54 Cont 12 5.4 17,6 1,58 0,06 55 SA 7429 A 3,6 14,6 1,6 0,06 56 SA 7429 B 3,6 20,6 1,42 0,09
Figura 5. Avaliação dos microRNAs isolados de exossomos e microvesículas circulantes por eletroforese.
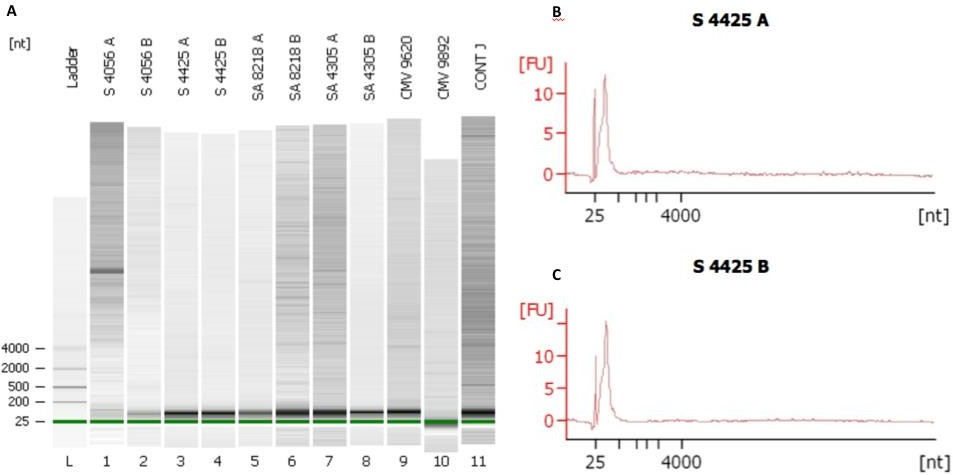
Pacientes sépticos (S) com ou sem síndrome do desconforto respiratório aguda (SA) tiveram amostras de sangue coletadas nas primeiras 24 (A) e 72h (B) de internação na UTI. Voluntários sadios (Cont) ou pacientes na UTI sob ventilação mecânica sem sepse (CMV) ou doença pulmonar foram coletados como controles. As canaletas (Painel A) representam a eletroforese capilar de cada uma das amostras (1 µl) no Bionalyzer avaliadas com o RNA Pico Chip. Em todas as amostras são observadas a presença de RNA pequenos e ausência de RNA ribossomal. Os painéis B e C mostram em detalhes o eletroferograma de um paciente (S 4425) com sepse em dois momentos (A e B) durante a internação da UTI. Experimentos representativos.
4.5 Análise dos dados de qPCR
Os dados brutos das 8 placas de qPCR array (TLDA) foram avaliados no software online Thermo Fisher Cloud (Applied Biosystems, Thermo). Considerando todas as amostras, as correções de baseline foram determinadas automaticamente enquanto o ajuste de threshold cycle (Ct) foi feito manualmente para cada um dos microRNAs. Nesta etapa, duas amostras (Controle 3 e S 4056 A) apresentaram erro de amplificação e foram excluídos das análises posteriores.
Para escolha do normalizador, havia quatro candidatos possíveis a serem utilizados: U6, miR-106a, miR-20a e miR-26. O único microRNA que foi expresso em todas as amostras foi o snRNU6 e, portanto, escolhido como normalizador.
O programa Thermo Fisher Cloud usa o método de Ct comparativo para análise quantitativa relativa, e os resultados são expressos como razões dos níveis de expressão (valores de DDCt). O teste estatístico aplicado foi o Teste T, considerando como significativas razões de expressão maior ou menor do que 1,5.
Inicialmente, comparamos a diferença de cada grupo biológico versus o controle sadio, considerando todas as amostras dentro de cada grupo. Nestes resultados, observamos que vários microRNAs apresentam menores quantidades de microRNAs sendo transportados na circulação em relação aos indivíduos saudáveis (Tabela 5).
Tabela 5. Quantificação relativa dos microRNAs transportados pelas microvesículas circulantes avaliados por PCR em tempo real em relação a indivíduos sadios
microRNA Quantificação
relativaP valor Cont Ventilação Mecânica vs Controle hsa-miR-1243-002854 -3,6 0,006 hsa-miR-99b-002196 -2,7 0,04 Sepse vs Controle hsa-miR-193a-5p-002281 -6,9 0,012 hsa-miR-148b-000471 -13,5 0,013 hsa-miR-199a-3p-002304 -15,4 0,018 hsa-miR-625*-002432 -8,1 0,012 hsa-miR-1243-002854 -2,6 0,037 Sepse + SDRA vs Controle hsa-miR-1243-002854 -4,0 0,0002 hsa-miR-127-000452 -166,7 0,002 hsa-miR-148b-000471 -27,0 0,005 hsa-miR-199a-3p-002304 -28,6 0,005 hsa-miR-340-002258 -47,6 0,07 hsa-miR-744-002324 -142,9 0,07 hsa-miR-625-002432 -13,2 0,09 hsa-miR-766-001986 -83,3 0,09 hsa-miR-339-3p-002184 -29,4 0,04 hsa-miR-222-002276 -7,1 0,016 hsa-miR-340-002259 -10,1 0,035 hsa-miR-598-001988 -4,4 0,036
Controle Sadio (n=11); Controle Ventilação Mecânica (n=6); Sepse (n=25); Sepse + Síndrome do Desconforto Respiratório Aguda (n=11). Análise estatística: Teste T. RNU6 foi usado para normalização dos dados.
4.6 MicroRNAs alterados na sepse quando associada à Síndrome do Desconforto Respiratório Aguda
Numa segunda análise, comparamos quais microRNAs aparecem em quantidades significativamente diferentes transportados pelas vesículas quando a sepse está associada a SDRA. Pelos dados iniciais, percebemos nove microRNAs em menor quantidade no grupo com sepse, e apenas um microRNA em maior quantidade no grupo com Sepse+SDRA (Figura 6).
Figura 6. MicroRNAs alterados na sepse quando associada à síndrome do desconforto respiratório aguda.
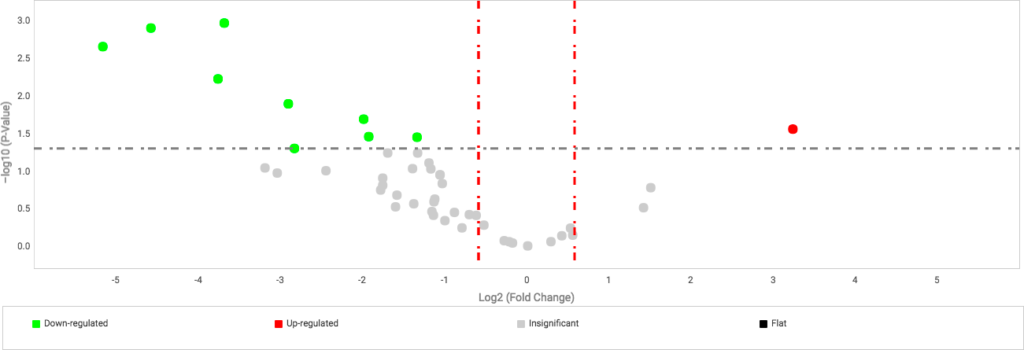
Amostras de sangue foram coletadas nas primeiras 24h e 72h de internação da UTI e as microvesículas isoladas por ultracentrifugação. O gráfico demonstra um volcano plot dos 48 microRNAs avaliados por PCR em tempo real mostrando a expressão de cada alvo nos pacientes com sepse e SDRA (n=10 amostras) quando comparados aos pacientes com apenas sepse (n=24 amostras). Nove microRNAs são transportados em menores quantidades sendo eles: miR-766 (-35,7 ; p=0,002), miR-127 (-23,8 ; p=0,001), miR-340 (-13,5 ; p=0,006), miR-29b (-12,8 ; p=0,001), miR-744 (-7,1 ; p=0,05), miR-618 (-4,0 ; p=0,02), miR-598 (-3,8 ; p=0,035), miR-1260 (-2,5 ; p=0,035). Por outrolado, o miR-885-5p está em níveis elevados (9,5 ; p=0,028). Teste T (Cloud software, thermofisher). Dados normalizados com RNU6.
Uma análise ainda mais detalhada foi realizada considerando as amostras pareadas de cada paciente, coletadas em dois momentos na UTI. Cada um dos 48 microRNAs foi avaliado individualmente no programa estatístico GraphPad Prism considerando teste de Wilcoxon pareado para amostras não paramétricas. O miR-194 não amplificou e não foi estudado. Confome mostra a Figura 7 abaixo, os dados preliminares já apontam para microRNAs que estão sendo transportados em quantidades diferentes dentro das microvesículas circulantes nos dois momentos da sepse e que o envolvimento do pulmão na resposta inflamatória sistêmica parece de fato influenciar nos microRNAs associados às MVs no plasma. Interessante observar que, de modo geral, o conjunto de microRNAs que está alterado na sepse associada à síndrome do desconforto é diferente daqueles observados nos pacientes diagnosticados apenas com sepse em suas amostras pareadas. Apenas o miR-25 e miR-199a-3p é que aparecem como importantes em ambos os contextos, onde após 72h de internação na UTI, seus níveis reduzem significativamente dentro das microvesículas no sangue.
Figura 7. Perfil molecular de 48 microRNAs transportados por exossomos e microvesículas ao longo da internação em unidade de terapia intensiva.
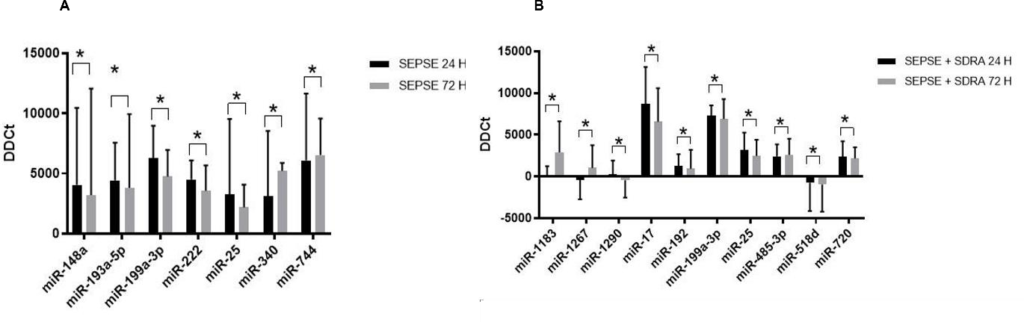
Pacientes com diagnóstico de sepse (Gráfico A, n=12) ou sepse associada à síndrome do desconforto (Gráfico B, n=5) foram avaliados quanto ao conteúdo molecular de suas microvesículas circulantes por PCR em tempo real. As barras pretas referem-se as primeiras 24 horas de internação na UTI, enquanto as cinzas representam 72 horas após.Os dados brutos de Ct foram normalizados com pelos níveis snRNU6 (DDCt). As diferenças estatísticas são indicadas. *P<0,05, teste de Wilcoxon-pareado (GraphPad Prism software).
Uma vez que qualquer dosagem em seres humanos tende a ter resultados bastante heterogêneos dentro de um mesmo grupo, e que ainda não completamos e que ainda não completamos o número de pacientes em todos os braços. A Tabela 6 abaixo mostra os microRNAs significativos das análises pareadas e em quais comparações do projeto anterior também foram encontrados como estatisticamente relevantes. A tabela também leva em consideração se cada microRNA já foi identificado no tecido pulmonar.
Tabela 6. miRNAs significativos nas análises pareadas e comparação com resultados do estudo anterior
Análise Pareada Estudo Atual Comparação significativa do estudo anterior miRNA já descrito
no pulmão (Tissue miRNA)miR-1183 Sepse + SDRA SepD0 morte x SepD0 sobrev sim
mir-1267
Sepse + SDRASepD0 morte x SepD0 sobrev e SepD7xCont
nãomiR-1290 miR-192
Sepse + SDRA
SepD0xCont e SepD7xCont
simmiR-485-3p miR-518d
Sepse + SDRA
SepD0 morte x SepD0 sobrev
nãomiR-720 Sepse + SDRA SepD0xCont ; SepD7xCont não miR17 Sepse + SDRA *normalizador sim miR148a Sepse SepD0 morte x SepD0 sobrev sim miR-222-3p Sepse SepD0 morte x SepD0 sobrev sim miR-340 Sepse SepD0xCont miR-193a-5p miR-744
Sepse
SepD0xCont ; SepD7xCont
simmiR-199a-3p Sepse e Sepse+SDRA SepD0xCont e SepD7xCont sim
miR-25
Sepse e Sepse+SDRASepD0 morte x SepD0 sobrev ; SepD0xCont ; SepD7xCont
não
Legenda: SepD0 – Sepse Dia Zero (primeiras 48 horas de internação na UTI) SepD7 – Sepse Dia Sete (7 dias de internação na UTI)
Cont – Controles (indivíduos sadios)
SepD0 morte – pacientes que evoluíram a óbito (amostra coletada nas primeiras 48h na UTI) SepD0 sobrev – pacientes que sobreviveram (amostra coletada nas primeiras 48h na UTI)
Os níveis dos 48 microRNAs avaliados por PCR em tempo real nos pacientes com sepse e SDRA (n=10 amostras) foi comparada aos pacientes com apenas sepse (n=24 amostras). Nove microRNAs foram encontrados sendo transportados em menores quantidades nas microvesículas circulantes sendo eles: miR-766, miR-127, miR-340, miR-29b, miR-744, miR-618, miR-598 e miR-1260. Por outro lado, o miR-885-5p encontra-se em níveis elevados no grupo com Sepse + SDRA (Tabela 7).
Tabela 7. Níveis de expressão de microRNAs nos pacientes com Sepse associada à Síndrome do Desconforto Respiratório Aguda em relação aos níveis de pacientes com sepse sem disfunção pulmonar.
miRBase ID Quantificação relativa P valor hsa-miR-766-3p -35.7 0.002 hsa-miR-127-3p -23.8 0.001 hsa-miR-340-5p -13.5 0.006 hsa-miR-29b-3p -12.8 0.001 miR-744 -7.1 0.05 hsa-miR-618 -4.0 0.02 hsa-miR-598-3p -3.8 0.035 hsa-miR-1260a -2.5 0.035 hsa-miR-885-5p 9.5 0.028
Ao considerar os dados da tabela acima, estatisticamente significativos, a análise de bioinformática fez inicialmente uma predição para descobrir quais os possíveis RNAs mensageiros são alvos destes microRNAs. Em seguida, a análise apontou quais vias de sinalização são potencialmente alteradas por estes microRNAs transportados pelas microvesículas circulantes, quando a sepse está ou não associada a síndrome do desconforto respiratória aguda, conforme demonstra a Figura 8. Importante ressaltar que a análise considerou apenas alvos dos microRNAs (RNAs mensageiros) que já foram descritos pela literatura como validados experimentalmente.
Figura 8. Vias biológicas potencialmente influenciadas por microRNAs.
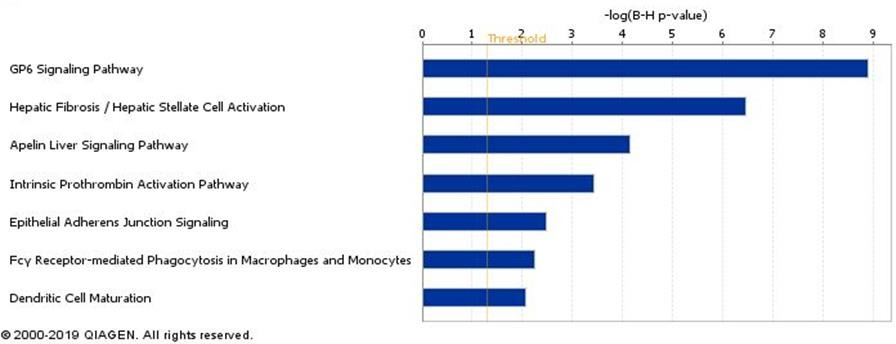
São diferencialmente expressos sendo transportados por exossomos circulantes em pacientes com sepse associada à síndrome do desconforto respiratório agudo (n=10 amostras ; n=5 pacientes) quando comparados aos pacientes com sepse (n=24 amostras ; n=12 pacientes). As amostras foram obtidas na admissão à unidade de terapia intensiva (24h) e 3 dias após.
A Figura 8 mostra os microRNAs e os RNAs mensageiros alvos possivelmente afetados pelos Exo-microRNAs sendo transportados nos pacientes com síndrome do desconforto na sepse quando comparados aos pacientes com sepse sem comprometimento pulmonar.
Figura 9. MicroRNAs transportados por exossomos circulantes em quantidades significativamente aumentadas (cor verde) ou diminuídas (cor vermelha) e seus possíveis efeitos em plaquetas e/ou megacariócitos em pacientes ao longo da internação em unidade de terapia intensiva com sepse associada à disfunção respiratória quando comparado aos pacientes com sepse sem comprometimento pulmonar.
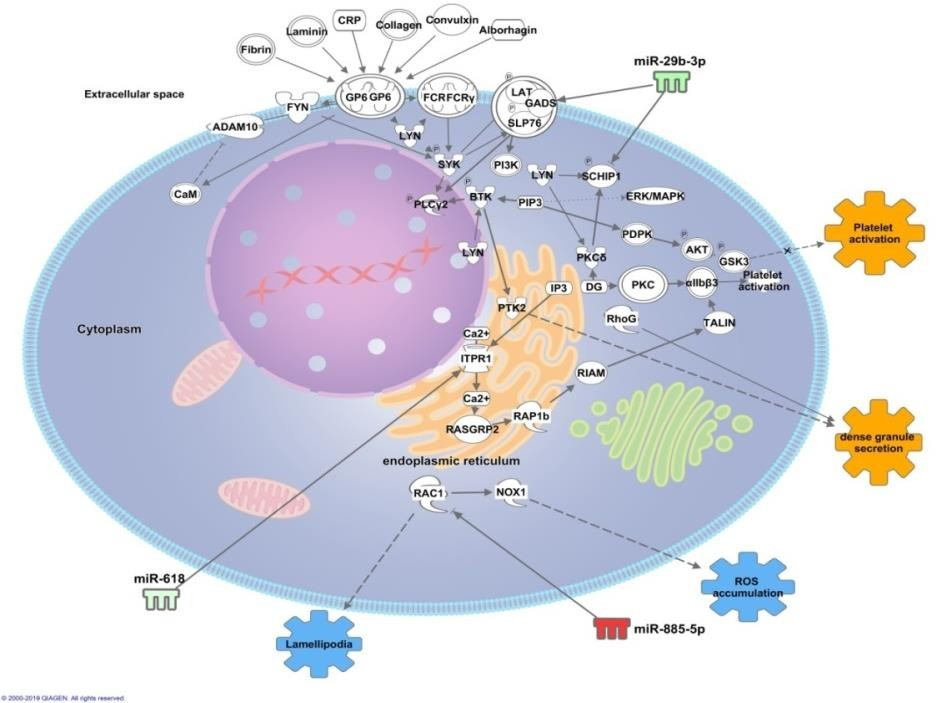
A figura mostra os possíveis RNAs mensageiros sendo regulados pelos Exo-microRNAs. A figura 9 ilustra o transporte de microRNAs mencionados, em conjunto com seus possíveis efeitos. Nota-se que há diferença entre o efeito em pacientes com sepse acompanhada de disfunção respiratória e o efeito em pacientes com sepse sem acometimentos pulmonares.
4.7 Dosagem proteica de SP-D1 e uteroglobina pela técnica de ELISA nas microvesículas isoladas e no plasma
Pelo fato da injúria no epitélio e endotélio pulmonar serem a base da patogênese nos estágios precoces da SDRA, avaliamos se proteínas exclusivas do tecido pulmonar, consideradas marcadores de injúria do epitélio pulmonar, podem ser encontradas nas microvesículas circulantes. As proteínas surfactant protein D – SP-D (R&D Systems #DY1920) e club cell secretory protein – CC-16 (uteroglobina R&D Systems #DY4218) foram investigadas por ELISA nas microvesículas isoladas do plasma por ultracentrifugação.
Os experimentos foram feitos em duplicata seguindo o protocolo do fabricante e lidos pelo equipamento SpectraMax M5 (Tecan). As curvas-padrão apresentaram boa correlação entre as concentrações (R2=0,99), sendo a sensibilidade do teste de Uteroglobina de 62,5 pg/ml e 39 pg/ml para SP-D.
Tabela 8. Quantificação de proteínas exclusivas do pulmão em microvesículas circulantes e plasma de pacientes por ELISA.
UTEROGLOBINA(pg/ml) SP-D(pg/ml) Amostra Microvesícula Plasma Microvesícula Plasma S 10595 A 393 7.267 936 <Min S 10595 B <Min 10.402 954 <Min S 4056 A <Min 4.175 891 701 S 4056 B <Min 4.072 777 514 S 4193 A <Min >Max <Min <Min S 4193 B <Min 15.544 <Min <Min S 7869 A 440 >Max 1.054 1.155 S 7869 B 359 >Max 483 <Min S 8349 A 383 ⎯ <Min ⎯ S 8349 B 39 ⎯ <Min ⎯ S 4123 A 58 >Max 1.018 716 S 4123 B <Min 14.170 774 664 S 8039 A <Min >Max 714 3.774 S 8039 B 327 12.917 3.054 1.709 S 8505 A 249 ⎯ <Min ⎯ S 8505 B 906 ⎯ <Min ⎯ S 4425 A 328 >Max 962 362 S 4425 B 363 >Max 808 466 S 8267 A 366 ⎯ <Min ⎯ S 8267 B 270 ⎯ <Min ⎯ S 8683 A 262 >Max <Min <Min S 8683 B 371 >Max <Min <Min S 7025 A 80 ⎯ 179 ⎯ S 7025 B 53 ⎯ <Min ⎯ S 7417 A <Min ⎯ 537 ⎯ S 7417 B <Min ⎯ <Min ⎯ S 7788 A <Min ⎯ <Min ⎯ S 7788 B <Min ⎯ <Min ⎯ Média 309 9.793 939 1.118 SA 4305 A <Min >Max 188 <Min SA 4305 B <Min 12.146 1.007 <Min SA 7429 A <Min >Max <Min 393 SA 7429 B <Min 12.268 108 133 SA 4465 A <Min >Max 3.162 19.892 SA 4465 B <Min >Max 1.846 2.366 SA 7816 A <Min 12.717 <Min <Min SA 7816 B <Min 9.480 <Min <Min SA 8218 A 537 >Max 946 <Min SA 8218 B 558 >Max 758 613 Média 547 11.653 1.145 4.679 CVM 4552 <Min 2.865 <Min <Min CVM 4422 <Min >Max <Min CVM 7023 <Min >Max 3.074 929 CVM 9620 <Min >Max <Min 2.645 CVM 4404 <Min 3.016 <Min <Min CVM 9892 <Min 15.785 <Min 503 Média 7.222 3.074 1.359 Cont 1 243 <Min Cont 2 <Min 14.150 <Min <Min Cont 3 114 15.478 <Min <Min Cont 4 <Min 9.032 <Min <Min Cont 5 <Min ⎯ <Min ⎯ Cont 6 <Min <Min <Min 193 Cont 7 <Min 6.325 <Min 4.554 Cont 8 <Min 9.813 <Min 619 Cont 9 <Min 13.162 <Min <Min Cont 10 2.118 ⎯ <Min ⎯ Cont 11 <Min 13.358 <Min 7.090 Cont 12 <Min 12.322 <Min 5.707 Média 2.118 12.164 3.633
Fonte: Elaborado pelo Autor (2023).
Legenda: S – Sepse
SA – Sepse associada à síndrome do desconforto respiratório aguda A – Amostra coletada nas primeiras 24h de admissão na UTI
B – Amostra coletada após 72h de admissão na UTI CMV – Controle ventilação mecânica
Cont – Controles (indivíduos sadios)
>Max – valores de absorbância acima do limite de detecção
<Min – valores de absorbância abaixo do limite de detecção
⎯ Amostras com volume esgotado
5 DISCUSSÃO
Este projeto buscou investigar possíveis miRNAs transportados por microvesículas e exossomos na circulação de paciente com sepse associada à síndrome do desconforto respiratório agudo a fim de trazer uma nova luz ao papel desses agentes biológicos como biomarcadores e colocando luz em novos miRNAs que possivelmente possuem funções na patofisiologia da doença. O estudo traz dados inéditos na literatura.
O plasma foi previamente filtrado em filtros de tamanho de 100 uM antes do isolamento das microvesículas por ultracentrifugação, o que favoreceu a presença de uma população pequena isolada conforme pretendido, tamanho esse característico de exossomos (0-100 nm). De fato, a ausência de RNA ribossomais observado na análise por eletroforese confirmou termos isolado prioritariamente exossomos da circulação.
Observamos que as quantidades circulantes dos exossomos isolados do plasma são similares entre os pacientes de estudo e os controles sadios ou controles sob ventilação mecânica. Porém, a quantidade de exossomos no sangue diminuiu significativamente três dias após a internação na UTI no grupo de sepse com SDRA. Alguns estudos já mostraram correlação entre o número de microvesículas circulantes e exossomos e evolução de doenças83. Futuramente seria interessante uma análise com maior número de pacientes com SDRA ao longo de sua internação da UTI para melhor avaliação se a quantidade de microvesículas e exossomos circulantes pode ser correlacionada com algum desfecho clínico.
Na primeira análise realizada referente ao conteúdo de miRNAs exossomais comparando pacientes com sepse versuscontrole sadio ou sepse mais SDRA versuscontrole sadio, observamos que a sepse promove alteração dos EVs-miRNAs, mas quando está associada à SDRA, uma maior quantidade de miRNAs é alterada. Dentre os doze miRNAs regulados negativamente no grupo Sepse+SDRA versus controle, o miR-127 está 166 vezes menos expresso do que nos controles sadios.
Numa segunda análise, quando foi comparada a expressão dos miRNAs transportados exossomos nos pacientes com sepse e SDRA em relação aos pacientes com apenas sepse, nove microRNAs são transportados em menores quantidades sendo o miR-766 (-35,7 ; p=0,002), miR-127 (-23,8 ; p=0,001) e miR-340 (-13,5 ; p=0,006) os que apresentaram maior alteração. Em contrapartida, o miR-885- 5p está em níveis mais elevados (9,5 ; p=0,028) nos pacientes com sepse e síndrome do desconforto respiratório.
Em 2021, Hui Lin e colaboradores mostraram que o miR-127 sérico se correlaciona positivamente com a severidade da SDRA, numa análise feita em 70 pacientes com SDRA comparados à 60 indivíduos sadios81. Em nosso estudo anterior, quando comparamos os pacientes com Sepse com 24 horas de internação na UTI, ou 7 dias depois, encontramos o mesmo miR-127, porém expresso em menores quantidades do que os indivíduos sadios (D0: -5,2 e D7: -6,6 vezes). No presente estudo, o miR-127 também esteve menos expresso (-166,7 vezes ,p=0,002) nos exossomos de pacientes com Sepse + SDRA (tabela 5) quando comparado aos controles sadios, e -23,8 vezes expresso em exossomos circulantes de pacientes com Sepse+SDRA quando comparados a apenas sepse. Embora nossos achados sejam contrários aos publicados por Hui Lin e cols, é importante notar que na referida pesquisa foi realizada uma análise de todo miRNA circulante. Uma vez que o miRNA por estar presente na circulação sanguínea associados a proteínas RNA-obrigatórias, este fato poderia explicar a diferença entre os estudos.
Além disso, outro dado importante é que quando as plaquetas não são ativadas (ou seja, quando estão em um estágio fisiologicamente normal), a quantidade de miR- 127 é maior que a do miR-320a.
Um estudo brasileiro realizado em 2021 com 200 pacientes internados na UTI (24 horas), observou de fato que entre os 140 pacientes que desenvolveram sepse, foi encontrada uma menor quantidade do miR-127 em relação ao miR-320a, utilizando amostras de plasma enriquecido em plaquetas. Os autores sugerem miRNAs são sensíveis ao processo de ativação plaquetária e sua medição em pacientes da UTI pode indicar quais pacientes sofreram coagulação intravascular disseminada, que é uma complicação comum e com risco de vida da sepse84.
Além de encontrado no soro de pacientes com ARDS, o miR-127 está relacionado também a vias de sinalização de genes supressores de tumor81.
O único miRNA exossomal que esteve aumentado na sepse associada à SDRA foi miR-885-5p. Até o presente momento não há publicação deste miRNA com relação especificamente à SDRA. Com relação à sepse, mesmo não sendo totalmente conhecido seu mecanismo de ação, ficou comprovada a elevação induzida de citocinas inflamatórias durante o processo de sepse81.
Considerando a análise pareada dos pacientes com SDRA associada ou não à sepse (Figura 7), observamos que para alguns quase não existem publicações a respeito no contexto de doenças pulmonares ou sepse, como miR-1183, miR-1267, miR-518, mostrando que sua importância neste contexto é totalmente inédito. Já o miR-485 tem atualmente 65 publicações científicas relacionadas, sendo 5 artigos relacionados a doenças pulmonares como infecção por influenza, doença pulmonar obstrutiva crônica, carcinoma do pulmão de pequenas células e apneia obstrutiva do sono79.
De acordo com os Exo-microRNAs diferencialmente expressos entre os pacientes ao longo da sua internação na UTI, observa-se na Figura 2 que, possivelmente, a via clássica do GP6 está sendo a mais significativamente afetada pelos Exo-microRNAs circulantes.
A GPVI é uma glicoproteína de membrana (58 kD), membro da superfamília de imunoglobulinas, que é expressa na superfície das plaquetas e de seus percursores megacariócitos. A proteína codificada por este gene é um receptor para o colágeno e desempenha um papel crítico na agregação plaquetária induzida pelo colágeno e na formação de trombos. Quando existe lesão na parede do vaso e subsequente dano ao revestimento endotelial, a exposição da matriz subendotelial ao fluxo sanguíneo resulta na deposição de plaquetas. A proteína codificada pelo gene GPVI forma um complexo com a cadeia gama do receptor Fc que inicia a cascata de sinalização de ativação plaquetária após a ligação do colágeno. Em condições fisiológicas, o agregado plaquetário resultante é o evento hemostático inicial que limita a perda de sangue. No entanto, a exposição do colágeno após a ruptura das placas ateroscleróticas é um importante estímulo para a formação de trombo associado a infarto do miocárdio ou acidente vascular cerebral. Mutações neste gene são uma causa do distúrbio hemorrágico do tipo plaqueta-11 (BDPLT11) 7.
Os distúrbios na cascata de coagulação são reconhecidos como importante mecanismo envolvido na patofisiologia da sepse. A síndrome do desconforto respiratório agudo é a disfunção orgânica mais comum na sepse, sendo caracterizada justamente pela ruptura da integridade da barreira endotelial e dano pulmonar difuso. O desequilíbrio entre a coagulação e a inflamação é uma característica predominante da SDRA, levando a uma resposta inflamatória extrema e à deposição difusa de fibrina no leito capilar vascular e nos alvéolos. As plaquetas ativadas, os neutrófilos, as células endoteliais, as armadilhas neutrophil extracellulartrapsproduzidas pelos neutrófilos, as microvesículas e as proteases da coagulação participam do complexo processo de imunotrombose, que é um evento-chave na fisiopatologia da SDRA11.
Por outro lado, já foram demonstrados que as vesículas extracelulares, especialmente das derivadas de plaquetas (conhecidas como micropartículas), contribuem para o estado hipercoagulável e hipofibrinolítico do pulmão, que está fortemente associado à fisiopatologia da SDRA. Sabe-se que as micropartículas carregam Tissue Fator (TF), o mais conhecido iniciador celular primário da coagulação sanguínea após dano endotelial20. Um artigo de Zheng et. al.66 analisa tal relação por meio de um estudo com pacientes acometidos pela sepse.
O choque séptico e outras complicações associadas à sepse também demonstram possuir relação com as microvesículas, conforme apontam estudos recentes na área65. Inclusive, Monnamorn et. al.62 afirmam que as microvesículas são fundamentais para diferenciar infecção de choque séptico, pois servem como indicadores do acometimento.
Interessantemente, Bastarache, J. e Fremont, R. (2009), demonstraram que o fluido de edema pulmonar de pacientes com SDRA continha uma quantidade maior de micropartículas expressando TF em comparação com o fluido obtido de paciente controle. Curiosamente, esses MPs pró-coagulantes conferiram uma tendência a maior mortalidade.
A proteína surfactante SP-D já foi apontada na literatura como um possível biomarcador para diagnóstico de SDRA nas primeiras 48h de admissão em UTI60. No intuito de avaliar se as microvesículas encontradas no plasma poderiam estar transportando proteínas exclusivas do tecido pulmonar, foram dosadas por ELISA as proteínas surfactantproteinD(SP-D) e clubcellsecretoryprotein(CC-16– uteroglobina) tanto nas microvesículas isoladas do plasma por ultracentrifugação como também no plasma. Era de se esperar que tais proteínas fossem encontradas no plasma ou microvesículas somente em pacientes com síndrome do desconforto respiratório agudo ou com alguma doença pulmonar. Entretanto, detectamos ambas as proteínas também em voluntários sadios, o que pode sugerir uma inespecificidade do anticorpo utilizado. Experimentos futuros para padronização adequada destes marcadores a fim de testar sua especificidade ou troca dos kits necessitariam ser realizados.
A área de pesquisa referente a relação entre doenças e microvesículas apresenta grandes avanços e pode ser muito promissora61. No caso do presente estudo, os dados vão de encontro e estão em consonância com todas as observações científicas descritas acima, além de acrescentarem a estudos recentes que analisam o efeito de microvesículas na sepse e na SDRA61-66. A partir de tais resultados, pela primeira vez na literatura, demonstrou-se a existência de microRNAs transportados por microvesículas circulantes, que possivelmente influenciam a via de imunotrombose e que claramente estão distinguindo pacientes com sepse quando apresentam SDRA.
6 CONCLUSÃO
Atualmente, surgem a cada dia novos estudos mostrando a função biológica das microvesículas e exossomos e como seu conteúdo biológico impacta a patofisiologia de diversas doenças. A pesquisa realizada demonstrou que microvesículas realizam o transporte de microRNAs, o que possibilitou a diferenciação da sepse em pacientes portadores e não-portadores da SDRA. Quando há a presença de insuficiência respiratória grave no contexto da sepse, o miR-885-5p é encontrado em maiores quantidades dentro de microvesículas e exossomos circulantes, enquanto um conjunto de miRNAs apresenta-se mais elevado quando há somente o quadro de sepse sem comprometimento pulmonar (miR-766, -127, -340, -29b, 744, -618, -598, 1260). Os miRNAs encontrados apresentam impacto importante na via da cascata de coagulação. Desta forma, a presença da SDRA durante a sepse demonstra interferência na produção de microvesículas e exossomos circulantes e seu conteúdo.
Estudos futuros poderão trazer maior luz ao desenvolvimento de pesquisas na área, onde será possível estabelecer parâmetros mais precisos e possivelmente descobrir nova ferramenta de diagnóstico.
REFERÊNCIAS
- Fleury A, Martinez MC, Le Lay S. Extracellular vesicles as therapeutic tools in cardiovascular diseases. Front Immunol. 2014 Aug 4;5:370. doi: 10.3389/fimmu.2014.00370. PMID: 25136343; PMCID: PMC4120684.
- Raposo G, Stoorvogel W. Extracellular vesicles: exosomes, microvesicles, and friends. J Cell Biol. 2013 Feb 18;200(4):373-83. doi: 10.1083/jcb.201211138. PMID: 23420871; PMCID: PMC3575529.
- Thakur BK, Zhang H, Becker A, Matei I, Huang Y, Costa-Silva B, Zheng Y, Hoshino A, Brazier H, Xiang J, Williams C, Rodriguez-Barrueco R, Silva JM, Zhang W, Hearn S, Elemento O, Paknejad N, Manova-Todorova K, Welte K, Bromberg J, Peinado H, Lyden D. Double-stranded DNA in exosomes: a novel biomarker in cancer detection. Cell Res. 2014 Jun;24(6):766-9. doi: 10.1038/cr.2014.44. Epub 2014 Apr 8. PMID: 24710597; PMCID: PMC4042169.
- Colombo M, Raposo G, Théry C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annu Rev Cell Dev Biol. 2014;30:255-89. doi: 10.1146/annurev-cellbio-101512-122326. Epub 2014 Aug 21. PMID: 25288114.
- Robbins PD, Morelli AE. Regulation of immune responses by extracellular vesicles. Nat Rev Immunol. 2014 Mar;14(3):195-208. doi: 10.1038/nri3622. PMID: 24566916; PMCID: PMC4350779.
- Villarroya-Beltri C, Baixauli F, Gutiérrez-Vázquez C, Sánchez-Madrid F, Mittelbrunn M. Sorting it out: regulation of exosome loading. Semin Cancer Biol. 2014 Oct;28:3-13. doi: 10.1016/j.semcancer.2014.04.009. Epub 2014 Apr 23. PMID: 24769058; PMCID: PMC4640178.
- Pegtel DM, Cosmopoulos K, Thorley-Lawson DA, van Eijndhoven MA, Hopmans ES, Lindenberg JL, de Gruijl TD, Würdinger T, Middeldorp JM. Functional delivery of viral miRNAs via exosomes. Proc Natl Acad Sci U S A. 2010 Apr 6;107(14):6328-33. doi: 10.1073/pnas.0914843107. Epub 2010 Mar 18. PMID: 20304794; PMCID: PMC2851954.
- Pegtel DM, van de Garde MD, Middeldorp JM. Viral miRNAs exploiting the endosomal-exosomal pathway for intercellular cross-talk and immune evasion. Biochim Biophys Acta. 2011 Nov-Dec;1809(11-12):715-21. doi: 10.1016/j.bbagrm.2011.08.002. Epub 2011 Aug 9. PMID: 21855666.
- Peinado H, Alečković M, Lavotshkin S, Matei I, Costa-Silva B, Moreno-Bueno G, Hergueta-Redondo M, Williams C, García-Santos G, Ghajar C, Nitadori-Hoshino A, Hoffman C, Badal K, Garcia BA, Callahan MK, Yuan J, Martins VR, Skog J, Kaplan RN, Brady MS, Wolchok JD, Chapman PB, Kang Y, Bromberg J, Lyden D. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET. Nat Med. 2012 Jun;18(6):883-91. doi: 10.1038/nm.2753. Erratum in: Nat Med. 2016 Dec 6;22(12 ):1502. PMID: 22635005; PMCID: PMC3645291.
- Anderson MR. Update on pediatric acute respiratory distress syndrome. Respir Care. 2003 Mar;48(3):261-76; discussion 276-8. PMID: 12667276.
- Amato MB, Barbas CS, Medeiros DM, Magaldi RB, Schettino GP, Lorenzi- Filho G, Kairalla RA, Deheinzelin D, Munoz C, Oliveira R, Takagaki TY, Carvalho CR. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. N Engl J Med. 1998 Feb 5;338(6):347-54. doi: 10.1056/NEJM199802053380602. PMID: 9449727.
- Amato MB, Meade MO, Slutsky AS, Brochard L, Costa EL, Schoenfeld DA, Stewart TE, Briel M, Talmor D, Mercat A, Richard JC, Carvalho CR, Brower RG. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med. 2015 Feb 19;372(8):747-55. doi: 10.1056/NEJMsa1410639. PMID: 25693014.
- Villar, J., Sulemanji, D. & Kacmarek, R. M. The acute respiratory distress syndrome: incidence and mortality, has it changed? Curr. Opin. Crit. Care 20, 3–9 (2014).
- Bastarache JA, Blackwell TS. Development of animal models for the acute respiratory distress syndrome. Dis Model Mech. 2009 May-Jun;2(5-6):218-23. doi: 10.1242/dmm.001677. PMID: 19407329; PMCID: PMC2675821.
- Fujishima S. Pathophysiology and biomarkers of acute respiratory distress syndrome. J Intensive Care. 2014 May 7;2(1):32. doi: 10.1186/2052-0492-2-32. PMID: 25520844; PMCID: PMC4267590.
- Hayes M, Curley G, Ansari B, Laffey JG. Clinical review: Stem cell therapies for acute lung injury/acute respiratory distress syndrome – hope or hype?. Crit Care. 2012;16(2):205. Published 2012 Dec 12. doi:10.1186/cc10570
- Sheu CC, Gong MN, Zhai R, et al. Clinical characteristics and outcomes of sepsis-related vs non-sepsis-related ARDS. Chest. 2010;138(3):559-567. doi:10.1378/chest.09-2933
- Sharma S, Kumar A. Septic shock, multiple organ failure, and acute respiratory distress syndrome. Curr Opin Pulm Med. 2003 May;9(3):199-209. doi: 10.1097/00063198-200305000-00008. PMID: 12682565.
- Angus DC, van der Poll T. Severe sepsis and septic shock. N Engl J Med. 2013 Aug 29;369(9):840-51. doi: 10.1056/NEJMra1208623. Erratum in: N Engl J Med. 2013 Nov 21;369(21):2069. PMID: 23984731.
- Schulte W, Bernhagen J, Bucala R. Cytokines in sepsis: potent immunoregulators and potential therapeutic targets–an updated view. Mediators Inflamm. 2013;2013:165974. doi: 10.1155/2013/165974. Epub 2013 Jun 18. PMID: 23853427; PMCID: PMC3703895.
- Assenzio, B. & Martin-conte, E. L. in SevereSepsisandSepticShock–UnderstandingaSerious Killer88, (2012).
- Martin GS, Mannino DM, Eaton S, Moss M. The epidemiology of sepsis in the United States from 1979 through 2000. N Engl J Med. 2003 Apr 17;348(16):1546-54. doi: 10.1056/NEJMoa022139. PMID: 12700374.
- Angus DC, Linde-Zwirble WT, Lidicker J, Clermont G, Carcillo J, Pinsky MR. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med. 2001 Jul;29(7):1303-10. doi: 10.1097/00003246-200107000-00002. PMID: 11445675.
- Silva E, Pedro Mde A, Sogayar AC, Mohovic T, Silva CL, Janiszewski M, Cal RG, de Sousa EF, Abe TP, de Andrade J, de Matos JD, Rezende E, Assunção M, Avezum A, Rocha PC, de Matos GF, Bento AM, Corrêa AD, Vieira PC, Knobel E; Brazilian Sepsis Epidemiological Study. Brazilian Sepsis Epidemiological Study (BASES study). Crit Care. 2004 Aug;8(4): R251-60. doi: 10.1186/cc2892. Epub 2004 Jun 15. PMID: 15312226; PMCID: PMC522852
- Kangelaris KN, Prakash A, Liu KD, Aouizerat B, Woodruff PG, Erle DJ, Rogers A, Seeley EJ, Chu J, Liu T, Osterberg-Deiss T, Zhuo H, Matthay MA, Calfee CS. Increased expression of neutrophil-related genes in patients with early sepsis-induced ARDS. Am J Physiol Lung Cell Mol Physiol. 2015 Jun 1;308(11): L1102-13. doi: 10.1152/ajplung.00380.2014. Epub 2015 Mar 20. PMID: 25795726; PMCID: PMC4451399.
- Hsu AT, Barrett CD, DeBusk GM, Ellson CD, Gautam S, Talmor DS, Gallagher DC, Yaffe MB. Kinetics and Role of Plasma Matrix Metalloproteinase-9 Expression in Acute Lung Injury and the Acute Respiratory Distress Syndrome. Shock. 2015 Aug;44(2):128-36. doi: 10.1097/SHK.0000000000000386. PMID: 26009816; PMCID: PMC4830084.
- Ware LB, Koyama T, Zhao Z, Janz DR, Wickersham N, Bernard GR, May AK, Calfee CS, Matthay MA. Biomarkers of lung epithelial injury and inflammation distinguish severe sepsis patients with acute respiratory distress syndrome. Crit Care. 2013 Oct 24;17(5): R253. doi: 10.1186/cc13080. PMID: 24156650; PMCID: PMC4056313.
- Balmelli C, Drexler B, Mueller C. Utile or futile: biomarkers in the ICU. Crit Care. 2011;15(2):131. doi:10.1186/cc10056
- ARDS Definition Task Force, Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, Camporota L, Slutsky AS. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012 Jun 20;307(23):2526-33. doi: 10.1001/jama.2012.5669. PMID: 22797452.
- Lelubre C, Anselin S, Zouaoui Boudjeltia K, Biston P, Piagnerelli M. Interpretation of C-reactive protein concentrations in critically ill patients. Biomed Res Int. 2013;2013:124021. doi: 10.1155/2013/124021. Epub 2013 Oct 28. PMID: 24286072; PMCID: PMC3826426.
- Real JM, Spilborghs GM, Morato-Marques M, de Moura RP, Negri EM, Camargo AA, Deheinzelin D, Dias AA. Pentraxin 3 accelerates lung injury in high tidal volume ventilation in mice. Mol Immunol. 2012 May;51(1):82-90. doi: 10.1016/j.molimm.2012.02.113. Epub 2012 Mar 15. PMID: 22425349
- Mauri T, Coppadoro A, Bellani G, Bombino M, Patroniti N, Peri G, Mantovani A, Pesenti A. Pentraxin 3 in acute respiratory distress syndrome: an early marker of severity. Crit Care Med. 2008 Aug;36(8):2302-8. doi: 10.1097/CCM.0b013e3181809aaf. PMID: 18596636.
- Agrawal A, Zhuo H, Brady S, Levitt J, Steingrub J, Siegel MD, Soto G, Peterson MW, Chesnutt MS, Matthay MA, Liu KD. Pathogenetic and predictive value of biomarkers in patients with ALI and lower severity of illness: results from two clinical trials. Am J Physiol Lung Cell Mol Physiol. 2012 Oct 15;303(8):L634-9. doi: 10.1152/ajplung.00195.2012. Epub 2012 Aug 3. PMID: 22865551; PMCID: PMC3469636.
- Terpstra ML, Aman J, van Nieuw Amerongen GP, Groeneveld AB. Plasma biomarkers for acute respiratory distress syndrome: a systematic review and meta- analysis*. Crit Care Med. 2014 Mar;42(3):691-700. doi: 10.1097/01.ccm.0000435669.60811.24. PMID: 24158164.
- Bakouboula B, Morel O, Faure A, Zobairi F, Jesel L, Trinh A, Zupan M, Canuet M, Grunebaum L, Brunette A, Desprez D, Chabot F, Weitzenblum E, Freyssinet JM, Chaouat A, Toti F. Procoagulant membrane microparticles correlate with the severity of pulmonary arterial hypertension. Am J Respir Crit Care Med. 2008 Mar 1;177(5):536-43. doi: 10.1164/rccm.200706-840OC. Epub 2007 Nov 15. PMID: 18006886.
- Bastarache JA, Fremont RD, Kropski JA, Bossert FR, Ware LB. Procoagulant alveolar microparticles in the lungs of patients with acute respiratory distress syndrome. Am J Physiol Lung Cell Mol Physiol. 2009;297(6):L1035-L1041. doi:10.1152/ajplung.00214.2009
- Guervilly C, Lacroix R, Forel JM, et al. High levels of circulating leukocyte microparticles are associated with better outcome in acute respiratory distress syndrome. Crit Care. 2011;15(1):R31. doi:10.1186/cc9978
- Letsiou E, Sammani S, Zhang W, Zhou T, Quijada H, Moreno-Vinasco L, Dudek SM, Garcia JG. Pathologic mechanical stress and endotoxin exposure increases lung endothelial microparticle shedding. Am J Respir Cell Mol Biol. 2015 Feb;52(2):193- 204. doi: 10.1165/rcmb.2013-0347OC. PMID: 25029266; PMCID: PMC4370243.
- Hunter MP, Ismail N, Zhang X, Aguda BD, Lee EJ, Yu L, Xiao T, Schafer J, Lee ML, Schmittgen TD, Nana-Sinkam SP, Jarjoura D, Marsh CB. Detection of microRNA expression in human peripheral blood microvesicles. PLoS One. 2008;3(11):e3694. doi: 10.1371/journal.pone.0003694. Epub 2008 Nov 11. Erratum in: PLoS One. 2010;5(3) doi: 10.1371/annotation/b15ca816-7b62-4474-a568-6b60b8959742. PMID: 19002258; PMCID: PMC2577891.
- Aliotta, J. M. etal.Alteration of marrow cell gene expression, protein production, and engraftment into lung by lung-derived microvesicles: a novel mechanism for phenotype modulation. StemCells 25, 2245–2256 (2007).
- Aliotta, J. M. et al. Microvesicle entry into marrow cells mediates tissue-specific changes in mRNA by direct delivery of mRNA and induction of transcription. Exp. Hematol. 38, 233–245 (2010).
- Aliotta JM. Tumor exosomes: a novel biomarker? J Gastrointest Oncol. 2011;2(4):203-205. doi:10.3978/j.issn.2078-6891.2011.041
- Chen JY, An R, Liu ZJ, Wang JJ, Chen SZ, Hong MM, Liu JH, Xiao MY, Chen YF. Therapeutic effects of mesenchymal stem cell-derived microvesicles on pulmonary arterial hypertension in rats. Acta Pharmacol Sin. 2014 Sep;35(9):1121-8. doi: 10.1038/aps.2014.61. Epub 2014 Aug 4. PMID: 25088001; PMCID: PMC4155533.
- Zhu YG, Feng XM, Abbott J, Fang XH, Hao Q, Monsel A, Qu JM, Matthay MA, Lee JW. Human mesenchymal stem cell microvesicles for treatment of Escherichia coli endotoxin-induced acute lung injury in mice. Stem Cells. 2014 Jan;32(1):116-25. doi: 10.1002/stem.1504. PMID: 23939814; PMCID: PMC3947321.
- Camussi G, Deregibus MC, Bruno S, Cantaluppi V, Biancone L. Exosomes/microvesicles as a mechanism of cell-to-cell communication. Kidney Int. 2010 Nov;78(9):838-48. doi: 10.1038/ki.2010.278. Epub 2010 Aug 11. PMID: 20703216.
- Sdrimas K, Kourembanas S. MSC microvesicles for the treatment of lung disease: a new paradigm for cell-free therapy. Antioxid Redox Signal. 2014 Nov 1;21(13):1905-15. doi: 10.1089/ars.2013.5784. Epub 2014 Feb 24. PMID: 24382303; PMCID: PMC4202925.
- Azevedo LC, Janiszewski M, Pontieri V, et al. Platelet-derived exosomes from septic shock patients induce myocardial dysfunction. Crit Care. 2007;11(6):R120. doi:10.1186/cc6176
- Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, Schein RM, Sibbald WJ. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992 Jun;101(6):1644-55. doi: 10.1378/chest.101.6.1644. PMID: 1303622.
- Felekkis K, Touvana E, Stefanou Ch, Deltas C. microRNAs: a newly described class of encoded molecules that play a role in health and disease. Hippokratia. 2010;14(4):236-240.
- Morin RD, O’Connor MD, Griffith M, Kuchenbauer F, Delaney A, Prabhu AL, Zhao Y, McDonald H, Zeng T, Hirst M, Eaves CJ, Marra MA. Application of massively parallel sequencing to microRNA profiling and discovery in human embryonic stem cells. Genome Res. 2008 Apr;18(4):610-21. doi: 10.1101/gr.7179508. Epub 2008 Feb 19. Erratum in: Genome Res. 2009 May;19(5):958. PMID: 18285502; PMCID: PMC2279248.
- Properzi F, Logozzi M, Fais S. Exosomes: the future of biomarkers in medicine. Biomark Med. 2013 Oct;7(5):769-78. doi: 10.2217/bmm.13.63. PMID: 24044569.
- Melo SA, Luecke LB, Kahlert C, Fernandez AF, Gammon ST, Kaye J, LeBleu VS, Mittendorf EA, Weitz J, Rahbari N, Reissfelder C, Pilarsky C, Fraga MF, Piwnica- Worms D, Kalluri R. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer. Nature. 2015 Jul 9;523(7559):177-82. doi: 10.1038/nature14581. Epub 2015 Jun 24. PMID: 26106858; PMCID: PMC4825698.
- Théry C. Cancer: Diagnosis by extracellular vesicles. Nature. 2015 Jul 9;523(7559):161-2. doi: 10.1038/nature14626. Epub 2015 Jun 24. PMID: 26106856.
- Binnie A, Tsang JL, dos Santos CC. Biomarkers in acute respiratory distress syndrome. Curr Opin Crit Care. 2014 Feb;20(1):47-55. doi: 10.1097/MCC.0000000000000048. PMID: 24296379.
- Harrison, P., Christopher Gardiner, I. L. S. Extracellular Vesicles in Health and Disease – Chapter 5: Preanalytical Variables standardization of microvesicle preanalytical variables. 149–154 (Hardback, 2014).
- Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real- time quantitative PCR and the 2(-Delta C(T)) Method. Methods. 2001 Dec;25(4):402- 8. doi: 10.1006/meth.2001.1262. PMID: 11846609.
- Sengupta, V. et al. Exosomes Derived from Bone Marrow Mesenchymal Stem Cells as Treatment for Severe COVID-19. Stem Cells Dev. 2020 Jun 15;29(12):747754. doi: 10.1089/scd.2020.0080. Epub 2020 May 12.PMID: 32380908.
- Sorensen GL. Surfactant Protein D in Respiratory and Non-Respiratory Diseases. Front Med (Lausanne). 2018;5:18. Published 2018 Feb 8. doi:10.3389/fmed.2018.00018
- Quan, C., Wang, M., Chen, H., Zhang, H. Extracellular vesicles in acute respiratory distress syndrome: Recent developments from bench to bedside. Int Immunopharmacol. 2021 Nov;100:108118. doi: 10.1016/j.intimp.2021.108118.
- Monnamorn, L. et al. The Concentration of Large Extracellular Vesicles Differentiates Early Septic Shock From Infection. Frontiers in Medicine. 2021 Sep; https://doi.org/10.3389/fmed.2021.724371.
- Szilágyi, B. et al. Platelet Microparticles Enriched in miR-223 Reduce ICAM-1-Dependent Vascular Inflammation in Septic Conditions. Frontiers in Physiology. 2021 Mar; https://doi.org/10.3389/fphys.2021.658524.
- Chen H.P., Wang X.Y., Pan X.Y., Hu W.W., Cai S.T., Joshi K., Deng L.H., Ma D. Circulating Neutrophil-Derived Microparticles Associated with the Prognosis of Patients with Sepsis. J Inflamm Res. 2020 Dec 14;13:1113-1124. doi: 10.2147/JIR.S287256.
- Das U.N. Circulating microparticles in septic shock and sepsis-related complications. Minerva Anestesiol. 2019 Jun;85(6):571-576. doi: 10.23736/S0375- 9393.19.13596-1.
- Zheng D., Zhang J., Zhang Z., Kuang L., Zhu Y., Wu Y., Xue M., Zhao H., Duan C, Liu L, Li T. Endothelial Microvesicles Induce Pulmonary Vascular Leakage and Lung Injury During Sepsis. Front Cell Dev Biol. 2020 Jul 16;8:643. doi: 10.3389/fcell.2020.00643.
- Takei Y, Yamada M, Saito K, et al. Increase in circulating ACE-positive endothelial microparticles during acute lung injury. Eur Respir J 2019; 54: 1801188 https://doi.org/10.1183/ 13993003.01188-2018.
- Shaver, C.M., Woods, J., Clune, J.K. et al. Circulating microparticle levels are reduced in patients with ARDS. Crit Care 21, 120 2017 https://doi.org/10.1186/s13054-017-1700-7.
- Lee, H. et al. Epithelial cell-derived microvesicles activate macrophages and promote inflammation via microvesicle-containing microRNAs. Sci. Rep. 6, 35250; doi: 10.1038/srep35250 2016.
- .Quan C, Wang M, Chen H, Zhang H. Extracellular vesicles in acute respiratory distress syndrome: Recent developments from bench to bedside. Int Immunopharmacol. 2021 Nov;100:108118. doi: 10.1016/j.intimp.2021.108118. Epub 2021 Sep 1. PMID: 34492532.
- Chen WX, Zhou J, Zhou SS, Zhang YD, Ji TY, Zhang XL, Wang SM, Du T, Ding DG. Microvesicles derived from human Wharton’s jelly mesenchymal stemcells enhance autophagy and ameliorate acute lung injury via delivery of miR-100. Stem Cell Res Ther. 2020 Mar 13;11(1):113. doi: 10.1186/s13287-020-01617-7. PMID: 32169098; PMCID: PMC7071666.
- Zhang D, Lee H, Wang X, Groot M, Sharma L, Dela Cruz CS, Jin Y. A potential role of microvesicle-containing miR-223/142 in lung inflammation. Thorax. 2019 Sep;74(9):865-874. doi: 10.1136/thoraxjnl-2018-212994. Epub 2019 Jul 22. PMID: 31331947; PMCID: PMC7036165.
- Park J, Kim S, Lim H, Liu A, Hu S, Lee J, Zhuo H, Hao Q, Matthay MA, Lee JW. Therapeutic effects of human mesenchymal stem cell microvesicles in an ex vivo perfused human lung injured with severe E. coli pneumonia. Thorax. 2019 Jan;74(1):43-50. doi: 10.1136/thoraxjnl-2018-211576. Epub 2018 Aug 3. PMID: 30076187; PMCID: PMC6295323.
- Chen J, Hu C, Pan P. Extracellular Vesicle MicroRNA Transfer in Lung Diseases. Front Physiol. 2017 Dec 12;8:1028. doi: 10.3389/fphys.2017.01028. PMID: 29311962; PMCID: PMC5732924.
- Lee H, Zhang D, Wu J, Otterbein LE, Jin Y. Lung Epithelial Cell-Derived Microvesicles Regulate Macrophage Migration via MicroRNA-17/221-Induced Integrin β1 Recycling. J Immunol. 2017 Aug 15;199(4):1453-1464. doi: 10.4049/jimmunol.1700165. Epub 2017 Jul 3. PMID: 28674181; PMCID: PMC5561736.
- Mostefai HA, Meziani F, Mastronardi ML, Agouni A, Heymes C, Sargentini C, Asfar P, Martinez MC, Andriantsitohaina R. Circulating microparticles from patients with septic shock exert protective role in vascular function. Am J Respir Crit Care Med. 2008 Dec 1;178(11):1148-55. doi: 10.1164/rccm.200712-1835OC. Epub 2008 Aug 21. PMID: 18723433.
- Sengupta V, Sengupta S, Lazo A, Woods P, Nolan A, Bremer N. Exosomes Derived from Bone Marrow Mesenchymal Stem Cells as Treatment for Severe COVID-19. Stem Cells Dev. 2020 Jun 15;29(12):747-754. doi: 10.1089/scd.2020.0080. Epub 2020 May 12. PMID: 32380908; PMCID: PMC7310206.
- Liu A, Zhang X, He H, Zhou L, Naito Y, Sugita S, Lee JW. Therapeutic potential of mesenchymal stem/stromal cell-derived secretome and vesicles for lung injury and disease. Expert Opin Biol Ther. 2020 Feb;20(2):125-140. doi: 10.1080/14712598.2020.1689954. Epub 2019 Nov 18. PMID: 31701782; PMCID: PMC6981051.
- Li, K., Wei, P., Qin, Y. & Wei, Y. MicroRNA expression profiling and bioinformatics analysis of dysregulated microRNAs in obstructive sleep apnea patients. Medicine (Baltimore). 96, e7917 (2017).
- Zhang S, Chen H, Liu W, Fang L, Qian Z, Kong R, Zhang Q, Li J, Cao X. miR- 766-3p Targeting BCL9L Suppressed Tumorigenesis, Epithelial-Mesenchymal Transition, and Metastasis Through the β-Catenin Signaling Pathway in Osteosarcoma Cells. Front Cell Dev Biol. 2020 Oct 7;8:594135. doi: 10.3389/fcell.2020.594135. PMID: 33117820; PMCID: PMC7575756.
- Lin H, Jiang L, Ren Y, Sheng F, Wang L, Zhang S. Expression Level, Correlation, and Diagnostic Value of Serum miR-127 in Patients with Acute Respiratory Distress Syndrome. Evid Based Complement Alternat Med. 2021 Sep 22;2021:2257764. doi: 10.1155/2021/2257764. PMID: 34603466; PMCID: PMC8483901.
- Huang Z, Xu Y, Wan M, Zeng X, Wu J. miR-340: A multifunctional role in human malignant diseases. Int J Biol Sci. 2021 Jan 1;17(1):236-246. doi: 10.7150/ijbs.51123. PMID: 33390846; PMCID: PMC7757049.
- Real JM, Ferreira LRP, Esteves GH, Koyama FC, Dias MVS, Bezerra-Neto JE, Cunha-Neto E, Machado FR, Salomão R, Azevedo LCP. Exosomes from patients with septic shock convey miRNAs related to inflammation and cell cycle regulation: new signaling pathways in sepsis? Crit Care. 2018 Mar 15;22(1):68. doi: 10.1186/s13054- 018-2003-3. PMID: 29540208; PMCID: PMC5852953.
- Vieira Corrêa PCM, Carneiro DM, da Silva Valente LDS, Diogo FM, Lamarão LM, da Silva Maués JH, Moreira-Nunes CA, Burbano RMR. Detection of Sepsis in Platelets Using MicroRNAs and Membrane Antigens. Genes (Basel). 2021 Nov 25;12(12):1877. doi: 10.3390/genes12121877. PMID: 34946826; PMCID: PMC8701354.
- Tu GW, Ma JF, Li JK, Su Y, Luo JC, Hao GW, Luo MH, Cao YR, Zhang Y, Luo Z. Exosome-Derived From Sepsis Patients’ Blood Promoted Pyroptosis of Cardiomyocytes by Regulating miR-885-5p/HMBOX1. Front Cardiovasc Med. 2022 Mar 8;9:774193. doi: 10.3389/fcvm.2022.774193. PMID: 35345489; PMCID: PMC8957255.
¹Mestre em Ciências da Saúde pelo Programa de Pós- graduação em Ciências da Saúde do IAMSPE.
