ANALYSIS OF ANTINEOPLASTIC BEHAVIOR OF ARTEMISIA SPECIES IN DIFFERENT CASES OF NEOPLASMS: INTEGRATIVE LITERATURE REVIEW
REGISTRO DOI: 10.5281/zenodo.8283377
Andressa Akiko Koshikumo[1]
Maria Cecília Lopes Friedrich[2]
Valéria do Amaral[3]
Resumo
A pesquisa teve como objetivo constatar na literatura estudos que comprovassem os efeitos antineoplásicos das espécies de Artemisia nos diferentes tipos de neoplasias. A metodologia adotada foi a de Revisão Integrativa da Literatura, cujos questionamentos são: Há benefícios adicionais no uso da Artemisia sobre o tratamento dos cânceres? Se sim, quais são os mecanismos de ação envolvidos? Os dados foram coletados nas bases de dados PubMed, ScienceDirect e Web of Science, no período de 2012-2022; utilizando-se o denominador booleano AND e a combinação das palavras-chaves e descritores: Artemisia; Absinthium; Carcinoma; Neoplasms. Foram selecionados estudos disponíveis na íntegra; nos idiomas inglês, português e espanhol; incluindo somente estudos experimentais in vivo e ensaios clínicos. Foram excluídos artigos com repetição, textos não completos e que possuíam apenas resumo, revisões de literatura e estudos realizados exclusivamente in vitro. A seleção dos estudos foi realizada por meio de uma adaptação do protocolo PRISMA Flow Diagram. Os resultados demonstram que diferentes espécies da Artemisia possuem variados mecanismos antineoplásicos frente às neoplasias.
Palavras-chave: Absinthium. Artemisia. Carcinoma. Neoplasms.
Abstract
The present research has aimed to acknowledge in literature studies that confirmed the antineoplastic effects caused by species of Artemisia in different cases of neoplasm. The methodology applied was the Integrative Revision of Literature, which presents the following questions: Are there any additional benefits in using Artemisia when treating cancer? If so, which action mechanisms are involved? Data was collected through PubMed, ScienceDirect, and Web of Science’s databases from 2012 to 2022, applying the Boolean logic AND, and the combination of the following keywords and descriptors: Artemisia; Absinthium; Carcinoma; Neoplasms. Fully published articles in English, Portuguese, and Spanish were selected, and those regarding only experimental studies in vivo and clinical trials. Articles containing only summaries, repetitions, or incomplete texts were excluded, as well as literature reviews and studies carried out exclusively in vitro. The selection of studies was conducted through an adaptation of the PRISMA Flow Diagram protocol. The results have demonstrated that different species of Artemisia present various antineoplastic mechanisms against neoplasms.
Keywords: Absinthium. Artemisia. Carcinoma. Neoplasms.
1.INTRODUÇÃO
O câncer é considerado o principal problema de saúde pública global, constituindo uma das mais importantes causas de morte e morte prematura no mundo. A estimativa mundial de 2018 apontou a ocorrência de 18 milhões de casos novos da doença e 9,6 milhões de óbitos provocados pela mesma (Brasil, 2019). Excluindo-se o câncer de pele não melanoma, o câncer de próstata é o mais incidente em homens, já nas mulheres, o câncer de mama é a neoplasia mais frequente e causadora de maior mortalidade. No Brasil, a estimativa para o triênio de 2023 a 2025 prevê a ocorrência de 704 mil novos casos de câncer, sendo o mais incidente o câncer de pele não melanoma, seguido pelos cânceres de mama, próstata, cólon e reto, pulmão e estômago (Brasil, 2022).
A oncogênese está fortemente associada a fatores externos, e em menor grau a condições propriamente intrínsecas, como erros diretos na replicação e reparação do material genético (Golemis et al., 2018). Mais de 100 carcinógenos são listados pela Agência Internacional de Pesquisa em Câncer (IARC) da Organização Mundial de Saúde, dentre eles destacam-se o tabagismo, obesidade, dieta e consumo de álcool (WHO, 2022). A carcinogênese é reflexo de múltiplas alterações moleculares de cunho genético, epigenético e imunológico. A modificação do DNA ou do controle da expressão gênica de proto-oncogenes e genes supressores tumorais, críticos no controle da proliferação celular, é fundamental para que ocorra o processo de iniciação e expansão clonal da célula afetada (Golemis et al., 2018; Peters; Gonzalez, 2018).
O tratamento convencional das neoplasias se dá através da quimioterapia, radioterapia, cirurgia e transplante de medula óssea, modalidades muitas vezes combinadas entre si e dependentes da extensão, gravidade e localização da doença (Brasil, 2022). Além do elevado sofrimento psíquico provocado pela doença, dor crônica, infertilidade, fadiga, insônia, perda óssea, disfunção sexual, cognitiva e gonadal são efeitos adversos comuns mediados pela terapêutica (Shapiro, 2018). Tendo em vista a complexidade e necessidade de recursos humanos e tecnológicos para o suporte terapêutico da doença, elevados são os recursos financeiros destinados à esse fim. Em 2018, o governo federal gastou aproximadamente 3,5 bilhões de reais com procedimentos oncológicos no Sistema Único de Saúde (SUS). As projeções para 2030 e 2040 são de, respectivamente, 5,90 e 7,84 bilhões de reais (Brasil, 2022).
Diante do exposto, as terapias alternativas e complementares podem representar uma possibilidade para auxiliar os pacientes oncológicos, desde que são de baixo custo, fácil acesso e há boa aceitação pela população brasileira. Entre as terapias não farmacológicas utilizadas, encontra-se a Medicina Tradicional Chinesa (MTC), que inclui a fitoterapia, mocha e acupuntura como formas de tratamento (Geng et al., 2020; Kim et al., 2017). O gênero Artemisia representa uma das plantas medicinais empregadas na MTC, devido às suas propriedades naturais com significativa ação bioativa. Assim sendo, tornam-se drogas vegetais de interesse terapêutico, pois vários estudos mostram que as mesmas apresentam diversas atividades farmacológicas, com ação antimalárica, antimicrobiana, anti-inflamatória, anticancerígena, dentre outras. Este gênero pertence à família das Compositae, compreende cerca de 481 espécies, e tem distribuição geográfica cosmopolita, presente em regiões temperadas, áridas e semiáridas (Fragoso, 2014).
No Brasil, as espécies mais utilizadas são A. absinthium L., A. vulgaris L. e A. annua L. (Fragoso, 2014). Os estudos das propriedades da A. absinthium são de interesse governamental e populacional, visto que ela está contida na Relação Nacional de Plantas Medicinais de Interesse ao Sistema Único de Saúde (Renisus). Estudos vêm sendo desenvolvidos sobre os potenciais efeitos antitumorais de princípios ativos da A. absinthium, sendo descrita atividade antineoplásica contra linhagens celulares de cânceres humanos, como carcinoma colorretal, pulmonar e mamário (Ferraz; Chagas; Dorigon, 2020). Além disso, os estudos sugerem que a moxabustão contendo A. vulgaris acarreta em melhora dos efeitos colaterais da quimioterapia e radioterapia, melhorando a qualidade de vida desses pacientes (Zhang et al., 2018). Indicando assim que o gênero Artemisia possui grande potencial para o desenvolvimento de coadjuvantes terapêuticos anticancerígenos.
Diante do exposto, o presente estudo teve como perguntas norteadoras: Há benefícios adicionais no uso da Artemisia sobre o tratamento dos cânceres? Se sim, quais são os mecanismos de ação envolvidos? Para tanto, foi realizada investigação literária em bases de dados, de forma retrospectiva e atualizada, para que pudéssemos investigar as vantagens e contribuições da Medicina Tradicional Chinesa no tratamento de pacientes oncológicos.
2.METODOLOGIA
Nesta Revisão Integrativa de Literatura, foram abordados os efeitos antineoplásicos das espécies de Artemisia em diferentes tipos de cânceres. O estudo em questão foi desenvolvido de acordo com as fases: 1) formulação do problema; 2) coleta de dados; 3) avaliação de dados; 4) análise dos dados; 5) apresentação e interpretação dos resultados.
A formulação do problema foi realizada utilizando-se a estratégia PICo (acrônimo para P: população/paciente/problema; I: fenômeno de interesse; Co: contexto), para resgate de informações qualitativas acerca do assunto (Araújo, 2020). Portanto, foram consideradas para esta pesquisa: tratamento do câncer, como problema do estudo; papel da Artemisia nessas neoplasias, como fenômeno de interesse; estudos experimentais in vivo estabeleceram o contexto da pesquisa.
A coleta foi realizada nas bases de dados Pubmed, Science Direct e Web of Science, utilizando o denominador booleano AND e a combinação das seguintes palavras-chaves e descritores: artemisia AND neoplasms; artemisia AND carcinoma; absinthium AND neoplasms; absinthium AND carcinoma. Os critérios de inclusão utilizados foram, artigos publicados no período de janeiro de 2012 a setembro de 2022, nos idiomas português, inglês e espanhol, estudos in vitro em animais e seres humanos e estudos in vivo em seres humanos e animais. Destes, foram selecionados apenas artigos com acesso livre e não pagos, que tinham como objetivo verificar a atividade antineoplásica das espécies de Artemisia. Também foram selecionados estudos experimentais e em fases clínicas I e II. Ademais, foram excluídos artigos com metodologia de revisão, com repetição nas diferentes bases, artigos que disponibilizam apenas o resumo, artigos pagos, artigos em outros idiomas que não selecionados para o estudo, artigos publicados anteriormente ao ano de 2012 e estudos realizados exclusivamente in vitro e aqueles que não responderam às perguntas norteadoras para avaliação do texto completo. Dessa forma, foram selecionados artigos de alta relevância para compor a totalidade desta Revisão Integrativa de Literatura.
Diante do número de artigos selecionados, realizou-se a avaliação da metodologia do estudo, procedência, título do artigo e periódico publicado, ano de publicação, idioma e país de financiamento do estudo. Em um segundo momento, foi realizada a caracterização do estudo, incluindo o tipo de câncer de estudado, espécie e/ ou princípio ativo envolvidos, efeitos antineoplásicos encontrados, via de administração, posologia e resultados primordiais.
Nesse sentido, realizou-se a interpretação dos dados, agrupamento e categorização de informações concordantes ou conflitantes dos estudos em questão, conforme a metodologia do estudo. Assim, os artigos foram selecionados baseados na análise de conteúdo de Bardin (2016), utilizando-se de uma adaptação do protocolo para revisões sistemáticas PRISMA Flow Diagram. Ademais, o presente estudo foi adequado conforme verificação dos 27 itens contidos no PRISMA checklist (Page et al., 2021).
3.RESULTADOS
De acordo com o uso dos descritores combinados com os operadores booleanos adotados pela revisão, o número total de artigos encontrados foi de 2389 estudos. Sendo que 366 artigos foram coletados do PubMed, 1877 artigos do Science Direct e 146 artigos do Web of Science. Em seguida, foram selecionados apenas os artigos que correspondiam aos publicados no período de janeiro de 2012 a setembro de 2022. Essa primeira filtragem resultou em 240 artigos publicados no PubMed, 1337 artigos no Science Direct e 110 artigos no Web of Science, totalizando 1687 trabalhos. Destes, foram selecionados, após a segunda análise, apenas artigos com acesso livre, resultando em 91 artigos do PubMed, 189 artigos do Science Direct e 62 artigos do Web of Science, totalizando 342 pesquisas. Ademais, excluindo-se artigos com metodologia de revisão, culminou-se nos seguintes valores: 87 artigos do PubMed, 107 artigos do Science Direct e 55 artigos do Web of Science totalizando 249 artigos. Foram excluídos artigos com repetições nas diferentes bases (68 artigos), contabilizados apenas uma vez – resultando em 181 registros para triagem. Destes, foram excluídos artigos não disponíveis na íntegra (13) e aqueles que, após a leitura do resumo, não responderam às perguntas norteadoras (99), finalizando em 69 estudos para avaliação do texto completo.
Durante a análise, na avaliação do texto completo, foram excluídos estudos realizados exclusivamente in vitro (44 artigos). Dessa forma, foram selecionados 25 artigos que se enquadraram nos critérios de resposta da pergunta norteadora e de qualidade do checklist PRISMA, conforme pode-se observar na figura 1.
Figura 1 – Fluxo da informação com as diferentes fases da revisão sistemática conforme orientação do protocolo PRISMA de 2020 (Page et al., 2021).
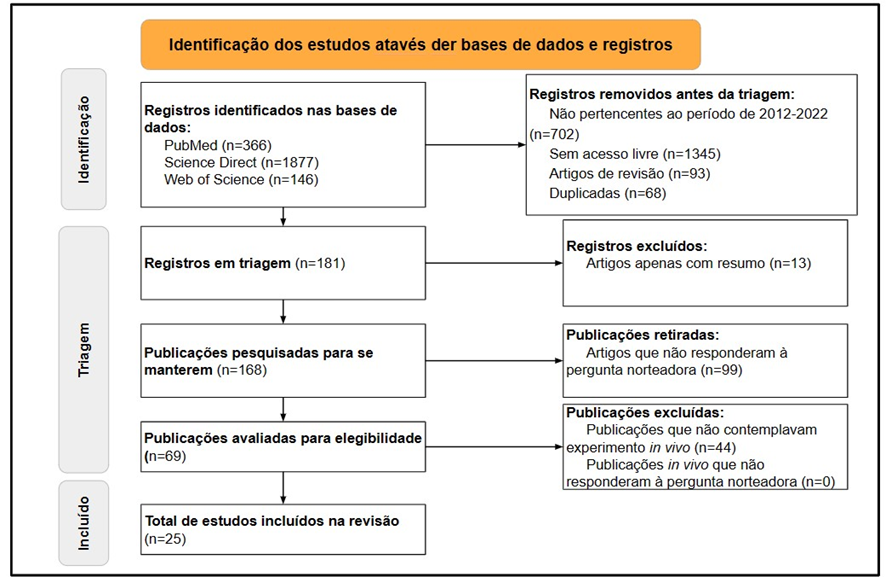
Fonte: Autoria própria (2023).
Os autores puderam observar que 100% dos artigos selecionados (n=25) foram publicados na língua inglesa. Em relação à metodologia, pode-se observar que 80% dos estudos (n=20) eram delineados por experimentos in vitro e in vivo e 20% (n=5) destes foram estudos realizados apenas in vivo.
Pudemos observar que o ano de maior publicação de estudos em relação às ações antineoplásicas das espécies de Artemisia foi o de 2019, representando 24% dos estudos (n = 6) selecionados. Em seguida, 2020 foi o segundo ano de maior publicação dentre os artigos selecionados, constituindo 20% destes (n=5). Os anos de 2017 e 2018 representaram, respectivamente, 16% das publicações (n=4) selecionadas. Os anos de 2012, 2013, 2015, 2016, 2021 e 2022 constituem, cada um, 4% das pesquisas (n=1) selecionadas para esta revisão.
Em relação aos países de origem das pesquisas, os dados revelaram que a China foi o país que mais desenvolveu estudos sobre os efeitos antineoplásicos da Artemisia, totalizando 36% dos estudos (n=9) selecionados. Em sequência, pudemos verificar que a Coreia do Sul vem em segundo lugar, com 24% (n=6) de estudos com o mesmo objetivo. A Alemanha e Egito compõem, cada um, 12% (n=3) dos estudos. Países como o Irã (n=1), Romênia (n=1), Reino Unido (n=1) e Paquistão (n=1) também pesquisaram a eficácia antineoplásica da Artemisia, representando, cada um, 4% do total de estudos.
Em relação aos tipos de cânceres estudados, 24% (n=6) dos estudos foram referentes ao câncer hepatocelular; 16% (n=4) ao câncer de mama; 16% (n=4) ao câncer renal; 12% (n=3) ao câncer colorretal; 8% (n=2) ao câncer de próstata; 8% (n=2) ao carcinoma sólido de Ehrlich; 4% (n=1) ao câncer de ovário; 4% (n=1) ao câncer de esôfago; 4% (n=1) ao câncer de cabeça e pescoço e 4% (n=1) corresponde a carcinomas variados estudados em cães e gatos.
Em relação aos modelos utilizados in vivo, os animais que compuseram os estudos, em suma maioria, foram animais nocautes, ou seja, camundongos criados para estudos oncológicos em fase pré-clínica. Neste ínterim, 16 estudos utilizaram camundongos Balb/c para suas análises, compondo 64% dos estudos. Dois estudos utilizaram ratos Wistar e outros dois utilizaram membrana coriolantóica de chick/ filhotes de galinha, compondo 8% dos estudos cada um. Enquanto que apenas um estudo foi encontrado para camundongos Kunming (4%), camundongos mus musculus (4%), cães e gatos (4%) e camundongos NRMI/Foxn1, sendo que este último, também utilizou membrana corioalantóide para seu delineamento in vivo. Um importante estudo utilizou o delineamento de ensaio clínico adotando fases 1 e 2 com pessoas voluntárias (4%). Ademais, um deles (4%) não especificou a linhagem de camundongo utilizada.
Dos tumores estudados in vivo, 76% (n=19) ocorreram por implantação direta de células cancerígenas nos animais experimentais, 16% (n=4) por indução de carcinógenos e 8% (n=2) remetem-se a tumores desenvolvidos espontaneamente.
Dos animais implantados com células tumorais (76%), 8% (n=2) correspondem à implantação de células MDA-MB-231 (linhagem de câncer de mama triplo negativo), 8% (n=2) referem-se à inoculação de células de carcinoma ascítico de Ehrlich e 8% (n=2) à inoculação de células H22 (células de hepatoma de camundongos).
Em relação às outras linhagens de carcinoma hepático, 4% (n=1) corresponde à implantação de HepG2 e 4% (n=1) à inoculação de ambas as células HepG2 e Huh7. À respeito da implantação de células cancerígenas renais, 4% (n=1) são de células UMRC-2 (carcinoma de células claras humanas), 4% (n=1) de células 786-O, 4% (n=1) de células Caki e 4% (n=1) de ambas as células 786-O e células Caki. No que se refere à inoculação de células cancerígenas prostáticas, 4% (n=1) refere-se à célula 22rv1 e 4% (n=1) à célula Du145-luc.
Enquanto que para as demais linhagens, tem-se 4% (n=1) de implantação de tecido de tumor mamário espontâneo de camundongos, 4% (n=1) de células HN9 (células de câncer de cabeça e pescoço resistente à cisplatina), 4% (n=1) de células HO-8910PM (células de câncer epitelial de ovário humano), 4% (n=1) de células TE-1 (células de carcinoma de esôfago humano) e 4% (n=1) de HCT116 (células de câncer de cólon humano).
No grupo de tumores desenvolvidos in vivo por indutores carcinógenos, 4% (n=1) refere-se ao tumor de câncer de cólon induzido por carcinógeno colônico e DSS, 4% (n=1) ao tumor de câncer de mama induzido por 7,12-dimetilbenzantraceno (DMBA), 4% (n=1) ao carcinoma hepatocelular induzido por ácido tricloroacético (TCA) e 4% (n=1) ao tumor hepatocelular induzido por dietilnitrosamina (DEN).
Os tumores desenvolvidos espontaneamente in vivo compõem um estudo (4%) de 17 tipos de tumores de diferentes linhagens desenvolvidos em cães e gatos e outro estudo (4%) desenvolvido em humanos (ensaio clínico randomizado). Neste estudo, o câncer estudado foi o adenocarcinoma colorretal de sítio primário único, confirmado por biópsia. Os pacientes inclusos foram aqueles com idade entre 21 e 90 anos, com todas as etapas passíveis de tratamento cirúrgico e sem necessidade de tratamento neoadjuvante, com ressecção curativa planejada e com consentimento informado e escrito. E os principais critérios de exclusão foram hipersensibilidade ao artesunato, gravidez, imunossupressão ou medicação concomitante conhecida por interagir com artesunato, peso < 50 kg ou > 100 kg, anemia grave, outras intervenções planejadas, incapacidade ou falta de vontade de tomar contracepção eficaz em mulheres em idade fértil, doença renal crônica e doença hepática crônica conhecida.
Em relação às linhagens celulares utilizadas in vitro, as células Caki foram as mais frequentes, sendo abordada por 12% (n=3) dos estudos. Em seguida, cada uma das linhagens celulares DU-145 (câncer de próstata), Hep G2 (hepatoma), HCT116 (câncer de cólon humano), MDA-MB-231 (câncer de mama triplo negativo), células 786-O (adenocarcinoma de células renais) foram abordadas por 8% (n=2) dos estudos. Por fim, apenas um estudo (4%) foi encontrado para as linhagens celulares 4T1 (referente ao câncer de mama triplo negativo), SW 948 (referente ao câncer de cólon humano), Hla-diFluoro (linhagem celular de autofagia), células U251MG (células de glioma humano), células TCMK-1 e ATCC-CCL-139 (câncer de próstata humano), células H22, NCTC 1469 e BEL-7404 (carcinoma hepatocelular), células SMMC-7721 (carcinoma hepatocelular), células HNC 2-10 e SNU (câncer de cabeça e pescoço), células UMRC-2 (carcinoma renal de células claras humanas), células WM35 (melanoma humano), HO8910PM (células de câncer ovariano), células 22rv1 (câncer de próstata), células epiteliais de esôfago (KYSE-410, KYSE-1, TE-1, HET-1A), células associadas ao câncer de próstata humano (PC-3) e células de próstata humana normal (RWPE-1), célula de câncer de mama (MCF-7), He-La (câncer cervical), HT-29 e HCT-115 (câncer de cólon), células de hepatoma humano 7402, células tumorais de cães (DH82 e DGBM), células de túbulos renais humanos (HK2), células de carcinoma hepatocelular (Huh7) e células de câncer de mama triplo negativo (MCF-7, MIA paCa-2; PC-3 e A549).
Em relação às espécies de Artemisia utilizadas, 60% (n=15) dos artigos estudaram os efeitos antineoplásicos de extratos e derivados de A. annua; 8% (n=2) pesquisaram os mecanismos da A. capillaris; enquanto que para as espécies A. princeps, A. absinthium L., A. argyi, A. judaica., A. herba alba, A. apiaceae, A. asiatica e A. vulgaris houveram apenas 1 estudo referente a cada uma, representando 4% das pesquisas.
Os artigos coletados para a Revisão Integrativa estão demonstrados nos quadros 1 e 2. As mesmas foram organizadas e sistematizadas de acordo com o tipo de metodologia e delineamento utilizados para os estudos. Sendo assim, os autores por conveniência e melhor didática, dividiram os artigos em dois grandes grupos M1 e M2. O grupo 1 (n=4) consiste nos estudos realizados somente in vivo, excluindo-se o Ensaio Clínico Randomizado, e o grupo 2 (n=20) consiste em estudos realizados in vivo e in vitro, independente da espécie utilizada como modelo. O Quadro 1 descreve para cada estudo, autor e ano de publicação, tipo e subtipo de câncer estudado, modelo in vivo utilizado, espécie e/ou princípio ativo de Artemísia estudada e desfecho do estudo. O Quadro 2 descreve para cada estudo, as mesmas informações contidas no Quadro 1, com inclusão das linhagens celulares estudadas in vitro.
Quadro 1- Estudos sobre o potencial antineoplásico das espécies de Artemisia realizados in vivo.
Autor e ano de publicação Tipo e subtipo de câncer Modelo in vivo Espécies e/ ou princípio de Artemísia Desfecho Mohamed; Amer; Faky, 2019 Carcinoma Sólido de Ehrlich Camundongos fêmeas BALB/c saudáveis de 6-8 semanas foram injetadas com células do líquido ascítico do carcinoma ascítico de Ehrlich de outros camundongos fêmeas Extrato alcoólico de Artemisia herba alba Redução do volume e peso tumoral;Redução do peso corporal dos camundongos;Sem evidências de metástases no tecido hepático e renal de camundongos tratados;Maior dano ao DNA da célula tumoral quando comparado com a administração de artesunato e cisplatina; – Lesões hepáticas e renais leves em comparação com lesões histológicas elevadas causadas por Artesunato e Cisplatina. Ali et al., 2020 Hepatocarcinoma Camundongos machos BALB/c inoculados com a droga Extrato hidroalcoólico de Artemisia – Atividade anticancerígena comprovada contra o carcinoma hepatocelular; dietilnitrosamina. vulgaris Diminuição significativa de ALT, AST, LDH, AFP, bilirrubina total, Y-GT, 5 NT e G6PDH; Aumento significativo de albumina. Faheem; Nabtity et al., 2020 Câncer de mama Ratos Wistar fêmeas adultas induzidas por DMBA Extrato aquoso de Artemisia Annua – Atividade antioxidante significativa em ratos fêmeas adultas. Mokhamer et al., 2022 Carcinoma hepatocelular Ratos Wistar machos albinos de 7-8 semanas de idade induzidos por ATA Extrato etanólico de Artemisia judaica (compostos fenólicos, flavonoides, hidrocarboneto s, terpenos e esteróis) Restauração do peso corporal dos ratos tratados isoladamente ou em combinação com CTX;Efeito hepatoprotetor;Restauração das características das células hepáticas.
Fonte: os autores.
Quadro 2 – Estudos sobre o potencial antineoplásico das espécies de Artemisia realizados in vivo e in vitro.
Autor e ano de publicação Tipo e subtipo de câncer estudado Modelo in vivo Linhagem celular in vitro Espécie e/ ou princípio de Artemisia Desfecho Wu et al., 2012 Câncer de ovário Camundongos BALB/c de 5 semanas inoculados com células HO8910PM Linhagem celular HO8910PM de câncer ovariano. Dihidroartemis inina – componente ativo da Artemisia annua – Inibição do crescimento, adesão, invasão, migração e proliferação tumoral, dose e tempo dependente, in vitro. Mohamad abadi et al., 2013 Tumor Mamário de Camundongo Espontâneo (SMMT) Camundongos BALB/c fêmeas induzidas por SMMT Linhagem celular de câncer de mama (4T1) e linfócitos normais de indivíduos saudáveis Arteether – Diminuição da taxa de crescimento tumoral dose-dependente nos camundongos. Kim et al., 2013 Câncer de próstata Camundongos BALB/c nu/nu machos induzidos por células DU-145 Linhagem celular de câncer humano de próstata DU145 e PC-3; linhagem celular imortalizada de próstata humana – RWPE-1; linhagem celular de CA de mama humano – MCF 7 e MDA-MB- 231; Linhagem celular de câncer hepatocelular humano HepG2; linhagem celular de câncer cervical He-La e linhagem celular de câncer de cólon HT-29; HCT-116; HCT-115. Escoparona (composto isolado da Artemisia capillaris) Efeito anti-proliferativo dose dependente, principalmente, sobre a linhagem celular DU-145 in vitro; Inibição da proliferação de linhagens celulares de hepatoma, câncer cervical, colônico e de mama; Efeito antitumoral in vivo, com redução do volume tumoral. Han et al., 2016 Carcinoma renal humano (células caki) Camundongos BALB/c nu inoculados com células Caki Células de carcinoma renal humano (Caki), Células de glioma humano (U251MG) Células de câncer de próstata humano (DU145), Células de rim de camundongo (TCMK-1, ATCC-CCL-139 ), Células mesangiais humanas normais. Eupafolina (flavona derivada Artemisia princeps) Eupafolina usada de forma isolada não exibiu efeito apoptótico;Tratamento combinado com TRAIL reduziu o crescimento tumoral e induziu apoptose in vivo, sem efeito sobre o peso corporal do animal; Tratamento combinado não teve efeito sobre células mesangiais humanas e epiteliais tubulares de camundongos; Tratamento combinado também induziu apoptose em células de glioma e células cancerosas de próstata. Roh et al., 2017 Câncer de cabeça e pescoço (CCP) Camundongos BALB/c atímicos de 6 semanas foram injetados com células HN9 Linhagens celulares de cabeça e pescoço HNC 2-10 e SNU Artesunato (derivado sintético da artemisinina, originada da A. annua) Morte seletiva de células CCP;Efeito subótimo em alguns CCPs resistentes à cisplatina; Coadministração de artesunato e trigonelina ou silenciamento genético de nrf2 e/ ou HO-1 eliminou células resistentes à cisplatina, in vitro, e diminuiu o crescimento tumoral in vivo. Wang et al., 2017 Câncer de próstata Camundongos machos BALB/c/nude de 7 semanas, injetados com células 22rv1 Células de câncer de próstata 22rv1 Artesunato (derivado semissintético da Artemisia annua) Inibição da viabilidade celular, aumento de apoptose, dose dependente, in vitro; Supressão do crescimento tumoral, dose dependente, in vivo. Kim et al., 2017 Câncer de cólon Camundongos BALB/c machos de 5 semanas injetados com células HCT 116. Linhagem celular de câncer de cólon humano HCT 116 e células fibroblásticas humanas normais. Extrato etanólico de Artemisia annua Linné Apoptose in vivo e in vitro; Diminuição do volume tumoral in vivo. Fei et al., 2018 Câncer de esôfago Camundongos BALB/c nu/nu fêmeas de 16 semanas de idade inoculados com células TE-1. Linhagens celulares epiteliais de esôfago KYSE-410; KYSE-1; TE-1; HET-1A. Artesunato derivado semissintético da artemisinina – composto ativo da Artemisia annua) Inibição da proliferação de células cancerígenas dose-dependente in vitro; Tratamento combinado com irradiação promoveu inibição do crescimento tumoral e diminuição do volume e peso tumoral in vivo; – Aumento da radiossensibilidade de células TE-1 in vitro e in vivo. Son et al., 2018 Carcinoma renal metastático Camundongos BALB/c nus de 4 semanas de idade foram injetados com células Caki e 786-O. Linhagem celular de carcinoma de células renais Caki e 786-O e linhagem celular epitelial de túbulos renais humanos HK2. MC-4 (material parcialmente purificado da Artemisia annua L.) Monoterapia (MC-4): Citotoxicidade seletiva e dose dependente das células cancerígenas in vitro; Inibição do crescimento tumoral e morte celular autofágica in vitro e in vivo; Sem sinais de efeitos colaterais in vivo.
Tratamento combinado com Everolimus: Maior efeito citotóxico in vitro;Aumento da morte celular autofágica e diminuição do crescimento tumoral, in vivo; Sem efeitos colaterais e redução de focos metastáticos pulmonares, in vivo.Kim et al., 2018 Carcinoma hepatocelular (CHC) Camundongos BALB/c nu/nu machos de 6 semanas injetados com HEPG2. Linhagens celulares humanas de CHC (HepG2 e Huh7) LAC117 (fração de etanol derivada da A. capillaris) Redução do crescimento celular e indução da apoptose in vitro e in vivo; Redução significativa do volume e peso tumoral in vivo. Lu et al., 2018 Tumor colorretal Camundongo BALB/c nu machos induzidos por carcinógeno colônico e DSS Linhagem celular de câncer de cólon humano SW 948 Dihidroartemis inina – componente ativo da Artemisia annua Inibição da viabilidade das células cancerígenas de cólon em concentração e tempo dependente; Redução do crescimento tumoral e inibição da inflamação do cólon in vivo. Wei et al., 2019 Carcinoma hepatocelular Camundongos Kunming machos de 6-8 semanas de idade inoculados com células H22. Linhagens celulares de carcinoma hepatocelular NCTC 1469, H22 e BEL-7404 Extrato etanólico de Artemisia absinthium L. e suas subfrações (éter de petróleo e acetato etílico) Supressão do crescimento de células BEL-7404 e H22 in vitro; Ausência de efeitos colaterais (perda de peso) em comparação com a cisplatina in vivo; Inibição do crescimento tumoral in vivo, semelhante à cisplatina; Maior taxa de sobrevida in vivo. Chen et al., 2019 Hepatoma Camundongos machos de 5 semanas de idade injetados com células H22. Linhagem celular de hepatoma de camundongo H22 e linhagem de hepatoma humano 7402. Polissacarídeos isolados da Artemisia apiaceae (HQG) Indução de apoptose celular in vitro e in vivo;Redução do tamanho e peso médio do tumor dose-dependente in vivo; Melhora da imunidade celular e humoral à defesa da tumorigênese in vivo. Yu et al., 2019 Carcinoma renal de células claras Camundongos nu machos de 4-6 semanas, implantados com células UMRC-2. Linhagens celulares de carcinoma renal de células claras humanas UMRC-2 e CAKI-2. Linhagem de células renais normais HK2. Artemisinina (derivado ativo da Artemisia annua L.) Inibição do crescimento de células cancerígenas dose dependente in vitro; Redução da formação de colônias de células cancerígenas in vitro;Inibição da migração e invasão de células CAKI-2 e UMRC-2 in vitro; O inibidor VIII de AKT potencializa os efeitos anticancerígenos da ART in vitro; Diminuição peso e tamanho tumoral in vivo;Redução da tumorigênese in vivo e in vitro. Zhong et al., 2019 Carcinoma de células renais/ adenocarcinom a renal/ Câncer renal (camundongos nus) Camundongos BALB/c nus machos injetados com células 786-O. Linhagem celular de adenocarcinoma de células renais 786-O. Eupatilina (flavonóide derivado da Artemisia asiatica). Eupatilina suprimiu a proliferação de células cancerígenas renais in vitro e in vivo; Inibição significativa da viabilidade celular 786-O e de sua migração in vitro; Diminuição do volume tumoral in vivo. Lang et al., 2019 Câncer de mama triplo negativo (TNBC) Membrana corioalantoide de filhotes de galinha, enxertadas com células MDA-MB-231 Camundongos NMRI-Foxn1 nu/nu fêmeas de 8 a 9 semanas de idade, com implantação de células MDA-MB-231 Linhagens celulares MDA-MB-231 (TNBC), MCF-7, MIA, PaCa-2, PC-3 e A549. Extratos de Artemisia annua deficientes de artemisinina diluídos em dimetilsulfóxi do (DMSO): Extrato de Momundo; Extrato de Momundo-A CN (com adição de acetonitrila). Efeitos antitumorais de momundo e momundo-ACN semelhantes ao paclitaxel in vitro; Momundo-ACN apresentou citotoxicidade maior às células MDA-MB-231 em comparação com momundo; Momundo-ACN inibiu seletivamente a viabilidade das linhagens celulares estudadas. Sem especificidade para um tecido tumoral e dependência da expressão de receptores hormonais. Lang et al., 2020 Câncer de mama triplo negativo Membrana corioalantóide de filhote de galinha induzido por MDA-MB- 231 Linhagens celulares de autofagia Hla-diFluo e hLC 3 e células mononucleares de doadores humanos saudáveis. Crisosplenol d e casticina (flavonóis derivados da Artemisia annua L.) Ambos apresentaram inibição seletiva contra as linhagens celulares cancerosas de TNBC (CAL-51, CAL-148 e MDA-MB-231), MCF7, A549, MIA PaCa-2 e PC-3 in vitro; Células MCF7 apresentaram maior resistência ao crisosplenol d e à casticina in vitro; – A Casticina, semelhante ao paclitaxel, mesmo em concentrações elevadas, é citotóxica apenas para uma proporção de células; Crisosplenol D eliminou todas as células cancerosas MDA-MB-231, CAL-51 e CAL-148; Ambos reduziram a massa tumoral, semelhante à doxorrubicina, in vivo; -Não promoveram indução de toxicidade sistêmica in vivo. Saeed et al., 2020 Carcinomas e sarcomas (vários tipos tumorais) Animais veterinários de pequeno porte (cães e gatos) Linhagens de células tumorais de cães DH82 e DGBM. Preparação comercial de A. annua (Luparte) contendo artemisinina Expressão elevada de Tfr em biópsias de adenocarcinoma de mama tubulopapilar, sarcoma de tecido mole e carcinoma de células escamosas; Superexpressão de Ki-67 e Tfr em linhagens celulares de glioblastoma e sarcoma histiocítico in vitro; Os animais tratados com A. annua tiveram tempo de sobrevida maior comparado aos tratados apenas com terapia padrão; – Não houve correlação entre o teor de ferro no sangue e o tempo de sobrevida, após terapia com A. annua; Não foi recomendado a suplementação de ferro ao tratamento com A. annua, exceto para aqueles com deficiência de ferro; – Não foram observados efeitos colaterais significativos nos animais tratados com A. annua. Stan et al., 2020 Carcinoma ascítico de Ehrlich Camundongos fêmeas mus musculus implantadas com células de carcinoma de ascite de Ehrlich Linhagem celular de melanoma humano WM35 e fibroblastos humanos normais primários (HDFa). Extrato hidroalcoólico de Artemisia annua L. Inibição do crescimento, adesão, invasão, migração e proliferação tumoral, dose e tempo dependente, in vitro; Maior seletividade contra células tumorais em comparação com a doxorrubicina, in vitro; Maior diminuição do volume ascítico quando em tratamento combinado com doxorrubicina, in vivo. Li et al., 2021 Carcinoma hepatocelular Camundongos BALB/c nu/nu fêmeas induzidos por células HepG2 Linhagem celular de carcinoma hepatocelular HepG2 e SMMC-7721 Óleo essencial de Artemisia argyi Apresenta atividade inibitória do carcinoma, seletiva e dose dependente, para células HepG2 e SMMC-7721 in vitro; Baixa toxicidade e inibição, dose dependente, de metástases cerebral, femoral e pulmonar in vivo; Dose de 115 mg/kg apresentou atividade anti-metastática semelhante ao sorafenib, in vivo. Enquanto que dose de 230 mg/kg apresentou efeito superior, in vivo.
Nota explicativa: AKT: Proteína quinase B; ART: Artemisinina; TFR: receptor de transferrina; TNBC: Câncer de mama triplo negativo; TRAIL: Ligante indutor de apoptose relacionado ao fator de necrose tumoral. Fonte: Autoria própria (2023).
4.DISCUSSÃO
Muitas espécies de Artemisia são utilizadas para fins farmacêuticos e medicinais, com atividade antimicrobiana, inseticida, antiparasitária, antipirética, antioxidante e antitumoral (Wei et al., 2019). Algumas espécies são utilizadas, ainda, para distúrbios gastrointestinais, distúrbios da pele, redução do risco de artrite e aterosclerose, controle de dismenorréia, entre outros fins terapêuticos (Li et al., 2021; Mokhamer et al., 2022). Neste âmbito, muito do que se discute é aplicado ao tratamento do câncer, visto que os quimioterápicos têm efeitos adversos indesejáveis ao paciente. Desta forma, o uso de fitoterápicos torna-se interessante, visto que os bioativos contidos nas plantas apresentam propriedades como: multi-alvo, baixa toxicidade, boa disponibilidade e custo de produção reduzido (Mokhamer et al., 2022). Assim, torna-se importante consolidar o conhecimento dos mecanismos antineoplásicos apresentados pelos múltiplos compostos de Artemísia.
Dentre os estudos selecionados, seis (24%) são referentes ao carcinoma hepatocelular. Os mecanismos antineoplásicos apresentados pelas espécies de Artemisia pesquisadas, promoveram apoptose das células cancerígenas mediada pela via mitocondrial (n=3). De acordo com Wei et al. (2019), o extrato etanólico de Artemisia absinthium e suas subfrações provocaram redução do potencial da membrana mitocondrial das células-alvo cancerígenas, com subsequente liberação de citocromo c no citosol e aumento dos níveis de caspase-3, caspase-9, poli (ADP-ribose) e polimerase (PARP) clivados, culminando na apoptose tumoral. Além disso, o extrato etanólico foi capaz de promover aumento do estresse do retículo endoplasmático, geração de espécies reativas de oxigênio (ROS) e aumento da expressão do gene CHOP, que por sua vez, exacerbaram a disfunção mitocondrial. Kim et al. (2018) colaboraram com a descoberta, uma vez que afirmam em seus estudos que os bioativos da planta, além de aumentarem as proteínas pró-apoptóticas (caspases), também promovem a diminuição das proteínas anti-apoptóticas (XIAP), que auxiliam na apoptose das linhagens celulares do câncer hepatocelular – mecanismo propiciado pela administração da fração de A. Capillaris extraída com etanol. Chen et al. (2014) corroboram com os mesmos achados, comprovando que polissacarídeos isolados da A. apiaceae (HQG) promoveram diminuição do tamanho tumoral, via apoptose, mediada pela disfunção mitocondrial. Para além da apoptose, o mesmo estudo ressalta um efeito imunomodulador mediado pelo HQG, com aumento de linfócitos TCD4+ e TCD8+, IFN-gama e IL-4, que auxiliam na imunodefesa contra o tumor.
Os compostos de Artemisia, ainda, são capazes de influenciar múltiplas vias de sinalização intracelular. Liu et al. (2021) demonstraram que a sinalização Wnt/ beta-catenina, envolvida com a promoção da tumorigênese, é inibida pela administração de óleo essencial de A. argyi, tanto in vitro quanto in vivo. Essa inibição é promovida pela supressão do oncoantígeno DEPDC1, cujo domínio DEP se liga ao receptor Wnt e exerce regulação sobre a via. Ainda, DEPDC1, quando suprimido, regula negativamente a transição epitélio-mesenquimal (TEM), contribuindo para a interrupção da metástase tumoral. Além desta via, Kim et al. (2018) demonstraram que a administração de A. capillaris é capaz de bloquear a via de sinalização PI3K/AKT, comumente desregulada no câncer hepatocelular, através da redução da fosforilação de AKT, mTOR e GSK3beta nas células cancerígenas.
Para mais, dois estudos evidenciaram a redução da hepatotoxicidade como efeito antineoplásico, provocada pelo tratamento com A. judaica e A. vulgaris. Segundo Mokhamer et al. (2022), quando os camundongos eram tratados com extrato etanólico de A. judaica, havia redução de enzimas hepáticas, como alanina aminotransferase (ALT), aspartato-aminotransferase (AST) e fosfatase alcalina (ALP), bem como redução de bilirrubina total e peróxido lipídico malondialdeído (MDA). Somado a isso, houve aumento de enzimas antioxidantes, como superóxido dismutase (SOD), catalase (CAT) e glutationa (GSH). Em consonância, de acordo com Ali et al. (2020), os animais tratados com extratos hidroalcoólico de A. vulgaris também apresentaram redução de ALT e AST, além de diminuição de lactato desidrogenase (LDH), alfa-fetoproteína (AFP), gama-glutamil-transferase (GGT), glicose-6-fosfato-desidrogenase (G6PDH), 5-nucleotidase (5-NT), com aumento de albumina. Nesse sentido, os estudos evidenciaram a redução do estresse oxidativo e dano hepático, sugerindo assim, o grande potencial hepatoprotetor da planta investigada. Visto que o padrão de dano hepatocelular se apresenta com aumento de AST e ALT e o padrão de dano colestático, com aumento de GGT e FA (Lala; Zubair; Minter, 2023).
Wei et al. (2019) compararam o efeito do extrato etanólico de A. absinthium e suas subfrações aos efeitos da cisplatina, quimioterápico que inibe a síntese de DNA e o crescimento celular (Brown; Kumar; Tchounwou, 2019), in vivo e foi demonstrado que a inibição do crescimento tumoral provocada por essas drogas é semelhante. Adicionalmente, os fitoterápicos apresentam vantagens, pois carecem de efeitos colaterais, enquanto que a cisplatina provoca a marcante perda de peso nos animais. Outrossim, o estudo demonstrou que as subfrações preparadas com éter de petróleo e acetato etílico apresentam taxas de sobrevida igual e superior, respectivamente, ao sorafenib, um quimioterápico utilizado para inibição do crescimento celular e angiogênese (Abdelgalil; Alkahtani; Al-Jenoobi, 2019). Li et al. (2021) compararam o efeito do óleo essencial de A. argyi ao sorafenib e concluíram que, além da ausência de efeitos colaterais tóxicos, o primeiro apresentou atividade antimetastática semelhante ou superior (dose dependente) ao quimioterápico. Mokhamer et al. (2022) investigaram a administração combinada de extrato etanólico de A. judaica e ciclofosfamida, agente antineoplásico inibidor da replicação de DNA (Luzardo et al., 2022). Os autores mostraram que a associação desses compostos, proporcionou vantagens adicionais, uma que vez que observaram menores efeitos tóxicos sistêmico, diminuição expressiva das enzimas hepáticas e bilirrubina total, maior aumento de biomarcadores antioxidantes hepáticos e melhor restauração das características histológicas do tecido hepático, em relação ao uso do quimioterápico isolado.
Os estudos referentes ao câncer hepatocelular apresentaram posologias bastante divergentes entre si, sendo 12,5 mg/kg a menor dose administrada em camundongos e 0,5 g/kg/dia a maior. Além disso, Ali et al. (2020) documentaram dose tóxica acima de 150 mg/kg do fitoterápico estudado. O tempo de tratamento, in vivo, também se mostrou diversificado, distribuindo-se entre 10 dias a 8 semanas. Enquanto que a via de administração escolhida, em sua maioria, foi a intraperitoneal (IP), mas também houve administração oral e gavagem. Os estudos comprovaram, em sua totalidade, que o peso corporal dos animais tratados com Artemisia não foi afetado, bem como houve redução do tamanho da massa tumoral. Desta forma, os trabalhos indicam que o uso, independentemente da via de administração, da Artemisia como adjuvante no tratamento de neoplasias, é capaz de auxiliar nos desfechos e que sua utilização também é segura, eficaz, aditiva e de baixa toxicidade sistêmica.
Os efeitos antineoplásicos do fitoterápico foram investigados no câncer de mama. Foram desenvolvidos quatro artigos sobre esse tema (16%), os estudos revelaram que o tratamento com a Artemisia annua reduziu de forma importante o crescimento tumoral através do tropismo e potencial citotóxico do composto por células tumorais, além de não interferir na imunomodulação. Segundo Mohamadabadi et al. (2013), Arteether (ARE), um derivado do da A. annua, foi capaz de reduzir o crescimento celular de células 4T1 in vitro. Porém não demonstrou resultado expressivo sobre a imunomodulação, pois não promoveu alteração nos níveis de IFN-gama, IL-4 e IL-10, que, porventura, foram encontrados em estudos referentes à espécie A. apiaceae no câncer hepatocelular. No entanto, o ARE promoveu redução de células Treg esplênicas, células capazes de manter a autotolerância imunológica (Júnior et al., 2010), o que pode estar relacionado à diminuição do crescimento tumoral in vivo.
Faheem e Nabity (2020) demonstraram que o extrato aquoso de A. annua também foi capaz de aumentar a capacidade antioxidante total nas ratas induzidas com câncer de mama, levando ao aumento de SOD, CAT, GSH e glutationa peroxidase (Gpx) e diminuição de MDA. Resultado concordante com os mecanismos antineoplásicos da A. judaica no câncer hepatocelular (Mokhamer et al., 2022). Por outro lado, a A. annua promoveu diminuição dos níveis de marcadores tumorais CA 15.3 e antígeno carcinoembrionário (CEA); restauração da expressão de AKT1 e aumento de ativador apoptótico BAX no câncer de mama (Faheem; Nabtity, 2020). Mecanismos também promovidos por outras espécies de Artemisia no câncer hepatocelular, como a A. capillaris que demonstrou ser capaz de regular a via de sinalização AKT1/ mTOR (Kim et al., 2018) e a A. absinthium que comprovou sua propriedade em aumentar os níveis de BAX e diminuir os níveis de proteínas anti-apoptóticas (Wei et al., 2019).
Outros dois estudos enfatizaram os efeitos citotóxicos em células cancerígenas mamárias in vitro e in vivo de diferentes compostos de A. annua, especialmente crisosplenol D e casticina. Lang et al. (2020) salientaram que ambos inibiram a viabilidade das células MDA-MB-231 do câncer de mama triplo negativo, culminando com formação de corpos apoptóticos, redução do potencial de membrana mitocondrial e aumento de fragmentação do DNA, mostrando, mais uma vez, morte celular mediada pela via mitocondrial. Em consequência, ambos promoveram parada do ciclo celular, achado consonante com Lang et al. (2019) que para além do envolvimento da via mitocondrial, apontam para a possibilidade de participação da via extrínseca no mecanismo de apoptose.
Lang et al. (2020) mostraram, ainda, que o crisosplenol D e casticina promoveram ativação sustentada de ERK 1/2 basal, via relacionada a efeitos pró-apoptóticos, e salientaram que os mesmos possuem efeito positivo sobre a redução do volume tumoral e diminuição do antígeno de proliferação Ki-67 in vivo, encontrados também em Lang et al. (2019).
Os autores em suas duas publicações enfatizaram que os compostos ativos artenuína B, crisosplenol D e casticina apresentaram efeitos comparativos e superiores aos quimioterápicos convencionais, paclitaxel e doxorrubicina. O paclitaxel atua como droga estabilizadora de microtúbulos, induzindo parada da mitose e morte celular (Bernabeu et al., 2017), enquanto que a doxorrubicina, fármaco do grupo das antraciclinas, inibe a síntese e replicação de DNA (Moura et al., 2017). A casticina demonstrou ter efeito semelhante ao paclitaxel, in vitro; enquanto que o crisosplenol apresentou resultado superior aos anteriores, pois foi capaz de eliminar todas as células cancerígenas, in vitro (Lang et al., 2020). O efeito dos fitoterápicos, in vivo, foi equivalente ao da doxorrubicina, levando à redução da massa tumoral, com a vantagem de não apresentarem efeitos tóxicos hepáticos e sistêmicos (Lang et al., 2019; Lang et al., 2020).
As posologias, in vivo, utilizadas pelos estudos variaram de 6 mg/ kg a 200 mg/ kg, em camundongos. Enquanto que foi utilizada posologia igual (20 μL) para os estudos in vivo em membrana corioalantóide. O tempo de tratamento nas membranas corioalantóides de galinhas, variou de 3 a 4 dias; e nos camundongos entre 13 dias a 4 semanas. Não foram vistos efeitos colaterais provocados pelos fitoterápicos. Os estudos mostraram ainda que os derivados de A. annua apresentaram seletividade para as células cancerígenas de mama, pois não foi observado efeito citotóxico no crescimento de linfócitos do sangue periférico, de células mononucleares e nas células epiteliais de mama normais (Lang et al., 2019; Lang et al., 2020; Mohamadabadi et al., 2013).
Os achados dos estudos mostram resultados favoráveis do uso dos compostos de A.
annua no tratamento da neoplasia de mama, justificando serem agentes anticancerígenos complementares promissores.
O câncer renal é representado por quatro estudos (16%) dos selecionados. Segundo Han et al. (2020), eupafolina, composto extraído da A. princeps, induziu, significativamente, regulação de proteínas atreladas à apoptose, diminuindo a expressão de proteína Mcl-1, via degradação lisossomal, e aumentando a expressão de proteína Bim, por meio da inibição da atividade do proteassoma pela via AMPK.
Ademais, os outros três estudos corroboraram para explicar a ação antineoplásica da espécie supracitada, mediada pela regulação negativa de via AKT. De acordo com Yu et al. (2019), artemisinina (ART), derivado da A. annua, conseguiu suprimir a fosforilação da AKT em células UMRC-2 e células CAKI-2. Isto foi decorrente da diminuição gênica in vitro e in vivo dos níveis de mRNA de c-Myc, ciclina D1, PCNA, N-caderina, Vimentina e Snail e aumento dos níveis de mRNA da E-caderina, fazendo com que houvesse bloqueio da proliferação, migração e invasão de células do carcinoma renal, efeito encontrado também para a espécie de A. argyi no câncer hepatocelular (Li et al., 2021).
Zhong et al. (2019) também salientaram o bloqueio da fosforilação de AKT como mecanismo estimulante da supressão do crescimento tumoral, nesta ocasião provocada pela eupatilina, substância derivada da A. asiática. Segundo os autores, a regulação se deve à interferência do composto na sinalização microRNA-21/ YAP1/ AKT. A eupatilina regula negativamente a expressão de miRNA-21, o que leva à perda de seu efeito inibitório sobre o RNAm de YAP1. Com isso, os níveis desta proteína aumentam e acabam por inibir a fosforilação de AKT, freando a proliferação neoplásica.
Son et al. (2018) corroboraram com os mesmos achados. Porém, além da inibição de AKT, outros mecanismos, como inibição do metabolismo de glicose, parada do ciclo celular, apoptose e autofagia também foram evidenciados. O estudo salientou que MC-4, material parcialmente purificado da A. annua L., é capaz de impedir a fosforilação de AKT, levando à diminuição de piruvato quinase M2 (PKM2), que por sua vez, contribuiu para diminuição de transportadores de glicose 1 (GLUT1), inibindo o metabolismo de glicose das células cancerígenas. Tais mecanismos levariam à morte celular por autofagia, demonstrada pela formação de vesículas autofágicas. Além disso, a apoptose também foi evidenciada pelo aumento de proteína pró-apoptótica BAX e diminuição de proteína anti-apoptótica BCL-2, dados condizentes com os efeitos provocados pela A. absinthium no carcinoma hepático. O composto também foi capaz de induzir parada do ciclo celular nas fases G2/M, achados compatíveis com os estudos da A. annua no câncer de mama e hepatocelular (Lang et al., 2020; Wei et., 2019).
Son et al. (2018) avaliaram a eficácia do uso combinado de MC-4 e everolimus no tratamento de câncer renal metastático. Everolimus, quando administrado sozinho, apresentou sucesso terapêutico limitado, pois, apesar de inibir mTOR C1, possui atividade compensatória sobre a via AKT e provoca aumento da expressão de PKM2 e GLUT1. MC-4, quando coadministrado, inibiu esse feedback compensatório. Dessa forma, por apresentar dupla inibição das vias de sinalização oncogênica AKT/ PKM2 e mTOR, tal medida pode ser promissora.
Han et al. (2016) demonstraram que o tratamento combinado de eupafolina e TRAIL é benéfico, superando o tratamento isolado de ambos, que não tiveram efeitos sobre a apoptose. Quando coadministrados, houve acúmulo de células na fase G1, indução da fragmentação do DNA, indução de caspase-3 e clivagem de PARP, já demonstrado em extratos de A.absinthium e A. capillaris no câncer hepático. Nesse sentido, o estudo evidenciou que a eupafolina sensibiliza as células cancerígenas para apoptose mediada por TRAIL, não tendo efeito sobre as células mesangiais humanas e epiteliais renais de camundongo, garantindo especificidade ao mecanismo. Yu et al. (2019) também verificaram maior eficácia do tratamento combinado de ART com inibidor de AKT VIII em relação ao tratamento isolado, pois houve maior supressão via de sinalização Akt.
As posologias administradas in vivo foram de 10, 20 e 200 mg/Kg, sendo que as vias de administração encontradas foram IP, subcutânea e gavagem. O tempo de tratamento se concentrou entre 2 semanas a 30 dias. Os fitoterápicos apresentaram especificidade para as células cancerígenas renais, sem haver qualquer efeito adverso associado.
O câncer de cólon e colorretal é abordado em três estudos ( 12%) dos vinte e cinco artigos selecionados. Lu et al. (2017) mostraram que a dihidroartemisinina, componente ativo da A. annua, foi capaz de inibir a viabilidade de células SW 948, por meio do aumento da expressão de polimerase clivada e ativação da caspase-3 induzindo morte celular. Mecanismos relatados também em estudos de cânceres hepatocelular, mama e renal. Além disso, o tratamento com diidrartemisinina foi capaz de inibir metaloproteinases 2 e 9,citocromo e apoptose mediada por caspases 3 e 7, já evidenciados em estudos anteriores. A sinalização de Akt, ativada por PDK1 (proteína quinase dependente de fosfoinositídeo-1), importante para a sobrevivência celular, foi inibida pelo fitoterápico, de modo independente do aumento de PTEN e p53, levando à diminuição das proteínas de sobrevivência celular.
Krishna et al. (2015), através de um estudo clínico, observaram o efeito anticancerígeno neoadjuvante do artesunato oral, derivado da A. annua, em pacientes submetidos ao tratamento cirúrgico. Não foi possível determinar se o composto estaria relacionado ao aumento de apoptose das células tumorais nesses pacientes, pois os indicativos de morte celular foram próximos ao do grupo placebo. Porém, o estudo evidenciou alta probabilidade da correlação da droga com efeitos redutores da expressão de Ki-67, marcador de proliferação tumoral. Achado concordante com estudos anteriores realizados in vitro e em animais (Lang et al., 2019; Son et al., 2018; Lang et al., 2020; Saeed et al., 2020). Outros marcadores tumorais, CD31 e CEA, foram analisados, embora com probabilidade mais baixa de serem afetados pelo fitoterápico.
A posologia utilizada pelo ensaio clínico foi de 200 mg via oral, enquanto que a dose dos demais estudos in vivo variou entre 20 a 40 mg/kg/dia. O tempo de tratamento se distribuiu entre 14 dias à 4 semanas. Destes, apenas o ensaio clínico demonstrou possíveis efeitos colaterais relacionados à administração do fitoterápico, como anemia, neutropenia e náuseas, corroborado pelo exame de medula óssea que sugeriu efeito tóxico do mesmo.
O desfecho dos estudos em ratos demonstrou redução do tamanho tumoral, enquanto que o desfecho do ensaio clínico, apesar de não indicar restauração da apoptose tumoral, demonstrou provável efeito antiproliferativo, boa tolerabilidade e maior sobrevida livre de recorrência.
O câncer de próstata é abordado em dois artigos (8%) dos estudos selecionados, cujos alvos moleculares são a via de sinalização AR-DNMT3b e a inibição de STAT3. O mecanismo encontrado por Wang et al. (2017) para combater o câncer de próstata, através da administração de artesunato, foi a inibição da expressão de receptor androgênico (AR) e aumento da expressão e atividade catalítica de DNMT3b (DNA metiltransferase 3b), com consequente apoptose das células malignas. A ativação do AR promove mudanças no metabolismo, proliferação celular e diferenciação da próstata. Enquanto que a DNA metiltransferase 3b promove metilação gênica e sua maior expressão é capaz de promover morte celular. O fato é que nos cânceres de próstata, no geral, há inibição de DNMT através do AR, portanto os resultados do artesunato mostram-se contrários aos eventos da gênese do câncer, apresentando bom desfecho.
Kim et al. (2013) observaram os efeitos anticancerígenos da escoparona, derivado da A. capillaris, destacando que os mecanismos antineoplásicos da substância se devem, principalmente, à inibição da fosforilação do transdutor de sinal e ativador de transcrição 3 (STAT3), ativo em alguns cânceres e promotor de tumorigênese e metástase. O estudo demonstrou que a inibição de STAT3 ocorreu de forma independente das quinases a montante, JAK e Src. Ou seja, a A. capillaris atua por ligação direta ao domínio SH2 de STAT3, inibindo-o. Além disso, o fitoterápico promoveu inibição dos genes-alvos a jusante de STAT3, com diminuição de proteínas antiapoptóticas BCL-2, survivina, ciclina D1, c-myc e socs3. Além de STAT3, outros fatores de transcrição que exercem influência na proliferação de células cancerígenas foram inibidos pela escoparona. Ainda, o estudo salientou aumento de proteínas inibidoras do ciclo celular, p21 e p27, e diminuição de promotores do ciclo, como pRb fosforilado.
Os estudos utilizaram doses, in vivo, de 50-100 mg/kg e 30 mg/kg, respectivamente. O tempo de administração variou entre 4 semanas e 18 dias, sendo as vias de administração utilizadas subcutânea e ip. Não houve relato de efeitos colaterais significativos, com ambos os estudos apresentando desfechos positivos. No entanto, uma possível limitação alegada por Kim et al. (2013) seria a necessidade de administração de doses muito elevadas de escoparona na prática clínica para que o efeito antiproliferativo fosse exercido.
O carcinoma sólido de Ehrlich é abordado por dois estudos dos selecionados (8%). Mohamad; Amer e Faky (2019) demonstraram que o extrato alcoólico de A. herba alba foi capaz de causar dano às fitas de DNA, promovendo efeito positivo sobre o gene supressor de tumor p53, já comentado no câncer colorretal e renal metastático, e efeito negativo sobre o pró-oncogene K-ras. Essas modificações gênicas culminaram na apoptose das células malignas, que foram correlacionados com a redução do peso tumoral e corporal dos ratos tratados. Além disso, os autores compararam esses resultados com os grupos de ratos tratados com cisplatina e artesunato, verificando maior efeito da A. herba alba sobre as alterações genéticas, bem como efeitos parecidos em volume tumoral. Lesões hepáticas e renais foram encontradas em todos os grupos, porém mais amenas no grupo da A. herba alba. Assim, esse é o único estudo, dentre os selecionados, que demonstrou segurança superior da A. herba alba em relação ao artesunato e à cisplatina.
Stan et al. (2020) evidenciaram alterações de enzimas antioxidantes como mecanismo antineoplásico promovido pelo extrato hidroalcoólico de A. annua. Os autores concluíram que houve diminuição de CAT e SOD, tornando as células tumorais mais suscetíveis aos danos causados por EROS. Dessa forma, o estresse oxidativo estaria envolvido com o efeito citotóxico e antiproliferativo causado pelo fitoterápico. Paradoxalmente, estudos já mencionados demonstraram aumento dessas enzimas antioxidantes e menor estresse oxidativo nas células cancerígenas como mecanismo antineoplásico promovido pela administração de A. judaica e A. annua nos cânceres hepatocelular e de mama, respectivamente.
Além disso, Stan et al. (2020) também demonstraram que, in vitro, o extrato hidroalcoólico de A. annua tem maior seletividade às células tumorais em comparação com a doxorrubicina. Os resultados do tratamento combinado, in vivo, comprovaram que o fitoterápico foi capaz de melhorar o efeito antiproliferativo da doxorrubicina, com melhores resultados quanto à diminuição do volume ascítico e concentração de células tumorais em comparação com o tratamento isolado do quimioterápico.
Os estudos utilizaram doses, in vivo, de 300 mg/kg/dia (Mohamad; Amer; Faky, 2019) e 1000 mg/kg (Stan et al., 2020) por tempo de 5-10 dias e 14 dias, respectivamente. As vias de administração escolhidas foram oral e ip. Não foram relatados efeitos adversos nos dois estudos, ambos apresentando desfechos positivos.
O câncer de ovário compreende apenas um estudo dos selecionados (4%). Os resultados do estudo de Wu et al. (2012) concluíram que a dihidroartemisinina, derivado da A. annua, foi capaz de suprimir a proliferação, adesão, invasão e migração das células de câncer de ovário, tanto in vitro quanto in vivo. Assim foram observados, in vitro, diminuição de quinase de adesão focal fosforilada (pFAK), proteína tirosinoquinase envolvida em interações célula-matriz extracelular, metástase e proliferação celular, além de redução de MMP-2, inibindo a metástase do carcinoma de ovário. Resultado concordante com estudo anterior, que verificou diminuição de MMP-2 e MMP-9, devido à administração do mesmo composto em tumores colorretais. In vivo, foram observados diminuição de fator de Von Willebrand (vWf), envolvido com a neovascularização cancerígena, e menor infiltração de macrófagos em tecidos metastáticos. A dose utilizada in vivo foi de 50 mg/kg, sendo que os ratos receberam três doses semanais por quatro semanas, via IP. Os efeitos adversos foram mínimos, podendo se tornar uma droga promissora para o tratamento de câncer de ovário.
O câncer de esôfago também compreende apenas um artigo (4%) dos estudos selecionados. Fei et al. (2018) demonstraram o aumento da radiossensibilidade das células cancerígenas pela administração prévia de Artesunato. Os pesquisadores encontraram que o grupo de células malignas (TE-1) submetido ao tratamento combinado com artesunato e irradiação apresentou menor sobrevivência in vitro. Dessa forma, o artesunato inibiu, de forma seletiva e dose-dependente, a proliferação celular de TE-1. A apoptose precoce e tardia foram observadas em maior nível no tratamento combinado em detrimento do isolado.
Além disso, os autores salientaram que a irradiação é capaz de promover quebras da fita dupla de DNA (DSB), sendo que o nível de histonas fosforiladas (γ-H2AX) está associado a esse mecanismo. Nesse sentido, foi verificado maior nível de γ-H2AX, induzido por artesunato comparado ao grupo controle, indicando efeito radiossensibilizador da substância. Ainda, o artesunato conseguiu reduzir o nível de expressão de proteínas reparadoras de DNA como RAD51, RAD54, Ku70 e Ku 86, causando maior efeito citotóxico e atrasando o reparo de DNA das células malignas. No tratamento in vivo, a administração de artesunato isolado suprimiu o crescimento tumoral, porém sem diferenças significativas em relação ao grupo controle. Quando em tratamento combinado, houve redução mais significativa do crescimento, volume e peso tumoral. O estudo utilizou dose de 100 mg/kg, via IP, por tempo de 7 dias nos ratos tratados e não houve efeitos colaterais.
O câncer de cabeça e pescoço (CCP) compreende apenas um estudo (4%) dos selecionados. Roh et al. (2017) notaram que o Artesunato foi capaz de promover, in vitro, morte celular seletiva das células cancerígenas, através da ferroptose, mecanismo dependente de ferro, com consequente diminuição de GSH e acúmulo de ROS. No entanto, esse efeito foi subótimo em CCPs resistentes à cisplatina, devido à ativação da via do elemento de resposta antioxidante-Nrf2 (Nrf2-ARE). Assim, quando coadministrado com silenciadores gênicos de Nrf2 e/ ou OH-1 ou em associação com trigonelina (inibidor de Nrf2) promoveram, in vitro, diminuição da viabilidade dessas células e menor crescimento do volume tumoral, in vivo. Dessa forma, a coadministração dessas drogas pode ser uma alternativa eficaz para superar a resistência dessas neoplasias à ferroptose promovida pelo artesunato.
Além disso, foi demonstrado aumento de focos de γ-H2AX nos tumores in vivo quando na coadministração das medicações, mecanismo equivalente ao promovido pelo artesunato no câncer de esôfago. In vivo, a posologia utilizada foi de 50 mg/ kg e a via de administração foi oral. Os resultados são promissores e indicam necessidade de investigações clínicas para exploração dessa terapia contra o CCP.
Um estudo dos selecionados aborda variados tipos de cânceres, cujos pesquisadores mediram o marcador bioquímico de proliferação Ki-67 (também abordado nos estudos anteriores referentes ao câncer de mama triplo negativo e carcinoma renal metastático) e receptor da transferrina (Tfr) para averiguar a atividade anticancerígena de uma preparação de
A. annua, em cães e gatos, em comparação com tratamento padrão. Saeed et al. (2019) encontraram relação positiva entre a expressão de Ki-67/ Tfr e a sensibilidade das células à artemisinina, sendo que tecidos que expressavam esses biomarcadores, característicos de evolução rápida, foram significativamente responsivos à ação da artemisinina, como câncer de pulmão, melanoma e câncer renal, sem resultados evidentes em outros cânceres. Ademais, um achado importante in vivo foi a sobrevida acima de 18 meses em animais tratados com A. annua, o que não foi averiguado no tratamento padrão.
In vitro, os pesquisadores observaram que o teor de ferro no sangue não foi essencial para a sobrevida dos animais, enquanto que o teor de Tfr no interior do tumor foi. Portanto, concluiu-se que a suplementação de ferro associada ao fitoterápico é desnecessária, sendo restrita aos pacientes com deficiência de ferro. O estudo obteve dose de 1.400 mg/m² em cães e gatos. Todos os animais foram tratados com o fitoterápico, por via oral, entre 2010 e 2017. Não foram observados efeitos colaterais, durante este período, nos animais tratados com A. annua.
Diante do exposto, os resultados promissores dos estudos apresentados, fornecem embasamento científico para maior exploração dos múltiplos compostos derivados das espécies de Artemisia em estudos clínicos maiores, que visem fornecer informações adicionais quanto aos benefícios do sinergismo desses compostos naturais aos regimes atuais de terapia. Outrossim, são necessários maiores investimentos e pesquisas sobre os possíveis efeitos colaterais em terapias de longo prazo, bem como das limitações sobre as vias de administração e posologias utilizadas em humanos.
Assim, podemos concluir que, da totalidade dos estudos selecionados, os principais derivados das espécies de Artemisia apresentados foram a artemisinina e o artesunato. A artemisinina, derivada da A. annua L., tem como estrutura química ser um sesquiterpeno lactônico (Oliveira; Cruz; Dias, 2022). Enquanto que o artesunato é um derivado semissintético desta (Fei et al., 2018). Esses compostos possuem atividade antimalárica bem estabelecida na literatura (Roh et al., 2017), tendo seus efeitos extrapolados como drogas anticancerígenas, pois são capazes de promover inibição do ciclo celular e angiogênese, apoptose, modulação da responsividade nuclear e interrupção da migração celular (Firestone; Sundar, 2009).
5 CONCLUSÃO
O emprego desta Revisão Integrativa de Literatura atua como vetor que aponta para averiguar os mecanismos antineoplásicos propiciados pelos múltiplos derivados das espécies Artemisia, cuja principal finalidade é instaurar, de forma segura e eficaz, um implemento no uso de terapias alternativas e tratamentos complementares em indivíduos com câncer de diversas morfogêneses. Nesse aspecto, este estudo sistematizou a concepção do tratamento de diversos tipos de câncer, sob a ótica das vias de sinalização, protooncogenes, principais interleucinas e substâncias de estresse celular, bem como parada do ciclo celular e apoptose, contemplados nos principais trabalhos mundiais sobre o assunto. Nossas investigações foram capazes de mostrar que a utilização de uma das abordagens da MTC, pode contribuir não apenas para o sucesso terapêutico de pacientes com câncer, mas também é capaz de melhorar a sobrevida e os efeitos indesejáveis dos indivíduos tratados com a espécie Artemisia. Desse modo, sugerimos o incentivo de estudos posteriores acerca do tema, assim como pudemos fornecer base teórica para maior exploração terapêutica em humanos, de forma que possam ser implementados no Sistema Único de Saúde.
REFERÊNCIAS
ABDELGALIL, A. P.; ALKAHTANI, M. H.; Al-JENOOBI, I. F. Chapter Four – Sorafenib. 2018. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S1871512518300189?via%3Dihub Acesso em: 14 de fev. 2023.
ALI, S. et al. Evaluation of chemopreventive and chemotherapeutic effect of Artemisia vulgaris extract against diethylnitrosamine induced hepatocellular carcinogenesis in Balb C mice. 2020. DOI: https://doi.org/10.1590/1519-6984.185979.
ARAÚJO, Wánderson Cássio Oliveira. Recuperação da informação em saúde: construção, modelos e estratégias. Convergências em Ciência da Informação, v. 3, n. 2, p. 100-134, maio/ago. 2020. Disponível em: http://www.repositorio.ufc.br/handle/riufc/52993. Acesso em: 21 jan. 2023.
BARDIN, Laurence. Análise de conteúdo. São Paulo: Edição:70, 2016.
BERNABEU, E. P. et al. Paclitaxel: What has been done and the challenges remain ahead. 2017. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S037851731730426X. Acesso em: 16 de fev. 2023.
BRASIL. INSTITUTO NACIONAL DE CÂNCER JOSÉ ALENCAR GOMES DA
SILVA. Estimativa 2020: incidência de câncer no Brasil. Rio de Janeiro: Inca, 2019. 120 p. 4.
BRASIL. INSTITUTO NACIONAL DE CÂNCER JOSÉ ALENCAR GOMES DA
SILVA. Estimativa 2023: incidência de câncer no Brasil. Rio de Janeiro: Inca, 2022. 160 p. 4.
BRASIL. INSTITUTO NACIONAL DE CÂNCER (INCA). Gastos federais atuais e futuros com os cânceres atribuíveis aos fatores de risco relacionados à alimentação, nutrição e atividade física no Brasil. Rio de Janeiro: Inca, 2022. 50 p.
BRASIL. INSTITUTO NACIONAL DE CÂNCER (INCA). Tratamento do câncer. 2022.
Disponível em: https://www.gov.br/inca/pt-br/assuntos/cancer/tratamento. Acesso em: 20 jan. 2023.
BROWN, A.; KUMAR, S.; TCHOUNWOU, B. P. Cisplatin-Based Chemotherapy of Human Cancers. 2019. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059781/ Acesso em: 15 de fev. 2023
CHEN, J. et al. ANTI-TUMOUR EFFECTS OF POLYSACCHARIDES ISOLATED FROM ARTEMISIA ANNUA L BY INDUCING CELL APOPTOSIS AND IMMUNOMODULATORY ANTI-HEPATOMA EFFECTS OF POLYSACCHARIDES. Chen et al., Afr J Tradit Complement Altern Med. (2014) 11(1):15-22. http://dx.doi.org/10.4314/ajtcam.v11i1.2. 15
FEI, Z; GU, W.; XIE, R. et al. Artesunate enhances radio-sensitivity of esophageal câncer Cells by Inhibiting the repair of DNA damage. 2018. Journal of Pharmacological Sciences. 138 (2018) 13q-137.
FERRAZ, Cleidiane Vedoy; CHAGAS, Juciéli Chiamulera das; DORIGON, Elisangela Bini. Artemisia absinthium L.: Aplicabilidade na saúde humana. Brazilian Journal Of Health Review, Curitiba, v. 3, n. 4, p. 10650-10661, jul. 2020. Disponível em: http://dx.doi.org/10.34119/bjhrv3n4-326. Acesso em: 20 jan. 2023.
FRAGOSO, Thaís Palmeira. Análise do uso medicinal do gênero Artemisia no Brasil com base em fatores tradicionais, científico. 2014. 45 f. Monografia (Especialização) – Curso de Gestão da Inovação em Fitomedicamentos, Instituto de Tecnologia em Fármacos – Farmanguinhos, Rio de Janeiro, 2014.
GARY L. F. et al. Anticancer activities of artemisinin and its bioactive derivatives. Expert Rev. Mol Med. 2009. Disponível em: https://pubmed.ncbi.nlm.nih.gov/19883518/ Acesso em: 16 de fev. 2023.
GENG, Guoyan; YIN, Zihan; SUN, Mingsheng; XU, Guixing; CHEN, Jiao; LIANG, Fanrong; ZHAO, Ling. Acupuncture for the treatment of marrow suppression after chemotherapy. Medicine, [S.L.], v. 99, n. 34, p. 1-6, 21 ago. 2020. Disponível em: http://dx.doi.org/10.1097/md.0000000000021876. Acesso em: 20 jan. 2023.
GOLEMIS, Erica A.; SCHEET, Paul; BECK, Tim N.; SCOLNICK, Eward M.; HUNTER, David J.; HAWK, Ernest; HOPKINS, Nancy. Molecular mechanisms of the preventable causes of cancer in the United States. Genes & Development, [S.L.], v. 32, n. 13-14, p. 868-902, 26 jun. 2018. Disponível em: http://dx.doi.org/10.1101/gad.314849.118. Acesso em: 20 jan. 2023.
HAN, E. M; M. J. K; WOOL, M. S. et al. Eupafolin enhances TRAIL-mediated apoptosis through cathepsin S-induced down-regulation of Mcl-1 expression and AMPK – mediated Bim up-regulation in renal carcinoma Caki cells. August. 2016. Vol. 3.
HEMMAT M. M. FAHEEM, M. M. Artemisia annua Extract Ameliorates DMBA-induced Breast Cancer in Albino rats; Antioxidant and Genetic Effects. DOI: http://dx.doi.org/10.13005/ojc/360314. Maio, 2020.
JÚNIOR, M. D. et al. Sistema imunitário – parte II: fundamentos da resposta imunológica mediada por linfócitos T e B. Artigo de Revisão Rev. Bras. Reumatol. 50 (5). Out 2010. Disponível em: https://www.scielo.br/j/rbr/a/kPW8JNvSRfRy7RkdZVjW3tw/# Acesso em: 15 de fev. 2023.
KIM, J. H. et al. Apoptosis-induced effects of extract from Artemisia annua Linné by modulating PTEN/p53/PDK1/Akt/ signal pathways through PTEN/p53-independent manner in HCT116 colon cancer cells. Kim et al. BMC Complementary and Alternative Medicine (2017) 17:236 DOI: 10.1186/s12906-017-1702-7.
KIM, K. J. et al. Scoparone Exerts Anti-Tumor Activity against DU145 Prostate Cancer Cells via Inhibition of STAT3 Activity. PLoS ONE 8(11): e80391. doi:10.1371/journal.pone.0080391.
KIM et al. Artemisia Capillaris leaves inhibit cell proliferation and induce apoptosis in hepatocellular carcinoma. Complementary and Alternative Medicine (2018) 18:147 DOI: https://doi.org/10.1186/s12906-018-2217-6.
KIM, Mikyung; KIM, Jung-Eun; LEE, Hye-Yoon; KIM, Ae-Ran; PARK, Hyo-Ju;
KWON, O-Jin; KIM, Eun-Jung; PARK, Yeon-Cheol; SEO, Byung-Kwan; CHO, Jung Hyo. Moxibustion for cancer-related fatigue: study protocol for a randomized controlled trial. Bmc Complementary And Alternative Medicine, [S.L.], v. 17, n. 1, p. 1-14, 5 jul. 2017. Disponível em: http://dx.doi.org/10.1186/s12906-017-1856-3. Acesso em: 20 jan. 2023.
KRISHNA, S. et al. A Randomised, Double Blind, Placebo-Controlled Pilot Study of Oral Artesunate Therapy for Colorectal Cancer. EBioMedicine 2 (2015) 82–90.
LALA, V.;ZUBAIR, M.; MINTER, A. D. Liver Function Tests. 2023. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK482489/ Acesso em: 15 de fev. 2023.
LANG, J. S. et al.Chrysosplenol d, a Flavonol from Artemisia annua, Induces
ERKI1/2-Mediated Apoptosis in Triple Negative Human Breast Câncer Cells. Int. J. Mol. Sci. 2020, 21, 4090; 345-345. doi:10.3390/ijms21114090.
LANG, J. S. et al. Antitumor activity of an Artemisia annua herbal preparation and identification of active ingredients. Phytomedicine 62 (2019) 152962.
LI, Y; TIAN, Y. ZHONG, W; WANG, N. Artemisia argyi Essential Oil Inhibits
Hepatocellular Carcinoma Metastasis via Suppression of DEPDC1 Dependent Wnt/β-Catenin Signaling Pathway. Frontiers in Cell and Developmental Biology. 2021. Vol.2.
LU, H. Z. PENG, H. J. ZHANG, F. W. et al. Dihydroartemisinin inhibits colon cancer cell viability by inducing apóstolos through up-apoptosis through up- regulation of PPARc expression. Saudi journal of biological Sciences. 25 (2018) 372-376.
LUZARDO, B. C. et al. Efeitos da doxorrubicina e ciclofosfamida isoladas e combinadas na linhagem celular de adenocarcinoma de mama MCF-7. Revista de Iniciação Científica da Ulbra, vol. 20, 2022.
MOHAMADABADI, A. M. HASSAN, M. Z. HOSSEINI, Z. A et al. Arteether Exerts Antitumor Activity and Reduções CD4+CD25+FOXP3+ T-reg Cells in Vivo. Iran.Immunol. VOL. 10 NO. 3 September. 2013.
MOHAMED, H. R. et al. Growth retardation and apoptotic death of tumor cells by Artemisia herba-alba oral administration in Ehrlich solid carcinoma bearing mice. DOI:
https://doi.org/10.1016/j.bjp.2019.06.007 .0102-695X/© 2019 Sociedade Brasileira de Farmacognosia.
MOKHAMER, et al. Attenuation of trichloroacetic acid-induced hepatocellular carcinoma by Artemisia judaica ethanolic extract in male rats. The Journal of Basic and Applied Zoology (2022) 83:2 DOI: https://doi.org/10.1186/s41936-022-00264-z.
MOURA, R. L. Ação do extrato etanólico da casca do pequi (Caryocar brasiliense) na cardiotoxicidade crônica induzida por doxorrubicina em ratos. Pequenos Animais. Pesq. Vet. Bras. 37 (07). Jul 2017. Disponível em: https://www.scielo.br/j/pvb/a/4C6wYqT4T6nWzYwZ4cfKgHv/ Acesso em: 16 de fev. 2023.
OLIVEIRA, G. R.; CRUZA, R. L.; DIA, C L. ARTEMISININA E DERIVADOS: DESCOBERTA, ESTRATÉGIAS SINTÉTICAS E OBTENÇÃO INDUSTRIAL. Quim. Nova, Vol. 45, No. 7, 831-846, 2022
PAGE, Matthew J; MOHER, David; BOSSUYT, Patrick M; BOUTRON, Isabelle; HOFFMANN, Tammy C; MULROW, Cynthia D; SHAMSEER, Larissa; TETZLAFF, Jennifer M; A AKL, Elie; BRENNAN, Sue e. PRISMA 2020 explanation and elaboration: updated guidance and exemplars for reporting systematic reviews. Bmj, [S.L.], p. 160, 29 mar. 2021. Disponível em: http://dx.doi.org/10.1136/bmj.n160. Acesso em: 20 set. 2022.
PETERS, Jeffrey M; GONZALEZ, Frank J. The Evolution of Carcinogenesis. Toxicological Sciences, [S.L.], v. 165, n. 2, p. 272-276, 25 set. 2018. Disponível em:http://dx.doi.org/10.1093/toxsci/kfy184. Acesso em: 21 jan. 2023.
ROH, L. J. et al. Nrf2 inhibition reverses the resistance of cisplatin-resistant head and neck cancer cells to artesunate-induced ferroptosis. Redox Biology 11 (2017) 254–262.
SAEED, M. et al. Retrospective study of small pet tumors treated with Artemisia annua and iron. INTERNATIONAL JOURNAL OF ONCOLOGY 56: 123-138, 2020.
SHAPIRO, Charles L.. Cancer Survivorship. New England Journal Of Medicine, [S.L.], v. 379, n. 25, p. 2438-2450, 20 dez. 2018. Disponível em: http://dx.doi.org/10.1056/nejmra1712502. Acesso em: 23 jan. 2023.
SON, Y. J. et al. Novel therapeutic roles of MC-4 in combination with everolimus against advanced renal cell carcinoma by dual targeting of Akt/ pyruvate kinase muscle isozyme M2 and mechanistic target of rapamycin complex 1 pathways. August 2018.
STAN, L. R. et al. ARTEMISIA ANNUA L. EXTRACT: A NEW PHYTOPRODUCT WITH SOD-LIKE AND ANTITUMOUR ACTIVITY. DOI: https://doi.org/10.31925/farmacia.2020.5.6
WANG, Z. et al. Artesunate Suppresses the Growth of Prostatic Cancer Cells through Inhibiting Androgen Receptor. Biol. Pharm. Bull. 40, 479–485 (2017).
WEI, X; XIA, L. ZIYAYIDING, D; CHEN, Q. LIU, R. The Extracts of Artemisia absinthium L. Suppress the Growth of Hepatocellular Carcinoma Cells through Induction of Apoptosis via Endoplasmic Reticulum Stress and Mitochondrial-Dependent Pathway Molecules. 2019, 24, 913; doi:10.3390/molecules24050913.
WORLD HEALTH ORGANIZATION (WHO). INTERNATIONAL AGENCY FOR RESEARCH ON CANCER. Agents Classified by the IARC Monographs, Volumes 1–132. 2022. Disponível em: https://monographs.iarc.who.int/agents-classified-by-the-iarc/. Acesso em: 26 jan. 2023.
WU, B. HU, K. ZHU, J. Dihydroartiminisin inhibits the growth and metastasis of epithelial ovarian cancer. ONCOLOGY REPORTS 27: 101-108, 2012.
YU, C; SUN, P; ZHOU, Y. Inhibition of AKT enhances the anti-cancer effects of Artemisinin in claro cell renal carcinoma. 2019. DOI: https://doi.org/10.1016/J.biopha.2019.109383.
ZHANG, Hong Wei; LIN, Zhi Xiu; CHEUNG, Fan; CHO, William Chi-Shing; TANG, Jin-Ling. Moxibustion for alleviating side effects of chemotherapy or radiotherapy in people with cancer. Cochrane Database Of Systematic Reviews, [S.L.], v. 2018, n. 11, p. 1-91, 13 nov. 2018. Disponível em: http://dx.doi.org/10.1002/14651858.cd010559.pub2. Acesso em: 20 jan. 2023.
ZHONG, W. et al. Eupatilin Inhibits Renal Cancer Growth by Downregulating MicroRNA-21 through the Activation of YAP1. Volume 2019, Article ID 5016483.
[1] Discente do Curso Superior de Medicina Da Unicesumar Campus Maringá. E-mail: andressa_koshikumo@hotmail.com
[2] Discente do Curso Superior de Medicina da Unicesumar Campus Maringá. E-mail: ma_ceci@live.com
[3] Docente do Curso Superior de Medicina da Unicesumar Campus Maringá. Doutora em Inflamação (UEM) . E-mail: doamaralvaleria@gmail.com
