INTEGRATIVE REVIEW OF CONGENITAL MALARIA IN AMAZON
REGISTRO DOI: 10.5281/zenodo.8035298
Frances T T Trindade1
Pedro G L F Marinho2
Orientadora: Profª Drª Alcione Oliveira dos Santos3
RESUMO
A malária é uma doença infecciosa causada pelo protozoário Plasmodium, sendo endêmica na região da Amazônia Legal. Assim sendo, há uma parcela da população que ainda é negligenciada nessas localidades que são as gestantes, visto que é um grupo, o qual está possui um agravante ao contrair esta enfermidade por conta da variação na imunidade e pôr a placenta ser propícia para a proliferação do Plasmodium. Diante disso, aumentam as chances de ocorrer a malária congênita.
Palavras chave: Malária; Congênita; Amazônia Legal; Plasmodium; Gestantes.
ABSTRACT
Malaria is an infectious disease caused by the protozoan Plasmodium, being endemic in the Legal Amazon region. Therefore, there is a portion of the population that is still neglected in these locations that are pregnant women, as it is a group, which is an aggravating factor in contracting this disease due to the variation in immunity and making the placenta be conducive to proliferation of Plasmodium. Therefore, the chances of congenital malaria occur.
Keywords: Malaria; Congenital; Legal Amazon; Plasmodium; Pregnant Woman
INTRODUÇÃO
A malária é considerada um grave problema de saúde, já que segundo a Organização Mundial de Saúde (OMS) só no ano de 2021 estimou-se 228 milhões de casos, ou seja quase metade da população mundial esteve em risco no ano referido (WHO, 2021a). No contexto brasileiro, esta enfermidade é endêmica na região da Amazônia Legal (AL), a qual compreende os estados do Acre, Amazonas, Amapá, Pará, Rondônia, Roraima, Tocantins e parte do Mato Grosso e do Maranhão (Brasil, 2022a) Dessa forma, por este território ter uma alta endemicidade da malária, possui a maior concentração de casos no país, apresentando uma porcentagem de 99%, enquanto que a região Extra-Amazônica engloba 1% dos casos (Brasil, 2022b).
Sendo que, no Brasil, a malária causada por P. falciparum e P. vivax são as que ocorrem em maior incidência e podem gerar um quadro clínico grave (ANSTEY et al., 2009; OLIVEIRA-FERREIRA et al., 2010). No entanto, a malária causada por P. vivax é a maior problemática, pois apresenta componentes importantes que aumentam o seu sucesso e dificulta o controle, como: (i) alta incidência no número de casos (83,7%), (ii) cepas resistentes a cloroquina, (iii) capacidade de permanecer latente nos hepatócitos na forma de hipnozoítos, o que pode levar a recaídas até anos depois da infecção e (iv) o mosquito An. darlingi é o seu principal vetor (OLIVEIRA-FERREIRA et al., 2010; SINKA, 2012; SIVEP, 2018).
DESENVOLVIMENTO
O mosquito Anopheles darlingi é uma espécie que apresenta muito sucesso na transmissão da malária o que pode ser explicado, principalmente, devido a três fatores: (i) ampla distribuição geográfica, (ii) alto grau de antropofilia e endofagia e (iii) susceptibilidade à infecção por plasmódios (DEANE, 1986; KLEIN, et al., 1991; TADEI et al., 1998). Sabe- se que esse mosquito é capaz de transmitir qualquer uma das três espécies de Plasmodium que circulam no Brasil (e.g. Plasmodium vivax, P. falciparum e P. malariae) (RACHOU 1958; CONSOLI; OLIVEIRA, 1994; TADEI et al., 1998 MORAIS et al., 2012) e que, especificamente, em Porto Velho-RO equivale a mais de 90% das espécies de anofelinos capturados, sendo considerada responsável por 95% dos casos reportados (GIL et al., 2003; GIL et al., 2007; MORAIS et al., 2012).
Com isso, é notável que o processo de transmissão da malária tem inúmeras causas envolvidas, que vão do vetor ao hospedeiro, o que dificulta seu controle. Além disso, a resistência dos Plasmodium spp. a antimaláricos e a resistência dos vetores a inseticidas, dificultam o quadro epidemiológico da doença e enfatiza a necessidade do controle integrado (WHO, 2017).
Outrossim, apesar da malária ser típica da região norte do Brasil, uma população que é atingida e apresenta graves riscos quando contrai a doença, ainda é negligenciada no Brasil. Esta seria a das gestantes, visto que não há confirmação do concreto índice malárico neste grupo de risco no país. Contudo, sabe-se que as mulheres, as quais estão em período gestacional são mais suscetíveis à malária. Isso advém da mudança da imunidade no período gestacional, podendo ser um fator de risco tanto para a mãe quanto para o feto (Chagas et al, 2009).
Dentre estes riscos pode-se citar a problemática de que a placenta é um local propício para que ocorra a reprodução do parasita, acarretando na exacerbação dos sintomas e ampliando a probabilidade de se apresentar complicações (Chagas et al, 2009). Entre estas, tem-se possíveis abortos espontâneos, prematuridade, baixo peso ao nascer e morte materna, sendo importante, verificar se o recém-nascido desenvolverá malária congênita, doença que se caracteriza por apresentar sintomas como: febre, irritabilidade, inapetência, hepatoesplenomegalia, anemia e icterícia (Neves, 2016; Ferrarini et al, 2009). O que deixa claro a gravidade da enfermidade não só para as genitoras, como também para os seus neonatos.
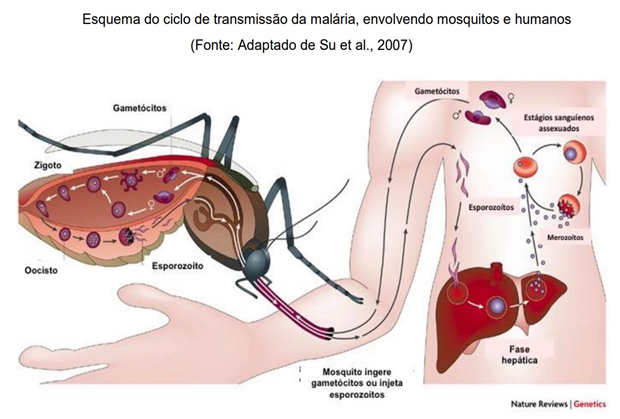
A malária grave na gravidez é mais comum em ambientes de transmissão instáveis devido à menor imunidade que as gestantes têm. Geralmente, as mulheres no segundo e terceiro trimestres de gravidez têm maior risco de desenvolver malária grave em comparação com adultos não gestantes. Em ambientes de baixa transmissão, a malária grave na gravidez é geralmente associada com edema pulmonar, hipoglicemia e anemia grave. A mortalidade em gestantes com malária grave e tratada com artesanato e quinina variou entre 9% e 12% (Who, 2021b).
A mortalidade materna associada à malária é provavelmente subnotificada. Tal doença foi uma importante causa de morte materna em alguns estudos, enquanto em outros não foi tão frequente. A redução substancial da mortalidade materna observada na Tailândia após a implementação da detecção precoce e tratamento da doença sugere que a malária é um importante contribuinte para a mortalidade materna (McGready et al, 2010)
Quando não é uma causa direta de morte (malária grave), malária na gravidez é frequentemente relatada como co-morbidade, por exemplo, com eclâmpsia, em condições associadas à mortalidade materna (Cottrell, 2010).
Entre os efeitos perinatais estão: aumento do risco de baixo peso ao nascer, particularmente na primeira gravidez, e sendo esse risco aparentemente maior para infecções no primeiro ou segundo trimestre, embora em um estudo isso tenha sido verdade também para infecções ocorridas ao final da gravidez (McGready et al, 2010; Kalilani et al, 2010; Valea et al, 2012).
Em locais com alta taxa de transmissão de malária, tal efeito se deve ao retardo do crescimento intrauterino ao invés do parto pré-termo, dado que a maioria das infecções são assintomáticas (McGready et al, 2010).
Em contrapartida, enquanto no Brasil há déficit nos dados de frequência da malária em gestantes, a OMS, no Relatório Mundial da Malária de 2021, deu enfoque ao risco de como essa enfermidade afeta grávidas e crianças. Apresentando dados, como o de que em 2020 acredita-se que 11 milhões de gestantes contraíram malária na África Subsaariana, acarretando em aproximadamente 900 mil neonatos com baixo peso. Ademais, mundialmente, mais da metade dos óbitos associados à malária correspondem à crianças (Who, 2021b).
Em suma, a consequência que a malária desempenha sobre a mãe e o feto está relacionada com a endemicidade da região de residência. Sendo que a prevalência da parasitemia sofre aumento em mulheres grávidas em relação a não grávida que estão na mesma região (Chagas et al, 2019).
A MC é identificada no recém-nascido com a presença assexuada do parasita no sangue periférico entre as primeiras 24h e entre o sétimo dia. Para se chegar ao diagnóstico da MC é necessário realizar uma boa entrevista com a gestante, a fim de levantar a suspeita da mesma ter sido infectada durante o período gestacional, exame físico cuidadoso e realização de gotas sequenciais (DEL CASTILLO CALDERÓN, J; CÁRDENAS SILVA, p. 749-753, 2020)
Os neonatos contaminados apresentam inicialmente um quadro de sepse e alguns são tratados inicialmente com antibioticoterapia, no entanto sem melhora, visto que não se considera um diagnóstico diferencial nos filhos de mulheres que residem em região endêmica para a malária. Caso presentes, e juntamente com uma boa anamnese com a mãe pode-se iniciar o tratamento adequado ao neonato (DEL CASTILLO CALDERÓN, J; CÁRDENAS SILVA, 2020).
Uma vez que a malária na gestação além de ser considerada um indicador de morbidade e mortalidade para o grupo materno-fetal, ainda é tratada de forma negligente e, isso torna a atuação preventiva nos serviços de assistência pré-natal em lugares endêmicos fragilizados. Sendo de suma importância a participação do ministério da saúde (MS) dentro do Programa Nacional de Controle da Malária (PNCM) para que seja possível obter um diagnóstico preciso e o tratamento eficaz da doença no período do pré-natal para que a grávida e o feto não tenham consequências relacionadas à malária (DOS SANTOS, R; ARAÚJO, O.,2011).
Desse modo, mulheres grávidas estão no grupo de risco para a infecção de malária, principalmente na região amazônica. Todavia, ainda há poucos estudos sobre a fisiopatologia da malária materna e o consequente tipo de tratamento específico. Por isso, após traçar um perfil epidemiológico da malária na região amazônica, é necessário estudos sobre o impacto gerado no feto, a fim de criar formas de prevenção para as gestantes residentes de locais endêmicos.
CONCLUSÃO
Concluiu-se que mulheres grávidas residentes em regiões endêmicas de malária possuem maior probabilidade de ser infectadas pelo protozoário quando comparadas às mulheres não grávidas. Portanto, nota-se a necessidade de analisar a relevância da malária congênita sob o índice de mortalidade infantil com a finalidade de demonstrar a seriedade desta enfermidade e planejar políticas públicas que visam a prevenção e promoção de saúde para as gestantes e crianças diagnosticadas com a doença.
REFERÊNCIAS
BRASIL, Ministério da Saúde, Secretaria de Vigilância em Saúde. Boletim Epidemiológico. v 50. Nov. 2019. Vigilância Epidemiológica da Malária no Brasil, 2020 a 2022. Disponível em: https://www.saude.gov.br/images/pdf/2021/novembro/20/Boletim-epidemiologico-SVS-35.pdf. Acessado em março de 2022.
BRASIL, Ministério da saúde. Malária: o que é, causas, sintomas, tratamento, diagnóstico e prevenção. Disponível em: https://saude.gov.br/saude-de-a-z/malaria#epidemiologia. Acessado em abril de 2022.
CHAGAS ECS, NASCIMENTO CT, SANTANA FILHO FS, BÔTTO-MENEZES CH, MARTINEZ-ESPINOSA FE. Malária durante a gravidez: efeito sobre o curso da gestação na região amazônica. Rev Panam Salud Publica. 2019;26(3):203–08.
DEL CASTILLO CALDERÓN, José Gabriel; CÁRDENAS SILVA, Angie Milena. Malaria congénita por Plasmodium falciparum. Revista chilena de pediatría, v. 91, n. 5, p. 749-753, 2020;
DOS SANTOS, Rafael Cleison Silva; ARAÚJO, Olinda Consuelo Lima. Malária na gestação. Estação Científica (UNIFAP), v. 1, n. 2, p. 45-53, 2011;
FERRARINI, M. & LAZZETTI, A. & FERREIRA, S. & Di Santi, Silvia & LT, Wigman & MBV, Silveira. (2019). Malária congênita: descrição de um caso e revisão da literatura. Pediatria Moderna. XLV. 140-145.
NEVES, David P. Parasitologia Humana. 13. ed. São Paulo. Editora Atheneu, 2016. cap. 17 Plasmodium – Malária, pag. 177.
World Health Organization. World Malaria Report 2021. Genebra: WHO; 2021. Disponível em: https://www.who.int/news-room/feature-stories/detail/world-malaria-report-2019. Acessado em março de 2022
World Health Organization. World Malaria Report 2021. Genebra: WHO; 2021. Disponível em: https://www.who.int/news-room/q-a-detail/world-malaria-report-2021. Acessado em março de 2022
ANSTEY, N. M.; RUSSEL, B.; YEO, T.W.; PRICE, R.N. The pathophysiology of vivax malária. Trends in Parasitology, v. 5: 220-227, 2009.
OLIVEIRA-FERREIRA, J.; LACERDA, M. V.; BRASIL, P.; LADISLAU, J. L.; TAIUL, P. L.; DANIEL-RIBEIRO, C. T. Malaria in Brazil: an overview. Malaria Journal, 9: e115, 2010. doi: 10.1186/1475-2875-9-115
SINKA, M. E.; BANGS, M. J.; MANGUIN, S.; RUBIO-PALIS, Y.; CHAREONVIRIYAPHAP, T.; COETZEE, M.; MBOGO, C. M.; HEMINGWAY, J.; PATIL, A. P.; TEMPERLEY, W. H.; GETHING, P. W.; KABARIA, C. W.; BURKOT, T. R.; HARBACH, R. E.; HAY, S. I. A global map of dominant malaria vectors. Parasites and Vectors, v. 5: 69-75, 2012.
Sistema de Informações de Vigilância Epidemiológica da Malária – SIVEP-MALÁRIA, 2018.
DEANE, L.M. Malaria Vectors in Brazil. Memórias do Instituto Oswaldo Cruz, v.81, n.2a., p.5-14, 1986.
KLEIN, T. A.; LIMA, J. B.; TADA, M. S. Comparative susceptibility of anopheline mosquitoes to Plasmodium falciparum in Rondonia, Brazil. Am J Trop Med Hyg, v. 44: 598-603, 1991.
TADEI, W. P. ; THATCHER, B. D.; SANTOS, J. M .; SCARPASSA, V. M.; RODRIGUES , I. B.; RAFAEL, M. S. Ecologic observations on anopheline vectors of malaria in the Brazilian Amazon. The American Journal of Tropical Medicine and Hygiene, v. 59: 325-335, 1998.
RACHOU, R.G. (1958) Anofelinos do Brasil: comportamento das espécies vetoras de malária. Rev. Bras. Malariol. D.Trop., 10:145-181.
CONSOLI, R. A. G. B.; LOURENÇO-DE-OLIVEIRA, R. Principais mosquitos de importância sanitária no Brasil. Rio de Janeiro: Fiocruz, 1994.
GIL, L. H. et al. Seasonal malaria transmission and variation of anopheline density in two distinct endemic areas in Brazilian Amazonia. Journal of Medical Entomology, v. 5: 636-641, 2003.
GIL, L. H. S.; TADA, M. S.; KATSURAGAWA, T. H.; RIBOLLA, P. E. M.; PEREIRA-DA-SILVA, L. H. Urban and suburban malaria in Rondônia (Brazilian western Amazon) II: perennial transmission with high anopheline densities are associated with human environmental changes. Memórias do Instituto Oswaldo Cruz, v.102: 271-76, 2007.
WHO-World malaria report 2017. Geneva: World Health Organization; 2017.
ZUANAZZI, J.A.C.; MONTANHA, J.A. Flavonoides. In: Simões C.M.M.O. et al. (org) Farmacognosia: da planta ao medicamento. 5aed. Porto Alegre: UFRGS, p.577- 614, 2003.
VALEA I, TINTO H, DRABO MK, HUYBREGTS L, SORGHO H, OUEDRAOGO JB, GUIGUEMDE RT, VAN GEERTRUYDEN JP, KOLSTEREN P, D’ALESSANDRO U. An analysis of timing and frequency of malaria infection during pregnancy in relation to the risk of low birth weight, anaemia and perinatal mortality in Burkina Faso. Malar J. 2012;11:71. doi: 10.1186/1475-2875-11-71.
KALILANI L, MOFOLO I, CHAPONDA M, ROGERSON SJ, MESHNICK SR. The effect of timing and frequency of Plasmodium falciparum infection during pregnancy on the risk of low birth weight and maternal anemia. Trans R Soc Trop Med Hyg. 2010;104(6):416–22. doi: 10.1016/j.trstmh.2010.01.013.
MCGREADY R, BOEL M, RIJKEN MJ, ASHLEY EA, CHO T, MOO O, PAW MK, PIMANPANARAK M, HKIRIJAREON L, CARRARA VI, LWIN KM, PHYO AP, TURNER C, CHU CS, VAN VUGT M, PRICE RN, LUXEMBURGER C, TER KUILE FO, TAN SO, PROUX S, SINGHASIVANON P, WHITE NJ, NOSTEN FH. Effect of early detection and treatment on malaria related maternal mortality on the north-western border of Thailand 1986–2010. PLoS ONE. 2012;7(7):e40244. doi: 10.1371/journal.pone.0040244.
MCGREADY R, BOEL M, RIJKEN MJ, ASHLEY EA, CHO T, MOO O, PAW MK, PIMANPANARAK M, HKIRIJAREON L, CARRARA VI, LWIN KM, PHYO AP, TURNER C, CHU CS, VAN VUGT M, PRICE RN, LUXEMBURGER C, TER KUILE FO, TAN SO, PROUX S, SINGHASIVANON P, WHITE NJ, NOSTEN FH. Effect of early detection and treatment on malaria related maternal mortality on the north-western border of Thailand 1986–2010. PLoS ONE. 2012;7(7):e40244. doi: 10.1371/journal.pone.0040244.
COTTRELL G, MARY JY, BARRO D, COT M. The importance of the period of malarial infection during pregnancy on birth weight in tropical Africa. Am J Trop Med Hyg. 2007;76(5):849–54.
SU, X.; HAYTON, K.; WELLEMS, T. Genetic linkage and association analyses for trait mapping in Plasmodium falciparum. Nature Reviews Genetics, v. 8: 497-506, 2007.
BRASIL, Ministério da Saúde, Secretaria de Vigilância em Saúde. Boletim Epidemiológico. v especial. Nov. 2020. Malária 2020. Disponível em: <https://www.gov.br/saude/pt-br/media/pdf/2020/dezembro/03/boletim_especial_malaria_1dez20_final.pdf> Acessado em março 2021;
BRASIL, Ministério da saúde. Malária: o que é, causas, sintomas, tratamento, diagnóstico e prevenção. Disponível em: <https://saude.gov.br/saude-de-a-z/malaria#epidemiologia> Acessado em junho de 2020;
BRASIL, Ministério da Saúde, Secretaria de Vigilância em Saúde. Boletim Epidemiológico. v 50. Nov. 2019. Vigilância Epidemiológica da Malária no Brasil, 2017 a 2019. Disponível em: <https://www.saude.gov.br/images/pdf/2019/novembro/20/Boletim-epidemiologico-SVS-35.pdf>. Acessado em junho de 2020;
CHAGAS, Eda Cristina da Silva et al. Malária durante a gravidez: efeito sobre o curso da gestação na região amazônica. Revista Panamericana de Salud Pública, v. 26, p. 203-208, 2009.
CINTRA, Anaclara Pincelli. Malária na gestação na Amazônia Ocidental Brasileira: fatores associados e implicações para a saúde materno-fetal. 2018. Tese de Doutorado. Universidade de São Paulo;
DEL CASTILLO CALDERÓN, José Gabriel; CÁRDENAS SILVA, Angie Milena. Malaria congénita por Plasmodium falciparum. Revista chilena de pediatría, v. 91, n. 5, p. 749-753, 2020;
DOS SANTOS, Rafael Cleison Silva; ARAÚJO, Olinda Consuelo Lima. Malária na gestação. Estação Científica (UNIFAP), v. 1, n. 2, p. 45-53, 2011;
FERRARINI, Maria Aparecida Gadiani et al. Malária congênita: descrição de um caso e revisão da literatura. Jornal de Pediatria, v. 45, n. 04, 2009.
NEVES, David P. Parasitologia Humana. 13. ed. São Paulo. Editora Atheneu, 2016. cap. 17 Plasmodium – Malária, pag. 177;
RODRÍGUEZ, José Alejandro Iza; RODRÍGUEZ, Shirley Natali Iza; OLIVERA, Mario Javier. Plasmodium vivax malaria across South America: management guidelines and their quality assessment. Revista da Sociedade Brasileira de Medicina Tropical, v. 53, 2020;
World Health Organization. World Malaria Report 2019. Genebra: WHO; 2019. Disponível em: <https://www.who.int/news-room/q-a-detail/world-malaria-report-2019> Acessado em junho de 2022
