REGISTRO DOI: 10.5281/zenodo.7994755
Gustavo Pires Feitosa
Bruhno Narciso de Castro Oliveira
Maria Eduarda Pereira Rodrigues Leal
Paulo Sérgio Sousa
Thiago Lopes
Jefferson Rocha
Leiz Maria Costa Véras
RESUMO
INTRODUÇÃO: É evidente que toda a população mundial vem sofrendo com a pandemia da COVID-19 desde a primeira infecção de um novo coronavírus. Importante ainda destacar os danos inimagináveis às sociedades e economias em todo o mundo devido ao seu aumento da transmissibilidade. METODOLOGIA: O trabalho será feito um teste a partir das proteínas dos vírus e seus respectivos ligantes, serão preparados para simulações de encaixe com o programa AutoDock Tools, após o teste visualizarmos o resultado de qual variante tem mais afinidade com as células pneumócitos humanas. RESULTADOS E DISCUSSÃO: Embora tenha sido observado uma mutação viral que confere particularidades a cada variante, eles possuem certa similaridade, como por exemplo a fusão das membranas virais e celulares por meio de uma proteína conhecida como transmembranar serina protease-2, ou TMPRSS-2. Além disso, essa junção só é possível também graças ao domínio metalopeptidase, ou ADAM17, que junto a TMPRSS-2 são capazes de iniciar a proteína S do vírus SARS-CoV-2. Foi observado que a variante Ômicron apresentou o maior número de mutações, revelando que a variante Ômicron formou um novo grupo distinto, não originado de outras variantes. Além disso, o autor relata uma relação próxima entre as variantes Ômicron e Alpha, sugerindo que esse vírus pode ter circulado por um período prolongado antes de ser identificado. CONCLUSÃO: A variante Ômicron, em decorrência de suas mutações, possui maior transmissibilidade, todavia também é aquela que apresenta menor gravidade em comparação às outras.
Palavras-chave/Descritores: SARS-CoV-2; COVID-19; OMICRON; ALPHA, DOCKING MOLECULAR
ABSTRACT
INTRODUCTION: It is evident that the entire world population has been suffering from the COVID-19 pandemic since the first infection of a new coronavirus. It is also important to highlight the unimaginable damage to societies and economies around the world due to its increased transmissibility. METHODOLOGY: The work will be done with a test from the proteins of the viruses and their respective ligands, they will be prepared for fitting simulations with the AutoDock Tools program, after the test we will visualize the result of which variant has more affinity with the human pneumocytes cells. RESULTS AND DISCUSSION: Although a viral mutation was observed that confers particularities to each variant, they have certain similarities, such as the fusion of viral and cellular membranes through a protein known as transmembrane serine protease-2, or TMPRSS-2 . Furthermore, this junction is also only possible thanks to the metallopeptidase domain, or ADAM17, which together with TMPRSS-2 are capable of initiating the S protein of the SARS-CoV-2 virus. It was observed that the Ômicron variant had the highest number of mutations, revealing that the Ômicron variant formed a new distinct group, not originating from other variants. Furthermore, the author reports a close relationship between the Omicron and Alpha variants, suggesting that this virus may have circulated for an extended period before being identified. CONCLUSION: The Omicron variant, as a result of its mutations, has greater transmissibility, however it is also the one that presents less severity compared to the others.
Keywords/Descriptors: SARS-CoV-2; COVID-19; OMICRON; ALPHA, MOLECULAR DOCKING
INTRODUÇÃO
O primeiro caso de coronavírus foi identificado na cidade de Wuhan, interior da China, em dezembro de 2019, ficando assim conhecido como COVID-19. Trata-se de uma infecção aguda, os sintomas assemelham-se aos de viroses respiratórias onde estes geralmente são: febre, tosse seca, cansaço, dispneia, sangramento pulmonar em casos mais graves, linfopenia grave e insuficiência renal (CRUZ, et al., 2020).
Não há dúvida de que toda a população mundial vem sofrendo de pandemia de coronavírus (COVID-19) desde a primeira infecção de um novo coronavírus, recentemente conhecido como coronavírus 2 da síndrome respiratória aguda grave (SARS-CoV-2). Importante ainda, têm causado danos inimagináveis às sociedades e economias em todo o mundo devido ao seu aumento da transmissibilidade e alta taxa de mortalidade (Yang, R. 2021). Em geral, os poluentes atmosféricos com micropartículas (PM10, PM2,5 e outros poluentes na atmosfera) podem penetrar profundamente na região alveolar do pulmão humano e levar a doenças respiratórias graves. No entanto, a quantidade dessa deposição de partículas é baseada nos tamanhos pulmonares (idade humana), atividades físicas diárias (causando diferentes taxas de fluxo de ar) e tamanhos de micropartículas (Islã, M.S.2021). Para o SARS-CoV-2, é classificado como uma nanopartícula a 120 nm e pode ser de até 1000 nm (Liu, Y.2020). Vários pesquisadores provaram que as nanopartículas tóxicas levam a um maior impacto negativo no sistema respiratório em comparação com as micropartículas tóxicas (Ghosh, A.2020).
As variantes de preocupação (ou VOCs, do inglês variants of concern) são aquelas que possuem evidências que as alterações no seu genoma estão associadas a um aumento da transmissibilidade, da virulência, da apresentação clínica ou da evasão imune. Das milhões de variantes que surgiram até o momento, 5 variantes foram classificadas pela OMS como variantes de preocupação: variante alfa (ou B.1.1.7, primeiramente descrita na Inglaterra), variante beta (ou B.1.351, primeiramente descrita na África do Sul), variante gama (ou P.1, primeiramente descrita no Brasil), variante delta (ou B.1.617.2, primeiramente descrita na Índia) e variante ômicron (ou B.1.1.529, descrita primeiramente na África do Sul e que rapidamente se espalhou por diversos países em novembro de 2021) (WHO, 2022). Em comum, as VOCs possuem suas principais mutações na região RBD da proteína spike que, devido a grande interação com células hospedeiras, tem sido considerado um hotspot para mutações (CASCELLA et al., 2021).
A variante delta (B.1.617.2), primeiramente documentada na Índia em outubro de 2020, foi classificada inicialmente como uma VOI pela OMS. Em maio de 2021 foi reclassificada como VOC, uma vez que rapidamente se espalhou por diversos países, tornando-se a variante mais dominante ao redor do mundo. Sua taxa de transmissão mostrou ser 60% maior quando comparado com as demais variantes (LI; LOU; FAN, 2021; WHO, 2022). Essa variante possui cerca de 15 mutações descritas, sendo 2 mutações características localizadas na porção RBD da proteína Spike – as mutações L452R e T478K (KANNAN et al., 2021). A mutação no resíduo L452 contribui para a estabilização da interação entre a proteína spike e a ACE-2, muito embora esse resíduo não interaja diretamente com o receptor (CHOI; SMITH, 2021), enquanto a mutação no resíduo T478 leva à um aumento na transmissão, na gravidade e no escape de anticorpos neutralizantes, contribuindo para a maior infecciosidade dessa variante (DHAWAN et al., 2022). Diferente das variantes alfa, beta e gama, a variante delta não compartilha mutações com as VOCs anteriormente em circulação.
Desde então, a variante Delta tem se espalhado drasticamente por muitos países não vacinados com um tremendo número de casos, aumentando as hospitalizações e as taxas de mortalidade. No entanto, Del Rio et al. 2021, também apresentaram que o surgimento da variante Delta no Reino Unido e nos EUA criou uma onda maciça de novas infecções, apesar de sua alta taxa de vacinação notavelmente, as áreas mais afetadas estão altamente localizadas em comunidades de segunda dose não vacinadas ou atrasadas.
De um modo geral, alguns fatores principais devem ser levados em conta para discutir as características da variante Delta. Primeiro, sua transmissibilidade é altamente infecciosa, o que é mais do que o dobro em comparação com as linhagens anteriores. Em segundo lugar, Sheikh et al. e Fisman, 2021. Afirmam que, em pacientes não vacinados, as infecções da variante Delta potencialmente causam doenças mais graves do que as variantes anteriores. Além disso, é altamente provável que esses pacientes sejam monitorados na unidade de terapia intensiva (UTI) do que a partir das cepas Alpha e originais. Além disso, Riemersma et al. e Nasreen et al. 2021. Analisaram os impactos da variante Delta em pessoas totalmente vacinadas, e concordam que, embora existam infecções inovadoras entre as pessoas vacinadas, as infecções tendem a reduzir mais rapidamente do que as pessoas não vacinadas.
A última VOC a ser assim classificada pela OMS é a variante ômicron. Essa VOC foi primeiramente identificada na África do Sul em novembro de 2021, mas rapidamente já estava disseminada mundialmente, sendo identificada em múltiplos países em cerca de uma semana. A rápida disseminação dessa variante deve-se possivelmente ao seu perfil mutacional bem distinto das variantes anteriores. A variante ômicron possui uma constelação de mutações, com mais de 50 alterações no seu genoma quando comparado ao genoma de referência NC_045512.2. Dessas mutações, 30 estão concentradas na proteína spike, sendo dessas mais de 15 somente na região RBD. As mutações presentes na região RBD são G339D, S371L, S373P, S375F, K417N, N440K, G446S, S477N, T478K, E484A, Q493R, G496S, Q498R, N501Y, Y505H e T547K (THAKUR; RATHO, 2022; XU et al., 2022).
Portanto, o estudo das variantes que a SARS-CoV-2 tem apresentado é de suma importância para entendermos como enfrentar essa doença, pois a cada variante se dá um novo estudo de taxa de transmissibilidade, infecção e reinfecção. Este presente estudo relata formas de comparação facilitando assim o acesso das cepas Delta e Ômicron do vírus SARS-COV2 com as células de pneumócitos humanas, por meio de simulações através de modelos computacionais, vendo interações entre proteína spike das cepas Delta e Ômicron e receptores ECA2. O vírus usa os receptores da enzima conversora da angiotensina (ECA), mais especificamente da ECA2, para penetrar nas células; portanto, o uso de fármacos inibidores de ECA e bloqueadores de receptores de angiotensina pode causar um aumento nestes receptores, assim facilitando a entrada do vírus na célula (Ferrari.2020).
METODOLOGIA
Ensaios de ancoragem molecular cegos foram realizados envolvendo Spike de proteína de Covid-19 (PDB ID: 6VXX, 6VYB, 7QO7 e 7W92) com a enzima conversora de angiotensina (PDB ID: 1R42). Todos os experimentos de ancoragem molecular foram realizados usando o servidor ClusPro 2.0 (https://cluspro.org), que é o servidor de melhor desempenho atualmente disponível para o desafio CAPRI. Também é utilizado para o estudo dos complexos inibidor-enzima, peptídeo-proteína e inibidor-proteína, além de permitir a análise e escolha do esquema de pontuação mais adequado para o complexo neste estudo.
A escolha dos modelos foi padronizada e seguiu os critérios de utilização do mesmo esquema de pontuação (Equilibrado) e equilíbrio entre o número de membros e menor energia de ligação. O esquema de pontuação balanceada apresenta os melhores coeficientes de peso para a energia utilizada nas estruturas. Os melhores complexos gerados por estudos de ancoragem molecular foram analisados em termos de energia de interface. Os primeiros 10 modelos do parâmetro de energia balanceada foram usados para a análise de resíduos e energia de interface.
RESULTADOS
Tabela 1. Ancoragem de interação molecular entre 6VXX, 6VYB, 7QO7 e 7W92 com 1R42. O ensaio de ancoragem molecular foi realizado usando o servidor ClusPro 2.0.
Complexo Energia de ligação mais baixaª 6VXX-1R42 -950.9 6VYB-1R42 -1053.4 7QO7-1R42 -1095.2 7W92-1R42 -1187.4
aCalculado pelo ClusPro server 2.0.
Figura 1. Ancoragem molecular 3D do complexo proteína-proteína com 6VXX (Cadeia A: vermelho; Cadeia B: centáurea azul e Cadeia C: verde floresta) e 1R42 (Vermelho, à esquerda) ilustrando o local de ligação.
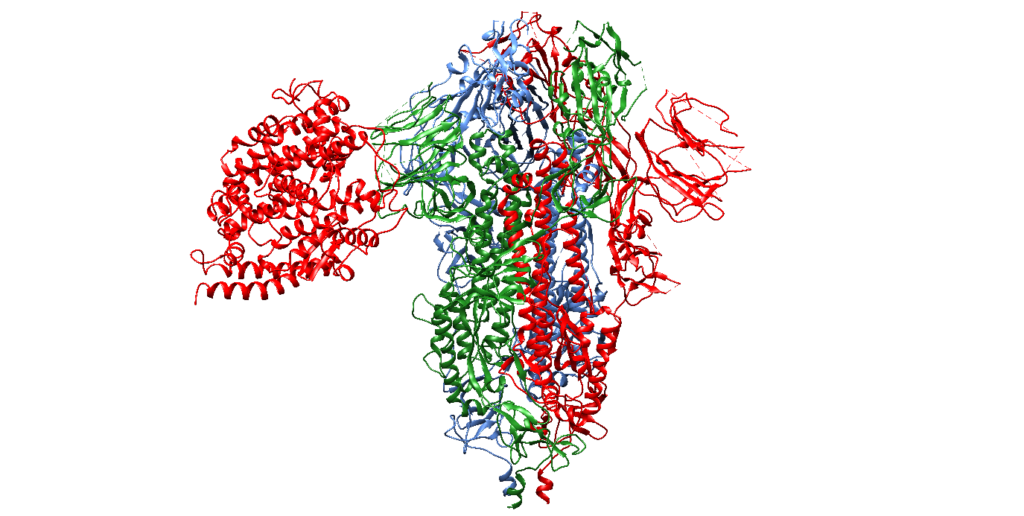
Figura 2. Ancoragem molecular 3D do complexo proteína-proteína com 6VYB (Cadeia A: amarelo; Cadeia B: roxo médio e Cadeia C: verde claro) e 1R42 (Amarelo, à esquerda) ilustrando o local de ligação.
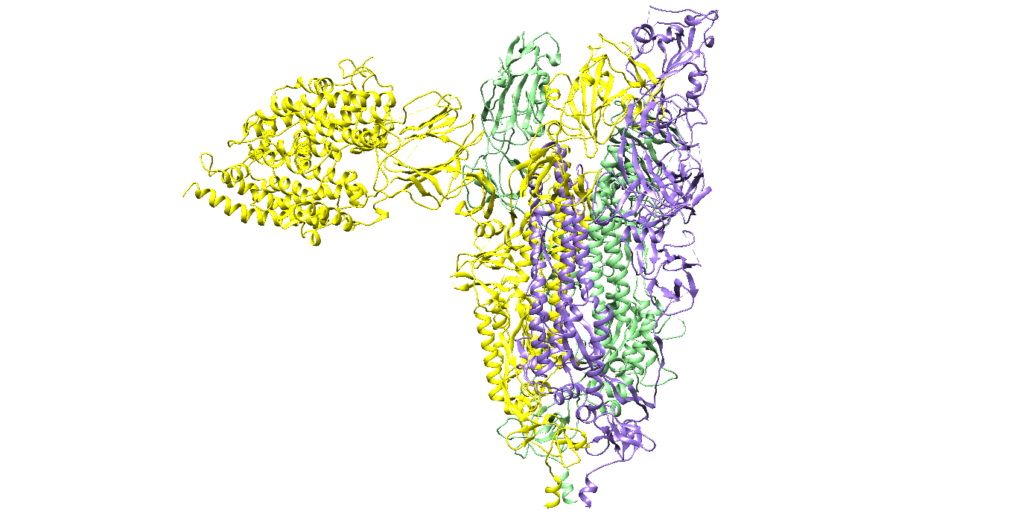
Figura 3. Ancoragem molecular 3D do complexo proteína-proteína com 7QO7 (Cadeia A: tijolo refratário, Cadeia B: rosa; Cadeia C: marrom arenoso) e 1R42 (tijolo refratário) ilustrando o local de ligação.
DISCUSSÃO
Nesse primeiro momento, é importante salientar que durante a pandemia da COVID-19, haviam diversas incógnitas sobre a fisiopatologia desse vírus e sua real repercussão no organismo humano, sendo necessário uma melhor avaliação desse patógeno. Nesse sentido, a partir disso, embora tenha sido observado uma mutação viral que confere particularidades a cada variante, eles possuem certa similaridade, como por exemplo a fusão das membranas virais e celulares por meio de uma proteína conhecida como transmembranar serina protease-2, ou TMPRSS-2. Além disso, essa junção só é possível também graças ao domínio metalopeptidase, ou ADAM17, que junto a TMPRSS-2 são capazes de iniciar a proteína S do vírus SARS-CoV-2. (Stephany Beyerstedt et al., 2021)
Além disso, Stephany Beyerstedt et al. (2021) ainda retrata em seu estudo que a capacidade de acometimento em diversos sistêmicos pode ter uma relação direta com a presença da enzima conversora de angiotensina 2, ou ACE2, em grande parte dos órgãos e tecidos do corpo humano. Dessa forma, por exemplo, uma das justificativas de comprometimento pulmonar pela infecção da COVID-19 são as lesões pulmonares agudas, que ocorrem em decorrência do acometimento de células alveolares tipo II, que possuem expressão do receptor ACE2.
Em paralelo a isso, Vasileios Papanikolaou et al. (2022) ratifica a proposta de Stephany Beyerstedt et al. (2021), descrevendo o código genético desse vírus com 29903 nucleotídeos que codificam proteínas estruturais e não estruturais necessárias para que a replicação viral e interação com as células hospedeiras aconteçam, sendo que dentro desse genoma existe uma proteína específica conhecida como SPIKE (S), que é essencial ligação do vírus às células dos pacientes através do receptor ACE2. Além disso, o SARS-CoV-2 apresenta taxas de mutação elevada devido à ausência de mecanismos de correção de erros em suas enzimas, o que afeta diretamente a sua transmissibilidade, infectividade e gravidade, assim como a resposta imunológica e a eficácia de vacinas e tratamentos.
Ademais, embora Mahmoud Kandeel et al. (2022) e Huiping Shuai et al. (2022) aborda sobre as variantes do SARS-CoV-2, especialmente a Omicron, é Stefano Pascarella et al. (2021) quem correlaciona a infecção dessa mutação do vírus com o receptor ACE2, contribuindo com os autores citados anteriormente. Dessa forma, Stefano Pascarella et al. (2021) realça a relação entre a elevada quantidade de mutações na proteína Spike a ligação com o receptor da enzima conversora de angiotensina 2, utilizando para isso uma modelagem computacional, que permitiu observar que as mutações possibilitam um potencial eletrostático positivo incomumente alto à região do domínio de ligação ao receptor de pico (S-RBD), que interage com o ACE2.
Outrossim, essa mutação pode predispor um movimento direcionado da carga viral para os receptores ACE2, contudo o autor deixa bem explícito que, na prática, o efeito real da variante Omicron no organismo é complexo e pode ser influenciado por outras mutações e interações com esse mesmo receptor, já que, de acordo com Stephany Beyerstedt et al. (2021), é possível observar o desenvolvimento de receptores ACE2 em células epiteliais respiratórias, em células miocárdicas, em células endoteliais, em células epiteliais do trato gastrointestinal, na mucosa oral, no fígado, nos testículos, nas células renais, nas células epiteliais do útero, no ovário e na mama, entre outros.
Por outro lado, Mahmoud Kandeel et al. (2022) descreve a análise filogenética da variante Omicron do SARS-CoV-2 com outras variantes, utilizando o primeiro genoma sequenciado da variante Omicron como referência. Nesse sentido, ele optou pela coleta da amostra em Botswana em novembro de 2021, e foram comparadas as mutações nucleotídicas presentes no genoma da variante Omicron em relação às outras variantes, como Alpha, Beta, Gamma, Delta, Mu e GH49R, além do isolado SARS-CoV-2 dos EUA. Dessa forma, a partir disso, foi observado que a variante Omicron apresentou o maior número de mutações, revelando que a variante Omicron formou um novo grupo distinto, não originado de outras variantes. Além disso, o autor relata uma relação próxima entre as variantes Omicron e Alpha, sugerindo que esse vírus pode ter circulado por um período prolongado antes de ser identificado.
Outrossim, Huiping Shuai et al. (2022) também relata que essa variante tem a capacidade de escapar dos anticorpos neutralizantes, o que pode predispor uma infecção mesmo em indivíduos vacinados, embora também tenha sido observado uma menor gravidade em comparação com variantes anteriores. Em contrapartida, Xuemei He et al. (2021) analisa as infecções de COVID-19 na África do Sul de acordo com cada tipo de vírus, ressaltando que que a variante Beta representou cerca de 50% das infecções diárias por um período de 100 dias, enquanto a Delta atingiu cerca de 80% nesse mesmo período. No entanto, a variante Omicron rapidamente se tornou dominante, atingindo aproximadamente 90% das infecções em apenas 25 dias.
CONCLUSÃO
Foi observado uma relação direta entre a infecção do vírus SARS-CoV-2 e os receptores ACE2, o que pode justificar a gravidade desta patologia, uma vez que é possível realçar o desenvolvimento dos receptores enzima conversora de angiotensina 2 por todo o corpo humano, como por exemplo em células alveolares tipo II, desencadeando lesões na região pulmonar e, por consequência, dando origem as manifestações clínicas características da COVID-19.
Além disso, é importante salientar que, dentre as variantes desse vírus, a Omicron, em decorrência de suas mutações, possui maior transmissibilidade, todavia também é aquela que apresenta menor gravidade em comparação às outras. Dessa forma, isso ocorre devido a capacidade dessa variação de escapar dos anticorpos neutralizantes, podendo acometer até mesmo indivíduos vacinados.
Portanto, o SARS-CoV-2 apresenta uma forte ameaça a humanidade, já que esse vírus possui uma alta capacidade de sofrer mutações devido à ausência de mecanismos de correção de erros em suas enzimas. Dessa forma, tanto a sua transmissibilidade, quanto a sua infectividade e gravidade em um hospedeiro humano são imprevisíveis, dificultando a resposta imunológica do organismo e também a eficácia de vacinas e tratamentos, que com o passar do tempo se tornam ineficazes, necessitando de alternativas viáveis para o tratamento dessa comorbidade.
REFERÊNCIAS
Beyerstedt S, Casaro EB, Rangel ÉB. COVID-19: angiotensin-converting enzyme 2 (ACE2) expression and tissue susceptibility to SARS-CoV-2 infection. Eur J Clin Microbiol Infect Dis. 2021 May;40(5):905-919. doi: 10.1007/s10096-020-04138-6. Epub 2021 Jan 3. PMID: 33389262; PMCID: PMC7778857.
Caprari S, Metzler S, Lengauer T, Kalininia OV. Sequence and structure analysis of distantly related viruses reveals extensive gene transfer between viruses and hosts and among viruses. Viruses. 2015;
CASTRIGNANO, Silvana Beres. O que são virus? um novo conceito. Boletim do Instituto Adolfo Lutz, p. 1-3, 2016
Del Rio, C.; Malani, P.N.; Omer, S.B. Confrontando a variante Delta do SARS-CoV-2, verão de 2021. JAMA 2021, 326, 1001–1002.
Duan, S.; Fernandes, M.; Zhang, W.; Oliveira, J.; Qi, R.; Qin, X.; Oliveira, H.; Zhou, C.; Hu, P.; Yu, X.-J. Soroprevalência e estado de portador assintomático do SARS-CoV-2 na cidade de Wuhan e em outros lugares da China. PLoS Negl. 2021, 15, e0008975.
Duong BV, Larpruenrudee P, Fang T, Hossain SI, Saha SC, Gu Y, Islam MS. A variante Omicron do SARS CoV-2 é mais mortal e mais transmissível do que a variante Delta? Revista Internacional de Pesquisa Ambiental e Saúde Pública. 2022; 19(8):4586.
FERRARI, Filipe. COVID-19: dados atualizados e sua relação com o sistema cardiovascular. Arquivos Brasileiros de Cardiologia, v. 114, p. 823-826, 2020.
Fisman, D.N.; Tuite, A.R. Aumento progressivo da virulência de novas variantes do SARS-CoV-2 em Ontário, Canadá. medRxiv 2021.
Frampton, M.W. Efeitos sistêmicos e cardiovasculares da lesão e inflamação das vias aéreas: exposição a partículas ultrafinas em humanos. Environ. Perspecto de Saúde. 2001, 109, 529.
Ghosh, A.; Islã, M.S.; Saha, S.C. Entrega de Fármacos Direcionados de Nanopartículas Magnéticas na Região Pulmonar Específica. Computação 2020, 8, 10.
Gu, P.; Qi, S.; Yue, Y.; Oliveira, J.; Zhang, B.; Sol, W.; Oliveira, W.; Islã, M.S.; Saha, S.; Wu, J. Alterações estruturais e funcionais da árvore traqueobrônquica após lobectomia pulmonar superior esquerda para câncer de pulmão. Biomed. Eng. Online 2019, 18, 1–18.
Hasnain, M.; Paxá, M.F.; Ghani, I. Medidas combinadas para controlar a pandemia de COVID-19 em Wuhan, Hubei, China: Uma revisão narrativa. J. Biosaf. Biossegurança. 2020, 2, 51–57.
HE, Xuemei et al. Variante SARS-CoV-2 Omicron: características e prevenção. MedComm , 2021.
Hendryx, M.; Islã, M.S.; Dong, G.-H.; Paul, G. Emissões de poluição do ar 2008-2018 da mineração de carvão australiana: implicações para a saúde pública e ocupacional. Int. J. Environ. Res. Saúde Pública 2020, 17, 1570.
Hsião, I.-L.; Huang, Y.-J. Efeitos do soro sobre a citotoxicidade de partículas de ZnO de tamanho nano e micro. J. Nanopart. 2013, 15, 1–16.
Islã, M.; Larpruenrudee, P.; Hossain, S.; Rahimi-Gorji, M.; Gu, Y.; Saha, S.; Paul, G. Transporte e Deposição de Aerossóis Polidispersos nas Vias Aéreas Superiores do Pulmão Específico da Idade. Int. J. Environ. Res. Saúde Pública 2021, 18, 6239.
Islã, M.S.; Gu, Y.; Farkas, A.; Paulo, G.; Saha, S.C. Modelo de mistura de hélio-oxigênio para transporte de partículas em vias aéreas superiores baseadas em TC. Int. J. Environ. Res. Saúde Pública 2020, 17, 3574.
Islã, M.S.; Larpruenrudee, P.; Paulo, A.R.; Paulo, G.; Gemci, T.; Gu, Y.; Saha, S.C. SARS CoV-2 aerossol: Até onde ele pode viajar para as vias aéreas inferiores? Phys. Fluidos 2021, 33, 061903.
Islã, M.S.; Larpruenrudee, P.; Saha, S.C.; Pourmehran, O.; Paulo, A.R.; Gemci, T.; Collins, R.; Paulo, G.; Gu, Y. Como o aerossol coronavírus-2 da síndrome respiratória aguda grave se propaga pelas vias aéreas superiores específicas da idade. Phys. Fluidos 2021, 33, 081911.
Islã, M.S.; Saha, S.C.; Sauret, E.; Gu, Y.; Ristovski, Z. Investigação numérica do transporte e deposição de partículas de aerossóis em vias aéreas pulmonares realistas. In Anais da Conferência Internacional sobre Métodos Computacionais, Auckland, Nova Zelândia, 14 a 17 de julho de 2015.
Islã, M.S.; Saha, S.C.; Sauret, E.; Ong, H.; Oliveira, P.; Gu, Y. Abordagem de Euler-Lagrange para investigar os efeitos da forma anatômica respiratória no transporte e deposição de partículas de aerossol. Toxicol. 2019, 3, 2397847319894675.
Khurshid, A.; Khan, K. Como o choque da COVID-19 impulsionará a economia e o clima? Uma abordagem orientada por dados para modelar e prever. Sci. Polonês Res. 2021, 28, 2948–2958.
Lim, W.M.; Para, W.-M. O impacto económico de uma pandemia global na economia do turismo: o caso da COVID-19 e a economia dependente do destino e do jogo de Macau. Curr. Questões Tour. 2021, 25, 1258–1269.
Liu, Y.; Ning, Z.; Chen, Y.; Guo, M.; Liu, Y.; Gali, N.K.; Sol, L.; Duan, Y.; Cai, J.; Westerdahl, D.; et al. Análise aerodinâmica do SARS-CoV-2 em dois hospitais de Wuhan. Natureza 2020, 582, 557–560.
MICHELON,Cleonice.Edição Especial Covid. Principais variantes do SARS-CoV-2 notificadas no Brasil. RBAC, v. 53, n. 2, p. 109-116, 2021.
Nasreen, S.; Chung, H.; Ele, S.; Brown, K.A.; Gubbay, J.B.; Buchan, S.A.; Fell, D.B.; Austin, P.C.; Schwartz, K.L.; Sundaram, M.E.; et al. Eficácia das vacinas COVID-19 contra variantes de preocupação em Ontário, Canadá. medRxiv 2021.
Oberdörster, G. Efeitos pulmonares de partículas ultrafinas inaladas. Int. Arco Ocupar. Environ. Saúde 2000, 74, 1–8.
Pham, T.D.; Dwyer, L.; Su, J.-J.; Ngo, T. Impactos da COVID-19 do turismo receptivo na economia australiana. Ann. Tour. 2021, 88, 103179
Riemersma, K.A.; Grogan, B.E.; Kirta-Yarbo, A.; Halfmann, P.J.; Segaloff, S.E.; Kocharian, A.; Florek, K.R.; Westergaard, R.; Bateman, A.; Jeppson, G.E.; et al. Indivíduos vacinados e não vacinados têm cargas virais semelhantes em comunidades com alta prevalência da variante Delta do SARS-CoV-2. medRxiv 2021.
Sandmann, F.G.; Davies, N.G.; Vassall, A.; Edmundos, W.J.; Jit, P.M. O potencial de saúde e valor econômico da vacinação contra o SARS-CoV-2, juntamente com o distanciamento físico no Reino Unido: uma análise de cenário futuro baseada em modelo de transmissão e avaliação econômica. Lancet infectar. 2021, 21, 962–974.
SANTOS, N. S. D. O.; ROMANOS, M. T. V.; WIGG, M. D. Virologia humana. 3. ed. Rio de Janeiro, RJ: Guanabara Koogan, 2015.
Sheikh, A.; Oliveira, J.; Oliveira, B.; Robertson, C. SARS-CoV-2 Delta VOC na Escócia: Demografia, risco de internação hospitalar e eficácia da vacina. Lancet 2021, 397, 2461–2462.
Singh, P.; Raghav, V.; Padhmashali, V.; Paulo, G.; Islã, M.S.; Saha, S.C. Previsão de Fluxo de Ar e Transporte de Partículas através da Stenosis Airways. Int. J. Environ. Res. Saúde Pública 2020, 17, 1119.
STRABELLI, Tânia Mara Varejão; UIP, David Everson. COVID-19 e o Coração. Arquivos Brasileiros de Cardiologia, v. 114, p. 598-600, 2020.
TEIXEIRA, Luiz Antonio. Vírus, ciências e homens. 2003.
Traço, D.P.; Oliveira, N.; Dash, A.K. Doenças infecciosas, capital humano e a economia dos BRICS em tempos de COVID-19. MétodosX 2021, 8, 101202.
WU, Canrong et al. Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods. Acta Pharmaceutica Sinica B, v. 10, n. 5, p. 766-788, 2020.
Yang, R.; Gui, X.; Gao, S.; Ke, H.; Xiong, Y. Evolução clínica e alterações dos achados da TC de tórax em pacientes assintomáticos e pré-sintomáticos com infecção por SARS-CoV-2 em Wuhan, China. Especialista Rev. Respir. Med. 2021, 15, 411–417.
