REGISTRO DOI: 10.5281/zenodo.7971747
Bruna Fernanda Damasceno Ramirez1
Luana Cavalcante Portes de Almeida2
Paula Martins da Silva3
Tiago Negrão de Andrade4
Guilherme Ayres Rossini5
RESUMO
A sensibilidade não celíaca ao glúten (SNCG) é uma síndrome que acomete uma boa parte da população, porém o mecanismo de ação necessita de mais investigações relacionadas com doenças crônicas, como a síndrome do intestino irritável (SII) e a doença celíaca (DC). A revisão reuniu 37 estudos, desde 2017, indexados em bases de dados cientificas das ciências da saúde. Demonstrou resultados independentes em relação à SNCG, pois há variação de métodos de estudos (duplo-cego com testes com placebos, testes laboratoriais – sangue, imunológicos com e sem exclusão de glúten e testes genéticos). Ao comparar os resultados, concluiu-se que há contradições e a fronteira deste conhecimento necessita de novas investigações para obter-se evidencias. Os pacientes devem evitar o autodiagnostico e entender a necessidade de uma intervenção nutricional para que não haja prejuízos à saúde.
Palavras-chave: sensibilidade não-celíaca, vilosidades, proteína, mucosa, glúten, trigo.
Introdução:
O que determina a qualidade da farinha é o glúten, que fornece às massas atributos como elasticidade e capacidade de absorção de água. É o principal constituinte proteico do trigo, do centeio e da cevada, onde encontramos as proteínas gliadina, hordeína e secalina, respectivamente, as quais podem provocar inflamação crônica da mucosa do intestino delgado, mais conhecido como “doença celíaca”. Tanto as prolaminas (gliadina, hordeína e secalina) quanto as gluteninas têm um alto teor de prolina e glutamina, que são resistentes à proteólise – quebra dessas proteínas – por enzimas gástricas. (COMINETTI, 2017)
A presença de glúten na alimentação humana data de 10.000 atrás, no entanto a sua proporção entre milho, arroz, centeio, cevada e trigo foi se alterando e o trigo passou a compor cerca de 50% do valor energético na alimentação nos dias atuais. Melhorias genéticas e a ampla variabilidade de espécies de trigo, hoje já são 25 mil, e representam um desafio para o metabolismo humano, “já que o trato gastrintestinal (TGI) e o sistema imune apresentam limitada capacidade de reconhecer e metabolizar algumas frações proteicas específicas presentes nestes cereais, tais como a fração 33-mer do glúten, que pode ser altamente tóxica” (COZZOLINO, 2016).
Embora a doença mais comumente associada ao glúten seja a Doença Celíaca, estima-se que a ocorrência de sensibilidade não celíaca ao glúten seja seis vezes maior. Além dessas ainda temos associadas ao glúten a dermatite herpetiforme, alergia ao trigo, ataxia, desordens neurológicas e psiquiátricas. A sensibilidade não-celíaca ao glúten (SNCG) é comumente autodiagnosticada, fazendo com que os pacientes eliminem alimentos com trigo de sua dieta. No entanto, relatórios mostram variações na prevalência da condição, com uma estimativa de ser 6 a 10 vezes maior do que a doença celíaca. (COZZOLINO, 2016; SADEGHI, 2015)
Os alelos HLA-DQ2/8 estão presentes tanto em Doença Celíaca quanto em Sensibilidade ao Glúten não Celíaca, no entanto a integridade do epitélio intestinal não é afetada da mesma maneira em ambas as doenças. Ao que tudo indica na DC ocorre resposta imune inata e adaptativa, responsável pelas lesões típicas de DC na parede intestinal, e na SNCG ocorre apenas a resposta imune inata. (COMINETTI, 2017; SILVA, 2010)
Apesar disso, a sensibilidade não-celíaca ao glúten ainda não possui um diagnóstico preciso e estudos feitos nos últimos anos tem buscado confirmar a existência da patologia além de entender e identificar possíveis marcadores. O objetivo deste trabalho é revisar a bibliográfia relacionando pacientes que apresentam sintomas de sensibilidade não-celíaca ao glúten após a exclusão de doença celíaca e síndrome do intestino irritável, para apresentar diagnóstico plausível e tratamento adequado ao paciente que sofre desta condição. Embora se trate de uma doença amplamente aceita na comunidade médica, a SNCG não possui embasamento científico para seu correto diagnóstico, sendo necessária uma investigação e revisão dos estudos disponíveis até o momento para lançar luz sobre a real existência da mesma e a necessidade de exclusão do glúten da dieta dos pacientes (NYLUND, 2020; COMINETTI, 2017; SILVA, 2010).
Materiais e Métodos:
A revisão bibliográfica foi realizada de forma sistemática nos bancos de dados DialNet, ACCESSSS, Springer, GoogleScholar, Refseek, World Wide Science e Microsoft Academic no período de setembro a novembro de 2020 utilizando as palavras chave “Non-celiac gluten intolerance”.
Foram selecionados artigos publicados nos últimos 10 anos que atendessem aos seguintes critérios: doenças associadas à SNCG (6), possíveis biomarcadores para SNCG (16), dieta sem glúten (15), prevalência de SNCG na população (1). O resultado da pesquisa inicial foi de 2440 artigos. Após leitura do título foram selecionados 1190 artigos, 37 foram escolhidos para esta revisão, conforme demonstra a figura 1:
Figura 1. Fluxograma de inclusão e exclusão de artigos
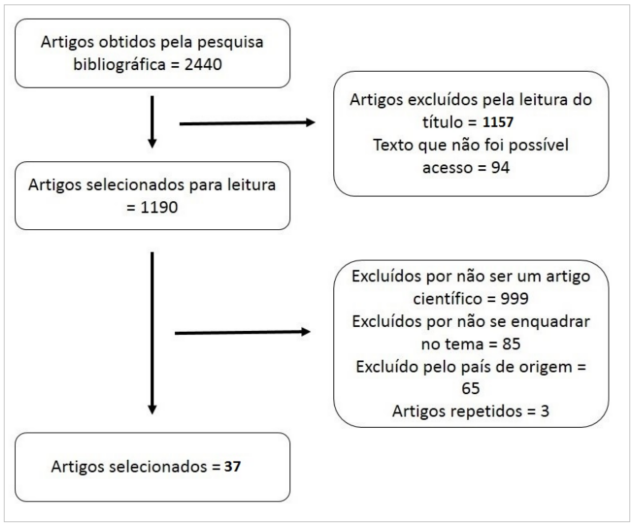
Fonte: os autores
Discussão:
No Brasil, a prevalência de pessoas que apresentam sensibilidade não celíaca ao glúten é de 1,7% (ARÁMBURO-GÁLVEZ, 2020). Quanto ao perfil de pessoas que apresentam relatos de sintomas relacionados ao glúten, não existe diferença estatisticamente significativa relacionadas ao IMC de grupos SNCG e DC (MANSUETO, 2019).
O estudo de MASAEBI (2020) observou que enquanto a doença celíaca apresenta como um de seus biomarcadores a presença de MHC classe II HLA-DQ2/ DQ8, níveis séricos de IL-8 e IL-15 e seus pontos de corte possuem um potencial de distinguir DC de SNCG.
LOSURDO (2017), relata que “em alguns estudos anteriores, que tiveram como objetivo a exploração da patogênese do glúten, hipoteticamente há desarranjo na imunidade inata”. Então, outras investigações foram iniciadas a fim de observar os resultados da resposta inflamatória relacionadas ao glúten quando provocados em pacientes com SNCG, notando que a maioria dos sintomas – como inflamação na mucosa intestinal – são mais comuns em pacientes celíacos que em pacientes sensíveis. Foram observados DQ2 e DQ8 (haplótipos marcadores de doença celíaca) apenas em 30% dos pacientes com sensibilidade ao glúten, sendo mais frequentes em mulheres adultas, apresentando sintomas de indisposição intestinal, porém apresentando menor quantidade de interleucinas em relação a pacientes celíacos. Os pacientes que apresentaram sensibilidade ao glúten tiveram o marcador CD117 (tumores gastrintestinais) encontrado em maior volume, levando à comparação de microvilosidades intestinais entre pacientes sensíveis e celíacos e portanto entenderam que “a combinação entre CD117 juntamente à caracterização de interleucinas podem ser o suporte para um diagnóstico clínico de SNGC”.
Segundo CLEMENTE (2019) as “Citocinas adaptativas que normalmente aumentam em CD (por exemplo IL6, IL21, interferon gama, IL17A) não parecem estar envolvidos no SNCG” e “A superexpressão de Toll like receptor 1 (TLR1), Toll like receptor 2 (TLR2) e a regulação negativa do marcador de células T regulatórias FoxP3 foi relatada na mucosa do intestino delgado desses pacientes. O soro de pacientes com SNCG também mostrou níveis aumentados de proteína de ligação a lipopolissacarídeo (LPS), CD14 solúvel e anticorpos contra LPS e flagelina”. Além disso, após uma triagem de miRNA e identificou-se que 6 deles são diferencialmente expressos em SNCG e DC. Assim é possível utilizar esses marcadores como diagnóstico para SNCG. Um fator interessante foi a superexpressão do miR-143/145, necessário para a renovação do epitélio intestinal, indicando um processo de renovação em curso. A presença do miR-145 também pode ser observada em “doenças autoimunes como esclerose múltipla, lúpus eritematoso e síndrome de Sjogreen primária sugerindo um possível aspecto autoimune na SNCG”.
GRIAUZDAITĖ (2020) demonstrou em um estudo com pacientes com enxaqueca uma relação entre o consumo de glúten e a diminuição da atividade da Diamina Oxidase (DAO), uma enzima que degrada histamina, sendo essa elevação de histamina uma possível causa para a enxaqueca.
A exclusão do glúten da dieta quando acompanhado de uma suplementação de probióticos demonstrou uma melhor eficácia quando comparada a dieta sem glúten sozinha indicando que o equilíbrio da microbiota intestinal é um fator importante na digestão do glúten. (DI PIERRO, 2020)
Segundo CAIO (2014), “o desaparecimento de anticorpos anti-gliadina (AAG) IgG em pacientes com SNCG pode ser visto como um sinal de estrita conformidade com os pacientes em dieta livre de glúten e uma expressão de uma boa resposta clínica nessa prática. A persistência AAG IgG em pacientes com SNCG indica que o glúten ainda está introduzido na dieta, e isso evita a melhora clínica”.
Ao avaliar uma possível disbiose como sendo a causa da SNCG, NYLUND (2020) comparou a composição da microbiota intestinal de indivíduos saudáveis, SNCG e DC, e observou que os perfis de micro-organismos foram semelhantes nos três grupos, descartando assim essa possibilidade. Embora um estudo tenha observado uma alteração na quantidade de cada tipo de microrganismo, demonstrando um aumento especialmente naqueles que metabolizam carboidratos e amido, não foi observada uma alteração em biomarcadores inflamatórios (BONDER, 2016). Um estudo realizado com 10 pacientes comparando o consumo de pão com baixo teor de gliadina e pão sem glúten apresentou mudanças positivas na microbiota intestinal em relação ao consumo de pão com baixo teor de gliadina, aumentando as bactérias produtoras de butirato favorecendo um perfil microbiano que é sugerido como sendo papel chave na manutenção ou melhoria da permeabilidade intestinal. (CARMEN HARO, 2018)
SADEGHI (2015), sugere que não há estudos suficientes para a condição de SNCG, pois a patogenia pode ser tanto com base no papel do sistema imune quanto a “leaky gut” – permeabilidade intestinal, além de não apresentarem base hereditária e doenças de longo-termo. Ao excluir glúten da dieta desses pacientes, notou-se inclusive que a prevalência de SNCG é em mulheres adultas, conclusão do próprio autor, tirada por histórico alimentar de pacientes, exames imunológicos e biópsias de intestino delgado comparando o antes e depois de linfócitos epiteliais quando submetidos à dieta livre de glúten. (SADEGHI, 2015)
No epitélio intestinal, a atrofia das vilosidades é um marcador histopatológico de doença celíaca. Em pacientes com SNCG foi observada a presença de quantidades aumentadas de mastócitos submucosos, sendo um possível marcador para diagnóstico. (GIANCOLA, 2020)
Durante o estudo de BIESIEKIERSKI (2011), foram comparados entre os grupos de controle – placebo e livres de glúten, a pontuação em relação a níveis de dor, inchaço, consistência das fezes e cansaço. O grupo que recebeu sua dieta normal, que incuía glúten, teve seu resultado maior do que o grupo que recebeu a dieta de efeito placebo. Este resultado demonstra que de fato os pacientes que apresentam doença celíaca têm resposta imunológica quando expostos ao glúten, no entanto, pacientes que não são DQ2 e DQ8 positivos, também apresentam sintomas de forma pontuada, corroborando a presença de SNCG, apesar de “no grupo placebo, a indução dos sintomas ocorreram mais vagarosamente e os níveis alcançados foram menos severos”.
Estudos paralelos a este foram feitos para entender qual o nível de inflamação e desordem intestinal poderiam ocorrer em pacientes que consomem gluten, buscando resultados que mostram que o consumo de gluten traz um efeito sistêmico, “provocando efeito de cansaço” nessa poulação. Também evidenciando a resposta imunológica, apresentando lactoferina aumentada em pacientes com inflamação intestinal, devido à “migração de neutrófilos no lúmen intestinal e a inabilidade de bactérias em degradar lactoferrina”. A proteína do glúten tambem pode ser outro fator de sintomas intestinais, devido à sua má-fermentação. “A gliadina é capaz de aumentar a permeabilidade epitelial e alterar a expressão da proteína de componentes das tight junctions, induzir apoptose e aumentar o estresse oxidativo em monocamadas Caco-2 (adenocarcinoma de cólon humano), um substituto modelo para o epitélio intestinal humano. Além disso, a gliadina pode inibir a síntese de RNA e DNA”. (BIESIEKIERSKI, 2011)
Além dos sintomas intestinais, alguns estudos mostram a presença de sintomas extra-intestinais, como alterações ginecológicas (alterações de ciclo menstrual, cistite e vaginite) associados ao consumo de glúten em pacientes com SNCG. E pacientes com dor lombar refratária e espondiloartrite ou pacientes com enterite linfocítica obtiveram uma melhora significativa após uma dieta sem glúten mesmo sendo descartada a possibilidade de doença celíaca. Ambos os grupos após a reintrodução do glúten na dieta apresentaram piora dos sintomas (SORESI, 2020; ISASIA, 2020).
Ao investigar uma possível associação entre Dispepsia Funcional (DF) e SNCG foi observada a elevada infiltração de eosinófilos na mucosa duodenal além de níveis elevados de IgG, indicando que uma resposta inflamatória, possivelmente causada pela presença do glúten, poderia levar à persistência de sintomas gastrointestinais (SHAHBAZKHANI, 2020).
Nas características clínicas de pacientes com SNCG, dados fornecidos pelos mesmos indicaram “anemias, emagrecimento involuntário, histórico de alergias na infância e doenças atópicas (como asma, rinite alérgica – doenças com predisposição a produção de respostas IgE a alérgenos do ambiente), apresentam-se mais frequentemente em pacientes com SNCG que com síndrome do intestino irritável. Em razão de outros estudos não mostrarem alterações na mucosa intestinal, acredita-se que a anemia e o emagrecimento involuntário são decorrentes de pacientes que se autodiagnosticaram e excluíram o glúten de sua dieta”. (CAROCCIO, 2012)
Outra possibilidade é uma família de carboidratos de cadeia curta mal absorvidos, conhecidos como FODMAPs (oligo-, di-, e monossacarídeos e polióis fermentáveis), que têm efeito osmótico e com a sua rápida fermentação, podem levar ao acumulo excessivo de fluidos e gases, causando distensão do intestino, levando a sintomas GI funcionais. Encontraram também numa variedade de alimentos, incluindo os que contêm lactose, frutose, galactose e polióis (sorbitol, manitol e xilitol), no trigo, centeio, leite, algumas frutas (como maçãs e melancias), legumes (como cebolas, alho e espargos) e leguminosas (como lentilhas e grão-de-bico). Um ensaio clínico randomizado realizou inicialmente a exclusão total de FODMAPS e glúten, para posteriormente voltar à inclusão de glúten e placebo em pacientes com SNCG. Nesse estudo o grupo que consumiu glúten apresentou uma piora dos sintomas intestinais indicando que a causa não seria os FODMAPs (BARONE, 2020).
Sobre a ataxia do glúten, uma das manifestações neurológicas atribuídas à doença celíaca, em achados sorológicos há maior prevalência de anticorpo anti-gliadina com ou sem enteropatia revelada por biópsia duodenal. Ao contrário da doença celíaca, a SNCG mostra sinais de um sistema imunológico inato ativado, mas sem lesões no intestino delgado com um aumento da permeabilidade da mucosa que são características da DC. A resposta a uma dieta sem glúten é semelhante a pacientes com DC. Ataxia do membro inferior foi encontrado em 92% dos pacientes. O marcador genético HLA-DQ2 foi predominante em pacientes com DC (89,6%) contrastando com a menor porcentagem encontrada nos pacientes com ataxia do glúten (30%), assim como a enterite linfocitica foi duas vezes maior em celíacos do que em pacientes com ataxia de glúten, indicando que os pacientes com ataxia de glúten são classificados com mais precisão dentro do grupo com SNCG do que dentro do grupo de doença celíaca Na maioria dos casos os pacientes buscam por um diagnóstico de DC, mas são enquadrados com síndrome do intestino irritável. Todos os pacientes desse estudo seguiram uma dieta estrita sem glúten durante o estudo e a maioria deles tiveram uma boa melhora ou parada das manifestações clínicas e neurológicas. (LUÍS, 2015)
Em uma pesquisa multicêntrica o quadro clínico de pacientes com SNCG foi caracterizado por combinação gastrointestinal (dor abdominal, distensão abdominal, diarréia e/ou prisão de ventre, náuseas, dor epigástrica, refluxo gastroesofágico, estomatite aftosa) e manifestações sistêmicas (cansaço, dor de cabeça, dor articular/muscular semelhante a fibromialgia, dormência nas pernas ou braços, dermatite, ou erupção cutânea, depressão, ansiedade e anemia). A doença frequentemente associada foi a síndrome do intestino irritável (SII) em 47% dos pacientes, intolerância alimentar (35%) e alergia mediada por IgE (22%). Em relação à família, 18% tinham histórico de DC, mas nenhuma relação foi encontrada com SNCG e resultado positivo para HLA-DQ2/DQ8. Anticorpos IgG anti-gliadina foram detectados em 25% dos pacientes testados. O diagnóstico para SNCG foi feito quando o paciente relatou sintomas intestinais que ocorrem após a ingestão de glúten, que melhorou ou desapareceu quando o glúten foi retirado da dieta e reapareceu quando o glúten foi reintroduzido na dieta. (UMBERTO,2014)
Segundo VALERII (2014, p. 4), “foram observadas diferenças significativas nas respostas de células mononucleares do sangue periférico (CMSP) de doadores saudáveis estimulados com extratos de proteínas de farinha contendo glúten em comparação com a estimulação com farinha de arroz sem glúten. A secreção de CXCL10 foi significativamente mais elevada (P < 0,01) para os quatro grãos testados. Isto significa que a secreção desta citocina pró-inflamatória é de alguma forma estimulada por extratos proteicos de cereais contendo glúten”.
Em pacientes com Fibromialgia e diagnóstico negativo para Doença Celíaca foi observada uma melhora significativa dos sintomas após uma dieta sem glúten. Com o objetivo de investigar uma possível relação entre Fibromialgia e Sensibilidade não celíaca ao glúten foram realizadas biópsias duodenais e identificou-se a presença de linfócitos intraepiteliais, confirmando assim a hipótese. (ISASI, 2014)
Tabela 1. Resumo da Revisão
Fonte: Objetivos Métodos N Resultados BIESIEKIERSKI et al, 2011 Determinar se ingestão de glúten pode induzir sintomas em pacientes não celíacos Randomização de grupos com dieta com e livre de glúten. Sintomas avaliados por questionários e monitoramento de sistema imune. 34 Pacientes que receberam produtos contendo glúten apresentaram piora em seu estado geral, porém não houveram mudanças significativas na proteína lactoferrina, aumento da sensibilidade da proteína C-reativa e permeabilidade intestinal. CARROCCIO et a, 2012 Demonstrar a existência de sensibilidade ao glúten, definindo seus marcadores. Pacientes submetidos a exames para confirmar SNCG, submetidos a dieta regular com placebos e então eliminatória. 920 Durante o teste placebo, parte dos pacientes foram diagnosticados com SNCG, enquanto apresentaram também outras alergias alimentares, confirmadas posteriormente por via de exames. A perda de peso causada não foi necessariamente pela exclusão de glúten, porém de outros alimentos. GONZALO et al, 2013 Pesquisar associação entre dermatite herpetiforme e SNCG Dieta sem glúten e análise clínica de 2 paciente com DH 2 Presença de sensibilidade ao glúten em pessoas com Dermatite Herpetiforme CARROCIO et al, 2014 Avaliar a prevalência de baixa densidade mineral óssea em pacientes com SNCG. Dieta de eliminação e duplo-cego controlado por placebo 190 Alguns pacientes sofriam com sensibilidade a multiplos alimentos e pacientes com sensibilidade ao trigo (46%) apresentaram osteopenia e osteoporose. VALERII et al, 2014 Avaliar resposta se células mononucleadas responderam ao contato com proteínas do trigo Seleção de cereais para extração de gliadina para testes de imunoglobulinas. 48 As pesquisas in vitro não permitem que tenha real comparação com o corpo humano, porém o estudo possibilitou que fossem encontrados biomarcadores de SNCG em razão de não apresentarem alterações nas vilosidades intestinais. KABBANI et al, 2014 Diferenciar Doença celíaca de Sensibilidade não celíaca ao glúten Biópsia da mucosa duodenal em pacientes em dieta livre de glúten com sorologia IgA / tTG para gliadina. 238 Pacientes com sorologia positiva tiveram sua biopsia confirmando a presença de DC. Em testes genéticos, os pacientes que possuíam SNCG não apresentaram alterações em DQ2 e DQ8. VOLTA et al, 2014
Definir quadro clínico de SNCG em comparação com doença celíacaPesquisa multicêntrica prospectiva com pacientes com SNCG. Questionário para coleta precisa de dados clínicos, bioquímicos e instrumentais, em 38 centro italianos para definir o quadro clínico e sua prevalência em comparação com a DC (Período de 12 meses). 486 O diagnóstico para SNCG foi feito quando o paciente relatou sintomas intestinais que ocorrem após a ingestão de glúten, que melhorou ou desapareceu quando o glúten foi retirado da dieta e reapareceu quando o glúten foi reintroduzido na dieta. Por não ter biomarcadores disponíveis, a suspeita para SNCG pode ser feita em cima de fundamentos clínicos após a exclusão de DC e Alergia ao trigo. RODRIGO et al, 2014 Avaliar efeito de dieta sem glúten em pacientes com síndrome do intestino irritável, enterite linfocítica e fibromialgia Caso-Controle 155 O estudo não foi capaz de tirar conclusão definitiva sobre a eficácia da dieta sem glúten em pacientes com Síndrome da Fibromialgia, Síndrome do Intestino Irritável e Enterite Linfocítica, mais estudos são necessários. CAIO et al, 2014 Caracterizar efeito de dieta sem glúten em anticorpos anti-gliadina Limitação de dietas dos pacientes para eliminação de sintomas, avaliados por formulário. Após 6 meses, foram submetidos à sorologia para confirmação de diagnóstico. 44 IgG persistiu em apenas 3 dos 44 pacientes após a dieta de 6 meses livre de glúten e em 39 dos pacientes, a dieta foi considerada positiva, pois nenhum deles possuía mais sintomas negativos em relação ao glúten e sua sorologia para IgG foi negativa. IgA foi positivo em apenas 4 dos 44 participantes quando havia glúten na dieta e ao retirar, IgA se tornou negativo. CARROCCIO et al, 2014 Avaliar a prevalência de baixa densidade de massa óssea em pacientes com SNCG Dieta com exclusão de trigo, leite, ovo, tomate e chocolate, reintrodução de trigo. Avaliação da Densidade Mineral Óssea, exames bioquimicos e IMC 75 Pacientes com SNCG apresentaram maiores índices de osteoporose e osteopenia. Também houve um retorno dos sintomas após a reintrodução de trigo. ISASI et al, 2014 Descrever efeitos de dieta sem glúten em pacientes não celíacos com fibromialgia Dieta sem glúten com reintrodução em pacientes com Fibromialgia. Ensaio antitransglutaminase, biópsia duodenal e tipagem HLA 20 Foi detectada a presença de linfocitose intraepitelial e uma melhora dos sintomas após uma dieta sem glúten. CATASSI et al , 2015 Definir diagnóstico para SNCG Duplo-cego controlado por placebo. Eliminação e Reintrodução do Glúten _ Não há biomarcador validado para o diagnóstico de SNCG, porém critérios de diagnósticos específicos são necessários para otimizar o atendimento clínico, evitando o autodiagnóstico. SADEGHI et al, 2015 Avaliar efeito de Dieta sem Glúten (DSG) na constipação Modificação de dieta com testes sorológicos. 1 Paciente excluiu glúten da dieta e hábitos intestinais normalizaram. Testes sorológicos não indicaram DC e alergia ao trigo. Considerado SNCG. RODRIGO et al, 2015 Comparar pacientes saudáveis com celíacos e SNCG Estudo observacional prospectivo: pacientes com Ataxia do Gluten. Marcadores genéticos, histocompatibilidade, classes de imunoglobulinas. Teste cutâneo e Endoscopia digestiva alta. 31 O resultado desse estudo indica que os pacientes com ataxia de glúten são classificados com mais precisão dentro do grupo com SNCG do que dentro do grupo de doença celíaca, as características sorológicas, genéticas e histológicas relacionadas a intolerância ao glúten foram semelhantes nos pacientes com ataxia do glúten e SNCG. BARMEYER et al, 2016 Verificar a resposta a longo prazo de uma dieta sem glúten em pacientes com Síndrome do Intestino Irritável de acordo com os critérios de ROMA III. Dieta sem glúten observando se os pacientes tiveram alívio completo ou considerável em 75% das semanas durante 4 meses. 35 Ambos os grupos demonstraram melhoras em uma dieta sem glúten. ELLI et al, 2016 Diferenciar pacientes celíacos de sensibilidade não celíaca ao glúten Biópsia da mucosa duodenal em pacientes em dieta livre de glúten com sorologia IgA / tTG e provocação cutânea para IgE. 140 Pacientes tiveram as reações esperadas durante o consumo de alimentos com glúten e placebos. O princípio foi a avaliação, sugerindo o glúten como gatilho para sintomas gastrointestinais. BONDER et al, 2016 Avaliar mudanças na microbiota em um dieta sem glúten Dieta sem glúten em pacientes saudáveis e exames fecais para avaliar a microbiota 21 Não houve alteração na composição de bactérias, porém ocorreram mudanças na atividade bacteriana. A DSG de curto prazo não influenciou os níveis de biomarcadores inflamatórios intestinais em indivíduos saudáveis. GHALICHI et al, 2016 Investigar efeito de dieta sem glúten em sintomas gastrointestinais e índices comportamentais em crianças com autismo Dieta sem glúten(n=40) comparada a Dieta regular (n=40) em crianças com autismo. Questionários 80 A incidência de sintomas gastrointestinais diminuiu significativamente (57,56%). Mudanças no comportamento e funcionamento cognitivo
foram relatados nesses casos. No entanto não deve ser aplicada a toda criança autista por se tratar de uma doença heterogêneaLOSURDO et al, 2017 Avaliar marcadores de linfócitos e ativação de imunidade inata em resposta ao glúten Biópsia da mucosa duodenal em pacientes em dieta livre de glúten. 52 Comparados resultados de sintomas entre pacientes normais e com DC. Pacientes com SNCG apresentaram sintomas e na comparação a outros, as vilosidades eram semelhantes às normais, enquanto a sorologia era semelhante aos pacientes com DC. CARROCIO et al, 2017 Explorar a prevalência de SNCG autorreferido em alunos do ensino médio e avaliar características. Caso-Controle. Pesquisa e Questionário. 555 Cada alimento apresentou uma resposta diferente; massas e pizzas eram considerados os mais problemáticos por 47% dos pacientes, enquanto biscoitos foram considerados prejudiciais por 8% dos pacientes. Os sintomas clínicos da SII foram os mais apresentados nos pacientes que se diziam com SNCG. HARO et al, 2018 Comprar aceitação e digestibilidade entre pão feito com trigo transgênicos de baixa gliadina e pão sem glúten Dieta com pão sem glúten e reintrodução do pão com baixo teor de gliadina. Exame de fezes, questionários e sorologia. 10 O consumo de pão com baixo teor de gliadina induziu potencialmente mudanças positivas na composição da microbiota intestinal, aumentando as bactérias produtoras de butirato, favorecendo um perfil microbiano que é sugerido como tendo um papel chave na manutenção ou melhoria de permeabilidade intestinal. CLEMENTE et al, 2019 Propor miRNAs como possível diagnóstico de SNCG Dieta sem glúten com reintrodução e questionário de sistomas em pacientes com DC, SNCG e controle saudável. Endoscopia e Biópsia. 117 Pacientes com SNCG têm perfis de expressão distintos de miRNA. Padrões de miRNA diferencialmente expressos combinados com exclusão sorológica e histológica de DC, podem representar um futuro marcador para o diagnóstico positivo desta síndrome. MANSUETO et al, 2019 Avaliar variação de peso em pacientes com SNCG Cálculo de IMC em pacientes com DC e SNCG. 145 Não houve diferenças estatisticamente significativas entre pacientes NCWS e DC para distribuição de IMC, mesmo quando pacientes com sobrepeso e obesos estavam considerado como um único subgrupo. IANIRO GIANLUCA et al , 2019 Comparar efeitos de uma variedade de trigo duro orgânico com trigo comercial padrão em pacientes com SNCG. Duplo-cego randomizado cruzado com pacientes diagnosticados com SNCG de acordo com os critérios de Salermo e adesão de dieta sem glúten por 12 semanas. 42 Pacientes tiveram menos sintomas ao ingerir trigo duro orgânico, porém, o termo SNCG parece ser mais apropriado já que mais de um componente (inibidores de alfa amilase e tripsina, FODMAPs e frutanos) do trigo está associado ao desenvolvimento de sintomas. GONZÁLEZ et al, 2019 Determinar influência de dieta sem glúten e sem caseína em crianças autistas Dieta sem glúten e sem caseína em crianças autistas com reintrodução de ambos. Questionários e concentrações urinárias de beta-casomorfina 37 Não foi observada diferença na concentração urinária de beta-caseomorfina ou no comportamento dos pacientes. MASAEBI et al. , 2020
Propor uma ferramenta para diagnóstico de doença celíaca e SNCGSorologia de pacientes com DC, SNCG e controle saudável 171 IL-8 e IL-15 podem ser propostas como potenciais marcadores em seus
pontos de corte ideais para distinguir CD de SNCG e de grupo controleGRIAUZDAITĖ et al. , 2020 Propor possível associação entre enxaqueca e DC e SNCG Sorologia para Diamina Oxidase (DAO) em pacientes com SNCG e enxaqueca 44 Os ajustes dietéticos reduziram significativamente o impacto da enxaqueca no dia a dia dos pacientes após 3 meses em ambos os grupos Di Pierro et al, 2020
Avaliar eficácia de probióticos no tratamento de SNCGRandomização de dois grupos com SNCG: dieta sem glúten e dieta sem glúten + suplementação de probióticos 37 Ambos os grupos demonstraram melhora nos sintomas e o grupo com duplo tratamento demonstrou vantagem. NYLUND et al, 2020 Caracterizar perfis de microbiota em indivíduos saudáveis, com doença celíaca e SNCG Questionários e amostras fecais para microbiota em pacientes com DC, SNCG e controle saudável 74 Não foi observada diferença na microbiota de indivíduos com DC e SGNC e indivíduos saudáveis, embora o grupo de SGNC tenha relatado mais sintomas intestinais que os demais. GIANCOLA et al, 2020 Investigar as interações neuroimunes na submucosa duodenal em pacientes com SNCG Biópsia da mucosa duodenal em pacientes com DC, SCNG e Alergia ao trigo 62 A proximidade de mastócitos ao nervo no duodeno de pacientes com SNCG/AT são recursos que fornecem
uma base histopatológica para melhor compreender os sintomas gastrointestinais nesta condiçãoARÁMBURO et al, 2020 Estimar prevalência e adesão a dieta sem glúten Questionários 1.630 A prevalência de SNCG na população Brasileira estudada foi de 1,7%. SORESI et al, 2020 Avaliar a frequência de sintomas ginecológicos em pacientes com SNCG Questionário para sintomas ginecológicos e cistite em pacientes com DC, SNCG e controle saudável 68 Pacientes com SNCG apresentaram uma frequência significativamente maior de sintomas ginecológicos e cistite recorrente
do que pacientes com IBS.BARONE et al, 2020 Diferenciar diagnótico de Síndrome do Intestino irritável de SNCG Sorologia, Hemograma e Biópsia. Dieta sem glúten e sem FODMAPs com reintrodução de glúten 40 De acordo com os critérios de Salerno, após a administração de glúten, 46,1% dos pacientes relataram piora de seus sintomas em comparação com o grupo placebo e, portanto, pode ser considerado afetado pelo SNCG. ISASI et al, 2020 Propor associação entre SNCG e dor lombar crônica Dieta sem glúten. Sorologia, Biópsia e Questionário para avaliar sintomas 110 62% experimentou uma melhoria exigente. Além disso, quase todos aqueles pacientes que experimentaram melhorias exigentes, mas começaram a comer glúten novamente apresentaram piora. SHAHBAZKHANI et al, 2020 Avaliar relação entre dispepsia funcional refratária(DFR) e SNCG Sorologia, Ultra-som abdominal, Endoscopia e exame de fezes e dieta sem glúten com reintrodução 77 Nossos achados mostram que, entre os pacientes com DFR, 6,5% apresentam recidiva sintomática durante um desafio de glúten às cegas e, portanto, podem ser categorizados como SNCG. EFTHYMAKIS et al., 2020 Identificar mecanismos e marcadores úteis para diagnóstico de SNCG Caso-Controle. Análise de expressão do genoma em RNA extraído da mucosa intestinal por análise de microArray. 19 Pacientes com sensibilidade não celíaca ao glúten podem ser geneticamente definido e o perfil da expressão gênica pode ser uma ferramenta adequada para apoiar o diagnóstico. BIESIEKIERSKI et al, 2020 Descobrir possível causa de sintomas comparando glúten e FODMAP Teste randomizado com dieta com baixo FODMAP, então alta carga de glúten e então troca de proteína nos produtos. 37 Os pacientes tiveram resultados esperados. Ao retirar FODMAPs, tiveram melhora do quadro, aumentando carga de glúten, os sintomas voltaram e na troca de proteína do produto, os pacientes tiveram sintomas brandos.
Fonte: os atores com as referências citadas na tabela.
Recomendações para investigações futuras:
Devido à ausência de critérios diagnósticos específicos para otimização do atendimento clínico e para evitar o autodiagnóstico, recomendamos uma investigação mais profunda através de um ensaio clínico randomizado com 3 grupos: 1 grupo de sensibilidade ao glúten não celíaca, 1 grupo de celíacos e 1 grupo controle saudável.
O modelo de intervenção adotado deve ser realizado em 3 etapas, na primeira etapa uma exclusão de FODMAPs e glúten, na segunda uma reintrodução de FODMAPs e na terceira a reintrodução de glúten.
Em todas as etapas, incluindo a fase de randomização os 3 grupos deverão responder a um questionário de sinais e sintomas e passarão por exames para os possíveis marcadores identificados nessa revisão.
Os marcadores investigados serão mastócitos e linfócitos intraepiteliais no duodeno, IL-8, IL-15 e 6 tipos de miRNA (hsa-miR-19b3p, hsa-miR-19a-3p, hsa-miR-186-5p, hsa-miR-17-5p, hsa-miR-145-5p, hsa-miR-30e-5).
Conclusões:
Apesar de difícil de ser diagnosticada, a sensibilidade não-celíaca ao glúten é um problema real, e que acomete uma boa parte da população e ao longo dessa pesquisa foi possível identificar possíveis biomarcadores que podem ser utilizados como diagnóstico no futuro. Há uma necessidade maior de pesquisas em relação à condição, dado que muitos pacientes se autodiagnosticam e fazem a exclusão do glúten da sua dieta, pois notam melhora em seu quadro geral. No entanto uma exclusão sem orientação pode resultar em deficiências nutricionais.
A intervenção nutricional se mostrou eficaz e primordial no tratamento dos mesmos, e com os estudos apresentados, ficou evidente que a recuperação da barreira epitelial intestinal bem como da microbiota, é fator importante para garantir a impermeabilidade intestinal, adequada absorção de nutrientes e uma eficiente resposta imunológica evitando carências nutricionais e piora do quadro clínico e manifestações extra intestinais que foram melhorados com a exclusão do glúten na dieta, proporcionando uma significativa melhora na qualidade de vida do paciente.
A presença de mastócitos e linfócitos na parede duodenal, Interleucina 8 e 15, além de 6 tipos diferentes de miRNA podem ser considerados como possíveis marcadores, diferenciando pacientes com Sensibilidade não-celíaca ao glúten de pacientes Celíacos, sendo necessários mais estudos sua confirmação.
Até o momento, o único tratamento para pacientes com sensibilidade não-celíaca ao glúten que se mostrou eficaz foi a dieta sem glúten.
Referências Bibliográficas:
ARÁMBURO-GÁLVEZ, J.G. et al. Prevalence of Adverse Reactions to Glutenand People Going on a Gluten-Free Diet:A Survey Study Conducted in Brazil. Medicina. 2020. Disponível em: https://www.mdpi.com/1010-660X/56/4/163
BARMEYER, C. et al. Long-term response to gluten-free diet as evidence for non-celiac wheat sensitivity in one third of patients with diarrhea-dominant and mixed-type irritable bowel syndrome. Int J Colorectal Dis 32, 29–39 (2017). Disponível em https://doi.org/10.1007/s00384-016-2663-x
BARONE, M. et al. Evaluation of Non-Celiac Gluten Sensitivity in Patients with Previous Diagnosis of Irritable Bowel Syndrome: A Randomized Double-Blind Placebo-Controlled Crossover Trial. Nutrients. 2020. Disponível em: https://www.mdpi.com/2072-6643/12/3/705
BIESIEKIERSKI, J. R. et al. Gluten Causes Gastrointestinal Symptoms in Subjects Without Celiac Disease: A Double-Blind Randomized Placebo-Controlled Trial. American College of Gastroenterology. 2011. Disponível em: https://pubmed.ncbi.nlm.nih.gov/21224837/
BIESIEKIERSKI, J. R. et al. No Effects of Gluten in Patients With Self-Reported Non-Celiac Gluten Sensitivity After Dietary Reduction of Fermentable, Poorly Absorbed, Short-Chain Carbohydrates. Gastroenterology. 2013. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S0016508513007026
BONDER, M.J. et al. The influence of a short-term gluten-free diet on the human gut microbiome. Genome Medicine. 2016. Disponível em: https://link.springer.com/article/10.1186/s13073-016-0295-y
CAIO, G. et al. Effect of gluten free diet on immune response to gliadin in patients with non-celiac gluten sensitivity. BMC Gastroenterology. 2014. Disponível em: https://pubmed.ncbi.nlm.nih.gov/24524388/
CARREIRO, D.M., Pereira, Murilo. Semiologia na prática clínica nutricional. 1ª edição. São Paulo,SP. 2020. 127p.
CARROCCIO, A. et al. Non-Celiac Wheat Sensitivity Diagnosed by Double-Blind Placebo-Controlled Challenge: Exploring a New Clinical Entity. The American Journal of Gastroenterology. 2012. Disponível em: https://journals.lww.com/ajg/Abstract/2012/12000/Non_Celiac_Wheat_Sensitivity_Diagnosed_by.23.aspx
CARROCCIO, A. et al. Risk of low bone mineral density and low body mass index in patients with non-celiac wheat-sensitivity: a prospective observation study. BMC Medicine 2014 12:230. Disponível em https://www.bmcmedicine.biomedcentral.com/doi 10.1186/s12916-014-0230-2
CARROCIO, A. et al. Self-Reported Non-Celiac Wheat Sensitivity in High School Students: Demographic and Clinical Characteristics. Nutrients 2017, 9, 771. Disponível em https://www.mdpi.com/journal/nutrients/doi:10.3390/nu9070771
CATASSI, C. et al. Diagnosis of Non-Celiac Gluten Sensitivity (SNCG): The Salerno Experts’ Criteria. Nutrients 2015, 7, 4966-4977. Disponível em https://www.mdpi.com/2072-6643/7/6/4966/doi:10.3390/nu7064966
CLEMENTE, E. ET AL. AN EXPLORATIVE STUDY IDENTIFIES MIRNA SIGNATURES FOR THE diagnosis of non-celiac wheat sensitivity. Journal Plos One. 2019. Disponível em: https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0226478
COMINETTI, C. et al. Genômica nutricional. 1° edição. São Paulo. Manole, 2017. 371 p.
COZZOLINO, S. M. F. Biodisponibilidade de nutrientes. 5ª edição. São Paulo: Manole, 2016. 1050 p.
DI PIERRO, F. et al. Pilot study on non-celiac gluten sensitivity: effects of Bifidobacterium longum ES1 co-administered with a gluten-free diet. Minerva Gastroenterologica e Dietologica. (2020) Disponível em: https://www.minervamedica.it/en/journals/gastroenterologica-dietologica/article.php?cod=R08Y2020N03A0187
ELLI, L. et al. Evidence for the Presence of Non-Celiac Gluten Sensitivity in Patients with Functional Gastrointestinal Symptoms: Results from a Multicenter Randomized Double-Blind Placebo-Controlled Gluten Challenge. Nutrients. 2016. Disponível em: https://pubmed.ncbi.nlm.nih.gov/26867199/
GHALICHI, F. et al. Effect of gluten free diet on gastrointestinal and behavioral indices for children with autism spectrum disorders:a randomized clinical trial. World J. Pediatr. 2016.
GIANCOLA, F. et al. Mast cell-nerve interactions correlate with bloating and abdominal pain severity in patients with non-celiac gluten / wheat sensitivity. Wiley Online Library. 2020. Disponível em: https://doi.org/10.1111/nmo.13814
GONZÁLEZ-DOMENECH, P.J. et al. Influente of a Combined Gluten-Free ans Casein-Free Diet on BehaviorDisordersinChildren ans Adolescents Diagnosed with Autism Spectrum Disorder: A 12-Mouth Follow-Up Clinical Trial. Journal of Autism and Developmental Disorders. 2019. Disponível em: https://link.springer.com/article/10.1007/s10803-019-04333-1
GONZALO, B.M. et al. Lesiones cutáneas con exacerbación perimenstrual: un reto diagnóstico. Actualidad Médica. 2013.
GRIAUZDAITE, K. et al. Associations between migraine, celiac disease, non-celiac gluten sensitivity and activity of diamine oxidase. Elsevier. 2020. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S0306987720302176?via%3Dihub
HARO, C. et al. The Dietary Intervention of Transgenic Low-Gliadin Wheat Bread in Patients with Non-Celiac Gluten Sensitivity (SNCG) Showed No Differences with Gluten Free Diet (GFD) but Provides Better Gut Microbiota Profile. Nutrients 2018, 10, 1964. Disponível em www.mdpi.com/journal/nutrients/doi:10.3390/nu10121964
IANIRO, G. et al. A Durum Wheat Variety-Based Product Is Effective in Reducing Symptoms in Patients with Non-Celiac Gluten Sensitivity: A Double-Blind Randomized Cross-Over Trial. Nutrients 2019, 11, 712. Disponível em www.mdpi.com/journal/nutrients/doi:10.3390/nu11040712
ISASI, C. et al. Fibromyalgia and non‑celiac gluten sensitivity: a description with remission of fibromyalgia. Rheumatol International. 2014. Disponível em: https://link.springer.com/article/10.1007/s00296-014-2990-6
ISASI, C. et al. Non-celiac gluten sensitivity and chronic refractory low back pain with spondyloarthritis features. ScienceDirect. 2020. Disponível em: https://www.sciencedirect.com/science/article/pii/S0306987720301493?via%3Dihub
KABBANI, T. A. et al. Celiac Disease or Non-Celiac Gluten Sensitivity? An Approach to Clinical Differential Diagnosis. The American Journal of Gastroenterology. 2014. Disponível em: https://pubmed.ncbi.nlm.nih.gov/24619056/
KONSTANTINOS, E. et al. An Exploratory Gene Expression Study of the Intestinal Mucosa of Patients with Non-Celiac Wheat Sensitivity. Int J Mol Sci. 2020 Mar 13;21(6):1969. Disponível em https://pubmed.ncbi.nlm.nih.gov/32183058/doi 10.3390/ijms21061969
LOSURDO, G. et al. T Helper Lymphocyte and Mast Cell Immunohistochemical Pattern in Nonceliac Gluten Sensitivity. Gastroenterology Research and Practice. 2017. Disponível em: https://www.hindawi.com/journals/grp/2017/5023680/
MANSUETO, P. et al. Body Mass Index and Associated Clinical Variables in Patirnts with Non-Celiac Wheat Sensitivity. Nutrients. 2019. Disponível em: https://www.mdpi.com/2072-6643/11/6/1220
MASAEBI, F. et al. The Predictive Value of Serum Cytokines for Distinguishing Celiac Disease from Non-Celiac Gluten Sensitivity and Healthy Subjects. Iranian Biomedical Journal. 2020. Disponível em: http://ibj.pasteur.ac.ir/article-1-3144-en.html
NYLUND, L. et al. Diet, Perceived Intestinal Well-Being and Compositions of Fecal Microbiota and Short Chain Fatty Acids in Oat-Using Subjects with Celiac Disease or Gluten Sensitivity. Nutrients. 2020. Disponível em: https://www.mdpi.com/2072-6643/12/9/2570
REESE, I. et al. Non-celiac gluten/wheat sensitivity (SNCG)-a currently undefined disorder without validated diagnostic criteria and of unknown prevalence. Allergo J Int (2018) 27:147–151. Disponível em https://doi.org/10.1007/s40629-018-0070-2
RODRIGO, L. et al. Effect of one year of a gluten-free diet on the clinical evolution of irritable bowel syndrome plus fibromyalgia in patients with associated lymphocytic enteritis: a case-control study. Arthritis Research & Therapy. 2014. Disponível em http://arthritis-research.com/content/16/4/421/doi 10.1186/s13075-014-0421-4
RODRIGO, L. et al. Gluten ataxia is better classified as non-celiac gluten sensitivity than as celiac disease: a comparative clinical study. Immunol Res. 2016 Apr;64(2):558-64. Disponível em https://pubmed.ncbi.nlm.nih.gov/26676361/doi 10.1007/s12026-015-8750-1. PMID: 26676361.
SADEGHI, A. et al. An unusual cause of constipation in a patient without any underlying disorders. Gastroenterology and Hepatology, 2015. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4403030/
SHAHBAZKHANI, B. et al. Prevalence of Non-Celiac Gluten Sensitivity in Patients with Refractory Functional Dyspepsia: a Randomized Double-blind Placebo Controlled Trial. Scientific reports. 2020. Disponível em: https://www.nature.com/articles/s41598-020-59532-z
SORESI, M. et al. Gynecological Disorders in Patients with Non‑celiac Wheat Sensitivity. Digestive Diseases and Sciences. 2020. Disponível em: https://link.springer.com/article/10.1007%2Fs10620-020-06184-8
VALERII, M. C. et al. Responses of peripheral blood mononucleated cells from non-celiac gluten sensitive patients to various cereal sources. Food Chemistry. 2014. Disponível em: https://www.sciencedirect.com/science/article/pii/S0308814614019748
VOLTA, U. et al. An Italian prospective multicenter survey on patients suspected of having non-celiac gluten sensitivity. BMC Medicine 2014, 12:85. Disponível em http://www.biomedcentral.com/1741-7015/12/85/doi10.1186/1741-7015-12-85
SILVA, T. S. G. et al. Diagnosis of Celiac Disease in Adults. Rev. Assoc. Medicina Brasileira. 2010. Disponível em: https://www.scielo.br/scielo.php?pid=S0104-42302010000100027&script=sci_arttext&tlng=pt
1 Graduada em Nutrição pelo Centro Universitário Nossa Senhora do Patrocínio – CEUNSP.
Endereço: Rua Luis Gazzola, nº154. Vila Nova. Itu- SP. CEP13300053
E-mail: brunaramireznutri@gmail.com
2 Graduada em Nutrição pelo Centro Universitário Nossa Senhora do Patrocínio – CEUNSP.
Endereço: Rua Pedro Luiz Correr, nº78, Cond. Dona Maria José. Jardim Explanada. Indaiatuba-SP
E-mail: luanacpalmeida@hotmail.com
3 Graduada em Nutrição pelo Centro Universitário Nossa Senhora do Patrocínio – CEUNSP.
Endereço: Rua Sr. Teobaldo Costa Azevedo, Lote 01, Quadra A. Residencial Milano. Indaiatuba-SP
E-mail: paulamartins-silva@outlook.com
4 Mestre em Ciência dos Alimentos pelo Instituto de Tecnologia de Alimentos – ITAL. Nutricionista e Farmacêutico pelo Centro Universitário Nossa Senhora do Patrocínio – CEUNSP.
Endereço: Alameda dos Cedros, 64. Cond. Portal de Itu. Itu-SP. CEP: 13301623
E-mail: tiagonandr@gmail.com
5 Doutor em Medicina pela Faculdade de Medicina da Universidade de São Paulo – FMUSP. Graduação em Medicina, pela Universidade Nove de Julho – UNINOVE. Coordenador Acadêmico SOBRAMFA/ SOBRAMFA, Educação Médica & Humanismo
Endereço: Rua Heitor de Moraes, 384 – Pacaembu, São Paulo-SP CEP: 01237000
E-mail: guilherme@sobramfa.com.br
