APPLICABILITY OF NON-INVASIVE VENTILATION IN ACUTE RESPIRATORY FAILURE IN PATIENTS WITH ACQUIRED IMMUNODEFICIENCY: A SYSTEMATIC REVIEW AND META ANALYSIS
REGISTRO DOI: 10.5281/zenodo.7698999
Donato da Silva Braz Júnior¹
Myllena Beatriz Moura de Lira Lima²
Exilly Ellen Vieira da Conceição³
Sandra Carolina Farias de Oliveira4
Andrei Luiz Sales Teixeira5
Marlon Chaves Cavalcanti6
André Luís Silva dos Santos7
Douglas Silva Barros8
Andréa Karla Soares Montenegro9
Roberto Bezerra da Silva10
RESUMO
A síndrome da imunodeficiência humana adquirida (AIDS), é o último estágio da infecção causada pelo vírus da imunodeficiência humana (HIV), o qual enfraquece o sistema imunológico e predispõe doenças oportunistas. Embora haja uma gama de agentes antimicrobianos e anti retrovirais, as afecções pulmonares continuam sendo as principais causas de morbimortalidade nessa população. A principal complicação e causa mais comum de admissão em unidade de terapia intensiva (UTI) é a insuficiência respiratória aguda (IRpA), e, na maioria dos casos é necessário utilizar o suporte ventilatório, seja ele invasivo (VMI), ou não invasivo (VNI), sendo esta, indicada como estratégia de primeira linha para pacientes imunocomprometidos. O estudo possui o intuito de verificar a aplicabilidade da ventilação não invasiva na insuficiência respiratória em indivíduos com imunodeficiência adquirida. Trata-se de uma revisão sistemática e meta-análise, realizando uma busca nas bases de dados Cochrane Library, MEDLINE, LILACS, SciELO, CINAHL, Web of Science e Scopus. Dois revisores independentes incluíram estudos, extraíram dados, realizaram avaliação da qualidade e resumiram os resultados. Os dados agrupados foram avaliados por meta-análise, resumos dos resultados e classificação das evidências foram realizados pelo método GRADE. Foram identificados um total de 1286 estudos nas diferentes fontes. Ao final, dois estudos foram considerados adequados para a inclusão. Notou-se que apesar do tempo de suporte ventilatório necessário ser similar entre os grupos, a mortalidade na UTI foi menor entre os que usaram VNI comparados a VMI. A VNI demonstrou reduzir a mortalidade na UTI de pacientes com insuficiência respiratória aguda que vivem com a imunodeficiência humana adquirida.
PALAVRAS-CHAVE: Ventilação não invasiva. Insuficiência respiratória. Síndrome da imunodeficiência adquirida.
ABSTRACT
Acquired human immunodeficiency syndrome (AIDS) is the last stage of infection caused by the human immunodeficiency virus (HIV), which weakens the immune system and predisposes to opportunistic diseases. Although there is a range of antimicrobial and antiretroviral agents, lung diseases remain the main causes of morbidity and mortality in this population. The main complication and most common cause of admission to an intensive care unit (ICU) is acute respiratory failure (ARF), and in most cases it is necessary to use ventilatory support, whether invasive (IMV) or non-invasive ( NIV), which is indicated as a first-line strategy for immunocompromised patients. To verify the applicability of non-invasive ventilation in respiratory failure in individuals with AIDS. METHOD: This is a systematic review with meta-analysis, performing a search in the Cochrane Library, MEDLINE, LILACS, SciELO, CINAHL, Web of Science and Scopus databases. Two independent reviewers included studies, extracted data, performed quality assessment, and summarized results. Pooled data were evaluated by meta-analysis, summaries of results and classification of evidence were performed using the GRADE method. A total of 1286 studies were identified from different sources. In the end, two studies were considered suitable for inclusion. It was noted that despite the time of ventilatory support required being similar between the groups, mortality in the ICU was lower among those using NIV compared to IMV. NIV has been shown to reduce ICU mortality in patients with acute respiratory failure living with acquired human immunodeficiency.
KEYWORDS: Non-invasive ventilation. Respiratory failure. Acquired immunodeficiency syndrome.
1 INTRODUÇÃO
A síndrome da imunodeficiência adquirida (AIDS – Acquired Immune Deficiency Syndrome) é uma fase da infecção pelo vírus da imunodeficiência humana (HIV) caracterizada pelo colapso do sistema imunológico, que propicia o surgimento de doenças oportunistas (ŠIMEKOVÁ et al., 2019).
Descoberta no início da década de 80, o número de portadores do vírus tem aumentado significativamente nos últimos anos. No Brasil, de 1980 a junho de 2018, foram notificados 926.742 casos de HIV, registrando entre 2013 a 2018, uma média de aumento anual de 40 mil novos casos, com 327.655 óbitos confirmados pelas complicações da AIDS, do início da epidemia até 31 de dezembro de 2017 (BRASIL, 2018).
O número de hospitalizações tem oscilado, entre 2008 até os dados mais recentes (2016) houve diminuição de 11,6% na necessidade de tratamento hospitalar. Neste contexto, as afecções do sistema respiratório foram apontadas como maiores indutoras de internamento hospitalar, sendo a insuficiência respiratória causa mais comum de admissão em UTI, havendo necessidade de assistência ventilatória, invasiva ou não invasiva na maioria dos casos (CALDAS et al., 2018; CORRÊA et al., 2015).
Ao evitar a intubação orotraqueal ou a traqueostomia, a ventilação não invasiva (VNI) mantém uma via aérea superior intacta e, portanto, mantêm os mecanismos de defesa das vias aéreas, o que é importante para pacientes imunocomprometidos que são especialmente vulneráveis a infecções nosocomiais, sendo assim, a VNI é considerada terapia de primeira linha nestes casos (WANG et al., 2016).
Portanto o objetivo deste trabalho é verificar a aplicabilidade da ventilação não invasiva em pacientes com insuficiência respiratória aguda que possuem a síndrome da imunodeficiência humana adquirida.
2 REFERENCIAL TEÓRICO
2.1 Sobre o AIDS/HIV
Os primeiros casos foram identificados no início dos anos 80, onde apresentavam como característica principal a extrema deficiência imunológica, determinada como sendo de uma infecção viral causada pelo agente Lentivirus, da família Retroviridae (CASTRO et al., 2018).
Quando se trata de termos a serem utilizados com os pacientes, o Programa Conjunto das Nações Unidas sobre HIV/Aids (UNAIDS Brasil) recomenda que não seja utilizado o termo “portador de HIV ou AIDS” e sim “pessoa vivendo com HIV ou AIDS”. Pois, o primeiro, apesar de ser mais popularmente conhecido, dá ênfase a doença e ao vírus em detrimento à pessoa.
2.2 Retrovírus
O genoma do retrovírus é composto por duas cópias idênticas de moléculas RNA de fita simples e é caracterizado pela presença de genes estruturais: gag, pol, env. Ao invadir las células TCD4 + auxiliares, o gen gag codifica as proteínas estruturais do núcleo, enquanto o gene env codifica as glicoproteínas gp120 e gp41 do envelope viral, e o gene pol codifica enzimas transcriptase reversa para a replicação do vírus, elas convertem o RNA viral em DNA, que é então integrado na molécula de DNA genético da célula hospedeira (MALDONADO; MANSKY, 2018). Novas células virais podem se formar na célula hospedeira, causando seu rompimento e liberando partículas similares recém-formadas, a mesma também pode permanecer inativa e as partículas virais latentes por um longo e indeterminado tempo. Com a contínua invasão das células auxiliares T CD4 +, o sistema imunológico fica sobrecarregado e incapaz de se proteger do vírus e de invasões de outros microrganismos oportunistas (HARRIS, 2018; MALDONADO; MANSKY, 2018; CHAN; TRINITÉ; LEVY 2017).
2.3 Fases do HIV
A infecção pelo HIV abrange uma fase aguda que pode variar de poucas semanas a meses, seguida por uma fase clinicamente latente que geralmente duram alguns anos e, finalmente, pelo colapso do sistema imunológico que caracteriza a AIDS (ŠIMEKOVÁ et al., 2019).
2.3.1 Fase 1
Chamada de infecção aguda, esse período varia de duas a quatro semanas e compreende altos valores do vírus circulante no plasma, com baixos níveis de linfócitos T e aumento de viremia, tendo em vista que o corpo, pode levar de 30 a 60 dias após a infecção para produzir anticorpos e combater o vírus (MORAIS et al., 2019).
2.3.2 Fase 2
Denominada fase assintomática ou latente, é caracterizada pela interação entre as células de defesa e as mutações do vírus, que amadurecem e morrem de forma equilibrada, assim, não enfraquecem o organismo ao ponto de permitir novas doenças. Nesta fase, o nível de carga plasmática do vírus pode permanecer estável por vários anos, mas esse ataque a longo prazo, faz com que as células de defesa comecem a funcionar com menos eficácia e o organismo fica cada vez mais fraco e vulnerável a infecções comuns (TRIGO; COSTA, 2016).
2.3.3 Fase 3
A fase sintomática é caracterizada pela alta redução dos linfócitos TCD4+ que chegam a ficar abaixo de 200 unidades por mm³ de sangue, em adultos saudáveis, esse valor varia entre 800 a 1.200 unidades. A baixa imunidade permite o aparecimento de doenças oportunistas, com isso, atinge-se o estágio mais avançado da doença, a AIDS. (MALDONADO; MANSKY, 2018)
2.4 Epidemiologia da AIDS
A AIDS já resultou na morte de mais de 32 milhões de pessoas. Apenas no ano passado 1,7 milhão de pessoas foram infectadas e hoje cerca de 37,9 milhões convivem com o vírus (LEHMANN; LEHMANN; ERFLE, 2019).
Com base nos dados do boletim epidemiológico do Ministério da Saúde, o país tem registrado anualmente, uma média de 40 mil novos casos, com queda gradual desde 2013. Num período de dez anos a taxa de detecção apresentou queda de 9,4%, onde em 2007 foi registrado 20,2 casos por 100 mil habitantes, já em 2017 foi de 18,3 casos a cada 100 mil habitantes.
A distribuição proporcional de casos no Brasil de 1980 até junho de 2018, mostra uma maior concentração nas regiões Sudeste com 51,8% e Sul com 20,0% do total de casos; as regiões Nordeste, Norte e Centro-Oeste correspondem a 15,8%, 6,4% e 6,1%, respectivamente. Embora a taxa de detecção no Brasil esteja em declínio, as regiões Norte e Nordeste apresentaram tendência ao crescimento, em 2017 foram registrados 16,4 (Norte) e 12,7 (Nordeste) casos por 100 mil habitantes, após uma década, subiram para 23,6 (Norte) e 15,7 (Nordeste), representando aumentos de 44,2% (Norte) e 24,1% (Nordeste) (BRASIL, 2018).
Nesse contexto, é possível observar que algumas variáveis podem influenciar no processo saúde/doença, em geral varia de acordo com a situação socioeconômica das localidades. Em relação à AIDS, o diagnóstico tardio pode ocorrer em regiões menos favorecidas economicamente, levando ao aumento de doenças oportunistas e mortes precoces. (PAIVA; PEDROSA; GALVÃO, 2019)
As causas de internação em UTI mudaram desde a introdução da terapia com antirretroviral (TARV), porém os principais motivos de internamento ainda se dáa por afecções oportunistas do trato respiratório. Nos países em desenvolvimento, uma alta porcentagem de indivíduos não sabem que é portador do HIV e não recebeu TARV ou profilaxia, esses pacientes representam o maior número de internações em UTI respiratória devido a insuficiência respiratória hipoxêmica aguda grave (HERNANDES- CARDENAS et al., 2019)
2.5 Insuficiência respiratória
A Insuficiência respiratória (IR) consiste na incapacidade do sistema respiratório em fornecer ventilação alveolar, mantendo adequadas trocas gasosas e promovendo oxigenação e eliminação de gás carbônico do sangue arterial. Deste modo, ocorre elevação dos níveis de PCO2 (pressão parcial de gás carbônico) acima de 50 mmHg e queda de PO2 (pressão parcial de oxigênio) abaixo de 50 mmHg (DAVIDSON et al., 2016).
A IR pode ser diferenciada pela sua velocidade de instalação, podendo ser aguda ou crônica. A insuficiência respiratória aguda (IRpA), possui rápida deterioração da função respiratória levando ao surgimento de manifestações clínicas mais intensas, com alterações gasométricas do equilíbrio ácido-base, alcalose ou acidose respiratória. Quando as alterações das trocas gasosas se impõem de maneira pertinente ao longo de meses ou anos, estaremos diante de casos de insuficiência respiratória crônica (IRpC) (PINHEIRO; PINHEIRO; MENDES, 2015).
2.5.1 Trocas Gasosas
A oxigenação e a eliminação do gás carbônico de maneira satisfatória, dependem do desempenho de diferentes elementos do sistema respiratório, o qual é dividido didaticamente em etapas específicas, porém interdependentes. As etapas são: 1. Ventilação; 2. Perfusão 3. Adequação entre a ventilação alveolar e a perfusão (relação ventilação-perfusão) 4. Difusão; (FERNANDES et al., 2002; PÁDUA; ALVARES; MARTINEZ, 2003). Caso haja um desequilíbrio entre estas etapas, haverá a possibilidade de complicações não só pulmonares, mas também sistêmicas.
2.5.2 Ventilação
A ventilação total é o volume de ar que entra e sai do sistema respiratório, encaminhado para realizar trocas gasosas denominadas de ventilação alveolar. Entretanto, parte desse volume não atinge os alvéolos, ficando em unidades chamadas de espaço morto, o movimento dos gases também pode ser influenciado pela gravidade. (PINHEIRO; PINHEIRO; MENDES, 2015).
2.5.3 Perfusão
Refere-se ao fluxo sanguíneo da circulação pulmonar disponível para a troca gasosa, dependente de postura, o que aumenta as áreas de troca nas bases pulmonares e diminui no ápice devido à gravidade. Tem características de um sistema hidráulico de baixa pressão, complacente e de baixa resistência, que podem ser alteradas por fatores intrínsecos (pressão, volume, fluxo) e extrínsecos (inervação autonômica, controle humoral) e pelos gases respiratórios (MANÇO, 1998; PÁDUA; ALVARES; MARTINEZ, 2003).
2.5.4 Relação Ventilação/Perfusão (V/Q)
É a relação entre o O2 (oxigênio) que é ventilado promovendo a esterilização ou oxigenação do sangue e o sangue perfundido pela membrana alvéolo capilar. Existem situações que podem gerar distúrbios no funcionamento normal, se caracteriza pelo índice V/Q alto (ventilação é alta e o fluxo sanguíneo baixo, denominado espaço morto) e índice V/Q baixo (ventilação é baixa e o fluxo sanguíneo é alto, pode também ser chamado de shunt intrapulmonar) (PINHEIRO; MENDES, 2015; MANÇO, 1998).).
2.5.5 Difusão
É a passagem do ar alveolar através da membrana alvéolo-capilar, para cada milímetro de mercúrio de diferença entre as pressões parciais deste gás no espaço alveolar e no sangue. A espessura da membrana alvéolo-capilar; extensão da superfície da membrana de difusão; solubilidade dos gases; propriedades de difusibilidade do meio e alterações dos gradientes de pressão, são fatores que podem influenciar nesta difusão (MATSUNO, 2012;).
2.6 Classificação da Insuficiência Respiratória Aguda
2.6.1 IRpA hipercápnica
Definida pela retenção de CO² trata-se de uma insuficiência ventilatória com parâmetros de pH (potencial Hidrogeniônico) <7,35 e PCO 2 > 45 mmHg. Normalmente, a quantidade de CO2 (gás carbônico) eliminada pelos pulmões é igual à quantidade produzida pelo corpo, é diretamente proporcional à ventilação alveolar. A retenção de CO2 pode ser causada por qualquer processo que diminua a ventilação minuto (diminuindo a frequência respiratória ou o volume corrente) ou que aumente a ventilação do espaço morto (FREITAS et al., 2017; MATSUNO, 2012).
2.6.2 IRpA hipoxêmica
A hipoxemia é resultante da falência da oxigenação, onde há prejuízo nas trocas gasosas, sem retenção simultânea de CO2, não ocorrendo diminuição significativa do volume minuto, razão pela qual o PCO2 se apresenta normal. Pode ocorrer por desequilíbrio V/Q e associada a dificuldade na difusão (PIVA et al., 1998)
Nestes casos, se faz necessário a internação em unidade de terapia intensiva e assistência ventilatória, que pode ser: ventilação mecânica invasiva (VMI) ou ventilação não invasiva (VNI), sua aplicabilidade vai depender da gravidade do caso (ANJOS et al., 2012; ESTEVES; ANTUNES; MATOS, 2014; SCALA; PISANI, 2018).
2.7 Ventilação Não Invasiva
Apesar de algumas controvérsias sobre o uso da VNI em pacientes internados em UTI, as diretrizes americanas/europeias apontam a VNI como uma abordagem de primeira linha para o gerenciamento da IRpA hipoxêmica, leve ou moderada em imunossuprimidos (FRAT et al., 2015; ROCHWERG et al., 2017).
A VNI corresponde à aplicação de suporte ventilatório através de uma interface externa, como máscara facial, máscara nasal ou prongas nasais, sem necessidade de intubação endotraqueal, de modo a permitir que o gás aquecido e umidificado chegue aos pulmões com pressões superiores à pressão atmosférica. Os modos ventilatórios mais conhecidos de VNI, são o CPAP (continuous positive airway pressure) e o BiPAP (bilevel positive airway pressure) (OLIVEIRA et al., 2018)
O CPAP possui mecânica relativamente simples; define uma pressão expiratória para distender as vias aéreas inferiores, fornece um modo de pressão constante em todas as fases da respiração, auxiliando na prevenção de atelectasias e também pode ser usado para manter a patência de uma via aérea superior em casos de obstrução (BELLO et al., 2018).
O BiPAP utiliza dois níveis de pressão, um nível de suporte inspiratório (IPAP – inspiratory positive airways pressure) e um nível de pressão no fim da expiração (EPAP ou PEEP – expiratory positive airways pressure) em outras palavras, o aparelho fornece a mesma pressão que o CPAP, mas reconhece quando há um esforço inspiratório e proporciona uma pressão mais alta durante a inspiração. Quando o fluxo pára, a pressão retorna ao nível de CPAP (RAPPARD; HICKEY, 2001).
Ambas as modalidades ajudam a distender as vias aéreas para manter o volume pulmonar e a oxigenação em nível alveolar, suportando a elasticidade da parede torácica e, finalmente, diminuindo o esforço respiratório e o uso de músculos acessórios,
A indicação para a VNI varia de acordo com a causa subjacente, gravidade da doença e fatores complicadores associados. A técnica deve ser considerada precocemente em pacientes com sinais de insuficiência respiratória, como dispnéia, taquipnéia, uso acessório de músculos, respiração abdominal paradoxal e deterioração das trocas gasosas (BELLO et al., 2018)
Segundo Diretrizes Brasileiras de ventilação mecânica 2013, às contraindicações para o uso da VNI absolutas (sempre evitar) podem incluir: Necessidade de intubação de emergência e em casos de parada cardíaca ou respiratória. Relativas (analisar caso a caso risco x benefício): Incapacidade de cooperar, proteger as vias aéreas, ou secreções abundantes, rebaixamento de nível de consciência, falências orgânicas não respiratórias, cirurgia facial ou neurológica, trauma ou deformidade facial, alto risco de aspiração, obstrução de vias aéreas superiores e anastomose de esôfago recente (NICKAS; WACHTER, 2000).
3 MÉTODOS
3.1 Estratégia de Busca
Está revisão foi realizada segundo as recomendações publicadas na declaração Preferred Reporting Items for Sistemmatic Reviews and Meta-Analysis (PRISMA).
Foram utilizados descritores e palavras-chave combinadas para captura de artigos relevantes relacionados ao tema. A pesquisa foi realizada nos bancos de dados eletrônicos: Cochrane Library, MEDLINE (via PubMed), LILACS (via BIREME), SciELO, CINAHL, Web of Science e Scopus. As listas de referências dos artigos incluídos foram verificadas em busca de outros estudos sobre o tema. Foram considerados os estudos que atenderam aos critérios de elegibilidade, sem restrição de idioma ou ano de publicação. Dois revisores (SD e SD) examinaram de forma independente e em duplicata, os títulos e resumos para possível inclusão. Os estudos potencialmente elegíveis foram revisados em texto completo para inclusão. Os estudos que não atenderam os critérios de elegibilidade foram organizados de acordo com o motivo da exclusão e apresentados na Figura 1. Um terceiro revisor foi consultado em casos de divergência ao longo da pesquisa. A avaliação dos estudos foi resolvida por consenso.
3.2 Critérios de Inclusão:
Foram incluídos ensaios clínicos randomizados (ECR) e estudos observacionais (caso controle e coorte).
Consideramos estudos realizados em pacientes com AIDS, que manifestaram sinais de IRpA, em que um dos grupos tenha realizado VNI como tratamento para a IRpA, isoladamente, ou em associação com cuidados médicos usuais. Foram considerados como controle o uso de VMI, oxigenoterapia sem pressão positiva, ou outras terapias que não se assemelham aos princípios da VNI.
3.3 Critérios de Exclusão
Estudos realizados em portadores do vírus HIV sem a presença de AIDS.
3.4 Medidas de Desfecho
Os desfechos primários foram mortalidade por todas as causas, incluindo mortalidade na UTI e hospitalar. Os desfechos secundários incluíram tempo de ventilação mecânica, duração do internamento na UTI e hospitalar.
3.5 Extração dos Dados
Foram extraídas informações resumidas sobre: modelo de estudo, número amostral, características da linha de base, desfechos de interesse, intervenção/exposição, controle, protocolo de intervenção e resultados. Os dados extraídos foram analisados no software Cochrane Review Manager (RevMan) versão 5.3. e apresentados em forma de tabelas e gráficos de floresta. A extração de dados foi realizada por dois revisores independentes, e divergências ajustadas por consenso.
3.6 Avaliação do risco de viés e qualidade de evidência
Foi utilizada a Newcastle-Ottawa Scale (NOS) para avaliação da qualidade dos estudos não randomizados. A qualidade de evidência foi verificada por meio da ferramenta Grading of Recommendatons Assessment, Development and Evaluation (GRADE).
3.7 Análise dos Dados
Os dados extraídos foram expostos em forma de tabela, e quando possíveis, através de metanálise. Para a metanálise, utilizamos odds ratio (OR) e diferença de média com intervalo de confiança de 95% (IC95%), em modelo de efeito aleatório. A heterogeneidade foi avaliada através da inspeção do forest plot, considerando um I² > 60% como sendo substancial heterogeneidade, e I² < 40% como baixa heterogeneidade.
4 RESULTADOS
4.1 Resumo dos resultados
Foram identificados um total de 1286 estudos nas diferentes fontes. Ao final, dois estudos foram considerados adequados para a inclusão. A leitura completa dos possíveis artigos elegíveis identificou 5 estudos, destes, 3 não apresentavam grupo de comparação, sendo assim excluídos. O resumo da pesquisa está demonstrado no fluxograma baseado no PRISMA (Figura 1).
Figura 1 – Fluxograma dos resultados da pesquisa
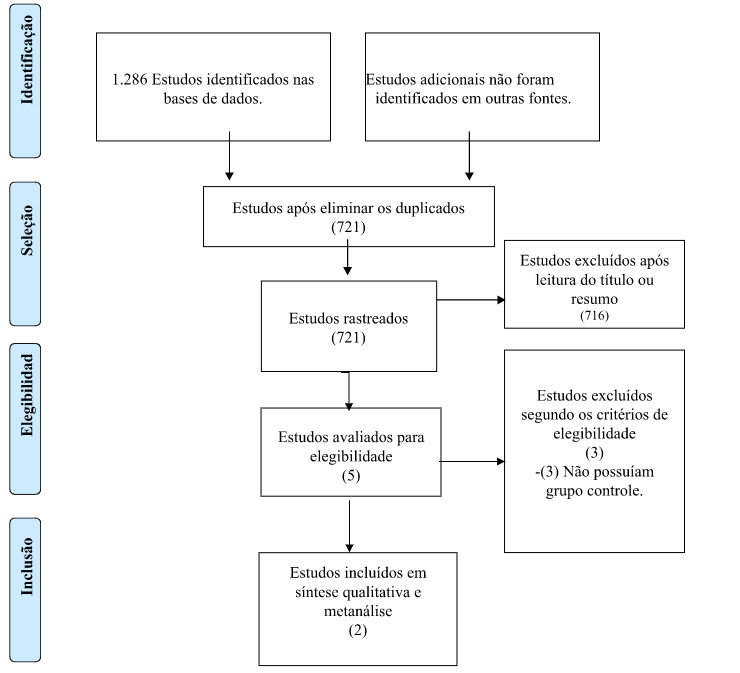
Tabela 1. Características dos estudos incluídos

Nota: VNI = Ventilação não invasiva; VMI = Ventilação mecânica invasiva; CPAP = Pressão positiva contínua nas vias aéreas “continuous positive airway pressure”; PEEP = Pressão expiratória final positiva “Positive expiratory end pressure”; PS = Pressão de suporte; UTI = Unidade de terapia intensiva; n/r = não relata.
Tabela 2. Qualidade dos estudos através da Newcastle-Ottawa Scale.
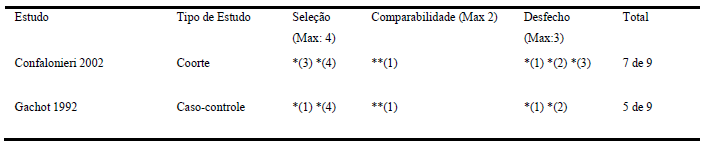
A qualidade dos estudos observacionais, avaliada pela Newcastle-Ottawa Scale, é demonstrada na Tabela 2. Foram observados vieses metodológicos específicos em ambos estudos, com uma maior ocorrência no estudo de Gachot (1992), pontuando 5, entre 9 quesitos.
4.2 Efeitos e qualidade da evidência
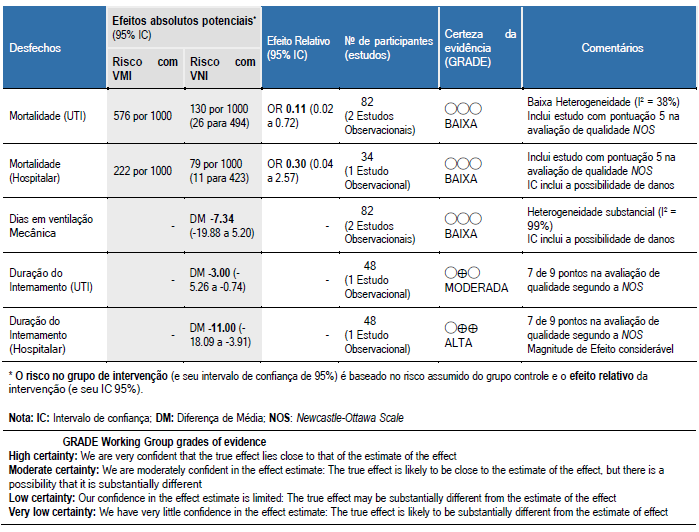
Um resumo dos achados e qualidade da evidência estão relatados na Tabela 3. Os motivos para elevar a qualidade das evidências estão expostos na mesma, bem como informações relevantes para a análise crítica da estimativa de efeito.
Tabela 3. Resumo dos achados (Sumary of Finds Table) baseado na abordagem GRADE
4.3 Desfechos Primários
Mortalidade durante o internamento na UTI foi relatado nos dois estudos incluídos. Os dados agrupados incluíram 82 indivíduos, onde 49 foram tratados inicialmente com VNI, e 33 com VMI. O tratamento com VNI resultou em uma mortalidade na UTI significativamente menor quando comparado a VMI (OR 0,11 IC95% 0,02 a 0,72, p = 0,02).

Figura 2. Forest Plot comparação 1: Mortalidade na UTI
4.4 Desfechos Secundários
Ambos os estudos relataram o tempo médio de ventilação mecânica. Assim como nos desfechos primários, um total de 82 indivíduos foram incluídos na análise, sendo 49 tratados com VNI e 33 com VMI. Não foram observadas alterações significativas na diferença média (em dias), do tempo de ventilação mecânica, entre indivíduos que fizeram VNI e os que fizeram VMI (DM -7,34, IC95% -19,88 a 5,20, p = 0,25), vale ressaltar que a análise fica limitada pelo pouco número de estudos encontrados.

Figura 3. Forest Plot comparação 2: Tempo de ventilação mecânica.
5 DISCUSSÃO
A VNI desempenha um papel importante no manejo de pacientes imunocomprometidos, com grau de indicação nível A em pacientes com insuficiência respiratória (BELLO et al 2018;). No entanto, em um recente estudo de coorte prospectivo multinacional, de 1611 indivíduos imunocomprometidos admitidos por IRpA hipoxêmica, a VNI inicial, comparada com o oxigênio padrão, não foi associada a benefícios clínicos em mortalidade, infecções adquiridas na UTI, duração da ventilação mecânica ou tempo de permanência na UTI (AZOULAY et al., 2018)
Hilbert e associados 2001, compararam a técnica de VNI com o tratamento padrão de oxigênio suplementar, foram inscritos 52 pacientes imunossuprimidos, a maioria deles transplantados de medula óssea, com insuficiência respiratória aguda, febre e infiltrados pulmonares. No grupo utilizado VNI, houve menor necessidade de intubação (12% vs. 20%), menor número de complicações graves (13% vs. 21%), o que levou à menor mortalidade na UTI (10% vs. 18%) e hospitalar (13% vs. 21%) intubação em 67% dos pacientes tratados, associando a melhor sobrevida na UTI (100% vs. 38%; p = 0,003).
Os resultados da metanálise confirmam a hipótese inicial de que pacientes com IRpA decorrente de complicações da AIDS, como a pneumonia pneumocystis, tem uma menor taxa de mortalidade durante o internamento na UTI quando utilizam a VNI como terapia de primeira escolha, quando comparado a VMI (OR 0,11 IC95% 0,02 a 0,72, p = 0,02).
A taxa de sobrevivência em um dos estudos também foi significativamente maior em pacientes que fizeram uso de VNI quando comparados a VMI, após dois meses de internamento hospitalar (58% vs 21%, p = 0,02), e tornando-se semelhante após seis meses (25% vs 16%, p= 0,678) (CONFALONIERI, 2002).
Em contrapartida, a taxa de mortalidade durante o internamento hospitalar, segundo o estudo realizado por Gachot (1992), foi semelhante entre os grupos (OR 0.30, IC95% 0.04 a 2.57, p = 0,27). A qualidade metodológica deste último sugere uma interpretação com cautela. A classificação através da NOS demonstrou possíveis vieses metodológicas nos três domínios propostos.
A escolha entre as duas formas de ventilação mecânica se dá na maioria das vezes em função da gravidade do quadro de IRpA, medido através de sinais como relação P/F (pressão alveolar de oxigênio/ fração inspirada de oxigênio), SpO2 (saturação de oxigênio capilar periférico), PCO2 e PO2, da aceitação do paciente quanto ao uso da interface, e de sinais clínicos usuais na UTI, como instabilidade hemodinâmica ou rebaixamento de nível de consciência (BELLO et al., 2018). Confalonieri (2002) demonstrou não haver diferença entre os grupos (VNI e VMI) no momento da admissão quanto a alguns destes preditores e sinais clínicos, sendo assim, a intubação e consequente VMI ficando a cargo da decisão.
Quanto aos desfechos secundários, ambos os estudos incluídos relataram o tempo de assistência ventilatória mecânica, sendo este não significativo entre os grupos (Figura 3) (DM-7,34, IC95% -19,88 a 5,20, p = 0,25). Tal achado se faz importante no que se diz respeito aos malefícios da VMI, visto que, pacientes submetidos à mesma, pela presença da cânula endotraqueal, e a consequente anulação da proteção das vias aéreas, estão sujeitos a uma maior chance de infecções nosocomiais, como pneumonia associada à ventilação (PAV) (CORRÊA, 2015). Esta combinação, tem maior chance de infecções, com imuno comprometimentos, e podem ser fatais nessa população. Associado a VMI, confalonieri (2002) também demonstrou uma maior taxa de pneumotórax, frequentemente relacionados a altas pressões ventilatórias. Em resumo, o suporte ventilatório não invasivo, mesmo sendo necessário durante um período de tempo similar ao invasivo, sugere menos malefícios ao paciente com AIDS.
6 CONSIDERAÇÕES FINAIS
De acordo com os dados encontrados nos estudos selecionados, o uso da VNI apresenta efeitos benéficos na redução da mortalidade de paciente com insuficiência respiratória aguda com AIDS, entretanto, não demonstrou diferença significativa quanto ao tempo de ventilação mecânica, quando comparado a pacientes que fizeram uso de VMI. A qualidade da evidência foi considerada “baixa” para tais desfechos.
7 REFERÊNCIAS
ANJOS, C. F. D., et al. A randomized trial of noninvasive positive end expiratory pressure in patients with acquired immune deficiency syndrome and hypoxemic respiratory failure.
Respiratory Care, v. 57, n. 2, p. 211–220, 2012.
AZOULAY, E., et al. Effect of High-Flow Nasal Oxygen vs Standard Oxygen on 28-Day Mortality in Immunocompromised Patients with Acute Respiratory Failure: The HIGH Randomized Clinical Trial. Journal of the American Medical Association, v. 320, n. 20, p. 2099–2107, 2018.
BARBAS, C. V., et al. A. Diretrizes brasileiras de ventilação mecânica. 2013. Associação de Medicina Intensiva Brasileira e Sociedade Brasileira de Pneumologia e Tisiologia, p. 1- 140, 2013.
BELLO, G., et al. Noninvasive Options. Critical Care Clinics, v. 34, n. 3, p. 395–412, 2018.
BRASIL, MINISTÉRIO DA SAÚDE. Boletim de Ocorrência de HIV/AIDS. v. 49, n 4, p. 103, 2018.
CALDAS, B., et al. Panorama das Hospitalizações para Tratamento de HIV / AIDS e suas complicações no Brasil : um estudo retrospectivo. Convención Internacional de Salud p. 1– 7, n.3, v42, 2018.
CASTRO, S. D. S., et al. HIV/AIDS case definition criteria and association between sociodemographic and clinical aspects of the disease reported in the State of Minas Gerais from 2007 to 2016. Revista da Sociedade Brasileira de Medicina Tropical, v. 51, n. 4, p. 427–435, 2018.
CHAN, C. N., TRINITÉ, B., & LEVY, D. N. Potent inhibition of HIV-1 replication in resting CD4 T cells by resveratrol and pterostilbene. Antimicrobial Agents And Chemotherapy, v. 61, n. 9, p. e00408-17, 2017
CONFALONIERI, M. et al. Noninvasive ventilation for treating acute respiratory failure in AIDS patients with pneumocystis carinii pneumonia. Intensive Care Medicine, v. 28, n. 9, p. 1233–1238, 2002.
CORRÊA, T. D. et al. Performance of noninvasive ventilation in acute respiratory failure in critically ill patients: A prospective, observational, cohort study. BMC Pulmonary Medicine, v. 15, n. 1, p. 1–8, 2015.
DAVIDSON, A. C., et al. BTS/ICS guideline for the ventilatory management of acute hypercapnic respiratory failure in adults. Thorax, v. 71, n. Suppl 2, p. ii1-ii35, 2016
ESTEVES, F.; ANTUNES, F.; MATOS, O. Pneumocystis e pneumocistose: o agente patogênico e a doença. Revista Portuguesa de Doenças Infecciosas,p. 1-39, v. 10, n. 1, 2014.
FERNANDES, C. R.; NETO R., POSO P. O sistema respiratório e o idoso: implicações anestésicas. Revista Brasileira Anestesiologia, v. 52, n. 4, p. 461-70, 2002.
FRAT, J. P., et al. J.High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. New England Journal of Medicine, v. 372, n. 23, p. 2185–2196, 2015.
FREITAS, M. B. A., et al. Terapia de alto fluxo com cânula nasal na insuficiência respiratória hipoxêmica: uma revisão de literatura. Encontro de Extensão, Docência e Iniciação Científica (EEDIC), p.1-4, v. 3, n. 1, 2017.
GACHOT, B., et al. Continuous positive airway pressure by face mask or mechanical ventilation in patients with human immunodeficiency virus infection and severe Pneumocystis carinii pneumonia. Intensive Care Medicine, v. 18, n. 3, p. 155–159, 1992.
HARRIS, R. Promoting Cardiovascular Health in Patients Living with Human Immunodeficiency Virus/Acquired Immunodeficiency Syndrome. The Nursing clinics of North America, v. 53, n. 1, p. 47-56, 2018
HERNÁNDEZ-CÁRDENAS, C. M., et al. A Multivariate Prognostic Score for Predicting Mortality of Acquired Immunodeficiency Syndrome Patients with Hypoxemic Respiratory Failure and Pneumocystis jiroveci Pneumonia. Revista de Investigación Clínica. v.71, n.5, p. 311-320, 2019.
HILBERT, G., et al. Noninvasive ventilation in immunosuppressed patients with pulmonary infiltrates, fever, and acute respiratory failure. New England Journal of Medicine, v. 344, n. 7, p. 481–487, 2001.
LEHMANN, M. H.; LEHMANN, J. M.; ERFLE, V. Nef-induced CCL2 Expression Contributes to HIV/SIV Brain Invasion and Neuronal Dysfunction. Frontiers in Immunology, v. 10, n. October, p. 1–10, 2019.
MALDONADO, J. O.; MANSKY, L. M. The HIV-1 reverse transcriptase A62V mutation influences replication fidelity and viral fitness in the context of multi-drug-resistant mutations. Viruses, v. 10, n. 7, p. 1–12, 2018.
MANÇO, J. C. Fisiologia e fisiopatologia respiratórias. Medicina (Ribeirão Preto. Online), v. 31, n. 2, p. 177-190, 1998
MATSUNO, A. K. Insuficiência respiratória aguda na criança. Medicina (Brazil), v. 45, n. 2, p. 168–184, 2012.
MORAIS, A. M. F., et al. Profilaxia pré-exposição a HIV–revisão de literatura. Revista de Iniciação Científica e Extensão, v. 2, n. 1, p. 62-68, 2019.
NICKAS, G.; WACHTER, R. M. Outcomes of intensive care for patients with human immunodeficiency virus infection. Archives of Internal Medicine, v. 160, n. 4, p. 541-547, 2000.
OLIVEIRA, R. A. C. Ventilação não invasiva na insuficiência respiratória aguda- Revisão bibliográfica. Instituto de Ciencias Biomédicas Abel Salazar v.1, n1, p. 10-48, 2018.
PÁDUA, A. I. DE; ALVARES, F.; BADDINI MARTINEZ, J. A. Insuficiência respiratória.
Medicina, v. 36, n. 2–4, p. 205–213, 2003.
PINHEIRO, B. DO V.; PINHEIRO, G. S. M.; MENDES, M. M. Entendendo melhor a
Insuficiência Respiratória Aguda. Pulmão RJ, v. 24, n. 3, p. 3–8, 2015.
PIVA, J. P., et al. Insuficiência respiratória na criança. Jornal pediatria, v. 74, n. Supl 1, p. S99, 1998.
RAPPARD, S; HICKEY, J. Just the Berries. Use of CPAP and BiPAP in acute respiratory failure. Canadian Family Physician, v. 47, n. 1, p. 269, 2001.
ROCHWERG, B., et al. Official ERS/ATS clinical practice guidelines: Noninvasive ventilation for acute respiratory failure. European Respiratory Journal, v. 50, n. 4, p. 1-20, 2017.
ŠIMEKOVÁ, K., et al. Clinical course of opportunistic infections— toxoplasmosis and cytomegalovirus infection in HIV-infected patients in Slovakia. Pathogens, v. 8, n. 4, p. 2– 11, 2019.
SCALA, R.; PISANI, L. Noninvasive ventilation in acute respiratory failure: which recipe for success?. European Respiratory Review, v. 27, n. 149, p. 180029, 2018
PAIVA, S. D, S; PEDROSA, N. L.; GALVÃO, M. T. G. Spatial analysis of AIDS and the social determinants of health. Revista Brasileira de Epidemiologia, v. 22, n 1, p1-12, 2019.
TRIGO, D.; B. COSTA, J. HIV: epidemiology, natural course and diagnosis; Diva Trigo.
Revista SPDV, v. 743, n. 4, p. 371–374, 2016.
WANG, T., et al. Noninvasive versus invasive mechanical ventilation for immunocompromised patients with acute respiratory failure: A systematic review and meta- analysis. BMC Pulmonary Medicine, v. 16, n. 1, p. 2-14, 2016.
¹Hospital de Câncer de Pernambuco (HCP)
²Centro Universitário Brasileiro (UNIBRA)
³Centro Universitário Brasileiro (UNIBRA)
4Cooperativa de Ensino Superior Politécnico e Universitário (CESPU)
5Hospital Getúlio Vargas (HGV)
6Centro de Ensino em Saúde (CES)
7Instituto de medicina integral professor Fernando Figueira (IMIP)
8Centro Universitário Faculdade Boa Viagem – UNIFBV
9Hospital de Câncer de Pernambuco (HCP)
10Hospital de Câncer de Pernambuco (HCP)
