REGISTRO DOI: 10.5281/zenodo.7620313
Francinara Neves Rodrigues
Orientador: Anderson Cavalcante Guimarães
RESUMO
O principal objetivo deste trabalho foi analisar a presença de metabólitos secundários e avaliar atividade antioxidante de extratos brutos e frações de resíduo de Sucupira Amarela e Vermelha da família Leguminosae utilizadas pelo setor madeireiro de Itacoatiara. O material vegetal seco e moído foi extraído com etanol 70% sob-refluxo e em seguida concentrado até remoção de todo solvente em evaporador rotatório, o fracionamento do extrato foi feito através de partição líquido-líquido utilizando solventes em ordem crescente de polaridade e os rendimentos determinados. Através das analises de prospecção fitoquímica feitas para os extratos e frações, as duas espécies evidenciaram a presença de constituintes fenólicos, terpenos, saponinas e alcalóides. A avaliação da atividade antioxidante foi realizada pelo método de sequestro de radicais livres DPPH e ABTS, obtendo resultados satisfatórios para as frações acetato de etila e butanolica das duas espécies. Isso demonstra que as espécies estudadas são ricas em compostos fenólicos e apresenta uma forte atividade antioxidante, apresentando grande potencial para aplicação como antioxidante natural.
1. INTRODUÇÃO
Na Amazônia, a família Leguminosae é um dos grupos que apresenta amplo destaque na composição da flora da região. A investigação de extratos obtidos tanto da madeira quanto da casca, sementes e folhas dessas plantas podem conduzir à caracterização e isolamento de metabólitos com atividades biológicas e a novos materiais para a indústria de cosméticos, alimentícia, madeireira e em outras aplicações. Dentre os estudos sobre a composição química da família Leguminosae tem levado a identificação de flavonóides, terpenóides, esteróides, taninos, alcalóides e outros (BARBOSA et al., 2006).
Diversas são as aplicações das leguminosas e subprodutos, principalmente as espécies madeireiras (LOUREIRO et al., 1968; 1979). Em outros casos, produtos oriundos dessas plantas vêm expandindo seu aproveitamento nos últimos anos além da madeira, como o óleo de copaíba, verniz copal, corantes, gomas naturais, taninos, substâncias para uso medicinal e outras (CARREIRA et al., 1996; PIZZI, 1994a; SOUZA; SILVA,1994).
Como primeiro passo, analisar fitoquimicamente os extratos quanto à presença dos grupos ou classes de metabólitos mais relevantes, o que compreende as etapas de isolamento, elucidação estrutural e identificação dos constituintes mais importantes do vegetal. Para a identificação de substâncias, podem-se realizar reações de caracterização diretamente sobre o tecido do material vegetal. (FENGEL; WEGENER,1984; SANTOS, 2003; SIMÕES et al., 2003).
As atividades da fitoquímica podem contribuir significativamente para a concretização de tal programação através da investigação da flora, da divulgação e geração de novos conhecimentos e da formação de recursos humanos qualificados. Possui como finalidade à caracterização estrutural, avaliação de propriedades e investigações biossintéticas de substâncias naturais produzidas pelo metabolismo secundário de organismos vivos (TORSSEL, 1997 apud BRAZ FILHO, 2010).
Acrescenta-se ainda, o fato de não existir na literatura estudos semelhante sobre as espécies descritas, portanto, este projeto, visa o estudo fitoquímico de Enterolobium schomburgkii e Andira parviflora, que, devido à escassez de estudos químicos, torna promissora a busca dos seus perfis químicos associados aos metabólitos secundários e a atividade antioxidante, a fim de agregar valores aos resíduos de madeireiras e conhecimento científico sobre as espécies da família Leguminosae.
2. FUNDAMENTAÇÃO TEÓRICA
De acordo com o APG-Angiosperm Phylogeny Group (2015), a família Leguminosae Adans (Fabaceae Lindl.) é constituída por cerca de 750 gêneros e 19.560 espécies, é a terceira maior família de Angiospermas do planeta, distribuindo-se em três subfamílias: Caesalpinioideae, Mimosoideae e Papilionoideae (LEWIS et al., 2005)
A espécie Enterolobium schomburgkii (Benth) conhecida como faveira, orelha de macaco ou sucupira amarela pertence a família Leguminosae – Mimosoideae, é uma arvore que ocorre em toda Amazônia em florestas altas de terra firme e fornece madeira para ser usada em marcenaria, faqueados, construções gerais, tacos, moveis de boa qualidade (SILVA et al., 2002)
Andira parviflora Ducke é conhecida popularmente por sucupira-vermelha e angelim-vermelho e segundo a base de dados do MOBOT. Essa espécie não apresenta nenhuma sinonímia botânica. A madeira é considerada pesada, com coloração vermelha, apresentando fundo fibroso amarelado/branco. É indicada para ebanisteria, carroceria de caminhão, tábuas de assoalho e carpintaria de interiores (GARCIA, 2013).
Em 2009 foi registrado que a atividade madeireira na Amazônia brasileira processou cerca de 14,2 milhões de m3 de madeira. Desse quantitativo, 5,8 milhões de m3 foram aproveitados pela indústria e 8,4 milhões de m3 de madeira classificada como resíduo (SFB-AMAZON, 2010). As principais espécies encontradas no mercado são: Cedrinho, Louro, Piquía, Sucupira, Marupá, Angelim, Muiracatiara, Marupá, Cumaru, Itaúba e Ipê (ANGELO et al, 2001).
De acordo com o Instituto Brasileiro de Informação em Ciência e Tecnologia – IBICT (2006), um aspecto importante a ser considerado sobre o processamento florestal na Amazônia Brasileira consiste na pesquisa para identificação de novas espécies de madeira, com o objetivo de criar alternativas de uso para proteger a sustentabilidade florestal e diminuir a pressão de corte sobre as essências ameaçadas de extinção.
Os resíduos madeireiros, quando gerenciados de forma correta, podem trazer benefícios econômicos e ambientais para toda a sociedade (RAMOS et al., 2017). Os metabólitos secundários encontrados na madeira agregam valor à mesma e têm-se buscado aplicações para os rejeitos da indústria madeireira. No entanto, há a necessidade do conhecimento do perfil químico da madeira (GRANATO et al., 2005).
Existem milhares de compostos bioativos com propriedades inexploradas na natureza. Quando não se dispõe de estudos dos perfis químicos sobre a espécie de interesse, a análise fitoquímica possibilita identificar os grupos de metabólitos secundários relevantes (FERREIRA E DANTAS, 2014). Muitos desses metabólitos secundários despertaram o interesse de cientistas em estudar a sua estrutura, biossíntese e distribuição. Novas substâncias com finalidade terapêutica são descobertas por meio de diversos processos, tais como: a síntese de novas moléculas, a extração, isolamento e purificação de novos compostos de origem vegetal, a qual se caracteriza como uma fonte inesgotável de substâncias potencialmente ativas como medicamentos (BRITO E BRITO, 1993).
A triagem fitoquímica é um procedimento importante para bioprospecção das espécies vegetais de interesse farmacológico e/ou toxicológico (SIMÕES et al., 2007). Os estudos etnofarmacológicos de espécies da família Leguminosae demonstram atividades biológicas como: analgésica, antialérgica, anti-inflamatória, anti malárica, cicatrizante, antidiarreica, hemoaglutinante, anti-hipertensivo, citotóxica, antioxidante, antimicrobiana, anti-helmíntica, analgésica, hipoglicemiante, diurética, laxativa, expectorante, hepatoprotetor e inibidora da acetilcolinesterase (VIEGAS JUNIOR et al., 2006)
O grande interesse tem sido voltado para o papel do estresse oxidativo e dos radicais livres na etiologia de várias doenças como as cardiovasculares, cânceres, aterosclerose, inflamação e envelhecimento. Nesta perspectiva, existe um grande estímulo relacionado à busca por novas substâncias obtidas de plantas com potencial antioxidante. (YUNES & CALIXTO, 2001 apud PAULA et al., 2015). As substâncias fenólicas oriundas do metabolismo secundário das plantas são bons agentes antioxidantes naturais (ATOUI et al., 2005).
3. MÉTODOS UTILIZADOS
3.1 Coleta, extração de compostos, fracionamentos e secagem dos extratos.
Os resíduos casca de Enterolobium schomburgkii e cerne de Andira parviflora, da família Leguminosae, foram coletados na empresa Mil Madeiras Preciosas Ltda, que opera na região na região de Itacoatiara. Os materiais vegetais foram limpos e levados para a secagem em estufa provida de um sistema de circulação forçada de ar (Nova Ética, modelo 400-8 DF 300°C). Para trituração do material, utilizou o moinho de facas (Solab, modelo SL-031). Para melhor identificação, foi criado um código para cada espécie, sendo o código LSA para a espécie Enterolobium S. e LSV para a espécie de Andira P.
Para o preparo dos extratos aquosos peso 800 g de cada material vegetal triturado e realizou a extração sob refluxo com etanol a 70% e em seguida concentrado em evaporador rotatório. Obteve cerca de 1000 mL de cada extrato aquoso e separou em volumes iguais, para obtenção do extrato bruto e frações. O volume de 500 mL obtido do extrato aquoso foi fracionado através de partição líquido-líquido utilizando solventes orgânicos de polaridade crescente, tais como: hexano (#01), clorofórmio (#02), acetato de etila (#03) e butanol (#04). As frações foram concentradas em rotaevaporadora, levadas ao banho maria a 60 °C (Solab, modelo SL- 156/6).
3.2 Testes colorimétricos de substâncias ativas do extrato bruto e das frações
Caracterização dos constituintes fenólicos: A prospecção fitoquímica em tubos para análise de compostos fenólicos foi realizada seguindo a metodologia de Matos (2009), utilizando reagentes convencionais para detecção de grupos fenólicos, os resultados foram baseados na mudança de coloração após a reação quando comparados com o branco (reagente com água destilada) e branco negativo (somente solução-estoque).
Caracterização de terpenos: O extrato bruto e as frações foram realizados por meio de ensaios utilizando anidrido acético e ácido sulfúrico, e os resultados foram baseados nos surgimentos de coloração após agitação (MATOS, 2009).
Caracterização de saponinas: foi realizada conforme a metodologia de Matos (2009), onde os extratos brutos e as frações foram observados em relação à capacidade de formação de espuma. Em seguida, foram submetidos à hidrólise ácida, banho-maria, neutralização de pH e agitação para observação de precipitados e ausência de espuma.
Caracterização de alcalóides: Os extratos brutos e as frações foram observados em relação à capacidade de formação de precipitados, após reação com a solução Dragendorff (MATOS, 2009).
3.3 Testes de capacidade antioxidante dos extratos
Todas as análises descritas foram realizadas na Faculdade de Ciências Farmacêuticas da UFAM em Manaus sob supervisão do professor Emerson Silva Lima.
Teor de fenóis totais: a concentração de fenóis totais foi quantificada pelo método descrito por Kim et al., (2003) onde o teor fenólico das amostras foi expresso em porcentual comparados com padrão ácido gálico e também como µg equivalente a ácido gálico (µgEqAG) quando comparado à diluição consecutiva do padrão.
Fenóis totais (%) = (Absorbância amostra/ Absorbância padrão) x 100
Atividade sequestrante do radical DPPH: a atividade sequestrante do radical lipossolúvel DPPH foi realizada segundo metodologia utilizada por Burits e Bucar (2000), os cálculos de percentual de inibição (inibição %) foram realizados baseando na absorbância do controle e utilizando o programa Excel.
% inibição = 100-[Absorbância amostra /Absorbância controle] x 100.
Atividade de inibição do radical ABTS: Este procedimento foi realizado baseado na metodologia de SHANTY & MAHANAN, ( 2017), as reações químicas foram observadas e as absorbâncias para cálculo de percentagem de inibição de radicais ABTS.
% inibição = 100-[Absorbância amostra /Absorbância controle] x 100
3.4 Prospecção fitoquímica em placa cromatográfica
A prospecção fitoquímica por cromatografia em camada delgada (CCD) foi realizada seguindo a metodologia de Guimarães (2005), foram preparadas soluções das amostras dos extratos brutos e frações de cada espécie identificadas como: LSA#02, LSA#03, LSA#04, LSA#05, LSV#02, LSV#03, LSV#04, LSV#05, dissolveu-se as amostras com metanol até alcançar a concentração de 30 mg/mL. A CCD foi realizada em placa com gel de sílica com 0,2 mm de espessura com suporte de alumínio (MERCK®), lavadas com metanol e ativadas em estufa a 90ºC, a aplicação foi em spot, variando de 5 µL a 10 µL de cada solução. As eluições foram feitas em cubas de vidro com a fase orgânica de seis sistemas de efluentes testados. Elas foram visualizadas por luz ultravioleta nos comprimentos de onda de 254 e 366 nm e por luz branca. Os reveladores testados foram: np/peg, sulfato cérico e dpph. As análises cromatográficas tiveram como objetivo avaliar o perfil químico e definição de sistemas de efluentes.
4. RESULTADOS E DISCUSSÃO
4.1 Rendimento
O rendimento do extrato bruto e das frações foi calculado através da massa final pela massa inicial do material botânico submetido à secagem. Obtiveram-se os seguintes rendimentos do extrato seco e fracionado, identificados na Tabela 1.
Tabela 1. Rendimento dos extratos secos e fracionados
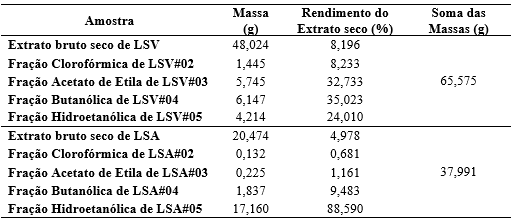
Fonte: Rodrigues, F. N., 2019
Obteve um total de 65,575 g de toda a extração de LSV e 37,991 g de toda extração de LSA partindo de uma massa inicial de 800 g, as frações com maior rendimento foram: LSV#04 (fração butanólica) e LSA#05(fração hidroetanólica).
4.2 Caracterizações dos constituintes fenólicos nos extratos brutos e frações
Segundo Matos (2009), cada fenólico difere-se em relação à coloração do meio, onde, torna-se possível a indicação dos constituintes presentes nas amostras. Na Tabela 2 estão os resultados para compostos fenólicos das espécie Enterolobium schomburgkii – LSA e Andira parviflora – LSV.
Tabela 2. Resultados para os testes de compostos fenólicos nas espécies LSA e LSV.
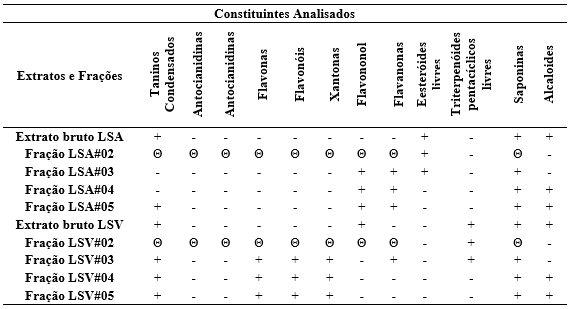
Legenda: + : Indicativo de presença; – : Indicativo de ausência; Θ: não houve teste nesta amostra.
Fonte: Rodrigues, F. N., 2019
Teste para fenóis e taninos: o extrato bruto de LSA e fração LSA#05 assim como extrato bruto de LSV e as frações LSV#03, LSV#04, LSV#05 evidenciaram coloração esverdeada com precipitado escuro. Segundo Matos (2009), esse resultado indicou a presença de taninos condensados.
Os taninos são caracterizados como compostos fenólicos de alto peso molecular, que precipitam proteínas. Várias espécies de leguminosas apresentam alto teor de taninos, principalmente no cerne e na casca (COUTO et al., 1999). A ação dos taninos está relacionada à precipitação de proteínas, os taninos propiciam um efeito antimicrobiano e antifúngico (CASTRO et al., 1999 apud LEITE et al., 2014)
Teste para Antocianidinas, antocianinas e flavonoides: em todas as amostras testadas com solução em pH 3, não foi possível detectar a classe de metabólitos (antocianidinas e antocianinas), devido à falta da coloração vermelha, que caracteriza esses constituintes. Constant (2003) afirma que soluções de antocianina apresentam uma coloração vermelha mais intensa em pH abaixo de 3,0 e que aumentando para a faixa de 4,0 a 5,0 essa coloração tende a desaparecer.
A ocorrência de resultados negativos não significa a ausência dos grupos químicos na planta, alguns fatores, como o solvente utilizado na fase de extração, as baixas concentrações das substancias nos tecidos vegetais ou até mesmo a interferência de outros constituintes na formação das cores durante os testes podem inviabilizar a detecção por reações qualitativas (ALMEIDA, et al., 2015).
O estudo fitoquímico realizado por Leite et al., (2014) com a espécie Bowdichia virgilioides Kunth, pertencente à família Leguminosae e conhecida popularmente como sucupira-preta, revelaram a presença de flavonoides em maior quantidade em todas as partes do vegetal, as análise por HPLC revelou a presença de taninos e flavonóides nas cascas e no cerne, e alcalóides apenas encontrados na casca.
Teste para leucoantocianidinas, catequinas e flavanonas: nas soluções em pH 11, observou-se o surgimento da cor amarela nas seguintes amostras: LSV#03, LSV#04 e LSV#05. Segundo Matos (2009), a cor observada nos tubos sugeriu a presença de flavonas, flavonóis e xantonas. Para o extrato bruto de LSA e as frações LSA#03, LSA#04 e LSA#05 e o extrato bruto de LSV; a coloração vermelha laranja foi evidenciada após a alcalinização das soluções, que segundo Matos (2009) indica a presença de flavono.
Nunes et al. (2006) afirmam que plantas pertencentes à família Leguminosae – Mimosoideae, apresentam flavonóides, geralmente flavonas e flavanonas como principais compostos fenólicos.
Teste para caracterização de terpenos: A presença de esteróides livres foi evidenciada através da coloração verde nas seguintes amostras: LSA, LSA#02 e LSA#03; LSV#02; LSV e LSV#03; obteve-se um resultado preliminar de coloração parda indicando a presença de triterpenóides pentacíclicos livres. Comparando esses resultados com os resultados fornecidos na literatura de Matos (2009), confirmou-se a presença de triterpenóides.
A presença de triterpenóides pentacíclicos livres foi confirmada nos extratos etanólicos da casca do caule e cerne de jurema preta que pertence à família Leguminosae (Fabaceae), enquanto que o resultado do extrato etanólico da folha foi positivo para a presença de esteróides livres (BEZERRA, 2008).
Teste para caracterização de saponinas: em análise para saponinas, após agitação verificou a presença de espuma persistente em LSA, LSA#03, LSA#04 e LSA#05 ; LSV, LSV#03, LSV#04 e LSV#05. A presença de espuma persistente e abundante indica a presença de saponinas (MATOS, 2009).
Os resultados obtidos da presença de saponinas esteroidais na espécie em estudo corroboram com estudos na literatura indicativos da presença de saponinas na família Leguminosae. Testes realizados por Cruz (2016) para a identificação de saponina espumídica apresentou resultado positivo para a amostra do extrato da casca da espécie B. virgilioides Kunth pertencente à família Leguminosae, na qual foi possível observar a formação de uma camada de espuma que teve duração de um período superior a trinta minutos. As saponinas encontradas no extrato de B. virgilioides Kunth apresentam atividade antimicrobiana e anti-inflamatória (SIMÕES et al., 2004 apud CRUZ, 2016).
Teste para caracterização de alcalóides: houve a formação de precipitado insolúvel após adição do reagente de Dragendorff em: LSA, LSA#04 e LSA#05; LSV, LSV#04 e LSV#05. Segundo Matos (2009) o aparecimento de precipitado é indicativo da presença de alcaloides. Denny et al., (2007) reafirma que o aparecimento da formação de precipitado vermelho-alaranjado pode ser considerado resultado positivo para presença de alcalóides.
4.3 Testes de capacidade antioxidante dos extratos
Os resultados do conteúdo de fenólicos totais das dez amostras analisadas encontram-se apresentados na Tabela 3.
Tabela 3. Resultados das análises de capacidades antioxidantes dos extratos.
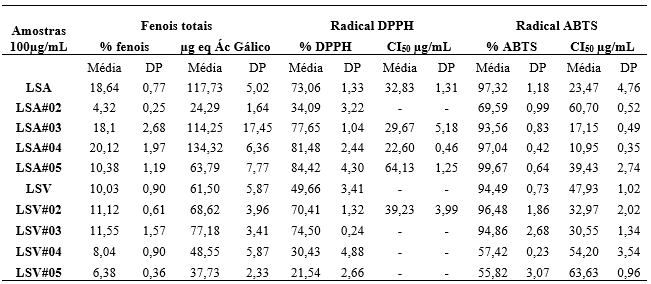
Fonte: Rodrigues, F. N., 2019
Verifica-se que as frações LSA#04, LSA#03, LSV#03 e LSV#02, e os extratos brutos LSA e LSV apresentaram quantidades relevantes de fenólicos totais, com destaque para a fração LSA#04 que obteve a maior porcentagem de fenóis totais com 20,12%. Foi possível observa um menor teor na fração LSA#02 e LSV#05.
Alguns fatores podem afetar o teor destes constituintes fazendo com que, muitas vezes, uma determinada substância ou classe de substâncias se acumule em maior ou menor quantidade (Santos e Martins, 2007). Segundo Moure et al. (2001) fatores como localização geográfica, área da coleta, poluição ambiental, calor e umidade, até mesmo a escolha do sistema de solventes na extração e o rendimento podem influenciar no teor destes constituintes.
Para as análises da capacidade de sequestrar radicais DPPH, os extratos brutos LSA e LSV e as frações LSA#05, LSA#04, LSA#03, LSV#03 e LSV#02, obtiveram os melhores resultados, na presente ordem, enquanto LSA#02 e LSV#05, obtiveram a menor capacidade de ligar-se ao radical.
Todas as amostras analisadas obtiveram uma %ABTS superior a 50%, apresentando alta capacidade de sequestro de radical ABTS.
4.4 Prospecção Fitoquímica em placas cromatográficas
Ao realizar as análises fitoquímicas pela metodologia da Cromatografia em Camada Delgada CCD, utilizou se eluentes de diferentes polaridades. Os sistemas de eluentes testados estão descritos na Tabela 4.
Tabela 4. Eluentes utilizados como fase móvel.
Identificação Composto Proporção Eluente A Acetato de Etila: Acido Fórmico: Ácido Acético: Água 100:11:11:26 Eluente B Clorofórmio: Ácido Acético: Metanol: Água 60:32:12:8 Eluente C Acetato de Etila: Metanol: Água 77:13:10 Eluente D Clorofórmio: Metanol: Água 8:2:0,2 Eluente D1 Clorofórmio: Metanol: Água 7:3:0,2 Eluente E Acetato de Etila: Metanol 95:5
Fonte: Rodrigues, F. N., 2019
Na placa revelada com NP/PEG com os eluentes C e D na fração acetato de etila – LSA#03 (Figura 1), revelaram-se manchas com fluorescência amarela e laranja palido, com Rfs variando de 0,85 a 0,92 sendo colorações características para flavonoides. As frações acetato de etila – LSA#03 e butanólica – LSA#04 revelaram-se manchas com fluorescência marrom e amarela, com Rfs variando de 0,51 a 0,61. Fluorescências de coloração azul foram reveladas em todas as amostras de LSA, revelando o perfil para flavonoides e outros fenólicos. Segundo Vila (2006) as manchas azuis presentes indicam presença de substâncias fenólicas, as quais ocorrem com frequência em plantas com flavonoides.
Na placa revelada com sulfato cérico, observou-se mancha de coloração roxa na fração acetato de etila – LSA#03,com Rfs variando de 0,60 a 0,92 e também o aparecimento de manchas em tons de cinza na fração butanólica – LSA#04 com Rf de 0,25, conforme demonstrado na Figura 1. Segundo Chávez (1997), a cor cinza sugere a presença de açúcares, a cor roxa a presença de terpenos e a amarela de flavonóides.
Com o teste qualitativo utilizando o radical DPPH ocorreu o aparecimento de manchas amareladas em todas as amostras de LSA. A fração acetato de etila – LSA#03 obteve uma maior intensificação das manchas amarelas indicando a presença de substâncias com potencial antioxidante, como pode ser visto na Figura 1. O potencial antioxidante de uma amostra é observado pelo grau de descoloração do radical, de violeta intenso para uma coloração amarelada, característica do produto reduzido (BURRATO, et al. 2011).

Figura 1: Placas de CCD da LSA reveladas com NP/PEG, Sulfato Cérico e DPPH.
Fonte: Rodrigues, F. N., 2019
Nas placas de LSV (Figura 2) reveladas com NP/PEG no extrato bruto de LSV e nas frações acetato de etila – LSV#03 e butanólica – LSV#04 revelava-se manchas com fluorescência amarela, laranja e verde com Rfs que variaram entre 0,8 a 0,9; sendo colorações características para flavonoides. Fluorescências de coloração azul foram observadas em todas as amostras com Rf 0,6 a 0,68 para o efluente A e com Rf 0,3 a 0,35 para o efluente E. A Figura 2 revela o perfil para flavonoides e outros fenólicos para o extrato bruto e frações.
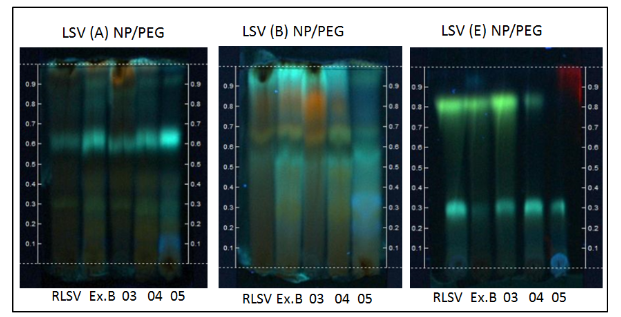
Figura 2: Placas de CCD da LSV reveladas com NP/PEG.
Fonte: Rodrigues, F. N., 2019
O revelador sulfato cérico mostrou manchas marrons intensas na placa utilizando os eluentes E e D1, conforme demonstrado na Figura 3, observa se o aparecimento de manchas escuras sugestivas de substâncias flavonóides em todas as amostra de LSV, com manchas intensificadas no Rf variando de 0,45 a 0,62. O sulfato cérico é empregado para a investigação de substâncias de natureza terpenoides e flavonoides.
Utilizando o radical DPPH ocorreu o aparecimento de manchas amareladas em todas as amostras de LSV. A fração acetato de etila – LSV#03 obteve uma maior intensificação das manchas amarelas indicando a presença de substâncias com potencial antioxidante, como pode ser visto na Figura 3.
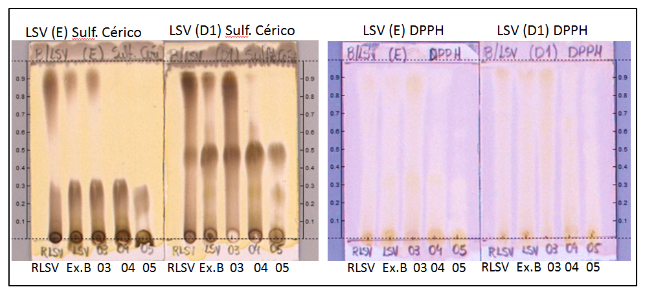
Figura 3: Placas de CCD da LSV reveladas com Sulfato Cérico e DPPH.
Fonte: Rodrigues, F. N., 2019
5. CONCLUSÃO
A análise dos resíduos da casca de Enterolobium schomburgkii e cerne de Andira parviflora, da família Leguminosae, realizada pela Técnica de Prospecção de constituintes químicos e CCD sugere a presença das seguintes classes de metabólitos secundários: taninos, saponinas, flavonóides e alcalóides. Essas informações direcionam estudos futuros para verificação da atividade biológica destes extratos com base na presença de constituintes fitoquímicos realizados. Sendo assim, é importante que se dê continuidade às pesquisas a fim de melhor identificação e elucidação estrutural dos constituintes químicos através de técnicas mais sofisticadas. A similaridade de resultados apresentados na literatura permite persistir na busca por possíveis compostos relacionados à ação farmacológica de E. schomburgkii e A. parviflora. Pode-se afirmar também que nesse estudo, houve uma relação direta entre o conteúdo de fenólicos totais e a capacidade antioxidante das amostras das duas espécies analisadas. As frações que apresentaram os maiores conteúdos de fenólicos totais foram as que apresentaram a maior atividade antioxidante, tanto utilizando os radicais DPPH, como os radicais ABTS, para as duas espécies estudadas.
6. REFERÊNCIAS BIBLIOGRÁFICAS
ALMEIDA, M. H. OLIVEIRA, M. F. F. FALCÃO, A. D. Análise fitoquímica dos extratos hidroalcoólicos da entrecasca e da folha de Pseudobombax marginatum (St. Hill) Rob. Anais do V Encontro Regional de Química & IV Encontro Nacional de Química – Blucher Chemistry Proceedings.v. 3, n. 1, p. 301-308 . São Paulo, 2015.
ANGELO, H. BRASIL, A.; A.; SANTOS, J. Madeiras Tropicais: Análise Econômica das Principais Espécies Florestais Exportadas. Revista ACTA AMAZÔNICA, Ed. 31, pg. 236-348, 2001.Manaus Amazonas.
ATOUI, A.K.; MANSOURI, A.; BOSKOU, G.; KEFALAS, P. Tea and herbal infusions: their antioxidant activity and phenolic profile. Food Chemistry. v. 89, p. 27-36, 2005.
BARBOSA, A.P.; PALMEIRA, R.C.F. NASCIMENTO, C.S.; FEITOZA, D.S.; CUNHA, M.S.C. (2006). Leguminosas florestais da Amazônia central. I. Prospecção das classes de compostos presentes na casca de espécies arbóreas. Instituto Nacional de Pesquisas da Amazônia-INPA. Revista Fitos. v. 1 n. 03. Manaus-AM. Março.
BURATTO, A.; P.; CARPES; T.; S. VECCHIA; D.; P.; LOSS; S.; E. PATRÍCIA APPELT, P. Determinação da atividade antioxidante e antimicrobiana em castanha-do-pará (Bertholletia excelsa). Revista Brasileira de Pesquisa em Alimentos, Campo Mourão (PR), v.2, n.1, p 60-65, jan./jun., 2011.
BRAZ FILHO, R. Contribuição da fitoquímica para o desenvolvimento de um país emergente. Química Nova. v. 33, n. 1, p. 229-239. Rio de Janeiro, 2010.
BRITO, A.R.M.S.; BRITO, A.A.S. Forty yeras of Brasilian medicinal plant research. Journal of Ethnopharmacology. 39: 53-67. 1993.
CARREIRA, L.M.M.; SILVA, M.F.; LOPES, J.R.C.; NASCI-MENTO, L.A.S.; CARREIRA, L.M.M. Catálogo das Leguminosas da Amazônia Brasileira. Manaus: PPG-7- MMA/MCT/FINEP, p.137, 1996.
COUTO, L.C. ; FORTIN, Y.; DOUCET, J.; RIEDL, B.; COUTO, L. Efeito da temperatura de extração no rendimento e no teor de taninos condensados da casca de barbatimão Stryph-nodendron adstringens (Mart.) Coville. Revista Árvore, v.23, n.3, p.333-339, 1999.
FERREIRA, S.B.; DANTAS, I.C.; CATÃO, R.M.R. Evaluation of the antimicrobial activity of the essential oil of sucupira (Pterodon emarginatus). Rev. bras. plantas med. vol.16 no.2 Botucatu abr./jun. 2014.
CHAVES, M.H. Análise de extratos de plantas por CCD: uma metodologia aplicada à disciplina “química orgânica”. Teresina, v. 20, n. 5, Química Nova. p. 560-561, 1997.
GARCIA, G.M.; (2013). Estudo dos Constituintes Químicos dos Resíduos Madeireiros de Andira parviflora, Dipteryx odorata e Swartzia laevicarpa (Fabaceae). Manaus –AM.
LEWIS, G.; SCHRIRE, B.; MACKINDER, B.; LOCK, M. (Eds.) Legumes of the World. Kew. Royal Botanic Gardens, p. 1-7, 2005.
GRANATO, D., NUNES, D.S., MATTOS, P.P., RIOS, E.M., GLINSKI, A., RODRIGUES, L.C., JÚNIOR, G.Z. 2005. Chemical and biological evaluation of rejects from the wood industry. Brazilian archives of biology and technology, 48: 237-241.
KIM, H. J.; PARK, G. M.; KIM, J. K. Anti-inflammatory effect of pristimerin on lipopolysaccharide-induced inflammatory responses in murine macrophages. Archives of Pharmacal Research. v.36, n. 4, P.495-500, 2013.
LEITE L.; H.; I.; TINTINO, S., R.; FIGUEREDO, F.; G.; OLIVEIRA, C.; D.; M.; OLIVEIRA, L.; SIEBRA,A.; L.; A.; SAMPAIO, R.; S.; BOLIGON,A.; A.; SOUZA, D.; O.; ATHAYDE, M.; L.; COUTINHO, H.; D.; M.; COSTA, J.; G.; M.; MENEZES, I.; R.; A.; KERNTOPF. M.; R. 2014. Composição química e estudo da atividade antibacteriana de Bowdichia virgilioides Kunth (Sucupira) – Fabaceae – Papilonoidae. Bol Latinoam Caribe Plant Med Aromat 13(5): 477 – 487, 2014.
LOUREIRO, A.A.; SILVA, M.F.; ALENCAR, J.C. Essências Madeireiras da Amazônia. Manaus: Imprensa Oficial do Estado do Amazonas, v.1, p. 245, v. 2, p. 187, 1979.
LOUREIRO, A.A.; SILVA, M.F.; ALENCAR, J.C. Catálogo de Madeiras da Amazônia. Ministério do Interior, Belém: Superintendência do Desenvolvimento da Amazônia (SUDAM), v.1, p. 433, vol. 2, p. 411, 1968.
MATOS, F. T. (2009). Introdução à Fitoquímica Experimental. Fortaleza: Universidade Federal do Ceará, p. 150.
MOURE, A.; CRUZ, J.; M.; FRANCO, D.; DOMINGUEZ, J.; SINEIRO, J.; DOMINHUEZ, H.; NUNES, M.; L. Natural antioxidants from residual sources. Food Chemistry, v. 72, n.2, p. 145-171, 2001.
NUNES, X.P., Lira, D.P., SILVA, D.A., COSTA, V.C.O., BARBOSA FILHO, J.M.B. Compostos fenólicos e derivado porfírico da fase clorofórmica de Mimosa paraibana Barney. In: 29ª Reunião Anual da Sociedade Brasileira de Química. Anais… Águas de Lindóia – SP, 2006.
PAULA, S. C. DIAS CANTEL, D. C. V. HIROTA, K. C. B. CAMPOS, R. OLIVEIRA, B. V. KALEGARI, M. SILVA, B. C. SILVA, M. G. MIGUEL, G. O. (2015). Potencial Antioxidante in vitro das folhas da Bauhinia Ungulata L. Revista Ciência Farmacêutica Básica Aplicad, 2014; P. 35(2):217-22
RAMOS, W.; F.; ANÁLISE DA INDÚSTRIA MADEIREIRA NA AMAZÔNIA: GESTÃO, USO E ARMAZENAMENTO DE RESÍDUOS. Revista RBCIAMB, n.43; pg. 1-16; mar 2017.
SANTOS, R.; T.; MARTINS, R.; C.; C. Variação Química da Constituição do Óleo Essencial de Cymbopogon citratus (capim limão). Revista PIBIC, Osasco, v.4, n. 1, p. 63-70, 2007.
SILVA, M.F. Revisão Taxonômica do gênero Dimorphandra Schott (Leguminosae – Caesalpinioideae). Manaus, 200p. Tese (Doutorado) – Convênio INPA/FUA, Universidade Federal do Amazonas, 1980.
SIMÕES, C.M.O.; FALKENBERG, M.B.; SANTOS, R.I. Introdução à análise fitoquímica. In: SIMÕES, C.M.O.; SCHENKEL, E.P.; GOSMANN, G.; MELLO, J.C.P.; MENTZ, L.A.; PETROVICK, P.R. (org.) Farmacognosia: da planta ao medicamento. 5.ed. Porto Alegre: Editora Universidade/UFR- GS, p.229, 2003.
SHANTY A.; A .; MOHANAN, P.; V.; Bases heterocíclicas de Schiff como antioxidantes não tóxicos: efeito do solvente, relação de atividade da estrutura e mecanismo de ação. Spectrochim Acta A Mol Espectrosc Biomol; n.192, pg. 181-187, 5 de mar de 2017.
SIMÕES, C.M.O.; SCHENKEL, E.P.; GOSMANN, G.; DE MELLO, J.C.P.; MENTZ, L.A.; PETROVICK, P.R. Farmacognosia: da planta ao medicamento. Ed. 6ª. Editora da UFRGS; Florianópolis: Editora da UFSC. Porto Alegre, 2007.
VILA, C.; F.; Identificação dos Flavonoides com atividade antioxidadnte da cana de açúcar (Saccharum officinarum). Dissertação de Mestrado, Universidade de São Paulo, São Paulo, 2006.
VIEGAS JUNIOR, C.; BOLZANI, V. S.; BARREIRO, E. J.; FRAGA, C. A. M.; CASTRO, N. G.; YOUNG, M. C. M.; ROCHA, M. S.; Espectalina, Cassina e Análogos Semi Sintéticos como Potenciais Candidatos a Fármacos para o Tratamento da Doença de Alzheimer. Rev. Virtual Quim. Vol 2. No. 1, 38-46, 2006.
