UNUSUAL PRESENTATION OF SHEEHAN SYNDROME: CASE REPORT
REGISTRO DOI: 10.5281/zenodo.7544030
Maria Eduarda da Silva e Sá1 2
Daniel da Costa Lins1
RESUMO
Objetivo: Relatar caso clínico de paciente com Síndrome de Sheehan (SS). Relato de caso: paciente feminina, 62 anos, com história de derrame pericárdico e pleural há cerca de 2 meses, além de queixa de dispneia, aumento ponderal e edema de membros inferiores. Apresentava antecedente pessoal de amenorreia há 31 anos após sangramento de grande monta durante parto. História clínica associada a exames laboratoriais e de imagem propiciou o diagnóstico hipopituitarismo secundário à SS. Após início de reposição de hormonal, paciente evolui com melhora clínica.
Conclusões: As possíveis manifestações inespecíficas da SS dificultam o diagnóstico. O tratamento melhora a qualidade de vida, diminuindo a morbimortalidade.
Palavras-chave: Síndrome de Sheehan; amenorreia; dispneia; derrame pericárdico, derrame pleural.
ABSTRACT
Objective: To report a clinical case of a patient with Sheehan Syndrome (SS). Case report: This report describes a case of 62 year-old female pacient, hospitalized because of pericardial and pleural effusion history for about 2 months besides dyspnea, weight increase and bilateral leg edema. She had a personal history of amenorrhea 31 years ago after postpartum hemorrhage. Clinical history added to laboratory and imaging findings led to hypopituitarism diagnosis secondary to SS. After replacement of the deficient hormones the evolution was favorable. Conclusions: The diagnosis of SS typically presents with very non-specific symptoms, demanding diagnostic challenges and delays. Treatment improves quality of life and reduces mortality.
Keywords: Sheehan syndrome, dyspnea, pericardial effusion, pleural effusion, amenorrhea
INTRODUÇÃO:
A síndrome de Sheehan (SS) é caracterizada por hipopituitarismo decorrente do infarto de células da glândula pituitária.1. Estima-se que ocorra em 1-2% de mulheres com perda sanguínea de 1-2 litros durante o parto associado a hipotensão 2. Os avanços na assistência obstétrica reduziram a incidência dessa condição. No entanto, ainda é uma causa significativa de morbidade e mortalidade em países menos desenvolvidos 1. Estudo no vale da Caxemira, no subcontinente indiano, estimou a prevalência de cerca de 3% das mulheres acima de 20 anos. Já em uma análise retrospectiva nacional na Islândia, a prevalência de SS em 2009 foi estimada em 5,1 por 100.000 mulheres 3.
A etiopatogênese ainda não é bem compreendida, porém acredita-se que envolva o alargamento fisiológico da hipófise de cerca de 120-136% durante a gravidez, bem como a interrupção do fluxo sanguíneo arterial para a glândula 4,5. O aumento no volume hipofisário ocorre principalmente pela hiperplasia das células produtoras de prolactina, acarretando maior demanda metabólica pela hipófise anterior sem que haja alteração vascular proporcional. Tais alterações propiciam maior susceptibilidade à isquemia em gestações complicadas por hemorragia pós-parto 1. A interrupção do fluxo sanguíneo pode resultar de vaso espasmo arterial devido à hipotensão grave resultante da hemorragia, compressão vascular devido ao aumento da hipófise e/ou tamanho menor da sela túrcica, trombose primária regional por hipercoagulação ou, ainda, fatores genéticos 5.
Neste relato, apresenta-se um caso de SS com diagnóstico tardio de SS com manifestações inespecíficas e atípicas.
RELATO DE CASO:
Este estudo de caso foi apreciado e aprovado pelo Comitê de Ética em Pesquisa (CEP) (parecer 5.844.284, CAAE 66417322.8.0000.5192), tendo a concordância do paciente com a assinatura do Termo de Assentimento Livre e Esclarecido (TCLE) e o responsável assinou o Termo de Consentimento Livre e Esclarecido e Autorização do Uso de Imagem.
Paciente feminina, 62 anos, hipertensa, com baixo nível de escolaridade, natural e procedente de área rural do estado de Pernambuco, foi hospitalizada em serviço de atenção terciária em saúde e transferida para hospital em capital devido a piora progressiva de dispneia iniciada em 4 meses.
Antes de internamento, havia procurado assistência médica diversas vezes por quadro semelhante, com história de observação de bradicardia, além de derrame pleural à esquerda com necessidade de drenagem, porém sem definição diagnóstica. Relatou, ainda, perda ponderal não quantificada nos últimos meses, náuseas e edema de membros inferiores. Detalhada anamnese revelou história ginecológica e obstétrica pregressa de 5 gestações, 5 partos, além de amenorreia há 31 anos. Sangramento de grande monta no pós-parto de natimorto há 31 anos.
Ao exame físico, estado geral regular, consciente, orientada, hipoativa, emagrecida, bradicardia (44 batimentos/minuto) e pressão arterial 100×70 mmHg. Presença de madarose. O sistema cardiovascular apresentava ritmo cardíaco regular, hipofonese de bulhas cardíacas, sem sopros. Ausculta pulmonar com murmúrio vesicular diminuído em base de hemitórax esquerdo. Extremidades com perfusão, edema em membros inferiores depressível + 1/4 +, simétrico. Ausência de turgência de veia jugular.
Exames laboratoriais evidenciaram hiponatremia (Na 118 mol/L), T4 livre < 0,14 ng/dL (valor de referência – VR 0,78-2,19 ng/dL), TSH 1,14 μUI/mL (valor de referência – VR 0,47-4,68 μUI/mL), prolactina 2,02 ng/ml (VR 5,18-26,53 ng/ml), estradiol <10 pg/mL (VR <10-28 pg/ml), FSH 0,47 mUI/mL (VR 26,72-133,41 mUI/mL), LH 0,11mUI/mL (VR 5,16-61,99 mUI/mL), cortisol sérico 4 μg/100ml (VR 6,2- 23,4 μg/100 ml) e ACTH 16 pg/ml (até 46 pg/ml).
Ecocardiograma trans torácico (ECO-TT) observou derrame pericárdico importante com diâmetro máximo de 3,4 cm relacionado a ventrículo esquerdo e menor diâmetro de 0,9 cm relacionado à câmaras direitas sem repercussão hemodinâmica ou outras alterações. Fração de ejeção preservada (FEVE 66,7%). Janela pericárdica diagnóstica com líquido de aspecto límpido, coloração amarelada, celularidade total 67 células/μL (diferencial de 81 % de mononucleares e 19% de polimorfonucleares), proteínas totais 5,4 g/dL, glicose 59 mg/dL, cultura e pesquisa de bacilo álcool ácido resistente negativos. Anatomopatológico compatível com pericárdio fibroso com alterações inflamatórias mínimas.
Exame de imagem revelou derrame pleural à esquerda, moderado derrame pericárdico (figura 1) sem outras alterações.
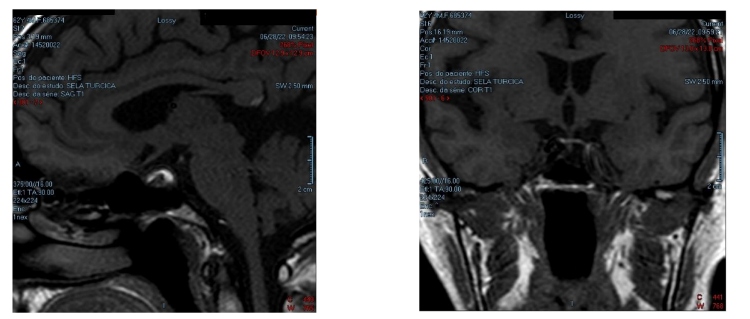
Diante de clínica e exames laboratoriais sugestivos de hipopituitarismo secundário a SS, prosseguida investigação com ressonância magnética (RNM) de sela túrcica com contraste. Imagem evidenciou sela túrcica parcialmente vazia (figura 2 e 3). Baseado em dados clínicos, laboratoriais e imagem, optado por iniciar de reposição hormonal com levo tiroxina associada a prednisona com boa resposta clínica.
Figura 1: Corte transversal de tomografia de tórax com presença de derrame pleural à esquerda e discreto
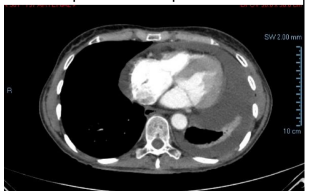
Figura 2 e 3: À esquerda (figura 2), corte sagital de ressonância magnética de encéfalo e à direita (figura 3), corte coronal. Sela túrcica de dimensões aumentadas, apresentando herniação de líquor da cisterna supra-selar para o interior da sela túrcica.
DISCUSSÃO
A necrose isquêmica da adenohipófise secundária a hemorragia pós-parto foi inicialmente descrita por Sheehan em 1937 6. Estima-se que alguma disfunção da hipófise ocorra em cerca de 1/3 de pacientes com histórico de hemorragia pós-parto severa 3. Ainda assim, o reconhecimento da SS pode representar um desafio devido a queixas inespecíficas e à ausência de achados notáveis.
As manifestações clínicas da SS podem ser diversas a depender da extensão e da localização do comprometimento isquêmico hipofisário. Os sinais e sintomas estão associados a diminuição ou ausência da produção de hormônios pela hipófise. O acometimento da adenohipófie é mais comum, podendo haver prejuízo da síntese de hormônios do crescimento (GH), prolactina, hormônio gonadotróficos (FSH, LH), tireotrófico (TSH) e adrenocorticotrófico – ACTH. 4,7.
Já o prejuízo de função da neuro-hipófise é pouco relatado, existindo poucos estudos a respeito 4,8. Estima-se a ocorrência de diabetes insípidos (DI) em 5% dos pacientes com SS 9. Acredita-se que a forma parcial do DI possa ser mais frequente do que se pensava (SOARES; CONCEIÇÃO; VAISMAN, 2008). Estudos indicam que funções neuro-hipofisárias são frequentemente afetadas em pacientes com SS, mas a maioria não apresenta manifestações clínicas. Isso porque a DI se manifesta clinicamente apenas quando a função de mais de 80% dos neurônios magno celulares localizados na neuro-hipófise – responsáveis pelo armazenamento da vasopressina – é perdida 8.
Oligomenorreia ou amenorreia, ondas de calor e/ou diminuição do desejo sexual podem ocorrer devido ao comprometimento de FSH e LH. Hipogonadismo hipogonadotrófico foi relatado em 67-100% das pacientes com SS e, embora raro, a gestação em mulheres com diagnóstico de SS pode ocorrer graças a reserva gonadotrófica 11,12. A insuficiência adrenal secundária a disfunção do ACTH pode apresentar sintomas de fadiga e perda de peso, podendo incluir hiponatremia, anemia e hipoglicemia 1.
Deficiência de GH pode causar alterações na composição corporal, perfil lipídico adverso, aumento da pressão arterial, aumento de alguns mediadores inflamatórios e risco aumentado de doença cardiovascular e mortalidade. Tratamento com GH recombinante em pacientes deficientes mostrou reverter algumas dessas manifestações clínicas, mas sua contribuição para o aumento da expectativa de vida não foi demonstrada 13.
O hipotireoidismo relaciona-se com fadiga, bradicardia, hipotensão, ganho de peso e constipação, juntamente com problemas de concentração ou de atenção.
Diagnóstico do hipotireoidismo central baseia-se em baixos níveis de T4 livre e valores adequados ou baixos de TSH 14. A presença de derrame pericárdico é uma complicação bem reconhecida do hipotireoidismo primário, estando associado ao aumento da permeabilidade capilar e a drenagem linfática lenta contribuem para o derrame pericárdico no hipotireoidismo. Já em pacientes com hipotireoidismo central, é incomum a descrição de derrame pleural, pois classicamente estes pacientes procuram atendimento médico antes do acúmulo importante de líquido pericárdico devido a outras deficiências hormonais 15.
A presença de derrame pericárdico não cursa com sintomas, a menos que evolua para tamponamento cardíaco. Nesse caso acarretará dispneia, taquipneia, taquicardia, bulhas cardíacas hipofonéticas, pulso paradoxal e turgência venosa da jugular 16. O estudo do líquido pode contribuir para elucidação diagnóstica. O líquido pericárdico normal tem as características de um ultrafiltrado plasmático, com celularidade predominante de linfócitos. A aparência macroscópica usual é clara e amarela pálida. Líquido de aparência serossanguinolenta é comum e inespecífico não indicando necessariamente sangramento ativo. Líquido turvo pode sugerir infecção ou malignidade, enquanto fluido grosseiramente sanguinolento pode ser visto em derrames malignos e tuberculosos. Efusões ricas em colesterol ocorrem no hipotireoidismo grave. Uma baixa concentração de glicose aponta para pericardite bacteriana 16. É usual a melhora clínica seguinte a reposição hormonal, porém como a resposta não é imediata e o derrame é quase sempre grande, pericardiocentese pode ser necessária 17.
Agudamente, após evento obstétrico, nossa paciente evoluiu com amenorreia sem apresentar queixa de ausência de amamentação – em decorrência do óbito fetal. Estudo francês, estimou o atraso médio no diagnóstico de 8,3 ± 8 anos para pacientes com amenorreia e 2,52 ± 3 meses para pacientes com agalactia 18. Outras queixas, como astenia, perda de peso e náuseas sugerem insuficiência adrenal secundária a disfunção de ACTH.
Exames laboratoriais podem revelar muitas outras anomalias, incluindo hiponatremia. Este é o desequilíbrio eletrolítico mais comum, ocorrendo em 33-69% dos casos, podendo estar presente por mais de 30 anos após o início da doença 10,19. Dentre os possíveis mecanismos envolvidos na hiponatremia em pacientes com hipopituitarismo estão o hipotireoidismo – causando diminuição da depuração de água livre e subsequente hiponatremia; a deficiência de glicocorticoide também pode diminuir a depuração de água livre, independente da vasopressina; além do próprio estimulo a secreção da vasopressina pelo hipopituitarismo, podendo acarretar secreção inapropriada do hormônio antidiurético e consequentemente hiponatremia 18.
Os critérios clássicos para o diagnóstico de SS envolvem: história obstétrica típica de hemorragia pós-parto grave, com posterior grau variável de insuficiência da hipófise anterior; parcial ou hipopituitarismo completo; associado a sela parcial ou totalmente vazia em exame de imagem 5,10. Apesar do achado de sela vazia ser comum neste distúrbio, a SS é uma causa incomum de sela vazia. Em estudo que analisou 41 mulheres com síndrome da sela vazia, não foi identificado um único caso associado a SS 20. Já em outro estudo com amostra de 50 indivíduos com síndrome da sela vazia, 1de 7 mulheres apresentaram SS 21.
É importante, ainda, descartar diagnósticos diferenciais mais comuns como tumores hipofisários e hipofisite linfocítica, condições não associadas com história prévia de hemorragia no período periparto 5,10. A hipofisite linfocítica trata-se de uma condição inflamatória rara com infiltração linfocítica e destruição do tecido hipofisário normal 10. A história natural da hipofisite é variável, mas pode ser semelhante a longo prazo, isto é, hipopituitarismo permanente e sela vazia. Pequenas diferenças nas características endócrinas foram relatadas, como uma ocorrência de 40% de hiperprolactinemia, além da presença de um distúrbio autoimune coexistente (encontrado em cerca de 20% dos casos) representarem fatores sugestivas de hipofisite – apesar de sua ausência não ser discriminatória. O diagnóstico definitivo da hipofisite prescinde de biópsia 22.
Estudo com 60 pacientes, observou um tempo médio entre o evento obstétrico anterior e o diagnóstico de SS de 13 anos 3. O retardo de 31 anos do diagnóstico da nossa paciente pode ser atribuído a presença de sintomas inespecíficos variados, juntamente com a falta de uma anamnese completa, imprescindível para percepção de uma condição rara. Além disso, outros fatores podem ter contribuído para este atraso diagnóstico, como o baixo nível de escolaridade da paciente e sua procedência de área com limitados recursos humanos e tecnológicos para cuidados continuados em saúde.
A literatura evidencia subdiagnóstico da SS em áreas rurais, principalmente em países em desenvolvimento, onde sintomas clássicos como a galactorreia pós-parto e amenorreia são frequentemente negligenciados 1,5,17.
A principal repercussão clínica do hipopituitarismo é sua associação com aumento da mortalidade, principalmente por doenças cardiovasculares, em comparação com a população normal de mesma idade e sexo, assim como da morbidade. Foi descrito, ainda, uma alta prevalência de fatores de risco cardiovasculares associado ao hipotireoidismo, como obesidade, diabetes, hipertensão ou dislipidemia. A contribuição exata de cada deficiência de hormônio hipofisário para o aumento da morbidade, o excesso de mortalidade ou os benefícios do tratamento substitutivo são desconhecidos13.
Dessa forma, uma vez estabelecido o diagnóstico, é importante instituir tratamento para correção do desequilíbrio endocrinológico presente por meio da reposição vitalícia de hormônios deficientes com consequente restauração da função dos eixos tireoide, adrenal e ovariano 1,6
REFERÊNCIAS
1. Schury MP, Adigun R, Oakland M. Pathophysiology. 2022;3–6.
2. Matsuzaki S, Endo M, Ueda Y, Mimura K, Kakigano A, Egawa-Takata T, et al. A case of acute Sheehan’s syndrome and literature review: A rare but life-threatening complication of postpartum hemorrhage. BMC Pregnancy Childbirth.2017;17(1):1–10.
3. Shivaprasad C. Sheehan′s syndrome: Newer advances. Indian J Endocrinol Metab. 2011;15(7):203.
4. Karaca Z, Laway BA, Dokmetas HS, Atmaca H, Kelestimur F. Sheehan syndrome. Nat Rev Dis Prim. 2016;2.
5. Diri H, Karaca Z, Tanriverdi F, Unluhizarci K, Kelestimur F. Sheehan’s syndrome: new insights into an old disease. Endocrine. 2016;51(1):22–31.
6. Errarhay S, Kamaoui I, Bouchikhi C, Châara H, Bouguern H, Tizniti S, et al. Sheehan’s syndrome a case report and literature review. Libyan J Med. 2009;4(2):81–2.
7. Oyinade Akinyede MD Kenneth Soyemi MD, MPH, MBAupta MPH*. Article in Press Article in Press. Eff grain boundaries paraconductivity YBCO. 2016;1(1):1–.
8. Atmaca H, Tanriverdi F, Gokce C, Unluhizarci K, Kelestimur F. Posterior pituitary function in Sheehan’s syndrome. Eur J Endocrinol. 2007;156(5):563–7.
9. Olmes GL, Solomayer EF, Radosa JC, Sklavounos P, Agne P, Schunk SJ, et al. Acute Sheehan’s syndrome manifesting initially with diabetes insipidus postpartum: a case report and systematic literature review. Arch Gynecol Obstet [Internet]. 2022;306(3):699–706. Available from: https://doi.org/10.1007/s00404- 021-06294-2
10. Soares DV, Conceição FL, Vaisman M. Aspectos diagnósticos e terapêuticos da síndrome de Sheehan. Arq Bras Endocrinol Metabol. 2008;52(5):872–8.
11. Silva ERP da, Castro CCM de. Gestação espontânea em paciente com suspeita de síndrome de Sheehan: relato de caso. Rev Med da UFC. 2018;58(4):71.
12. Pineyro MM, Diaz L, Guzzetti M, Risso M, Pereda J. Acute Sheehan’s Syndrome Presenting with Hyponatremia Followed by a Spontaneous Pregnancy. Case Rep Endocrinol. 2022;2022.
13. Fernandez-Rodriguez E, Bernabeu I, Andujar-Plata P, Casanueva FF. Subclinical hypopituitarism. Best Pract Res Clin Endocrinol Metab. 2012;26(4):461–9.
14. Persani L. Central hypothyroidism: Pathogenic, diagnostic and therapeutic challenges. J Clin Endocrinol Metab. 2012;97(9):3068–78.
15. Boro H, Goyal A, Tandon N. Spontaneous Conception , Pericardial Effusion , and Pseudohypertrophic Myopathy Mimicking Muscular Dystrophy in Delayed Presentation of Sheehan Syndrome. 2020;2020–2.
16. Azarbal A, LeWinter MM. Pericardial Effusion. Cardiol Clin [Internet]. 2017;35(4):515–24. Available from: https://doi.org/10.1016/j.ccl.2017.07.005
17. Mittal A, Ray A, Talupula RM, Sood R. Sheehan’s syndrome presenting as cardiac tamponade. BMJ Case Rep. 2018;2018:2017–9.
18. Genetu A, Anemen Y, Abay S, Bante SA, Mihrete KM. A 45-year-old female patient with Sheehan’s syndrome presenting with imminent adrenal crisis: a case report. J Med Case Rep [Internet]. 2021;15(1):1–5. Available from: https://doi.org/10.1186/s13256-021-02827-0
19. Sert M, Tetiker T, Kirim S, Kocak M. Clinical report of 28 patients with Sheehan’s syndrome. Vol. 50, Endocrine Journal. 2003. p. 297–301.
20. Jara-Albarrán A, Bayort J, De Juan M, Benito C. Spontaneous Partial Empty Sella. A Study of 41 Cases. Exp Clin Endocrinol Diabetes. 1984;83(1):63–72.
21. Brismar K, Efendic S. Pituitary function in the empty sella syndrome. Neuroendocrinology. 1981;32(2):70–7.
22. Dejager S, Gerber S, Foubert L, Turpin G. Sheehan’s syndrome: Differential diagnosis in the acute phase. J Intern Med. 1998;244(3):261–6.
1Hospital Universitário Oswaldo Cruz – Universidade de Pernambuco, Recife – PE
