REGISTRO DOI: 10.5281/zenodo.7362882
Denize Rodrigues de Carvalho1
Prof. MS. Ademilton Costa Alves2
RESUMO
INTRODUÇÃO: A imunoterapia é a utilização de medicamentos para auxiliar o próprio sistema imunológico do paciente a reconhecer e destruir as células cancerígenas de forma eficaz. Determinados tipos dessa terapia são empregados em alguns casos da Leucemia Linfoide Aguda (LLA) e em determinadas situações. A imunoterapia anticâncer com células CAR-T, proveniente da manipulação de linfócitos T do próprio paciente, acrescentando um receptor específico para atingir a célula tumoral, e administrar essa célula modificada para o próprio paciente, pode trazer inúmeros benefícios aos portadores dessa doença maligna.
OBJETIVO: Realizar uma revisão integrativa sobre a imunoterapia com células T em pacientes portadores de leucemias linfoides.
MÉTODOS: A pesquisa foi elaborada por meio de uma revisão bibliográfica, do tipo revisão integrativa, utilizando a base de dados eletrônica: National Library of Medicine (PUBMED); na faixa temporal entre 2016 a 2022; empregando os descritores, na língua inglesa.
RESULTADOS: Com esta pesquisa foi possível observar 187 artigos científicos na base de dados PUBMED, 146 artigos foram excluídos por não atender os critérios de inclusão, restaram 41 artigos para leitura dos títulos e resumos. Posterior a uma leitura minuciosa foram selecionados 18 artigos científicos para leitura de elegibilidade e após leitura completa dos textos foram direcionados como objeto de estudo 11 artigos científicos.
CONCLUSÃO: Pode-se perceber que diante das várias complicações e dificuldades no tratamento da Leucemia Linfoide Aguda, os avanços da imunoterapia direcionada com células T-CAR, vem se mostrando uma técnica eficaz contra a LLA, registrando de forma expressiva percentuais de remissão quase completos dessa doença hematológica maligna.
Palavras-chave: Terapia CAR. Antígeno CD19. Leucemia Linfoblástica.
ABSTRACT
INTRODUCTION: Immunotherapy is the use of drugs to help the patient’s own immune system to effectively recognize and destroy cancer cells. Certain types of immunotherapy are used in some treatments for Acute Lymphoid Leukemia (ALL) in certain situations. Anticancer immunotherapy with CAR-T cells, from the manipulation of the patient’s own T lymphocytes, adding a specific receptor to reach the tumor cell, and administering this modified cell to the patient himself, can bring countless benefits to patients with this malignant disease.
OBJECTIVES: To carry out an integrative review on T-cell immunotherapy in patients with lymphoid leukemia.
METHODS: The research was carried out through a bibliographic review, of the integrative review type, based on the electronic database: National Library of Medicine (PUBMED); temporal range between 2016 and 2022 using the descriptors, in the English language.
RESULTS: With this research, it was possible to observe 187 scientific articles in the PUBMED database, 146 articles were excluded for not meeting the inclusion criteria, 41 articles remained for reading the titles and abstracts, after thorough reading, 18 scientific articles were selected for eligibility reading, after reading the texts in full, 11 scientific articles were chosen as the object of study.
CONCLUSION: It can be seen that that in the face of the various complications and difficulties in the treatment of ALL, the advances in targeted immunotherapy with TCAR cells, have been proving to be na effective techique against ALL, hus displaying almost complete percentages of remission of the disease.
Keywords: CAR Therapy. CD19 antigen. Lymphoblastic Leukemia
1 INTRODUÇÃO
A leucemia é uma doença neoplásica caracterizada pelo acúmulo de leucócitos malignos presente na medula óssea e no sangue. As células leucêmicas causam inúmeras alterações no organismo levando o paciente a apresentar quadros clínicos de anemia, trombocitopenia e infiltração celular em determinados órgãos, como fígado, baço, cérebro e meninges. Há vários tipos de leucemias, que são classificadas de acordo com a rapidez, denominadas aguda ou crônica; e pelo tipo de células afetadas, mieloide ou linfoide (INCA, 2018).
De acordo com a Agência Internacional de Pesquisa sobre o Câncer (IARC), em 2018 a incidência global estimada de câncer foi de 18,1 milhões de casos, e a mortalidade estimada por câncer foi de 9,6 milhões de pessoas. No Brasil, estima-se que aproximadamente 600.000 novos casos de câncer ocorreram anualmente em 2018 e 2019 (SILVA et al., 2019). Esses tipos de neoplasias hematológicas registram manifestações clínicas em 5.920 homens e 4.890 mulheres, embora haja a ciência que essa patologia, inicialmente, em alguns casos, também pode se manifestar de forma silenciosa (BRASIL, 2020).
As manifestações clínicas das leucemias podem ser classificadas de acordo com a rapidez de sua evolução e do tipo de células afetadas, em cada portador desse tipo de neoplasia hematológica. Nos pacientes com leucemias da linhagem linfoide, agudas e crônicas, os sintomas são heterogêneos devido a correlação do comprometimento medular e extracelular com a diminuição da produção das células sanguíneas que podem acarretar quadros de anemia, neutropenia, trombocitopenia. E o comprometimento medular e extracelular quando se trata das leucemias linfoides agudas, os sintomas são heterogêneos, e os mais relatados são: fadiga, letargia, dor óssea (difusa ou localizada) com tendência de se tornar artralgia e/ou artrite, diferentes graus de anemia, perda de peso, neutropenia, trombocitopenia, infiltração dos tecidos pelos blastos, palidez, pirexia e sangramentos (DAVILA et al., 2016).
A confirmação diagnóstica da leucemia é feita com o exame da medula óssea, denominado mielograma. Os casos leucêmicos são identificados através de procedimentos automatizados e microscópicos, permitindo uma avaliação da estrutura celular onde os principais exames complementares utilizados para fins de confirmação da linhagem celular são a Citoquímica; a Análise Citogenética; e ferramentas da
Biologia Molecular (MOREIRA et al., 2021)
Pacientes com leucemia devem ser encaminhados a um hematologistaoncologista para iniciar o tratamento. Os principais tipos de tratamento são a quimioterapia, radioterapia, cirurgia, terapia-alvo, imunoterapia e transplante de células-tronco. A terapia a ser adotada, varia, significativamente, com base no subtipo de leucemia e nos fatores do paciente, por exemplo, idade e comorbidades (CAVALCANTE et al., 2022)
A imunoterapia anticâncer tem apresentado bons resultados, diante de suas diversas vertentes. E uma delas é a transferência de células adotivas (ACT), que retira células imunológicas do paciente, tornando-as capacitadas para combater determinados subtipos leucêmicos. Essa utiliza células T, coletadas do sangue do paciente e isoladas no laboratório, sendo modificadas geneticamente, com o auxílio de um Lentivírus, que modifica seu RNA e ainda são usados como vetores, que liberam os chamados genes do Receptor de Antígeno Quimérico (CAR) para os linfócitos T (CAR-T), com a finalidade de produzir receptores de superfície específicos para antígenos das células cancerosas (OLIVEIRA, 2016).
A “Food and Drug Administration” (FDA), em agosto de 2017, aprovou a primeira terapia CAR-T, chamada Kymriah, que começou a ser utilizada em pacientes, crianças e adultos, com casos de Leucemia Linfoide Aguda (LLA), associada a uma avaliação clínica desses pacientes. Posteriormente, foi aprovada outra vertente terapêutica, a denominada Yescarta, que representa uma geração mais avançada desse tipo de imunoterapia. As principais indicações são para os pacientes com
Leucemia Linfocítica Aguda de células B refratária; e portadores de Linfoma NãoHodgkin (NIH, 2018b).
A imunoterapia é o uso de medicamentos para ajudar o próprio sistema imunológico do paciente a reconhecer e destruir as células cancerígenas de forma eficaz. Alguns tipos de imunoterapia estão sendo bem direcionados para o tratamento da leucemia linfóide aguda, em determinadas circunstâncias. Os princípios da imunoterapia são relevantes como tratamento adjuvante no combate a determinados tipos cancerígenos. Ela apresenta possível capacidade de ser uma das mais específicas para o tratamento do câncer, pois não afeta a maioria das células normais, já que são utilizados antígenos tumorais específicos. A imunoterapia anticâncer consiste na prevenção, inibição ou no aumento da supressão de células malignas.
Atualmente já é considerada como o quarto pilar no tratamento tumoral, sendo considerada como um tratamento adjuvante ou neoadjuvante (MARTHO et al., 2017).
Em relação a imunoterapia com células CAR-T é demonstrado um expressivo avanço na engenharia ligada a campo da Biologia Molecular, pois sua capacidade de manipular os linfócitos T do próprio paciente acrescentando um receptor específico para atingir a célula tumoral, e administrar essa célula modificada para o próprio paciente, podendo reduzir os efeitos colaterais que as terapias convencionais causariam, devido sua destacada especificidade (ABATE-DAGA E DAVIA, 2016).
Diante do exposto o objetivo deste trabalho foi realizar uma revisão integrativa sobre a imunoterapia com células T em pacientes portadores de leucemias linfoides.
2 METODOLOGIA
A pesquisa foi elaborada por meio de uma revisão bibliográfica, do tipo revisão integrativa, com base na base de dados eletrônica: National Library of Medicine (PUBMED), faixa temporal entre 2018 a 2022, utilizando os descritores em inglês, respectivamente: LEUCEMIAS LINFOIDES AGUDAS; IMUNOTERAPIA; e CÉLULAS T; LYMPHOID ACUTES LEUKEMIAS; IMMUNOTHERAPY; and T CELLS.
A coleta de dados foi feita a partir de artigos científicos que estavam correlacionados com o tema, faixa temporal delimitada, objetivos, no período de coleta de 30 de agosto de 2022 a 10 novembro de 2022. Quanto a organização e análise dos dados, a seleção foi realizada a partir de leitura criteriosa dos artigos encontrados nas bases de dados selecionadas, sendo escolhida, exclusivamente, a literatura que atendia aos critérios de inclusão definidos neste estudo, tais como: textos completos e gratuitos, nas línguas portuguesa e inglesa nos últimos 5 anos.
E como critérios de exclusão, foram excluídos os trabalhos que possuíam desajustamentos com a faixa temporal; que não apresentavam texto completo gratuitos; ou em idioma que não fosse o selecionado. Após a identificação dos artigos do referido tema, foi realizada uma leitura exploratória com o objetivo de identificar se o artigo se enquadra na temática.
3 RESULTADOS
Com esta pesquisa foi possível observar 187 artigos científicos na base de dados PUBMED, 146 artigos foram excluídos por não atender os critérios de inclusão, restaram 41 artigos para leitura dos títulos e resumos, após leitura minuciosa foram selecionados 18 artigos científicos para leitura de elegibilidade, após leitura completa dos textos foram direcionados como objeto de estudo 11 artigos, conforme mostra Fluxograma 1 abaixo.
Fluxograma 1 – Fluxograma da Coleta de Dados
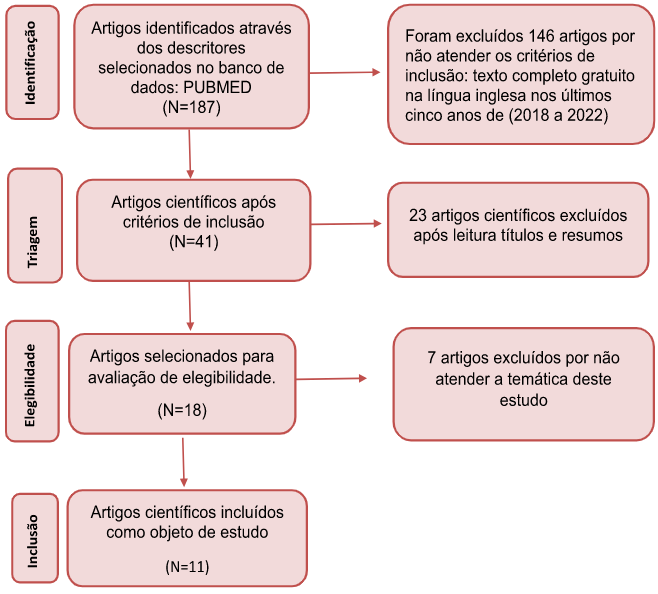
Fonte: Autoria Própria(2022)
Os 11 artigos selecionados, conforme os critérios metodológicos de inclusão e exclusão, estão apresentados no Quadro 1, onde é possível observar a procedência, título do trabalho, autores, periódicos, e as considerações relevantes dos 10 artigos científicos inclusos nesta revisão integrativa.
Quadro 1: Artigos utilizados nesta revisão integrativa
Procedência Título do trabalho Autor Periódico Considerações relevantes do trabalho 1 PUBMED T-Cell Acute Lymphoblastic Leukemia: Biomarkers and Their Clinical Usefulness. Bardeli et al., (2021) Genes (Basel). 2021 Jul 23;12(8):1118. O desafio é que esse subtipo raro de leucemia (LLA) exibe uma ampla gama de complexidade e variabilidade interindividual, identificando assim marcadores prognósticos e preditivos, sendo assim um processo duradouro em grandes cortes de pacientes. 2 PUBMED Unconventional T Cells and Innate Lymphoid Cells to Prevent and Treat Hematological Malignancies: Prospects for New Immunotherapy. Allegra et al., (2022) Biomolecules. 2022 May 27;12(6):754. A alteração de células T não convencionais e células linfóides inatas (ILCs) em frequência e funcionalidade está correlacionada com o aparecimento de várias doenças autoimunes, alergia, inflamação e tumor. Porém, dependendo do quadro fisiopatológico, células T não convencionais podem exibir atividade protetora ou patogênica em uma variedade de doenças neoplásicas. No entanto, modelos experimentais e estudos clínicos têm mostrado que algumas células T não convencionais são potenciais alvos terapêuticos, bem como marcadores prognósticos e diagnósticos. 3 PUBMED Clinical trials of dualtarget CAR T cells, donor-derived CAR T cells, and universal CAR T cells for acute lymphoid leukemia. Zhao et al., (2019) J Hematol Oncol. 2019 Feb 14;12(1):17. O advento de novos agentes direcionados, blinatumomabe, inotuzumabe ozogamicina e células T do receptor de antígeno quimérico (CAR), está mudando o paradigma de tratamento da LLA. As células CAR T direcionadas a CD19 aprovado para o tratamento de LLA de células R/RB e linfoma. Em uma tentativa de reduzir a taxa de recaída e tratar os pacientes recidivantes com perda de antígeno, células T CAR derivadas de doadores e células T CAR de alvo duplo CD19/CD22 estão em ensaios clínicos. Células T CAR universais “prontas para uso” editadas por genes também estão passando por um desenvolvimento clínico ativo. 4 PUBMED CAR T-cell therapy in mature lymphoid malignancies: clinical opportunities and challenges Narkhede et al.,(2021) Ann Transl Med. 2021 Jun;9(12):1036. O advento da terapia quimérica de células T receptoras de antígenos (CAR T-cell) revolucionou o paradigma de tratamento de várias malignidades hematológicas. Desde a sua primeira aprovação para o tratamento de leucemia linfoblástica aguda (lla) em 2017, a terapia com células T CAR tem se mostrado eficaz em várias outras malignidades linfoides, com aprovações recentes em linfoma difuso de grandes células B (DLBCL) e células do manto linfoma (LCM). Embora a terapêutica com células CAR T ofereça uma nova abordagem imunoterapêutica para tratar malignidades refratárias, a infinidade de estudos/produtos e complexidades na fabricação e administração levaram a vários desafios para os médicos e para o sistema de saúde como um todo. 5 PUBMED Comprehensive Overview of Gene Rearrangements in Childhood T-Cell Acute Lymphoblastic Leukaemia. Mroczek et al., (2021) Int J Mol Sci. 2021 Jan 15;22(2):808. A leucemia linfoblástica aguda (LLA) é uma forma relevante de neoplasia infantil, pois representa mais de 80% de todos os casos de leucemia. A LLA de células T constitui um câncer geneticamente heterogêneo derivado de progenitores linfóides T. O diagnóstico de T-ALL é baseado em características morfológicas, imunofenotípicas, citogenéticas e moleculares, portanto, os resultados são usados para a estratificação do paciente. Devido à expressão de antígenos de superfície e intracelulares, vários subtipos de T-ALL podem ser distinguidos. 6 PUBMED Treatment of patients with relapsed or refractory CD19+ lymphoid disease with T lymphocytes transduced by RV-SFG.CD19.CD28.4-1BBzeta retroviral vector: a unicentre phase I/II clinical trial protocol. Schubert et al., (2019) BMJ Open. 2019 May 19;9(5):e026644 As células T do receptor de antígeno quimérico (CAR) despertam esperança para pacientes com neoplasia de células B CD19+, incluindo leucemia linfoblástica aguda (LLA) recidivante ou refratária ou linfoma não-Hodgkin (NHL). Os estudos publicados usaram principalmente CARs de segunda geração com 4-1BB ou CD28 como domínios coestimulatórios. Resultados pré-clínicos de CARs de terceira geração incorporando ambos os elementos mostraram superioridade em relação à longevidade e proliferação. 7 PUBMED Use of CAR T-cell for acute lymphoblastic leukemia (ALL) treatment: a review study. Cancer Gene Sheykhhasan et al., (2022) Epub 2022 Jan 5 as células T geneticamente modificadas com o tratamento do Receptor de Antígeno Quimérico (CAR) para o LLA são amplamente estudadas e representam a nova era da estratégia. De acordo com os ensaios clínicos de Fase I/II, os resultados desta tecnologia parecem muito promissores e podem ser usados no futuro próximo como um tratamento eficaz e seguro para o tratamento da LLA. Nesta revisão, são discutidos diferentes gerações, desafios e estudos clínicos relacionados às células T do receptor de antígeno quimérico (CAR) para o tratamento de LLA. 8 PUBMED Mechanisms of Immune Evasion in Acute Lymphoblastic Leukemia. Pastorczak et al., (2021) Cancers (Basel). 2021 Mar 26;13(7):1536. Os mecanismos pelos quais as células LLA escapam do reconhecimento imunológico e da eliminação pelo sistema imunológico. Focamos nas alterações em todas as células, como a superexpressão de ligantes para vários receptores inibitórios, incluindo receptores antifagocíticos em macrófagos, receptores inibitórios de células NK, bem como pontos de controle imunológico de células T. 9 PUBMED Immunotherapy for Pediatric Acute Lymphoblastic Leukemia: Recent Advances and Future Perspectives. Lv et al., (2022) Front Immunol. 2022 Jun 13; 13:921894 A leucemia linfoblástica aguda pediátrica (LLA) é o subtipo mais comum de leucemia infantil, caracterizada pela proliferação anormal e acúmulo de células linfóides imaturas na medula óssea. Embora a taxa de sobrevida em longo prazo para a LLA pediátrica tenha feito progresso significativo ao longo dos anos com o desenvolvimento de regimes terapêuticos contemporâneos, os pacientes ainda sofrem recaídas, levando a um resultado insatisfatório. Uma vez que o sistema imunológico desempenha um papel importante na progressão e recidiva da LLA, a imunoterapia, incluindo acopladores de células T biespecíficos e células T receptoras de antígenos quiméricos, demonstrou ser capaz de aumentar a resposta imune em pacientes pediátricos com células B refratárias ou recidivantes LLA, e melhorando a taxa de cura da doença e a qualidade de vida dos pacientes, recebendo assim a autorização para comercialização. 10 PUBMED T cells with dual targeting of CD19 and CD22 in pediatric and young adult patients with relapsed or refractory B cell acute lymphoblastic leukemia: a phase 1 trial. Cordoba et al., (2021) Nat Med. 2021 Oct;27(10):1797-1805. Células T do receptor de antígeno quimérico (CAR) direcionadas a CD19 ou CD22 mostraram atividade notável na leucemia linfoblástica aguda de células B (LLA-B). A principal causa de falha do tratamento é a diminuição ou perda de antígenos. O direcionamento duplo do antígeno poderia potencialmente evitar isso, mas a segurança clínica e a eficácia das células CAR T direcionadas para CD19 e CD22 permanecem obscuras. 11 PUBMED Bispecific CAR-T cells targeting both CD19 and CD22 for therapy of adults with relapsed or Daí et al., (2020) J Hematol Oncol. 2020 May 18;13(1):53. A terapia autóloga com células CAR T CD19/CD22 é viável e segura e medeia potente atividade antileucêmica em pacientes com LLA B recidivante/refratária. refractory B cell acute lymphoblastic leukemia. Além disso, o surgimento de perda de antígeno alvo e regulação negativa da expressão destaca a necessidade crítica de antecipar o escape de antígeno. Nosso estudo demonstra a confiabilidade da terapia de células CAR T biespecíficas CD19/CD22 na indução de remissão em pacientes adultos com LLA-B.
4 REVISÃO INTEGRATIVA
De acordo com as pesquisas de Bardeli et al., (2021) novas oportunidades terapêuticas para a Leucemia Linfóide Aguda (LLA), associadas à imunoterapia emergente, ou seja, anticorpos monoclonais (anti-CD33 em T-ALL imaturo ou antiCD30 em casos de expressão de antígeno), ou abordagens de células CART-T ou NK direcionadas contra CD4, CD3, CD1a, tem se tornado promissoras e por isso esperase que os antígenos mudem a perspectiva desse subtipo agressivo de leucemias.
Allegra et al., (2022) evidenciaram que numerosas células participam na regulação da imunidade inata, especialmente as células NK T. Elas têm um impacto crucial na proteção antineoplásica devido à sua capacidade de conduzir a imunidade adaptativa para uma resposta Th1 que é vantajosa para o controle de malignidades. No entanto, também podem afetar negativamente o avanço neoplásico, principalmente, após alterações causadas pelo meio tumoral. Recentemente, várias estratégias para modular e aumentar a eficácia dos efetores da imunidade inata foram sugeridas como um possível tratamento para malignidades hematológicas.
De acordo com Zhao et al., (2019) a imunoterapia com células CAR-T mostra um avanço na engenharia de Biologia Molecular, pois sua capacidade de manipular os linfócitos T do próprio paciente acrescentando um receptor específico para atingir a célula tumoral, e administrar essa célula modificada para o próprio paciente, reduzem os efeitos colaterais que as terapias convencionais causariam, devido sua especificidade.
Sendo assim Narkhede et al., (2021) afirmam que a tecnologia de células TCAR apresenta maior benefício quando comparada com os métodos de tratamento convencionais, uma vez que os efeitos relatados são reversíveis. A qualidade de vida dos voluntários sempre é a prioridade, sobretudo ao que diz respeito a célula tumoral, o que torna o assunto instigante para pesquisadores das áreas de imunologia, oncologia e biotecnologia.
Sobre isso Mroczek et al., (2021) fazem uma ressalva relevante que a toxicidade sucedida da terapia por CAR-T ainda é expressiva. Ocorre uma síndrome de liberação de citocinas (CRS) que é um fato (ou implicação) potencialmente inevitável que foi notado depois da realização de tratamentos com células CAR-T em paciente com LLA, cujo episódio se dá por uma ativação de linfócitos T, que suscita uma liberação excessiva de citocinas. Essa liberação causa respostas inflamatórias sistêmicas, gerando alguns sintomas como febre, mialgia, taquicardia, náusea, vômito, hipoxemia, dentre outros.
Em concordância Schubert et al., (2019) também relatam que em seus estudos as decorrências mais letais provocadas pela síndrome são: falhas renais e hepáticas, coagulação intravascular disseminada e disfunção cardíaca. Contudo, essa síndrome de liberação de citocinas (CRS) pode ser controlada por meio de imunossupressores como tocilizumab, sem acarretar lesões na extensão das células CAR-T ou diminuição de sua atuação no organismo do paciente
Sheykhhasan et al., (2022) ressaltam que apesar de algumas implicações com as células CAR-T, ainda assim são mais beneficentes quando comparados aos tratamentos invasivos como a quimioterapia e a radioterapia, visto que esses efeitos são reversíveis nessa terapia. A qualidade de vida dos pacientes decorrentes dessa técnica também se apresentou mais satisfatórias. De modo que, a imunoterapia com células T-CAR é uma técnica promissora no tratamento da LLA favorecendo muitos pacientes no decorrer dos anos, não apenas no tocante a essa enfermidade, mas também para outros tipos de câncer.
Pastorczak et al., (2021) acrescentam que a imunoterapia é um tipo de tratamento contra o câncer que visa combater o avanço da doença pela ativação do próprio sistema imunológico do paciente. No caso da imunoterapia com as células CAR-T os tratamentos empregados no combate a LLA devem ser absolutamente avaliados a depender do estado clínico do paciente. A fusão de terapia gênica, terapia celular e imunoterapia mostra uma significativa promessa para o futuro do tratamento e cura potencial de pacientes com malignidades avançadas como no caso da leucemia linfoblástica aguda.
Em outro estudo feito por Lv et al., (2022) asseveram que cada categoria de imunoterapia é apresentada a fisiopatologia de sua modulação imunológica, assim como as classes de agentes dentro de cada uma como: as toxicidades baseadas em evidências associadas a cada classe e as implicações para a prática. Por isso as altas taxas de remissão completa e parcial da LLA, possibilitam um aumento considerável da sobrevida comparado a outros tratamentos convencionais. Portanto, o uso de células CAR-T tem se mostrado uma ferramenta poderosa, que permite o foco específico de células malignas por meio de engenharia de células T.
Portanto, Cordoba et al., (2021) em seus estudos reiteram que a esperança para a cura do câncer com células CART-T está em nível elevado produzindo estudos cada vez promissores, invasivos, seguros e estáveis. A motivação aumentada está levando estudiosos a afirmar que em mais duas décadas teremos finalmente a cura do câncer. Espera-se que a terapia celular adotiva de CAR-T se mostre tão eficaz em tumores sólidos como nas indicações para tumores hematológicos.
Diante do exposto, Dai et al., (2020) destacam que é importante que a equipe de saúde que atenderá o paciente portador da LLA, esteja atenta aos medicamentos que têm uso contraindicado antes da aférese para a coleta de linfócitos e/ou antes da infusão do CAR-T; e, ao mesmo tempo, treinada para reconhecimento e manejo de todas as possíveis toxicidades específicas oriundas desse tratamento. No seguimento pós-tratamento, a terapia com células CAR-T pode ser considerada uma terapia definitiva para essas neoplasias hematológicas.
5 CONSIDERAÇÕES FINAIS
Sendo assim diante de tudo que foi exposto pelos autores a respeito da imunoterapia com células T para a Leucemia Linfoide Aguda – LLA, pode-se perceber que há grandes avanços nos resultados, sobretudo em crianças, ao apresentar pesquisas bem promissoras.
Dessa forma diante das várias complicações e dificuldades no tratamento da LLA, os avanços da imunoterapia direcionada com células T-CAR, vem se mostrando uma técnica eficaz nesse tipo leucêmico, exibindo assim percentuais de remissão quase completos da doença.
Ressalta-se ainda sobre os resultados adversos determinados pelo tratamento com esses tipos de células linfoides, que de modo geral são mais benéficos, quando comparados aos tratamentos agressivos da quimioterapia e radioterapia. Com uma decorrente qualidade de vida mais satisfatória aos pacientes submetidos a essa terapia celular.
Uma metodologia tão promissora no tratamento da LLA foi aqui explicitada, pelas pesquisas selecionadas, na imunoterapia com células T-CAR, que enumera expressivos benefícios específicos aos pacientes portadores dessa doença hematológica maligna, mas que continua sendo necessário maiores estudos para fins de elucidar as melhores formas de manejo desse tipo de terapia atual.
REFERÊNCIAS
ABATE-DAGA, D; DAVILA, M. Modelos CAR: modificações CAR de última geração para melhorar a função das células T. Terapia Molecular – Oncolíticos. v.14, n.3, maio, 2016.
ALLEGRA A, CASCIARO M, LO PRESTI E, MUSOLINO C, GANGEMI S. HARNESSING. Unconventional T Cells and Innate Lymphoid Cells to Prevent and Treat Hematological Malignancies: Prospects for New Immunotherapy.
Biomolecules. 2022 May 27;12(6):754. doi: 10.3390/biom12060754. PMID: 35740879; PMCID: PMC9221132.
BARDELLI V, ARNIANI S, PIERINI V, DI GIACOMO D, PIERINI T, GORELLO P, MECUCCI C, LA STARZA R. T-Cell Acute Lymphoblastic Leukemia: Biomarkers and Their Clinical Usefulness. Genes (Basel). 2021 Jul 23;12(8):1118. doi:
10.3390/genes12081118. PMID: 34440292; PMCID: PMC8394887.
BRASIL, Ministério da Saúde. Disponível em: bcc.org.br/leucemia-deve-atingirmais-de-10-mil-pessoas-no-brasil-este-ano/ Acesso em: 23.11.2022
CAVALCANTE et al,. Leucemia linfoide aguda e seus principais conceitos. Acute lymphidleukemia and its main concepts. Revista Científica da Faculdade de Educação e Meio Ambiente. Ariquemes: FAEMA, v. 8, n. 2, jul./dez., 2017.ISSN: 2179-4200.
CORDOBA S, ONUOHA S, THOMAS S, PIGNATARO DS, HOUGH R, GHORASHIAN S, VORA A, BONNEY D, VEYS P, RAO K, LUCCHINI G, CHIESA R, CHU J, CLARK L, FUNG MM, SMITH K, PETICONE C, AL-HAJJ M, BALDAN V, FERRARI M, SRIVASTAVA S, JHA R, ARCE VARGAS F, DUFFY K, DAY W, VIRGO P, WHEELER L, HANCOCK J, FARZANEH F, DOMNING S, ZHANG Y, KHOKHAR NZ, PEDDAREDDIGARI VGR, WYNN R, PULE M, AMROLIA PJ. CAR T cells with dual targeting of CD19 and CD22 in pediatric and young adult patients with relapsed or refractory B cell acute lymphoblastic leukemia: a phase 1 trial. Nat Med. 2021 Oct;27(10):1797-1805. doi: 10.1038/s41591-021-01497-1. Epub 2021 Oct 12. PMID: 34642489; PMCID: PMC8516648.
DAI H, WU Z, JIA H, TONG C, GUO Y, TI D, HAN X, LIU Y, ZHANG W, WANG C, ZHANG Y, CHEN M, YANG Q, WANG Y, HAN W. Bispecific CAR-T cells targeting both CD19 and CD22 for therapy of adults with relapsed or refractory B cell acute lymphoblastic leukemia. J Hematol Oncol. 2020 Apr 3;13(1):30. doi: 10.1186/s13045020-00856-8. Erratum in: J Hematol Oncol. 2020 May 18;13(1):53. PMID: 32245502; PMCID: PMC7126394.
DAVILA, M. L., & SADELAIN, M. Biology and clinical application of CAR T cells for B cell malignancies. International journal of hematology, 104(1), 6-17. 2016 INCA. Instituto nacional do câncer: Leucemia. (2018).
LV M, LIU Y, LIU W, XING Y, ZHANG S. Immunotherapy for Pediatric Acute
Lymphoblastic Leukemia: Recent Advances and Future Perspectives. Front Immunol. 2022 Jun 13;13:921894. doi: 10.3389/fimmu.2022.921894. PMID: 35769486; PMCID: PMC9234114.
MARTHO LJ, DEGASPERI GR, TARSITANO CA. Imunoterapia com células t-car: bioengenharia contra a leucemia linfoblástica aguda CAR-T cells. CuidArte Enferm. 2017
MROCZEK A, ZAWITKOWSKA J, KOWALCZYK J, LEJMAN M. Comprehensive Overview of Gene Rearrangements in Childhood T-Cell Acute Lymphoblastic Leukaemia. Int J Mol Sci. 2021 Jan 15;22(2):808. doi: 10.3390/ijms22020808. PMID: 33467425; PMCID: PMC7829804.
MOREIRA, J.K. HORTON TM, STEUBER CP. Overview of the treatment of acute lymphoblastic leukemia/lymphoma in children and adolescents [Internet]. In: Park, J. R.; Rosmarin, A. G. (Ed.) (Uptodate). 2022
NARKHEDE M, MEHTA A, ANSELL SM, GOYAL G. CAR T-cell therapy in mature lymphoid malignancies: clinical opportunities and challenges. Ann Transl Med. 2021 Jun;9(12):1036. doi: 10.21037/atm-20-5546. PMID: 34277836; PMCID: PMC8267254.
NIH. National Institutes Of Health. CAR T Cells: Engineering Patient’s Immune Cells to Treat Their Cancers. 2018.
OLIVEIRA, T. A. S. Imunoterapia de Células T CAR em Neoplasias Linfoides: Aplicações e Limitações. 2016. 38 f. Dissertação (Mestrado) do Instituto de Ciências Biomédicas Abel Salazar, da Universidade do Porto. Portugal, 2016.
PASTORCZAK A, DOMKA K, FIDYT K, POPRZECZKO M, FIRCZUK M. Mechanisms of Immune Evasion in Acute Lymphoblastic Leukemia. Cancers (Basel). 2021 Mar 26;13(7):1536. doi: 10.3390/cancers13071536. PMID: 33810515; PMCID: PMC8037152.
SCHUBERT ML, SCHMITT A, SELLNER L, NEUBER B, KUNZ J, WUCHTER P, KUNZ A, GERN U, MICHELS B, HOFMANN S, HÜCKELHOVEN-KRAUSS A, KULOZIK A, HO AD, MÜLLER-TIDOW C, DREGER P, SCHMITT M. Treatment of patients with relapsed or refractory CD19+ lymphoid disease with T lymphocytes transduced by RV-SFG.CD19.CD28.4-1BBzeta retroviral vector: a unicentre phase I/II clinical trial protocol. BMJ Open. 2019 May 19;9(5):e026644. doi: 10.1136/bmjopen-2018-026644. PMID: 31110096; PMCID: PMC6530404.
SHEYKHHASAN M, MANOOCHEHRI H, DAMA P. Use of CAR T-cell for acute lymphoblastic leukemia (ALL) treatment: a review study. Cancer Gene Ther. 2022 Aug;29(8-9):1080-1096. doi: 10.1038/s41417-021-00418-1. Epub 2022 Jan 5. PMID: 34987176; PMCID: PMC9395272.
SILVA, et al. Atenção ao câncer no Brasil: estrutura e distribuição geográfica.
Câncer BMC. Disponível em: https://doi.org/10.1186/ s12885-019-6190-3. 2019.
ZHAO J, SONG Y, LIU D. Clinical trials of dual-target CAR T cells, donor-derived CAR T cells, and universal CAR T cells for acute lymphoid leukemia. J Hematol Oncol. 2019 Feb 14;12(1):17. doi: 10.1186/s13045-019-0705-x. PMID: 30764841; PMCID: PMC6376657.
