REGISTRO DOI: 10.5281/zenodo.7292758
Beatriz Lopes Ramos Coelho1, Geórgia Pietra Áppio Lorenzetti1,Priscila Ferreira Silva2
RESUMO
A biópsia embrionária é a retirada de algumas células para a análise genética, chamada de teste genético pré implantacional (PGT). O objetivo deste teste é descartar embriões com alterações genéticas e transferir apenas embriões normais para o útero da futura mãe. Para que o procedimento seja bem sucedido e obtenha resultados confiáveis, a biópsia do embrião deve obedecer a alguns critérios específicos relacionados ao dia de diferenciação celular do embrião, aguardando até a fase de blastocisto. Desta forma, é possível diminuir taxas de aborto espontâneo, evitar o desenvolvimento de doenças genéticas e investigar se o embrião biopsiado carrega alguma doença hereditária já conhecida pela família, evitando assim futuras complicações de saúde. Portanto, se um dos pais tem uma doença genética grave, ou mesmo uma mutação genética relacionada à herança familiar que não gostaria de passar adiante para seus descendentes, o teste genético pré implantacional é recomendado. Como qualquer outro procedimento invasivo, a biópsia embrionária é regida por resoluções respaldadas pelo Conselho Federal de Medicina (CFM), não tendo nenhuma lei cadastrada na legislação brasileira oficialmente.
Palavras chaves: Biópsia embrionária; Teste genético pré implantacional; infertilidade e esterilidade; taxa de implantação; PGT-A; NGS
ABSTRACT
Embryo biopsy is the removal of a few cells for a genetic analysis called Preimplantation Genetic Testing (PGT). This test aims to eliminate embryos with genetic alterations so only normal embryos will be transferred into the future mom’s uterus. In order for the procedure to be successful and follow up to trustworthy results, the embryo biopsy must obey some specific steps related to the cell differentiation day of the embryo, awaiting until the blastocyst phase. Therefore, it is possible to decrease miscarriage rates, avoid the development of geneticdesieses and investigate if the biopsied embryo carries any hereditary desiese previous known by the familly, avoiding future healthy complication. So if one of the parents carries a dangerousgenetic disease or even a genetic mutation of a family history background that they wouldn’t like to pass forward to their descendentes, the preimplantation genetictestingis recommended.As any other invasive procedure, the embryo biopsy is held by Conselho Federal de Medicina (CFM) resolutions, yet without an official registered law on the Brazilian legislation.
Keywords: embryo biopsy; preimplantation genetic testing; infertility and sterility; implantation rate; PGT-A; NGS
___________________________________________________________________
INTRODUÇÃO
A infertilidade é considerada como uma doença que apresenta como critério diagnóstico a impossibilidade de estabelecer uma gestação após 12 meses de relações sexuais frequentes sem a utilização de nenhum tipo de método contraceptivo. A infertilidade feminina é classificada em primária e secundária, sendo a primária relacionada a mulheres que nunca conseguiram engravidar, e a secundária, a mulheres que já tiveram uma gestação, mas não conseguem engravidar novamente. Já a subfertilidade é um termo que anda em conjunto com a infertilidade, e é definida como qualquer grau ou forma de fertilidade restrita (ou reduzida multifatorial) em casais que não tiveram sucesso ao tentar ter um filho. Já a esterilidade é o estado permanente de infertilidade (BORGHT; WYNS, 2018).
Casais do mundo todo tem dificuldades para conceber, estima-se que a infertilidade conjugal alcance de 10% a 15% nos casais com idade reprodutiva da população mundial, com uma função crescente de acordo com a idade dos futuros pais. Essa porcentagem vem aumentando ao longo dos anos devido diversas causas multifatoriais. De acordo com estudos a prevalência da infertilidade indica que 8% a 10% dos indivíduos em idade reprodutiva e um em cada seis casais têm problemas de fertilização. O aumento da busca pelas técnicas de reprodução assistida está ligada diretamente com o adiantamento da gravidez, uso de contraceptivos por grandes períodos, pela facilidade de contrair as doenças sexualmente transmissíveis, infecções genitias, consumo de drogas, álcool, abortos provocados, histórico de endometriose (tanto pessoal quanto familiar), anorexia, apendicite supurada, disfunção tubária, fator cervical, insuficiência luteínica, ovários policísticos, e distúrbios hormonais, todos esses fatores podem levar à infertilidade (FÉLIS; ALMEIDA, 2016).
A infertilidade masculina é responsável por aproximadamente 30% dos casos de infertilidade em casais que estão tentando engravidar. Nas mulheres, uma das causas mais comuns de infertilidade é a infertilidade secundária, quadro que ocorre muitas vezes devido a infecções do trato reprodutor. Para mulheres a partir de 30 anos as chances de uma gravidez espontânea já começam a diminuir, e muitas vezes isso está relacionado com a diminuição da reserva ovariana e/ou outras doenças que estão relacionadas com a infertilidade, dentre elas: hipogonadismo hipogonadotrófico, falência ovariana, síndrome do ovário policístico, endometriose, pólipos endometriais, sêmen com baixa qualidade (BORGHT; WYNS, 2018).
O teste genético pré-implantacional (PGT) é de extrema relevância quando se trata de infertilidade masculina, doenças genéticas conhecidas na família, abortos de repetição e mulheres com idade materna avançada, utilizada pela primeira vez na década de 90, esta técnica consiste na análise genética de células coletadas de um embrião (DAHDOUH et al., 2015).
Para prosseguir com a implantação, existe a opção de realizar uma avaliação para saber se o embrião pertence ao grupo de embriões livres de mutações gênicas. Sendo assim, é de suma importância a realização de diagnóstico pré implantacional, que aprimora a redução dos riscos em gerar um descendente com algum tipo de doença genética e como consequência disso há a redução de interrupções gestacionais (HARTON et al., 2010; BREZINA; KUTTEH, 2015).
O Diagnóstico Genético Pré-Implantacional (PGT), tem o propósito de ser uma técnica capaz de aumentar as chances de uma gestação viável. É uma fonte derivada dos procedimentos de Reprodução Humana Assistida (RHA), onde é feito um exame genético realizado em células embrionárias antes que a futura mãe receba o embrião. (GARDNER; SUTHERLAND; SHAFER, 2012). Este procedimento é sugerido pela sua eficiência na seleção de embriões, com um maior potencial de implantação e aumento nas taxas de nascimento de crianças.(GARDNER; SUTHERLAND; SHAFER, 2012). O PGT se sobressai dentre os outros métodos por usar a tecnologia NGS (Next Generation Sequencing) ou também nomeada de sequenciamento de nova geração para analisar simultaneamente o sequenciamento de milhares de pequenos fragmentos de DNA. Os principais tipos de PGT são divididos em três: PGT-A (aneuploidias); PGT-M (doenca̧s monogênicas); PGT-SR (rearranjos estruturais) (ZILMER, 2021).
Justificativa
A biópsia embrionária é considerada um avanço na tecnologia reprodutiva, nela é possível investigar a qualidade dos embriões e seleciona os embriões geneticamente normais. A seleção é feita por meio de testes genéticos pré- implantacionais. Com o uso dessa técnica é estimado que gestação com síndromes genéticas sejam menores, taxas de aborto e aumento de taxas de implantação na fertilização in vitro.
(AQUINO; MARTINHAGO; MARTINHAGO, 2013). Fazendo com que casais que tenham maiores chances de abortos, idade materna avançada, presença de anomalia genética familiar, má-formações e falhas repetitivas em outros métodos procurem realizar essa técnica. (COUTINHO, 2022) É importante que o casal escolha essa técnica para um melhor aconselhamento genético e também mais completo.
OBJETIVOS
Geral:
• Ser uma revisão bibliográfica a cerca do assunto de análise genética embrionária em tratamentos de reprodução humana assistida enfatizando sua importância para casais que buscam essa técnica.
Objetivos específicos:
- Descrever quais as técnicas atuais para a realização do PGT;
- Apontar os riscos e benefícios existentes neste procedimento;
- Discutir a diferença de taxas de sucesso entre pacientes que realizam o PGT e casais que optam por não realizá-lo;
- Explicar questões éticas envolvendo o descarte de embriões com alterações genéticas.
MATERIAL E MÉTODOS
Para o desenvolvimento do presente trabalho realizarão -se uma pesquisa de revisão acerca do desenvolvimento da reprodução humana nos últimos anos, com enfoque no tema escolhido. A seleção bibliográfica foi realizada de Abril de 2010 a Novembro de 2022, sendo realizadas buscas nos idiomas inglês e português através das plataformas PubMed, Google
Acadêmico, Elsevier e Scielo, utilizando os seguintes descritores de busca: “Biópsia embrionária”, “Análise genética pré implantacional”, “taxa de implantação”, “mulher E sociedade E gravidez tardia”, “male and female infertility”, “preimplantation genetic testing”, as siglas “PGT (preimplantationgenetic testing)” e “PGD (preimplantation genetic diagnosis)”, com base nas terminologias cadastradas na Biblioteca Virtual em Saúde (BVS).
Como critério de inclusão, delimitaramse os artigos referentes ao tema publicados no período de 2010 a 2022 nos idiomas selecionados. Durante a pesquisa foram levantados dados de monografias, livros e dissertações de mestrado, todos especializados no tema proposto. Foram excluídos os artigos não originais, publicações anteriores ao ano de 2010, estudos em animais e artigos que não tratavam sobre a temática desejada ou que não continham informações relevantes.
DESENVOLVIMENTO
A biópsia embrionária
A biópsia embrionária consiste na remoção de algumas células do embrião para que, através dessas células retiradas, seja feito o PGT com o intuito de obter um diagnóstico confiável em relação a alterações genéticas e cromossômicas em embriões formados durante ciclos de fertilização in vitro (FIV). Para que seja feita a extração de algumas células do blastocisto é necessário que ocorra a abertura na zona pelúcida, que é um envoltório glicoproteico do embrião, com o auxílio de um laser infravermelho. A biópsia embrionária pode ser realizada em embriões em seu primeiro, terceiro e quinto dia de evolução, mudando assim a quantidade de perda na massa celular, então buscando os melhores resultados o presente trabalho destacará a análise de embriões de cinco dias, também conhecidos como blastocistos. Nos embriões em fase de blastocisto é possível que haja a extração de cinco a dez células da trofoectoderma, região do embrião que dá origem às estruturas da placenta, sendo assim, não é necessário interferir em células da massa celular interna, que é a região do embrião que dará origem ao futuro bebê (PIZZATO et al., 2017; MAGGIULLI et al., 2019).
Figura 1:Procedimento de retirada de células da região do trofoectoderma do blastocisto para realização do PGT.
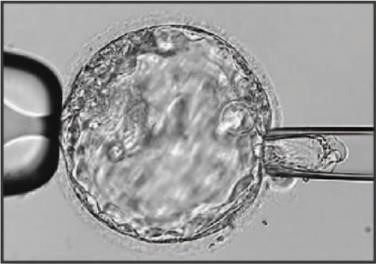
Fonte: Retirado de SULLIVAN-PYKE; DOKRAS, 2018
Teste genético pré-implantacional
A primeira técnica usada para avaliar a qualidade de embriões durante um tratamento de FIV era baseada em sua morfologia, através de visualização no microscópio e classificação com notas de acordo com sua aparência. Porém, há alguns anos, com a evolução das técnicas em RHA, o foco se voltou para metodologias mais avançadas e específicas, como o Teste Genético Pré-Implantacional para Aneuploidias (Preimplantation Genetic Testing For Aneuploidy -PGT-A), o Teste Genético PréImplantacional para Doenças
Monogênicas (Preimplantation Genetic Testing for Monogenic Disorders – PTG-M) e o Teste Genético PréImplantacional para Rearranjos Estruturais (Preimplantation Genetic Testing for Structural Rearrangements – PGT-SR) (PENZIAS et al., 2018).
Essas variações de testes analisam se o embrião possui a quantidade correta de cromossomos, ou seja, se o embrião é euplóide; investiga nos genes do embrião se ele possui alguma alteração específica, previamente conhecida, ou se há qualquer alteração na estrutura dos cromossomos, ocasionadas por quebras cromossômicas, seguidas ou não, de reconstituição de maneira errônea. Várias técnicas moleculares, como o NGS (Next Generation Sequencing), têm sido utilizadas durante tratamentos de FIV para verificar a quantidade de cromossomos nos embriões, para que somente os euploides sejam transferidos para o útero das mulheres em processo de RHA (PENZIAS et al., 2018). Esta técnica tem como objetivo estudar o genoma, lendo fragmentos de DNA selecionados para enformar um painel genético que apontará os resultados referente a doenças genéticas, checando anormalidades nos números e estruturas cromossômicas e também mutações nos genes. É uma técnica com alta sensibilidade e especificidade, com baixa taxa de resultados inconclusivos (NEXT-GENERATION SEQUENCING AVALIA A SAÚDE DO EMBRIÕES E PODERÁ SUBSTITUIR ACGH, 2015).
O intuito principal do PGT é avaliar embriões antes de serem transferidos para o útero, para que apenas os identificados como saudáveis cheguem à etapa de transferência embrionária. Enquanto o PGT-M é feito para a investigação de alterações que envolvem apenas um gene, a técnica de PGT-A é mais abrangente e avalia se há uma aneuploidia, ou seja, variações no número esperado de cromossomos (46 para a espécie humana) já a técnica de PGT-SR é capaz de identificar inserções, deleções, translocações e inversões, identificando rearranjos estruturais em todos os cromossomos. Independentemente de qual categoria de PGT seja realizado, existe a possibilidade de resultados falsopositivos ou falso-negativos, e os pacientes devem estar cientes de que mesmo com resultados considerados normais, não há garantia de que nasça uma criança livre de anormalidades genéticas, uma vez que a alteração pode ocorrer durante a fase de desenvolvimento embrionário. É recomendado que todos os pacientes em ciclos de FIV sejam orientados a realizar o PGT-A, mesmo já tendo realizado PGT-M ou PGT-SR (ACOG, 2020).
Métodos mais frequentes na prática clínica
O PGT-SR é a técnica utilizada para estudar rearranjos cromossômicos estruturais, como as translocações. Os principais rearranjos identificados são translocações do tipo inversão, robertsoniana e recíproca. O objetivo da aplicação desta técnica é estabelecer uma gestação em que não haja esse tipo de anormalidade, e é através deste tipo de investigação que se torna possível identificar por exemplo a ocorrência de rearranjos cromossômicos balanceados nos genitores. É importante reforçar que os pais podem não apresentar nenhum tipo de sintoma em decorrência da alteração cromossômica que possuem; são indivíduos saudáveis antes de tentarem a gestação e não sabem que são portadores de alterações (BUTLER et al., 2019; MATEU-BRULL et al., 2019).
A tecnologia do PGT-M visa o sucesso de uma gravidez que não seja afetada por características genéticas específicas para distúrbios monogênicos como a anemia falciforme ou a fibrose cística. Também pode ser usada na seleção de embriões para transferência, nos casos em que seja necessária a produção de descendentes compatíveis com irmãos afetados por determinada doença que requer transplante de células-tronco (STOCK-MYER; JOHNSON, 2018; BUTLER et al., 2019).
Já a técnica de PGT-A consiste em identificar embriões com a quantidade normal de cromossomos durante ciclos de FIV para que apenas embriões euploides cheguem à etapa de transferência embrionária. Uma vez que os embriões com número de cromossomos alterados são descartados, a técnica promove uma maior taxa de implantação e número de nascidos vivos (HOMER, 2019).
O PGT-P é a mais nova técnica de rastreio para assessorar na seleção de células embrionárias, que possuem variantes genéticos em diversos genes, causadores de grande parte da porcentagem de óbitos prematuros, visando que se trata de doenças poligênicas mais frequentes na sociedade como, diabetes tipo I, hipertensão e esquizofrenia, este rastreio está designado a casais que saibam da existência dessas doenças sendo eles portadores ou por casos na família, uma vez que o teste não diagnostica, entretanto, se dá preferência para implantação de embriões onde a probabilidade é baixa de que seja acometido com a doença, é indicado também em casos de adoção, uma vez que se desconhece os descentes do indivíduo (KARAVANI et al., 2019; TREFF et al., 2020).
O teste genético préimplantação não invasivo (Non-Invasive Preimplantation Genetic Test – niPGT) é um método de triagem cromossômica não invasiva (NICS) baseado na sequência do genoma secretado do blastocisto no meio de cultura. Essa nova avaliação genética de embriões ainda está em estudo e ainda não foi validada, mas os testes sugerem que ela pode ser usada na identificação de aneuploidias cromossômicas e anormalidades em casais com ou sem rearranjos cromossômicos, através de uma análise cromossômica combinada do DNA de células livres do embrião. O DNA livre de células identificado é uma mistura de DNA embrionário e materno, dificultando o diagnóstico de embriões em mosaico. Em comparação com os métodos conhecidos, a vantagem é que não há necessidade de retirada de células do embrião, por isso é considerada uma técnica não invasiva, mas ainda experimental, não podendo substituir a biópsia embrionária (FANG et al., 2019; JIAO et al., 2019).
Indicações para a realização de PGT na RHA
É por meio do PGT que os problemas de interrupção gestacional prematura e elevado risco de gerar um embrião com alterações genéticas, podem ser previamente diagnosticados e eliminados. O processo de PGT é recomendado para casais que desejam descobrir ou já sabem da existência de alterações cromossômicas, rearranjos cromossômicos, detectar condições mendelianas, para mulheres que já passaram por repetições de abortos espontâneos, quando já se foi efetuado ciclos de FIV e houve falha e para pacientes acima de 35 anos. Essa técnica mostra eficácia ao eleger embriões de alta potência e chance de sucesso implantacional, aumentando consequentemente a taxa de nascidos vivos. Em casos de casais portadores de rearranjos cromossômicos balanceados, geralmente tem-se relato de repetições de abortamento ou diagnóstico de cariótipos alterados durante o pré- natal, o PGT em casos como este é de grande recomendação. Outro cofator é a idade materna, que eleva as chances de anomalias cromossômicas, nessa situação, o PGT serve como screening para aneuploidias, possibilitando a evolução do embrião com cromossomos adequados. O PGT começou a ter maior solicitação após os anos 90, visto que demonstrava sucesso em diagnosticar e evitar possíveis abortamentos que ocorriam constantemente nas evoluções gestacionais que apresentavam alterações gênicas. O método também faz sucesso em famílias onde a predisposição hereditária ao câncer é por muitas vezes frequente e os pais desejam diminuir o potencial de risco (GARDNER; SUTHERLAND; SHAFFER, 2012; POMPEU; VERZELETTI, 2015).
Inaplicabilidade
Apesar da ideia de que o sucesso de uma gravidez pode aumentar quando se realiza uma análise genética pré implantacional, o dia em que o embrião é biopsiado tem impactos grandes na taxa de implantação. O estudo mostra que embriões biopsiados em estágio de clivagem (6 a 8 células) sofrem uma perda muito significativa de sua massa celular, uma vez que são removidas de 1 a 2 células para a realização do PGT. Homer e colaboradores (HOMER et. al.,2019) mostraram que a taxa de implantação de embriões em estágio de clivagem não biopsiado é de 53% e a de embriões biopsiados é de apenas 31%, o que mostra não ser vantajoso realizar o procedimento antes de cinco dias.
Mosaicismo
O mosaicismo se trata da existência de um número diferente de cromossomos quando se compara diferentes células presentes no mesmo embrião. O mosaicismos foi inicialmente identificado como um fenômeno comum em embriões na fase de clivagem, porém sua prevalência exata no embrião é desconhecida. Acredita-se que o mosaicismo seja um grande confundidor ao se interpretar um resultado de PGT-A, já que embriões com mosaico são frequentemente classificados como “mosaico aneuplóide” ou “mosaico diplóide aneuplóide”, situação na qual em um único embrião são encontradas tanto células diplóides quanto aneuplóides (PENZIAS et al., 2018).
Segundo Penzias et al. (2018) a biópsia feita na região do trofoectoderma para a realização do PGT tem apresentado diversas melhorias na detecção de mosaicismo. Plataformas analíticas, como o NGS agora tem a habilidade de detectar mosaicismo do ponto de vista molecular. Embriões com mosaicismo podem ser implantados e gerar descendentes euploides, porém, também podem resultar em menores taxas de sucesso de implantação. Para (Homer et al. 2019) essa preocupação estava especialmente ligada a pacientes com poucos embriões, devido ao descarte errôneo de embriões utilizáveis por conta da identificação de alterações na análise de células do trofectoderma. Porém, apesar da anormalidade na trofectoderma, 31% dos blastocistos possuem uma massa celular interna euplóide, sem alterações.
Taxa de implantação
Um estudo clínico randomizado controlado (ECRC) avaliou a taxa de implantação de 112 pacientes, todos com idade inferior a 35 anos, fator de infertilidade masculina, sem tratamentos de FIV anteriores. Separando os pacientes em dois grupos, o Grupo A e Grupo B, sendo eles:
GRUPO A GRUPO B 55 casais 48 casais Biópsia de blastocisto e PGT-A Sem análise 425 blastocistos biopsiados (7 embriões por casal) 389 blastocistos morfologicamente normais (8 embriões por casal) 234 aptos 191 de 425 eram aneuploides (descartados) 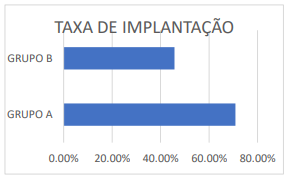
Os resultados mostraram que a taxa de sucesso foi maior no grupo A, cuja porcentagem de gravidez foi de 70,9%, enquanto no grupo B, onde foi levado em consideração apenas a morfologia dos embriões, a taxa de sucesso implantacional foi de 45,8% (YANG et al., 2012).
Um outro ECRC teve como objetivo determinar se a taxa de sucesso entre transferir um único embrião euplóide era equivalente à transferência de dois embriões sem PGT-A, e como benefício, evitar o risco de gestações múltiplas. Neste estudo foi realizado com 205 casais inférteis e as mulheres participantes tinham menos de 43 anos de idade e fator anti mulleriano ≥ 1,2ng/mL. Dividiram-se em dois grupos:
GRUPO TESTE: transferiu 1 embrião euplóide
GRUPO CONTROLE: transferiu 2 embriões de melhor qualidade morfológica, porém sem PGT-A.
Pode-se concluir que mulheres com até 42 anos, transferir um embrião biopsiado resulta em uma taxa de gravidez muito próxima a de transferir dois blastocistos não testados e reduzir os riscos de gravidez gemelar
(FORMAN et al., 2013).
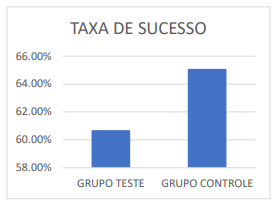
Mais um ECRC, esse feito com casais inférteis em tratamento de FIV cujas mulheres tinham idade entre 21 e 42
anos, realizou a transferência de 134 blastocistos com PGT de 72 diferentes casais (grupo teste), e 163 blastocistos
não testados de 83 diferentes casais (grupo controle). Os resultados demonstraram que a taxa de implantação foi estatisticamente significativa para o grupo teste, onde houve a implantação de 89 embriões dos 134 transferidos, o que corresponde a uma taxa de 66,4% de sucesso. Já o grupo controle teve 78 embriões que implantaram dos 163 transferidos, taxa de 47,9% de sucesso (SCOTT et. al., 2013)
Diagnósticos mais frequentes
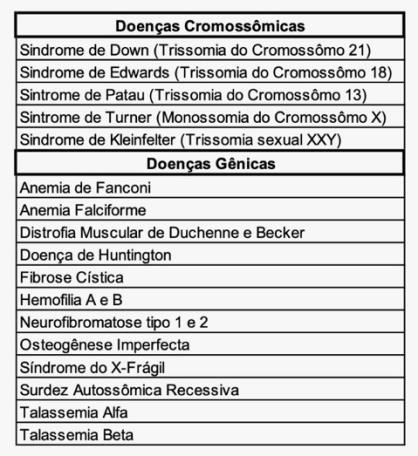
Tendo em vista todas as variações genéticas possíveis, desde as cromossômicas até as gênicas, as mais frequentemente diagnosticadas através de PGT são as aneuploidias, ou seja, a presença de número maior ou menor de cromossomos do que os 46 esperados para uma célula humana. Embriões com aneuploidia geralmente não são adequados para a obtenção de sucesso na implantação, podendo nascer com uma diversidade de sintomas, que envolvem desde deformidades físicas até prejuízo cognitivo-comportamental. A tabela a seguir lista as principais doenças genéticas diagnosticadas por PGT-A e PGT-M (SOUZA et al., 2010).
Quadro 1: Exemplos de doenças detectadas pelos métodos de PGT-A e PGT-M.
Descarte de embriões- questões éticas e regulamentação
No Brasil, a Resolução do Conselho Federal de Medicina (CFM) nº 2.168/2017, que reduz o período de congelamento de 5 anos para 3 anos como período mínimo para autorização do descarte dos embriões, fazendo uma alteração complementar da Lei de Biossegurança (Lei nº 11.105/2005), lei que permite que embriões congelados a 3 anos ou mais possam ser utilizados para pesquisas. Existe um termo de consentimento assinado pelos casais envolvidos em FIV que trata do destino do material biológico armazenado caso uma separação ou morte aconteça com os responsáveis. Neste documento fica acordado que os embriões excedentes só podem ser doados para pesquisa ou para outra pessoa caso este documento de consentimento esteja assinado por ambos (GASDA, 2015; BRASIL, 2017; BENTO et al., 2019).
Em caso de embriões que passaram pelo processo de biópsia embrionária e PGT e foram diagnosticados com alguma alteração genética, é permitido que seja feito o descarte dos embriões sem a necessidade de mantê-los criopreservados por tempo determinado ou que eles sejam doados para pesquisa, contanto que o casal esteja de acordo e documente sua decisão através de um Termo de Consentimento Livre e Esclarecido (BRASIL, 2017).
De acordo com a Resolução CFM nº 2.168/2017 os embriões abandonados, o que ocorre quando os responsáveis romperam os contratos pré- estabelecidos ou não foram localizados pelo estabelecimento ou embriões com idade de criopreservação superior ou igual a três anos poderão ser descartados, entretanto o procedimento deverá ser documentado devidamente através do TCLE.
O Sistema Nacional de Produção de Embriões (SisEmbrio) é o órgão criado pela Agência Nacional de Vigilância Sanitária (ANVISA) para fiscalizar anualmente a manipulação de células reprodutivas em laboratórios no Brasil, tendo como objetivo verificar a quantidade de embriões que foram produzidos, armazenados e congelados. Para que essa verificação aconteça, é necessário que as clínicas de RHA realizem um cadastro na plataforma do SisEmbrio e o não cadastramento pode acarretar em penalidades por infração sanitária. Contudo, a plataforma não pode ser considerada uma forma autêntica para informações, pois deve-se levar em consideração que o fornecimento dos dados armazenados podem não ser íntegros e reais. (MACHADO, 2016; BRASIL, 2017; NETO et al., 2018).
Figura 2
Proporção de embriões descartados categorizados por estados brasileiros.
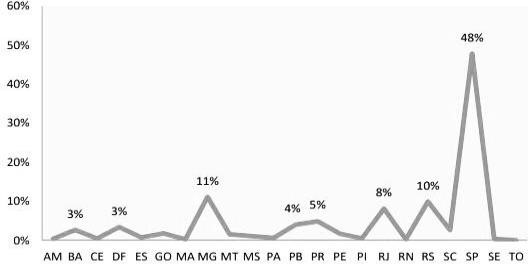
Figura 3: Proporção de embriões criopreservados categorizados por estados brasileiros.
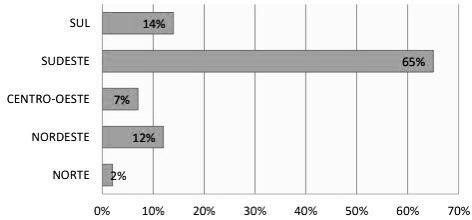
Observando os percentuais acima nota-se que a região Sudeste lidera o percentual de procuras para realização destes procedimentos e criopreservação por possuir uma ampla diversidade de instituições de pesquisas especialistas e desenvolvidas sobre RHA. (LEITE, 2019).
O estudo comparativo das duas situações apresentadas nas Figuras 2 e 3, levantam a quantidade de amostras biológicas criopreservadas e descartadas em todos os estados brasileiro. Como mostra a Figura 2 pertence ao estado de São Paulo, um alto índice de descarte é observado na região sudeste, já ao relacionar as Figuras 3 com a Figura 2, entende-se que a quantidade de embriões descartados equivale a quantidade criopreservada (GRANGEIRO et al.,2020).
De acordo com a Resolução CFM nº 2.168/2017 os embriões abandonados, o que ocorre quando os responsáveis romperam os contratos pré- estabelecidos ou não foram localizados pelo estabelecimento ou embriões com idade de criopreservação superior ou igual a três anos poderão ser descartados, entretanto o procedimento deverá ser documentado devidamente através do TCLE.
Um fator também considerado dentro da mesma resolução é a escolha do sexo, ficando estritamente proibido utilizar a técnica para escolhas em prol da satisfação pessoal, envolvendo características biológicas, exceto se tal escolha possa evitar doenças no possível descendente, que é viabilizada por meio de uma autorização do CFM da jurisdição (GUALBERTO, 2015, BRASIL, 2017).
A resolução mais atual para as normas de reprodução humana aprovada pelo Conselho Federal de Medicina (CFM) é a Resolução 2.320/ 2022. Foi revisada e editada, onde uma das principais diferenças está no descarte. Com a resolução antiga seria necessária uma autorização judicial para o descarte de embriões, porém com a nova aprovação o descarte dos embriões está fora da judicialização. (BRASIL, 2022)
Leis que regulamentam o PGT no Brasil
A regulamentação da técnica de RHA está vinculada ao CFM, pois trata-se de uma questão de saúde pública. Este vínculo ao CFM direciona a execução dos procedimentos em instituições externas, como clínicas de RHA, sendo necessários seguir o código de biossegurança estipulado em território nacional que envolve as práticas de manipulação de materiais biológicos humanos (OLIVEIRA et al., 2018; SANTOS, 2019).
A legislação brasileira é falha quando se trata da tomada de decisões sobre o PGT de forma unilateral. Esta situação deixa claro a importância da implementação da legislação federal para introduzir as diretrizes sobre a execução do diagnóstico préimplantacional e permitindo assim ampliar a atuação neste procedimento a diversos outros profissionais da área da saúde, capacitados à realização dos procedimentos envolvidos (MEDEIROS; VERDI, 2010).
O CFM, juntamente aos representantes da Sociedade Brasileira de Reprodução Assistida, da Federação Brasileira das Sociedades de Ginecologia e Obstetrícia, da Sociedade Brasileira de Reprodução Humana e da Sociedade Brasileira de Genética Médica, entram em defesa do aprimoramento das práticas e do cumprimento dos princípios básicos de ética e bioética, visando ofertar maior eficácia ao tratamentos e procedimentos médicos realizados, além da segurança de todos os envolvidos. Até o momento da escrita desta revisão bibliográfica não existe legislação específica publicada a respeito das técnicas de RHA, existem sim diversos projetos de lei a respeito do assunto tramitando no Congresso Nacional, mas nenhum até o momento concretizado (BRASIL, 2010; BRASIL, 2017).
CONSIDERAÇÕES FINAIS
Este trabalho se propôs a apontar os motivos que levam os casais a realizar o PGT. Após os resultados coletados através da revisão bibliográfica, pode-se chegar a algumas conclusões: a transferência embrionária realizada apenas com blastocisto que apresentaram resultados genéticos normais possuem maiores taxas de sucesso de gravidez, maior número de nascidos vivos e diminui também a quantidade de transferências embrionárias necessárias até conseguir o teste de gravidez positivo. Ou seja, a importância da realização do PGT está mais relacionada com a eliminação de transferências embrionárias que resultarão em falhas implancionais, uma vez que o teste não aumenta a chance de gravidez, apenas seleciona embriões com maior chance de sucesso implantacional.
O teste de PGT tem sido cada dia mais requisitado em tratamentos de RHA, pois os casais querem ferramentas que promovam a diminuição de taxas de falhas implantacionais, muitas vezes causadas por aneuploidias existentes em seus embriões. Casais que possuem alterações genéticas que não querem que seja passada para as próximas gerações também têm optado pelo PGT, sendo permitido o descarte de embriões alterados.
Seria interessante que os métodos de PGT possuíssem uma legislação regulamentadora, uma vez que a técnica é exercida diante das resoluções do CFM em conjunto com leis de biossegurança e direitos humanos éticos, determinando normas a serem seguidas pelos estabelecimentos que oferecem a RHA.
É de suma importância também enfatizar a importância dos profissionais biomédicos em todo esse processo, uma vez que estão presentes nas bancadas de laboratório de embriologia operando com excelência procedimentos tão importantes como biópsia embrionária, FIV, congelamento e descongelamento de gametas e embriões e realizando testes biomoleculares; procedimentos esses que têm um impacto direto e tão importante na vida de pessoas que recorrem a clínicas de RHA para realizarem o sonho de serem pais.
REFERÊNCIAS BIBLIOGRÁFICAS
- BREZINA, P. R. ; KUTTEH, W. H. Clinical applications of preimplantation genetic testing. BMJ, v. 350, n. 193, p. 350-7611, 19 fev. 2015.
- HARTON, G. L. et al. ESHRE PGD consortium best practice guidelines for amplification- based PGD. Human Reproduction, v. 26, n. 1, p. 33-40, 21 out. 2010.
- DAHDOUH, E. M. ; BALAYLA, J. ; GARCÍA-VELASCO, J. A. Impact of blastocyst biopsy and comprehensive chromosome screening technology on preimplantation genetic screening: a systematic review of randomized controlled trials. Reproductive Biomedicine Online, v. 30, n. 3, p. 281-289, mar. 2015.
- GRADVOHL, S. M. O.; OSIS, M. J. D.; MAKUCH, M. Y. Características de homens e mulheres que buscam tratamento para infertilidade em serviço público de saúde. Reprodução & Climatério, v. 28, n. 1, p. 18-23, jan. 2013.
- MALUF, V. M. D. ; KAHHALE, E. M. P. Mulher, Trabalho e Maternidade: Uma Visão Contemporânea. Labore Laboratório de Estudos Contemporâneos, v. 9, n. 3, p. 143 – 160, jul./set., 2010.
- BORGHT, M. V. ; WYNS, C. Fertility and infertility: definition and epidemiology. Clinical Biochemistry, v. 62, p. 2-10, dez. 2018.
- FELIS, Keila; ALMEIDA, Rogerio. Perspectiva de casais em relação à infertilidade e reprodução assistida: uma revisão sistemática. Reprodução & Climatério, v. 31, n. 2, p. 105- 111, mai./ agos, 2016.
- ZILLMER, Ezieli. A importância do Diagnóstico genético pré implantacional (PGT) para a reprodução humana, 2021. Disponível em: <https://repositorio.ufsc.br/bitstream/handle/123456789/233391/Ezieli_Zillmer. pdf?sequ ence=1&isAllowed=y> Acesso em: 3 de maio 2022
- AQUINO, Aleister; MARTINHAGO, Ana; MARTINHAGO, Ciro. Biópsia embrionária: qual a melhor escolha?. Reprodução & Climatério, v.28, n.3, p. 122- 129, set./ dez., 2013
- COUTINHO, Henrique et al. Diagnóstico pré- natal de doenças genéticas. Brazilian Journal of Health Review, Curitiba, v.5, n.2, p. 4023- 4043. mar./ abri., 2022
- ACOG Committee Opinion. Preimplantation Genetic Testing. Obstetrics & Gynecology, v. 107, n. 1, p. 1-5, mar. 2020.
- BENTO, L. A. et al., Bioética e reprodução humana assistida homóloga post-mortem. Revista Uningá, v.56, n. 2, p. 215-227, 2019.
- BUTLER R., et al. Analysis of PGT-M and PGT-SR outcomes at a Canadian fertility clinic. Prenat Diagn. p 866-870. set. de 2019.
- BRASIL. Resolução CFM nº 1.957/2010, de 06 de janeiro de 2011. Diário Oficial da República Federativa do Brasil, Brasília, DF, Seção I, p. 79, 2011.
- BRASIL. Resolução CFM nº 2.168/2017, de 21 de setembro de 2017. Diário Oficial da República Federativa do Brasil, Brasília, DF, Seção I, p. 73, 2017.
- CAMBIAGHI, S. A. Diagnóstico Genético Pré-implantacional (PGD e PGS), Instituto Paulista de Ginecologia e Obstetrícia, 2019. Disponível em: <https://ipgo.com.br/diagnostico-genetico-pre-implantacional-pgs-avaliacromossomos/>, Acesso em: 17/11/2020.
- FANG, R. et al. Chromosome screening using culture medium of embryos fertilised in vitro: a pilot clinical study. Journal Of Translational Medicine, v. 17, n. 1, p. 1-8, 8 mar. 2019.
- FORMAN, E. et al. In vitro fertilization with single euploid blastocyst transfer: a randomized controlled trial. Fertility And Sterility, v. 100, n. 1, p. 1-9, jul. 2013.
- GARDNER, R. J. M. ; SUTHERLAND, G. R. ; SHAFFER, L. G. Chromosome abnormalities and genetic couseling. New York: Oxford University Press, 4a ed, 2012.
- GASDA, E. Criopreservação de embriões humanos no contexto da saúde sexual e reprodutiva. Revista Pistis & Praxis: Teologia e Pastoral, v. 7, n. 3, p 635-661. 2015.
- GUALBERTO, C. S. F. P. A. Reprodução Humana Assistida no Brasil: Necessidade de regulamentação do procedimento para preservação de direitos fundamentais. 2015, p. 70 a 84. Mestrado (Graduação em Direito) – Pontifícia Universidade Católica de Goiás , Programa de Pós-graduação em Direito, Relações internacionais e Desenvolvimento, 2015.
- GRANGEIRO, A. Y. et al. REPRODUÇÃO HUMANA ASSISTIDA NO BRASIL: uma análise epidemiológica. Revista Interfaces: Saúde, Humanas e Tecnologia, v. 8, n. 1, p. 437-444, 1 abr. 2020.
- HOMER, A. H. “Teste Genético Pré-implantação para Aneuploidia (PGT-A): A Biologia, a Tecnologia e os Resultados Clínicos”. Australian and New Zealand Journal of Obstetrics and Gynecology , vol. 59, n o 2, p. 317–24, abril de 2019.
- JIAO, J. et al. Minimally invasive preimplantation genetic testing using blastocyst culture medium. Human Reproduction, v. 34, n. 7, p. 1369-1379, 28 jun. 2019.
- KARAVANI, E. et al. Screening Human Embryos for Polygenic Traits Has Limited Utility. Cell, v. 179, n. 6, p. 1424-1435, nov. 2019.
- LEITE, T. H. Análise crítica sobre a evolução das normas éticas para a utilização das técnicas de reprodução assistida no Brasil. Ciência & Saúde Coletiva, v. 24, p. 917928, 2019.
- MACHADO C. S. Bioética na reprodução humana assistida: os impactos éticos e emocionais no destino de embriões excedentários, p. 215, 2016. Dissertação (Mestrado em Serviço Social) – Faculdade Ciências Humanas e Sociais, Universidade Estadual Paulista “Júlio de Mesquita Filho”, 2016.
- MAGGIULLI, R. et al. Human Blastocyst Biopsy and Vitrification. Journal Of Visualized Experiments, n. 149, p. 1-12, 26 jul. 2019.
- MATEU-BRULL, E. et al. Interchromosomal effect in carriers of translocations and inversions assessed by preimplantation genetic testing for structural rearrangements (PGT-SR). Journal Of Assisted Reproduction And Genetics, v. 36, n. 12, p. 25472555, 6 nov. 2019.
- MEDEIROS L. S.; VERDI M. I. M. Direito de acesso ao serviço de reprodução humana assistida: discussões bioéticas. Ciênc. Saúde Coletiva, Rio de Janeiro, v. 15, n.2, p. 3129-3138, 2010.
- NETO, M. O. L. A. S. et al. Debatendo a procriação medicamente assistida. 2018.
- NGS (Next-Generation Sequencing) avalia a saúde dos embriões e poderá substituir o CGH, Instituto Paulista de Ginecologia e Obstetrícia, 2015. Disponível em: <https://ipgo.com.br/novo–exame–ngs–next/>. Acesso em: 10/11/2020.
- OLIVEIRA, A. F. et al. Os aspectos jurídicos da reprodução humana assistida post mortem. Revista de trabalhos acadêmicos–Universo Belo Horizonte, v. 1,n. 3, 2018.
- PENZIAS, A. et al. The use of preimplantation genetic testing for aneuploidy (PGT-A): a committee opinion. Fertility And Sterility, v. 109, n. 3, p. 429-436, mar. 2018.
- PIZZATO, B. R. et al. Revisão das técnicas de biologia molecular aplicadas no diagnóstico genético pré‐implantacional e uma reflexão ética. Reprodução & Climatério, v. 32, n. 1, p. 7-14, jan. 2017.
- POMPEU, T. N.; VERZELETTI, F. B. Diagnóstico genético pré‐implantacional e sua aplicação na reprodução humana assistida. Reprodução & Climatério, v. 30, n. 2, p. 83-89, maio 2015.
- SANTOS, V. F. D. Reprodução humana assistida em casais homoafetivos: reflexões acerca da gestação por substituição na realidade brasileira contemporânea, 2019, p.8.Monografia (Graduação em Direito) – UCSAL, Universidade Católica do Salvador, Salvador, 2019.
- SCOTT, R. et al. Blastocyst biopsy with comprehensive chromosome screening and fresh embryo transfer significantly increases in vitro fertilization implantation and delivery rates: a randomized controlled trial. Fertility And Sterility, v. 100, n. 3, p. 697703, set. 2013.
- SOUZA, J. C. M. et al. Síndromes Cromossômicas: uma revisão. Cadernos da escola de saúde, Curitiba, v. 3, p. 1-12, 2010.
- STOCK-MYER, S.; JOHNSON, M. A big step forward for PGT-M? Reproductive Biomedicine Online, [S.L.], v. 37, n. 2, p. 126-127, ago. 2018.
- SULLIVAN-PYKE, C.; DOKRAS, A. Preimplantation Genetic Screening and Preimplantation Genetic Diagnosis. Obstetrics And Gynecology Clinics Of North America, v. 45, n. 1, p. 113-125, mar. 2018.
- TREFF, N. R. et al. Preimplantation Genetic Testing for Polygenic Disease Relative Risk Reduction: evaluation of genomic index performance in 11,883 adult sibling pairs. Genes, v. 11, n. 6, p. 648-658, 12 jun. 2020.
- YANG, Z. et al. Selection of single blastocysts for fresh transfer via standard morphology assessment alone and with array CGH for good prognosis IVF patients: results from a randomized pilot study. Molecular Cytogenetics, v. 5, n. 1, p. 1-8, 2012.
- BRASIL. Resolução CFM nº 2.320/ 2022, de 20 de setembro de 2022. Diário Oficial da República Federativa do Brasil, Brasília, DF, Seção I, p. 108, 2022.
1Discente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil
2Docente da Universidade Anhembi Morumbi, São Paulo / SP, Brasil
