REGISTRO DOI: 10.5281/zenodo.7117821
Autora:
Rachel Anne Alencar Martins
RESUMO
As flores de plantas pertencentes ao gênero Senna possuem heteranteria, ou seja, possuem diferentes tipos de anteras com funções diferenciadas na mesma flor. Esta característica lhes confere a capacidade de oferecer pólen às abelhas visitantes, por meio das anteras de coleta, e ainda garantir que as anteras de polinização depositem pólen em lugares seguros, “safe sites” onde as abelhas não conseguem alcançar. Deste modo, as abelhas acabam transportando este pólen até o estigma das outras flores visitadas sem que possam usá-lo em benefício próprio. Assim as plantas garantem sua reprodução (com o pólen para polinização seguro) e as abelhas garantem a alimentação da sua prole (com o pólen de coleta). O objetivo deste estudo foi descobrir que abelhas visitantes são de fato polinizadoras efetivas de três espécies de plantas do gênero Senna: Senna acuruensis, Senna spectabilis e Senna alata, em uma área do entorno da Chapada do Araripe- CE, Brasil. Verificar também os padrões de deposição de pólen no corpo dos visitantes a partir das anteras de coleta e de polinização, bem como a capacidade destes polinizadores de depositar pólen co-específico nos estigmas das flores visitadas, garantindo o sucesso reprodutivo das mesmas. Para isso, foram analisados os padrões de deposição de pólen no corpo dos visitantes, o padrão de captação de pólen pelos estigmas, o comportamento de limpeza dos visitantes, bem como a distribuição de visitas ao longo do dia. Como resultado foram encontradas três espécies de abelhas polinizadoras efetivas das três espécies de plantas. Nas três espécies de abelhas foram observados padrões de deposição de pólen semelhantes. Apesar de ter sido constatado que as três espécies polinizaram de maneira efetiva, em todos os casos as abelhas maiores apresentaram capacidade de depositar maior quantidade de pólen nos estigmas, provavelmente por seu tamanho favorecer o contato entre a área de deposição de pólen e o estigma dessas plantas.
Palavras-chave: polinização por vibração, heteranteria, interações, divisão de trabalho.
ABSTRACT
The flowers of plants belonging to the genus Senna have heteranthery, different kinds of anthers with differentiated functions in the same flower. This feature gives them the ability to provide pollen to bees visitors through “feeding” stamens, and still ensure the deposit of pollen by “pollinating” stamens in safe places, “safe sites” where bees cannot reach the pollen grains. Thus, bees end up carrying this pollen to the stigma of other flowers visited without being able to use it to their advantage. So the plants ensure its reproduction (with pollen for pollination assured) and bees ensure the supply of their offspring (with pollen for collection). The aim of this study was to find which visiting bees are effective pollinators of three species of the genus Senna: S. acuruensis, S. spectabilis and S. alata, in a surrounding area of Chapada do Araripe- CE, Brazil. Verify the pollen deposition patterns in the body of visitors from the feeding and pollinating stamens, and the ability of these pollinators to deposit co-specific pollen on the stigma of flowers visited, ensuring the reproductive success of the plants. Pollen deposition patterns in the body of visitors, the pattern of pollen capture by the stigma, the cleaning behavior of visitors, as well as the distribution of visits throughout the day were analyzed. As a result we found three bee species as effective pollinators of the three plant species. In the three bee species similar pollen deposition patterns were observed. Although we found that the three bee species pollinated effectively, in all cases larger bees showed the ability to deposit larger amounts of pollen on the stigma, probably due to its larger size favor the contact between the pollen deposition area and the stigma from these plants.
Keywords: buzz pollination, heteranthery, interactions, division of labor.
INTRODUÇÃO
Mecanismos de polinização mais complexos envolvendo flores de pólen estão associados à presença de estames de diferentes tipos na mesma flor (heteranteria). A heteranteria foi reportada pela primeira vez pelos biólogos Fritz e Hermann Muller em meados do século XIX, com base em observações de diversas flores de pólen no Brasil, os autores propuseram que um conjunto de estames é especializado em fornecer pólen para a polinização e outro conjunto especializado em fornecer pólen para as abelhas (estames de coleta) (Muller, H. 1881; Muller, F. 1883). Em flores de Solanum rostratum, por exemplo existem um conjunto de estames centrais, geralmente mais conspícuos, nos quais as abelhas pousam e agem. Outro conjunto inferior de estames mais longos, menos conspícuos, depositam pólen na região dorsal das abelhas, onde toca o estigma. Estas áreas (“safe sites” sensu Buchmann, 1983) são parcialmente inalcançáveis para as pernas das abelhas. Este dimorfismo do androceu ocorre em algumas espécies com anteras rimosas ou poricidas. Dentro das angiospermas mais de 20.000 espécies disponibilizam somente pólen como recurso para os visitantes florais, neste caso o pólen é o único atrativo para os polinizadores (Endress, 1994). Dentre as flores de pólen existem aquelas cujo pólen está armazenado em anteras poricidas e é explorado exclusivamente por abelhas capazes de realizar vibrações. Buchmann (1985) sugeriu que este comportamento teria surgido a partir de uma função original de termorregulação, como ocorre em vários grupos atuais de insetos. Ao longo da evolução este comportamento teria sofrido modificações na sua função, de forma que as abelhas passaram a utilizá-lo para a vibração das flores. Assim, a vantagem de coletar mais pólen pela vibração, comparativamente à manipulação das anteras, tornou o comportamento de coleta por vibração característico em alguns táxons de abelhas.
Segundo Endress (1994) do ponto de vista da evolução floral, características como anteras longas, tubulares e poricidas podem ser consideradas como adaptações das plantas à coleta de pólen por vibração. Neste sentido, a proteção do pólen, a seleção de visitantes e a promoção da polinização com a deposição mais precisa de pólen no corpo dos visitantes serviriam como vantagens adaptativas para garantir o sucesso reprodutivo das plantas. Vallejo-Marín et al. (2010) realizaram uma análise filogenética em espécies com flores com heteranteria e concluíram que ela surgiu convergentemente em 12 ordens e 16 famílias, incluindo monocotiledôneas e eudicotiledôneas. Além disso, a heteranteria está filogeneticamente relacionada a flores de pólen, polinização por vibração e enantiostilia (Barret, 2003).
Flores assimétricas, enantiostilia e heteranteria são características comuns às espécies da subtribo Cassiinae (Fabaceae) (Gottsberguer & Silberbauer-Gottsberguer 1988). A enantiostilia surgiu independentemente em pelo menos dez famílias de angiospermas e normalmente está associada à heteranteria, e ambas relacionadas à coleta de pólen por vibração, ausência de nectários florais e assimetria floral (Barret et al. 2000) . A presença desses caracteres em grupos não relacionados sugere que a convergência evolutiva para a qual a posição do polinizador durante a visita é importante para a dispersão do pólen e consequentemente para o sucesso reprodutivo (Barret et al. 2000). Contudo, nem todas as espécies que visitam flores de pólen e vibram as anteras são polinizadores de fato, isto depende do tamanho do visitante e seu comportamento na flor.
Para coletar pólen de anteras poricidas a abelha se agarra a uma antera ou a um conjunto de estames e vibra a musculatura do tórax. A vibração é transmitida para as estruturas florais e faz com que os grãos de pólen, geralmente pequenos e secos, fiquem na superfície do corpo das abelhas. Embora o pólen dessas flores seja coletado somente por vibração, nem todas as abelhas visitantes e capazes de vibrar estas flores são polinizadoras efetivas. A polinização só ocorrerá se o visitante tocar o estigma com a parte do corpo que recebeu a carga polínica, o que dependerá do comportamento do visitante na flor e do seu tamanho corporal em relação à posição, tamanho e arranjo dos estames. Bem como a posição e tamanho do estilete.
Em estudos anteriores acerca da biologia reprodutiva e polinização de espécies do gênero Senna, Wolowisk & Freitas (2010) encontraram abelhas grandes (Bombus, Epicharis, Centris e Xylocopa) como polinizadores efetivos, e outras abelhas menores visitantes, como pilhadoras de pólen. A espécie estudada Senna multijuga, não formou frutos por autopolinização, se mostrando dependente de polinizadores para a polinização cruzada. Para outra espécie do gênero, Senna sylvestris, foi observado o mesmo padrão de polinizadores efetivos, e ainda foi encontrada uma divisão de trabalho entre as anteras, havendo estames menores estéreis que servem apenas como “suporte” para o polinizador se agarrar durante a visita e mais dois conjuntos de estames com função de polinização e de coleta (Carvalho & Oliveira 2003). Neste estudo, foi observado que só houve a formação de frutos quando realizada polinização cruzada com o pólen das anteras maiores (de polinização). Apesar de poucos estudos já terem sido feitos sobre os sistemas reprodutivos de Senna e de Cassiinae em geral, sabe-se que são comuns mecanismos de autoincompatibilidade gametofítica para a subfamília Caesalpinioideae (Arroyo 1981) e que foram inferidos para as espécies de Cassiinae com base no tipo de estigma úmido comum entre as espécies do grupo (Owens 1989).
O presente estudo teve como objetivo verificar os sistemas de reprodução e polinização de três espécies do gênero Senna (S. acuruensis, S. alata e S. spectabilis) por meio dos processos de captação e deposição de pólen no corpo dos polinizadores, de forma a tentar compreender como a divisão de trabalho entre as anteras e o comportamento dos polinizadores podem influenciar o sucesso reprodutivo das espécies. Para tanto, foram testadas as seguintes hipóteses:
1) Abelhas vibradoras de maior porte, dentre as visitantes, são os polinizadores efetivos nas espécies de Senna estudadas;
2) As flores das espécies estudadas depositam pólen em áreas específicas do corpo do polinizador;
3) A deposição de pólen em regiões específicas do corpo do polinizador está relacionada com diferentes tipos de anteras e suas diferentes funções.
MATERIAL E MÉTODOS
Área de estudo e espécies de plantas estudadas
O estudo se deu em uma área que compreende os municípios de Crato (7°13’57,90”S; 39°24’52, 79” O) e Juazeiro do Norte (7°14’13,97”S; 39°19’19,81”O), esta região fica logo abaixo da Chapada do Araripe, nos limites do seu entorno. A precipitação média anual é de cerca de 760 mm, concentrada entre os meses de janeiro a abril (66,3%) e a temperatura média anual de 24,1°C. A região possui diferentes tipos de fisionomias vegetais como floresta úmida, floresta seca, cerradão, cerrado e carrasco (Fernandes 1990, Campelo et al. 2000). A área de estudo possui muitos representantes da subtribo Cassiinae, e as espécies estudadas são facilmente encontradas na região de encosta da Chapada, principalmente em clareiras e borda de mata. Com exceção de S. alata que é encontrada na área mais plana, abaixo da chapada em localidades de brejo próximas a rios ou riachos. A coleta de dados de campo foi realizada durante os anos de 2014 e 2015 nos meses de floração das espécies estudadas: S. spectabilis – dezembro a abril; S. acuruensis – fevereiro a junho; S. alata – junho a outubro.


Biologia reprodutiva e visitantes florais
A biologia floral foi estudada a partir de flores estocadas em FAA 70%. A receptividade do estigma foi analisada por meio de teste com peróxido de hidrogênio a 10 ou 20?% (Zeisler 1938), com auxílio de lupa de campo. A viabilidade polínica foi estimada em 200 grãos de pólen por antera em três anteras de cada tamanho do mesmo indivíduo utilizando carmim acético, com auxílio de microscópio óptico (Dafni 1992). O número de grãos de pólen foi estimado em três anteras por tamanho do mesmo indivíduo, utilizando câmara de Neubauer com auxílio de microscópio óptico. Outros aspectos da biologia floral como coloração, horário e duração da antese e duração da flor foram observados diretamente no campo.
Os sistemas reprodutivos foram determinados através de testes de polinização controlados em flores de inflorescências isoladas em sacos de tecido na fase de botões. Nos testes foram utilizados dois indivíduos de cada espécie no ápice de sua floração. Nas três espécies estudadas o acesso às flores era fácil, devido à presença de inflorescências a alturas acessíveis. As flores foram submetidas aos tratamentos: apoximia (flores em pré-antese foram emasculadas, marcadas e mantidas na inflorescência sem deposição de pólen no estigma); autopolinização manual (flores em antese foram marcadas e o conteúdo de pólen de uma antera da própria flor foi depositado no estigma); autopolinização espontânea (flores em antese foram marcadas sem que houvesse deposição de pólen no estigma); polinização cruzada manual (flores em antese foram marcadas e o conteúdo de pólen da antera de outro indivíduo da mesma espécie foi depositado no estigma. Nos tratamentos de autopolinização manual e polinização cruzada as anteras foram dissecadas sobre lâminas limpas e o conteúdo depositado diretamente no estigma. Nesses tratamentos foram realizados cruzamentos utilizando os três diferentes tamanhos de anteras.
A fim de estimar a produção de frutos em condições naturais (polinização livre ou controle), flores em antese foram marcadas e mantidas expostas.
Deposição e captação de pólen
Para a análise da existência de deposição de pólen em locais específicos do corpo do polinizador, as três espécies de abelhas mais abundantes foram coletadas logo após as visitas às flores, sacrificadas em seguida em câmara com Acetato de Etila, e posteriormente observadas ao estereomicroscópio. O pólen do corpo das abelhas foi retirado com gelatina glicerinada, separando o pólen da região dorsal do pólen da região ventral e foram montadas lâminas milimetradas com gelatina glicerinada para contagem dos grãos de pólen.
Comportamento dos visitantes
O comportamento dos visitantes foi observado quanto à frequência de visitas, resultado da visita (polinizador ou pilhador) e quanto à forma de coleta do pólen (vibradoras ou mordedoras) (Wile 1969). A frequência de visitas também foi observada em um período de 5 dias, para cada espécie de planta, das 6 às 17:30hs.
Análise dos dados
O teste Qui-quadrado foi utilizado para avaliar possíveis diferenças entre produção de frutos formados nos tratamentos (entre cruzamentos com anteras de diferentes tamanhos) e entre o tratamento de polinização cruzada e controle e ainda para analisar possíveis diferenças na viabilidade entre os grãos de pólen das três anteras diferentes em cada espécie de planta. Os testes foram feitos por meio do software Bioestat 5.0.
RESULTADOS
Senna spectabilis (DC.) H.S. Irwin & Barneby, Mem. New York Bot. Gard. 35(2): 600. 1982.
São árvores eretas com 5 a 7 metros de altura. Possuem 18 a 30 flores por racemo com brácteas linear lanceoladas, pedicelo, sépalas com 3-6mm de comprimento. Corola assimétrica, amarela. Pétalas com 14-27mm de comprimento, 4 estames medianos com filetes com 2,1-2,5mm de comprimento. E antera com 5-6mm de comprimento. Estames abaxiais com anteras isomórficas. A floração da espécie vai de dezembro a abril, na região onde foi realizado o presente estudo. As anteras possuem deiscência poricida, sendo o pólen o único recurso disponível para os visitantes florais.
A viabilidade dos grãos de pólen foi de 95,45% ± 0,02 (n=3) nas anteras pequenas, 97,16% ± 0,03 nas anteras médias e 94,56% ± 0,02 nas anteras grandes. Não houve diferença entre a viabilidade polínica dos três tipos de anteras (X² = 3,56 p= 0,15). Anteras pequenas apresentaram 15654 ± 4764 grãos de pólen, anteras médias, 16648 ± 5768 e anteras grandes, 22546 ± 7479. Houve diferença significativa no número de grãos de pólen entre anteras grandes e médias (X²=143544.241 p<0.0001) entre anteras médias e pequenas (X²= 32718.241 p<0.0001) e entre anteras grandes e pequenas (X²=73472.964 p<0.0001).
O início da antese ocorreu por volta das 6:30 da manhã, quando o estigma já estava receptivo e as anteras apresentavam coloração amarelo-esverdeada. Ao longo da manhã os poros das anteras se abriam e o pólen tornava-se disponível. No fim do dia as anteras já haviam adquirido uma coloração escurecida, mas persistiam até dois dias. A antese durou em média 12 horas.
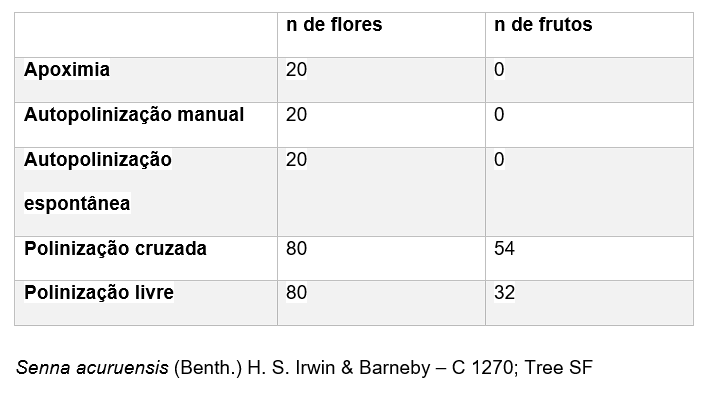
Quanto ao sistema reprodutivo, a espécie é autoincompatível, não tendo havido formação de frutos a partir dos tratamentos de autopolinização espontânea e manual com pólen proveniente dos três tipos diferentes de anteras. Não houve diferença significativa entre a taxa de formação de frutos no tratamento de polinização cruzada com o pólen dos três tipos de anteras (X²=0,90 p = 0,58). A produção de frutos após a polinização cruzada foi maior que em condições naturais (Tabela 1).
TABELA 1: TRATAMENTOS DE AUTOPOLINIZAÇÃO MANUAL, AUTOPOLINIZAÇÃO ESPONTÂNEA, POLINIZAÇÃO CRUZADA E POLINIZAÇÃO LIVRE EM SENNA SPECTABILIS
São arbustos com 1 a 2,5 metros de altura. Possuem 4 a 10 flores por racemo com brácteas linear lanceoladas, pedicelo, sépalas com 3-4mm de comprimento. Corola assimétrica, amarela. Pétalas com 15-25mm de comprimento, 4 estames medianos com filetes com 3,2-2,3mm de comprimento. E anteras com 4-6mm de comprimento. Estames abaxiais com anteras isomórficas. A floração da espécie vai de fevereiro a junho, na região onde foi realizado o presente estudo. As anteras possuem deiscência poricida, sendo o pólen o único recurso disponível para os visitantes florais.
A viabilidade dos grãos de pólen foi de 98,38% ± 0,02 (n=3) nas anteras pequenas, 97,13% ± 0,02 nas anteras médias e 96,6% ± 0,02 nas anteras grandes. Não houve diferença entre a viabilidade polínica dos três tipos de anteras (X² = 4,45 p= 0,22). Anteras médias apresentaram 12987 ± 5763 grãos de pólen, anteras pequenas, 10765 ± 4762 e anteras grandes, 18764 ± 8969. Houve diferença significativa no número de grãos de pólen entre anteras grandes e médias (X²=172530.983 p<0.0001), médias e pequenas (X²= 1208098.609 p<0.0001) e entre anteras grandes e pequenas (X²= 98112.649 p<0.0001).
O início da antese ocorreu por volta das 5:30 da manhã, quando o estigma já estava receptivo e as anteras apresentavam coloração amarelada. Ao longo da manhã os poros das anteras se abriam e o pólen tornava-se disponível. No fim do dia as anteras já haviam adquirido uma coloração escurecida, mas persistiam até o fim do dia. A antese durou em média 8 horas.
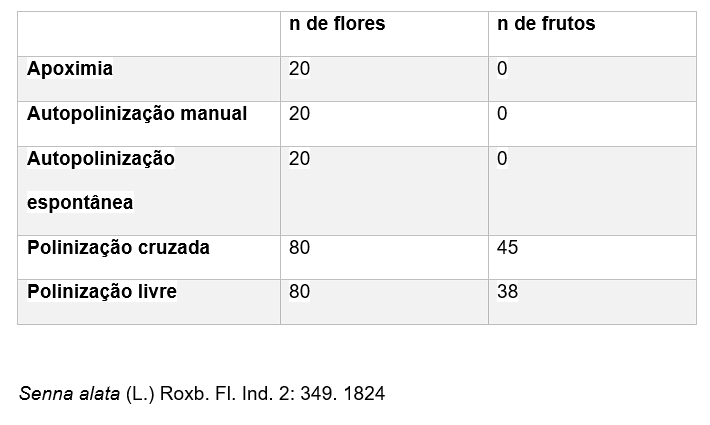
Quanto ao sistema reprodutivo, a espécie é autoincompatível, não tendo havido formação de frutos a partir dos tratamentos de autopolinização espontânea e manual com pólen proveniente dos três tipos diferentes de anteras. Não houve diferença significativa entre a taxa de formação de frutos no tratamento de polinização cruzada com o pólen dos três tipos de anteras (X²=0,88 p = 0,62). A produção de frutos após a polinização cruzada foi maior que em condições naturais (Tabela 2).
TABELA 2: TRATAMENTOS DE AUTOPOLINIZAÇÃO MANUAL, AUTOPOLINIZAÇÃO ESPONTÂNEA, POLINIZAÇÃO CRUZADA E POLINIZAÇÃO LIVRE EM SENNA ACURUENSIS
Arbustos eretos 1-4 metros de altura, racemos axilares com 20-30 flores zigomorfas, sépalas com 10,5-16 mm de comprimento; corola amarelo ouro com pétalas de 15-24 mm de comprimento; 4 estames medianos com filetes de 2,5 a 3,7mm de comprimento e anteras com 3,3-5mm de comprimento; estames abaxiais com anteras ansisomórfica e gineceu com 13-21mm. Floração vai de abril a setembro no local onde foi realizado o presente estudo. As anteras com deiscência poricida.
A viabilidade dos grãos de pólen foi de 92,36% ± 0,04 (n=3) nas anteras pequenas, 93,12% ± 0,03 nas anteras médias e 96,4% ± 0,02 nas anteras grandes. Não houve diferença entre a viabilidade polínica dos três tipos de anteras (X² = 4,65 p= 0,2). Anteras pequenas apresentaram 8987 ± 3876 grãos de pólen, anteras médias, 12765 ± 6985 e anteras grandes, 15874± 8759. Houve diferença significativa no número de grãos de pólen entre anteras grandes e médias (X²= 16401.9 p<0.0001), entre anteras médias e pequenas (X²= 36418.412 p<0.0001) e entre anteras grandes e pequenas (X²= 87774.078 p<0.0001).
O início da antese ocorreu por volta das 6:00 da manhã, quando o estigma já estava receptivo e as anteras apresentavam coloração amarelo-esverdeada. Ao longo da manhã os poros das anteras se abriam e o pólen tornava-se disponível. No fim do dia as anteras já haviam adquirido uma coloração escurecida, persistindo até o final do dia. A antese durou em média 10 horas.
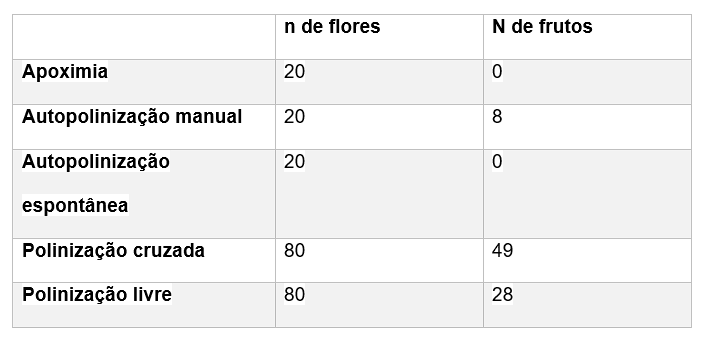
Quanto ao sistema reprodutivo, a espécie é autocompatível, porém só houve formação de frutos no tratamento de autopolinização manual. A autopolinização espontânea não formou frutos com pólen proveniente de nenhum dos três tipos diferentes de anteras. Não houve diferença significativa entre a taxa de formação de frutos no tratamento de polinização cruzada com o pólen dos três tipos de anteras (X²=0,85 p = 0,47). A produção de frutos após a polinização cruzada foi maior que em condições naturais (Tabela 3).
TABELA 3: TRATAMENTOS DE AUTOPOLINIZAÇÃO MANUAL, AUTOPOLINIZAÇÃO ESPONTÂNEA, POLINIZAÇÃO CRUZADA E POLINIZAÇÃO LIVRE EM SENNA ALATA
Visitantes florais, deposição e captação de pólen
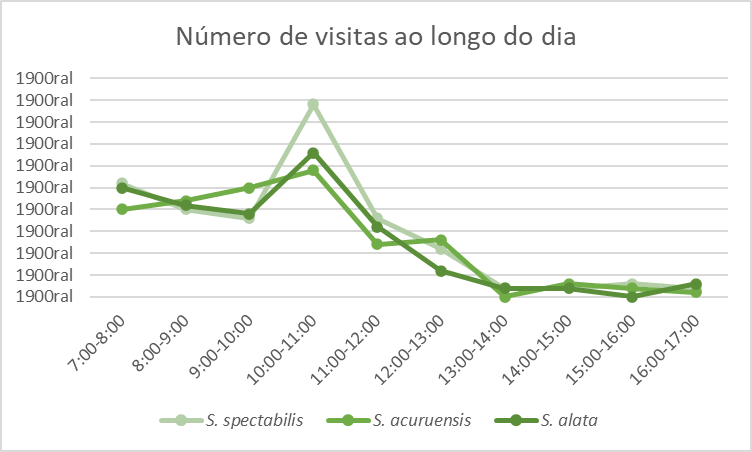
Os visitantes florais observados foram abelhas fêmeas (Hymenoptera: Apoidea) que coletaram pólen. A coleta teve início por volta das 7:00 horas da manhã e permaneceu intensa até às 11:00h, quando a frequência de visitas diminuiu consideravelmente (Figura 4). Tendo ocorrido, entretanto, visitação menos frequente até as 17:00 horas. Dentre as espécies que visitaram S. spectabilis três foram consideradas polinizadoras e uma pilhadora.
FIGURA 4: NÚMERO DE VISITAS ÀS FLORES DAS TRÊS ESPÉCIES DE SENNA AO LONGO DO DIA
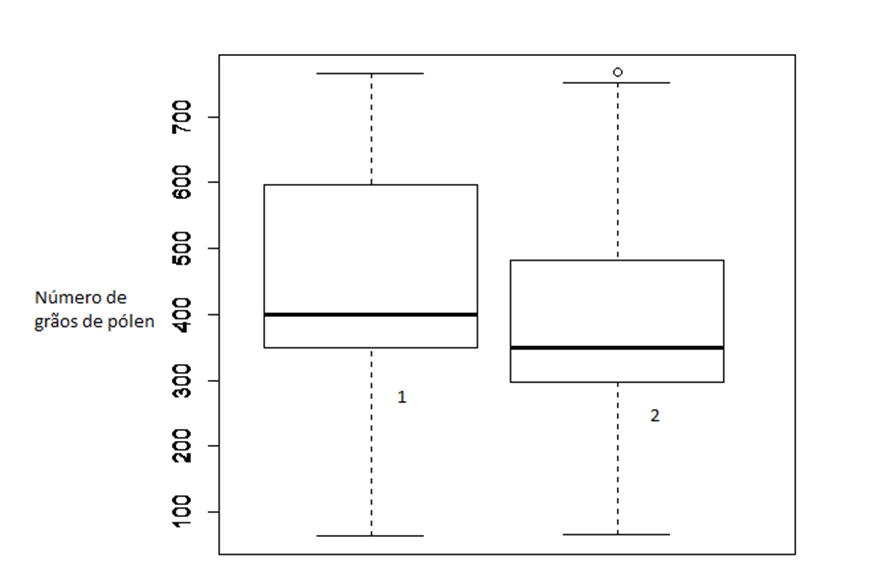
Foram consideradas polinizadoras as abelhas cujo corpo recebia pólen (por meio da vibração) em uma área tocada pelo estigma durante a visita. Nestas abelhas foi verificada uma quantidade média de 778 ± 257 grãos de pólen na sua região ventral (pernas e tórax) e 567 ± 234 na sua região dorsal (tórax, abdome e cabeça) para S. spectabilis. Sempre houve uma grande concentração de pólen na junção das asas com o tórax, área correspondente ao lugar onde o estigma toca durante a visitação, em flores de ambas as orientações do pistilo (devido à enantiostilia) para a direita ou esquerda. Em S. acuruensis, foi verificada uma quantidade média de grãos de pólen entre 446 ± 267 na região ventral e 354 ± 278 na região dorsal; os grãos de pólen se concentraram entre as asas nas duas espécies de Centrise na junção das asas com o tórax nas duas espécies de Xylocopa. Nos visitantes de S. alata foram contabilizados 456 ± 354 grãos de pólen na região ventral e 276 ± 212 na região dorsal. Os grãos de pólen observados no dorso dos visitantes de S. alata encontrava-se mais espalhado, não formando uma região de concentração como nas outras duas espécies.
FIGURA 5: QUANTIDADE DE GRÃOS DE PÓLEN ENCONTRADOS NO CORPO DAS ABELHAS VISITANTES DE S. SPECTABILIS, S. ACURUENSIS E S. ALATA
Todas as abelhas visitaram as flores durante todo o período observado, sendo Xylocopa grisescens o visitante mais frequente. Foram observadas em média 154 visitas por dia, sendo 76 de X. grisescens (espécie responsável por 49,3% das visitas diárias em S. spectabilis). Em S. alata e S. acuruensis o visitante mais frequente dentre os polinizadores foi Centris obsoleta responsável, respectivamente, por 62,4% e 56,9% de todas as visitas em um dia.
Trigona spinipes (Apidae Meliponinae), foi considerada pilhadora, pois, devido ao seu tamanho e comportamento, ao visitar as flores das três espécies estudadas não tocava o estigma de nenhuma delas. Apenas ocasionalmente ocorria este contato. Esta espécie coleta o pólen mastigando as anteras em sua base até que a mesma se solte da flor e o pólen seja retirado.
TABELA 4: VISITANTES FLORAIS, RECURSOS EXPLORADOS E RESULTADO DA VISITA

DISCUSSÃO
As características morfológicas das flores das três espécies, S. spectabilis, S. acuruensis e S. alata, tais como anteras de tamanhos e posições diferentes na mesma flor, dois tipos de orientação na posição do pistilo (enantiostilia) e anteras poricidas as enquadram na categoria de flores de pólen (Vogel 1978, Buchmann 1983). As mesmas são dependentes de abelhas vibradoras para liberação do pólen das anteras poricidas, processo bastante comum para as espécies da subtribo Cassiinae (Buchmann 1983, Gosttberguer & Silberbauer-Gottsberger 1988). O posicionamento dos estames nas três espécies indica funções diferentes. As três espécies de plantas possuem grupos de estames diferentes com quantidades de pólen diferentes, porém não houve diferença na viabilidade polínica. Deste modo, a divisão de trabalho está relacionada provavelmente à restrição de pólen, para que os visitantes não coletem o recurso indiscriminadamente, ficando a salvo o pólen destinado à polinização. A orientação dos poros afeta diretamente a direção de liberação do pólen e a assimetria da corola tem um papel importante durante a polinização (Marazzi et al. 2007, 2008). Este posicionamento diferencial dos estames mostrou favorecer a deposição de pólen em regiões específicas do corpo dos visitantes: estames maiores e voltados para as pétalas depositam grãos de pólen no dorso das abelhas, e estames menores, que durante a visita ficam posicionados sob o corpo das abelhas, depositam o pólen em sua região ventral. Em S. spectabilis e S. acuruensis houve uma concentração da deposição de pólen em áreas específicas no dorso das abelhas, que coincide com o local que toca o estigma de flores de ambos os morfos (ou seja, com o pistilo orientado para a direita ou para a esquerda). Essa deposição concentrada pode estar ligada ao processo de deposição indireta do pólen, pois estas duas espécies possuem pétalas maiores, assimétricas, que parecem ser uma característica importante para o direcionamento do jato de pólen e para minimizar a sua perda.
Diferente das duas espécies anteriores, as flores de S. alata não possuem a pétala assimétrica, depositando os grãos de pólen de forma difusa no dorso do polinizador. Os estames voltados para o lado oposto ao pistilo e à pétala grande favorecem a deposição de pólen no dorso dos visitantes, enquanto os estames cujos poros estão voltados para o ventre dos visitantes depositam o pólen nas regiões que as abelhas têm acesso, sendo assim as anteras de coleta. Esta estratégia tem sido relatada por diferentes autores para espécies de Cassiinae (Vogel 1978, Westerkamp 2004, Laporta 2005). Apesar das anteras de polinização possuírem mais grãos de pólen que as anteras de forrageio para as três espécies de plantas foi encontrado mais pólen nas abelhas em sua região ventral. Contudo, isso pode ser explicado pelo fato de as abelhas estarem armazenando o pólen coletado sempre que possível nas escopas e corbículas, e no papo como é comum em Xylocopa (Westerkamp 1996), enquanto o pólen depositado na região dorsal está sempre exposto ao contato com as próximas flores visitadas (principalmente os estigmas), e nesse processo muito pólen fica na flor seguinte (o que torna a heteranteria funcionalmente eficiente).
A enantiostilia é outra característica da assimetria floral que está presente nas três espécies estudadas e que associada à heteranteria contribui na polinização. Jason e Barret (2005) sugerem que a deflexão das anteras grandes opostas ao pistilo podem aumentar a precisão de transferência de pólen cruzado e reduzir a interferência do estigma e das anteras dentro ou entre flores da mesma planta. Desta forma a distinção dos visitantes florais entre pilhadores e polinizadores é determinada pela combinação das características florais e a relação com o tamanho das abelhas visitantes.
As abelhas polinizadoras destas três espécies pertencem aos gêneros Xylocopa e Centris que são gêneros já conhecidos como polinizadores de outras espécies de Senna (Gosttberguer & Silberbauer-Gottsberger 1988, Silva et al. 2002, Carvalho & Oliveira 2003, Pinheiro & Sazima 2007).
Senna spectabilis e S. acuruensis não formaram frutos por autopolinização, apresentando um sistema de autoincompatibilidade. Apesar do registro desse sistema para algumas espécies de Leguminosae (Gibbs & Sassaki 1998, Rodriguez-Riãno et al. 1999, Freitas & Oliveira 2002) a expressão da autoincompatibilidade pode variar nas populações de uma espécie tal como observado em espécies heterostílicas (Barret et al. 1989, Pailler & Thompson 1997) e em diferentes tamanhos populacionais ou no limite geográfico da distribuição da espécie (Fausto et al. 2001). O aumento significativo da produção de frutos após a polinização cruzada manual em relação ao controle indica a limitação nos níveis de polinização natural e déficit de polinizadores (Stephenson 1981). No contexto da seleção sexual, o sucesso reprodutivo masculino provavelmente é limitado pela capacidade de os gametas masculinos garantirem o acesso aos gametas femininos, enquanto o sucesso feminino é provavelmente limitado pela capacidade de prover recursos para óvulos e embriões (Bateman 1948). No caso de Senna spectabilis e S. acuruensis a questão está ligada provavelmente à polinização, ou seja, sucesso reprodutivo masculino. Já em S. alata, que é autocompatível, obedece a uma tendência das espécies da subtribo Cassiinae, relatado em estudos realizados em espécies de Senna (Ribeiro & Lovato 2004, Laporta 2005, Leite & Machado 2010), Cassia (Dulberguer 1981) e Chamaecrista (Liu & Koptur 2003, Costa et al.2007, Gómez 2008).
REFERÊNCIAS BIBLIOGRÁFICAS
ARROYO, M. T. K. 1981. Breeding systems and pollination biology in Leguminosae. In: Advances in Legume Systematics, Royal Botanic Gardens, 723-769.
BARRET, S. C. H., MORGAN, M. T. & HUSBAND. 1989. The dissolution of a complex genetic polymorphism: the evolution of self-fertilization in trustylous Eichornia paniculata (Pontederiaceae) Evolution 43: 1398-1416.
BATEMAN, A. J. 1948. Intra-sexual selection in Drosophila. Heredity 2: 349-368.
BUCHMANN, S. L. & HURLEY, J. P. 1978. A biophysical modelo for buzz pollination in Angiosperms, Journal of Theoretical Biology, 72: 639-657.
BUCHMANN, S. L. 1985. Bees use vibration toa aid pollen collection from non-poricidal flowers. Jpurnal of the Kansas Entomological Society, 58: 517-525.
BURKART, A., LUNAU, K. & SCHLINDWEIN, C. 2011. Comparative bioacoustical studies on flight and buzzing of neotropical bees. Journal of pollination ecology 6(16): 118-124.
CAMPELLO, F. C. B., LEAL-JUNIOR, G., SILVA, J. A. & CAMPELLO, R. C.B. 2000. Avaliação dos recursos florestais da área de proteção ambiental da Chapada do Araripe. Projeto MMA- Ministério do Meio Ambiente, Secretaria da Biodiversidade e Floresta, Diretoria do Programa Nacional de Florestas, Crato-CE, 49.
CARVALHO, D. A. & OLIVEIRA, P. E. 2010. Biologia reprodutiva e polinização de Senna sylvestris (Vell.) H. S. Irwin & Barneby (Leguminosae, Caesalpinioideae). Revista Brasileira de Botânica, 26: 319-328.
COSTA, C. B. N., LAMBERT, S. N., BORBA, E. L. & DE QUEIROZ, L. P. 2007. Postzygotic reproductive isolation between sympatric taxa in the Chamaecrista desvauxii complex (Leguminosae- Caesalpinioideae). Ann Bot. 99: 625-635.
DAFNI, A. 1992. Pollination Ecology: a practical approach. Oxford University Press, New York.
DULBERGER, R. 1981. The floral biology of Cassia didymobotrya and C. auriculata (Caesalpiniaceae). American Journal of Botany 68: 1350-1360.
CARVALHO, D. A. & OLIVEIRA, P. E. 2003. Biologia reprodutiva e polinização de Senna silvestres (Vell.) H. S. Irwin & Barneby (Leguminosae, Caesalpiniodeae). Revista Brasileira de Botânica v.26.p.326-328.
CORBET, S. A., CHAPMAN, H. & SAVILLE, N. 1988. Vibratory pollen collection and flower form: Bumble bees on Actinidia, Symphytum, Borago and Polygonatum. Functional Ecology, 2: 147-155.
ENDRESS, P. 1994. Diversity and evolucionary biology of tropical flower. Cambridge University Press, Cambridge.
FAUSTO, J. A., ECKHART, V. M. & GEBER, M. A. 2001. Reproductive assurance and the evolutionary ecology of self-pollination in Clarkia xantiana (Onagraceae). American Journal of Botany 88(10): 1794-1800.
FERNANDES, A.1990. Temas Fitogeográficos. Fortaleza: Stylus Comunicações.
FREITAS, C. V. & OLIVEIRA, P. E. 2002. Biologia reprodutiva de Copaifera langsdorffii Desf. (Leguminosae- Caesalpinioideae) Revista Brasileira de Botânica, 25: 311-321.
GOBBS, P. & SASSAKI, R. 1998. Reproductive biology of Dalbergia miscolobium Benth. (Leguminosae- Papilionoideae) in SE, Brasil: the effects of pistillate sorting of fruit-set. Anals of Botany, 81: 735-740.
GOTTSBERGER, G. & SILBERBAUER-GOTTSBERGER, I. 1988. Evolution of flower structures and pollination in neotropical Cassiinae (Caesalpiniaceae) species. Phyton. 28: 293-320.
KING, M. J. & LENGOC, L. 1993. Vibratory pollen collection dinamics. Transactions American Society of Agricultural Engineers 36: 135-140.
KING, M. J. & BUCHMANN, S. L. 2003. Floral sonication by bees: mesosomal vibration by Bombus and Xylocopa but not Apis (Hymenoptera: Apidae) ejects pollen from the poricidal anthers. Journal of Kansas Entomological Society 76: 295-305.
LAPORTA, C. 2003. Floral biology and reproductive system of enantiostylous Senna corymbosa (Caesalpiniaceae). Revista de Biologia Tropical, 53(1-2): 49-61.
LAPORTA, C. 2005. Floral biology and reproductive system of enantistylous Senna corymbosa (Caesalpiniaceae). Revista de Biologia Tropical, 53: 49-61.
LEITE, A. V. & MACHADO, I. C. 2010. Reproductive biology of wood species in Caatinga, a dry forest of Northeastern Brazil. Journal of arid environments 74:1374-1380.
LIU, H & KOPTUR, S. 2003. Breeding system and pollination of a narrowly endemic herb of the Lower Florida Keys: Impacts of the urban-wildland interface. American Jounal of Botany 90: 1180-1187.
MARAZZI, B., ENDRESS, B. K., QUEIROZ, L. P. & CONTI, E. 2006 Phylogenetic relationships within Senna (Cassiinae-Leguminosae) in Paraguay: synopses, occurrence, ecological role and ethnobotany. Candollea 61:315-329.
MARAZZI, B., ENDRESS, B. K. 2008. Patterns of development of floral assymmetry in Senna (Leguminosae-Cassiinae). American Journal of Botany, v. 95. n.1.p.22-40.
MULLER, H. 1881. Two kinds of stamens with diferente functions in the same flower. Nature, 24: 307-308.
MULLER, F. 1883. Two kinds of stamens with diferente functions in the same flower. Nature, 27: 364-365.
OWENS, S. J. 1989. Stigma, style, pollen and the pollen-stigma interactions in Caesalpinioideae. In: Advances in legume biology. Monographs in Sistematic Botany from the Missouri Botanic Garden, 29: 113-126.
PAILLER, T. & THOMPSON, J. D. 1997. Distyly and variation in heteromorphic incompatibility in Gaertnera vaginata (Rubiaceae) endemic to la reunion Island. American Journal of Botany 84(3): 315-327.
PINHEIRO, M. & SAZIMA, M. 2007. Visitantes florais e polinizadores de seis espécies arbóreas de Leguminosae melitófilas na Mata Atlântica no sudeste do Brasil. Revista Brasileira de Biociências, 5: 447-499.
RIBEIRO, R. A. & LOVATO M. B. 2004. Mating system in a neotropical tree species, Senna multijuga (Fabaceae). Genet. Mol. Biol. 27(3): 418-424.
RODRIGUES-RIAÑO, T., ORTEGA-OLIVENCIA A. & DEVESA, J. A. 1999. Reproductive biology in two Genisteae (Papilionoideae) endemic of the western Mediterranean region: Cytisus striatus and Retama sphaerocarpa. Canadian Journal of Botany 77: 809-820.
RODRIGUES, R. S., FLORES, A. S., MIOTTO, S. T. S. & BAPTISTA, R. L. M. 2005. O gênero Senna (Leguminosae- Caesalpinioideae) no Rio Grande do Sul, Brasil. Acta Botânica Brasilica, 19(1): 1-16.
SILVA, A. L. G., ORMOND, W. T. & PINHEIRO, M. C. B. 2002. Biologia floral e reprodutiva de Senna autralis (Vell.) Irwin & Barneby (Fabaceae, Caesalpinioideae). Boletim do Museu Nacional, 121: 1-11.
STEPHENSON, A. G. 1981. Flower and fruit abortion: proximate causes and ultimate functions. Anual Review of Ecology, Evolution and Systematics 12: 432-440.
VALEJO-MARÍN, M., DA SILVA, E. M., SARGENT, R. D. & BARRET, S. C. H. 2010. Trait correlates and functional significance of heteranthery in flowering plants. The new phytologist, 188, 418-425.
VOEGEL, S. 1978. Evolutionary shifts from reward to deception in polen flowers. In: The pollination of flowers by insects. Linnean Society Symposium Series 6: 89-96.
WESTERKAMP, C. 2004. Ricochet pollination in Cassis- and how bees explain enantiostily. In: Magalhães FB, Pereira JO. Eds. Solitary bees: Conservation, rearing and manegement for pollination. Fortaleza: Universidade Federal do Ceará,p. 255-230.
WOLOWSK, M. & FREITAS, L. 2010. Sistema reprodutivo e polinização de Senna multijuga (Fabaceae) em Mata Atlãntica montana, Rodriguesia, 61: 167-179
ZEISLER, M. 1938. Uber die Abgrenzung der eigentlichen Narbenflache mit Hilfe von Reaktionen. Beith. Bot. Centralbl. 58: 308-318.
