REGISTRO DOI: 10.5281/zenodo.7013693
Autores:
Danielle Veloso Marinho Guedes1
Raíssa Andrade do Nascimento1
Kawanna Franco Mota1
Hanah Kamada Chaves Ribeiro1
Tsutomu Kamada Chaves Ribeiro1
Tawanna Franco Mota2
Orientador:
Leonardo Mendes Acatauassú Nunes1
Coorientador:
Marília Gabriela Queiroz da Luz1
RESUMO
Objetivo: Avaliar a prevalência de sintomas da síndrome da apneia obstrutiva do sono em grávidas atendidas no Ambulatório de Atenção à Saúde da Gestante do Centro de Especialidades Médicas do Cesupa. Método: O estudo, observacional e transversal, foi realizado por meio do preenchimento de questionário e escalas por 50 pacientes, no período de outubro de 2018 a março de 2019, e em um segundo momento, por meio da coleta de dados dos respectivos prontuários. Resultados: O sintoma mais denunciado (78%) pelas participantes foi o cansaço durante o dia. 48,9% das pacientes relataram sonolência diurna excessiva e 40%, ronco. Não foi encontrada correlação significante entre a sonolência diurna excessiva e o ronco. A faixa etária mais prevalente foi a de 21 a 25 anos, enquanto 50% das gestantes eram nulíparas e 40% estavam no terceiro trimestre. Não houve relação entre sintomas apresentados e alteração de índice de massa corpórea ou pressão arterial sistêmica. Conclusão: Constatou-se significativa presença de sintomas da síndrome da apneia obstrutiva do sono nas mulheres avaliadas, ainda que inespecíficos, o que possivelmente deve-se ao modesto tamanho amostral e transversalidade do estudo.
Palavras-chave: Apneia Obstrutiva do Sono. Gravidez. Complicações na Gravidez.
ABSTRACT
Objective: Assess the prevalence of symptoms of obstructive sleep apnea syndrome in pregnant women attended at Prenatal Care Ambulatory of Medical Specialties Center of Cesupa. Methods: This was a cross-sectional study, conducted by analyzing the filling of questionnaire and scales by 50 patients, between October 2018 and March 2019, and in a second phase, by data collection from respective medical records. Results: The most denounced symptom (78%) by the participants was tiredness during the day. 48.9% of the patients reported excessive daytime sleepiness and 40%, snoring. No significant correlation was found between excessive daytime sleepiness and snoring. The most prevalent age group was 21 to 25 years, while 50% of pregnant women were nulliparous and 40% were in the third trimester. There was no relationship between symptoms presented and alteration of body mass index or systemic blood pressure. Conclusion: There was a significant presence of symptoms of obstructive sleep apnea syndrome in the women evaluated, although non-specific ones, which is possibly the result of modest sample size and study’s cross-sectionalism.
Keywords: Obstructive Sleep Apnea. Pregnancy. Pregnancy Complications.
INTRODUÇÃO
A síndrome da apneia obstrutiva do sono (SAOS), principal distúrbio respiratório do sono, é considerada atualmente um problema de saúde pública, devido às suas complicações cardiovasculares e metabólicas1. Caracteriza-se por colapso repetitivo e cíclico das vias aéreas superiores durante o sono, gerando apneia, definida como ausência de fluxo de ar por pelo menos 10 segundos; dessaturação intermitente de oxigênio, com hipoxemia; despertares noturnos e estimulação do sistema nervoso simpático2,3.
Fisiologicamente, à noite ocorre rebaixamento da atividade motora dos músculos esqueléticos, incluindo os responsáveis por manter as vias aéreas patentes durante o período de pressão intraluminal negativa gerada pela contração diafragmática. Dessa forma, há maior propensão ao estreitamento do diâmetro transverso da faringe durante as inspirações noturnas. Além disso, a anatomia das vias aéreas de alguns indivíduos apresenta-se naturalmente mais estreita, o que não acarreta dificuldade respiratória durante o dia, já que a musculatura faríngea se encarrega de manter a tensão das paredes desta região, entretanto condiciona o colabamento faríngeo durante o sono4,5.
A hipoxemia e a hipercapnia resultantes destas obstruções intermitentes resultam em ativação do sistema nervoso simpático, que por sua vez atua elevando os níveis séricos de catecolaminas, acarretando inflamação, disfunção endotelial, e alteração da coagulabilidade5. Esses mecanismos podem gerar alterações cardiovasculares, como hipertensão arterial, síndrome metabólica, intolerância glicídica e diabetes mellitus tipo 26.
O quadro clínico dos pacientes portadores da SAOS pode ser composto de sintomas diurnos e noturnos. Dentre os sintomas diurnos, o mais comum é a sonolência excessiva diurna, além de sensação de sono não restaurador, cefaleia matinal, fadiga, falta de concentração, ansiedade e outros7. O principal sintoma noturno é o ronco, contudo, despertar ofegante, noctúria, e apneias testemunhadas também são relatados8. Enquanto o ronco é considerado o sintoma mais comum da síndrome, as apneias testemunhadas e despertar ofegante são considerados mais específicos9.
A prevalência de SAOS na gestação cresceu de 0,7 para 7,3 a cada 10.000 gestantes durante o período de 1998 a 2009, com um aumento anual de 24%10,11,12. Entretanto, esses números são determinados com base em casos diagnosticados, e provavelmente subestimam o real cenário da SAOS na gestação, visto que o rastreio não é realizado rotineiramente10.
Gestantes com doenças crônicas, tais como diabetes, hipertensão, síndrome do ovário policístico, artrite e depressão têm um risco significativamente maior de desenvolver SAOS quando comparadas com gestantes saudáveis. Além disso, alguns estudos mostram associação entre distúrbios respiratórios do sono e ronco com o desenvolvimento de diabetes mellitus, além da relação entre resistência à insulina e SAOS associada à obesidade13.
A gravidez está associada a mudanças hormonais e anatômicas que alteram a qualidade e os padrões do sono14,15. Os altos níveis de estrogênio geram edema e hipersseceção de mucosas, com aumento global da resistência nasal e orofaríngea15, enquanto a elevação da progesterona cursa com aumento do drive respiratório, que por sua vez reduz a PaCO2, também aumentando a resistência da via aérea16. Além disso, o ganho de peso na gestação favorece a deposição de gordura na via aérea, além da diminuição da capacidade contrátil da musculatura respiratória, o que, associado ao útero gravídico, aumenta a capacidade residual funcional, a relação ventilação-perfusão e o gradiente alvéolo-capilar, diminuindo a oxigenação17. Tais alterações costumam aparecer a partir da décima semana de gestação, contudo, é no terceiro trimestre que podem ser mais perceptíveis, haja vista a progressão da gravidez18.
Durante a gestação, a alcalose respiratória crônica estimula a síntese de 2,3-difosfoglicerato, causando desvio para a direita na curva de dissociação da hemoglobina, o que aumenta a transferência de oxigênio através da placenta. Isso compensa as alterações fisiológicas mencionadas acima, porém, a presença de apneia ou hipopneia pode levar à hipóxia materna e à diminuição do oxigênio transferido para o feto12. A ideia de que a SAOS pode alterar a função placentária é corroborada pela evidência de níveis alterados de marcadores de bem-estar feto-placentário em mulheres com SAOS, podendo-se citar a redução de alfa-fetoproteína e estriol, bem como a presença de normoblastemia fetal em mulheres que roncam20.
Alguns estudos têm mostrado que a presença de sintomas como ronco e sonolência diurna são comuns e aumentam durante a gravidez, sobretudo no terceiro trimestre21. Sabe-se que durante o primeiro trimestre há aumento do tempo total de sono, entretanto, menor tempo do sono de ondas lentas12. Já no segundo trimestre, o tempo total de sono também diminui, juntamente com a duração do sono REM18. Dessa forma, no terceiro trimestre a gestante apresenta redução global da duração e da qualidade do sono. Comparando grupos de mulheres grávidas em terceiro trimestre e não-grávidas em pré-menopausa, houve maior porcentagem de ronco entre as gestantes, o que também teve relação com mais nascimentos prematuros18,22.
As limitações do fluxo aéreo devido SAOS não tratada em gestante podem levar a complicações significativas tanto para a mãe quanto para o feto18. Situações adversas, tais como hipertensão gestacional, pré-eclâmpsia, diabetes gestacional, cardiomiopatia e embolia pulmonar podem ocorrer11. Além disso, distúrbios do sono na gravidez podem levar a um aumento do número de cesarianas, nascimentos prematuros, redução do crescimento intrauterino, tamanho pequeno para a idade gestacional e índice de APGAR baixo20,22,23,24. Também foi observado risco de maior permanência no hospital após o parto em mulheres com SAOS além de maior probabilidade de admissão nas Unidades de Terapia Intensiva (UTI)12.
Gestantes com SAOS têm risco aumentado de desenvolver edema pulmonar, cardiomiopatia e insuficiência cardíaca congestiva18. Períodos de hipóxia intermitentes associados com SAOS causam disfunção no endotélio vascular, inflamação e estresse oxidativo. Tais alterações endoteliais podem contribuir com a fisiopatologia da pré-eclâmpsia e são vistas em mulheres com pré-eclâmpsia e SAOS12.
A polissonografia é o exame padrão-ouro para o diagnóstico da SAOS, que se dá pela clínica associada ao Índice de Apneia-Hipopneia (IAH) maior ou igual a 525. No entanto, por seu alto custo, alta complexidade, e restrito acesso, faz-se necessário que outros métodos sejam utilizados para triagem, como as escalas e os questionários, entre eles a Escala de Sonolência de Epworth e a Escala de Ronco de Stanford, que revelam aqueles que têm maior risco de apresentar SAOS, selecionando, dessa forma, os que poderiam se beneficiar da polissonografia7,12,13,24,26,27.
A Escala de Sonolência de Epworth é simples e autoaplicável, e tem sido utilizada em diversos estudos para avaliação da sonolência. É composta por oito situações do cotidiano nas quais se questiona a chance de o paciente cochilar, devendo ele pontuar esta chance com uma nota de 0 a 3, sendo: 0, nenhuma chance de cochilar; 1, uma chance pequena; 2, uma chance moderada; e 3, uma alta probabilidade de cochilar. Varia, portanto, de 0 a 24 pontos, sendo que uma pontuação acima de 10 sugere a ocorrência de sonolência diurna excessiva ou anormal24,28,29.
A Escala de Ronco de Stanford permite a detecção do ronco e a sua classificação em cinco categorias, de acordo com o valor da nota dada à intensidade do mesmo, podendo variar de 0 a 10, sendo esta referida por parceiros, de acordo com o incômodo gerado25,26.
Perante tais achados, o presente trabalho visa avaliar a prevalência de sintomas da SAOS em gestantes atendidas no Ambulatório de Atenção Saúde à Gestante do Centro de Especialidades Médicas do Cesupa (CEMEC).
MÉTODOS
Após aprovação pelo Comitê de Ética e Pesquisa em Seres Humanos do Centro Universitário do Estado do Pará (CEP-CESUPA), sob processo número 2.851.818 (Anexo A), foi realizado estudo observacional transversal com 61 pacientes atendidas no Ambulatório de Atenção à Saúde da Gestante do CEMEC, em Belém-Pará, no período de outubro de 2018 a março de 2019. Após assinatura do Termo de Consentimento Livre e Esclarecido (TCLE), as pacientes preencheram um questionário de sintomas de SAOS (apêndice B), a Escala de Sonolência de Epworth (anexo B) e a Escala de Ronco de Stanford (anexo C). Posteriormente, foi feita coleta das variáveis de estudo (idade gestacional, paridade, IMC calculado na avaliação do estado nutricional inicial, IMC atual, e alterações de pressão arterial sistêmica no período gestacional), obtidas nos respectivos prontuários, por meio da ficha de coleta de dados (apêndice C). Foram incluídas pacientes grávidas com idade acima de 18 anos, e excluídas aquelas que não dormiam no mesmo cômodo do parceiro. As informações da caracterização amostral foram apuradas em banco de dados elaborado no software Microsoft® Office Excel® 2016. Na aplicação da Estatística Descritiva, foram construídos tabelas e gráficos para apresentação dos resultados e calculadas as medidas de posição como média aritmética e desvio padrão. A estatística analítica foi utilizada para avaliar os resultados das variáveis categóricas da amostra através dos Testes G e Qui-Quadrado Aderência para tabelas univariadas. Na verificação das associações entre as escalas utilizadas e as variáveis de interesse foram calculadas a matriz de correlação de Pearson e o coeficiente de Spearman. As estatísticas descritiva e analítica, foram realizadas no software BioEstat® 5.4. Para a tomada de decisão, adotou-se o nível de significância α = 0,05 ou 5%, sinalizando com asterisco (*) os valores significantes.
RESULTADOS
TABELA 1 – NÚMERO DE CONSULTAS REALIZADAS PELAS GESTANTES DO ESTUDO ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019
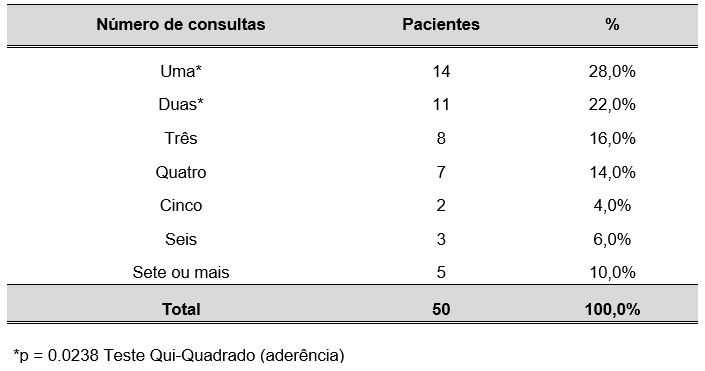
Houve proporção significativa de pacientes que realizaram de uma a duas consultas durante a realização do presente estudo.
FIGURA 1 – TRIMESTRE GESTACIONAL DAS PACIENTES DO ESTUDO ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019
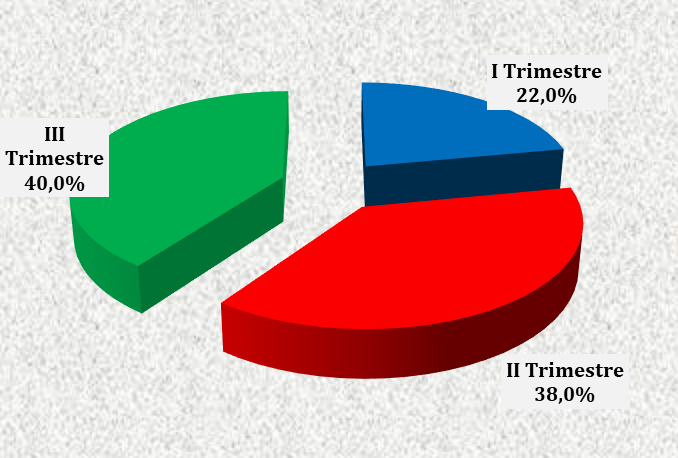
Observa-se, na figura 1, a distribuição das pacientes estudadas de acordo com o trimestre gestacional. Apesar da prevalência do terceiro trimestre, não houve diferença significante nesta distribuição.
TABELA 2 – NÚMERO DE GESTAÇÕES, PARIDADE E ABORTOS RELATADOS PELAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019
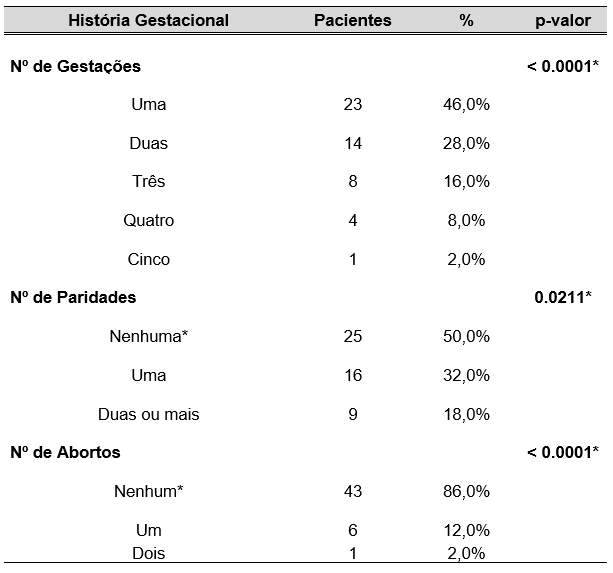
Observa-se, na tabela 2, que houve proporção significativa de pacientes com uma gestação, nenhuma paridade e nenhum aborto (G1P0A0).
FIGURA 2 – RELAÇÃO ENTRE O ÍNDICE DE MASSA CORPORAL INICIAL E ATUAL DAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019.
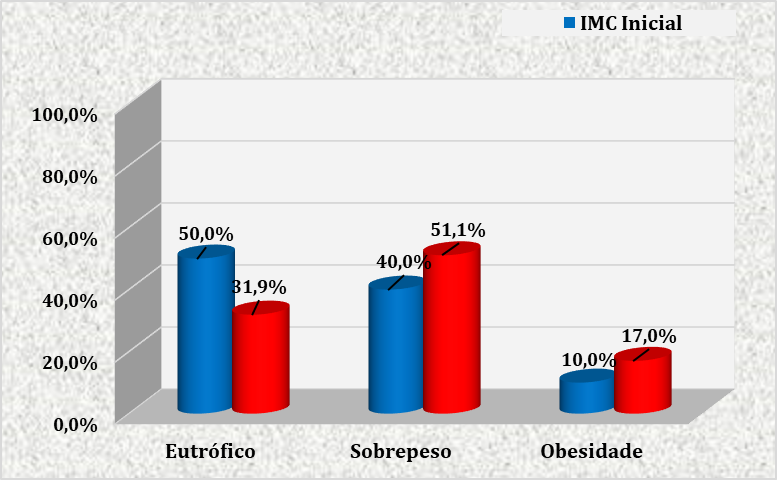
Na figura 2, observa-se que no início da gestação metade das pacientes analisadas encontravam-se eutróficas (50%). Em segunda análise (IMC atual), prevaleceu o sobrepeso (51,1%).
TABELA 3 – FAIXA ETÁRIA DAS GESTANTES DO ESTUDO ATENDIDAS NO CENTRO DE ESPECIALIDADE MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019.
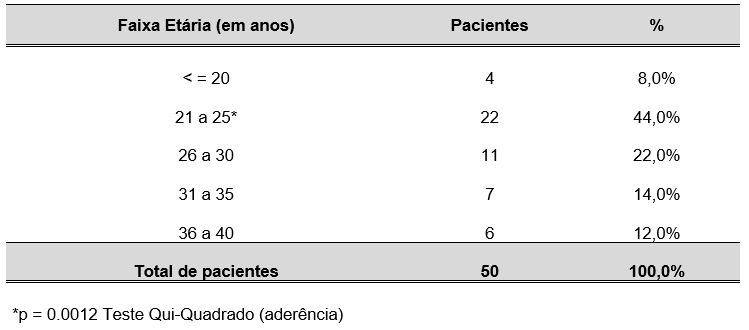
Na tabela 3, nota-se que houve proporção significante de pacientes com idade entre 21 a 25 anos.
FIGURA 3 – MEDIDAS DE PRESSÃO ARTERIAL REGISTRADAS NAS CONSULTAS REALIZADAS PELAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019.
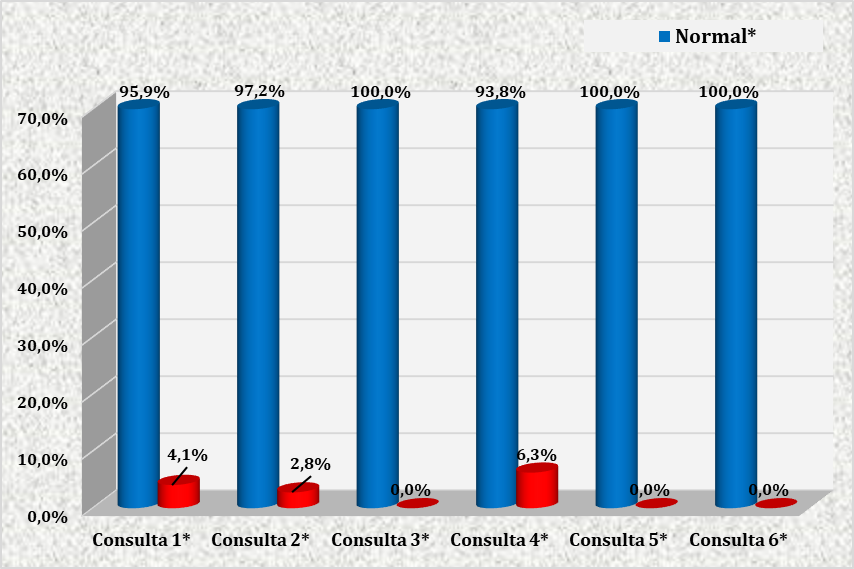
Através da figura 3, observa-se que houve proporção significante de pacientes com pressão arterial normal em todas as consultas.
TABELA 4 – CARACTERÍSTICAS E SINTOMAS RELATADOS ATRAVÉS DO QUESTIONÁRIO PARA AVALIAÇÃO DE SAOS EM GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019
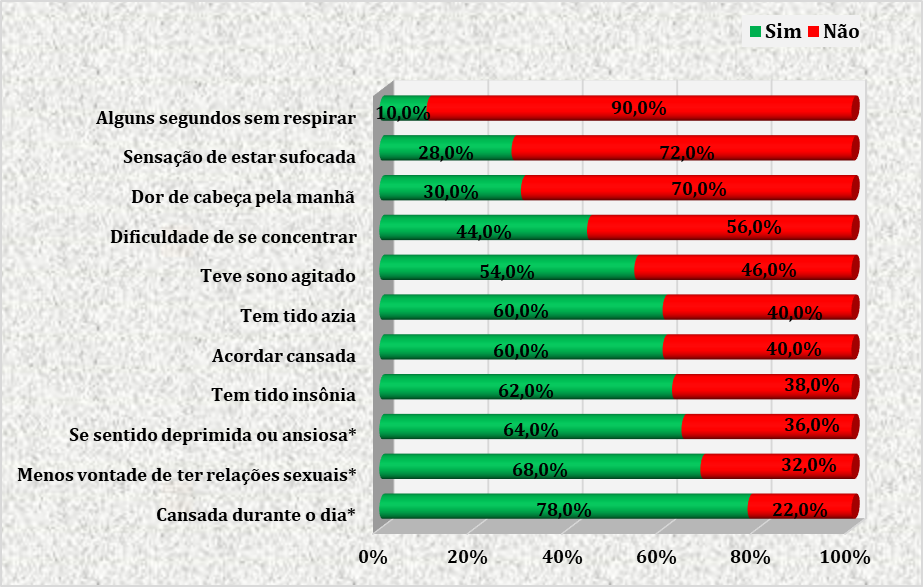
Na tabela 4, observa-se que os sintomas mais referidos pelas gestantes foram cansaço durante o dia (78%), menos vontade de ter relações sexuais (68%) e sentimento de depressão ou ansiedade (64%). Cerca de 28% relataram sensação de sufocamento e 10% referiram episódios em que ficaram alguns segundos sem respirar durante a noite.
TABELA 5 – PROBABILIDADE DE COCHILAR OU DORMIR EM SITUAÇÕES DO COTIDIANO PROPOSTAS PELA ESCALA DE EPWORTH, SEGUNDO RELATO DAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019
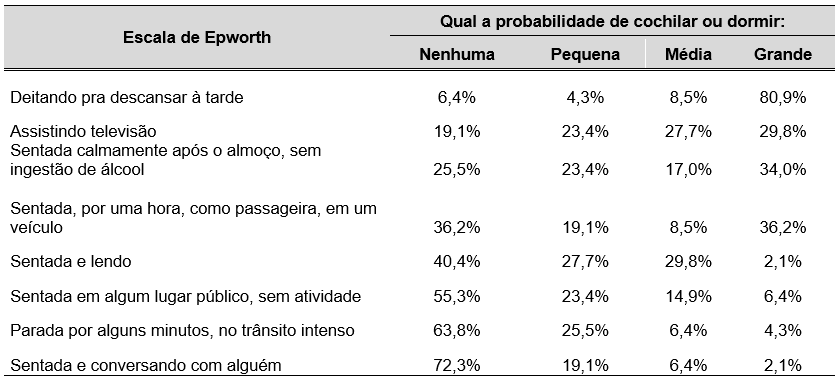
Observa-se na Tabela 5 que, segundo relato das pacientes, existe grande probabilidade de cochilar ou dormir ao deitar-se para descansar à tarde (80,9%) e probabilidade significativa ao assistir televisão (29,8%), ao sentar-se calmamente após o almoço sem ingestão de álcool (34%) e ao sentar-se por uma hora como passageira em um veículo (36,2%).
FIGURA 4 – CLASSIFICAÇÃO DA SONOLÊNCIA, ATRAVÉS DA ESCALA DE EPWORTH, DAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019
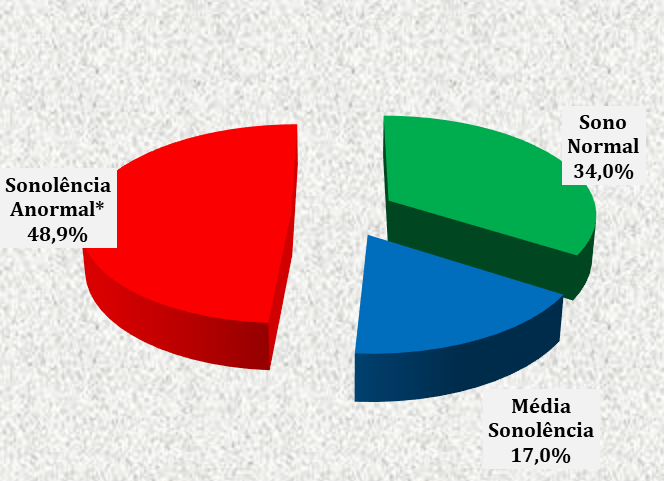
Na Figura 4 pode-se perceber que houve proporção significante de sonolência anormal (48,9%) entre as pacientes analisadas no estudo.
TABELA 6 – CLASSIFICAÇÃO DO RONCO SEGUNDO STANFORD ATRAVÉS DOS RELATOS DAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019

Na Tabela 6, observa-se que a maioria das pacientes, cerca de 60% não relatou ronco. Porém, 35,6% das gestantes referiram ronco leve e 4,4% queixaram-se de ronco alto.
FIGURA 5 – CORRELAÇÃO ENTRE AS ESCALAS DE EPWORTH E STANFORD A RESPEITO DOS SINTOMAS SONOLÊNCIA E RONCO NAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019
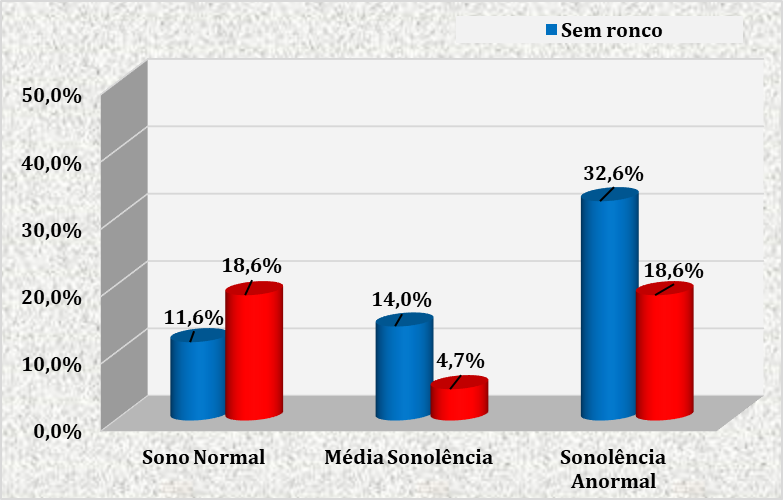
Foi calculada a matriz de correlação tendo como variáveis dependentes as escalas de Epworth e Stanford. Não foi encontrada correlação significante entre as duas escalas, na amostra coletada. Observa-se, na Figura 5, que das pacientes que referiram sono normal, a maioria (18,6%) queixaram-se de ronco leve ou alto. Já em relação às pacientes com sonolência anormal, grande parte (32,6%) relatou ausência de ronco.
FIGURA 6 – GRÁFICO DE DISPERSÃO MOSTRANDO CORRELAÇÃO ENTRE AS VARIÁVEIS ESCALA DE EPWORTH E IDADE GESTACIONAL DAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019
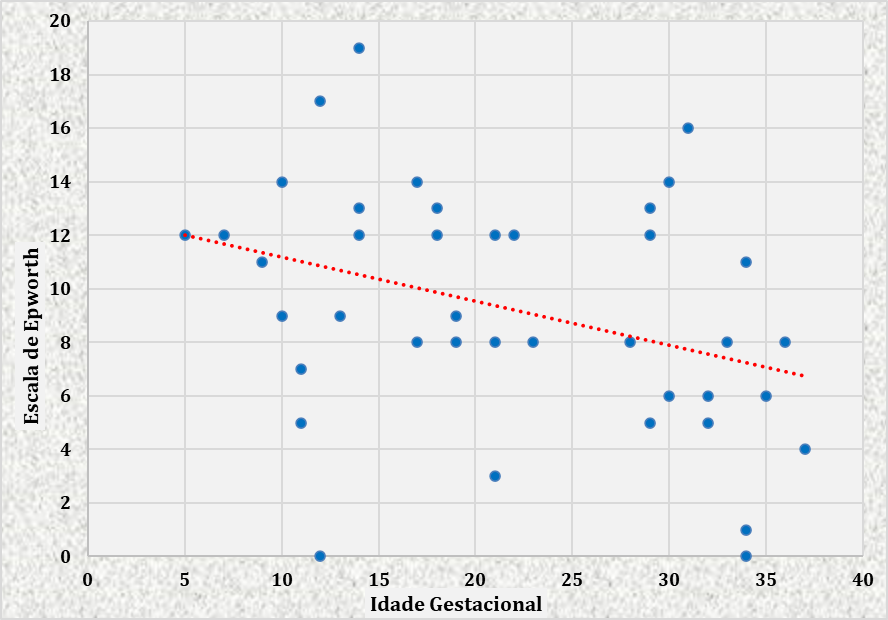
Encontrou-se correlação significante entre a escala de Epworth e Idade Gestacional. Essa correlação se mostrou inversa, ou seja, quanto maior a idade gestacional, menor é o valor da escala de Epworth, como mostrado no gráfico de dispersão (Figura 6), o que demonstra que no início da gestação os valores da escala são maiores.
TABELA 7 – RELAÇÃO ENTRE OS SINTOMAS DE SAOS E AS IDADES DAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019
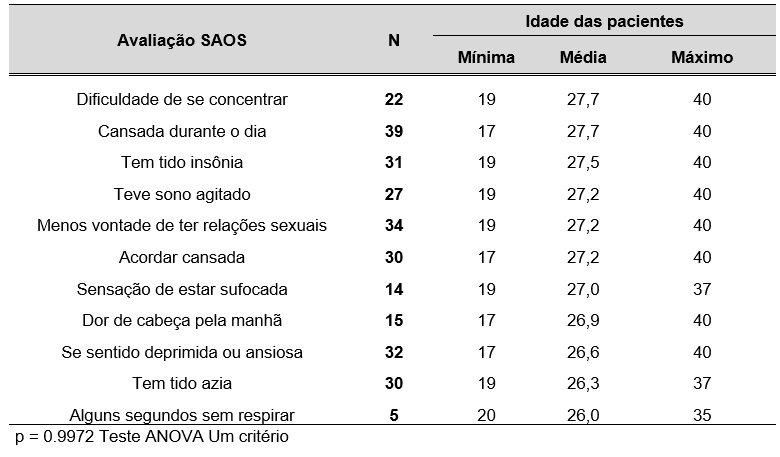
Na Tabela 7, é possível visualizar a relação entre os sintomas de SAOS e a idade das gestantes. Não houve diferença significante entre diferença de idade e sintoma apresentado. Observa-se que a média de idade foi em torno de 26 e 27 anos para todos os sintomas pesquisados através do questionário para avaliação de SAOS.
TABELA 8 – RELAÇÃO ENTRE O SINTOMA SONOLÊNCIA PESQUISADO PELA ESCALA DE EPWORTH E AS IDADES DAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019

Em relação à sonolência avaliada pela escala de Epworth, não houve diferença significante para a idade das pacientes estudadas.
TABELA 9 – RELAÇÃO ENTRE O RONCO PESQUISADO PELA ESCALA DE STANFORD E AS IDADES DAS GESTANTES ATENDIDAS NO CENTRO DE ESPECIALIDADES MÉDICAS DO CESUPA, NO AMBULATÓRIO DE ATENÇÃO À SAÚDE DA GESTANTE, BELÉM, 2019

Em relação ao ronco avaliado pela escala de Stanford, também não houve diferença significante para a idade das pacientes.
TABELA 10 – VARIÁVEIS NUMÉRICAS SEGUNDO AS ESTATÍSTICAS DESCRITIVAS DE POSIÇÃO E DISPERSÃO
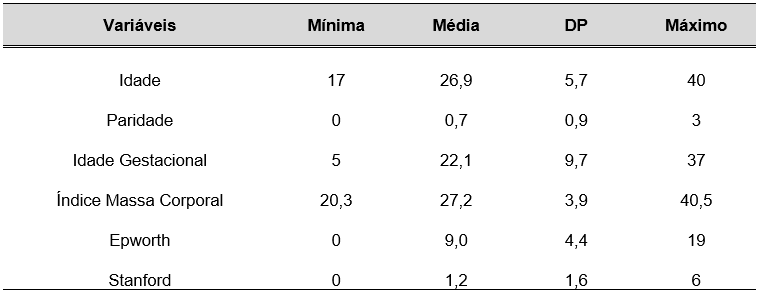
Na Tabela 10, observa-que a idade média das pacientes estudadas foi de 17 anos, enquanto que a média da idade gestacional foi de 22,1 semanas e a de IMC, 27,2 kg/m². Em relação à escala de Epworth, a média obtida foi de 9 pontos, enquanto a da escala de Stanford foi de 1,2 pontos.
DISCUSSÃO
No presente estudo, a maior parte das queixas relatadas pelas pacientes relacionou-se com sintomas diurnos, como cansaço durante o dia (78%). O que se assemelha ao estudo no qual as queixas mais frequentes das pacientes relacionavam-se com sintomas durante o dia, particularmente sonolência excessiva diurna, fadiga e sono não reparador25. Nesse contexto, convém mencionar que tais sintomas podem se sobrepor aos próprios sintomas da gravidez, já que a sonolência excessiva é uma queixa muito comum entre mulheres grávidas que pode ser causada por mudanças hormonais e distúrbios respiratórios e do sono, como mencionado em literatura16.
Em relação à classificação de ronco segundo Stanford, grande parte das gestantes estudadas relatou ausência de ronco ou ronco leve. Em contrapartida, estudos7,17, demonstraram a presença desse sintoma e o aumento de sua prevalência à medida que a gestação progride, do primeiro ao terceiro trimestre. Porém, convém destacar que quando comparadas com os homens, as mulheres são menos propensas a relatar ronco e outros sintomas de SAOS, somado ao fato de que este sintoma é geralmente notado por pessoas próximas às gestantes, que não estavam presentes na ocasião do preenchimento dos questionários, o que pode contribuir como viés de informação.
Ainda nesse contexto, observou-se que quase metade das pacientes estudadas apresentou sonolência excessiva diurna (48,9%), demonstrada pela escala de Epworth, concordando com estudos em que a maior parte das gestantes relataram qualidade do sono pobre, sono noturno insuficiente e sonolência diurna excessiva3,6. Entretanto, como mencionado anteriormente, a sonolência diurna é uma queixa muito comum ao longo da gravidez, mesmo em mulheres sem SAOS.
Durante a gravidez, a sonolência excessiva tem sido reportada no primeiro trimestre gestacional, piorando durante o segundo e terceiros trimestres, quando a qualidade do sono é afetada pelo desconforto físico da gravidez avançada. É o que demonstram os estudos em que as pacientes estudadas apresentaram aumento da sonolência durante o curso da gravidez, com valores mais baixos da escala de Epworth no primeiro trimestre e valores mais altos no mês final de gestação17,25,26. Entretanto, neste estudo, observou-se valores mais altos da escala no início da gestação, o que contradiz outros autores. Todavia, a sonolência excessiva diurna é altamente prevalente mesmo durante o início da gravidez25. Além disso, tal achado é compatível com estudos de outros autores nos quais a sonolência diurna foi mais frequente no primeiro do que durante o segundo e terceiro trimestres15.
Não foi encontrada correlação significante entre os sintomas ronco e sonolência anormal durante este estudo. Tal achado é consistente com estudos prévios que demonstram que mulheres grávidas com distúrbios respiratórios do sono podem não se queixar de sonolência excessiva16. De fato, um recente estudo mostrou que apenas 25% das mulheres que roncavam obtiveram valores maiores que 10 na escala de Epworth29. Outro estudo encontrou uma modesta correlação entre a escala de Epworth e o ronco na gravidez16.
Neste estudo, houve proporção significante de pacientes com pressão arterial normal em todas as consultas. É sabido que existe correlação direta entre a SAOS e a Hipertensão Arterial Sistêmica (HAS), visto que pacientes com distúrbios respiratórios do sono possuem fatores que podem contribuir para o desenvolvimento de HAS, tais como a atividade simpática aumentada11,13.
O presente estudo apresentou algumas limitações. Os questionários para avaliação de sintomas de SAOS e as escalas de Stanford e Epworth são alternativas para triagem de possíveis pacientes com SAOS, gestantes ou não. Nesse sentido, a principal vantagem é que podem ser aplicados repetidas vezes durante a gravidez, pelo fácil manuseio e baixo custo. Todavia, como relatado em estudos prévios, apresentam menor acurácia em diagnosticar e quantificar a severidade da SAOS quando comparada com outros métodos como a Polissonografia14,24.
No atual cenário de Belém, no Estado do Pará, a Polissonografia, exame padrão-ouro para o diagnóstico de SAOS, é realizada apenas em um serviço de saúde, a saber, Hospital Universitário Bettina Ferro de Souza, e já atende a uma grande demanda de pacientes. Nesse contexto, o tempo médio de espera para a realização do exame por parte das pacientes estudadas seria inviavelmente longo, tendo por base os prazos estabelecidos para o desenvolvimento do presente trabalho.
Além disso, as limitações desse estudo incluem um tamanho amostral modesto, sendo a maior parte da população analisada de gestantes de baixo risco, as quais podem não ser representativas para todos os grupos de gestantes. De fato, vários trabalhos apontam que gestantes com gravidez de alto risco apresentam maiores chances de desenvolver SAOS13,16,25. Por conta disso, é importante que se pesquise sintomas da SAOS especialmente em gestantes obesas, hipertensas, diabéticas e portadoras da síndrome dos ovários policísticos como parte dos cuidados de rotina12.
Somado a todos estes fatores, convém mencionar que a maioria das participantes da pesquisa tinham realizado de uma a duas consultas até o momento da coleta de dados, logo, não houve estudo longitudinal da gravidez completa em relação aos sintomas pesquisados, o que poderia ter demonstrado melhores resultados em termos de mudanças dos mesmos com o passar do tempo17.
É importante reafirmar, também, que os sintomas da SAOS podem se confundir com os sintomas próprios da gestação, onde, devido a alterações hormonais, principalmente o aumento da progesterona, há maior tendência ao colapso das vias aéreas superiores durante o sono24.
Diante do exposto, a explicação para os baixos valores discriminativos dos questionários convencionais de triagem de SAOS durante a gravidez aplicados neste estudo (média de nove pontos na escala de Epworth e de 1,2 na de Stanford) pode ser relacionada ao fato de que tanto a SAOS quanto a gravidez levam a queixas semelhantes quanto ao padrão e qualidade do sono. Além disso, há uma mudança contínua na sintomatologia e gravidade das desordens respiratórias e de sono com a progressão da gravidez25. Somado a isto, tanto o parâmetro quanto o limiar para o diagnóstico SAOS na gravidez ainda não foram definidos. E por último, o momento ideal para a aplicação dos questionários ainda não foi padronizado.
Em suma, no que concerne ao estudo da SAOS na gestação, o desafio é desenvolver estratégias diagnósticas que permitam abordar com eficiência tal cenário. As evidências científicas ainda são insuficientes e há muito o que investigar, visto que a SAOS na gravidez é provavelmente subdiagnosticada, devido a fatores como a falta de ferramentas de triagem de alta acurácia validadas e à necessidade de maior compreensão dos efeitos dinâmicos da gravidez na SAOS10.
CONCLUSÃO
A avaliação dos sintomas da SAOS em mulheres atendidas no Ambulatório de Atenção à Saúde da Gestante do CEMEC revelou que todas as pacientes dessa casuística apresentaram ao menos um sintoma característico da síndrome, sendo cansaço matinal o mais denunciado, seguido de diminuição da libido e sensação de depressão ou ansiedade. Tais sintomas não são os mais comuns da SAOS, descritos em literatura nacional e internacional, nem mesmo os mais específicos. Além disso, não foi verificada correlação significativa entre os sintomas e a idade, paridade ou IMC das pacientes. Ademais, não foi encontrado qualquer sinal de complicação pressórica entre as gestantes estudadas. Ainda assim, considerando que nos últimos anos tem-se dado significativa importância para o estudo da SAOS na gestação, visto esta ser uma condição tanto subdiagnosticada, dada a complexidade de ser avaliada em um contexto confundidor como a gravidez, como potencialmente causadora de desfechos maternos e fetais desfavoráveis, conclui-se que é importante ter postura ativa quanto à avaliação da qualidade de sono das gestantes durante as consultas de pré-natal, ou mesmo em consultas otorrinolaringológicas ainda que procuradas por queixas outras que não relacionadas ao sono.
REFERÊNCIAS BIBLIOGRÁFICAS
1. Boari L, Cavalcanti CM, Bannwart SRFD, Sofia OB, Dolci JEL. Avaliação da escala de Epworth em pacientes com a Síndrome da apnéia e hipopnéia obstrutiva do sono. Ver. Bras. Otorrinolaringol. 2004; 70(6):752-6.
2. Bullough AS. Sleep disordered breathing in pregnancy: an obstetric anesthesiologist’s perspective. Open Sleep Journal. 2013; 6(1):44-53.
3. Tantrakul V, Numthavaj P, Guilleminault C, McEvoy M, Panburana P, Khaing W, et al. Performance of screening questionnaires for obstructive sleep apnea during pregnancy: A systematic review and meta-analysis. Sleep medicine reviews. 2017; 36:96-106.
4. Santos MBV. Especificidades da síndrome da apneia obstrutiva do sono na mulher [dissertação na internet]. Coimbra (Portugal): Universidade de Coimbra, Faculddade de Medicina; 2014 [acessado em: 24 fev. 2018]. 12p. Disponível em: https://estudogeral.sib.uc.pt/handle/10316/28090.
5. Zancanella E, Haddad FM, Oliveira LAMP, Nakasato A, Duarte BB, Soares CFP, et al. Obstructive sleep apnea and primary snoring: diagnosis. Brazilian journal of otorhinolaryngology. 2014; 80(1):1-16.
6. Cintra FD, Tufik S, Paola AD, Feres MC, Melo-Fujita L, Oliveira W, et al. Perfil cardiovascular em pacientes com apneia obstrutiva do sono. Arq Bras Cardiol. 2011; 96(4):293-9.
7. Schönfeld D, Pérez-chada D. Trastornos respiratorios del sueño durante el embarazo [editorial]. Revista americana de medicina respiratória (Buenos Aires). 2018;18(1):25-32.
8. Downey R, Gold PM, Wickramasinghe H. Obstructive sleep apnea. Medscape. 2009.
9. Venkata C, Venkateshiah SB. Sleep-disordered breathing during pregnancy. The Journal of the American Board of Family Medicine. 2009;22(2):158-68.
10. Spence DL, Allen RC, Lutgendorf MA, Gary VR, Richard JD, Gonzalez SC, et al. Association of obstructive sleep apnea with adverse pregnancy-related outcomes in military hospitals. European Journal of Obstetrics and Gynecology and Reproductive Biology. 2017;210:166-172.
11. Lima S. Associação entre distúrbios respiratórios do sono e pré-eclâmpsia [mestrado]. Brasília: Universidade de Brasília, Faculdade de Medicina; 2006.
12. Carnelio S, Morton A, Mcintyre H. David. Sleep disordered breathing in pregnancy: the maternal and fetal implications. Journal of Obstetrics and Gynaecology. 2017;37(2):170-8.
13. Karaduman M, Sari O, Aydogam U, Akpak YK, Semiz A, Yilanlioglu NC, et al. Evaluation of obstructive sleep apnea symptoms in pregnant women with chronic disease. The Journal of Maternal-Fetal & Neonatal Medicine. 2016;29(20):3379-3385.
14. Santiago JR, Nolledo MS, Kinzler W, Santiago TV. Sleep and sleep disorders in pregnancy. Annals of Internal Medicine. 2001;134(5):396-408.
15. Leung PL, Hui DSC, Leung TN, Yuen PM, Lau TK. Sleep disturbances in Chinese pregnant women. BJOG: An International Journal of Obstetrics & Gynaecology. 2005;112(11):1568-1571.
16. Izci-balserak B, Zhu B, Gurubhagavatula I, Keenan B, Pien GW. A Screening Algorithm for Obstructive Sleep Apnea in Pregnancy. Annals of the American Thoracic Society. 2019, jun.
17. Pien GW, Fife D, Pack AI, Nkwuo JE, Schwab RJ. Changes in symptoms of sleep-disordered breathing during pregnancy. Sleep. 2005;28(10):1299-1305.
18. Truong KK, Guilleminault C. Sleep disordered breathing in pregnant women: maternal and fetal risk, treatment considerations, and future perspectives. Expert review of respiratory medicine. 2018;12(3):177-189.
19. Bourjeily G, Danilack VA, Bublitz MH, Lipkind H, Muri J, Caldwell D, et al. Obstructive sleep apnea in pregnancy is associated with adverse maternal outcomes: a national cohort. Sleep medicine. 2017;38:50-7.
20. Bourjeily G, Butterfield K, Curran P, Lambert-Messerlian G. Obstructive sleep apnea is associated with alterations in markers of fetoplacental wellbeing. The Journal of Maternal-Fetal & Neonatal Medicine. 2015;28(3):262-6.
21. Fernández AMA, Chedraui P, Pérez-lópez FR. Assessment of obstructive sleep apnea-hypopnea syndrome risk at the end of pregnancy using the Berlin Questionnaire. Gynecological Endocrinology. 2015;31(9):715-9.
22. Li R, Zhang J, Zhou R, Liu J, Dai Z, Liu D, et al. Sleep disturbances during pregnancy are associated with cesarean delivery and preterm birth. The Journal of Maternal-Fetal & Neonatal Medicine. 2017;30(6):733-8.
23. Bourjeily G, Barbara N, Larson L, He M. Clinical manifestations of obstructive sleep apnoea in pregnancy: more than snoring and witnessed apnoeas. Journal of Obstetrics and Gynaecology. 2012;32(5):434-8.
24. Martins I. Patologia Respiratória do Sono na Gravidez [mestrado]. Porto: Universidade do Porto, Faculdade de Medicina; 2011.
25. Tantrakul V, Sirijanchune P, Panburana P, Pengjam J, Suwansathit W, Boonsarngsuk V, et al. Screening of obstructive sleep apnea during pregnancy: differences in predictive values of questionnaires across trimesters. Journal of clinical sleep medicine. 2015;11(2):157-163.
26. Street LM, Aschenbrenner CA, Houle TT, Pinyan CW, Eisenach JC. Gestational obstructive sleep apnea: biomarker screening models and lack of postpartum resolution. Journal of Clinical Sleep Medicine. 2018;14(4):549-555.
27. Melo MHDA, Neves DD, Ferreira LVMV, Moreira MLV, Nigri R, Simões SMG, et al. Questionários e escalas úteis na pesquisa da síndrome da apneia obstrutiva do sono. Revista Hospital Universitário Pedro Ernesto (HUPE). 2016;15(1):49-55.
28. Romero R, Badr MS. A role for sleep disorders in pregnancy complications: challenges and opportunities. American Journal of Obstetrics & Gynecology. 2014;210(1):3-11.
29. Izci-Balserak B, Martin SE, Dundas KC, Liston WA, Calder AA, Douglas NJ, et al. Sleep complaints: Snoring and daytime sleepiness in pregnant and pre-eclamptic women. Sleep Med. 2005;6(2):163-169.
1Centro Universitário do Estado do Pará (CESUPA), Belém-PA.
2Universidade Estadual do Pará (UEPA), Belém-PA.
E-mail: Kawannamota@gmail.com
