REGISTRO DOI: 10.5281/zenodo.6635015
Autores:
Thayna Melo1
Rafael Leite Carvalho2
RESUMO
Ao longo dos anos, a medicina desenvolveu formas de integrar tecnologias avançadas para estudar o DNA humano, com o propósito de buscar diagnósticos precoces e precisos de muitas doenças, entender seu desenvolvimento, origem e os mecanismos que as provocam, conduzindo a novas perspectivas de tratamento. Dessa maneira, este trabalho tem como objetivo exemplificar o processo de aconselhamento genético em casos de câncer hereditário adquirido pela mutação dos genes BRCA1 e BRCA2, utilizando a metodologia de revisão bibliográfica. Objetiva esclarecer sobre como ocorre à mutação BRCA, quais os riscos e doenças podem causar quais as etapas do processo de aconselhamento genético, os profissionais envolvidos neste processo, quais os principais métodos de diagnóstico e os impactos psicossociais. Utilizando como ferramenta principal a análise de artigos e pesquisas já existentes, as informações obtidas promoveram uma reflexão sobre o papel do aconselhador genético na transcrição das informações de forma clara e objetiva, a relevância do serviço de aconselhamento genético e a importância clínica dos testes genéticos para o diagnóstico de mutações germinativas.
Palavras-chave: Aconselhamento Genético, Mutação, Hereditário, BRCA1, BRCA2.
ABSTRACT
Over the years, medicine has developed ways to integrate advanced technologies to study human DNA, with the purpose of seeking early and accurate diagnoses of many diseases, understanding their development, origin and the mechanisms that provoke them, leading to new treatment prospects. Thus, this work aims to exemplify the process of genetic counseling in cases of hereditary cancer acquired by the BRCA1 and BRCA2 gene mutation, using the bibliographic review methodology. It aims to clarify how the BRCA mutation occurs, what risks and diseases can cause, what stages of the genetic counseling process occur, the professionals involved in this process, what are the main diagnostic methods and psychosocial impacts. Using as main tool the analysis of existing articles and research, the information obtained promoted a reflection on the role of the genetic counseler in the transcription of information in a clear and objective way, the relevance of the genetic counseling service and the clinical importance of genetic tests for the diagnosis of germ mutations.
Keywords: Genetic Counseling, Mutation, hereditary, BRCA1, BRCA2.
1. INTRODUÇÃO
Os genes BRCA1 e BRCA2, localizados nos cromossomos 17 e 13 (figura 1), respectivamente, são classificados como genes supressores tumorais, responsáveis por produzir proteínas que auxiliam na estabilidade do material genético, reparando o DNA danificado e regulando o controle do ciclo celular por meio de recombinação homóloga (TUTT & ASHWORT, 2002; QUARESIMA et al., 2006).
FIGURA 1: LOCALIZAÇÃO DOS GENES BRCA
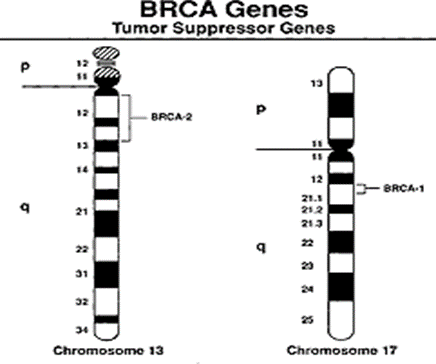
Quando esses genes sofrem uma alteração ou mutação, perdem seu produto proteico, dessa forma o dano ao DNA não pode ser reparado adequadamente. Como consequência, o organismo fica exposto e tem maior probabilidade de desenvolver alterações genéticas que podem induzir ao desenvolvimento do câncer de mama, ovário e próstata.
O gene BRCA1 foi identificado em 1994 por clonagem posicional, estabelecido como um gene de suscetibilidade ao câncer de mama. BRCA1 é composto por 22 éxons codificadores e codifica uma proteína de 1863 aminoácidos possui mais de 200 mutações germinativas associadas à suscetibilidade ao câncer. Devido a apenas 45% do câncer de mama familiar apresentar evidências de ligação ao BRCA1, a busca por um o segundo gene de suscetibilidade ao câncer de mama continuou, e em 1995 o gene BRCA2 foi encontrado, composto de 27 éxons codificantes, dos quais 26 codificam uma proteína com 3.418 aminoácidos (YOSHIDA; MIKI, 2004).
Sabe-se que uma falha no reparo de DNA pode levar a morte celular e translocações cromossômicas; O gene RAD51 interage com diversas proteínas envolvidas no reparo do DNA e no ciclo celular. A interação de BRCA1 e BRCA2 com a proteína RAD51 tem a função de reparar as quebras na dupla fita de DNA.
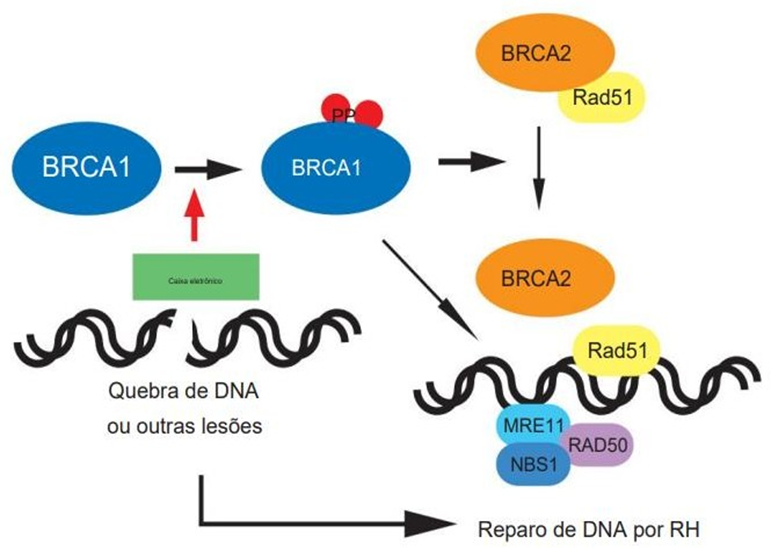
Em resposta ao dano à fita dupla de DNA a proteína BRCA1 é fosforilado por ATM, o BRCA1 fosforilado ativa o reparo do DNA através da recombinação homóloga, com auxílio de BRCA2 e Rad51. A proteína BRCA1 também recruta o complexo Rad50-Mre11-NBS para os locais de dano ao DNA. Ambas as proteínas BRCA1 e BRCA2 tem em comum o propósito de proteção do genoma, porém atuam em funções e estágios diferentes. BRCA1 atua na ativação do checkpoint, sinalizando o local do dano e no reparo do DNA (figura 2); BRCA2 atua como um medidor do mecanismo de recombinação homóloga (YOSHIDA; MIKI, 2004).
Estima-se que de 5% a 10% dos casos de cânceres de mama e ovário sejam causados por mutações hereditárias, sendo 60% e 80% dessas mutações nos genes BRCA1 e BRCA2 (EASTON et al., 1995; MIKI et al., 1994; SCOTT et al., 2003).
A compreensão dos mecanismos de ação destes genes, fatores de risco e hereditariedade auxiliam no diagnóstico precoce e na implantação de medidas preventivas. O aconselhamento genético é a principal ferramenta no processo de diagnóstico e definição de tratamento para indivíduos acometidos por essa mutação.
FIGURA 2: MODELO DE FUNÇÃO DAS PROTEÍNAS BRCA NA REPARAÇÃO DE DNA DANIFICADO
O aconselhamento genético, fundamentado na década de 1940 nos Estados Unidos pelo Biólogo e Geneticista Sheldon Reed (GUEDES; DINIZ, 2008), é um processo de transmissão de informações sobre doenças genéticas, cujo objetivo é auxiliar pessoas com mutações a compreender e se adaptar a anomalias genéticas, informar sobre os riscos de ocorrência de doenças de causas genéticas em indivíduos específicos, seus familiares e futuros descendentes, tal como os tratamentos disponíveis.
A herança biológica, ou seja, a transmissão de características ao longo das gerações despertou a curiosidade de cientistas e leigos durante um grande período. A forma como a sociedade lida com características indesejáveis expandiu a busca por aperfeiçoamento na área genética, sobretudo pela possibilidade de detectar doenças precocemente.
O Aconselhamento Genético é uma ferramenta fundamental no processo de transmissão de informações genéticas de forma compreensível aos pacientes e seu familiar auxilia na compreensão e adaptação às implicações médicas, psicossociais e familiares decorrentes da contribuição genética para uma determinada doença.
De acordo com Kessler (1997), o aconselhamento genético possui dois modelos práticos: O “modelo de ensino” e o “modelo de aconselhamento”. O “modelo de ensino” é composto pela comunicação efetiva, conferindo ao conselheiro maior autoridade sob a perspectiva do paciente, é o processo de transmissão de informações técnicas da condição genética, desconsiderando valores e crenças pessoais. O “modelo de aconselhamento” consiste na orientação baseada na condição individual do paciente, ainda que preserve o direito de autonomia, objetiva orientar e identificar os recursos para lidar com a condição genética.
A integração desses dois modelos é fundamental na prática do aconselhamento genético, para que além de compreender o conceito técnico da doença, o paciente também compreenda que suas crenças e opiniões pessoais estão sendo compreendidas e respeitadas.
No Brasil, o serviço de aconselhamento genético já é oferecido pela rede privada de saúde, tendo cobertura no ROL da ANS para diversos testes e exames diagnósticos e consulta com geneticista. No sistema público de saúde SUS (Sistema Único de Saúde), o serviço de aconselhamento genético passou a ser ofertado no ano de 2019, tendo como prioridade pessoas e famílias com risco de desenvolver doenças geneticamente determinadas ou anomalias congênitas.
Estabeleceu atendimento de três grupos problemas, que concentram cerca de 80% do total de agravos em genética clínica, sendo eles: anomalias genéticas, erros inatos do metabolismo e deficiências mentais (AGÊNCIA SAÚDE, 2009). Deficiências congênitas são o segundo fator de mortalidade infantil, sendo a discussão. A prática do AG no Brasil enfrenta diversos problemas de acesso, por exemplo, o número reduzido de profissionais qualificados e a oferta limitada de testes genéticos.
O aconselhamento genético é um processo longo, e sua etapa principal é a de triagem, onde é possível, em casos de mutações BRCA, diferenciar mulheres portadoras de não portadoras de mutações germinativas, para evitar a realização de testes genéticos desnecessariamente, além de diminuir a preocupação, ansiedade e depressão. A avaliação de histórico familiar é de grande importância para a identificação de indivíduos em risco, sendo um fator determinante para o conselheiro genético.
O processo do AG confere muitos questionamentos ao consulente, que precisa compreender em um período relativamente curto os riscos e benefícios de realizar a consulta genética. Os benefícios do estudo estão diretamente relacionados à compreensão acerca da doença, da delimitação de um tratamento que confere maior qualidade de vida e controle sobre características sintomáticas da doença. Os riscos estão associados à exposição a exames desnecessários, procedimentos evasivos e alterações psicológicas.
Este trabalho tem como objetivo promover uma reflexão sobre a relevância do processo de aconselhamento genético em pacientes com câncer de origem hereditária e a sua relação com a mutação BRCA, evidenciando as características éticas do aconselhamento genético, tal como suas etapas, os profissionais envolvidos e a os mecanismos que promovem a mutação dos gene BRCA.
2. OBJETIVOS
2.1 Geral
Descrever o processo Aconselhamento genético em casos de câncer adquirido pela mutação BRCA1 e BRCA2.
2.2 Específicos
◉ Descrever o processo de aconselhamento genético, suas bases fundadoras e características principais;
◉ Caracterizar a fisiopatia da mutação germinativa de BRCA1 e BRCA2;
◉ Descrever os métodos de diagnóstico para detecção da mutação BRCA;
◉ Apresentar o tratamento disponível para câncer de origem hereditária.
3. METODOLOGIA
Este projeto foi realizado sob estudo de caráter qualitativo e expositivo com elaboração em formato de revisão bibliográfica, utilizando publicações científicas nas plataformas de busca Google Acadêmico e SciELO, utilizando os descritores “Aconselhamento Genético”, “Mutação BRCA1 e BRCA2”, “Câncer de etiologia hereditária”, “Genes BRCA1 e 2”. Foram selecionados 16 artigos nos períodos de 1994 a 2020, publicados em revistas nacionais e internacionais, nos idiomas inglês e português.
4. DESENVOLVIMENTO
4.1 Métodos Diagnósticos
Os exames para detecção das mutações BRCA1 e BRCA2 são indicados para pacientes com histórico pessoal ou familiar de câncer mama, ovário, pâncreas, próstata e melanoma. O exame é realizado através de uma amostra de sangue ou saliva sem necessidade de preparos específicos.
A metodologia do teste e a mutação pesquisada são definidas pelo aconselhador genético, são elas: Sequenciamento completo, em que é analisado todo o genoma do indivíduo, possibilitando identificar todas as mutações presentes no genoma; Sequenciamento por genoma, em que é analisado somente regiões específicas do DNA, identificando mutações presentes naquelas regiões de interesse; Pesquisa de mutação específica, em que o médico determina qual a mutação deseja identificar e são realizados testes específicos que permitem identifica-la, sendo esse o método mais indicado para pessoas que possuem familiares com alguma alteração genética já identificada; Pesquisa isolada de inserções e deleções, indicada para indivíduos que já realizaram o sequenciamento e necessitam uma avaliação complementar, analisando somente alterações em genes específicos.
O teste genético indicado para a pesquisa de mutações nos genes BRCA1 e BRCA2 avalia a presença de mutações germinativas nestes genes através do sequenciamento de nova geração (Next Generation Sequencing – NGS), o método de análise se dá pela técnica de MPLPA (Multiplex Ligation-dependent Probe Amplification), que permite identificar deleções e duplicações genômicas por meio de PCR. Os testes genéticos são parte importante do processo de aconselhamento genético, é através dele que o conselheiro geneticista poderá direcionar quanto às medidas preventivas a serem adotadas, estabelecer um conjunto de ações visando maiores chances de cura, definir escolhas terapêuticas e calcular a probabilidade de risco familiar.
4.2 MLPA – Amplificação de Sonda Dependente de Ligação Multiplex
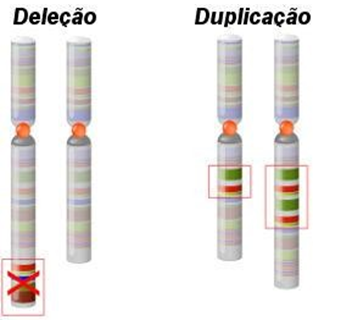
O MLPA é uma técnica da biologia molecular para diagnóstico de doenças genéticas, capaz de detectar perda (deleção) ou ganho (duplicação) de material genético (figura 3). Neste método de análise é utilizado sondas MLPA que apontam uma sequência específica do genoma. A sonda é composta por um oligonucleotídeo de sonda esquerdo e outro direito, que contém o primer de PCR e a sequência de hibridização do DNA. Auxilia na identificação do número de cópias dos genes, detectando pequenos rearranjos, grandes rearranjos e alterações cromossômicas completas.
FIGURA 3: MODELO DE ALTERAÇÃO CROMOSSÔMICA ESTRUTURAL
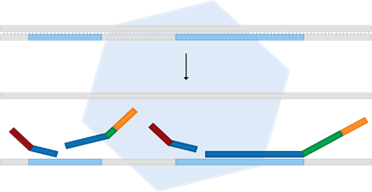
A técnica de MLPA é realizada através de cinco etapas; desnaturação e hibridização, ligação, amplificação (por PCR), separação dos fragmentos e análise de dados. A etapa de desnaturação consiste na separação das duas fitas de DNA por aquecimento a 98°C, seguido da hibridização, cujo sondas MLPA são ligadas a sequência alvo do DNA desnaturado (figura 4).
FIGURA 4: DESNATURAÇÃO E HIBRIDIZAÇÃO
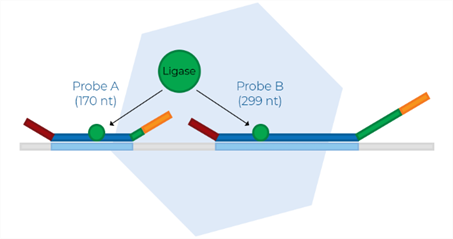
Na etapa de ligação, a sequência alvo de DNA e as sondas hibridizadas são unidas pela enzima ligase. Sendo essa etapa fundamental para avaliá-la compatibilidade entre sonda e sequencia alvo, para evitar erros de amplificação (figura 5).
FIGURA 5: LIGAÇÃO
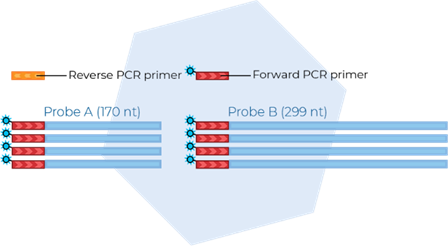
A etapa de amplificação é realizada através do método de PCR, nesta etapa as sequencias do DNA ligadas às sondas são copiadas. A utilização de PCR exige a adição de uma polimerase, um nucleotídeo e um primer direto e reverso, sendo o primer direto marcado com sonda florescente para medição do número de cópias do DNA (figura 6).
FIGURA 6: AMPLIFICAÇÃO
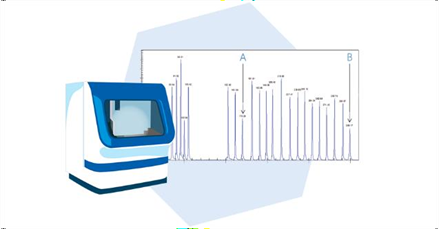
A separação dos fragmentos consiste na divisão dos fragmentos amplificados por meio de eletroforese capilar. Cada fragmento é observado como um padrão de pico distinto remete a uma sonda MLPA (figura 7).
FIGURA 7: SEPARAÇÃO DOS FRAGMENTOS
A última etapa do processo é a análise dos dados obtidos, onde os dados obtidos são comparados à amostra referência de DNA para calcular o número de cópias de um gene (Principle of MLPA, 2002).
Pacientes que testam positivos para mutações em BRCA1 ou BRCA2 apresentam risco aumentado para desenvolver câncer de mama ao longo da vida, que pode variar entre 45 e 80%. No caso de câncer de ovário, o risco varia entre 20-40 % para portadoras de mutações em BRCA1 e entre 10-20 % para portadoras de mutações no gene BRCA2. Além do câncer de mama e ovário, as mutações nos genes BRCA1 e BRCA2 predispõem aos cânceres de ovário, próstata e pâncreas.
A identificação dos indivíduos com risco aumentado para o desenvolvimento de câncer hereditário é importante, principalmente por trata- se de uma característica autossômica dominante, que confere possibilidade de passar para os filhos. Indivíduos afetados apresentam maior risco cumulativo vital ao da população em geral para vários tipos de câncer. O diagnóstico precoce auxilia na rastreabilidade de familiares, tratamentos e qualidade de vida.
TABELA 1: INTERPRETAÇÃO DOS RESULTADOS DE EXAME PARA OS GENES BRCA UM E BRCA DOIS
| Resultado | Interpretação |
| Positivo para os genes BRCA1 ou BRCA2 | Identificado na paciente uma mutação que é conhecida por estar associada com um aumento do risco para o câncer de mama ou ovário. |
| Provável negativo | A mutação do BRCA1 ou BRCA2 não foi conhecida. Todavia o resultado não exclui a possibilidade de a paciente ter um risco hereditário de câncer. |
| Negativo real | Uma mutação do BRCA1 ou BRCA2 sabidamente existente em um dos seus familiares foi descartada na paciente. |
| Positivo para a mutação genética de significado desconhecido | Existe uma mutação genética, mas não se sabe ainda se esta mutação específica aumenta o risco de câncer de mama ou câncer de ovário. |
4.3 Aconselhamento Genético
O AG propõem detalhar as informações sobre a origem, herança e implicações da doença. Trata-se de um processo complexo, realizado por uma equipe de profissionais coordenados por um geneticista, que assume o papel de facilitador da informação genética, tendo como responsabilidade principal orientar os pacientes para que as decisões tomadas diante um diagnóstico sejam de forma consciente. Este processo divide-se em diferentes etapas, sendo elas, levantamento do histórico pessoal e familiar, avaliação de exames clínicos e genéticos, solicitação de exames adicionais, análise dos dados genéticos obtidos, análise e comparação dos resultados com síndromes conhecidas, esclarecimento sobre o mecanismo de herança genética, cálculo de risco, identificação de familiares portadores da mutação e orientação quanto a tratamentos disponíveis e exames preventivos (PINA-NETO, 2008).
O aconselhamento genético é um processo continuo que pode ocorrer em diferentes momentos do ciclo de vida do indivíduo e difere de acordo com suas necessidades. Quando relacionado à mutação BRCA, a realização da consulta genética é comum em pacientes que possuem histórico familiar de câncer de mama e/ou ovário, quando se tem um achado incomum em exames de rotina e em poucos casos, para planejar a reprodução.
A função do profissional geneticista é informar de maneira clara e objetiva os riscos e tratamentos disponíveis, para que assim o consultante possa, dentro das opções oferecidas pelo geneticista, decidir quais as medidas serão tomadas frente ao diagnóstico. A informação genética advinda de um processo de aconselhamento deve ser analisada minuciosamente para evitar informar o consultante sobre riscos vagos, que podem gerar ansiedade e a incerteza sobre o desenvolvimento de doenças. A imparcialidade e neutralidade são pilares importantes para a consulta genética, isso se deve a falta de garantias de que o risco calculado no AG possa de fato causar doenças ao longo da vida.
4.4 Aspectos Éticos do AG
Quando o termo aconselhamento genético surgiu, ainda havia incerteza sobre o tipo de assistência e informações a serem fornecidos durante as consultas. O fim da segunda guerra mundial abriu um amplo debate sobre a ética na ciência, o termo aconselhamento genético foi proposto com o intuito de afastar a genética de conotações eugênicas, aplicando uma nova estratégia educativa de diálogo entre ciência e sociedade (GUEDES; DINIZ, 2008). Atualmente, a ética é considerada um dos principais pilares do processo de aconselhamento genético. Isso se deve à ausência de terapias ou cura para grande parte das doenças genéticas, dessa forma, alguns princípios tornaram-se fundamentais para a prática do aconselhamento genético. São eles: não-diretividade, neutralidade moral, privacidade e confidencialidade da informação genética.
A não-diretividade tem como objetivo garantir a autonomia do indivíduo frente a um prognóstico, respeitando suas preferências e assegurando a preservação de seus direitos, definindo a posição do aconselhador como um facilitador da informação. A neutralidade moral define que as orientações médicas devem ser imparciais e isenta de crenças pessoais que podem interferir na decisão do consulente, utilizando a informação genética como elemento central para garantir o bem-estar individual. Esses princípios garantem que a tomada de decisões, como por exemplo, reprodução, utilização de recursos e procedimento preventivos, tratamentos, hábitos pessoais e compartilhamento do diagnóstico com familiares, sejam respeitadas.
A garantia de privacidade da comunicação entre médico e paciente é um pilar fundamental na prática médica. Desta forma, determina que os testes genéticos, resultados e tratamentos não possam ser comunicados a terceiros sem o consentimento do consulente, exceto seus responsáveis legais. O fator hereditário tem grande impacto psicossocial no indivíduo que busca o serviço de aconselhamento genético, isso porque envolve questões reprodutivas individuais e familiares.
4.5 Impacto Psicossocial
O processo de testagem e conhecimento sobre uma condição genética tem um forte impacto psicossocial, por isso o aconselhador assume a função de acolher o consulente e prover suporte emocional. Este processo coloca em perspectiva diversas áreas da vida de um indivíduo, nas mutações BRCA o risco de câncer de mama e ovário implica em questões reprodutivas irreversíveis, questiona-se a probabilidade de transmissão hereditária, a adoção de terapias e ações preventivas que podem mudar a aparência física, acarretando impactos físicos e psicológicos.
Para mulheres portadoras da mutação BRCA, as medidas preventivas podem incluir, além dos exames rotineiros de rastreamento, medidas traumáticas, tais como, mastectomia e Ooforectomia profilática, que diminuem de 90% a 96% o risco de desenvolvimento de tumores malignos. Não foram encontrados estudos específicos que abordem os efeitos psicológicos em portadores de mutações, no entanto, relatos de pacientes com suspeita de mutações indicam impactos emocionais significativo perante a hipótese de diagnóstico cancro.
4.6 Comunicação Efetiva
O conteúdo da nossa comunicação está diretamente ligado à nossa referência de cultura, e o processo de comunicação da informação genética para o consulente pode ser um grande desafio no processo de aconselhamento genético, deve-se considerar que, na maioria dos casos, o consulente não compreende e não possui familiaridade com expressões clínicas e com os fatores biológicos envolvidos, portanto, é importante optar por uma comunicação efetiva, onde o consulente consiga compreender de maneira simples a sua condição de saúde. O uso de linguagem técnica e pouco acessível à compreensão cria uma barreira entre o conselheiro e consulente, que neste processo tem como função acolher e facilitar a comunicação dos fatores biológicos. A comunicação é um processo de duas vias, e o conselheiro deve, além de fornecer informações, aderir a uma linguagem acessível e empática, considerando o nível de compreensão do consulente e seus familiares.
5. CONCLUSÃO
O Aconselhamento Genético é uma ferramenta essencial para auxiliar na compreensão das condições genéticas. O estabelecimento de um diagnóstico genético permite determinar a natureza dos riscos, as opções disponíveis de tratamento, melhorar a qualidade de vida do indivíduo e diminuir os impactos psicológicos. Ainda que, nos casos de mutações nos genes BRCA, este processo tenha implicações sociais e psicológicas consideráveis, o AG se faz necessário para que o conhecimento adquirido através de estudos de cada caso possa resultar em um tratamento individual específico para cada paciente.
REFERÊNCIAS BIBLIOGRÁFICAS
AGÊNCIA SAÚDE. SUS terá aconselhamento genético, 22 jan. 2009. Disponível em: https://bvsms.saude.gov.br/bvs/sus/pdf/janeiro/sus_aconselhamento_genetico_2201.pdf. Acesso em: 15 mar. 2022.
AMENDOLA, Luis Cláudio Belo; VIEIRA, Roberto. A contribuição dos genes BRCA na predisposição hereditária ao câncer de mama. Revista Brasileira de Cancerologia, p. 1-6, 2005. Disponível em: https://rbc.inca.gov.br/index.php/revista/article/view/1927. Acesso em: 15 mar. 2022.
CASTRALLI, Heloísa Augusta; BAYER, Valéria Maria Limberger. Câncer de mama com etiologia genética de mutação em BRCA1 e BRCA2: uma síntese da literatura. Brazilian Journal of Health, p. 2215-2224, 2019. Disponível em: https://www.brazilianjournals.com/index.php/BJHR/article/view/1634. Acesso em: 20 set. 2021.
DANTAS, Élida Lívia Rafael et al. Genética do Câncer Hereditário. Revista Brasileira de Cancerologia, p. 263-269, 2009. Disponível em: https://rbc.inca.gov.br/index.php/revista/article/view/1619. Acesso em: 8 nov. 2021.
GUEDES, Cristiano; DINIZ, Debora. A Ética na História do Aconselhamento Genético: um Desafio à Educação Médica. Revista Brasileira de Educação Médica, p. 1-6, 2008. Disponível em: https://www.scielo.br/j/rbem/a/7LprGfs8W8KjbFLFMZxFxcH/?format=pdf&lang=pt. Acesso em: 11 out. 2021
PINA-NETO, João Monteiro de. Aconselhamento Genético. Jornal de Pediatria, p. 1-7, 2008. Disponível em:https://www.scielo.br/j/jped/a/CN9MqPcMqy8yyjHDYg69gLg/?format=pdf&lang=pt. Acesso em: 18 out. 2021.
WARD, Laura Sterian. Entendendo o Processo Molecular da Tumorigênese. Arq. Bras. Endocrinol. Metab., p. 1-10, 2002. Disponível em: https://www.scielo.br/j/abem/a/vNG3zLQKMLsKPG8D8qHnJ3y/?lang=pt. Acesso em: 8 nov. 2021.
1Discente da Universidade Anhembi Morumbi. São Paulo, Brasil.
2Docente da Universidade Anhembi Morumbi. São Paulo, Brasil.

