UNILATERAL TOTAL NEPHRECTOMY IN A DOG PARASITIZED BY DYOCTOPHYMA RENALE
REGISTRO DOI: 10.69849/revistaft/cl10202509191710
Tatiane Monteiro de Jesus
Orientadora: Profa. Dra. Daniela Fantini Vale
RESUMO
O Dyoctophyma renale é um parasita nematoide, sendo o maior já descrito, que afeta os rins de mamíferos, incluindo caninos. Popularmente conhecido como “verme gigante do rim”, é normalmente encontrado no rim direito, mas também há casos descritos de presença do parasita no peritônio, fígado, tecido subcutâneo, testículos e na cavidade abdominal. É adquirido pela ingestão de larvas presentes em anelídeos aquáticos, sendo hospedeiros intermediários, ou em rãs e peixes, sendo hospedeiros paratênicos. Os principais sinais clínicos envolvem hematúria, apatia e/ou prostração, algia em região lombar e em casos mais graves, podem ser observados sinais de nefropatia aguda, porém, muitos caninos podem ser assintomáticos. O diagnóstico é realizado por exames de imagem, no caso a ultrassonografia abdominal, onde é observado estruturas cilíndricas com centro hipoecogênico e bordas hiperecogênicas e/ou o rim com alteração em seu formato, e urinálise, onde é possível detectar a presença dos ovos do parasita. Não há anti-helmíntico eficaz para o tratamento clínico do parasita, sendo o tratamento preconizado a realização da remoção cirúrgica do rim afetado (nefrectomia). A técnica de nefrectomia indicada é a nefrectomia total unilateral e em raros casos em que o parasita está presente em ambos os rins, pode ser realizada nefrotomia para remoção do parasita do parênquima renal, sendo considerada uma piora drástica em questão de prognóstico.
Palavras-chave: Parasita, Rim, Tratamento cirúrgico, Nefropatia.
ABSTRACT
Dyoctophyma renale is a nematode parasite, the largest ever described, that affects the kidneys of mammals, including canines. Popularly known as the “giant kidney worm,” it is typically found in the right kidney, but cases of the parasite have also been described in the peritoneum, liver, subcutaneous tissue, testes, and abdominal cavity. It is acquired by ingesting larvae present in aquatic annelids, which are intermediate hosts, or in frogs and fish, which are paratenic hosts. The main clinical signs include hematuria, apathy and/or prostration, lumbar pain, and in more severe cases, signs of acute nephropathy may be observed. However, many canines may be asymptomatic. Diagnosis is made through imaging tests, such as abdominal ultrasound, which reveals cylindrical structures with a hypoechoic center and hyperechoic edges and/or a kidney with altered shape. A urinalysis also detects the presence of parasite eggs. There is no effective anthelmintic for clinical treatment of the parasite, and the recommended treatment is surgical removal of the affected kidney (nephrectomy). The recommended nephrectomy technique is unilateral total nephrectomy, and in rare cases where the parasite is present in both kidneys, nephrotomy may be performed to remove the parasite from the renal parenchyma, which is considered a drastic worsening of the prognosis.
Keywords: Parasite, Kidney, Surgical treatment, Nephropathy
Introdução
O Dioctophyma renale, popularmente conhecido como “verme gigante do rim”, é um nematoide da família Dioctophymatidae que acomete, principalmente, cães domésticos e canídeos silvestres, mas também pode infectar outras espécies de mamíferos, incluindo o ser humano, configurando-se como uma zoonose de importância médico-veterinária1,2. Trata-se do maior nematoide parasita de mamíferos, capaz de atingir até 100 centímetros de comprimento, localizando-se preferencialmente no rim direito, onde provoca destruição progressiva do parênquima renal3.
A infecção ocorre pela ingestão de larvas de terceiro estágio (L3) presentes em hospedeiros intermediários, como oligoquetas aquáticos, ou paratênicos, como peixes e anuros4,5. Após o consumo, as larvas migram pela parede intestinal e alcançam a cavidade abdominal, podendo estabelecer-se no rim ou em outros tecidos ectópicos1. Estudos recentes têm apontado que a proximidade de cães com ambientes aquáticos contaminados, associada a hábitos alimentares como a ingestão de peixes crus, é um fator de risco relevante para a infecção6.
A distribuição do parasito é mundial, mas apresenta maior prevalência em regiões com abundância de recursos hídricos, como áreas ribeirinhas e rurais da América do Sul7. No Brasil, diversos casos têm sido relatados em estados do Sul, Sudeste e Centro-Oeste, indicando que a dioctofimose é subdiagnosticada e potencialmente emergente em determinadas localidades8.
Os sinais clínicos são frequentemente inespecíficos, incluindo emagrecimento progressivo, letargia, hematúria e dor abdominal9,10. Em muitos casos, a doença é diagnosticada de forma incidental por exames de imagem, como ultrassonografia, que revela a presença do parasito ou alterações renais compatíveis11. A tomografia computadorizada e a ressonância magnética, embora menos acessíveis na rotina clínica, também podem auxiliar na avaliação da extensão da lesão renal e exclusão de diagnósticos diferenciais12.
Do ponto de vista patológico, o parasito provoca atrofia progressiva do parênquima renal, culminando em perda funcional completa do órgão afetado. O rim contralateral geralmente compensa essa deficiência, mas a ocorrência de infecção bilateral ou ectópica representa grave risco à vida do animal3,13.
Quando o rim está totalmente comprometido, o tratamento indicado é a nefrectomia total unilateral, procedimento cirúrgico que consiste na retirada completa do órgão afetado, com objetivo de eliminar a fonte parasitária e prevenir complicações sistêmicas10,14. Em casos selecionados, quando o rim ainda apresenta porções funcionais preservadas, a remoção do parasito por nefrotomia pode ser considerada15.
O prognóstico geralmente é favorável, desde que o rim contralateral mantenha a função preservada3. No entanto, a falta de diagnóstico precoce, associada à escassez de estudos epidemiológicos amplos, reforça a importância da notificação de casos clínicos e do aprofundamento em estratégias diagnósticas e terapêuticas7,8.
O estudo de casos clínicos envolvendo nefrectomia em cadelas acometidas por D. renale é fundamental, visto que contribui para ampliar o conhecimento sobre os aspectos epidemiológicos, diagnósticos e terapêuticos da dioctofimose, além de reforçar a importância da vigilância parasitológica em regiões endêmicas1,2.
Relato de caso
Uma cadela, fêmea inteira de seis meses, sem raça definida, cor branca e marrom, foi encaminhada ao Serviço Veterinário aos onze dias do mês de julho de 2025, sob queixa do tutor de hematúria.
Segundo histórico, a cadela havia sido resgatada há cerca de um mês e apresentava hematúria intensa há aproximadamente sete dias. Além disso, relatava-se alterações comportamentais, caracterizadas principalmente por hiporexia e prostração.
O animal passou algumas vezes por atendimento veterinário, tendo sido realizado tratamento terapêutico para infecção no trato urinário.
Foi solicitado exame ultrassonográfico, o qual revelou rins assimétricos, sendo o esquerdo dentro da normalidade e o direito com acentuado aumento de tamanho (cerca de 7,4cm), ecogenicidade elevada, parênquima grosseiro, perda de definição corticomedular e a presença de caminhos tubulares distribuídos por todo o parênquima renal. Assim, as imagens ultrassonográficas sugeriram a possibilidade da presença de nefropatia secundária a verminose em rim direito.
Diante da presença de Dyoctophyma renale no rim direito, a paciente foi encaminhada para realização de exames de hemograma, bioquímico sérico complementares e urinálise.
Enquanto aguardava resultado dos exames solicitados e a programação cirúrgica, fora estabelecido tratamento à base de analgésicos, sendo Dipirona (25mg/kg a cada 8 horas durante 5 dias) e Cloridrato de Tramadol (4mg/kg a cada 8 horas durante 5 dias), além de estimulante de apetite Apevitin BC (0,1mL/kg a cada 12 horas durante 5 dias).
Os exames séricos revelaram poucas alterações, sendo elas a presença de anemia leve e aumento da enzima Fosfatase Alcalina. A função renal estava dentro da normalidade. A urinálise revelou coloração âmbar, proteinúria +++, sangue oculto ++++, incontáveis hemácias, presença de 4 a 8 leucócitos por campo e não foram visualizados presença de ovos de Dyoctophyma renale na amostra.
A partir do diagnóstico de parasitismo por Dyoctophyma renale, a paciente fora submetida à celiotomia para nefrectomia do rim afetado.
O procedimento cirúrgico teve como objetivo a remoção completa do rim afetado pelo parasita.
A paciente foi submetida a jejum prévio, alimentar e hídrico, de oito horas. No dia da cirurgia, a paciente encontrava-se estável, com todos os exames pré-operatórios, tendo sido devidamente realizados e avaliados pela equipe cirúrgica e anestésica.
Já nas dependências do Hospital Veterinário, na sala de preparo, a paciente foi pesada e identificada.
Foi colocado um acesso venoso periférico na veia cefálica direita com cateter nº22G, visando o estabelecimento de via para administração de fluidos de manutenção e medicamentos.
A medicação pré-anestésica foi realizada com Acepromazina 0,2%, na dose 0,2 mg/kg, associado à Metadona 10mg/ml, na dose de 0,1 mg/kg, por via intramuscular.
Uma vez pré medicada, foi realizada a tricotomia abdominal ampla da paciente, a fim de remover os pelos do animal, além de auxiliar na remoção de sujidades, permitir a visibilidade durante o ato cirúrgico e tornar eficiente a limpeza e assepsia da pele.
Realizou-se antibioticoterapia com Cefalotina 1000mg/5ml, por via intravenosa, na dose de 30 mg/kg 30 minutos antes do início do procedimento.
No centro cirúrgico, foi realizada a indução anestésica com Propofol 10mg/ml, na dose de 2mg/kg, associado a Midazolam 5mg/ml, na dose de 0,3mg/kg, por via intravenosa. O animal passou a receber solução de Ringer com Lactato na dose de manutenção 5ml/kg/h também por via intravenosa. Procedeu-se, então, com auxílio de um laringoscópio, a intubação endotraqueal com sonda nº 4 e manutenção anestésica com Isofluorano por aparelho anestésico vaporizador universal, durante todo o trans-cirúrgico.
Durante o procedimento, foram monitoradas a frequência cardíaca e respiratória, a saturação de oxigênio, a temperatura e glicemia do animal, visando prevenir hipotermia, hipotensão e hipoglicemia.
Para realização do ato operatório, o animal foi posicionado em decúbito dorsal em calha, estando a mesma sobre a mesa cirúrgica, de maneira que o local da incisão e o campo operatório ficassem acessíveis ao cirurgião e ao seu auxiliar.
Após o posicionamento do animal, a área de intervenção cirúrgica foi preparada previamente com solução de clorexidina alcoólica 0,5% com uso de gaze limpa. Feito isso, o cirurgião, já paramentado procedeu as manobras de antissepsia definitiva também com solução de clorexidina alcoólica 0,5%, com auxílio de gazes estéreis presas a uma pinça Foester, respeitando o sentido centro-periférico do abdômen.
Após a antissepsia, foram colocados panos de campo estéreis sobre o paciente.
Iniciou-se o procedimento com uma incisão mediana na pele pré-retro-umbilical, com auxílio de lâmina de bisturi número 23. A hemostasia de pequenos vasos fora realizada a partir do uso de pinças hemostáticas Halstead.
O acesso à cavidade abdominal deu-se através do uso de lâmina de bisturi número 11, em estocada, estendendo-se o acesso com tesoura Mayo.
À inspeção da cavidade abdominal, o rim direito foi devidamente identificado no espaço retroperitoneal, a partir da retração do duodeno para a esquerda e ventralmente. O mesmo apresentava alterações anatômicas importantes devido ao quadro do parasitismo. Da mesma forma, foram localizadas a veia cava caudal e as veias renais saindo do hilo renal. Foram utilizadas compressas para isolamento do rim do restante do conteúdo abdominal.
Após a identificação do órgão e da vascularização adjacente, com auxílio de pinça Mixter, fora realizada a divulsão de maneira minuciosa, sendo realizada a exposição do rim do retroperitônio e das suas fixações sublombares. Foi realizada a manobra de elevação do rim e retração do mesmo medialmente com intuito de colocar artéria e veia renais na superfície dorsal do hilo renal.
Ao identificar toda vascularização renal, foram realizadas duplas ligaduras da artéria e veia renal separadamente com fio inabsorvível sintético n° 2-0 o mais próximo possível dos grandes vasos para se certificar de que todos os ramos tenham sido ligados.
Com auxílio da pinça mixter, fora realizada divulsão do ureter direito do retroperitôneo, também presente no hilo renal (Figura 1), sendo realizada sua ligadura proximal ao rim com fio inabsorvível sintético n°2-0.
Figura 1: Ureter dissecado saindo do hilo renal, se estendendo em sentido caudal.
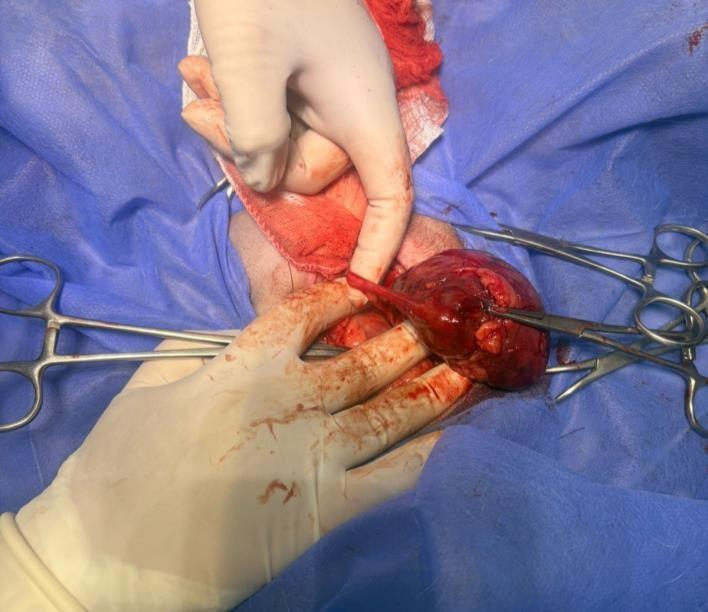
Fonte: Arquivo pessoal
Prosseguiu-se com a excisão completa do rim da cavidade abdominal (Figura 2).
Figura 2: Rim direito após sua excisão completa da cavidade abdominal.
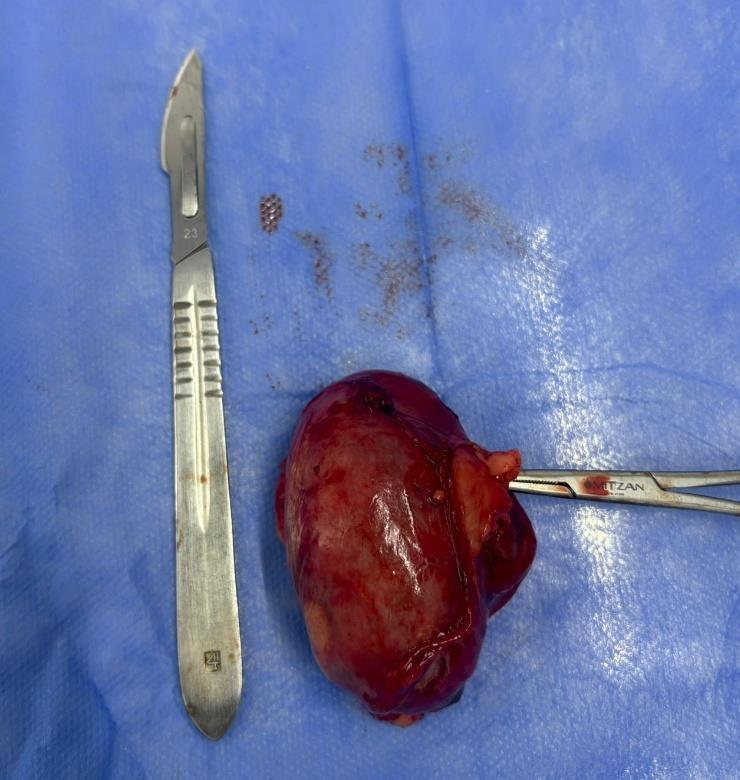
Fonte: Arquivo pessoal
Foi avaliada a cavidade abdominal como um todo para garantir que não havia qualquer intercorrência, tal como hemorragias, congestão ou indícios de presença do parasita em outros órgãos/tecidos.
Com auxílio de porta-agulhas, pinça anatômica dente de rato e tesoura, procedeu-se a síntese da linha alba com fio inabsorvível sintético n°2-0, em padrão simples contínuo. O tecido subcutâneo fora com fio inabsorvível sintético Nylon n°3-0, com padrão contínuo colchoeiro modificado.
A síntese cutânea fora realizada com fio inabsorvível sintético nº 3-0 em padrão simples separado.
Todo o procedimento ocorreu sem intercorrências cirúrgicas ou anestésicas.
Ao finalizar o procedimento cirúrgico, a equipe cirúrgica procedeu com a abertura do órgão no intuito da visualização do parasita e das alterações morfológicas que o mesmo causou antes de ser devidamente descartado (Figura 3).
Figura 3: Dyoctophyma renale removido de dentro do parênquima renal.
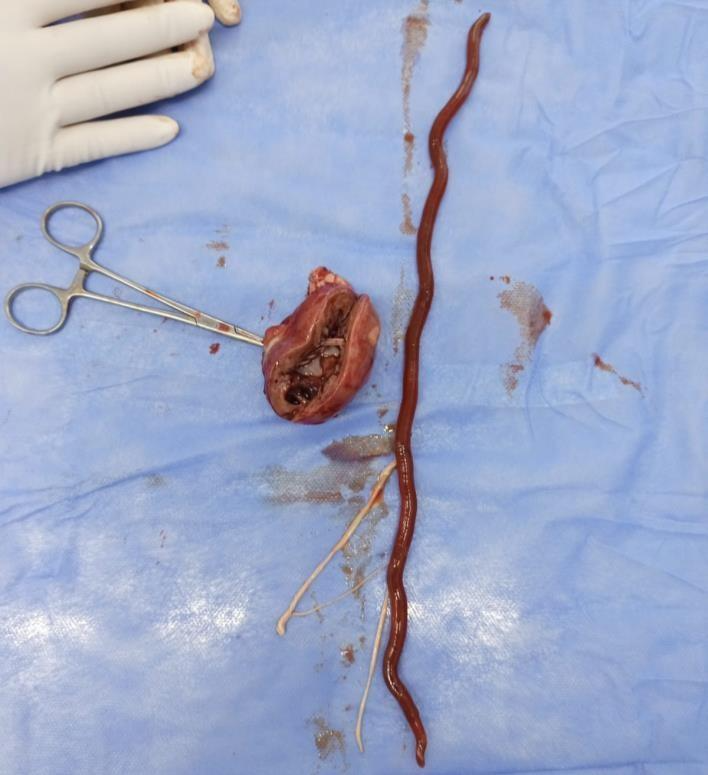
Fonte: Arquivo pessoal
Após o procedimento, a paciente permaneceu em área de recuperação pós-operatória, adjacente à área cirúrgica, tendo sido mantida em gaiola com aquecedor e monitorada cuidadosamente até a sua recuperação anestésica completa.
No pós-operatório imediato, o animal recebeu medicação analgésica e anti-inflamatória (metadona 0,2mg/kg, dipirona 25mg/kg e meloxicam 0,05mg/kg).
Nos dias que se seguiram ao pós-operatório, foi prescrito o uso de Amoxicilina com Clavulanato de potássio na dose 22mg/kg por via oral a cada doze horas, durante sete dias, Cloridrato de Tramadol na dose de 4mg/kg por via oral a cada oito horas, durante cinco dias, Dipirona na dose 25mg/kg por via oral a cada oito horas, durante cinco dias e Meloxicam na dose 0,05mg/kg por via oral a cada vinte e quatro horas, durante quatro dias.
Após quinze dias do procedimento cirúrgico para nefrectomia, a paciente retornou para reavaliação e retirada de pontos, onde foram solicitados novos exames de hemograma e bioquímico sérico.
Os exames revelaram normalidade em questão das alterações que paciente apresentava em exames pré cirúrgicos, concedendo assim a alta cirúrgica da paciente.
Discussão
O caso relatado descreve uma cadela jovem, sem raça definida, diagnosticada com parasitismo por Dioctophyma renale em rim direito, manifestando-se clinicamente por hematúria, hiporexia e prostração. Esses achados clínicos corroboram a literatura, que aponta a hematúria como o principal sinal clínico observado em cães acometidos, embora em muitos casos a infecção possa permanecer assintomática por longos períodos1,2.
Alterações inespecíficas, como letargia e diminuição do apetite, também já foram associadas à dioctofimose, reforçando a importância da anamnese detalhada e da investigação por exames de imagem3,4.
O exame ultrassonográfico desempenhou papel fundamental na confirmação diagnóstica, revelando aumento de volume renal, alterações na ecogenicidade e perda da definição corticomedular, além da visualização de estruturas tubulares compatíveis com o parasita. Estudos prévios destacam que a ultrassonografia é o método mais sensível para o diagnóstico da dioctofimose, permitindo a diferenciação de nefropatias comuns e a detecção de lesões características do helminto10,11. Outros métodos, como a tomografia computadorizada, podem ser utilizados em casos de difícil visualização ou quando se suspeita de acometimento bilateral12, embora não tenham sido necessários neste caso.
Apesar da presença de hematúria significativa, não foram visualizados ovos do parasito na urinálise. Essa ausência não é incomum e já foi relatada em diferentes estudos, sendo explicada pela dificuldade de eliminação dos ovos quando o ureter encontra-se obstruído ou quando o parasita não está presente na pelve renal6,7. Assim, a urinálise negativa para ovos de D. renale não deve ser considerada suficiente para descartar a infecção.
Os exames laboratoriais complementares demonstraram apenas anemia leve e discreta elevação da fosfatase alcalina, sem alteração da função renal. Tal achado reforça relatos de que, mesmo em infecções unilaterais, o rim contralateral pode manter a função renal preservada, garantindo o equilíbrio homeostático do paciente8,9. Isso justifica a adoção da nefrectomia como tratamento definitivo, uma vez que a remoção do rim parasitado não compromete a função global do organismo14,15.
A escolha pela nefrectomia total foi condizente com a literatura, que recomenda o procedimento sempre que o rim acometido se encontra destruído ou sem possibilidade de recuperação funcional13,15. Alternativamente, em casos de acometimento parcial, a nefrotomia poderia ser considerada, visando preservar o parênquima renal14. No entanto, devido à extensão da lesão descrita neste caso, a nefrectomia representou a conduta mais segura.
O protocolo anestésico-cirúrgico descrito seguiu padrões consolidados, incluindo analgesia multimodal e monitoramento contínuo, práticas já ressaltadas como fundamentais para reduzir riscos e garantir estabilidade intraoperatória em pacientes submetidos à nefrectomia14. O uso prévio de antibioticoprofilaxia também se alinha às recomendações atuais para cirurgias limpas-contaminadas, reduzindo o risco de complicações infecciosas15.
O desfecho pós-operatório foi satisfatório, com adequada analgesia, ausência de complicações e retorno da paciente à normalidade clínica e laboratorial no acompanhamento. Esse prognóstico positivo é compatível com outros relatos de nefrectomia em cães parasitados por D. renale, os quais destacam a elevada taxa de recuperação quando o procedimento é realizado de forma precoce e o rim contralateral encontra-se íntegro3,9,13.
Portanto, este caso clínico reforça a importância da ultrassonografia como ferramenta diagnóstica essencial, da interpretação criteriosa de exames laboratoriais e da nefrectomia como abordagem cirúrgica segura e eficaz em casos de destruição renal por D. renale. A literatura atual corrobora a conduta adotada, destacando que o sucesso do tratamento depende da detecção precoce, da avaliação minuciosa da função renal contralateral e da execução técnica adequada da cirurgia.
Considerações finais
O diagnóstico precoce da dioctofimose canina é de extrema importância para um melhor prognóstico, sendo a ultrassonografia o método mais eficiente para a identificação do parasita. A ausência de ovos na urinálise reforça que o exame isolado não é suficiente para excluir a enfermidade.
A nefrectomia mostrou-se um procedimento seguro e eficaz diante do comprometimento total do rim afetado, possibilitando a plena recuperação clínica do paciente.
A dioctofimose deve ser considerada diagnóstico diferencial em cães com hematúria persistente, especialmente em regiões endêmicas, e que a conduta cirúrgica adequada assegura prognóstico favorável.
Referências
- PEDRASSANI, D.; MORAIS, H. A.; RISSETI, R. M. Dioctophyma renale in domestic dogs: case report and review. Brazilian Journal of Veterinary Parasitology, v. 29, n. 3, p. e018519, 2020. Disponível em: < https://doi.org/10.1590/S1984-29612020061 >. Acesso em: 13 de Setembro de 2025.
- BECKER, A. C.; MARTINS, D. S.; MOLENTO, M. B. Canine dioctophymosis: a review of cases in Brazil. Parasitology Research, v. 118, n. 1, p. 11–20, 2019. Disponível em:< https://doi.org/10.1007/s00436-018-6137-5 >. Acesso em: 13 de Setembro de 2025.
- MORAIS, H. A.; PEDRASSANI, D.; LORENZINI, G. Canine dioctophymosis: clinical and pathological aspects. Acta Scientiae Veterinariae, v. 49, n. 1, p. 635, 2021. Disponível em:< https://doi.org/10.22456/1679-9216.109346 >. Acesso em: 13 de Setembro de 2025.
- BARROS, L. A.; OLIVEIRA, F. C. R.; MUNIZ-PEREIRA, L. C.; KNOFF, M. Dioctophyma renale: ocorrência no Brasil, aspectos morfológicos e patológicos em cães. Revista Brasileira de Parasitologia Veterinária, v. 25, n. 4, p. 452–460, 2016.
- MEASURES, L. N. Dioctophymatosis. In: SAMUEL, W. M.; PYBUS, M. J.; KOCAN, A. A. (ed.). Parasitic diseases of wild mammals. Iowa: Iowa State University Press, 2001. p. 357–364. Disponível em:< https://agris.fao.org/agris-search/search.do?recordID=US201300097525 >. Acesso em: 13 de Setembro de 2025.
- GOMES, D. C.; SANTOS, T. P.; ROCHA, F. F. Risk factors associated with canine dioctophymosis in riverine communities. Acta Veterinaria Brasilica, v. 15, n. 2, p. 87–94, 2021. Disponível em:< https://doi.org/10.21708/avb.2021.15.2.10023 >. Acesso em: 13 de Setembro de 2025.
- ANTUNES, T. R.; LOPES, R. S.; PEREIRA, L. C. Epidemiological aspects of Dioctophyma renale infection in dogs in South America. Revista de Medicina Veterinária, v. 21, n. 2, p. 33–41, 2020. Disponível em:< https://doi.org/10.26605/medvet-v21n2-3321 >. Acesso em: 13 de setembro de 2025.
- VIEIRA, A. C. S. et al. Dioctophyma renale in dogs from central Brazil: clinical and epidemiological findings. Pesquisa Veterinária Brasileira, v. 39, n. 7, p. 495–502, 2019. Disponível em:< https://doi.org/10.1590/1678-5150-PVB-5974 >. Acesso em: 14 de Setembro de 2025.
- SILVA, D. S.; ALMEIDA, A. M.; COSTA, A. J. Dioctophymosis in dogs: clinical aspects and surgical treatment. Revista de Educação Continuada em Medicina Veterinária e Zootecnia do CRMV-SP, v. 16, n. 2, p. 95–101, 2018. Disponível em:< https://revistas.bvs-vet.org.br/recmvz/article/view/38034 >. Acesso em: 14 de Setembro de 2025.
- CRIVELLENTI, L. Z.; FRANCO, L. G.; MAMPRIM, M. J. Ultrasonographic diagnosis of Dioctophyma renale in dogs: 16 cases. Semina: Ciências Agrárias, v. 41, n. 5, p. 2101–2110, 2020. Disponível em:< https://doi.org/10.5433/1679-0359.2020v41n5p2101 >. Acesso em: 13 de Setembro de 2025.
- LEITE, L. C.; MENDES, R. S.; AZEVEDO, F. D. Aspectos ultrassonográficos da dioctofimose canina. Clínica Veterinária, v. 20, n. 115, p. 40–44, 2015. Disponível em:< https://www.revistaclinicaveterinaria.com.br >. Acesso em: 14 de Setembro de 2025.
- MATSUBAYASHI, M. et al. Imaging diagnosis of dioctophymosis in dogs using computed tomography. Japanese Journal of Veterinary Research, v. 65, n. 3, p. 157–163, 2017. Disponível em:< https://doi.org/10.14943/jjvr.65.3.157 >. Acesso em: 13 de Setembro de 2025.
- KIM, H. J.; PARK, S. I.; LEE, Y. S. Bilateral dioctophymosis in a domestic dog: case report and review of the literature. Journal of Veterinary Medical Science, v. 82, n. 6, p. 844–848, 2020. Disponível em:< https://doi.org/10.1292/jvms.20-0015 >. Acesso em: 14 de Setembro de 2025.
- FERREIRA, F. P.; NOGUEIRA, D. A.; SOUZA, H. J. Cirurgia em pequenos animais: abordagens e técnicas. São Paulo: MedVet, 2019. Disponível em:< https://www.livrariamedvet.com.br/cirurgiaem-pequenos-animais >. Acesso em: 14 de Setembro de 2025.
- ANDRADE, R. L.; OLIVEIRA, R. M.; SOUZA, V. F. Surgical approaches in canine dioctophymosis: nephrectomy versus nephrotomy. Veterinary Medicine and Science, v. 8, n. 4, p. 1501–1509, 2022. Disponível em:< https://doi.org/10.1002/vms3.905 >. Acesso em: 14 de Setembro de 2025.
