REGISTRO DOI: 10.69849/revistaft/cl10202507141849
Jorge de Jesus Passinho e Silva1
RESUMO
Neste trabalho, foi avaliado o desempenho do carvão ativado CA119 na adsorção do etanol. Para tanto, foram obtidos dados experimentais da cinética e do equilíbrio de adsorção para obter o quanto de etanol é adsorvido pelo carvão, dado imprescindível para simular o ciclo adsortivo. O experimento foi realizado a pressão inicial constante. Para descrever o equilíbrio de adsorção foi utilizado o modelo de isoterma de Langmuir. Para a concentração máxima de adsorvato no adsorvente, o Wo, encontramos um valor médio de 0,2068g/g e uma pressão final média de 156,90mbar e uma pressão relativa média de 0,195. Todos os valores bem próximos dos valores obtidos no trabalho citado, isso confirma que o experimento pode ser utilizado para determinar a pressão de equilíbrio dos pares envolvidos no fenômeno de adsorção e também nos fornece a concentração máxima para o par a ser estudado, logo o experimento foi validado conforme seus resultados.
Palavras-chave: Adsorção; Carvão ativado; Etanol.
Introdução
Para modelar e simular o ciclo de adsorção é necessário caracterizar o equilíbrio termodinâmico entre o par adotado, adsorvente e adsorvato. Também precisa saber a quantidade de adsorvato que é adsorvido pelo adsorvente, W0 da equação de Dubinin-Astakhov.
Neste trabalho, será descrito a configuração da bancada para determinar a concentração de etanol no carvão ativado CA119, a isoterma de adsorção do par propostos foi determinada por Javier Perez-Carvajal, do Laboratoire de Physique de l’Ecole Normale Sup´erieure-ENS, Universit´e PSL, CNRS, 75005 Paris, France (Perez-Carvajal, 2017). Mostra-se também os detalhes do funcionamento da bancada experimental. Descrevendo os materiais e os dispositivos desenvolvidos para medição dos dados que precisamos medir para simular o sistema.
Objetivo Geral
Desenvolver uma bancada de testes capaz de medir a cinética de adsorção e, principalmente, determinar a concentração máxima de etanol adsorvido pelo carvão ativado e a partir desse dado, podemos simular o ciclo adsortivo usando esse par.
Objetivos Específicos
- Projetar e construir uma bancada de testes, em escala reduzida, capaz de medir a cinética de adsorção;
- Medir a cinética de sorção de amostras significativas (centenas de gramas);
- Construir as isotermas para determinar parâmetros para as equações do ciclo de adsorção;
- Aprimorar/Validar os modelos matemáticos já desenvolvidos por outros pesquisadores.
Calor isostérico de adsorção desenvolvido a partir da equação D-A (Dubinin-Astakhov)
A equação pode ser escrita como:
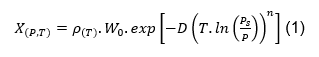
X(P,T): É a massa de fluido adsorvido por unidade de massa do adsorvente, a uma temperatura T e pressão P.
W0: Representa a concentração máxima de adsorvato no adsorvente.
P: É a pressão de adsorção.
Ps: É a pressão de saturação. Ps na equação D-A, é a pressão de saturação onde não ocorre mais adsorção física.
D: É um parâmetro relacionado à energia característica da adsorção ou ao calor isostérico de adsorção, conforme o contexto da equação D-A. .
ρ(T): É a densidade do etanol, ou fluido de trabalho.
T a temperatura.
Bancada e Procedimento Experimental
Uma bancada foi montada com uma bomba de vácuo que trabalha com pressões iniciais de 3kPa. O motivo dessa pressão é que estão de acordo com a propriedade do etanol para evaporar.
A bancada experimental foi montada conforme desenho abaixo, com dois tubos metálicos para representar os dois trocadores de calor, um trocador contendo carvão, ambos na vertical e o outro, etanol, que representa um elemento do coletor adsorvedor e a outra na vertical o evaporador, o que reproduz, para estudo, condições análogas à configuração do sistema proposta de adsorção.
A bancada experimental montada foi instrumentada e é composta de uma coluna de etanol, com carvão ativado,
Figura 01- Bancada experimental para medir a concentração de etanol no CA119
Fonte: próprio autor/2025
Esse experimento vai nos fornecer a quantidade de etanol que é adsorvido pelo carvão e a partir desses dados vamos determinar as constantes nas equações do ciclo adsortivo para que possamos elaborar a simulação numérica do ciclo de adsorção com os referidos pares adsortivos, inicialmente etanol e carvão ativado CA119.
Como podemos verificar pela figura, esse experimento é bem simples e de fácil montagem, ele foi idealizado por nós, porque tivemos dificuldade de encontrar um experimento que pudesse fornecer essas quantidades (concentração de etanol no carvão) que precisamos para simular o ciclo, inicialmente fizemos com tubos de PVC, para verificar se a ideia funcionava, e o importante é que funcionou.
No tubo da esquerda (vertical) enchemos de etanol até a válvula, fechamos a válvula e no outro tubo a direita, onde colocamos o carvão aditivado, fizemos vácuo para depois abrirmos a válvula e medirmos quanto de etanol é adsorvido pelo carvão. Depois de atingir o equilíbrio termodinâmico, desacoplávamos os tubos e medimos a quantidade de etanol que ficava no tubo, agora contendo carvão e etanol adsorvido, antes registrávamos as massas antes de realizarmos o experimento, repetimos várias vezes em vários dias, para que pudéssemos ter um resultado confiável.
Experimento para determinar a concentração máxima de Etanol no Carvão Ca119 e as Isotermas de Adsorção para esse par
Aqui apresentamos o experimento que realizamos para traçar as isotermas do par analisado.
Os materiais utilizados no experimento, juntamente com o par adsorvente e adsorvato utilizados e os equipamentos de medição:
Carvão ativado, Etanol, Termopares, Data Logger, Bomba de Vácuo, Vacuômetros, Válvulas, Tubulações, Conexões, Balança, Estufa, Notebook, Pasta térmica, cola , resistência, termostato
Adsorvente utilizado:
O adsorvente é o sólido que vai adsorver o fluido, escolhemos para esse experimento, o Carvão ativado CA119 .
Adsorvato utilizado
O adsorvato é o fluido que vai produzir frio ao ser adsorvido pelo carvão ativado CA119, em refrigeração chamamos de refrigerante, mas no ciclo adsortivo é chamado de adsorvato. No nosso experimento usamos como adsorvato o etanol.
O etanol
O etanol é nosso fluido de trabalho, nosso refrigerante, mas como é mais conhecido no ciclo adsortivo, nosso adsorvato. As propriedades do etanol usadas na simulação do protótipo foram extraídas do próprio fabricante, conforme as características do projeto, ou seja, as temperaturas de evaporação e condensação do adsorvato que são respectivamente 0°C e 40°C:
Densidade:757kg/m3, calor específico: 2430J/kg.K.
Figura 02 – Características do etanol
Fonte: programa Engineering Equation Solver (EES) 2025
Procedimento experimental: resultados e discussões
A bancada experimental foi montada com duas tubulações de alumínio para representar os trocadores de calor, uma coluna (horizontal) que representa um elemento do coletor adsorvedor e a outra na vertical o evaporador, o que reproduz, para estudo, condições análogas à configuração do sistema proposta de adsorção.
Figura 03 – Trocadores de calor contendo (carvão CA119) e (etanol)
Fonte: próprio autor/2025
A bancada experimental montada foi instrumentada e é composta de uma coluna de adsorção, com carvão ativado (horizontal), onde colocou-se um vacuômetro para medir a pressão de equilíbrio ao cessar a adsorção do etanol pelo carvão, depois de ter cessado a cinética de adsorção, pesamos novamente o carvão, e pela diferença de massa antes da cinética e depois , tiramos a massa de etanol que foi adsorvida aquela temperatura tudo sendo registrado numa tabela.
Passo a passo do Experimento para medir a massa de etanol adsorvida pelo carvão ativado
Etapas prévias:
Pesar os dois reservatórios e válvulas vazias para conhecer suas respectivas massas.
1º Passo: Colocar o carvão na reservatório;
2º Passo: Fazer vácuo no reservatório do carvão – (para limpar o carvão). Nessa etapa fizemos vácuo com os tempos de 5min, 10min, 15min e 60min;
3º Passo: Pesar o reservatório do carvão (fechado) – (para saber a massa de carvão);
4º Passo: Colocar etanol no reservatório, 5ml;
5º Passo: Fazer um vácuo rápido do reservatório de etanol e fechar a válvula com a bomba ligada – (para retirar o ar atmosférico do reservatório, assim fica apenas etanol em estado saturado);
6º Passo: Pesar o reservatório de etanol (fechado) – (para saber a massa de etanol);
7º Passo: Acoplar os dois reservatório fechados às tubulações e fazer vácuo na tubulação;
8º Passo: Fixar os termopares na superfície externa dos reservatórios e configurar o datalogger;
9º Passo: Abrir as válvulas dos reservatórios para iniciar o processo de adsorção;
10º Passo: Após o equilíbrio térmico, fechar as válvulas e desacoplar das tubulações;
11º Passo: Pesar as válvulas para conhecer a variação de massa (espera-se encontrar valores próximos, mas normalmente a perda de etanol é ligeiramente maior que o ganho do carvão, porque parte do vapor pode se perder na tubulação.);
12º Passo: Analisar os resultados.
Com esse experimento nos forneceu a quantidade máxima de etanol que é adsorvido pelo carvão, encerrada a adsorção, medimos a massa do carvão novamente e pela diferença de massas antes e depois da adsorção, determinamos o valor máximo de etanol adsorvido no carvão, abaixo alguns desses valores obtidos e a partir desses dados podemos alimentar a simulação numérica do ciclo de adsorção com o referido par adsortivo. Esses valores são os disponibilizados abaixo.
Dados Experimentais da cinética de Adsorção
1° medida
Tempo de vácuo: 3min
Pinicial=30mbar
Tabela 01: Concentração máxima do etanol no carvão CA119

Fonte: próprio autor/2025
Tempo de vácuo: 10min
Pinicial=30mbar
Tabela 02: Concentração máxima do etanol no carvão CA11

Fonte: próprio autor/2025
Tempo de vácuo: 5min
Pinicial=30mbar
Tabela 03: concentração máxima do etanol no carvão CA119

Fonte: próprio autor/2025
Tempo de vácuo: 15min
Pinicial=30mbar
Tabela 04: Concentração máxima do etanol no carvão CA119

Fonte: próprio autor/2025
Conforme resultados, observamos que os valores encontrados convergem para o encontrado na literatura sobre o par estudado, como o trabalho: Thermal kinetics on adsorption heat transformation based on activated biocarbon and ethanol as working pairs (Carvalho et all 2022). Que podemos comparar com os nossos resultados obtidos. Para a concentração máxima de adsorvato no adsorvente, o Wo, encontramos um valor médio de 0,2068g/g e uma pressão final média de 156,90mbar e uma pressão relativa média de 0,195. Todos os valores bem próximos dos valores obtidos no trabalho citado, isso confirma que o experimento pode ser utilizado para determinar a pressão de equilíbrio dos pares envolvidos no fenômeno de adsorção e também nos fornece a concentração máxima para o par a ser estudado.
Como esse adsorvente, embora muito utilizado para experimento relacionados a adsorção, não existe na literatura muitos trabalhos que nos forneçam os dados da concentração máxima que esse adsorvente adsorve. No trabalho citado realizou-se um experimento BET para determinar a sua área superficial. O Método de BET ou ainda Teoria de Adsorção Multimolecular é uma teoria matemática com o objetivo de descrever a adsorção física de moléculas de gás sobre uma superfície sólida e serve como base para uma técnica de análise importante para medição de área superficial específica de um material. O método de BET foi desenvolvido por Stephen Brunauer, Paul Hugh Emmett e Edward Teller —B.E.T. Brunauer, Emmett, Teller — e publicado em 1938 em artigo intitulado “Adsorption of Gases in Multimolecular Layers” no Journal of the American Chemical Society. (wikipedia)
Analisador de área superficial BET
O equipamento para análise de área superficial por BET realiza medidas de área superficial específica através da determinação do volume de gás adsorvido fisicamente na superfície da amostra. O procedimento experimental utiliza um inerte gás, nesse experimento foi utilizado nitrogênio, devido a sua facilidade de obtenção em estado puro e por apresentar interação relativamente baixa com a grande maioria dos sólidos. Devido ao fenômeno de adsorção física estar relacionado a forças de interação molecular fracas entre o adsorbato — moléculas de gás — e adsorvente — superfície sólida da amostra —, as medidas no equipamento são realizadas na temperatura de condensação do nitrogênio a fim de se obter valores detectáveis de adsorção. A análise é realizada adicionando em etapas quantidades conhecidas de pressão de nitrogênio (p0) ao recipiente da amostra, de forma que diferentes pressões de vapor (p) sejam alcançadas no equilíbrio do sistema. Durante o procedimento, um sensor de pressão monitora as variações de pressão (p) devido aos processos de adsorção. Quando a pressão de saturação é alcançada não ocorre mais adsorção física independente de acréscimo na pressão. Após as camadas de adsorção serem formadas — p0 for igual a pressão de saturação — a amostra é removida da atmosfera de nitrogênio, e aquecida para que ocorra a dessorção e quantificação das moléculas de nitrogênio adsorvidas no material. Os dados coletados de pressão são apresentados na forma da isoterma de BET — equação (1) —, que relaciona o volume de gás adsorvido v em função da pressão relativa p/p0. Existem cinco tipos,
Figura 04 – Tipo de isoterma de adsorção de acordo com a classificação de Brunauer
Fonte: Adaptado de Charles Hill, 1977, p.173
Isoterma Tipo I
A isoterma encontrada no experimento foi do tipo I, como podemos comparar, é uma pseudo-isoterma de Langmuir, porque está relacionada a adsorção de uma única ou poucas camadas sobre a superfície sólida. Uma isoterma do tipo I é típica de materiais microporosos, onde os poros excedem em pouco o diâmetro molecular do adsorbato.
O resultado depois da análise de área superficial por BET foi esse apresentado na figura 05,
Figura 05: Pressão relativa x volume do CA119 (Jorge Passinho)
Fonte: próprio autor/2025
Outro experimento realizado foi o DVS que consiste na medida de isotermas de sorção do solvente. Em geral, uma isoterma de sorção de vapor de etanol mostra a quantidade de vapor sorvido no equilíbrio em função da pressão de vapor relativa do estado estacionário, a uma temperatura constante.
Figura 06 Cinética de sorção de ETANOL NO CARVÃO ATIVADO CA119 ISOTERMA a 25.0°C. (Jorge Passinho)
Fonte: próprio autor/2025
Figura 06 apresenta resultado de sorção de etanol no carvão ativado CA119, experimento realizado com DVS. Os dados de cinética mostram a alteração na massa como função do tempo. A partir dos resultados de cinética, a velocidade de captação de etanol e o coeficiente de difusão do etanol podem ser determinados. Os valores de equilíbrio da massa no final de cada degrau de vapor foram usados para calcular a isoterma de sorção e dessorção. A diferença na captação do vapor de etanol entre a isoterma de sorção e dessorção é denominada histerese. O formato e a localização da histerese na isoterma podem elucidar informações sobre o mecanismo de sorção e porosidade da amostra.
Considerações finais
O estudo demonstrou a viabilidade e a eficácia de uma bancada experimental simplificada para a determinação da concentração máxima de etanol adsorvido no carvão ativado CA119. A concordância dos resultados experimentais com os dados da literatura para este par adsorvente-adsorvato valida a metodologia proposta e os dados obtidos. A determinação precisa de parâmetros como W0 e a pressão final é fundamental para a modelagem e simulação do ciclo adsortivo, um objetivo central deste trabalho.
A abordagem de construir e validar uma bancada de testes em escala reduzida para medir a cinética de adsorção e determinar a concentração máxima de etanol no carvão ativado CA119 preenche uma lacuna na literatura, visto que, não há muitos trabalhos que forneçam esses dados específicos para este adsorvente. A simplicidade e facilidade de montagem da bancada são pontos fortes que podem facilitar futuras pesquisas e o aprimoramento de modelos matemáticos.
A análise complementar com métodos como BET e DVS fortalece a caracterização do adsorvente e do processo de adsorção. A isoterma do tipo I obtida via BET indica a natureza microporosa do carvão CA119, o que é relevante para entender o mecanismo de adsorção. Os dados de cinética de sorção de etanol, obtidos por DVS, oferecem insights sobre a velocidade de captação e o coeficiente de difusão, informações cruciais para otimizar o desempenho de sistemas adsortivos.
Este trabalho fornece dados experimentais valiosos e uma metodologia validada para a caracterização do par carvão ativado CA119-etanol. Esses dados são essenciais para avançar na simulação numérica e no desenvolvimento de protótipos de sistemas de refrigeração por adsorção, contribuindo significativamente para o campo da utilização de calor baseada em adsorção.
REFERÊNCIAS
Brunauer, S., Deming, L.S., W.E, Teller, E.,1940, On a theory of the van der Waals adsorption gases, J.Am.Chem. Soc. Vol 62, p.1723-1732
CARVALHO-FILHO, Aluizio F., ALCÂNTARA, Ana C.S., PAIVA, Antônio E.M., SILVA,Jorge J. Passinho, PEREZ-CARVAJAL, Javier, ROJAS, Alex.Thermal kinetics on adsorption heat transformation based on activated biocarbon and ethanol as working pairs,Materials Letters, Volume 311, 2022, 131622, ISSN 0167-577X, https://doi.org/10.1016/j.matlet.2021.131622.
Dubinin, M.M., 1961, Astakhov, V.A.,1971, Development of the concpts of volume filling of micropores in the adsorption of gases and vapors by micropouros adsorbents, Bulletin of the academy of sciences of the URSS, vol.20, p.3-7
El-Sharkawy, I.I., Saha, B.B., Koyama, S.,He, J., Ng, K. C., Yap, C., 2008, Experimental investigation on activad carbon-ethanol pair for solar powered adsorption cooling applications, Int.J.Refrig., vol 31, p1407-1413
El-Sharkawy, I.I., Uddin, K., Miyazaki, T.,Saha, B.B., Koyama, S.,miyawaki, J., Yoon, S.H., 2014, Adsorption of ethanol onto parent and surface treated activad carbon , Int.J.Heat Mass Transfer, vol 73, p445-455
Gordeeva, L.G.; Aristov, Y.I. Adsorptive Systems for Heat Transformation and Heat Storage Applications. Energies 2022, 15, 617. https://doi.org/10.3390/en15020617
HILL, C. An Introduction to Chemical Engineering Kinetics and Reactor Design. New York: John Wiley and Sons, 1977. 594 p. Disponível em: <https://books.google.com. br/books?id=okQWAwAAQBAJ&printsec=frontcover&hl=pt-BR&source=gbs_ge_ summary_r&cad=0#v=onepage&q&f=false>.
Kil, H.S., Hata, K., Ideta, K., miyawaki, J., Mochida, I., Yoon, S.H., Influence of surface functionality on ethanol adsorption behavoir in activated carbons analyzed by solid-state NMR, in: B.B. Saha et. Al. (Ed.), Proceeding of innovative Materials for processes in Energy Systems 2013 (IMPRES2013), Fukouka, Japan, 2013, p.525-528.
PEREZ-CARVAJAL, Javier, do Laboratoire de Physique de l’Ecole Normale Sup´erieure-ENS, Universit´e PSL, CNRS, 75005 Paris, France, 2017.
1Professor do Departamento de Física/CECEN/UEMA. E-mail: jorgepassinho@gmail.com
