REGISTRO DOI: 10.69849/revistaft/pa10202506140903
Yasmim Namie Da Silva Tanigawa
Orientadora: Dra. Ana Lucia Chalhoub Chediac Rodrigues
RESUMO
Esta revisão bibliográfica se inicia explicando a origem da “Eugenia” por Galton em 1883, sendo seguida pelo avanço da biologia molecular para, mais tarde, a modernização da engenharia biomédica apresentar a edição de gene como uma proposta de um futuro altamente aprimorado, com a descoberta do mecanismo de defesa das bactérias, CRISPR-Cas9. São descritas as subclasses do sistema com o seu funcionamento e a aplicação como o tratamento oncológico. Após testes e artigos regidos por um grupo de cientistas foi possível a obtenção de resultados por meio de estudos in vivo e em vitro. O Caso ocorrido em 2018, com o biofísico chinês He Jiankui que surpreendeu e causou revolta à comunidade científica e ao mundo. Apesar da necessidade de aprimoramento e aprovação e dos muitos questionamentos e críticas partindo da bancada de ética e da científica, o CRISPR-Cas9 se torna uma possibilidade para os humanos.
Palavras-chave: CRISPR-CAS9. Edição de gene. Oncologia. Engenharia genética. Terapia de gene. Biologia molecular. CRISPR.
ABSTRACT
This literature review begins by explaining the origin of “Eugenics” by Galton in 1883, followed by the advancement of molecular biology and, later, the modernization of biomedical engineering, presenting gene editing as a proposal for a highly improved future, with the discovery of the bacterial defense mechanism, CRISPR-Cas9. The subclasses of the system are described with their functioning and application as oncological treatment. After tests and articles conducted by a group of scientists, it was possible to obtain results through in vivo and in vitro studies. The Case occurred in 2018, with the Chinese biophysicist He Jiankui, which surprised and caused a revolt in the scientific community and the world. Despite the need for improvement and approval and the many questions and criticisms from the ethical and scientific benches, CRISPR-Cas9 becomes a possibility for humans.Keywords: CRISPR-CAS9. Gene editing. Oncology. Genetic engineering. Gene therapy. Molecular biology. CRISPR.
1 INTRODUÇÃO
Mais precisamente em 1883, Inglaterra, durante a era vitoriana, surgia o conceito de “Eugenia”, criado pelo antropólogo Francis Galton, a palavra de origem grega significa “bem- nascido”. Galton, que era primo de Charles Darwin, tinha a ideia de manipular a genética humana para a melhoria das futuras gerações. Ele acreditava que uma vez que conseguisse atingir o controle da quantificação hereditária, surgiriam seres humanos superiores e assim tomaria as rédeas da evolução humana. “Não era irracional que biólogos como Galton pensassem que, se as ciências físicas estavam mudando o mundo tão dramaticamente − as ferrovias, a luz elétrica, o telefone −, as ciências da vida poderiam fazer o mesmo”, diz Daniel Kevles, Historiador de Ciência da Universidade de Yale1.
E foi na transição do século XIX que a onda de “Eugenia” ganhou força e chegou aos Estados Unidos, por volta de 1920, carregando um certo apavoramento na população local, sem dúvida, eram tempos de mudanças nos campos da Medicina e da Pesquisa. Com essa ideia de superioridade genética e no ápice global da “Eugenia”, muitos Casais, por possuírem patologias genéticas, foram proibidos de procriar, considerados inferiores para o aperfeiçoamento genético; assim, abortos e esterilizações eram alguns dos métodos de prevenção ao nascimento de bebês considerados não saudáveis. “Muita gente associa a palavra ‘eugenia’ aos nazistas e ao Holocausto. Mas isso está errado. Na verdade, Hitler aprendeu com o que os EUA haviam feito”, esclarece Daniel Kevles2.
Novamente é possível ressaltar os questionamentos em relação à pseudociência que foi como a Eugenia se consolidou, até onde iria a ambição científica e suas tentativas de manipulação da vida e quem arcaria com o peso de tamanha responsabilidade e suas consequências. Hoje, a tecnologia toma conta de nossas vidas por um todo e claro que não seria diferente em relação à ciência, possibilitando um certo refinamento na engenharia genética, com técnicas que prometem revolucionar o modo como se enxerga o âmbito genético. Isaac Asimov fez a seguinte previsão em 1970, “O avanço da engenharia genética torna praticamente possível que começaremos a desenhar nosso próprio progresso evolutivo”2, pois foi entre o final do século XX e início do século XXI que surgiu a edição de genes, técnicas que possibilitaram modificações no genoma humano, ele acreditava que o homem tentaria cada vez mais ter controle sobre a natureza humana e suas imprevisibilidades. Há quase 50 anos, Asimov acertara sobre o futuro, vulgo, nosso presente3.
2 OBJETIVO
Essa revisão bibliográfica tem por finalidade apresentar a ferramenta CRISPR-Cas9 como um meio de tratamento para o câncer, abrangendo suas questões positivas e negativas, reunindo dados para uma melhor discussão, possibilitando uma conclusão mediante as informações apresentadas.
3 METODOLOGIA E MÉTRICA
Esta revisão de literatura se deu por artigos retirados de plataformas como PubMed, The Lancet, The New York Times. Inicia-se com uma descrição de eventos cronológicos, explicando desde o surgimento da Eugenia, referenciando eventos históricos, até o surgimento da edição de gene.
O desenvolvimento do trabalho abrange a complexibilidade da ferramenta e o que ela representa, assim como sua origem, fisiologia e funcionabilidade, que se dividem em subtítulos. Resultados tabelados de pesquisas com o CRISPR foram comparados buscando esclarecer a eficácia da ferramenta em diferentes genes, possibilitando, assim, a inerência e adequação de cada tumor a CRISPR-Cas9. Com o objetivo de proporcionar a discussão entre os resultados, incorporando questões morais e éticas como controvérsias. Foi utilizado o método de pesquisa exploratória.
A pesquisa foi realizada por revisão de literatura por fontes secundárias, como artigos científicos, sites credenciados, jornais e revistas acadêmicas. Tendo como principal objetivo reunir o maior número de informações, discursando sobre a eficácia da técnica em estudo. Foram utilizados artigos nos idiomas inglês e português, publicados entre 2015 e 2021. Informações apresentadas em forma de tabelas também foram adicionadas. O período de acesso foi entre setembro de 2022 e maio de 2023, com os descritores CRISPR-Cas9, edição de gene no câncer, terapia gênica, genética, as referências foram pesquisadas em português e inglês. Os artigos foram disponibilizados com ano, título e resumo. Os critérios de exclusão se basearam em assuntos que não abrangiam o assunto principal e publicações repetidas, totalizando 22 artigos descartados. Os 14 restantes foram analisados e concluíram essa amostra. A grande dificuldade se deu pelo fato de o tema ser muito complexo e não ter a disponibilidade de resultados e dados mais específicos, porém, as informações obtidas foram satisfatórias para a conclusão dessa amostra.
4 CRISPR, UM ELEMENTO GENÉTICO
Foi em 2012 que problemas éticos e morais em relação às técnicas envolvendo o genoma humano foram postos novamente em questão pela comunidade científica. As responsáveis desta vez eram duas pesquisadoras, a francesa Emmanuelle Charpentier e a estadunidense Jennifer Doudna que, a partir dali, mudariam a forma como interagimos com os DNA humano. Descoberto em 1987, pelo pesquisador Yoshizumi Ishino, mas agora com finalidades na edição de gene, assim surgia o sistema CRISPR, uma tecnologia que prometia revolucionar a engenharia genética3.
O CRISPR é um acrônimo para expressão inglesa Clustered Regularly Interspaced Short Palindromic Repeats, em português “Repetições Palindrômicas Curtas Agrupadas e Regularmente Interespaçadas”. A explicação de uma técnica tão extraordinária, com a promessa de não só revolucionar a engenharia genética como também servir de passe para a humanidade ser capaz de controlar a própria raça e escrever um futuro transcendente. O sistema CRISPR pode ser divido em duas classes, I e II, sendo que a primeira requer um número grande de proteínas para atuação; já a classe II, apenas uma proteína é necessária e é nessa classe que se encontra o sistema CRISPR-Cas94.
O mecanismo do sistema CRISPR sempre existiu e se manteve discretamente em um organismo muito acessível a nós humanos, os procariontes. A velha história do bacteriófago que infecta bactérias, com o simples propósito de reprodução viral através do ciclo lítico. Este vírus tem capacidade de infectar a bactéria sem se associar ao DNA dela, provocando reprodução através de proteínas e produzindo um novo material genético viral dentro desta bactéria. Entretanto, assim como os humanos têm o sistema imunológico que auxilia no combate às patologias causadas por agentes infecciosos, a bactéria possui seus próprios mecanismos de defesa como, por exemplo, o uso de enzimas de restrição, enzimas especiais que fazem a clivagem desse material genético, impedindo assim sua reprodução. Com o tempo e os avanços na microbiologia foi possível um melhor entendimento sobre o funcionamento desse mecanismo, existe uma região dentro da bactéria que atua como um reservatório para esse fragmento de DNA viral, região essa chamada de CRISPR-Cas9. Esse material viral possui repetições palindrômicas, e é colocado junto ao gene da bactéria. Essas repetições são espaçadas, porque são colocadas entre trechos de DNA não codificantes, a sequência segue da seguinte maneira: gene Cas9 (enzima destruidora de DNA viral), DNA viral, DNA não codificante, DNA viral, DNA não codificante e assim por diante. Quando um novo vírus infecta esta bactéria (Figura 1), ela rapidamente produz uma porção desse gene do vírus, graças ao sistema CRISPR- Cas9, e adere o mesmo junto ao gene da enzima Cas9, esta que com o DNA viral preso a ela, vai direto ao encontro do invasor e consegue clivar esse novo material genético do microrganismo infeccioso4.
Figura 1- CRISPR-Cas9: repetições palindrômicas curtas, agrupadas e regularmente interespaçadas ligada à proteína 9; DNA: ácido desoxirribonucleico; crRNA: ácidos ribonucleicos CRISPR maduros curtos; PAM: protospacer.
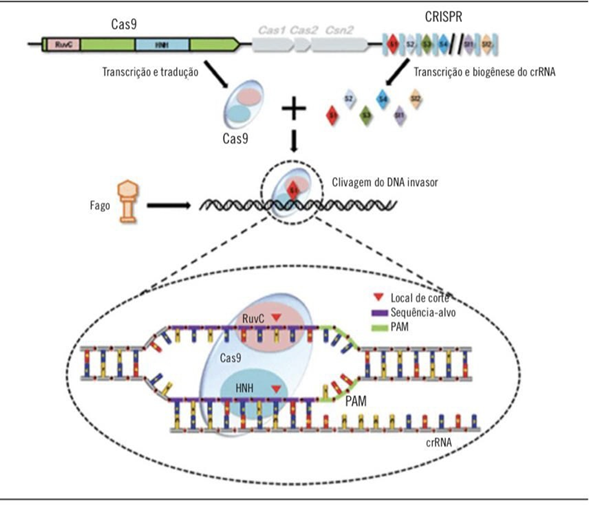
Fonte: Adaptado de Zhang et al. (2014)
Pensando pelo princípio químico, semelhante atrai semelhante, a tática pode ser comparada com a nossa memória imunológica. Cientistas pensaram em como poderiam utilizar esse princípio em humanos, programar uma enzima para “cortar” exatamente onde se deseja, era extraordinário de se pensar que a ciência poderia chegar a tanto. Charpentier e Doudna ganharam o prêmio Nobel em química, em 2020. O CRISPR se diferencia das demais tecnologias de edição de gene por sua alta especificidade, simultaneidade de atingir em diversos genes, praticidade, tempo e por último, custo-benefício. Dois componentes importantes para a realização da técnica são o sgRNA e, claro, a proteína Cas9. O sgRNA consiste em uma sequência que engloba a enzima Cas9 através do seu sítio de ligação e uma sequência espaçadora chamada de sequência alvo, que é específica para o gene de interesse que foi programada. A sequência espaçadora conta com 20 nucleotídeos e é seguida pela PAM, esta, que varia de acordo com o tipo de enzima Cas9 e serve como um sítio de ligação para a enzima, para que ela possa começar o mecanismo de edição4.
Basicamente, foram encontrados mais de um tipo de enzima Cas, tornando a sua manipulação mais flexível ao ponto de atingir um grande avanço na engenharia genética5.
Por ser uma ferramenta de alta especificidade, o sistema CRISPR-Cas9 pode ter diferentes alvos, graças ao complexo de direcionamento que necessita de uma sequência de gene alvo acompanhado de uma Cas9 em atividade endonuclease:
Uma vez que o sgRNA e a Cas9 são incorporadas no sistema, Cas9 faz a ligação através de seus grânulos positivos, formando um complexo ribonucleico. Uma vez que o complexo se forma, Cas9 passa por uma alteração conformacional, ativando-a. Já ativado, o complexo Cas9-sgRNA se liga ao gene alvo de uma maneira altamente específica. O complexo não media os efeitos até que haja alta especificidade de sequência entre sgRNA e o locus alvo. A fita modelo se liga ao gRNA enquanto a não-modelo se liga ao sulco HNH/RuvC da Cas9. A especificidade do nucleotídeo é alcançada, o sgRNA se liga ao target locus em uma direção 3’- 5’.
Explicam os pesquisadores do departamento de Imunoterapia voltada para Terapia Alvo do Câncer, da Texas Tech University, Itishree Kaushik, Sharavan Ramachandran e Sanjay K. Srivastava5.
4.1 CRISPR-Cas9, edição gênica em genes alvos
A medicina vem se desenvolvendo cada dia mais e, com isso, aguarda-se ansiosamente para que doenças como o câncer não sejam mais um diagnóstico atrelado à morte. O sistema CRISPR-Cas9 vem sendo considerado como essa possível esperança, juntamente com outras técnicas de edições de gene, porém, esse sistema se prova mais sofisticado a medida que seu mecanismo consiste na clivagem de nucleotídeos específicos, a base de uma pequena sequência mediada por RNA, mas sendo também capaz de ter vários alvos simultaneamente. Os cientistas acreditam que esta nova tecnologia ajudará em um melhor entendimento sobre a diversidade de variação do genoma entre pacientes e ainda contribuirá com novas informações para serem estudadas, ajudando no aprimoramento da terapia do câncer. O objetivo do mecanismo consiste em um melhor funcionamento do gene, a enzima Cas9 opera uma ruptura na dupla hélice do DNA, esta que é reparada por mecanismos de junção, induzindo pequenas deleções ou inserções. Modelos de tumores geneticamente modificados mediados por CRISPR-Cas9 se tornaram uma ferramenta indispensável na pesquisa oncológica. O sistema ainda possui o potencial de modificar uma ampla gama de genes presentes de forma abundante em cânceres humanos, Quadro 15.
Quadro 1- Genes alvos
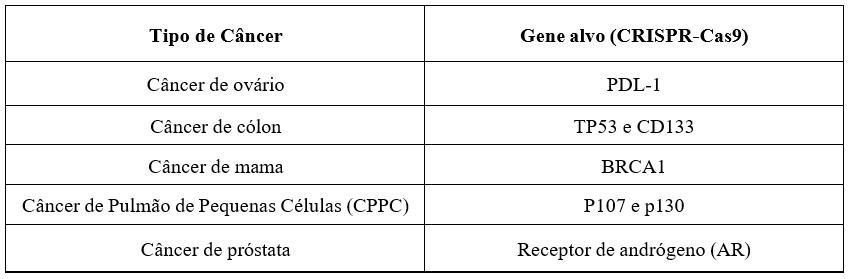
Fonte: Brazilian Journal of Development ISSN: 2525-8761 90914, 90915 e 90917
A técnica tem sido estudada e utilizada no silenciamento de oncogênese e genes supressores de tumor, além de indicar alvos para o desenvolvimento de novos fármacos. O câncer, por se tratar de uma doença causada por alterações genéticas, é um ótimo candidato ao uso desse sistema de edição de genoma. A utilização de modelos de câncer tem sido estudada e produzida de maneira eficaz, sendo sua produção simples e de baixo custo, incluindo modelos de leucemias com alvo em genes inativados por Cas-sgRNA6.
Ademais, o sistema pode ser útil na identificação de novos alvos de drogas com um sistema de rastreamento genético, e na busca de interações gênicas sinérgicas que podem ser úteis para bloquear a resistência a medicamentos7.
5 RESULTADOS
Muitos dos artigos sobre esse tema pesquisam sobre o modelo nocaute tanto in vitro quanto in vivo, com o intuito de obter mais informações através da biologia molecular de diversos tipos de cânceres, além de estudar a progressão da doença conforme a mutação nessas células. O ciclo celular tem como principal função a produção de novas células e com isso a passagem de seu material genético para futuras células descendentes, infelizmente, alguns agentes podem interferir nesse processo, agentes físicos, químicos e biológicos.
Nosso corpo possui mecanismos de reparação para corrigir tais erros, porém, esses mecanismos as vezes não conseguem suprir a necessidade de reparação celular. Então, os agentes causam danos ao DNA e esses danos são a principal causa de as mutações serem capazes de desencadear um futuro tumor. Uma vez que um tumor é gerado, ele é perpetuado por genes proto-oncogene, que estimulam a proliferação descontrolada de células com o DNA comprometido por alterações genéticas, esse processo é denominado de oncogênese.
Segundo Laura Ward (2002) “contamos com os genes supressores de tumor para reparar tais danos, retardar a divisão celular, e estimular apoptose”8.
“Dois jeitos de provocar tumorinogênese seria pela ativação de proto-oncogene em oncogenes ou pela inativação dos genes supressores de tumor”. Estudos in vitro que foram realizados entre 2018 e 2020, pela cientista Eva Lentsch e seus companheiros, mostraram a eficácia do CRISPR-Cas9 com experimentos feitos em genes comuns em determinados tipos de cânceres, com o intuito da busca pelo nocaute de genes através de uma variedade de linhagens celulares. Uma vez que os genes foram confirmados inativos/silenciados pelo CRISPR, células foram cultivadas para apuração dos ensaios clínicos, tendo como características observadas, proliferação celular, formação de colônias, invasão e migração. Os estudos foram realizados com foco na supressão tumoral, tentando avaliar a progressão dos tumores em dois estudos in vitro, tendo como objetivo induzir o nocaute de genes envolvidos. O nocaute genético é a inativação de um gene, um bloqueio da expressão de certo gene em um organismo, e logo depois a substituição desse gene por uma versão modificada (Quadro 2)6.
Quadro 2- Principais resultados obtidos in vitro com a utilização da técnica CRISPR na oncologia.
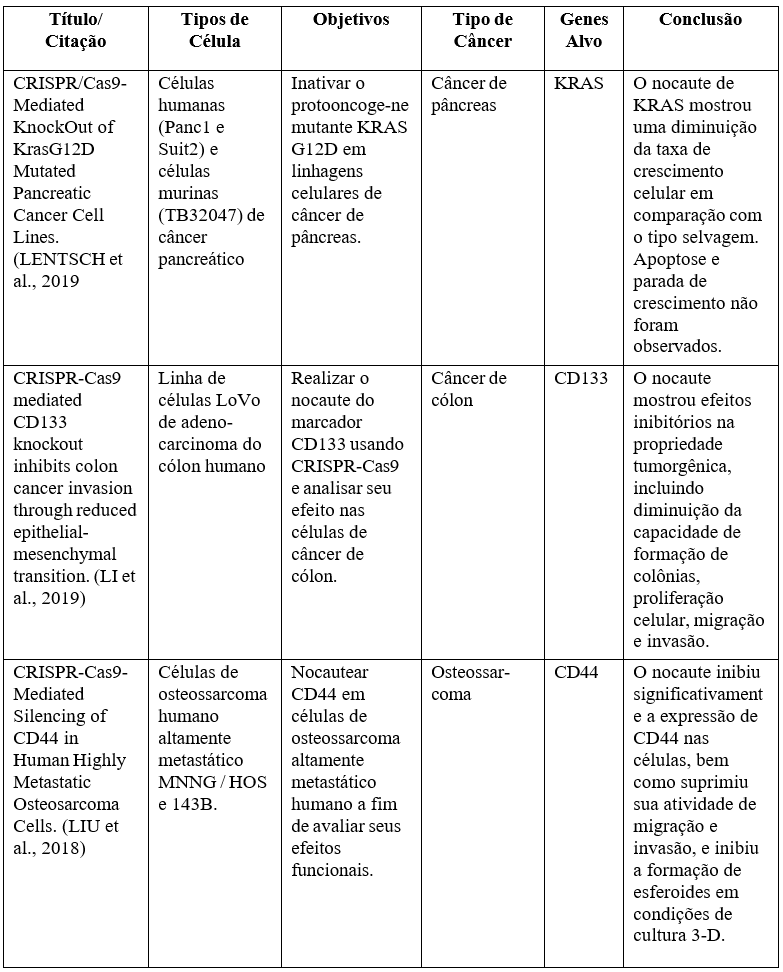
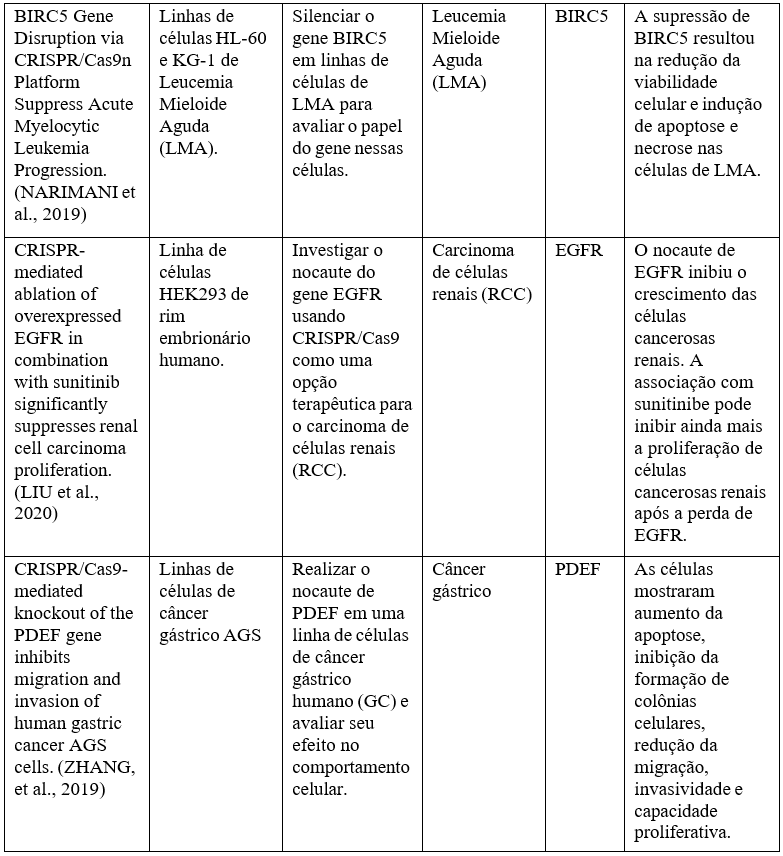
Fonte: https://www.brazilianjournals.com/index.php/BRJD/article/view/36160.
Bresolin, Wietholter e Kirsten (2021), comentam: “não observaram diminuição da apoptose nem parada de crescimento celular, porém, houve uma considerável diminuição da taxa de crescimento”9.
Aplicações da técnica envolvem não só os ensaios in vitro, mas também os in vivo (Quadro 3), a parte inicial de todo o processo acontece na etapa in vitro, onde os genes são editados, programados e inativados. A próxima etapa é a fase in vivo, onde esses genes são observados como um todo, como eles irão se correlacionar com outras células, como o sistema vai reagir, ou seja, a relação que estas células modificadas terão com o organismo em si9.
Quadro 3- Principais resultados obtidos in vivo, a partir de modelos animais, com a utilização da técnica CRISPR na oncologia.
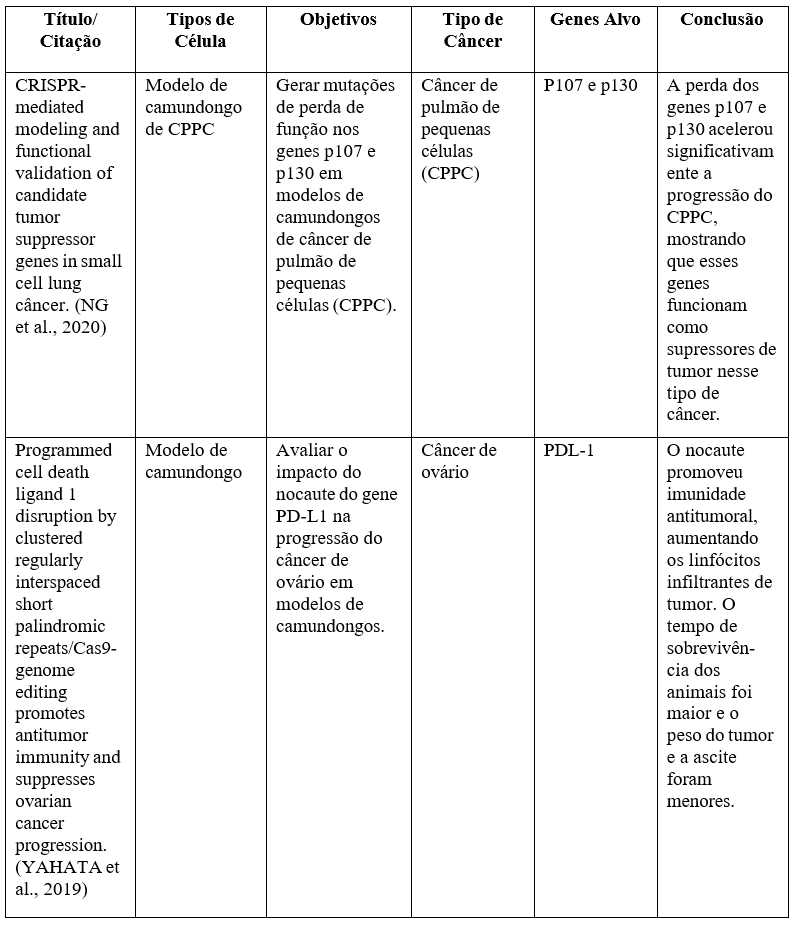
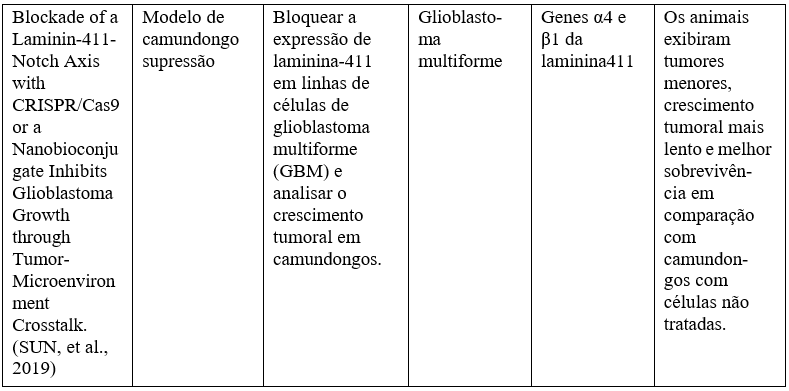
Fonte: https://www.brazilianjournals.com/index.php/BRJD/article/view/36160.
Ambas as fases estudam a inativação de genes com tendências à progressão tumoral. O CRISPR teve bons resultados de pesquisa nos últimos anos, mostrando-se realmente como uma promessa de esperança para a engenharia genética e para o tratamento oncológico, “editando oncogenes ou genes supressores de tumor, diminuindo a progressão tumoral e criando modelos de estudo para avaliar a participação de genes na tumorigênese”. Dados apontam o crescimento de células tumorais diminuindo e apresentam maior sobrevivência em animais testados. “A baixa eficácia dos tratamentos existentes para pacientes com diversos tipos de câncer também torna a técnica promissora para a identificação de novas vias que reduzam a resistência aos quimioterápicos”. Enquanto estudos no corpo humano ainda sejam um assunto delicado e em pauta, pesquisadores ao redor do mundo têm mantido não só a ideia, mas as práticas laboratoriais10.
O câncer matou aproximadamente 10 milhões de pessoas no mundo em 2020, sendo uma doença que pode ser desencadeada por diversos fatores e agentes, tendo seus sintomas variados e dependentes do tipo de órgão acometido11.
São inúmeros os desafios, principalmente para aqueles que tiveram e tem suas vidas dedicadas a procurar uma cura. A edição de gene, junto à técnica CRISPR-Cas9, abre uma nova onda de possibilidades na terapia oncogênica com seu baixo custo, eficácia, modernidade e rapidez, mais uma vez sendo a promessa para um futuro sem esta doença tão enigmática12.
5.1 O caso He Jiankui e as controvérsias da edição de gene
Em 26 de novembro de 2018, o biofísico chinês He Jiankui causou inquietação e abalou a comunidade científica internacional com seu vídeo anunciando o nascimento das gêmeas Nana e Lulu, com a ferramenta CRISPR-Cas9. Os primeiros bebês geneticamente modificados, de acordo com Jiankui, nascerem totalmente saudáveis. “Eu sinto uma forte responsabilidade de não só realizar primeiro, mas também de dar um exemplo”, e continuou, “A sociedade decidirá o que fazer a seguir”, disse ele para a Associated Press. Jiankui ou como prefere ser chamado JK, recrutou Casais através de um grupo de defesa da AIDS com sede em Pequim, chamado Baihulain. O líder do grupo explicou que não era incomum pessoas perderem empregos ou encontrem dificuldades em adquirir tratamento médico, uma vez que seu diagnóstico é revelado. A edição de gene ocorreu durante a fertilização in vitro; primeiramente, o esperma foi “lavado” para ser separado do sêmen, os fluidos onde o HIV pode se esconder. Apenas um esperma foi introduzido em um óvulo para criar um embrião e a técnica de edição de gene foi adicionada.
Quando os embriões tinham de três a cinco dias de vida, algumas células foram removidas e checadas para edição. Os Casais tiveram a opção de embriões: 8 editados ou não editados para tentativas de implantação. No total, 16 de 22 embriões foram editados, e 11 foram usados em seis tentativas antes da gravidez das gêmeas ser concretizada, contou o biofísico. “Nós achamos ético”, também comentou Lin Zhitong, um administrador, que está à frente do painel de ética do hospital Harmonia para mulheres e crianças, lugar onde JK buscou e recebeu aprovação para o seu projeto. Os participantes envolvidos no estudo não eram etilistas, disse ele, porém “são como autoridades no que é correto e o que é errado porque é a vida deles em risco”, e completou, “Eu acredito que isso vai ajudar famílias e crianças”, disse ele e acrescentou que no Caso de efeitos colaterais e prejudiciais, sentiria a mesma dor que eles, e que “também seria sua responsabilidade”.
Após o anúncio de He Jiankui ter alarmado o campo científico e a área da saúde, foi discutida a necessidade de leis preventivas vinculadas à bioética para evitar futuros projetos como esse. Uma das cocriadoras, Jennifer Doudna, afirmou que ficou horrorizada com a notícia, estas foram as palavras da pesquisadora para Bloomberg News:
Me sinto profundamente desapontada que a tecnologia foi usada do jeito que ela descreveu, e também um pouco horrorizada e enojada. Muito desapontante que as diretrizes internacionais, que muitas pessoas trabalham duro para estabelecer tenham sido ignoradas. Suas ações, certamente não eram medicamente necessárias, se sua motivação era ser o pioneiro, considero uma razão inapropriada para fazer uma coisa como esta impulsivamente e sem supervisão apropriada. Porque escolher usar uma tecnologia experimental, que nunca foi testada em humanos antes, ao invés de métodos já estabelecidos para evitar a transmissão do HIV, isso é inconcebível para mim. Novos reforços serão feitos para tornar essas diretrizes ainda mais claras, prescritivas e também potencialmente para colocar em prática consequências reais caso haja descumprimento dessas condutas. Como alguém faz algo assim em um cenário internacional? É muito ardiloso13.
Com o avanço da ciência, não se pode deixar de lado as questões éticas e os limites que rodeiam essas grandes inovações, sendo essa uma das principais preocupações dos cientistas hoje14.
6 CONCLUSÃO
Desde a “Eugenia”, em 1883, por Galton, é inegável que ainda há muito a ser feito e estudado em relação à edição de gene e suas técnicas, principalmente quando se trata de um organismo tão complexo quanto o do ser humano.
Entretanto, é impossível negar o que o sistema CRISPR pode fazer pelo tratamento de doenças como o câncer. O caminho a ser percorrido é de extrema complexidade, carregado de incerteza, e, claro, longo. Sendo um procedimento um tanto enigmático, assim como complicado para a grande maioria leiga, o sistema CRISPR tem como grande desafio a aprovação não só do Conselho de Ética Internacional, mas também da sociedade.
É de suma importância a conscientização sobre o assunto, a informação levará a grandes questionamentos e avanços, afinal, é um comprometimento de extrema responsabilidade com a integridade, o bem-estar e o futuro da raça humana. As consequências que se desencadearão no futuro, e os vários questionamentos diante de tal circunstância rodeiam o promissor sistema CRISPR e várias outras técnicas de edição genética.
As pessoas poderão finalmente deixar de olhar o câncer como um sinônimo de mortalidade e com isso uma realidade surge para a humanidade? ou em um futuro frustrado com falsas esperanças, cobrar de quem seria tamanha irresponsabilidade.
REFERÊNCIAS
1- Lang-Stanton P, Jackson S. BCC News. Brasil. Eugenia: como movimento para criar seres humanos ‘melhores’ nos EUA influenciou Hitler. 23 abr. 2017. [acesso em: 21 set. 2022].
Disponível em: https://www.bbc.com/portuguese/internacional-39625619..
2- Sganzerla A, Pessini L. Edição de humanos por meio da técnica do Crispr-Cas9: entusiasmo científico e inquietações éticas. Saúde debate, Rio de Janeiro, v. 44, n. 125, p. 527-539, jul./2020. [acesso em: 21 set. 2022]. Disponível em: https://doi.org/10.1590/0103-1104202012519..
3- Nature. Pioneers of revolutionary CRISPR gene editing win chemistry Nobel. 07 out. 2020. [acesso em: 21 set. 2022]. Disponível em: https://doi.org/10.1038/d41586-020-02765-9...
4- Almeida ASR, Souza CB. Sistema CRISPR-Cas9: uma alternativa terapêutica para neoplasia pulmonar J Bras Patol Med Lab. 2021; 57: 1-9. [acesso em: 19 out. 2022]. Disponível em: <https://www.jbpml.org.br/wp-content/uploads/2022/01/10.59351676- 2444.20210051_PT.pdf.>
5- Kaushik I, Ramachandran S, Srivastava SK. CRISPR-Cas9: A multifaceted therapeutic strategy for cancer treatment. Seminars in Cell & Developmental Biology, United Kingdom, v. 96, n. 96, p. 4-12, dez./2019. [acesso em: 11 nov. 2022]. Disponível em:
https://doi.org/10.1016/j.semcdb.2019.04.018..
6- Lentsch E, Li L, Pfeffer S, Ekici AB, Taher L, Pilarsky C, Grützmann R. CRISPR/Cas9- Mediated Knock-Out of KrasG12D Mutated Pancreatic Cancer Cell Lines. Int. J. Mol. Sci. 2019, 20(22), 5706. [acesso em: 11 nov. 2022]. Disponível em:
https://www.nature.com/articles/s41698-019-0080-7.
7- Tian X, et al. CRISPR/Cas9 – An evolving biological tool kit for cancer biology and oncology. 2019. Npj: precision oncology, USA, v. 3, n. 8, p. 1-8, mar./2019. [acesso em: 24 jan. 2023]. Disponível em: https://www.nature.com/articles/s41698-019-0080-7.
8- Ward LS. Entendendo o processo molecular da tumorigênese. Arq. Bras. Endocrinol. Metab. 46 (4), Ago 2002. [acesso em: 24 jan. 2023]. Disponível em:
https://www.scielo.br/j/abem/a/vNG3zLQKMLsKPG8D8qHnJ3y/abstract/?lang=pt..
9- Bresolin E, Wiethölter P, Kirsten KS. CRISPR: Edição genômica aplicada à Oncologia / CRISPR: Genomic editing applied to Oncology. Brazilian Journal of Development, 7(9), 90908– 90927. [acesso em: 24 jan. 2023]. Disponível em: https://doi.org/10.34117/bjdv7n9-310..
10- Watanabe S, et al. M. TP53 Mutation by CRISPR System Enhances the Malignant Potential of Colon Cancer. Mol Cancer Res 1 July 2019; 17 (7): 1459–1467. [acesso em: 24 jan. 2023].
Disponível em: https://doi.org/10.1158/1541-7786.MCR-18-1195..
11-Jiang C, Lin X, Zhao Z. Applications of CRISPR/Cas9 technology in the treatment of lung cancer. 2019. Trends in Molecular Medicine, Oxford, v. 25, n. 11, p. 1039-1049, ago./2019. [acesso em: 27 jan. 2023]. Disponível em: <https://www.cell.com/trends/molecular- medicine/fulltext/S1471-4914(19)30184- 4?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS147149141 9301844%3Fshowall%3Dtrue.>.
12- Zhao R, et al. CRISPR/Cas9-Mediated BRCA1 Knockdown Adipose Stem Cells Promote Breast Cancer Progression. Plastic and Reconstructive Surgery 143(3): p 747-756, March 2019. [acesso em: 9 nov. 2023]. Disponível em:<https://journals.lww.com/plasreconsurg/Abstract/2019/03000/CRISPR_Cas9_Mediated_BRCA 1_Knockdown_Adipose_Stem.17.aspx.>.
13-Thermal. CRISPR Co-Inventor ‘Disgusted’. 28 nov. 2018. [acesso em: 5 mar. 2022].
Disponível em: https://www.thermalpr.com/news/crispr-co-inventor-disgusted/..
14-Associated Press. Chinese researcher claims first gene-edited babies. 26 nov. 2018. [acesso em: 10 maio 2023]. Disponível em:<https://apnews.com/article/ap-top-news-international-news- ca-state-wire-genetic-frontiers-health-4997bb7aa36c45449b488e19ac83e86d.>.
