EFFICACY OF PRETOMANID IN PATIENTS WITH MULTIDRUG-RESISTANT PULMONARY TUBERCULOSIS, A NARRATIVE REVIEW
REGISTRO DOI: 10.69849/revistaft/fa10202505181603
Natália Costa Braga¹
Orientadora: Maria Helena Durães Alves Monteiro²
RESUMO
A tuberculose (TB) continua a ser uma das principais causas de morte por doenças infecciosas por um único agente infeccioso em todo o mundo. A tuberculose suscetível a medicamentos e, principalmente, a tuberculose resistente a medicamentos, incluindo a multirresistente (MDR), representa um desafio significativo para a saúde pública e a necessidade urgente de novas estratégias de tratamento. O objetivo do estudo foi revisar o papel da pretomanida no tratamento da tuberculose pulmonar em pacientes infectados por bactéria multidroga resistentes, através de uma revisão narrativa. A busca de referências da pesquisa de caráter qualitativo foi feita nas bases PubMed e BVS. A Pretomanida (PA), surge como um importante avanço, sendo derivado do nitroimidazol, com potente atividade bactericida e bacteriostática, bicíclico oral. O fármaco demonstra menor incidências de efeitos adversos, toxicidade hepática reduzida, boa absorção tecidual, encurtamento do tempo de tratamento em pacientes com tuberculose pulmonar multidroga resistente. A pesquisa contínua e o desenvolvimento de novos tratamentos são essenciais para alcançar o controle global da tuberculose e reduzir o sofrimento causado por essa doença.
Palavras-chave: Tuberculose; Pretomanida; Multidroga resistente
ABSTRACT
Tuberculosis (TB) remains one of the leading causes of death from infectious diseases caused by a single infectious agent worldwide. Drug-susceptible tuberculosis, and especially drug-resistant tuberculosis, including multidrug-resistant (MDR), represents a significant public health challenge and an urgent need for new treatment strategies. The aim of the study was to review the role of pretomanid in the treatment of pulmonary tuberculosis in patients infected with multidrug-resistant bacteria, through a narrative review. The search for references in this qualitative study was carried out in PubMed and BVS. Pretomanid (PA) is an important advance, being derived from nitroimidazole, with potent bactericidal and bacteriostatic activity, oral bicyclic. The drug demonstrates lower incidence of adverse effects, reduced liver toxicity, good tissue absorption, and shortening of treatment time in patients with multidrug-resistant pulmonary tuberculosis. Continued research and the development of new treatments are essential to achieve global control of tuberculosis and reduce the suffering caused by this disease.
Keywords: Tuberculosis, Pretomanid; drug-resistant
INTRODUÇÃO
A tuberculose (TB) continua representando um desafio significativo para a saúde pública global. A Organização Mundial da Saúde (OMS) reconhece a gravidade dessa enfermidade, destacando a necessidade urgente de novas estratégias de prevenção, diagnóstico e tratamento (1).
Tanto a tuberculose suscetível quanto a resistente aos medicamentos convencionais ameaçam os avanços no controle da doença, exigindo regimes terapêuticos mais longos, complexos e, por vezes, menos eficazes (2). A forma resistente da TB caracteriza-se pela não resposta clínica aos antibióticos de primeira linha-isoniazida, rifampicina, pirazinamida e etambutol (3).
A tuberculose multirresistente (TB-MDR) é definida pela resistência à isoniazida e rifampicina, enquanto a tuberculose extensivamente resistente (TB-XDR) apresente resistência à isoniazida, rifampicina, qualquer fluoroquinolona e a pelo menos um medicamento injetável (amicacina, capreomicina ou canamicina) (3). Os pacientes acometidos por altamente resistentes da TB têm opções limitadas (3). O tratamento padrão além de extenso, envolve alta carga de comprimidos, custo elevado, efeitos adversos significativos e taxas consideráveis de desfechos desfavoráveis (4). O surgimento de cepas resistentes à rifampicina e à isoniazida, principais fármacos de primeira linha, tem gerado grande preocupação na comunidade científica (4).
No Brasil, a TB permanece com um grave problema de saúde pública. A baixa adesão ao tratamento e a perda de seguimento dos pacientes são fatores críticos que contribuem para a persistência da infecção e para o desenvolvimento da resistência medicamentosa. Nesse contexto, regimes terapêuticos mais curtos têm potencial para melhorar a adesão dos pacientes, reduzir os custos do tratamento e aumentar as taxas de cura(5).
Diante da necessidade de novas abordagens terapêuticas, a pretomanida (PA), surge como um importante avanço. Aprovada em 2019 pela Food and Drug Administration (FDA) dos EUA, a pretomanida é um fármaco derivado do nitroimidazol, com atividade bactericida e bacteriostática contra micobactérias em replicação e estado latente. O perfil de eficácia e tolerabilidade tem se mostrado promissor em estudos clínicos. Trata-se de um composto nitroimidazooxazínico bicíclico, administrado por via oral, o que favorece a adesão ao tratamento (6).
A pretomanida apresenta alta lipofilicidade e baixa solubilidade, características que favorecem sua difusão nas membranas lipídicas. A administração do fármaco com alimentos, especialmente refeições ricas em gorduras e calorias, aumenta sua solubilidade e absorção gastrointestinal(7). Em relação às microbactérias em replicação, a pretomanida inibe a produção de ácido micólico, componente essencial da parede celular bacteriana (8,9,10). Existem três classes de ácidos micólicos α-micolatos, metoximicolatos e cetomicolatos, sendo esta última a principal alvo da pretomanida. A inibição da síntese desses ácidos compromete a integridade da parede celular, tornando a bactéria mais suscetível à ação de outros fármacos(8). No caso das microbactérias em estado latente, não replicantes, a pretomanida atua por meio da geração de óxido nítrico reativo, que resulta na liberação de espécies reativas de nitrogênio a partir dos metabólitos desnitro(9). Esse processo leva à diminuição dos níveis de ATP, inibição da respiração celular e consequente ação bactericida. Entretanto, para que essas ações sejam efetivas, a pretomanida precisa ser ativada pela enzima nitrorredutase dependente de deazaflavina presente no Mycobacterium tuberculosis(8,9,10).
Em 2023, a Comissão Nacional de Incorporação de Tecnologias no SUS (Conitec) aprovou a inclusão da pretomanida na lista de medicamentos ofertados pelo Sistema Único de Saúde (SUS) para o tratamento da TB no Brasil. Com isso, foram introduzidos dois novos esquemas terapêuticos: o BPaL (bedaquilina, pretomanida e linezolida) e o BPaLM (bedaquilina, pretomanida, linezolida e moxifloxacino), com a perspectiva de reduzir o tempo de tratamento da tuberculose multirresistente (TB MDR)(11).
Esta pesquisa busca contribuir, por meio de uma análise teórico, para compreensão das novas abordagens terapêuticas com potencial de eficácia e redução no tempo de tratamento para o enfrentamento da TB no Brasil. O presente trabalho tem como objetivo realizar uma revisão da literatura científica sobre a eficácia da pretomanida no tratamento da tuberculose pulmonar causada por cepas multirresistentes, avaliando seus efeitos terapêuticos, limitações e impacto sobre a adesão ao tratamento.
METODOLOGIA
Para tanto foi realizado uma revisão narrativa da literatura, com objetivo de responder à pergunta norteadora sobre à eficácia da pretomanida no tratamento da tuberculose pulmonar causada por cepas multidroga resistentes. A pesquisa possui caráter qualitativo e foi conduzido por meio da consulta a bases de dados científicos indexados National Library of Medicine (PubMed) e Biblioteca Virtual em Saúde ((BVS).
A seleção dos artigos utilizou os Descritores em Ciências da Saúde (DeCS), bem como busca manual. Os termos utilizados para a busca foram: “tuberculosis”, “pretomanid”, “multidrug resistente”, “tuberculose resistente a múltiplos medicamentos”, “pretomanida”. Esses descritores foram combinados usando os operadores booleanos “AND” e “E”, conforme os seguintes agrupamentoss: “tuberculosis and pretomanid”, “multidrug resistente tuberculosis and pretomanid”, “tuberculose resistente a múltiplos medicamentos e pretomanida”.
Como critério de inclusão, foram considerados artigos publicados nos idiomas inglês e português, disponíveis na íntegra, que abordassem a temática proposta. Foram incluídos estudos publicados nos últimos 10 anos, classificados como revisões sistemáticas, ensaios clínicos randomizados controlados e meta-análises.
Os critérios de exclusão adotados foram: teses, monografias, dissertações e/ou cartas ao editor, ensaios clínicos, artigos duplicados ou que não apresentassem relação direta com o objetivo desta revisão. Por fim, os artigos selecionados foram analisados criticamente, considerando seu grau de relevância, qualidade metodológica e contribuição para entendimento da eficácia da pretomanida no tratamento da tuberculose multirresistente.
RESULTADOS E DISCUSSÃO
A busca bibliográfica resultou em um total de 1.251 artigos, sendo 654 na base de dados PUBMED e 596 artigos no BVS. Os critérios de inclusão aplicados foram artigos publicados entre 2015 e 2025, reduzindo o número para 1.142 artigos. Em seguida, foram selecionados artigos disponíveis na íntegra e nos idiomas português e inglês, resultando em 922 artigos. Foram incluídas revisões sistemáticas, ensaios clínicos randomizados controlados e meta-análise, restando 86 artigos para uma análise mais detalhada. Após aplicação dos critérios de exclusões foram selecionados 4 artigos para a revisão, conforme apresentado na Figura 1.
Figura 1: Fluxograma de seleção dos artigos identificados nas bases do PUBMED e do BVS para a revisão narrativa
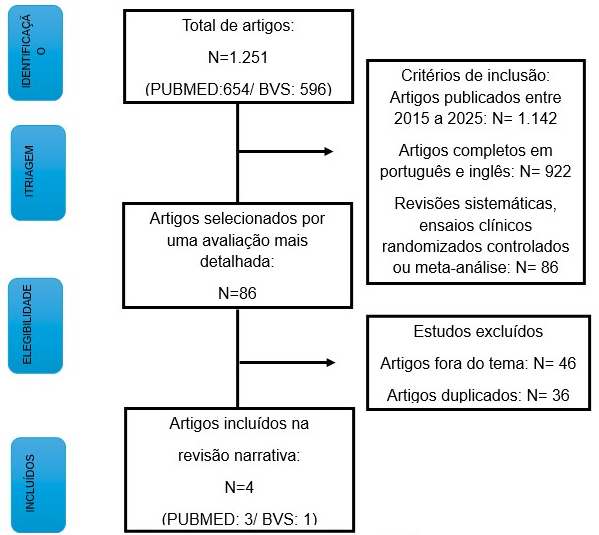
Nesta revisão narrativa foram analisados três ensaios clínicos randomizados que atenderam aos critérios de inclusão estabelecidos (ver Tabela 1) e uma revisão sistemática (ver Tabela 2), todos com foco em esquemas terapêuticos orais contendo pretomanida no tratamento da tuberculose resistente à rifampicina (TB-RR) e tuberculose multirresistente (TB-MDR).
O estudo conduzido por Conradie et al. (2022)(12), avaliou a eficácia e segurança do regime BPaL, composto por bedaquilina, pretomanida e linezolida (BPaL). O esquema terapêutico foi inteiramente oral, com a seguinte posologia: bedaquilina 200 mg por oito semanas, seguida de 100 mg ao dia por dezoito semanas); pretomanida 200 mg/ dia por vinte e seis semanas e linezolida em diferentes regimes de doses 1200 mg ou 600 mg ao dia por nove ou vinte e seis semanas(12).
Os resultados demonstraram eficácia entre 84 e 93% na população com intenção de tratar modificada, que exclui participantes perdidos no seguimento após tratamento bem-sucedido ou óbitos não relacionados à tuberculose. Eventos adversos ocorreram em 86,2% (156 de 181), sendo graves em 6,1% (11 de 181). A pretomanida demostrou menor potencial de indução de resistência em comparação com os demais fármacos. No entanto, o estudo foi parcialmente descontinuado devido à toxicidade da linezolida, que frequentemente resultou em neuropatia periférica e mielossupressão, especialmente em doses elevadas e em tratamentos prolongados. Regimes com doses mais baixas de linezolida apresentaram menor toxicidade e perfil de risco-benefício mais favorável. Entre as limitações do estudo estão o tamanho amostral reduzido, que limita a precisão de qualquer estimativa do efeito do tratamento; a ausência de um grupo controle com tratamento padrão e a necessidade de mais dados sobre manejo dos efeitos adversos(12).
O outro estudo de Nyang’wa et al. (2022)(13), comparou regimes orais contendo BPaL (bedaquilina, pretomanida e linezolida) com o tratamento padrão para pacientes TB resistente à rifampicina, incluindo variantes com clofazimina (BPaLC) ou moxifloxacina (BPaLM). O ensaio foi dividido em duas fases. Fase 1 objetivou identificar regimes promissores com base na segurança e eficácia em oito semanas com BPaL. A fase 2 avaliou a eficácia e segurança de um regime de vinte e quatro semanas de tratamento com o regime BPaLM pacientes com tuberculose resistente à rifampicina(13).
O esquema BPaLM demonstrou eficácia e segurança significativas, mostrando superioridade ao tratamento padrão. As dosagens utilizadas no estudo foram as seguintes: no esquema BPaL, a bedaquilina administrada na dose de 400 mg por dia durante duas primeiras semanas, seguida de 200 mg três vezes por vinte e duas semanas; a pretomanida foi administrada na dose de 200 mg por dia durante por vinte e quatro semanas; e a linezolida foi utilizada na dose de 600 mg por dia durante dezesseis semanas, seguida de 300 mg por dia por mais 8 semanas. O esquema BPaLM seguiu o mesmo regime do BPaL, a adição da moxifloxacina na dose de 400 mg por dia durante vinte e quatro semanas(13).
Em comparação com o tratamento padrão, o regime BPaL reduziu o risco de eventos adversos que levariam à descontinuação terapêutica. O regime BPaLM apresentou menor taxa de falhas terapêuticas, recorrências e resistência emergente aos medicamentos, mantendo perfis semelhantes de eventos adversos em relação aos demais regimes experimentais. As proporções de pacientes com desfechos favoráveis foram maiores nos grupos BPaLC (81%) e BPaL (77%) do que no grupo de tratamento padrão, sendo essa diferença atribuída, principalmente, à descontinuação precoce do tratamento convencional devido a eventos adversos. A presente revisão optou por analisar a população com intenção de tratar modificada, que inclui pacientes randomizados que receberam pelo menos uma dose do medicamento em estudo e excluiu aqueles sem confirmação microbiológica de tuberculose resistente à rifampicina (TB-RR). Os desfechos desfavoráveis considerados foram: óbito, falha terapêutica, interrupção do tratamento, perda de seguimento, recorrência e ocorrência de eventos adversos. Os eventos adversos observados incluíram disfunção hepática, pancreatite, prolongamento do intervalo QTc (≥ grau 3), arritmias cardíacas (≥ grau 3), neuropatia periférica (≥ grau 3), convulsão/desmaio, catarata. Os de grau 4 incluíram anemia, neutropenia, hipercalcemia. Na fase 2 do estudo, 21% dos participantes do grupo padrão apresentaram eventos adversos, em contraste com apenas 7% no grupo BPaLM evidenciando um melhor perfil de segurança para os regimes contendo pretomanida(13).
Após setenta e duas semanas de acompanhamento, 59% pacientes do grupo de tratamento padrão apresentaram eventos adversos, enquanto no grupo BPaLM esse índice foi de apenas 19%. O regime BPaLM demonstrou ser mais favorável em relação ao tratamento padrão, considerando os desfechos desfavoráveis (uma combinação de óbito, falha terapêutica, descontinuação do tratamento, perda de acompanhamento ou recorrência da tuberculose)(13).
As principais limitações do estudo incluíram a ausência de cegamento, perdas amostrais superiores ou iguais a 20%, ausência de análise de intenção de tratar completa, falta de cálculo amostral formal e interrupção precoce do ensaio. Este último foi encerrado antecipadamente por recomendação de um comitê independente de monitoramento de dados e segurança(13).
A revisão sistemática de Silva et al. (2024) também analisou este estudo, concluindo que o regime terapêutico BPaLM reduziu o risco de desfechos desfavoráveis (composto por: morte, falha do tratamento, descontinuação precoce do tratamento, perda de acompanhamento ou recorrência) e taxas menores de eventos adversos em comparação ao tratamento padrão(14).
O terceiro artigo que compõe esta revisão é uma continuidade do ensaio clínico anterior do TB-PRACTECAL (2022)(13), com transição de um estudo de fase 2B (estágio 1) para um ensaio de fase 3 (estágio 2). Esse ensaio clínico randomizado, controlado, aberto, multicêntrico de Nyang’wa et al. (2024)(15) avaliou a eficácia e segurança de regimes de tratamento oral para tuberculose resistente à rifampicina (TB-RR) em comparação com o regime padrão de tratamento mais longo no período de vinte e quatro meses. Participaram do estudo, adolescentes a adultos, de ambos os sexos, de três países diferentes, incluindo participantes com coinfecção por HIV e doença grave resistente à rifampicina, com e sem resistência à fluoroquinolona(15).
Na fase 2, o desfecho primário foi composto por eventos desfavoráveis como morte, falha terapêutica, descontinuação do tratamento, recorrência da tuberculose ou perda de seguimento em até setenta e duas semanas após a randomização. A população com intenção de tratar modificada foi utilizada para análise, incluindo apenas os participantes que receberam pelo menos uma dose do regime experimental e com confirmação de resistência a pelo menos rifampicina. Os regimes testados foram: BPaLM (bedaquilina, pretomanida, linezolida e moxifloxacino, BPaLC (bedaquilina, pretomanida, linezolida e clofazimina), BPaL (bedaquilina, pretomanida e linezolida), e o tratamento padrão. A análise de segurança inclui a ocorrência de eventos adversos graves ou de grau maior ou igual a 3 ao final do tratamento de setenta e duas semanas e cento e oito semanas após a randomização (desfechos desfavoráveis eram compostos por morte, falha do tratamento, descontinuação do tratamento, recorrência da tuberculose ou perda de seguimento do tratamento), bem como prolongamento do intervalo QTcF em vinte e quatro semanas após a randomização(15).
Os grupos BPaLM, BPaLC e BPaL apresentaram taxas inferiores de eventos adversos graves e eventos adversos de pelo menos grau 3 quando comparados ao grupo controle (tratamento padrão). O período de setenta e duas semanas, o grupo com tratamento padrão apresentou 17% de eventos adversos, enquanto os demais regimes experimentais registraram 5% na população com intenção de tratar modificada. Em cento e oito semanas, a taxa de desfechos desfavoráveis foram 46,7% no grupo controle, 13,9% no grupo BPaLM, 24,4% no grupo BPaLC e 21,6% no grupo BPaL. A maior duração do tratamento padrão esteve associada à maior incidência de eventos adversos.O grupo BPaLM também apresentou maior taxa de conversão de cultura negativa em 12 semanas (89,2%). Diante desses resultados, os grupos BPaLM e o tratamento padrão foram selecionados para continuidade no estágio dois do ensaio (15).
O regime BPaLM totalmente oral e com duração de vinte e quatro semanas, demonstrou ser seguro e eficaz no tratamento da tuberculose pulmonar resistente à rifampicina, sendo incorporado às diretrizes da Organização Mundial de Saúde (OMS) em 2022. O estudo concluiu que o regime BPaLM deve ser considerado a primeira opção terapêutica para adolescentes e adultos com tuberculose pulmonar resistente à rifampicina (15).
Diversas combinações medicamentosas contendo pretomanida têm sido avaliados. Os estudos avaliados demonstraram que a pretomanida não foi inferior ao regime padrão com isoniazida, rifampicina, pirazinamida e etambutol. Além disso, a pretomanida apresentou toxicidade hepática reduzida e possibilitou encurtamento do tempo de tratamento. Observa-se que a incidência de eventos adversos tende a aumentar com a duração da terapia, o que reforça a relevância de regimes encurtados para melhor adesão dos pacientes ao tratamento para TB. Contudo, são necessários novos estudos para aprofundar a avaliação da segurança a longo prazo e do potencial de desenvolvimento de resistência à pretomanida.
Essa revisão também analisou uma revisão sistemática conduzida por Gils et al. 2022 (16), que avaliou o efeito bactericida e esterilizante da pretomanida, considerando seu uso isolado ou em combinação com outros fármacos. Foram analisados oito estudos, incluindo quatro ensaios clínicos com foco na atividade bactericida precoce (early bactericidal activity-EBA) em pacientes com tuberculose suscetível à rifampicina; três ensaios com braços randomizados em tuberculose suscetível e braço único em tuberculose resistente à rifampicina (dois avaliando EBA em 8 semanas, e um com desfechos de fim de tratamento), além de um ensaio de braço único com avaliação de desfechos terapêuticos em casos com tuberculose altamente resistente(16).
Os autores destacam que a pretomanida apresenta atividade bactericida precoce significativa, especialmente quando combinada com moxifloxacino e pirazinamida. Os regimes terapêuticos contendo pretomanida demonstram altas taxas de sucesso no tratamento de pacientes com tuberculose resistente à rifampicina e estreptomicina. A revisão analisou a atividade bactericida precoce (EBA), a alta atividade bactericida precoce (EBA) é importante para prevenir a resistência aos medicamentos principais. O regime Pa-Z (pretomanida e pirazinamida) apresentou EBA superior à pretomanida isolada, e o regime Pa-M-Z (pretomanida, moxifloxacino e pirazinamida) mostrou resultados ainda melhores(16).
Comparativamente, o regime PA-M-Z demonstrou atividade bactericida precoce superior ao regime padrão RHZE (isoniazida, rifampicina, pirazinamida, etambutol) nas duas primeiras semanas quanto após oito semanas de tratamento. A atividade do esquema Pa-M-Z foi superior ao tratamento padrão, o regime RHZE (isoniazida, rifampicina, pirazinamida, etambutol) nas primeiras 2 semanas e em 8 semanas. A dosagem de pretomanida utilizada foi 200mg ao dia(16).
Um dos estudos foi interrompido precocemente devido à ocorrência de eventos adversos hepatotóxicos graves, incluindo três óbitos (4% dos pacientes), no grupo tratado com regime Pa-M-Z. Apesar disso, pacientes com tuberculose resistente à rifampicina e sem complicações adicionais, o regime Pa-M-Z, resultou em desfecho favorável em 91% dos casos. Em pacientes com tuberculose altamente resistente, 90% dos que foram tratados com o regime pretomanida-bedaquilina-linezolida apresentaram desfechos terapêuticos positivos seis meses após o término do tratamento, embora a toxicidade associada à linezolida tenha sido frequente. Não foi relatada resistência adquirida à pretomanida(16).
Nos casos de tuberculose suscetível à rifampicina, a combinação de pretomanida e bedaquilina teve sua eficácia aumentada com a adição da pirazinamida. Contudo, a toxicidade da linezolida, levou à interrupção do tratamento em 66% dos pacientes. Importante destacar que, até o momento não foi identificada resistência adquirida à pretomanida(16).
Dois estudos incluídos na revisão apresentaram dados de desfechos final do tratamento, os regimes terapêuticos contendo pretomanida tiveram resultados favoráveis nos pacientes com resistência à rifampicina em 91–92% (tabela 2). No primeiro, publicado em 2020, os pacientes apresentaram resolução clínica da doença e cultura negativa após seis meses do término do tratamento, mas o estudo não apresentava grupo controle randomizado. No segundo estudo, um ensaio clínico parcialmente randomizado publicados em 2021, a negativação da cultura foi observada após doze meses, com pelo menos duas culturas negativas subsequente a uma positiva(16).
Entre as limitações desta revisão, destaca-se os estudos serem parcialmente ou não randomizados, ausência de uma meta-análise para síntese quantitativa dos dados. Além disso, não foi possível determinar se a pretomanida pode atuar como um fármaco central do regime terapêutico, com elevada capacidade bactericida e esterilizante, ou se sua função está mais relacionada à proteção de medicamentos contra resistência adquirida.
CONCLUSÃO
A tuberculose permanece um dos principais desafios de saúde pública em escala global. Contudo, a introdução de novos fármacos como a pretomanida representa um avanço promissor, especialmente no enfretamento das formas resistentes da doença. Os estudos analisados demonstraram que, quando associada a outros medicamentos, a pretomanida pode compor esquemas terapêuticos eficazes, mais curtos e com menores taxas de eventos adversos em comparação ao tratamento padrão. Esses regimes ofereceram uma alternativa terapêutica crucial para pacientes com tuberculose multirresistente, ampliando as possibilidades de cura e contribuindo para a contenção da transmissão.
No entanto, a incorporação dessas inovações no sistema de saúde requer investimentos em infraestrutura, capacitação de profissionais e estratégias logísticas eficazes, assegurando que os medicamentos estejam disponíveis de forma equitativa em todo território nacional. A simples existência de tratamentos eficazes não é suficiente se o acesso for restrito ou desigual.
Além do enfrentamento farmacológico, o controle da tuberculose exige uma abordagem abrangente, que inclua os determinantes sociais da saúde. Fatores como pobreza, insegurança alimentar, habitação inadequada e acesso limitado à educação e aos serviços de saúde são determinantes críticos na propagação e persistência da doença. Nesse sentido, políticas públicas intersetoriais, com foco na redução das desigualdades sociais e no fortalecimento dos sistemas de vigilância e atenção básica de saúde, são essenciais para a erradicação da tuberculose.
Portanto, o combate à tuberculose deve ir além da prescrição de medicamentos, integrando estratégias clínica, sociais e políticas para produzir um impacto duradouro e equitativo na saúde das populações mais vulneráveis.
Tabela 1: Caracterização dos ensaios clínicos selecionados que investigaram eficácia terapêuticas dos regimes contendo pretomanida para pacientes com TB-XDR, RR.
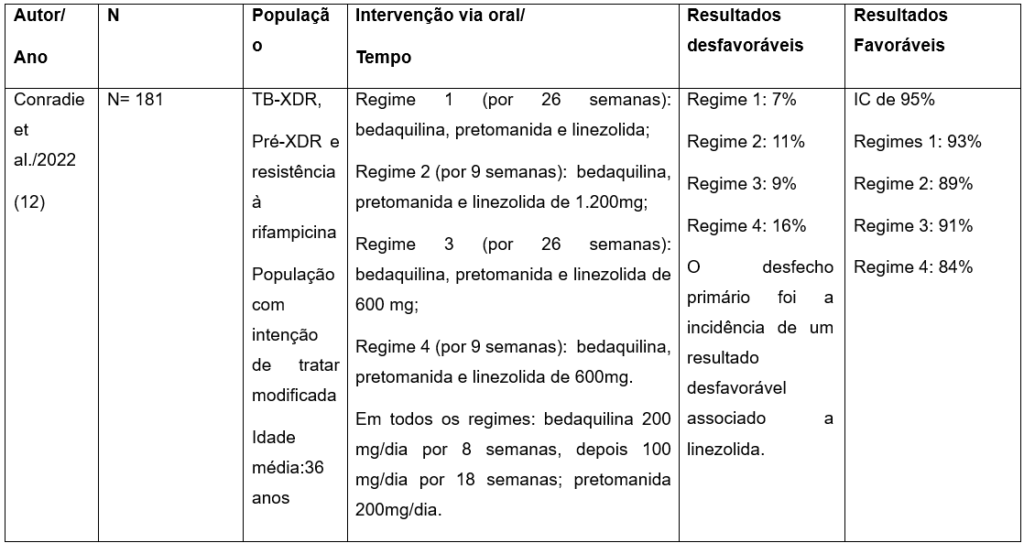
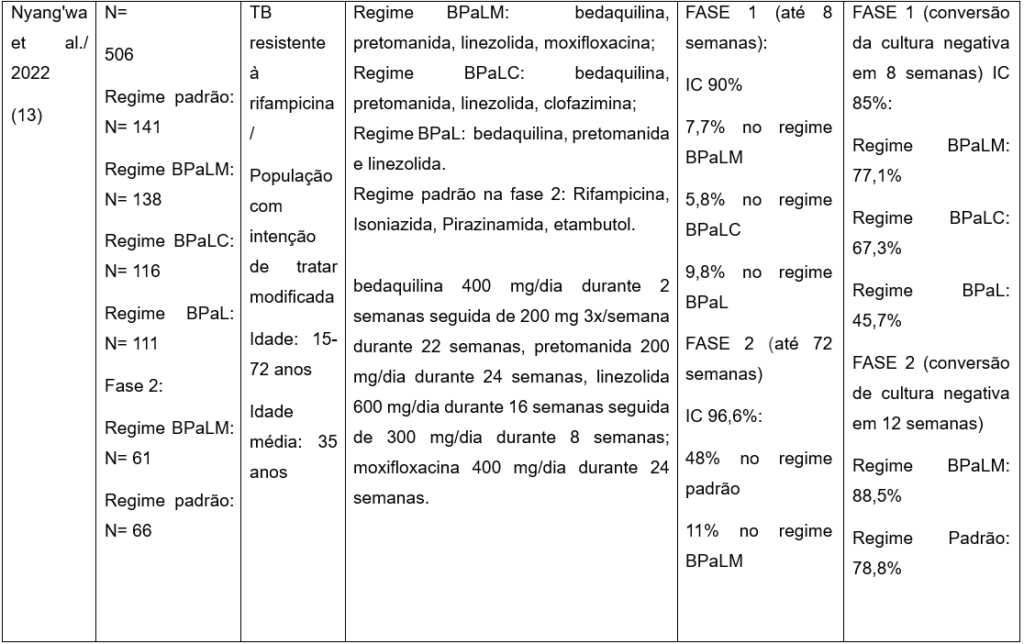
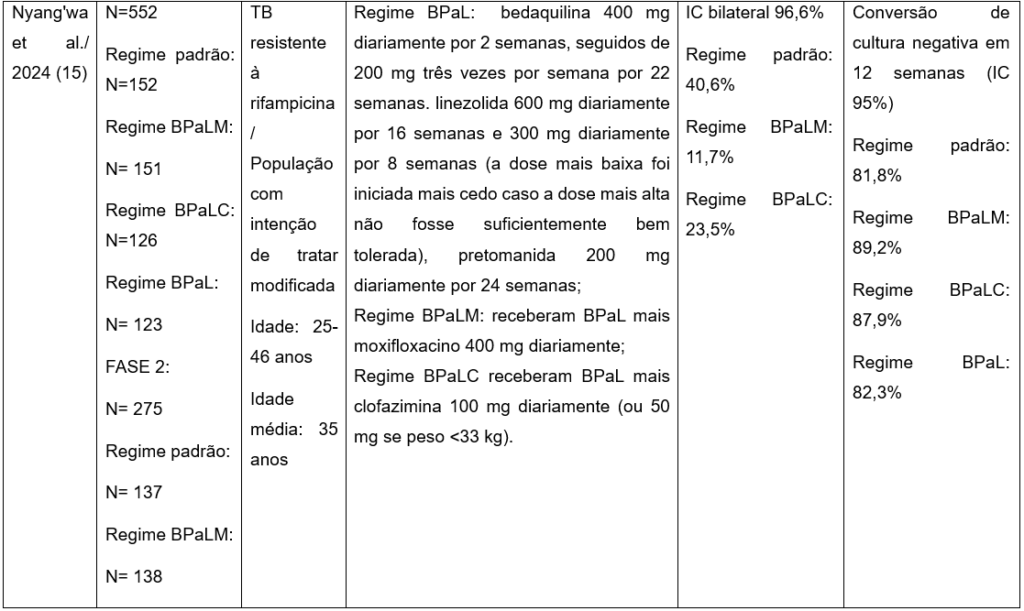
N: número de participantes; TB: tuberculose; XDR: droga extensivamente resistente; IC: intervalo de confiança
Tabela 2: Eficácia do tratamento contendo pretomanida
| Pacientes com tuberculose resistente à rifampicina | Esquema terapêutico | Resultados favoráveis do tratamento % (IC 95%) |
| Estudo 1, 2020 | Pretomanida, bedaquilina, linezolida | 92% (85,5-96,7) Cultura negativa 6 meses após tratamento |
| Estudo 2, 2021 | Pretomanida, moxifloxacino, pirazinamida | 91% (59-100) Cultura negativa 12 meses após randomização com mínimo duas culturas negativas após a positividade |
REFERÊNCIAS
1. World Health Organization. Global tuberculosis report 2019. Geneva: World Health Organization. Licence: CC BY-NC-SA 3.0 IGO; 2019.
2. Pattemore PK, Jennings LC. Chapter 31- Epidemiology of respiratory infections. Pediatric Respiratory Medicine. Part Drug-resistant tuberculosis. Mosby. 2 ed, p. 435-452; 2008.
3. Conradie F, Diacon AH, Ngubane N, Howell P, Everitt D, Crook AM, et al. Treatment of highly drug-resistant pulmonary tuberculosis. New England Journal of Medicine, v. 382 (10), p. 893-902; 2020.
4. World Health Organization. WHO consolidated guidelines on tuberculosis. Module 4: treatment – drug-resistant tuberculosis treatment. Geneva: World Health Organization; update 2022. Licence: CC BY-NC-SA 3.0 IGO. Disponível em: https://iris.who.int/bitstream/handle/10665/365308/9789240063129-eng. pdf? sequence=1. Acesso em 8 de abril de 2024.
5. Silva DR, Mello FC, Centis R, Dalcolmo MP, Migliori GB. Diagnóstico da tuberculose: documento de consenso da Sociedade Brasileira de Pneumologia e Tisiologia. J Bras Pneumol; v. 47(2):20210054–20210054. 2021.
6. U.S. Food and Drug Administration. Center for Drug Evaluation and Research: application number 212862Orig1s000. Disponível em: https: //www.accessdata.fda.gov/drugsatfda_docs/nda/2019/212862Orig1s000Lbl.pdf. Acesso em 8 de abril de 2024.
7. Simanjuntak AM, Daenansya R, Aflandhanti PM, Yovi I, Suvanto S, Anggraini D, et al. Efficacy of pretomanid-containing regiments for drug-resistant tuberculosis: A systematic review and meta-analysis of clinical trials. Narra J, v.3 (3); 2023.
8. Deb U, Biswas S. Pretomanid: The latest USFDA-approved anti-tuberculosis drug. Indian Journal of Tuberculosis, v. 68(2): p. 287-291; 2021.
9. Singh R, Manjunatha U, Boshoff HI, Ha YH, Niyomrattanakit P, Ledwidge R, et al. PA-824 kills nonreplicating Mycobacterium tuberculosis by intracellular NO release. Science, v. 322 (5906): p.1392–95; 2008.
10. Tyagi S, Nuermberger E, Yoshimatsu T, Williams K, Rosenthal I, Lounis N, et al. Bactericidal activity of the nitroimidazopyran PA-824 in a murine model of tuberculosis. Antimicrobial agents and chemother, v. 49 (6): p.2289–93; 2005.
11. Brasil. SUS incorpora medicamento que reduz em 70% o tempo de tratamento da tuberculose resistente. Brasília-DF. Ministério da Saúde, set. de 2023.
12. Conradie F, Bagdasaryan TR, Borisov S, Howell P, Mikiashvili L, Ngubane N, et al. Bedaquiline–Pretomanid–Linezolid Regimens for Drug-Resistant Tuberculosis. N Engl J Med, v.387 (9), p. 810-823; 2022.
13. Nyang’wa BT, Berry C, Kazounis E, Motta I, Parpieva N, Tigay Z, et al. A 24-Week, All-Oral Regimen for Rifampin-Resistant Tuberculosis. N Engl J Med, v. 387(25), p. 2331-2343; 2022.
14. Silva DR, Fernandes FF, Ferreira JC, Bernardo W, Dalcolmo NP, Johansen FDC, et al. Bedaquiline, pretomanid, linezolid, and moxifloxacin (BPaLM) for multidrug or rifampin-resistant tuberculosis: a systematic review. J Bras Pneumol, v.50(6). 2024.
15. Nyang’wa BT, Berry C, Kazounis E, Motta I, Parpieva N, Tigay Z, et al. Short oral regimens for pulmonary rifampicin-resistant tuberculosis (TB-PRACTECAL): an open-label, randomised, controlled, phase 2B-3, multi-arm, multicentre, non-inferiority trial. Lancet Respiratory Medicine, v.12(2), p. 117-128; 2024.
16. Gils T, Lynen L, de Jong BC, Van Deun A, Decroo T. Pretomanid for tuberculosis: a systematic review. Clin Microbiol Infect., v.28 (1), p31-42; 2022.
¹Acadêmica. Universidade do Grande Rio Afya- Duque de Caxias-RJ, Brasil.
²Orientadora. Universidade do Grande Rio Afya- Duque de Caxias-RJ, Brasil.
