EFFICACY AND SAFETY OF SEMAGLUTIDE IN THE TREATMENT OF OBESITY: AN INTEGRATIVE REVIEW
REGISTRO DOI: 10.69849/revistaft/dt10202505172020
Adelina Feitosa Nogueira Moreira1; Cibelle Aparecida Felix Gonçalves1; Adrielly Regina Dantas Gomes1; Clarice da Silva Costa1; Nayron Micael da Silva Santos1; Iana Bantim Felício Calou2
RESUMO
A obesidade é uma enfermidade complexa e multifatorial. Seu tratamento tem como base mudanças no estilo de vida, através de uma alimentação equilibrada e da prática regular de atividades físicas. Entretanto, esse é um processo longo, gradual e de difícil adesão e com taxas de reganho de peso consideráveis. Diante desse cenário, a busca por tratamentos farmacológicos eficazes e duradouros é incessante. Nas últimas décadas as incretinas ganharam destaque no tratamento para diabetes tipo dois e, mais recentemente, no tratamento da obesidade e do sobrepeso associado a fatores de risco. A semaglutida um agonista do receptor do GLP-1 (peptídeo semelhante ao glucagon 1), atua estimulando a liberação de insulina e inibindo a liberação de glucagon, além de reduzir a velocidade do esvaziamento gástrico, o que promove maior sensação de saciedade, levando a uma redução significativa do apetite com consequente perda de peso. Como todo medicamento, pode causar efeitos adversos, principalmente no início do tratamento, como sintomas gastrointestinais, considerados leves a médios e passageiros. Esta revisão integrativa, visa discutir a eficácia, segurança e perspectivas do uso da semaglutida na obesidade. Ensaios clínicos aqui apresentados demonstraram perda significativa de peso, com boa tolerância e efeitos adversos leves e transitórios. Sendo considerada uma terapia eficaz não só na perda de peso, mas também trazendo benefícios cardiovasculares, físicos e metabólicos. Apesar de sua eficácia e boa tolerabilidade, a semaglutida deve ser complementar às abordagens tradicionais.
Palavras-chave: Tratamento. Perda de peso. Semaglutida. Obesidade. Revisão bibliográfica.
1. INTRODUÇÃO
A obesidade é uma doença crônica multifatorial que afeta mais de 650 milhões de pessoas no mundo, tendo sua prevalência triplicada desde 1975 (WHO, 2021) e está associada a complicações físicas e mentais (Ortega, et al., 2016). Sabe-se que perdas de peso de 5% da massa corporal ou mais ajudam a amenizar tais complicações de forma significativa, com perdas maiores resultando em maiores benefícios à saúde. Mudanças no estilo de vida com foco da atividade física e na alimentação balanceada continuam sendo a terapia primária, não obstante perdas de peso duradoura e clinicamente significativa apenas com intervenção no estilo de vida tem sido desafiador (Wadden et al.,2020), uma vez que perdas de peso abaixo do ideal e reganho de peso aconteçam constantemente neste tipo de abordagem (Chao et al., 2021).
Diante deste cenário, os medicamentos utilizados no manejo do peso na obesidade apresentam grande importância e destaque ao ajudarem aqueles pacientes que exibem dificuldades em perderem ou manterem a perda mesmo após mudança dos hábitos de vida. Em média, após um ano de tratamento medicamentoso prescrito como parte de um programa de mudança de estilo de vida, adultos perdem de 3 – 12% mais peso do que os que não fizeram uso de medicação, podendo alcançar perdas superiores a 10% do peso inicial (Yanovski; Yanovski, 2021).
Dentre as opções medicamentosas disponíveis, os agonistas dos receptores GLP-1ª tem ganhado destaque por sua eficácia e segurança. Os agonistas do GLP-1RAs são análogos das incretinas que promovem controle da glicemia através do aumento da secreção de insulina glicose-dependente, aumentando a resistência à insulina, diminuindo o esvaziamento gástrico, inibindo a liberação de glucagon e reduzindo o apetite (Shu et al., 2022).
A semaglutida, representante desta classe , tem sido extensamente utilizada no tratamento do diabetes tipo 2, tendo meia vida de aproximadamente uma semana, seu uso foi aprovado pelo FDA em 2017, sendo utilizada uma administração semanal por dia subcutânea (FDA, 2017). Em Janeiro de 2020 o FDA expandiu a indicação para diabéticos com risco cardiovascular, quando os estudos demonstraram uma redução considerável do risco cardiovascular entre os usuários de semaglutida quando comparados ao placebo (FDA, 2020).
Em 2021 o FDA aprovou a utilização do medicamento no manejo do peso de pacientes obesos ou com sobrepeso. A dose inicial é de 0,25mg, administrados por via subcutânea semanalmente, aumentando a dose a cada 4 semanas até atingir a dose de 2,4mg/semana (Chao et al, 2023).
Este trabalho de revisão tem por objetivo sintetizar informações de estudos clínicos assim como de estudos teóricos e pré-clínicos sobre a efetividade e segurança da semaglutida no manejo do peso em pacientes com obesidade.
2. METODOLOGIA
Esse estudo consiste em uma revisão de literatura do tipo integrativa, sem intenção de esgotar o assunto tendo em vista o caráter recente da liberação da droga para este fim e a observação ativa e constante da fase de farmacovigilância, mas objetivando pôr luz ao que se sabe até o momento sobre a eficácia e segurança da semaglutida no tratamento da obesidade, assim como identificar lacunas existentes nos estudos através da revisão das teorias e das metodologias empregadas.
2.1 Estratégia de busca
Foi realizada ampla busca na literatura em bases de dados eletrônicas. As bases de dados eletrônicas utilizadas para a identificação dos estudos foram: MEDLINE (PubMed), SciELO e CAPES. Os descritores utilizados na busca foram: “SEMAGLUTIDE” AND “OBESITY” AND “CLINICAL TRIALS”. A estratégia de busca elaborada para cada base de dados incluiu termos controlados e não controlados referentes à condição, à intervenção e ao tipo de estudo. A lista de referências dos estudos incluídos e de revisões relevantes foi examinada para identificar possíveis estudos não recuperados nas bases de dados.
2.2 Seleção de estudos
Inicialmente, os registros identificados foram combinados no Excel e, em seguida, os duplicados foram excluídos. Foram considerados duplicados todos os registros que apresentaram o mesmo título, nome do jornal, volume, número de edição e páginas. A seleção de estudos foi realizada em duas fases. Na primeira fase, foi feita a triagem de títulos e resumos das referências restantes. As referências foram codificadas como “potencialmente elegíveis” ou “excluídas” com base nos critérios de inclusão. A segunda fase consistiu na leitura na íntegra de todos os registros codificados como “potencialmente elegíveis” na primeira fase, para confirmação de que atendiam aos critérios de inclusão.
Os estudos foram incluídos nesta revisão se atenderam a todos os seguintes critérios de elegibilidade: (1) Ensaios clínicos controlados randomizados; (2) Todos os indivíduos adultos com um diagnóstico clínico de obesidade usando uma definição clínica bem estabelecida, sem restrições quanto ao ambiente, estágio da doença ou presença de outros problemas médicos; (3) Intervenção experimental com semaglutida isoladamente; (4) O grupo controle adotado foi placebo, outras terapias não medicamentosas ou nenhuma intervenção; (5) Acesso aberto, texto completo.
Os estudos foram excluídos da revisão caso não atendessem aos seguintes critérios: estudos observacionais, de coorte ou não randomizados. Além disso, foram excluídos estudos que envolveram populações que não apresentaram diagnóstico clínico de obesidade e/ou sobrepeso com co-morbidades. Também foram excluídos estudos que não envolveram a semaglutida como intervenção experimental, seja isolada ou em combinação com outras terapias.
2.3 Extração de dados
A extração de dados dos estudos clínicos incluídos foi realizada por uma revisora independente usando um formulário de extração de dados padrão que foi elaborado para uso nesta revisão. As divergências foram resolvidas por consenso ou discussão com um segundo pesquisador. O formulário foi testado antes da execução desta etapa da revisão. Foram extraídos os seguintes dados: (1) Detalhes da publicação; (2) Critérios de elegibilidade do estudo; (3) Detalhes do estudo (por exemplo, objetivo, desenho do estudo, método de randomização, local do estudo, datas de início e término); (4) Características dos participantes (por exemplo, critérios de inclusão e exclusão, número de participantes, idade, sexo, critérios diagnósticos, gravidade, outros problemas médicos, ambiente do estudo); (5) Descrição da intervenção e comparador (por exemplo, dose medicamentosa, duração do tratamento, frequência, número de participantes randomizados para grupos, co-intervenções, intervenção de controle); (6) Dados de resultados (por exemplo, dados numéricos, como médias e desvios-padrão, instrumentos usados para avaliar resultados de interesse, momentos de avaliação de resultados, desistências e motivos para desistência); (7) Dados de reações adversas ou colateralidades da terapia com a semaglutida.
3. RESULTADOS
A pesquisa recuperou 282 registros em bases de dados, desses foram excluídos 42 que estavam duplicados. Após a triagem de títulos e resumos, excluímos 177 registros e obtivemos o texto completo dos 63 registros restantes. Através da leitura do texto completo realizamos a
exclusão adicional de 49 relatórios, por falta de informações necessárias para a pesquisa e incongruência na metodologia. Finalmente, foram incluídos 14 estudos, como demonstrado na figura 1.
Figura 1: Fluxograma
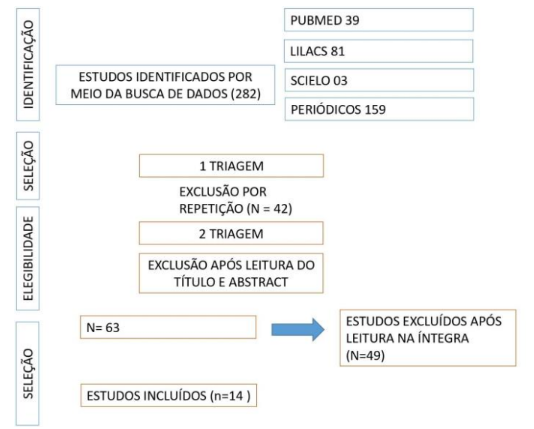
As características dos estudos incluídos estão resumidas na Tabela 1. Os estudos foram publicados entre 2019 e 2024. A idade dos participantes varia entre 18 e 80 anos, com a média sendo de aproximadamente 47 anos. A distribuição de sexo varia entre os estudos. Em alguns, há uma predominância de mulheres, como no Estudo 1, onde 71% dos participantes eram do sexo feminino, e outros com predominância masculina, como no Estudo 3, onde 72,3% eram homens.
O tamanho da amostra varia de estudo para estudo, com alguns estudos incluindo mais de 17.000 participantes (Estudo 3), enquanto outros possuem amostras menores, como o Estudo 8, com 72 participantes. Todos os estudos utilizam administração subcutânea. As doses administradas seguiam um certo padrão entre os estudos, onde foram utilizadas doses variadas, começando de 0,25 mg e aumentando até 2,4 mg por semana, com diferentes combinações (0,25 mg, 0,5 mg, 1 mg, 1,7 mg, e 2,4 mg).
A duração do tratamento variou de 16 a 104 semanas, com a maior parte dos estudos tendo uma duração de 52 a 68 semanas. O Estudo 11 teve duração mais curta, com 16 semanas, enquanto o Estudo 3 teve a maior duração, com 104 semanas de tratamento ativo e mais 104 de observação. O controle dos estudos foi principalmente placebo, mas houve também comparações com outros medicamentos, como a liraglutida no Estudo 7 e estudo 9 e o survodutide no Estudo 11.
Tabela 1: Dados exportados dos artigos
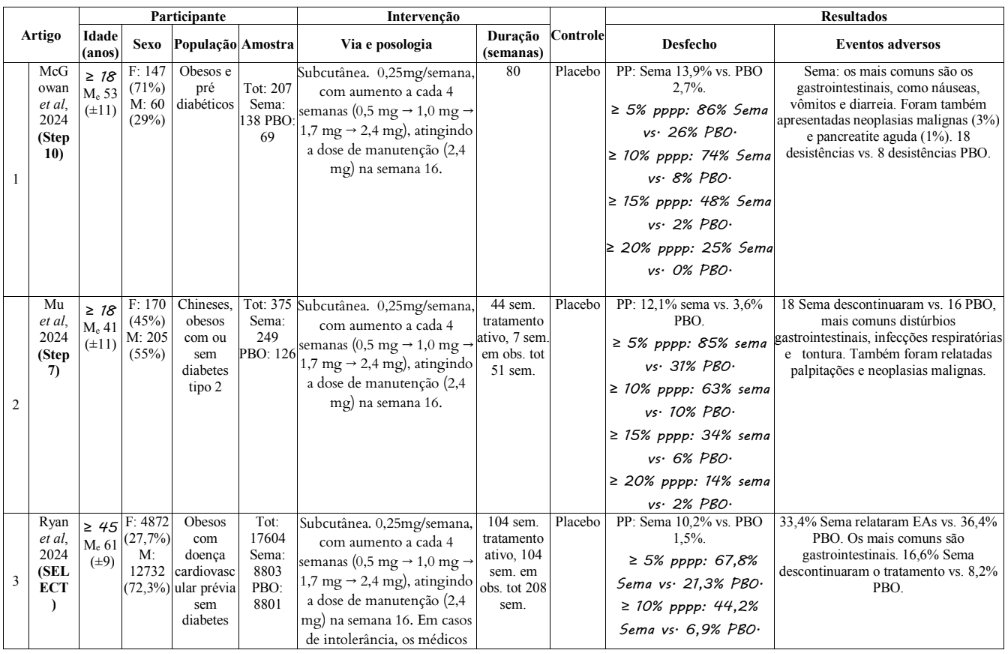
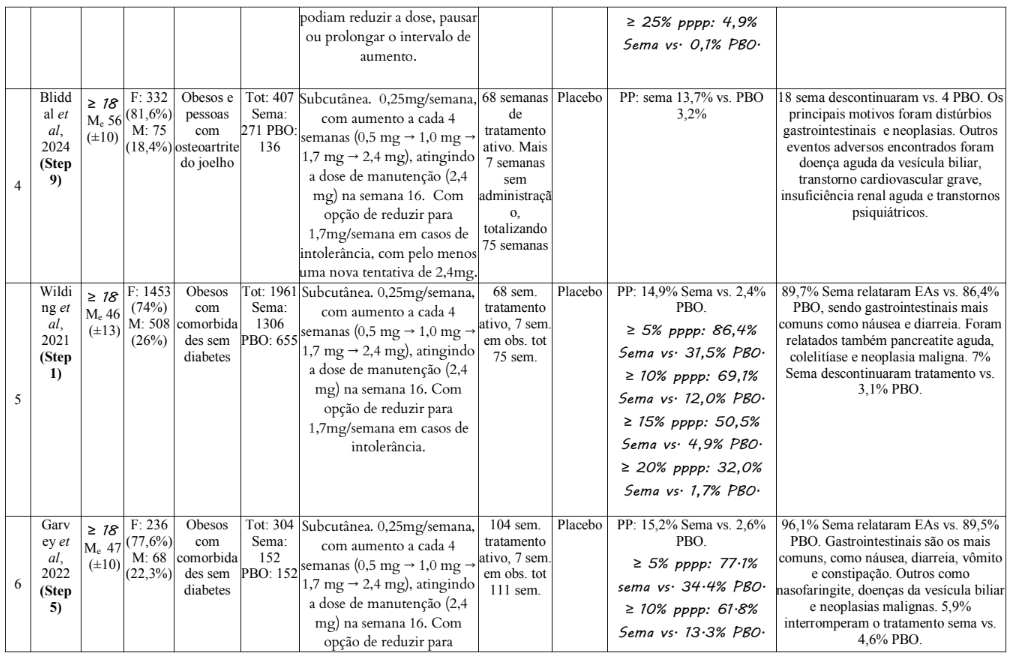
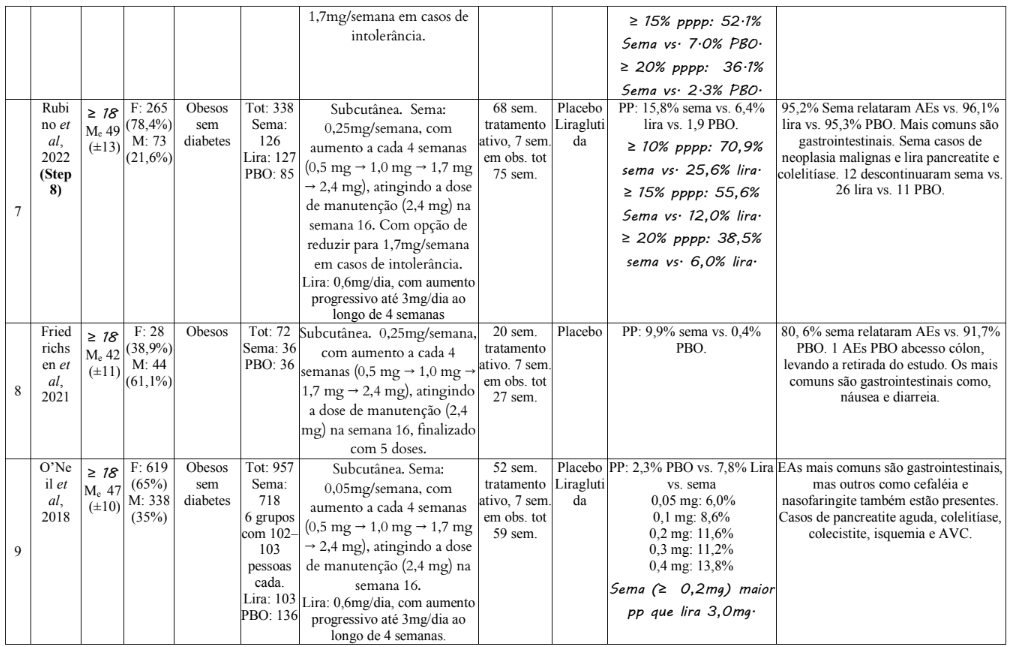
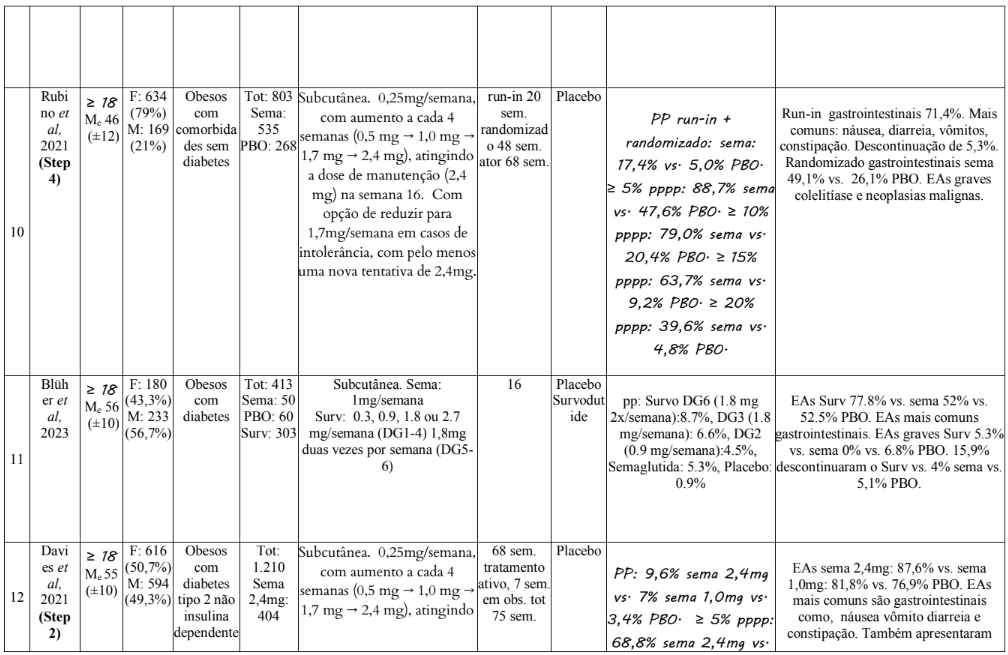

Legenda: ≥: maior igual a que; Me: média; ±: desvio padrão; F: feminino; M: masculino; Sema: semaglutida; PBO: placebo; lira: Liraglutida; Tot: total; mg: miligrama; sem.: semana: obs.: observação; surv: survodutide; PP: perda de peso; vs.: versos; EAs: eventos adversos; PPPP: proporção de participantes com perda de peso;
A magnitude da perda de peso foi particularmente significativa em estudos com doses de 2,4 mg semanais de semaglutida, sendo observadas reduções de até 16% do peso corporal após 68 semanas de tratamento, como no estudo 13. Essas reduções são consideráveis quando comparadas a estudos que utilizaram placebo, nos quais a perda de peso foi, no máximo, 5,7%, como mostrado também no estudo 13.
Quando comparada com outras terapias para perda de peso, como a liraglutida, a semaglutida também se destacou. Em um estudo de 68 semanas (estudo 7), a semaglutida levou a uma perda de peso de 15,8%, significativamente superior aos 6,4% observados com a liraglutida. Esses dados reforçam a superioridade da semaglutida no controle do peso, mesmo em relação a medicamentos com mecanismos de ação semelhantes.
É importante notar que a dose de semaglutida tem um impacto direto nos resultados. Nos estudos que utilizaram doses progressivamente maiores (de 0,25 mg a 2,4 mg), as reduções de peso foram mais expressivas. A utilização de uma dose menor pode resultar em efeitos adversos mais leves, mas com uma eficácia proporcionalmente reduzida. Isso sugere que a personalização da dosagem é essencial para equilibrar a eficácia e a tolerabilidade do tratamento, garantindo o melhor resultado para o paciente.
A duração do tratamento desempenhou um papel crucial nos resultados. Os estudos de maior duração mostraram perdas de peso mais acentuadas e sustentadas. Por exemplo, o estudo de 208 semanas (estudo 3) indicou uma perda de peso de 10,2% com a semaglutida, enquanto o placebo gerou apenas 1,5% de perda. Esse estudo, além de sua longa duração, também envolveu uma gradual titulação da dose, o que permitiu que os participantes se adaptassem melhor aos efeitos do medicamento, resultando em uma eficácia aumentada ao longo do tempo. A adaptação gradual também foi um fator importante para minimizar os efeitos adversos gastrointestinais, comuns nas primeiras semanas de tratamento.
Os eventos adversos foram comuns nos estudos que utilizaram semaglutida, principalmente efeitos gastrointestinais como náuseas, vômitos, diarreia e constipação. A frequência desses efeitos adversos foi maior no início do tratamento, diminuindo ao longo do tempo. A náusea é o efeito adverso mais prevalente (observada em 53,3% dos participantes no estudo 6) e embora a maioria dos eventos adversos tenha sido de baixa a moderada intensidade e de curta duração, a taxa de desistência devido a esses eventos foi mais alta em comparação ao placebo. Nos estudos, a taxa de descontinuação é mais notável nos estudos com maior duração e maior dose, como no estudo 3 (16,6%). Isso sugere que a dosagem mais alta de semaglutida e a exposição prolongada aumentam o risco de efeitos adversos, que podem levar à descontinuação do tratamento. No entanto, os efeitos adversos gastrointestinais tendem a ser transitórios, com a maioria dos participantes se ajustando ao tratamento ao longo do tempo. Em contraste, a taxa de descontinuação no grupo placebo foi consistentemente menor, variando de 2,9% a 8,2%. Isso pode ser interpretado como uma indicação de que, embora o placebo não ofereça os mesmos benefícios no controle do peso, os pacientes não estão expostos aos efeitos adversos associados ao tratamento ativo. No estudo 5, por exemplo, 4,5% dos participantes do grupo de semaglutida descontinuaram o tratamento devido a eventos adversos gastrointestinais, como náuseas e diarreia, enquanto apenas 0,8% do grupo placebo interromperam o tratamento por esse motivo. Isso demonstra que, embora os efeitos adversos possam ser transitórios, sua incidência pode ser um fator limitante para a adesão ao tratamento.
4. DISCUSSÃO
A perda sustentável de peso é sabidamente um desafio, uma vez que se trata de um processo complexo que envolve mudanças consistentes na dieta, na atividade física além de alterações comportamentais visando uma melhora na qualidade de vida e na saúde mental (Sarwan et al., 20024). O desenvolvimento de terapias para controle de peso e obesidade tem sido periodicamente prejudicado por questões de segurança, devido à indução ao risco de aumento de ou cardiovasculares levando à retirada de medicamentos do mercado (Drucker, 2025.)
Desde o início do século XX os hormônios semelhantes a secretina e hormônios intestinais, em geral, têm sido amplamente estudados, sabendo-se hoje que os mesmos estão envolvidos na regulação da fome, da saciedade, da motilidade intestinal e da função de barreira e imunológica intestinal, bem como na absorção, digestão e assimilação da energia ingerida. Dentre esses hormônios, estão as incretinas: GIP (originalmente “polipeptídeo inibitório gástrico”, posteriormente renomeado “polipeptídeo insulinotrópico dependente de glicose”) e GLP-1 (“peptídeo semelhante ao glucagon 1”) (Rehfeld, 2018).
Os estudos do GLP-1 demonstraram que o mesmo possui atividade insulinotrópica marcante, diminui a liberação pancreática de glucagon, neutraliza a hiperglicemias, ativa os mecanismos de saciedade, contribui para perda de peso, além de diminuir o risco cardíaco, se tornando um ótimo agente para o tratamento do diabetes tipo 2 (Creutzfeldt et al., 1996). A busca por medicamentos que mimetizam as ações do GLP-1 nativo para o tratamento do diabetes tipo 2 foi desafiada pela rápida degradação e depuração do GLP-1 nativo, juntamente com a indução de náuseas, diarreia e vômitos quando uma grande quantidade de GLP-1 era infundida rapidamente (Drucker, 2025.)
O desenvolvimento da semaglutida, pertencente a classe medicamentosa de análogos de GLP-1, foi motivado pelo desejo de melhorar a qualidade de vida e adesão ao tratamento de pacientes com diabetes tipo 2 através de um medicamento que exigisse apenas uma aplicação semanal, por meio de sua maior taxa de ligação à proteínas plasmáticas, maior estabilidade e meia vida de aproximadamente uma semana, tendo sido liberado para este fim em 2019 pelo FDA (Montalván et al., 2022).
Estudos pré-clínicos indicam que a semaglutida pode acessar áreas do cérebro envolvidas na regulação do apetite, sugerindo o envolvimento do sistema nervoso central na perda de peso induzida por este medicamento. Nestes estudos ainda foi possível observar um efeito positivo adicional representado pela perda de peso em roedores sem a diminuição do gasto energético dos mesmos, por meio de efeitos nas vias neurais homeostáticas aumentando a sensibilidade à leptina e diminuindo os sinais orexígenos, (alterando o controle do apetite, fome e saciedade) (Martins et al., 2023) e hedônicas (escolha alimentar, controle) (Gabery et al., 2020).
A observação dos usuários diabéticos, levou a constatação de que o fármaco induz perda de peso superior à observada nos demais agentes da mesma classe (Knudsen & Lau, 2019), o que motivou ensaios clínicos que avaliassem a sua eficácia na perda de peso de pacientes obesos, independentemente de serem diabéticos ou não (Andrade et al. 2022).
Os estudos STEP (Semaglutide Treatment Effect in People with Obesity), são uma série de ensaios clínicos que investigaram a eficácia e segurança da semaglutida no tratamento do sobrepeso e obesidade em vários contextos e populações. Ainda que tenham sido os responsáveis pela aprovação e liberação da comercialização para este fim, não são únicos tendo sido corroborados ou confrontados por diversos outros, realizados na fase 4, após comercialização do fármaco, como observado nesta revisão.
Esta revisão arrolou 14 estudos. É importante citar que entre eles há uma variabilidade importante quanto ao tempo de tratamento com a semaglutida, o tipo de tratamento comparador (ainda que a maioria tenha sido o placebo), comorbidades dos participantes, localidade dos participantes e desfechos secundários (melhora da qualidade de vida, da dor artrítica, entre outros). Vale ressaltar, porém, que os participantes selecionados em todos os estudos deveriam ter passado por, no mínimo, uma tentativa frustrada de perda de peso.
Os estudos apresentaram tempo de duração do tratamento com a semaglutida, variando de 20 à 104 semanas, com a maioria tendo duração de mais de 50 semanas. A escolha por períodos mais prolongados de tratamento se embasa na observação de que o efeito da semaglutida atinge um máximo , entrando em um platô, em aproximadamente 65 semanas. Os percentuais de perda de peso foram igualmente variáveis, indo de 9,6% (Davies et al., 2021) à 16% (Wadden et al., 2021), para os tratamentos com aplicação semanal de 2,4mg de senaglutida.
Uma perda de peso superior a 5% do valor do peso de base é amplamente utilizada como critério determinante de resposta clínica significativa para agentes antiobesidade. Já perdas superiores, como 10 ou 15% do peso de base têm sido recomendadas para pessoas com obesidade associada a complicações como diabetes, hipertensão e apneia do sono (Bessesen; VanGaal, 2018).
Em todos os estudos analisados, a semaglutida atinge os objetivos de eficácia clínica, superando na maior parte das vezes, perdas superiores a 10% do peso de base. Alguns estudos, inclusive, apontam um percentual que chega a 20% de perda referente ao peso inicial como observado em alguns participantes do STEP 1. Essa eficácia se aproxima a de estratégias invasivas, como a cirurgia bariátrica, que promove, dentro de 1 a 3 anos, perdas de peso que variam de 20 a 30% do peso inicial (Maciejewski et al., 2016). Esses valores são muito superiores aos 4-10,9% de perda de peso conseguidos pelas demais medicações contra obesidade já aprovadas (ADA, 2020).
Várias razões podem estar envolvidas na variação de perda de peso, mesmo entre estudos com mesmo duração. Estudos que, associado ao tratamento com a semaglutida, investiram em terapia comportamental mais intensa e próxima com intervenções no estilo de vida como metas de atividade física semanal e dietas com déficit energético, apresentaram melhor efeito que os estudos que não disponibilizaram esse suporte. Outro ponto que acaba gerando variações na perda de peso vem da variável participante, já tendo sido observado que mulheres, brancas, com IMC elevado são as que mais perdem peso com a terapia (Rayan et al., 2024), e esta era a característica dos participantes randomizados na maioria dos estudos.
É importante citar, que alguns estudos possibilitaram reajuste de dose em pacientes que não suportavam, devido aos efeitos adversos, principalmente gastrointestinais, a dose completa, preconizada. A estes indivíduos a dose de 1,7mg/semana era ofertada e os mesmos permaneciam no estudo, alterando, obviamente, os parâmetros que determinam a eficácia do medicamento. A idade e a classe social também são fatores de variabilidade que podem contribuir para o perfil da eficácia da droga (Xu et al., 2024). Sempre existe variabilidade na resposta terapêutica e na tolerância aos fármacos, sendo esse um aspecto importante no manejo da obesidade (Petersen et al.,2021).
O estudo SELECT (Ryan et al., 2024) oferece a oportunidade de avaliar a eficácia da semaglutida em uma população geográfica e racialmente diversa. O estudo englobou os dois sexos, todas as raças e tamanhos de corpo, contendo 8.802 usuários de semaglutida 2,4mg/semana mais 8.802usuários de placebo randomizados em 41 países diferentes ao longo de 208 semanas, representando o maior estudo clínico de eficácia contra obesidade já realizado com a semaglutida. Na semana 104, 67,8% dos usuários de semaglutida havia perdido 5% do peso, 22% haviam perdido 15% e mais de 430 usuários , representando 4,9% dos participantes, haviam perdido 25% do seu peso, demonstrando claramente a eficácia da aplicação de 2,4mg de semaglutida semanalmente na perda e controle do peso.
Ainda que os resultados obtidos com a semaglutida sejam , de fato, animadores, como em qualquer outro método utilizado para emagrecimento, o tratamento atinge um platô, depois do qual perdas adicionais de peso não são alcançadas sem que para isso haja uma modificação do programa. As estratégias que envolvem dieta e mudanças nos hábitos de vida, geralmente atingem um platô na perda de peso em 24 semanas (Garvey et al., 2016). Os ensaios clínicos com a semaglutida apontam que esse platô é alcançado mais tardiamente, na 65º semana (Ryan et al., 2024), em consonâncias com outros métodos farmacológicos de emagrecimento que atingem o platô em 12 meses de uso (Hall, 2024). O platô na perda de peso é determinado por fatores fisiológicos, genéticos, psicológicos e ambientais e resulta de uma adaptação metabólica diante do déficit energético persistente (Sarwan et al., 2025). Entretanto, os estudos de mais longa duração, como o STEP 5 (104 semanas) e o SELECT, 208 semanas, demonstraram que é possível sustentar a perda de peso após o atingimento do platô, corroborando com o entendimento de que a semaglutida deve ser utilizada de forma ininterrupta, como qualquer tratamento farmacológico para doenças crônicas.
Outro problema recorrente no tratamento da obesidade é o reganho de peso. O que também foi observado após a interrupção do tratamento com a semaglutida. Participantes dos estudos STEP 1 e STEP 4 apresentaram reganho de peso e perda do benefício cardiovascular e sobre a glicemia após a interrupção do tratamento (semaglutida 2,4mg/semana) (Wilding et al., 2022; Rubino et al., 2021). Tais observações destacam a natureza crônica e recorrente da obesidade que também tem sido observada em intervenções de mudança de estilo de vida, outras terapias farmacológicas e na cirurgia bariátrica (Castro et al., 2018). Portanto, para além da compreensão e evidências sobre efetividade e segurança da terapia, precisa-se entender se e/ou como os benefícios são mantidos e quais são aqueles perdidos após a interrupção do tratamento. De forma anedótica, no STEP 5, alguns pacientes em uso de semaglutida ganharam peso, e mesmo considerando erros que possam ter ocorrido de não administração de doses, o fato é que a proporção de ganho de peso foi maior no grupo semaglutida do que no grupo placebo, evidenciando o carácter complexo e multifatorial dos mecanismos envolvidos na perda de peso que sempre deve ser levado em consideração ao se observar a variabilidade de resposta dos indivíduos a um mesmo tratamento (Garvey et al., 2022).
O perfil de segurança e tolerabilidade da semaglutida é muito semelhante entre os estudos, sendo os eventos adversos no sistema digestivo os mais frequentes (náusea, vômito e diarreia) com intensidade geralmente de leve a moderada, com tendência a desaparecer com o tempo (Kushner et al., 2020). No STEP 10 , dois participantes do grupo da semaglutida foram diagnosticados com neoplasias malignas, o que também foi observado entre usuários de semaglutida em outros estudos como no STEP 2 (5 PARTICIPANTES), STEP 3 (3 PARTICIPANTES), entre outros estudos. É importante pontuar que, em todos os estudos, os pesquisadores admitiram que não havia relação entre a neoplasia maligna e a semaglutida mas que, a maioria dos estudos onde se identificou esse efeito adverso grave, o patrocínio vinha da indústria farmacêutica, podendo ser considerado um conflito de interesse. Na contramão desses estudos, SELECT (o estudo número 3 desta revisão), que apresentou maior duração de tratamento e maior número de pacientes arrolados, não apresentou aumento do risco de câncer advindo do uso do fármaco e uma revisão sistemática com metanálise dos estudos randomizados já realizados, também não encontrou associação entre o uso de semaglutida com qualquer tipo de câncer (Nagendra et al., 2023). No estudo SELECT (Rayan et al., 2024), era maior quanto menor fosse o IMC dos participantes ao que se atribuiu questões culturais e motivacionais. Em geral, os estudos observam um aumento no número de casos de colelitíase entre os usuários de semaglutida, o que já havia sido observado com outros agonistas do GLP 1 (Nauck et al., 2019), mas que também é consistente com a perda de peso rápida (Quesada et al., 2010).
O pouco tempo de uso da semaglutida no tratamento da obesidade permite afirmar que, a curto prazo, a medicação é segura e bem tolerada, principalmente se, no início do tratamento, for feito o escalonamento da dose. Não obstante, os estudos de farmacovigilância devem continuar, a fim de que se conheça melhor os aspectos relacionados à sua segurança de longo prazo.
Para além dos aspectos de eficácia e segurança, a semaglutida está no meio de um importante e preocupante movimento cultural, impulsionado pela indústria da beleza e do culto aos corpos perfeitos, que envolve automedicação e uso indevido da medicação, falsificações e utilização off-label, (Chiappini et al., 2023). Diferentemente dos demais análogos do GLP-1- RA, a semaglutida parece estar associada a níveis significativamente mais elevados de (I) abuso, (II) problemas de utilização intencional do produto e (III) utilização sem receita médica. A despeito de não ter sido relatado na literatura médica, estes fatos são totalmente consistente com a vasta gama de reportagens de revistas e jornais anedóticas e não confirmadas (BBC News, 2023; The Independent, 2023; The Guardian, 2023; Valdesolo, 2023; Orsolini et al, 2015; Zaprutko et al., 2022; Chiappiniet et al., 2023)
Em Março de 2023, a Agência Nacional Francesa para a Segurança de Medicamentos anunciou níveis de “vigilância reforçada” para a semaglutida (Le Monde, 2023), movimento que deve ser seguido por todos os centros de farmacovigilância dos países que aprovaram sua utilização a fim de que se consiga promover seu uso racional, afastando a população de riscos indevidos e desnecessários movidos por razões outras que não a busca por uma melhor saúde e qualidade de vida.
5. CONSIDERAÇÕES FINAIS
Os estudos clínicos que avaliaram a eficácia da semaglutida conseguiram demonstrar sua superioridade na perda de peso perante as outras alternativas farmacológicas, apresentando, ainda, bom perfil de segurança e tolerabilidade. Os benefícios advindos do uso da semaglutida são superiores a perda peso, diminuindo a glicemia, o risco cardiovascular, as dores artríticas, aumentando, consequentemente, a qualidade de vida dos usuários. A observação de reganho de peso e perda dos benefícios adicionais após interrupção do tratamento com a semaglutida destacam o caráter crônico da obesidade assim como a necessidade de observação dos efeitos da droga utilizada de forma contínua, avaliando também, dessa forma, os riscos decorrentes da utilização de longo prazo.
REFERÊNCIAS
ADA. American Diabetes Association. Obesity management for the treatment of type 2 diabetes: standards of medical care in diabetes — 2020. Diabetes Care, v. 43, suppl. 1, p. S89- S97, 2020.
BESSESEN, Daniel H.; VAN GAAL, Luc F. Progress and challenges in anti-obesity pharmacotherapy. The Lancet Diabetes & Endocrinology, v. 6, p. 237-248, 2018. doi: (10.1016/S2213-8587(17)30236-X)
BEZIN, J. A. Gouverneur, M. Pénichon, C. Mathieu, R. Garrel, D. Hillaire-Buys, et al. GLP-1 receptor agonists and the risk of thyroid cancer. Diabetes Care, v. 46, n. 2, p. 384-390, fev. 2023. doi: (10.2337/dc22-1148)
CHAO, Ariana M.; TRONIERI, Jena S.; AMARO, A.; WADDEN, Thomas A. Semaglutide for the treatment of obesity. Trends in Cardiovascular Medicine, v. 33, n. 3, p. 159-166, abr. 2023. doi: [10.1016/j.tcm.2021.12.008]
CREUTZFELDT, Werner O.; KLEINE, N.; WILLMS, B.; ORSKOV, C.; HOLST, J. J.; NAUCK, M. A. Glucagonostatic actions and reduction of fasting hyperglycemia by exogenous glucagon-like peptide I(7-36) amide in type I diabetic patients. Diabetes Care, v. 19, n. 6, p. 580-586, jun. 1996. doi: (10.2337/diacare.19.6.580).
DAVIES, Melanie; FAERCH, L.; JEPPESEN, O. K.; et al. Semaglutide 2.4 mg once a week in adults with overweight or obesity, and type 2 diabetes (STEP 2): a randomised, double-blind, double-dummy, placebo-controlled, phase 3 trial. The Lancet, v. 397, n. 10278, p. 971-984, 2021. doi: [10.1016/S0140-6736(21)00213-0]
DRUCKER, Daniel J. Discovery of GLP-1-Based Drugs for the Treatment of Obesity. The New England Journal of Medicine, v. 392, n. 6, p. 612-615, fev. 2025. doi: (10.1056/NEJMcibr2409089).
FDA (FOOD AND DRUG ADMINISTRATION). Semaglutide (Wegovy) prescribing information. Washington, 2017. Disponível em: [https://www.accessdata.fda.gov/drugsatfda_docs/label/2017/209637lbl.pdf]
FDA (FOOD AND DRUG ADMINISTRATION). Semaglutide (Wegovy) prescribing information. Washington, 2020. Disponível em: [https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/209637s003lbl.pdf]
GABERY, Sanaz; SALINAS, C. G.; PAULSEN, S. J.; AHNFELT-RØNNE, J.; ALANENTALO, T.; BAQUERO, A. F.; et al. Semaglutide lowers body weight in rodents via distributed neural pathways. JCI Insight, v. 5, n. 6, e133429, mar. 2020. doi: [10.1172/jci.insight.133429]
GARVEY, W. Timothy; MECHANICK, J. I.; BRETT, E. M.; GARBER, A. J.; HURLEY, D. L.; JASTREBOFF, A. M.; et al. American Association of Clinical Endocrinologists and American College of Endocrinology Comprehensive Clinical Practice Guidelines for Medical Care of Patients with Obesity. Endocrine Practice, v. 22, suppl. 3, p. 1-203, jul. 2016. doi: (10.4158/EP161365.GL).
GARVEY, W. Timothy; BATTERHAM, R. L.; BHATTA, M.; et al. Two-year effects of semaglutide in adults with overweight or obesity: the STEP 5 trial. Nature Medicine, v. 28, n. 10, p. 2083-2091, 2022. doi: [10.1038/s41591-022-02026-4]
HALL, Kevin D. Physiology of the weight-loss plateau in response to diet restriction, GLP-1 receptor agonism, and bariatric surgery. Obesity (Silver Spring), v. 32, n. 6, p. 1163-1168, jun. 2024. doi: (10.1002/oby.24027)
KNOP, Filip K.; ARODA, V. R.; DO VALE, R. D.; HOLST-HANSEN, T.; LAURSEN, P. N.; ROSENSTOCK, J.; et al. Oral semaglutide 50 mg taken once per day in adults with overweight or obesity (OASIS 1): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet, v. 402, p. 705-719, 2023. doi: (10.1016/S0140-6736(23)01185-6).
MACIEJEWSKI, Matthew L.; ARTERBURN, D. E.; VAN SCOYOC, L.; et al. Bariatric surgery and long-term durability of weight loss. JAMA Surgery, v. 151, n. 11, p. 1046-1055, 2016. doi: (10.1001/jamasurg.2016.2317).
MARTINS, Flávia F.; SANTOS-REIS, T.; MARINHO, T. S.; AGUILA, M. B.; MANDARIM DE-LACERDA, C. A. Hypothalamic anorexigenic signaling pathways (leptin, amylin, and proopiomelanocortin) are semaglutide (GLP-1 analog) targets in obesity control in mice. Life Sciences, v. 313, 121268, jan. 2023. doi: (10.1016/j.lfs.2022.121268).
NAUCK, Michael A.; MUUS GHORBANI, M. L.; KREINER, E.; SAEVEREID, H. A.; BUSE, J. B. Effects of liraglutide compared with placebo on events of acute gallbladder or biliary disease in patients with type 2 diabetes at high risk for cardiovascular events in the LEADER randomized trial. Diabetes Care, v. 42, p. 1912-1920, 2019. doi: (10.2337/dc19- 0415).
QUESADA, Bárbara M.; KOHAN, G.; ROFF, H. E.; CANULLÁN, C. M.; CHIAPPETTA PORRAS, L. T. Management of gallstones and gallbladder disease in patients undergoing gastric bypass. World Journal of Gastroenterology, v. 16, n. 16, p. 2075-2079, 2010. doi: (10.3748/wjg.v16).
REHFELD, Jens F. The Origin and Understanding of the Incretin Concept. Frontiers in Endocrinology, v. 9, 387, jul. 2018. doi: (10.3389/fendo.2018.00387)
RUBINO, Domenica; ABRAHAMSSON, N.; DAVIES, M.; et al. Effect of continued weekly subcutaneous semaglutide vs placebo on weight loss maintenance in adults with overweight or obesity: the STEP 4 randomized clinical trial. JAMA, v. 325, n. 14, p. 1414-1425, 2021. doi: [10.1001/jama.2021.3224]
SHU, Y.; HE, X.; WU, P.; LIU, Y.; DING, Y.; ZHANG, Q. Gastrointestinal adverse events associated with semaglutide: a pharmacovigilance study based on FDA adverse event reporting system. Frontiers in Public Health, v. 10, 2022. doi: (10.3389/fpubh.2022.996179).
SPEAKMAN, John R.; et al. Set points, settling points and some alternative models: theoretical options to understand how genes and environments combine to regulate body adiposity. Disease Models & Mechanisms, v. 4, n. 6, p. 733-745, 2011. doi: (10.1242/dmm.008698).
WADDEN, Thomas A.; BAILEY, T. S.; BILLINGS, L. K.; et al. Effect of subcutaneous semaglutide vs placebo as an adjunct to intensive behavioral therapy on body weight in adults with overweight or obesity: the STEP 3 randomized clinical trial. JAMA, v. 325, n. 14, p. 1403- 1413, 2021. doi: [10.1001/jama.2021.1831]
WADDEN, Thomas A.; TRONIERI, Jena S.; BUTRYN, Meghan L. Lifestyle modification approaches for the treatment of obesity in adults. American Psychologist, v. 75, n. 2, p. 235- 251, 2020. doi: (10.1037/amp0000517).
WILDING, John P. H.; BATTERHAM, R. L.; CALANNA, S.; et al. Once-weekly semaglutide in adults with overweight or obesity. The New England Journal of Medicine, v. 384, p. 989- 1002, 2021. doi: [10.1056/NEJMoa2032183]
XU, M.; ZHANG, D.; YANG, M.; WU, W.** Factors influencing safe use of drugs among community residents: a cross-sectional study. BMC Public Health, v. 24, n. 1, p. 2373, 2 set. 2024. doi: (10.1186/s12889-024-19911-x).
YANOVSKI, Susan Z.; YANOVSKI, Jack A. Progress in pharmacotherapy for obesity. JAMA, v. 326, n. 2, p. 129-130, 2021. doi: [10.1001/jama.2021.9486]
1Discentes do Curso Superior de Nutrição da Universidade Federal do Piauí Campus CSHNB e-mail: adelinafeitosanmoreira@ufpi.edu.br;cibelle.goncalves@ufpi.edu.br;adrielly.dantas@ufpi.edu.br; clarice.costa@ufpi.edu.br; nayron.santos@ufpi.edu.br
2Docente do Curso Superior de Nutrição da Universidade Federal do Piauí Campus CSHNB. Doutora em farmacologia. e-mail: ianabantim@ufpi.edu.br
