IMMUNOTHERAPY BY CHIMERICS ANTIGENS RECEPTORS IN ONCOLOGICAL TREATMENT: AN INTEGRATIVE REVIEW
REGISTRO DOI: 10.69849/revistaft/dt10202505142128
Leandro Maia Leão1; Josemir de Almeida Lima2; Karina Brandão Menezes Lima3; Jackelyne Oliveira Costa Tenório4; Aline de Araújo Marques Mousinho5; Melissa Moura Saraiva6; Aldrya Ketly Pedrosa7; Geórgia Maria Ricardo Félix dos Santos8
RESUMO
INTRODUÇÃO: A Imunoterapia Celular Adotiva (ICA) através dos Receptores de Antígenos Quiméricos (CARs) tem demonstrado grande eficácia na área oncológica, principalmente em malignidades do sistema hematopoiético, entretanto, ainda existem algumas limitações a serem resolvidas, como um melhor entendimento sobre efeitos adversos da terapia, a eficácia desse tratamento para tumores sólidos e eficácia para cânceres heterogêneos. OBJETIVO: Evidenciar as contribuições atuais e perspectivas futuras da imunoterapia por receptores de antígenos quiméricos na área oncológica. METODOLOGIA: Trata-se de uma revisão integrativa da literatura, com análise qualitativa, as bases de dados utilizadas para busca dos artigos foram: Nature, The Lancet e PubMed; tendo sido encontrado um total de 1803 artigos através dos descritores: ‘’CAR-T Cell Therapy OR CAR-NK Cell Therapy AND Remission Induction’’; ‘Adoptive Cell Therapy OR Immunotherapy AND CAR-T Cell AND Future Directions’’ sendo utilizados alguns critérios do fluxograma PRISMA2020 e, sendo utilizada a Análise Textual Discursiva (ATD) para formação das unidades de significado na análise dos dados. RESULTADOS: Após aplicabilidade dos critérios de inclusão e exclusão, 14 artigos foram selecionados através do recorte temporal de 5 anos. DISCUSSÃO: Evidenciou-se que as células CAR-T promovem remissões parciais e/ou totais de malignidades hematológicas e são mais eficazes em cânceres homogêneos, quanto que as células CAR-NK por sua vez, além dessas propriedades terapêuticas atuam melhor na infiltração do microambiente de tumores sólidos. CONCLUSÃO: A imunoterapia CAR demonstra grande potencial para atingir a remissão de inúmeros tipos de cânceres, como já tem demonstrado em suas aplicações ao redor do planeta, entretanto, ainda precisam ser transpassadas algumas limitações como: um melhor entendimento geral sobre os efeitos adversos (síndromes neurotóxicas) que ela pode apresentar e, o desenvolvimento de CARs de multisinalização, para ampliar a eficácia do tratamento em cânceres heterogêneos.
Palavras-chave: Imunoterapia Adotiva; Receptores de Antígenos Quiméricos; Oncologia Clínica
ABSTRACT
INTRODUCTION: Adoptive Cellular Immunotherapy (ICA) through Chimeric Antigen Receptors (CARs) has shown great efficacy in the oncological area, especially in malignancies of the hematopoietic system. However, there are still some limitations to be resolved, such as a better understanding of the adverse effects of therapy, the efficacy of this treatment for solid tumors and efficacy for heterogeneous cancers. OBJECTIVE: To highlight the current contributions and future prospects of chimeric antigen receptor immunotherapy in the oncology field. METHODOLOGY: This is an integrative literature review with a qualitative analysis. The databases used to search for the articles were: Nature, The Lancet and PubMed; a total of 6273 articles were found using the descriptors: ”CAR-T Cell Therapy OR CAR NK Cell Therapy AND Remission Induction”; ”Adoptive Cell Therapy OR Immunotherapy AND CAR-T Cell AND Future Directions” with some criteria from the PRISMA2020 flowchart being used, and Textual Discourse Analysis (TDA) being used to form the units of meaning in the data analysis. RESULTS: After applying the inclusion and exclusion criteria, 14 articles were selected over a 5-year period. DISCUSSION: It was found that CAR-T cells promote partial and/or total remissions of hematological malignancies and are more effective in homogeneous cancers, while CAR-NK cells, in addition to these therapeutic properties, are better at infiltrating the microenvironment of solid tumors. CONCLUSION: CAR immunotherapy shows great potential for achieving remission in numerous types of cancer, as it has already demonstrated in its applications around the world. However, some limitations still need to be overcome, such as: a better general understanding of the adverse effects (neurotoxic syndromes) that it can present, and the development of multisignaling CARs, in order to increase the effectiveness of treatment in heterogeneous cancers.
Keywords: Adoptive Immunotherapy; Chimeric Antigen Receptors; Clinical Oncology
INTRODUÇÃO
Essa pesquisa teve como objeto de estudo a Imunoterapia Celular Adotiva (ICA) na utilização de Receptores de Antígenos Quiméricos (CARs), das contribuições atuais até as perspectivas futuras dessa terapia na área oncológica. A escolha desse objeto de estudo deu-se através de evidências científicas recentes acerca dessa nova abordagem terapêutica emergente, sendo uma opção inovadora para o tratamento de diversos tipos de cânceres através dos CARs, utilizados principalmente em neoplasias do sistema hematopoiético.
O câncer é caracterizado como uma nomenclatura associada a uma gama extensa de grupos e subgrupos de doenças que podem surgir em quaisquer órgãos ou tecidos do corpo, onde células anômalas adquirem a capacidade de desenvolver-se de forma desordenada e incontrolável, o que lhes confere habilidades de ultrapassar os limites fisiológicos de uma célula saudável, invadir órgãos ou sistemas adjacentes do corpo e espalharem-se através dos mesmos, sendo esse último processo chamado de metástase e, é o principal causador de morte por câncer no mundo (OMS, 2020).
Partindo desta introdução sobre o câncer, é notório que essa doença vem assolando a humanidade, onde nos tempos de outrora não haviam perspectivas de tratamento, nem o conhecimento científico para tentar realizá-lo, entretanto, nos dias hodiernos as pesquisas apontam-nos uma terapia inovadora e eficaz para alguns tipos de câncer, a imunoterapia celular adotiva que utiliza receptores de antígenos quiméricos. As células T modificadas por receptor de antígeno quimérico surgiram recentemente, sendo uma opção terapêutica viável para o tratamento de tipos de câncer hematológicos, onde dentre eles são incluídos tipos de leucemias linfoblástica, linfomas de células do tipo B, linfoma folicular, linfoma de células do manto e mieloma múltiplo (RUELLA et al, 2023).
As células modificadas pelo CAR são identificadas como uma terapia personalizada para cada paciente de maneira individual, onde é realizada a coleta das células T do mesmo, reprojetando-as em laboratório para capacitá-las a produzir uma proteína de membrana específica, reconhecendo e ligando-se nas proteínas de membrana das células mutantes, os chamados antígenos de superfície (NATIONAL CANCER INSTITUTE, 2025).
Apesar do sucesso clínico na utilização da terapia com células CAR-T em malignidades hematológicas, essa terapia possui a capacidade de resultar em toxicidades significativas, sendo essas diretamente associadas à indução de respostas inflamatórias sistêmicas (MORRIS et al, 2022).
Entretanto, existem alternativas ao tratamento CAR em células T que minimizam a possibilidade dessas toxicidades, que é o tratamento CAR através das células NK. As células CAR-NK, quando comparadas as células CAR-T, apresentam vantagens significativas, onde nessas vantagens estão inclusas: maior segurança como a ausência da síndrome de liberação de citocinas (CRS) e síndrome de neurotoxicidade associada a células efetoras imunes (ICANS) em ambiente autólogo, e também menor risco de doença do enxerto contra o hospedeiro em ambiente halogênico; outra vantagem é a capacidade de infiltração no microambiente tumoral em tumores sólidos (XIE et al, 2020).
Mesmo havendo a possibilidade desse efeito adverso, o tratamento com células CAR-T não foi descontinuado, onde essa abordagem terapêutica tem a capacidade de ser melhor desenvolvida e sua tecnologia estender-se para outros tipos de cânceres também.
Face ao exposto, é relevante responder a seguinte questão norteadora: ‘’quais as contribuições atuais e perspectivas futuras da imunoterapia celular adotiva através dos receptores de antígenos quiméricos no tratamento oncológico?’’.
Diante deste cenário e dos fatos abordados, a investigação das contribuições atuais e perspectivas futuras da Imunoterapia Celular Adotiva através dos Receptores de Antígenos Quiméricos é de suma relevância, pois a constante evolução das técnicas de engenharia genética, unida a melhor compreensão dos mecanismos dos efeitos adversos, resistência tumoral e as novas estratégias para ampliar sua tecnologia, segurança e eficácia, apontam para a necessidade de estudos que explorem tanto os sucessos e possibilidades futuras quanto as limitações e desafios dessa abordagem. Portanto, Compreender os nuances dessa terapia é crucial para fornecer um cuidado de alta qualidade e individualizado, além de preparar os profissionais da saúde para os avanços científicos e tecnológicos emergentes, sendo assim, esse estudo teve como objetivo geral analisar as contribuições atuais e perspectivas futuras da imunoterapia celular adotiva através dos receptores de antígeno quimérico no tratamento oncológico.
METODOLOGIA
Trata-se de uma revisão integrativa da literatura. Esse modelo de produção de conhecimento reúne e avalia criticamente diversos estudos primários e secundários sobre uma determinada temática, oferecendo uma síntese compreensiva das evidências existentes, identificando áreas de consenso e controvérsia, além de proporcionar diretrizes para futuras investigações (KUTCHER & LEBARON, 2022).
Segundo Kutcher e LeBaron (2022), as etapas preconizadas pelo método para elaboração de revisões integrativas são: 1. Elaboração da pergunta norteadora; 2. Determinar os objetivos claros do estudo; 3. Busca ou amostragem na literatura, base de dados e periódicos; 4. Coleta de dados e avaliação dos mesmos; 5. Análise crítica dos estudos incluídos e sua síntese; 6. Discussão dos resultados obtidos e, 7. Apresentação da revisão integrativa, divulgação dos resultados.
Para guiar o desenvolvimento desta revisão, foi utilizada a estratégia PICO para a elaboração do problema de pesquisa da seguinte maneira: População/Pacientes (P): Pacientes diagnosticados com câncer do sistema hematopoiético, outros tipos de câncer e tumores sólidos; Intervenção (I): Utilização da imunoterapia celular adotiva por Receptores de Antígenos Quiméricos (CAR); Comparação/Controle (C): Comparações dos CARs utilizados em células T e NK; Outcome/Desfecho (O): Identificar a eficácia dessas terapias, seus avanços sobre o que já está estabelecido, limitações das mesmas e as perspectivas futuras (HOSSEINI et al, 2024).
A busca foi realizada nas bases de dados: Nature; The Lancet; PubMed; também do portal da Organização Mundial da Saúde, identificando os artigos que entravam em acordo com o objetivo geral do presente estudo. As publicações foram buscadas através da Medical Subject Headings (MeSH) a saber: ‘’CAR-T Cell Therapy OR CAR-NK Cell Therapy AND Remission Induction’’; ‘Adoptive Cell Therapy OR Immunotherapy AND CAR-T Cell AND Future Directions’’; ‘’CAR-T Cell Therapy OR CAR-NK Cell Therapy AND Cancer’’, “Adoptive Cell Therapy AND Immunotherapy OR CAR T-Cell Therapy”, o escopo da busca foi melhorado através da pesquisa avançada para buscar os descritores em title, abstract e keywords. A estratégia de busca eletrônica completa está ilustrada no Quadro 1.
Quadro 1. Estratégias de busca, Maceió, AL, Brasil, 2024.

A busca foi realizada entre os meses de fevereiro e maio de 2025. Os critérios de inclusão e exclusão foram elaborados em tabela para melhor visualização e separação dos mesmos, estão completos e ilustrados no Quadro 2.
Quadro 2. Critérios de Inclusão e Exclusão.


Para seleção dos estudos, os pesquisadores, de forma independente, examinaram as pesquisas com base no título, resumo e descritores; quando estes deixaram claro que se enquadravam nos critérios de elegibilidade adotados, o artigo completo era lido, a partir disso os estudos relevantes foram alinhados, lidos em texto completo e selecionados de acordo com os critérios de elegibilidade empregados.
A seleção da amostra de artigos da presente revisão deu-se seguindo algumas recomendações do Preferred Reporting Items For Systematic Reviews and MetaAnalyses (PAGE et al, 2021).
O processo completo pode ser visualizado no fluxograma da Figura 1.
Figura 1. Fluxograma de seleção da amostra dos artigos.
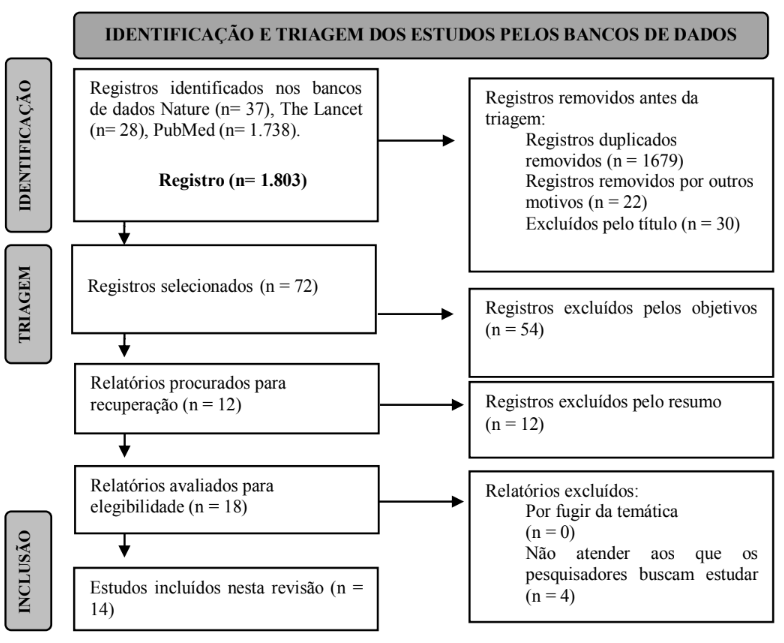
Sobre a extração dos dados, os pesquisadores, de forma independente, extraíram as informações dos artigos publicados utilizando de protocolo pré-estabelecido. Durante a extração dos dados qualitativos, foram checadas as seguintes informações: Autor, revista, ano de publicação, desenho do estudo, população, critérios de inclusão e exclusão, qual o instrumento de coleta de dados utilizado, variáveis estudadas e principais desfechos.
Os estudos foram analisados qualitativamente, seguindo alguns passos da Análise Textual Discursiva (ATD) de Moraes e Galiazzi (2016) para melhor organização, tendo assim sido abordado a autoria, ano de publicação, local de estudo, intervalo de idade, objetivos, nível de evidência científica e os principais resultados.
Quadro 3. Formação das unidades de significado através da ATD.
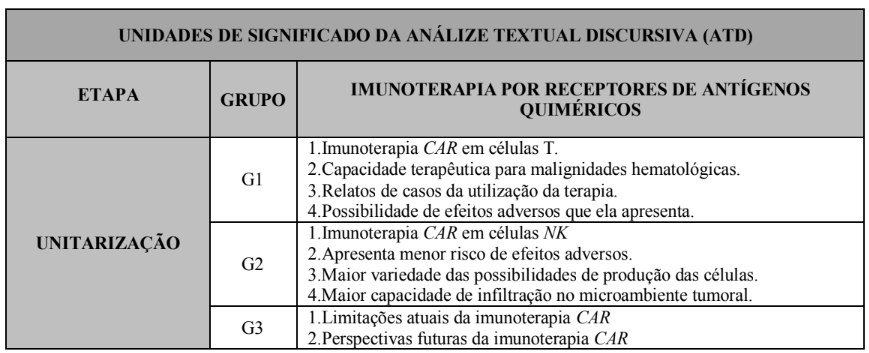
Para analisar o nível de evidência, foi utilizada a seguinte classificação: 1. Revisões sistemáticas e/ou metanálises; 2. Revisões sistemáticas de estudos qualitativos e/ou descritivos sem metanálise através do protocolo SWiM (Synthesis Without Meta Analysis); 3. Estudos clínicos originais; 4. Estudos qualitativos e descritivos. Tendo seu conteúdo analisado e discutido sob a óptica da literatura científica.
RESULTADOS
A partir da busca realizada e empregados os critérios de inclusão e exclusão, foram selecionados 14 artigos para compor a discussão do presente estudo, onde foram explorados e sintetizados os seguintes dados: autor principal, título do artigo, base de dados em que o artigo está inserido, periódico que o estudo foi publicado, fator de impacto do periódico que o estudo foi publicado, ano da publicação, objetivo do estudo ter sido selecionado e a metodologia utilizada pelo mesmo (Quadro 3). Em seguida, foi realizada uma análise textual discursiva que resultou na categoria analítica: contribuições atuais da imunoterapia CAR em células T e NK, perspectivas futuras da imunoterapia em novas gerações de CARs na área oncológica.
Quadro 4. Descrição dos artigos selecionados para o presente estudo.
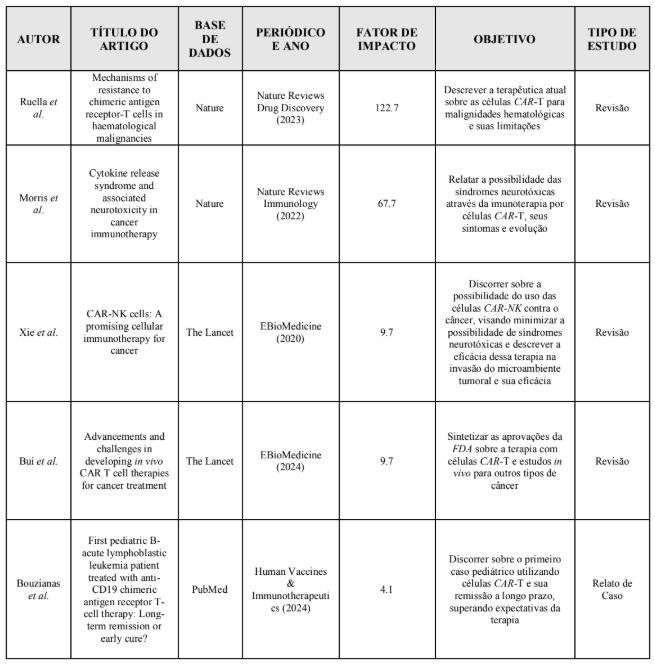
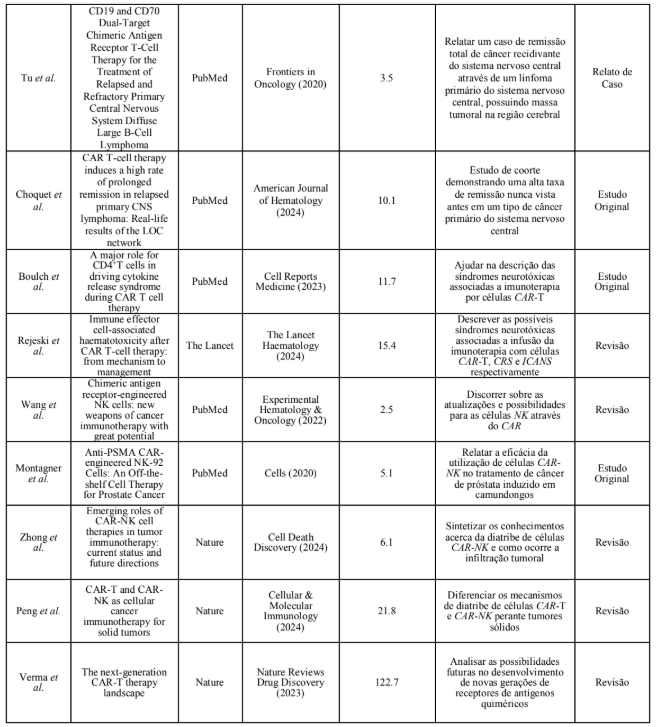
DISCUSSÕES
A imunoterapia CAR-T para cânceres do sistema hematopoiético já demonstrou se eficaz em diversos casos ao redor do mundo, sinalizando para instituições e governos que é uma terapia viável e uma alternativa a tratamentos mais convencionais, a FDA (Food and Drug Administration), órgão regulador dos Estados Unidos da América, já aprovou a imunoterapia CAR, tanto para uso em humanos (Em casos de Mieloma Múltiplo, Leucemia de células B (Ou Leucemia Linfoblástica Aguda) e Linfoma não Hodgkin (LNH), quanto em testes clínicos in vitro e in vivo para uma variedade de outros tipos de cânceres (BUI et al, 2024).
Em 2012 nos Estados Unidos da América, a primeira paciente pediátrica do mundo recebeu o tratamento com células CAR-T anti-CD19 para Leucemia Linfoblástica Aguda do tipo B (LLA-B), após 5 meses da infusão da terapia, já não era detectado nenhum traço de células cancerígenas em seu organismo, continuou sendo acompanhada ao longo dos anos e a paciente ainda encontra-se em remissão total nos dias atuais; levantando uma questão sob a óptica da nomenclatura associada ao câncer que os pesquisadores utilizam, essa paciente está em remissão total? Ou está curada? Já tendo perpassado 12 anos da terapia recebida pela mesma (BOUZIANAS & BOUZIANA, 2024).
Resultados esperançosos vêm permeando a imunoterapia CAR, tanto em cânceres específicos do sistema hematopoiético, quanto cânceres metastáticos que originalmente eram do mesmo sistema, desde 2011 um paciente vinha recebendo tratamentos convencionais de quimioterapia, radioterapia e cirurgia, estava em constante remissão completa e recidiva, uma em 2016, onde passou por quimioterapia e cirurgia de ressecção do lobo frontal direito e outra em 2017, sendo a última um Linfoma Primário do Sistema Nervoso Central (PCNSL) sendo um tipo extranodal raro de câncer, advindo de um Linfoma não-Hodgkin com característica altamente maligna, esse tipo de tumor representa 3% dos tumores de SNC, sendo apresentado também em estatística que cerca de um terço dos pacientes que apresentam esse tumor, parecem ser resistentes ao tratamento de convencional e, cerca de metade dos pacientes que alcançaram alguma remissão, tem recaídas. O caso desse paciente foi estudado e ele entrou no ensaio clínico de células CAR-T, sendo identificada a expressão de CD19 e CD70 através de um lentivírus carregando essas codificações expressivas e sendo inseridos nas células T, codificando-as em um CAR de quarta geração contendo anti CD19 e anti-CD70 munido de múltiplos domínios de sinalização intracelular (CD28- CD27-CD3z-2A-iCasp9), sendo feito exame de ressonância magnética antes da infusão, um mês após infusão e dezessete meses após infusão, demonstrando êxito na remissão total da massa tumoral que estava presente no lobo frontal (TU et al, 2020).
Pacientes com linfoma primário do sistema nervoso central (CPNPC) possuem uma condição rara, malignidade que afeta células B (LDGCB), que tem prognóstico desfavorável por conta de sua alta taxa de recidivas e, com uma taxa de sobrevivência global média de 6,8 meses de vida após diagnóstico, adicionando a equação a baixa capacidade de tratamento dessa condição, tendo em vista sua complexidade, custo e ausência de resposta ao tratamento de resgate e, quando pacientes alcançavam alguma remissão, era de curta duração, quase sem cura definitiva. Através do maior estudo de coorte realizado na França, foi obtido uma quantidade favorável de pacientes em remissão dessa malignidade tratada com células CAR-T, apresentando 46% do total de pacientes com remissão prolongada e sem utilização de terapias adicionais (CHOQUET et al, 2024).
A imunoterapia CAR em células T já demonstrou sua eficácia ao ser utilizada para tratar diversos pacientes ao redor do mundo, conseguindo remissões parciais e totais de longa duração, sendo exitosas na maior parte dos casos, e sua utilização sendo sozinha ou em conjunto a outros tipos de terapias, entretanto, ainda existem barreiras a serem transpassadas, uma delas é a presença dos efeitos adversos que a imunoterapia CAR pode apresentar, as chamadas síndromes neurotóxicas (MORRIS et al, 2022).
A imunoterapia CAR-T tem a capacidade de resultar em toxicidades significativas, associadas a indução sistêmica de respostas efetoras imunes, duas grandes toxicidades foram identificadas nos primeiros estudos com células CAR-T feitos em camundongos, sendo eventualmente analisadas através de ensaios clínicos: a chamada Síndrome de Liberação de Citocinas (CRS) sendo a primeira, e uma segunda síndrome neurotóxica que possui uma associação em decorrência da primeira, chamada de Síndrome de Neurotoxicidade Associada a Células Efetoras Imunes (ICANS) (MORRIS et al, 2022; BOULCH et al, 2023).
A CRS tem início com sintomas como febre, rigor muscular, mal-estar e perda de peso, a febre pode ser de alto grau e pode vir a persistir por vários dias, quando em casos graves, ela possui características de uma resposta inflamatória a nível sistêmico, onde o paciente pode manifestar sintomas como: hipóxia, hipotensão, disfunção orgânica, podendo também ocorrer disfunção e falência múltipla de órgãos, incluindo sistemas cardíaco, hepático, pulmonar, gastrointestinal e renal, mesmo sendo observada a gravidade dessa condição, ela é evitável e reversível na maior parte dos casos, tendo o manejo dos sintomas em sua fase aguda como crucial para o tratamento do paciente, evitando assim maiores complicações, vale salientar que essa condição não inviabiliza a utilização do tratamento pelas células CAR-T (MORRIS et al, 2022; REJESKI et al, 2024).
A segunda condição chamada ICANS, tem sua manifestação como uma encefalopatia tóxica, sendo observados os seguintes sintomas manifestados: dislalia, desorientação, disfagia, afasia, habilidades motoras finas prejudicadas e obnubilação; em casos agravados também foram observados os sintomas: miastenia, convulsões, edema cerebral e coma, essas condições ocorrem por conta do aumento na sensibilidade da barreira hematoencefálica, perpassando para a área neurológica as citocinas liberadas pelas células efetoras imunes; a maior parte dos pacientes que apresentem os sintomas de ICANS tiveram anteriormente a CRS, sendo as duas associadas chamadas de síndromes neurotóxicas por imunoterapia de células CAR-T; podem ocorrer com menor frequência alguns casos em que o paciente apresente as duas síndromes concomitantemente e, semelhante ao quadro da CRS, a ICANS também é reversível na maior parte dos casos, sem déficits neurológicos permanentes quando manejada corretamente (MORRIS et al, 2022; REJESKI et al, 2024).
Os dados clínicos concerne às síndromes neurotóxicas sugerem uma correlação na presença das síndromes com a carga tumoral do paciente no momento da infusão com células CAR-T, sugerindo que, quanto maior a carga tumoral no paciente, maiores as chances de desenvolver as síndromes neurotóxicas por células CAR-T, entretanto, mesmo com o risco desses efeitos adversos, a terapia ainda é viável para utilização em humanos (BOULCH et al, 2023).
Não é só a célula T que tem a capacidade de receber os CARs, as células NK (Natural Killers) também podem recebê-los e existem diferenças substanciais nos mecanismos de interação celular e modus operandi quando se trata das células NK, sendo uma opção promissora no tratamento de doenças oncológicas (XIE et al, 2020).
As células NK modificadas para tornarem-se CAR-NK possuem uma maior segurança que foi demonstrada em ambiente clínico, o risco de neurotoxicidade no alvo e fora do tumor para tecidos saudáveis é relativamente baixo devido a vida útil da célula que é limitada no percurso da circulação sanguínea; as infusões alogênicas de células CAR-NK reduziram o risco de doença do enxerto contra o hospedeiro (DECH), as CAR NK secretam diferentes tipos de citocinas, geralmente IFN-y e GM-CSF, enquanto as células CAR-T produzem predominantemente interleucinas inflamatórias como citocinas utilizadas no seu modus operandi (XIE et al, 2020; WANG et al, 2022).
As células CAR-NK tem maior capacidade também para lidar com tumores heterogêneos que necessitem de mais receptores de antígeno do que o CAR que lhe foi conferida, tendo a capacidade de reconhecer outras células tumorais que independem do reconhecimento de um CAR; outra vantagem que as células CAR-NK possuem é a capacidade de serem geradas de diversas fontes, incluindo linhagens celulares de células NK comuns autólogas ou alogênicas, células mononucleares do sangue periférico (PBMCs), células retiradas do cordão umbilical (UCB) e células-tronco pluripotentes induzidas (iPSCs), com a capacidade de produção em massa e o produto tornar-se ‘’pronto para uso’’ em aplicações clínicas (WANG et al, 2022).
As células CAR-NK tem maior capacidade de infiltração, tendo em vista que as células cancerígenas conseguem criar microambientes propícios para sua sobrevivência, principalmente quando em estado de tumor sólido, diminuindo a capacidade das células imunes alcançarem as células tumorais que estiverem permeadas por esse microambiente, quando as CAR-NK adquirem a habilidade chamada de ‘’maior capacidade de infiltração no microambiente tumoral’’, por conta da melhora no mecanismo de lise através de Perforinas e Granzimas que induzem a apoptose, piroptose ou necroptose (MONTAGNER et al, 2020; ZHONG & LIU, 2024).
As células NK possuem naturalmente a capacidade de reconhecer e atacar tumores cancerígenos, entretanto, quando elas estão modificadas por CAR específico, a habilidade de causar a morte celular de células cancerígenas é amplificada, fazendo da célula NK uma promessa para tratamento de tumores sólidos de difícil infiltração no microambiente tumoral (MONTAGNER et al, 2020; PENG et al, 2024).
A imunoterapia CAR está cada vez mais ganhando espaço na comunidade científica, sendo visualizada como a possível ferramenta na remissão de doenças onde antes essa possibilidade não era viável; dentro dessa linha de pesquisas as gerações e fabricações dos CARs são de grande relevância para amplificar ainda mais a inovação terapêutica que já foi alcançada pela mesma; onde estão sendo visualizadas as possibilidades do uso de CARs em outras células do sistema imunológico como Macrófagos e Células Dendríticas e, também no desenvolvimento de melhorias nas suas gerações, possibilitando a criação de CARs com múltiplos receptores de alvos (melhorando a eficácia das células CAR perante múltiplos tipos de cânceres, os chamados cânceres heterogêneos) e também na busca de reduzir os possíveis efeitos adversos dessa terapia quando utilizada em células T (VERMA et al, 2023).
CONCLUSÃO
Infere-se que os resultados desta revisão integrativa revelam que a imunoterapia CAR tem alcançado grande capacidade terapêutica principalmente para malignidades hematológicas, entretanto, a tecnologia que a circunda possibilita uma gama imensa de projeções e hipóteses e são nelas que a terapia CAR precisa estar inserida, a capacidade de modificar células do sistema imunológico, conferindo-as habilidades de reconhecimento, de migração e infiltração melhoradas.
Face aos resultados e discussão, evidenciou-se que as células CAR-T possuem a capacidade de promover remissões parciais em cânceres heterogêneos ou totais em cânceres homogêneos, principalmente quando usadas em malignidades hematológicas; mesmo quando apresentam os efeitos adversos chamados de síndromes neurotóxicas; quanto as células CAR-NK por sua vez, além das propriedades terapêuticas, conseguem atuar melhor na infiltração do microambiente tumoral de tumores sólidos; possui também menor risco de apresentar efeitos adversos de síndromes neurotóxicas quando comparadas às células CAR-T por conta de sua sobrevida celular.
Perpassando as perspectivas futuras, a imunoterapia CAR já mostra-se uma grande ferramenta coadjuvante no tratamento oncológico para os próximos anos; e vem sendo melhor desenvolvida a projeção de novas gerações de CARs que tenham múltiplos domínios de sinalização e reconhecimento, melhorando assim a terapêutica perante cânceres heterogêneos que são atualmente um desafio para essa terapia, sendo esses os motivos para que sejam realizados mais estudos nessa área, visando aumentar as capacidades terapêuticas e seu entendimento geral, seja no quesito eficácia ou efeitos adversos oriundos da mesma.
REFERÊNCIAS
1. BOULCH, M. et al. A major role for CD4+ T cells in driving cytokine release syndrome during CAR T cell therapy. Cell reports. Medicine, v. 4, n. 9, p. 101161, 2023.
2. BOUZIANAS, D.; BOUZIANA, S. First pediatric B-acute lymphoblastic leukemia patient treated with anti-CD19 chimeric antigen receptor T-cell therapy: Long-term remission or early cure? Human vaccines & immunotherapeutics, v. 20, n. 1, p. 2321678, 2024.
3. BUI, T. A. et al. Advancements and challenges in developing in vivo CAR T cell therapies for cancer treatment. EBioMedicine, v. 106, n. 105266, p. 105266, 2024.
4. Cancer. Disponível em: <https://www.who.int/health-topics/cancer>. Acesso em: 15 fevereiro. 2025.
5. CAR T cells: Engineering immune cells to treat cancer. Disponível em: <https://www.cancer.gov/about-cancer/treatment/research/car-t-cells>. Acesso em: 3 março. 2025.
6. CHOQUET, S. et al. CAR T-cell therapy induces a high rate of prolonged remission in relapsed primary CNS lymphoma: Real-life results of the LOC network. American journal of hematology, v. 99, n. 7, p. 1240–1249, 2024.
7. HOSSEINI, M.-S. et al. Formulating research questions for evidence-based studies. Journal of Medicine, Surgery, and Public Health, v. 2, n. 100046, p. 100046, 2024.
8. KUTCHER, A. M.; LEBARON, V. T. A simple guide for completing an integrative review using an example article. Journal of professional nursing: official journal of the American Association of Colleges of Nursing, v. 40, p. 13–19, 2022.
9. MONTAGNER, I. M. et al. Anti-PSMA CAR-engineered NK-92 cells: An off-the shelf cell therapy for prostate cancer. Cells (Basel, Switzerland), v. 9, n. 6, p. 1382, 2020.
10. Moraes, R; Galiazzi, M. C. Análise Textual Discursiva. 3ª Edição. Ijuí, RS: Unijuí, 2016. 264p.
11. MORRIS, E. C. et al. Cytokine release syndrome and associated neurotoxicity in cancer immunotherapy. Nature reviews. Immunology, v. 22, n. 2, p. 85–96, 2022.
12. PAGE, M. J. et al. The PRISMA 2020 statement: an updated guideline for reporting systematic reviews. BMJ (Clinical research ed.), v. 372, p. n71, 2021.
13. PENG, L. et al. CAR-T and CAR-NK as cellular cancer immunotherapy for solid tumors. Cellular & molecular immunology, v. 21, n. 10, p. 1089–1108, 2024.
14. REJESKI, K. et al. Immune effector cell-associated haematotoxicity after CAR T cell therapy: from mechanism to management. The Lancet. Haematology, v. 11, n. 6, p. e459–e470, 2024.
15. RUELLA, M. et al. Mechanisms of resistance to chimeric antigen receptor-T cells in haematological malignancies. Nature reviews. Drug discovery, v. 22, n. 12, p. 976–995, 2023.
16. TU, S. et al. CD19 and CD70 dual-target chimeric antigen receptor T-cell therapy for the treatment of relapsed and refractory primary central nervous system diffuse large B-cell lymphoma. Frontiers in oncology, v. 9, p. 1350, 2020.
17. VERMA, M. et al. The next-generation CAR-T therapy landscape. Nature reviews. Drug discovery, v. 22, n. 10, p. 776–777, 2023.
18. WANG, X. et al. Chimeric antigen receptor-engineered NK cells: new weapons of cancer immunotherapy with great potential. Experimental hematology & oncology, v. 11, n. 1, p. 85, 2022.
19. XIE, G. et al. CAR-NK cells: A promising cellular immunotherapy for cancer. EBioMedicine, v. 59, n. 102975, p. 102975, 2020.
20. ZHONG, Y.; LIU, J. Emerging roles of CAR-NK cell therapies in tumor immunotherapy: current status and future directions. Cell death discovery, v. 10, n. 1, p. 318, 2024.
1Centro Universitário CESMAC, ORCID: 0000-0002-8393-687X
2Centro Universitário CESMAC, ORCID: 0000-0003-3295-1006
3Centro Universitário de Maceió (UNIMA), ORCID: 0000-0001-5915- 5689
4Centro Universitário de Maceió (UNIMA), ORCID: 0000-0002-0788-0552
5Centro Universitário de Maceió (UNIMA), ORCID: 0009-0007-4702-5159
6Universidade Estadual de Ciências da Saúde de Alagoas (UNCISAL), ORCID: 0009-0003-8096-8897
7Universidade Estadual de Ciências da Saúde de Alagoas (UNCISAL), ORCID: 0000-0002-2422-2738
8Universidade Estadual de Ciências da Saúde de Alagoas (UNCISAL), ORCID: 0000-0003-0154-597X
