BENEATH THE SURFACE: METHODOLOGICAL CHALLENGES IN ASSESSING THE HEALTH RISKS OF ANABOLIC ANDROGENIC STEROID USE
REGISTRO DOI: 10.69849/revistaft/cs10202504270648
Lucas Caseri Câmara1
Diogo Pinto da Costa Viana2
Lucio de Sousa Monte Alto3
Resumo
O uso abusivo de esteroides anabolizantes androgênicos (EAA) têm sido amplamente associado a efeitos adversos sobre a saúde. No entanto, a atribuição de causalidade direta entre EAA e desfechos negativos é metodologicamente desafiadora. Este artigo realiza uma análise crítica da literatura, destacando as principais limitações dos estudos observacionais, especialmente em relação à ausência de controle de fatores de confusão. Revisões sistemáticas e estudos populacionais demonstram que usuários de EAA apresentam padrões de uso extremamente variáveis, incluindo doses muito superiores às terapêuticas, polifarmácia com outras drogas potencialmente mais nocivas, e aquisição de produtos adulterados no mercado paralelo. Adicionalmente, o uso de EAA raramente ocorre de forma isolada, sendo comumente associado a substâncias lícitas e ilícitas. Também são frequentes antecedentes psicossociais e comportamentais que diferenciam significativamente os usuários de EAA dos não usuários, como histórico de traumas, transtornos de imagem corporal e baixa autoestima. Tais elementos comprometem a comparabilidade entre grupos e dificultam a identificação de efeitos específicos dos EAA. Conclui-se que a interpretação dos dados deve ser feita com parcimônia, e que futuras pesquisas devem incluir estratégias metodológicas mais refinadas para controle de confundidores e melhor caracterização dos usuários.
Palavras-chave: Esteroides anabolizantes, testosterona, androgênios.
Abstract
Abuse of anabolic-androgenic steroids (AAS) has been widely linked to adverse health outcomes. However, establishing direct causality between AAS use and negative effects remains methodologically complex. This article presents a critical review of the literature, emphasizing the main limitations of observational studies, particularly regarding the lack of control for confounding variables. Systematic reviews and population surveys reveal that AAS users display highly heterogeneous usage patterns, often involving supratherapeutic doses, concomitant use of multiple substances (polypharmacy), and reliance on counterfeit products from the underground market. Moreover, AAS abuse rarely occurs in isolation and is frequently associated with the use of licit and illicit drugs. Users also tend to present distinct psychosocial profiles compared to non-users, including histories of trauma, body image disorders, and low self-esteem. These characteristics undermine group comparability and hinder the attribution of specific outcomes to AAS exposure. We conclude that data interpretation should be approached with caution and that future research must adopt more robust methodologies, including better user characterization and advanced strategies to control for confounders.
Keywords: Anabolic steroids, testosterone, androgens.
Introdução:
O uso não terapêutico e abusivo de esteroides anabolizantes androgênicos (EAA) têm sido amplamente relacionado a uma variedade de efeitos adversos à saúde, que variam de leves a potencialmente graves, conforme demonstrado por diversas revisões sistemáticas e estudos observacionais [1–3]. Em um estudo do tipo survey, conduzido por Parkinson AB e Evans NA (2006), envolvendo 500 usuários de EAA, apenas 0,8% dos participantes relataram não ter apresentado qualquer efeito colateral associado ao uso dessas substâncias [4].
Entre os eventos adversos mais frequentemente descritos na literatura estão: acne e oleosidade da pele, ginecomastia, alterações de humor e comportamento, disfunções sexuais, atrofia testicular, retenção hídrica, insônia, dor local nos pontos de aplicação, estrias, aumento de pelos corporais, queda de cabelo, engrossamento da voz, hipertrofia do clitóris, hipertensão arterial e alterações nos perfis lipídico e enzimático hepático [1–4].
Embora menos frequentes, efeitos adversos de maior gravidade também são relatados, com destaque para complicações cardiovasculares. Evidências observacionais têm mostrado que o uso prolongado e abusivo de EAA pode acarretar danos significativos ao sistema cardiovascular, incluindo hipertrofia ventricular esquerda, disfunção sistólica e diastólica, e casos que evoluem para insuficiência cardíaca grave [5–7].
Nesse contexto, um estudo recente, conduzido por Windfeld-Mathiasen et al. (2025) [8], acompanhou por aproximadamente 11 anos 1.189 usuários de EAA, comparando-os a um grupo controle com 59.450 indivíduos. Os resultados indicaram maior incidência de eventos cardiovasculares entre os usuários, com risco aumentado de infarto agudo do miocárdio, necessidade de intervenções como angioplastia ou cirurgia de revascularização miocárdica, além de tromboembolismo venoso, arritmias, cardiomiopatia e insuficiência cardíaca [8].
Por outro lado, autores como Goldman A. e Basaria S. [3] apontam que os desfechos mais graves associados ao uso de EAA, particularmente os cardiovasculares, são relatados predominantemente em estudos com importantes limitações metodológicas. Tais estudos incluem relatos e séries de caso, estudos retrospectivos do tipo caso-controle, pesquisas transversais e coortes observacionais não controladas.
Em linha semelhante, uma análise crítica publicada por Fanaroff AC et al. (2020) [9] enfatiza que, na ausência de ensaios clínicos randomizados com robustez metodológica, outras formas de evidência podem ser insuficientes para estimar com precisão os reais riscos e benefícios das intervenções. Em temas complexos, marcados por potenciais fatores desconhecidos ou confundidores, a interpretação baseada apenas em observações clínicas, conhecimentos anatômicos, fisiológicos ou farmacológicos pode levar a conclusões enviesadas [9].
Adicionalmente, é importante reconhecer que o estabelecimento de relações causais claras é dificultado pela não distinção entre diferentes cenários de uso dos EAA (terapêutico versus abusivo), bem como pela presença de múltiplos fatores de confusão frequentemente negligenciados. Entre esses fatores estão o uso de substâncias clandestinas e adulteradas, administração de doses extremamente elevadas (por vezes mais de 30 vezes superiores às terapêuticas), uso prolongado e ininterrupto, polifarmácia, abuso concomitante de outras drogas (lícitas ou ilícitas) e condições pré-existentes de saúde [10,11].
Diante disso, este manuscrito tem como objetivo central aprofundar, de forma narrativa e crítica, a compreensão sobre os potenciais efeitos adversos decorrentes do abuso de EAA, à luz das limitações metodológicas frequentemente presentes na literatura científica atual. Em um cenário marcado por vieses e fatores confundidores, e pela frequente ausência de distinção entre usos terapêuticos e abusivos, torna-se essencial promover uma análise mais rigorosa e contextualizada. Acredita-se que esta abordagem possa contribuir significativamente para o avanço da pesquisa científica, fomentar debates mais qualificados e oferecer suporte clínico mais consciente e fundamentado aos profissionais de saúde que atuam com usuários de EAA.
– Mercado paralelo:
Em uma revisão publicada em 2023 [12], abordamos a qualidade dos esteroides anabolizantes androgênicos (EAA) oriundos do mercado paralelo internacional e suas implicações para a pesquisa científica. A análise reuniu dados de diversos estudos envolvendo apreensões e análises laboratoriais de EAA em diferentes países, evidenciando taxas de adulteração que variaram entre 18% e 86%, incluindo contaminações por metais pesados e ausência dos princípios ativos declarados. Além dos riscos diretos à saúde, a má qualidade desses produtos representa um importante fator de confusão em estudos clínicos e relatos de casos que investigam eventos adversos supostamente relacionados ao uso de EAA. A revisão ressalta a importância de considerar a origem e a composição das substâncias utilizadas em estudos científicos, a fim de evitar conclusões enviesadas sobre a segurança e toxicidade dos EAA, especialmente em estudos não controlados [12].
Em 2024, publicamos uma segunda revisão [13], desta vez com foco exclusivo no mercado clandestino brasileiro de EAA, reunindo dados forenses de apreensões realizadas no país. O levantamento abrangeu nove estudos que analisaram, em laboratório, amostras confiscadas, revelando taxas expressivas de adulteração (variando entre 20% e 66,7%) com destaque para ausência de princípios ativos, presença de compostos não declarados, subdosagem e uso de veículos oleosos incompatíveis com aplicações farmacêuticas. Esses achados reforçam o cenário alarmante do consumo de substâncias de baixa qualidade no Brasil, particularmente em ambientes com alta prevalência de uso, como academias e centros esportivos. A revisão, à semelhança do observado em outros países, destaca o papel central dessas adulterações na amplificação dos riscos à saúde e na dificuldade de se estabelecer relações causais confiáveis em estudos observacionais e relatos de eventos adversos [13].
Em um estudo pioneiro, Ferenchick (1996) [14] avaliou a validade dos autorrelatos de uso de EAA entre praticantes de musculação, comparando os relatos dos participantes com os resultados de exames laboratoriais de urina utilizando cromatografia gasosa e espectrometria de massa (GC/MS). A sensibilidade dos autorrelatos foi de apenas 74%, e a especificidade de 82%, evidenciando que uma proporção significativa dos usuários não reportou adequadamente o uso. Além disso, 22 dos 23 indivíduos que testaram positivo apresentaram ao menos uma substância não declarada na urina, enquanto 15 participantes relataram o uso de substâncias que não foram detectadas. Esses resultados indicam não apenas a baixa confiabilidade dos autorrelatos, mas também levantam suspeitas sobre a composição dos produtos consumidos, possivelmente adulterados ou falsificados, conforme descrito anteriormente [12,13]. Os autores defendem a necessidade de validação laboratorial em estudos clínicos com EAA, a fim de evitar vieses de classificação entre usuários e não usuários e melhorar a precisão na atribuição causal de eventos adversos [14].
Apesar da reconhecida baixa qualidade de muitos desses produtos, o mercado paralelo permanece como a principal via de aquisição para a maioria dos usuários de EAA. Apenas 11,6% relatam utilizar prescrições médicas como forma de obtenção [4]. Dados observacionais mostram que 70,8% dos usuários compram de traficantes pela internet, 24,2% por meio de contatos em academias, 18,8% importam diretamente de outros países via correio, e 8,6% adquirem os produtos em farmácias online [4].
Por fim, um comentário importante, publicado por Kimergård et al. (2014) [15], já alertava para as limitações metodológicas enfrentadas em relatos clínicos que envolvem o uso de EAA provenientes do mercado ilegal. Os autores destacam que a composição desses produtos é, frequentemente, desconhecida, variando de dosagens incorretas à completa ausência da substância declarada, além da presença de contaminantes tóxicos ou combinações não autorizadas de ativos. Esses produtos são fabricados em laboratórios clandestinos, sem controle de qualidade farmacêutico, o que eleva significativamente o risco de efeitos adversos imprevisíveis. Como consequência direta, a interpretação causal de sintomas clínicos atribuídos ao uso de EAA torna-se fragilizada, uma vez que muitos pacientes sequer sabem exatamente o que utilizaram. Os autores recomendam, sempre que possível, a realização de análises laboratoriais tanto das substâncias utilizadas quanto de amostras biológicas dos usuários, como forma de validar a exposição e melhorar a acurácia diagnóstica dos casos clínicos. O viés de autorrelato e a incerteza sobre a composição dos produtos comprometem de maneira significativa a robustez científica desses relatos [15].
– Doses:
Segundo observou Evans NA (1997) [16], a média de doses suprafisiológicas utilizadas por usuários de esteroides anabolizantes androgênicos (EAA) girava em torno de 500 mg por semana, com variações entre 250 e 3.200 mg semanais (ou seja, entre 2,5 e até 32 vezes a dose terapêutica semanal recomendada, de aproximadamente 100 mg). Cerca de dez anos após essa primeira publicação, verificou-se um aumento considerável nas doses utilizadas, alcançando até 6.000 mg por semana, conforme demonstrado em um novo levantamento com 500 usuários, publicado em 2006 [4]. Nesse estudo mais recente, 59,6% dos usuários relataram utilizar doses superiores a 1.000 mg por semana, e 12,6% faziam uso de doses acima de 2.000 mg semanais (o que equivale, respectivamente, a 10 e 20 vezes a dose terapêutica recomendada) [4].
Em paralelo, diversos estudos randomizados controlados foram realizados em ambiente experimental, administrando testosterona em doses progressivas a homens jovens saudáveis. As doses variaram desde níveis subfisiológicos (25 mg por semana) até níveis seis vezes superiores à dose fisiológica (600 mg por semana) [17–23]. Esses estudos demonstram que os níveis de testosterona apresentam um padrão de resposta em “curva em U”. Quando os níveis estão baixos, há maior prevalência de sintomas associados ao hipogonadismo, como fadiga física e mental, diminuição da libido, disfunção sexual e piora da composição corporal. Por outro lado, quando os níveis estão muito elevados, aumentam os riscos de efeitos adversos, como elevação do hematócrito, aumento da pressão arterial, sobrecarga hepática, dislipidemia e alterações comportamentais [17–23].
Complementarmente, uma investigação exploratória conduzida por Abrahin et al. (2016), que avaliou o padrão de uso de EAA entre mulheres brasileiras, mostrou que 18,7% utilizavam doses entre 1.000 e 2.000 mg por semana, enquanto 4,2% relataram doses superiores a 2.000 mg por semana. Tais valores são considerados extremamente elevados, especialmente se comparados à dose de reposição masculina, o que representa, respectivamente, 10 e 20 vezes esse parâmetro [24].
Dessa forma, considerando o padrão em curva U do comportamento fisiológico da testosterona e seu impacto na saúde, é essencial, na análise de dados observacionais, separar cuidadosamente o que poderia ser atribuído ao efeito específico dos EAA daquilo que é apenas reflexo da dose utilizada. Ou seja, muitos efeitos adversos observados podem ser explicados mais por uma relação quantitativa do que por uma resposta qualitativamente diferente ao hormônio [10,11]. Isso se torna ainda mais evidente quando comparamos com estudos randomizados controlados, que seguem critérios rigorosos, como triagem de participantes com exclusão de comorbidades, controle de dieta e treinamento, uso de fármacos industriais padronizados, ausência de polifarmácia ou uso concomitante de outras substâncias lícitas ou ilícitas, além de períodos de intervenção bem definidos (como, por exemplo, 20 semanas). Nessas condições, mesmo em doses significativamente elevadas, não foram observados eventos adversos graves [10,17–23]. Já nos estudos observacionais, a ausência de controle dessas variáveis compromete fortemente a validade das conclusões sobre causalidade.
– Polifarmácia:
Uma revisão sistemática conduzida por Sagoe et al. (2015), reunindo dados de 50 estudos, trouxe um alerta relevante sobre a prática generalizada da polifarmácia entre usuários de esteroides anabolizantes androgênicos (EAA), que pode representar um fator de risco importante e frequentemente negligenciado [25]. Os autores destacam que essa associação deve ser amplamente considerada por médicos, pesquisadores e formuladores de políticas públicas em saúde. Foi identificado o uso concomitante de diversas classes farmacológicas durante os ciclos com EAA, incluindo analgésicos, anti-inflamatórios, opioides, estimulantes e depressores do sistema nervoso central, diuréticos, drogas cosméticas (como as dermatológicas), medicamentos cardiovasculares, drogas recreativas e outros hormônios [25].
Além disso, autores como Parkinson e Evans [4] também mapearam esse padrão e categorizam os medicamentos usados em conjunto com os EAA em quatro principais grupos: (a) hormônios anabólicos acessórios, como GH, insulina e IGF-1; (b) estimulantes, como efedrina, anfetamina, hormônios tireoidianos, ioimbina e dinitrofenol; (c) fármacos diversos, como diuréticos, relaxantes musculares e analgésicos; e (d) medicamentos voltados à mitigação dos efeitos colaterais, incluindo citrato de clomifeno, antiaromatases, tamoxifeno e gonadotrofina coriônica humana (HCG).
Entre as usuárias do sexo feminino, também se observa essa tendência de uso concomitante de substâncias adicionais. Dados de Abrahin et al. (2016) [24] apontam uma prevalência de 18,7% para uso conjunto de diuréticos, 2,1% de efedrina e 2,1% de clembuterol. Além disso, observou-se, ao longo do tempo, não apenas um aumento nas doses de EAA, mas também na frequência e intensidade do uso de fármacos acessórios. Em 1997, por exemplo, registrava-se o uso de GH (12%), insulina (2%) e hormônios tireoidianos (2%) [16]. Já em 2006, esses valores haviam aumentado para 25%, 25% e 45%, respectivamente [4].
É importante destacar que muitas dessas substâncias acessórias, quando utilizadas de forma abusiva e sem supervisão médica, podem apresentar risco ainda maior que os próprios EAA. Drogas como insulina, tiroxina, diuréticos e estimulantes possuem elevado potencial para precipitar emergências clínicas, incluindo hipoglicemia, arritmias, distúrbios psiquiátricos e cardiovasculares graves [26].
Ainda assim, os efeitos colaterais gerados pelo abuso de EAA não costumam ser percebidos como um freio ao seu uso contínuo e progressivo. Em vez disso, muitos usuários optam por se automedicar com outras substâncias com o intuito de minimizar os efeitos adversos, ao invés de reduzir ou interromper o uso dos EAA [4,26].
Em resumo, é frequente a associação de múltiplas drogas potencialmente perigosas aos ciclos de EAA, o que compromete a capacidade de atribuir causalidade a um único agente. Em muitos estudos observacionais, os usuários são tratados como um grupo homogêneo (“usuários de EAA”), comparado a um grupo de “não usuários”. No entanto, o uso de EAA quase nunca ocorre de forma isolada. Essa limitação metodológica torna as conclusões sobre efeitos adversos específicos potencialmente inadequados se a polifarmácia não for devidamente considerada nas análises [4,16,24–26].
– Abuso conjunto de substâncias lícitas e ilícitas:
Sagoe et al. (2015) [25] observaram que o uso concomitante de substâncias lícitas e ilícitas é uma realidade amplamente presente entre usuários de esteroides anabolizantes androgênicos (EAA). Dentre essas substâncias, destacam-se o álcool, tabaco, maconha, cocaína, alucinógenos, heroína, inalantes, LSD e metanfetamina. De forma semelhante, o estudo “The Anabolic 500 Survey”, conduzido por Ip et al. (2011) [27], por meio de um questionário com 99 itens, identificou altas taxas de uso paralelo de outras drogas entre usuários de EAA: 47,2% relataram uso de álcool, 22,9% de tabaco, 30,6% de maconha, 3,0% de heroína e 11,3% de cocaína nos 12 meses anteriores à pesquisa. Entre mulheres, dados de Abrahin et al. (2016) [24] mostraram padrões semelhantes, com 29,2% relatando uso concomitante de álcool e 10,4% de tabaco.
Diversos estudos sugerem que, em muitos casos, o uso abusivo de EAA é precedido por um histórico de consumo de outras substâncias psicoativas. A revisão de Sagoe et al. (2015) [25] corrobora esse padrão, e dados adicionais indicam que usuários de EAA frequentemente já fizeram uso anterior de álcool [28,29], maconha [28,29], opioides [26], heroína [30] e cocaína [28,29].
Além disso, o uso de recursos ergogênicos (Performance Enhancing Drugs — PEDs) é extremamente prevalente entre esses indivíduos. O estudo de Ip et al. (2011) [27], por exemplo, revelou que usuários de EAA relataram utilizar, em média, 11,1 diferentes substâncias (com um máximo de até 29) quando considerados EAA e outros PEDs em conjunto. Mesmo desconsiderando os EAA, os participantes ainda relataram o uso de 8,9 substâncias diferentes (com máximo de 28), número significativamente superior ao reportado por não usuários.
Com base nesses achados, é possível afirmar com segurança que o abuso de EAA raramente ocorre de forma isolada. O cenário mais comum é o de uso combinado de múltiplos recursos ergogênicos, substâncias lícitas (como álcool, tabaco e opioides) e ilícitas (como cocaína e heroína) [26–30]. Vale lembrar que essas substâncias, por si só, já representam riscos significativos à saúde, os quais se amplificam com o aumento da dose e do tempo de uso. Essa complexa interação farmacológica dificulta a atribuição clara de causalidade entre os EAA e os eventos adversos observados, uma vez que os efeitos podem resultar de sobreposição ou sinergismo entre múltiplas substâncias [26].
Portanto, esse fator deve ser considerado de forma criteriosa na análise de estudos observacionais. Contudo, observa-se que, em grande parte da literatura, os grupos são classificados apenas como “usuários” e “não usuários” de EAA, ignorando a complexidade do uso concomitante. Essa limitação metodológica compromete a validade de conclusões sobre os efeitos adversos atribuídos exclusivamente aos EAA, e evidencia a necessidade de maior refinamento analítico em pesquisas futuras.
– Antecedentes de saúde e psicosociais:
A investigação sobre os fatores que motivam o uso abusivo de esteroides anabolizantes androgênicos (EAA) têm revelado que essa prática, muitas vezes, está inserida em um contexto mais amplo de vulnerabilidades psíquicas e sociais. Diversos estudos apontam que a população usuária de EAA apresenta particularidades que a distinguem significativamente do grupo de não usuários, especialmente em termos de saúde mental, histórico de traumas e percepção corporal distorcida [31].
Uma revisão sistemática conduzida por Sagoe et al. (2014) [31] demonstrou que, entre os usuários de EAA, há uma prevalência aumentada de histórico de anorexia, vigorexia, baixa autoestima, imagem corporal negativa, transtornos psíquicos, uso de drogas e eventos traumáticos como bullying, estupro e divórcio. Esses fatores parecem compor um perfil de risco que antecede o início do uso dessas substâncias [31].
Dados do estudo de Ip et al. (2011) [27] corroboram essa tendência: 6,1% dos participantes relataram histórico de abuso sexual, e 10,0% de abuso físico. De modo semelhante, Gruber e Pope (1999) [32], ao avaliarem 75 mulheres praticantes de levantamento de peso, identificaram que 13% tinham histórico de estupro, o que levou muitas delas a iniciar um padrão compulsivo de treinamento físico, culminando na adoção de substâncias ergogênicas como EAA e clenbuterol. Dentre essas mulheres, 70% passaram a utilizar esses recursos com o objetivo de modificar seu corpo e aumentar o desempenho físico [32].
Em outro estudo de revisão, Harmer (2010) [33] argumenta que o uso de EAA iniciado na adolescência está mais associado a um conjunto de distúrbios comportamentais do que a motivações voltadas exclusivamente ao desempenho esportivo. Corroborando essa ideia, uma pesquisa norueguesa com 1.351 estudantes [34] apontou, por meio de análise de regressão logística, que o uso de álcool, a presença de sintomas de ansiedade e depressão, bem como o uso de drogas ilícitas, foram os principais preditores para o uso de EAA, indicando que esse comportamento pode estar integrado a um padrão mais amplo de risco.
Estudo semelhante realizado por pesquisadores suecos (Kindlundh et al., 2001) [35] com 1.353 estudantes identificou, também por regressão logística, associações significativas entre o uso de EAA e status de imigrante, baixo desempenho escolar, baixa autoestima e uso de substâncias como álcool, sedativos e tranquilizantes. Esses achados reforçam a tese de que, para muitos indivíduos, o uso de EAA não é motivado apenas por objetivos atléticos, mas por questões subjacentes de ordem psicológica e social.
Além disso, algumas motivações de uso relatadas pelos próprios usuários reforçam esse cenário, onde o “aumento da agressividade”, para “proteção pessoal” e para “aceitação social” são frequentemente citadas [27]. Notavelmente, 8,9% dos entrevistados relataram utilizar EAA de forma secreta, ocultando essa prática até mesmo de pessoas próximas como parentes de primeiro grau e cônjuges.
Diante desses dados, torna-se evidente que os usuários de EAA constituem uma população com características psicossociais e clínicas próprias, que os diferenciam substancialmente dos não usuários. Dessa forma, análises observacionais que comparam esses dois grupos, considerando apenas a presença ou ausência de uso de EAA como a principal variável de distinção, correm o risco de negligenciar importantes confundidores. Tal omissão pode comprometer a interpretação dos achados, sobretudo em desfechos relacionados à saúde mental (como ansiedade, depressão e suicídio) e a comportamentos sociais de risco (como agressividade, violência e abuso de substâncias).
O complexo cenário que envolve o abuso de EAA e os potenciais vieses principais que podem comprometer as conclusões de desfechos adversos em saúde (efeitos colaterais e eventos adversos graves) estão ilustrados, para melhor compreensão na Figura 1, a seguir.
Figura 1 – Principais viéses do cenário de abuso de EAA
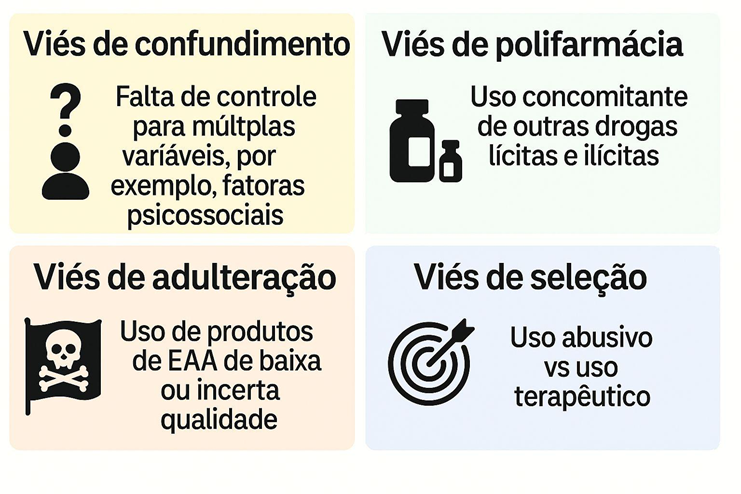
Conclusão:
A relação entre o uso de esteroides anabolizantes androgênicos (EAA) e seus potenciais efeitos adversos sobre a saúde ainda apresenta importantes lacunas metodológicas que precisam ser reconhecidas com clareza. Apesar da ampla documentação desses efeitos em estudos observacionais, a atribuição direta de causalidade permanece limitada por uma série de fatores que frequentemente não são devidamente controlados nas análises. Entre os mais relevantes, destacam-se a utilização de substâncias oriundas do mercado paralelo (muitas vezes adulteradas e contaminadas), o uso concomitante de diversas drogas (a chamada polifarmácia), e os históricos clínicos e psicossociais frequentemente complexos dos usuários.
Esses elementos sugerem que a população usuária de EAA possui características suficientemente distintas para que comparações diretas com não usuários, como as comumente vistas em estudos observacionais, sejam interpretadas com cautela. Em muitos casos, esses dois grupos não são verdadeiramente comparáveis, o que pode levar a conclusões enviesadas sobre os reais efeitos dos EAA.
Diante disso, é fundamental que estudos futuros avancem não apenas em termos de desenho metodológico, mas também no aprofundamento da caracterização dos usuários, levando em conta variáveis sociais, comportamentais e contextuais. O uso de validações laboratoriais, a distinção clara entre diferentes padrões de consumo, e o controle para múltiplos fatores de confusão são etapas indispensáveis para o aprimoramento das evidências disponíveis. Somente com esse olhar mais amplo e cuidadoso será possível compreender, de forma mais precisa, os riscos associados ao uso de EAA e orientar práticas clínicas e políticas de saúde com maior responsabilidade.
Referências:
1 – Albano GD, Amico F, Cocimano G, Liberto A, Maglietta F, Esposito M, Rosi GL, Di Nunno N, Salerno M, Montana A. Adverse Effects of Anabolic-Androgenic Steroids: A Literature Review. Healthcare (Basel). 2021 Jan 19;9(1):97. doi: 10.3390/healthcare9010097.
2 – Frati P, Busardò FP, Cipolloni L, Dominicis ED, Fineschi V. Anabolic Androgenic Steroid (AAS) related deaths: autoptic, histopathological and toxicological findings. Curr Neuropharmacol. 2015 Jan;13(1):146-59. doi: 10.2174/1570159X13666141210225414.
3 – Goldman A, Basaria S. Adverse health effects of androgen use. Mol Cell Endocrinol. 2018 Mar 15;464:46-55. doi: 10.1016/j.mce.2017.06.009.
4 – Parkinson AB, Evans NA. Anabolic androgenic steroids: a survey of 500 users. Med Sci Sports Exerc. 2006 Apr;38(4):644-51. doi: 10.1249/01.mss.0000210194.56834.5d.
5 – Baggish AL, Weiner RB, Kanayama G, Hudson JI, Picard MH, Hutter AM Jr, et al. Long-term anabolic-androgenic steroid use is associated with left ventricular dysfunction. Circ Heart Fail. 2010 Jul;3(4):472-6. doi: 10.1161/CIRCHEARTFAILURE.109.931063.
6 – Abdullah R, Bjørnebekk A, Hauger LE, Hullstein IR, Edvardsen T, Haugaa KH, et al. Severe biventricular cardiomyopathy in both current and former long-term users of anabolic-androgenic steroids. Eur J Prev Cardiol. 2024 Mar 27;31(5):599-608. doi: 10.1093/eurjpc/zwad362.
7 – Rasmussen JJ, Schou M, Madsen PL, Selmer C, Johansen ML, Ulriksen PS, et al. Cardiac systolic dysfunction in past illicit users of anabolic androgenic steroids. Am Heart J. 2018 Sep;203:49-56. doi: 10.1016/j.ahj.2018.06.010.
8 – Windfeld-Mathiasen J, Heerfordt IM, Dalhoff KP, Trærup Andersen J, Andersen MA, Johansson KS, Biering-Sørensen T, Olsen FJ, Horwitz H. Cardiovascular Disease in Anabolic Androgenic Steroid Users. Circulation. 2025 Feb 13. doi: 10.1161/CIRCULATIONAHA.124.071117.
9 – Fanaroff AC, Califf RM, Harrington RA, et al. Randomized Trials Versus Common Sense and Clinical Observation: JACC Review Topic of the Week. J Am Coll Cardiol. 2020 Aug 4;76(5):580-589. doi: 10.1016/j.jacc.2020.05.069.
10 – Câmara L C. Possible Scenarios of Testosterone and Anabolic Androgenic Steroids Use in and Outside Medicine. J. Adv. Med. Med. Res. 2024, 36, 346-352. Doi: 10.9734/jammr/2024/v36i115646
11 – Câmara LC. Complexities in Assessing Health Risks of Anabolic Steroid Abuse. J. Adv. Med. Pharm. Sci. 2024, 26, 151-153. doi: 10.9734/jamps/2024/v26i12740
12 – Câmara LC. Anabolic Androgenic Steroids from Underground Market: Drug Quality and Implications for Research. Asian J. Res. Med. Pharm. Sci. 2023, 12 (3):59-64. doi.org/10.9734/ajrimps/2023/v12i3221.
13 – Câmara, L. C. Counterfeit Anabolic Steroids in Brazil: A Forensic Perspective on Quality and Risks. J. Pharm. Res. Int. 2024, 36, 130-139.
14 – Ferenchick GS. Validity of self-report in identifying anabolic steroid use among weightlifters. J Gen Intern Med. 1996 Sep;11(9):554-6. doi: 10.1007/BF02599607.
15 – Kimergård A, Breindahl T, Hindersson P, McVeigh J. The composition of anabolic steroids from the illicit market is largely unknown: implications for clinical case reports. QJM. 2014 Jul;107(7):597-8. doi: 10.1093/qjmed/hcu101.
16 – Evans NA. Gym and tonic: a profile of 100 male steroid users. Br J Sports Med. 1997 Mar;31(1):54-8. doi: 10.1136/bjsm.31.1.54. PMID: 9132214.
17 – Bhasin S, Travison TG, Storer TW, Lakshman K, Kaushik M, Mazer NA, et al. Effect of testosterone supplementation with and without a dual 5α-reductase inhibitor on fat-free mass in men with suppressed testosterone production: a randomized controlled trial. JAMA. 2012 Mar 7;307(9):931-9. doi: 10.1001/jama.2012.227.
18 – Coviello AD, Lakshman K, Mazer NA, Bhasin S. Differences in the apparent metabolic clearance rate of testosterone in young and older men with gonadotropin suppression receiving graded doses of testosterone. J Clin Endocrinol Metab. 2006 Nov;91(11):4669-75. doi: 10.1210/jc.2006-0822.
19 – Bhasin S, Storer TW, Berman N, Callegari C, Clevenger B, Phillips J, et al. The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men. N Engl J Med. 1996 Jul 4;335(1):1-7. doi: 10.1056/NEJM199607043350101.
20 – Bhasin S, Woodhouse L, Casaburi R, Singh AB, Bhasin D, Berman N, et al. Testosterone dose-response relationships in healthy young men. Am J Physiol Endocrinol Metab. 2001 Dec;281(6):E1172-81. doi: 10.1152/ajpendo.2001.281.6.E1172.
21 – Storer TW, Magliano L, Woodhouse L, Lee ML, Dzekov C, Casaburi R, Bhasin S. Testosterone dose-dependently increases maximal voluntary strength and leg power, but does not affect fatigability or specific tension. J Clin Endocrinol Metab. 2003 Oct;88(10):1478-85. doi: 10.1210/jc.2002-021231
22 – Sinha-Hikim I, Roth SM, Lee MI, Bhasin S. Testosterone-induced increase in muscle size in healthy young men is associated with muscle fiber hypertrophy. Am J Physiol Endocrinol Metab. 2002 Jan;283(1):E154-64. doi: 10.1152/ajpendo.00502.2001.
23 – Singh AB, Hsia S, Alaupovic P, Sinha-Hikim I, Woodhouse L, Buchanan TA, et al. The effects of varying doses of testosterone on insulin sensitivity, plasma lipids, apolipoproteins, and C-reactive protein in healthy young men. J Clin Endocrinol Metab. 2002 Aug;87(8):3624-32. doi: 10.1210/jcem.87.8.8762.
24 – Abrahin O, Félix Souza NS, de Sousa EC, Santos AM, Bahrke MS. Anabolic–androgenic steroid use among Brazilian women: an exploratory investigation. J Subst Use. 2016;22(3):246–52. doi:10.1080/14659891.2016.1179806
25 – Sagoe D, McVeigh J, Bjørnebekk A, Essilfie MS, Andreassen CS, Pallesen S. Polypharmacy among anabolic-androgenic steroid users: a descriptive metasynthesis. Subst Abuse Treat Prev Policy. 2015 Mar 15;10:12. doi: 10.1186/s13011-015-0006-5.
26 – Evans NA. Current concepts in anabolic-androgenic steroids. Am J Sports Med. 2004 Mar;32(2):534-42. doi: 10.1177/0363546503262202.
27 – Ip EJ, Barnett MJ, Tenerowicz MJ, Perry PJ. The Anabolic 500 survey: characteristics of male users versus nonusers of anabolic-androgenic steroids for strength training. Pharmacotherapy. 2011 Aug;31(8):757-66. doi: 10.1592/phco.31.8.757.
28 – Fudala PJ, Weinrieb RM, Calarco JS, Kampman KM, Boardman C. An evaluation of anabolic-androgenic steroid abusers over a period of 1 year: seven case studies. Ann Clin Psychiatry. 2003 Jun;15(2):121-30. doi: 10.1023/a:1024640410093.
29 – Kanayama G, Pope HG, Cohane G, Hudson JI. Risk factors for anabolic-androgenic steroid use among weightlifters: a case-control study. Drug Alcohol Depend. 2003 Jul 20;71(1):77-86. doi: 10.1016/s0376-8716(03)00069-3.
30 – Cornford CS, Kean J, Nash A. Anabolic-androgenic steroids and heroin use: a qualitative study exploring the connection. Int J Drug Policy. 2014 Sep;25(5):928-30. doi: 10.1016/j.drugpo.2014.06.002.
31 – Sagoe D, Andreassen CS, Pallesen S. The aetiology and trajectory of anabolic-androgenic steroid use initiation: a systematic review and synthesis of qualitative research. Subst Abuse Treat Prev Policy. 2014 Jul 2;9:27. doi: 10.1186/1747-597X-9-27.
32 – Gruber AJ, Pope HG Jr. Compulsive weight lifting and anabolic drug abuse among women rape victims. Compr Psychiatry. 1999 Jul-Aug;40(4):273-7. doi: 10.1016/s0010-440x(99)90127-x.
33 – Harmer PA. Anabolic-androgenic steroid use among young male and female athletes: is the game to blame? Br J Sports Med. 2010 Jan;44(1):26-31. doi: 10.1136/bjsm.2009.068924.
34 – Pallesen S, Jøsendal O, Johnsen BH, Larsen S, Molde H. Anabolic steroid use in high school students. Subst Use Misuse. 2006;41(13):1705-17. doi: 10.1080/10826080601006367.
35 – Kindlundh AM, Hagekull B, Isacson DG, Nyberg F. Adolescent use of anabolic-androgenic steroids and relations to self-reports of social, personality and health aspects. Eur J Public Health. 2001 Sep;11(3):322-8. doi: 10.1093/eurpub/11.3.322.
1Departamento de Especialização em Anabolismo Clínico. Faculdade de Governança, Engenharia e Educação de São Paulo – FGE – SP, Brasil. Diretor científico da Sociedade Brasileira de Endocrinologia e Metabologia do Exercício e do Esporte. E-mail: lucascc_med@hotmail.com. https://orcid.org/0000-0001-6329-2897
2Diretor da Sociedade Brasileira de Endocrinologia e Metabologia do Exercício e do Esporte. E-mail: pinto.vianadiogo@gmail.com. https://orcid.org/0009-0009-9245-2509
3Presidente da Sociedade Brasileira de Endocrinologia e Metabologia do Exercício e do Esporte. https://orcid.org/0009-0004-3418-8870. E-mail: lucio.endocrinology@yahoo.com
