EVALUATION OF APIS MELLIFERA L. PROPOLIS EXTRACT IN THE PRESERVATION OF FRESH STRAWBERRIES AGAINST CONTAMINATING FUNGI.
REGISTRO DOI: 10.69849/revistaft/fa10202504162128
Aderson Fernandes de Olivera Júnior1,
Francisco Jailson Bezerra Júnior2,
Marcelino Gevilbergue Viana3
RESUMO
A contaminação microbiológica de alimentos representa perdas econômicas significativas para a indústria e novas medidas de prevenção e controle vêm sendo desenvolvidas. O Brasil é um dos grandes produtores mundiais de morango, pseudofruto de fácil cultivo e que agrega valor aos pequenos e grandes produtores. Embora seja muito cultivado, suas características são propícias para o desenvolvimento de vários tipos de microrganismos, principalmente fungos, que podem agir na contaminação e degradação do morango. O objetivo deste trabalho foi avaliar a ação do extrato da própolis de Apis mellifera L. na prevenção de crescimento fúngico em morangos in natura. O extrato da própolis foi obtido e posteriormente testes foram realizados para saber se possuía alguma contaminação microbiológica que afetasse diretamente nos resultados obtidos após a realização dos tratamentos. O extrato de própolis de A. mellifera L. foi inicialmente dissolvido em água esterilizada deionizada nas seguintes proporções: 1:9; 2:8 e 3:7ml de água, consistindo assim em três tratamentos. O delineamento experimental consistiu em quatro repetições por tratamento, sendo cada repetição formada por uma placa de Petri com três morangos. Após o período de contato de cada tratamento por 96 horas os morangos foram, a priori, observados para a identificação de crescimento fúngico e encaminhados para a quantificação das unidades formadoras de colônias fúngicas (UFC). Depois de passada as 96 horas, foi evidentemente nítido o crescimento de fungos contaminantes. Logo, o extrato de própolis não se mostrou capaz de mitigar a degradação fúngica, não tendo assim, eficácia na atividade preventiva.
PALAVRAS-CHAVE: Preventiva, Degradação, Perdas econômicas significativas.
ABSTRACT
Microbiological contamination of food represents significant economic losses for the industry and new prevention and control measures have been developed. Brazil is one of the world’s largest producers of strawberries, a pseudofruit that is easy to grow and adds value to small and large producers. Although it is widely cultivated, its characteristics are conducive to the development of different types of microorganisms, mainly fungi, which can act to contaminate and degrade the strawberry. The objective of this work was to evaluate the action of Apis mellifera L. propolis extract in preventing fungal growth in fresh strawberries. The propolis extract was obtained and tests were subsequently carried out to find out if there was any microbiological contamination that directly affected the results obtained after carrying out the treatments. The A. mellifera L. propolis extract was initially dissolved in sterilized deionized water in the following proportions: 1:9; 2:8 and 3:7 ml of water, thus consisting of three treatments. The experimental design consisted of four replications per treatment, with each replication consisting of a Petri dish with three strawberries. After the contact period of each treatment for 96 hours, the strawberries were, a priori, observed to identify fungal growth and sent for quantification of fungal colony forming units (CFU). After 96 hours, the growth of contaminating fungi became evident. Therefore, propolis extract was not able to attenuate fungal degradation and is therefore not effective in preventive activity.
KEYWORDS: Preventive, Degradation, Significant economic losses.
1 INTRODUÇÃO
A preservação de alimentos à contaminação por microrganismos é um dos principais desafios da indústria, seja por ter que garantir a ótima qualidade do alimento da produção à mesa do consumidor, como também pelo viés econômico em usar substâncias químicas e outros tipos de antimicrobianos expansivos e de impacto indireto na saúde da população. No contexto da agroindústria, a comercialização de frutas e sua preservação é ainda mais importante por se tratar de alimentos perecíveis, de manuseio delicado e cuidadoso, e de fácil contaminação por microrganismos. Estima-se que centenas de toneladas de frutas sejam perdidas por contaminação microbiana por ano em todo o mundo (FAO, 2021), o que gera impactos significativos no setor e o leva a novas perspectivas de tecnologias de controle ou mitigação do impacto.
O morango (Fragaria x ananassa Duchesne) é uma fruta amplamente produzida no mundo, sendo a China, Estados Unidos e Egito os maiores produtores (SINGH, KRISHAN & SRAN, 2023). O cultivo de morango no Brasil está concentrado nos estados do Rio Grande do Sul, de São Paulo e de Minas Gerais, mas, atualmente, as áreas da cultura dessa fruta vêm se expandindo por outros estados, tendo alcançado a produção de 105 mil toneladas de morango, o que corresponde a 33% de toda a produção da América Latina (ANTUNES, JÚNIOR e SCHWENGBER, 2016). A produtividade e a qualidade do morango são influenciadas por alguns fatores, como: fotoperíodo, temperatura, pelo período de dormência, por pragas e doenças na planta, condições do solo, adubação, umidade do ar e do solo (UENO, 2004), tempo de conservação no mercado – tempo de prateleira (JUNKES & GROFF, 2020), além da contaminação por fungos e bactérias no fruto (VALENZUELA et al., 2015), o que leva à sua rápida degradação e inviabilidade comercial.
Dentre os principais microrganismos contaminantes do fruto, os fungos se destacam pela rápida propagação e consequente alta taxa de degradação em curto período. Gêneros e espécies de fungos filamentosos e leveduras, como Fusarium, Botrytis cinerea, Colletotrichum spp., Rhizopus stolonifer, Phytophthora cactorum, entre outros (ANTUNES, JÚNIOR e SCHWENGBER, 2016) são frequentemente identificados gerando degradação do morango in natura após a colheita e durante o seu tempo de prateleirA (PONCE et al., 2010).
O morango é uma fruta perecível e de fácil contaminação microbiológica, procedimentos mínimos devem ser adotados para garantir sua qualidade ao mercado, como uso de substância químicas, manuseio com práticas de cuidados antimicrobianos, rápida embalagem, uso de atmosfera modificada, além de material adequado para a conservação, como bandejas. O constante uso de agrotóxicos nos países como, Brasil, Chile, México e Índia, acaba provocando não só a contaminação do solo, como também da água e dos trabalhadores rurais (ECOBICHON, 2001). Diante disso, surge uma necessidade de substituir esses produtos químicos por novas maneiras de controle que não afetem tanto o meio ambiente e o ser humano, dentre as substâncias com potencial na conservação, a própolis se destacaria por suas funções imunobiológicas e antimicrobianas. A própolis bruta apresenta agregados de substâncias químicas (ácidos e ésteres alifáticos, ácidos e ésteres aromáticos, açúcares, álcoois, aldeídos, ácidos graxos, aminoácido) com ampla ação medicinal e terapêutica (MENEZES, 2005), que sofre variação de acordo com influências ambientais e edáficas existentes ao redor da colmeia (KUMAZAWA et al., 2004.). Dentre suas inúmeras propriedades a ação antimicrobiana, em específica a antifúngica, é relatada sobre ação de vários gêneros patológicos (WOLSKA e ANTOSIK, 2023) e de importância econômica, como Candida albicans (HEGAZI et al., 2000), Fusarium sp. e Aspergillus sp (PETRUZZI et al., 2020). O uso da própolis contra fungos fitopatogênicos ou degradantes de frutos é ainda uma proposta inusitada, visto que na literatura, a maioria dos trabalhos são relacionados às espécies fúngicas patogênicas (ZULHENDRI et al., 2021).
Dessa forma, o objetivo central deste trabalho foi avaliar a ação do extrato da própolis de Apis mellifera L. na inibição de crescimento fúngico em morangos in natura, evitando assim a degradação.
MATERIAL E MÉTODOS
2.1. Obtenção do extrato da própolis de A. mellifera.
A própolis de A. mellifera foi obtida em uma propriedade rural no município de Pau dos Ferros-RN, com a utilização de coletores TP (tira e põe). A coleta da própolis foi feita através de uma faca com o gume contrário, e posteriormente colocada dentro de sacos plásticos no congelador, sendo retirada apenas para a diluição em álcool. O extrato foi produzido em Janeiro de 2023 e armazenado em geladeira a 4oC. A mistura foi agitada a cada três dias em temperatura ambiente, por um período de cerca de 45 dias para que a própolis pudesse ser extraída. Após esse período, o extrato foi filtrado com auxílio de filtro de papel. As porcentagens constituintes do extrato corresponderam a 70% de álcool cereais e 30% de própolis bruta, sendo deste valor, 11% de extrato seco, atendendo ao regulamento do Ministério da Agricultura (Instrução Normativa n. 3, de 19 de janeiro de 2001) que determina que o extrato deve ter, no mínimo, 11% de extrato seco (ES), também denominado sólidos solúveis totais (SST).
2.2 Teste de contaminação microbiológica do extrato de própolis de A. mellifera.
Após a obtenção, o extrato de própolis foi submetido ao teste de contaminação microbiológica para garantir a seguridade dos demais testes. Utilizou-se de 500 μL do extrato adicionado no centro de placas de Petri contendo meio batata-dextrose-ágar (BDA), sendo espalhados e incubados em BOD a ±29o C, por 48 horas. O teste foi feito em triplicata, sendo o crescimento microbiano avaliado após o período de incubação.
2.3 Avaliação preventiva de crescimento fúngico do extrato da própolis de A. mellifera.
Os morangos foram adquiridos in natura e separados em três unidades, devidamente pesados (40g) e postos em placas de Petri esterilizadas (Figura 01). Os pseudofrutos foram observados em relação à presença de fungos contaminantes antes de iniciar os ensaios, sendo os contaminados descartados.

Figura 01: Morangos in natura distribuídos em placas de Petri.
O extrato de própolis de A. mellifera foi inicialmente dissolvido em água esterilizada deionizada nas seguintes proporções: 1:9; 2:8 e 3:7 ml de água, consistindo assim em três tratamentos. Após a diluição, cada tratamento foi separadamente reservado em recipiente spray com a respectiva capacidade, mais o controle (água destilada).
O delineamento experimental consistiu em quatro repetições por tratamento, sendo cada repetição formada por uma placa de Petri com três morangos. Cada tratamento foi aplicado sobre os morangos na forma de spray em cada placa, sendo posteriormente fechadas e deixadas em tempo de contato de 96 horas (quatro dias), considerado como tempo de prateleira (Figura 02). Após esse período foi avaliado a presença ou ausência do crescimento de fungos filamentosos do tipo bolor.

Figura 02:Experimento montado
2.4 Avaliação antifúngica do extrato da própolis de A. mellifera.
Após o período de contato de cada tratamento por 96 horas os morangos foram, a priori, observados para a identificação de crescimento fúngico e encaminhados para a quantificação das unidades formadoras de colônias fúngicas (UFC). Os testes para a quantificação deram-se a partir da maceração dos morangos de cada repetição com água destilada esterilizada, sendo retiradas alíquotas de 500μL, depositadas no centro de placas de Petri contendo meio batata-dextrose-ágar (BDA) e espalhadas com alça de Drigalsky. Cada placa foi armazenada em BOD, à ±29oC, por 48 horas. Após esse período foi realizada a quantificação das colônias de fungos filamentos e de leveduras.
3 RESULTADOS E DISCUSSÃO
3.1. Teste de contaminação microbiológica do extrato de própolis de A. mellifera.
Nenhum crescimento microbiano foi verificado no teste de contaminação microbiológica do extrato (Figura 03), estando assegurado para os demais ensaios de atividade antimicrobiana.

Figura 03: Ausência de crescimento microbiano nos testes de contaminação do extrato de própolis de A. mellifera L.
3.2 Atividade preventiva do extrato da própolis de A. mellifera sobre crescimento fúngico.
O extrato da própolis de A. mellifera L. não foi efetivo na prevenção do crescimento de fungos em nenhum tratamento avaliado após o período de 96 horas de contato, não diferindo do controle (água deionizada). Houve crescimento visível de fungos filamentosos contaminantes do tipo bolor em todos os tratamentos avaliados (Figura 04).

Figura 04: Presença de fungos filamentosos (bolor) nos tratamentos avaliados: (a) controle (água destilada); (b) tratamento com 1 mL; (c) tratamento com 2 mL e (d) tratamento com 3 mL de extrato da própolis.
3.3 Avaliação antifúngica do extrato de própolis de A. mellifera pelo método de UFC.
Os dados mostraram que o extrato de própolis de A. mellifera não teve ação antifúngica em nenhum tratamento avaliado em 96 horas de tempo de contato, não diferindo estatisticamente do controle (Tukey a 5%) (Tabela 01).
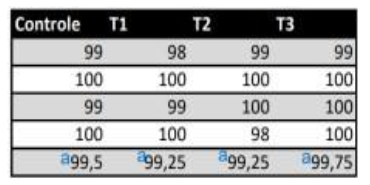
Tabela 01: Obtenção das médias (%) de unidade formadoras de colônias de fungos (UFC) após 96 horas de contato com cada tratamento do extrato da própolis de A. mellifera. Teste de Tukey (0.05%): mesmas letras não diferem estatisticamente.
É sabido também que as substâncias químicas presentes no extrato atuam em sinergismo para resultar em sua atividade (PARK et al. 2004), o que pode ter interferido nesse caso quando há substâncias mais predominantes sem atividade antifúngica. Diferentemente, em outros trabalhos, o extrato de própolis de A. mellifera apresentou ação antifúngica contra leveduras patogênicas do gênero Candida (TOBALDINI-VALERIO et al., 2016) e sobre espécies de fungos filamentosos do gênero Fusarium, mostrando-se efetivo em inibir seu crescimento (DAVARI & EZAZI, 2022). Entretanto, sobre fungos fitopatogênicos ou contaminantes de alimentos os trabalhos avaliando a própolis ainda são poucos ou inexistentes. Compostos naturais com composição química bastante parecida com a própolis tiveram ação contra fungos fitopatogênicos (CURIFUTA et al., 2012; TEMIZ et al., 2013), o que sugere que em novos ensaios com diferentes metodologias podem ter resultados efetivos com uso do extrato da própolis de A. mellifera L.
4 CONCLUSÃO
O extrato de própolis de A. mellifera não demonstrou atividade preventiva contra o crescimento de fungos contaminantes de morango e nenhuma ação antifúngica após 96 horas de contato em diferentes concentrações na metodologia aqui avaliada. Novos ensaios podem ser realizados em concentrações mais elevadas da própolis na perspectiva de melhores resultados ou utilizando outros protocolos metodológicos.
5 Referências
ANTUNES, JÚNIOR; LUIS EDUARDO CORRÊA, REISSER; SCHWENGBER, JOSÉ ERNANI. (Editores Técnicos). MORANGUEIRO. Brasília, DF: Embrapa Clima Temperado, 2016.
ARAUJO, DENISE NUNES; BOIAGO, MARCEL MANENTE; FRANÇA, ARIELI ZIBETTI;
LÓPEZ GARCIA, PATRÍCIA RODRIGUES ANTELO; STEFANI, LENITA DE CÁSSIA MOURA. Própolis: diferentes tipos de uso. Política, ed. 245, ano 12, 21/05/2020. Acadêmicas do Curso de Mestrado em Zootecnia – UDESC Oeste.
ATANASOV, A.G., ZOTCHEV, S.B., DIRSCH, V.M. et al. Natural products in drug discovery: advances and opportunities. Nat Rev Drug Discov 20, 200–216 (2021). https://doi.org/10.1038/s41573-020-00114-z.
BARBOSA, MARCELO SOUSA. Uso de substâncias alternativas no controle do fungo Colletotrichum musae na bananeira. 2013. 18 f. Dissertação (Curso de Agronomia) -Universidade Estadual de Mato Grosso do Sul, Unidade Universitária de Cassilândia,Cassilândia-MS, junho de 2013.
CIRASINO, L.; PISATI, A.; FASANI, F. Contact dermatitis from propolis. Contact Dermatitis, v.16, n.2, p.110-111, 1987.
CURIFUTA, M., VIDAL, J., SALAZAR, L. A., SANCHEZ-VENEGAS, , ALVEAR, M.,
CONTRERAS, A. (2012). The in vitro antifungal evaluation of a commercial extract of Chilean propolis against six fungi of agricultural importance. Ciencia e Investigación Agraria, 39(2),347359.
DAROLT, MOACIR ROBERTO. Morango orgânico: opção sustentável para produtores, consumidores e meio ambiente. In: A produção de morangos no Brasil. Acesso em 17, 2017.
DAVARI, M., EZAZI, R. Mycelial inhibitory effects of antagonistic fungi, plant essential oils and propolis against five phytopathogenic Fusarium species. Arch Microbiol 204, 480, (2022). https://doi.org/10.1007/s00203-022-03102-6
DUDOIT, AURIANE, CARDINAULT, NICOLAS, MERTZ, CHRISTIAN, CHILLET, MARC and BRAT, PIERRE. “Antifungal Activities of Propolis and its Main Components with an Emphasis Against Phytopathogenic Fungi” Journal of Apicultural Science, vol.65, no.1, 2021, pp.5-24. https://doi.org/10.2478/jas-2021-0013
FAO – Food and Agriculture Organization of the United Nations. Joint FAO/WHO Expert Meeting on Microbiological Risk Assessment (JEMRA) on the Prevention and Control of Microbiological Hazards in Fresh Fruits and Vegetables, November of 2021. Disponível em: http://www.fao.org/food-safety/en/ .
GONÇALVES, JULIANE. “As propriedades farmacológicas da própolis e seus benefícios para a saúde humana.” (2019).
HEGAZI, A.G.; ABD, E.I.; HADY, F.K.; ALLAH, F.A. Chemical composition and antimicrobial activity of European propolis. Zeitschrift für Naturforschung, v.55c, p.70-75, 2000.
JUNKES, VALDERICE & GROFF, ANDREA. RENDIMENTO E QUALIDADE DE MORANGOS PRODUZIDOS EM DOIS SISTEMAS DE PRODUÇÃO. Brazilian Journal of Development, v.6., p. 55125-55134, 2020. DOI: https://doi.org/10.34117/bjdv6n8-072
KUMAZAWA, S.; HAMASAKA, T.; NAKAYAMA, T. Antioxidant activity of propolis of various geographic origins. Food Chemistry, v.84, n.3, p.329-339, 2004.
LORINI, A.; WOBETO, C.; BONALDO, S. M.; BOTELHO, S. C. C.; SINHORIN, A. P. Chemical composition and antifungal activity of propolis on Aspergillus flavus, Biosci. J., Uberlândia, v. 34, n. 5, p. 1298-1307, Sept./Oct. 2018.
MONTI, M.; BERTI, E.; CARMINATI, G.; CUSINI, M. Occupational and cosmetic dermatitis from propolis. Contact Dermatitis v.9, n.2, p.163, 1983.
NICHITOI, M.M., JOSCEANU, A.M., ISOPESCU, R.D. et al. Polyphenolics profile effects upon the antioxidant and antimicrobial activity of propolis extracts. Sci Rep 11, 20113 (2021). https://doi.org/10.1038/s41598-021-97130-9
PARK, Y. K., PAREDES-GUZMAN, J. F., AGUIAR, C. L., ALENCAR, S. M. FUJIWARA, F. Y. (2004). Chemical Constituents In Baccharis dracunculifolia as the Main Botanical Origin of Southeastern Brazilian Propolis. Journal of Agricultural and Food Chemistry, 52, 1100-1103.
PEREIRA, DANIEL SANTIAGO; FREITAS, CARLOS IBERÊ ALVES; FREITAS, MARINALVA OLIVEIRA; MARACAJÁ, PATRÍCIO BORGES; SILVA, JBA; DA SILVA, RA; DA SILVEIRA, DC. Histórico e principais usos da própolis apícola. ACSA – Agropecuária Científica no Semi-Árido, vol. 11, n. 2, p. 01-21, 2015.
PEREIRA, LEONOR TUNES. *Própolis português como agente de biocontrole de doenças da maçã.* Dissertação (Mestrado em Biologia Molecular, Biotecnologia e Bioempreendedorismo em Plantas) – Universidade [Universidade do minho], [Campus-Gualtar], março de 2021. Orientação: Prof. Ana Cristina Gomes da Cunha; Prof. Cristina Alexandra de Almeida Aguiar.
PONCE, A.R.; BASTIANI, M.I.D.; MINIM, V.P.; VANETTI, M.C.D. Características físicoquímicas e microbiológicas de morango minimamente processado. Food Science and Technology, 30(1), 113–118, 2010. https://doi.org/10.1590/S0101-20612010005000016.
PETRUZZI L, ROSARIA CORBO M, CAMPANIELLO D, SPERANZA B, SINIGAGLIA M,
BEVILACQUA A. Antifungal and Antibacterial Effect of Propolis: A Comparative Hit for FoodBorne Pseudomonas, Enterobacteriaceae and Fungi. Foods, May 2; 9(5):559, 2020. doi: 10.3390/foods9050559.
SINGH, KRISHAN & SRAN, AMANPREET. Handbook of Strawberry Farming and Production. v.1, 2023. TEMIZ, A., Mumcu, A. Ş., Tüylü, A. Ö., & Sorkun, K.(2013). Antifungal activity of propolis samples collected from different geographical regions ofTurkey against two food-related molds, Aspergillus Versicolor and Penicillium aurantiogriseum. GIDA,38(3), 135-142. DOI: 10.5505/gida.2013.10820.
TOBALDINI-VALERIO FK, BONFIM-MENDONÇA PS, ROSSETO HC, BRUSCHI ML, HENRIQUES M, NEGRI M, SILVA S, SWIDZINSKI TLE. Propolis: a potencial natural product to fight Candida species infections. Future Microbiol. 2016 Aug;11:1035-46.
UENO, B.; COUTO, M. E. O.; HELLWIG, T. C.; NICKEL, G. K. Mancha foliar, necrose em pecíolo e podridão de frutos de morangueiro causada por Gnomonia comary no Rio Grande do Sul. Fitopatologia Brasileira, v. 31, p. 228-229, 2006.
WOLSKA, K., & ANTOSIK, K. ity of propolis against pathogenic fungi isolated from human infections. Brazilian Journal of Pharmaceutical Sciences, 59, e19978, 2023. https://doi.org/10.1590/s2175-97902023e19978.
ZULHENDRI F, CHANDRASEKARAN K, KOWACZ M, RAVALIA M, KRIPAL K, FEARNLEY J, PERERA CO. Antiviral, Antibacterial, Antifungal, and Antiparasitic Properties of Propolis: A Review. Foods. Jun 11;10(6):1360, 2021. doi:10.3390/foods10061360.
1Discente do Curso Técnico em Apicultura. Instituto Federal de Educação, Ciência e Tecnologia do Rio Grande do Norte (IFRN) – Campus Pau dos Ferros. E-mail: aderson.f@escolar.ifrn.edu.br
2Discente do Curso Técnico em Apicultura. Instituto Federal de Educação, Ciência e Tecnologia do Rio Grande do Norte (IFRN) – Campus Pau dos Ferros. E-mail: b.junior@escolar.ifrn.edu.br
3Professor Doutor em Biotecnologia. Instituto Federal de Educação, Ciência e Tecnologia do Rio Grande do Norte (IFRN) – Campus Pau dos Ferros. E-mail:viana.marcelino@ifrn.edu.br
