METABOLIC ACIDOSIS IN CHRONIC KIDNEY DISEASE: MECHANISMS, CONSEQUENCES, AND THERAPEUTIC APPROACHES
REGISTRO DOI: 10.69849/revistaft/pa10202503231930
Amanda Lana Fonseca1; Ana Clara Fernandes de Souza2; Lucas Gabriel da Cruz3; Jeniffer Thamires Resende Barros4; Sérgio Heron Gomes da Silva5; Joice de Oliveira Silva Souza6; Reinaldo Reis Pimentel7; Pablo José Passos Teixeira8; Rafael André Ferreira9; Daniel Inácio da Silva10
RESUMO
A acidose metabólica é uma complicação frequente da doença renal crônica (DRC) e está associada a diversos desfechos adversos, incluindo a progressão da disfunção renal, comprometimento da saúde musculoesquelética, eventos cardiovasculares e mortalidade. Os mecanismos que previnem a acidose metabólica, paradoxalmente, contribuem para danos renais adicionais, estabelecendo um ciclo entre o acúmulo de ácido e a lesão renal mediada pelo ácido. Interromper esse ciclo por meio da administração de álcalis, geralmente com bicarbonato de sódio, é uma estratégia que se acredita preservar a função renal e atenuar os efeitos prejudiciais do excesso de ácido sobre ossos e músculos. No entanto, os resultados de ensaios clínicos têm sido conflitantes. Além disso, há um grande interesse em determinar se o bicarbonato de sódio pode melhorar os desfechos clínicos em pacientes que não apresentam acidose metabólica evidente. Supõe-se que esses indivíduos possam estar sofrendo danos orgânicos mediados pelo ácido, apesar de apresentarem concentrações normais de bicarbonato sérico — um estado frequentemente denominado acidose metabólica subclínica. Os resultados de ensaios clínicos de pequeno a médio porte em indivíduos com acidose metabólica subclínica também foram inconclusivos. Portanto, ensaios clínicos bem delineados e com maior poder estatístico são necessários para avaliar a eficácia e segurança do bicarbonato de sódio e determinar se essa intervenção pode melhorar os desfechos clínicos dos pacientes.
Palavras-chave: acidose metabólica; acidose metabólica subclínica; doença renal crônica; equilíbrio ácido-base; bicarbonato de sódio; dieta; nutrição; doença renal em estágio terminal; fibrose túbulo-intersticial.
ABSTRACT
Metabolic acidosis is a common complication of chronic kidney disease (CKD) and is associated with various adverse outcomes, including the progression of renal dysfunction, impaired musculoskeletal health, cardiovascular events, and mortality. The mechanisms that prevent metabolic acidosis paradoxically contribute to further kidney damage, creating a cycle between acid accumulation and acid-mediated kidney injury. Interrupting this cycle through alkali administration, most commonly with sodium bicarbonate, is believed to preserve kidney function and mitigate the harmful effects of excess acid on bones and muscles. However, clinical trial results have been conflicting. Additionally, there is significant interest in determining whether sodium bicarbonate can improve clinical outcomes in patients without overt metabolic acidosis. It is hypothesized that these individuals may experience acid-mediated organ damage despite having normal serum bicarbonate concentrations—a condition often referred to as subclinical metabolic acidosis. Results from small to medium-sized clinical trials in individuals with subclinical metabolic acidosis have also been inconclusive. Therefore, well-designed and adequately powered clinical trials are necessary to evaluate the efficacy and safety of sodium bicarbonate and to determine whether this intervention can improve patient outcomes.
Keywords: metabolic acidosis; subclinical metabolic acidosis; chronic kidney disease; acid–base balance; sodium bicarbonate; diet; nutrition; end-stage kidney disease; tubulointerstitial fibrosis.
1. Introdução
O pH sistêmico é rigorosamente regulado para manter a função celular normal. Os rins e os pulmões são os principais órgãos responsáveis por manter o pH arterial dentro da faixa de 7,40. A retenção de CO₂ devido à ventilação respiratória insuficiente leva à acidose respiratória, enquanto o acúmulo excessivo de ácidos não voláteis resulta em acidose metabólica [1].
A acidose metabólica aguda pode ocorrer em diversas condições, incluindo diarreia, ingestão de álcoois tóxicos, acidose láctica e cetoacidose.
No entanto, a causa mais comum de acidose metabólica crônica, foco desta revisão, é a doença renal crônica (DRC), que afeta cerca de 900 milhões de pessoas em todo o mundo [1].
A acidose metabólica crônica na DRC está associada a riscos elevados de progressão da própria doença, doenças cardiovasculares (DCV) e complicações musculoesqueléticas, entre outras condições [2–15].
Aproximadamente 15% dos indivíduos com DRC apresentam acidose metabólica crônica, o que representa cerca de 135 milhões de pessoas em risco aumentado para essas complicações em nível global [16,17]. O tratamento da acidose metabólica crônica na DRC por meio da terapia alcalina é relativamente simples e geralmente seguro, mas sua eficácia ainda não está totalmente esclarecida.
2. Gênese da Acidose Metabólica Crônica na DRC
Em média, a carga diária de ácido não volátil, ou fixo, para um indivíduo que segue uma dieta ocidental é de aproximadamente 1 miliequivalente por quilograma de peso corporal. Os rins são responsáveis pela excreção desses ácidos não voláteis e pela reposição do bicarbonato consumido, garantindo a manutenção da concentração sistêmica normal de bicarbonato e do pH.
O principal mecanismo pelo qual os rins desempenham essa função é por meio do catabolismo da glutamina no túbulo proximal. Nesse processo, o amônio (NH₄⁺) é excretado, e o bicarbonato é liberado na circulação sistêmica para repor os ânions de bicarbonato consumidos na neutralização inicial do ácido.
Outro mecanismo essencial na regulação do equilíbrio ácido-base pelos rins é a secreção de prótons (H⁺), que podem se ligar ao amoníaco (NH₃) ou a um tampão titulável, como o fosfato monohidrogenado (HPO₄²⁻) (Figura 1). Quando os prótons são excretados por meio desses “carregadores de prótons”, qualquer bicarbonato gerado no túbulo proximal ou nas células intercalares (Figura 2) também é disponibilizado para a circulação sistêmica [18].
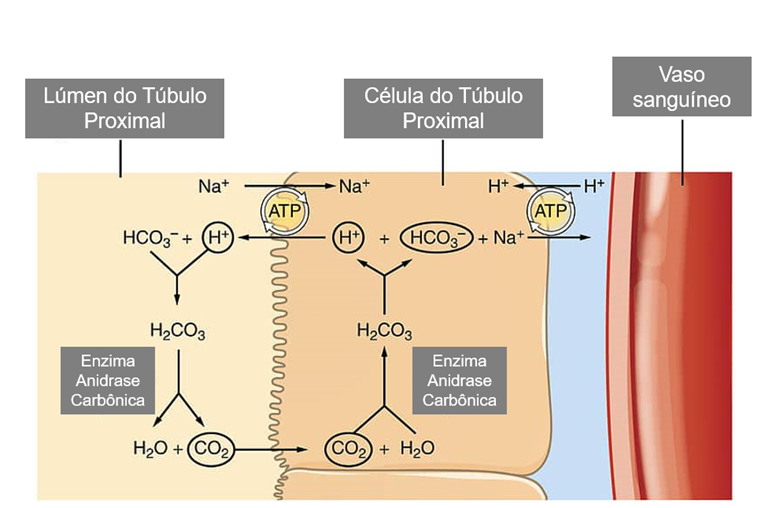
Figura 1. Principais componentes da regulação ácido-base em uma célula do túbulo proximal (PTC). O fosfato monohidrogenado (HPO₄²⁻) e o bicarbonato (HCO₃⁻) são filtrados e se ligam aos prótons (H⁺) secretados pela H⁺-ATPase ou pelo antiporte sódio-hidrogênio (NHE3) no lado luminal da PTC, formando fosfato di-hidrogenado (H₂PO₄⁻) e ácido carbônico (H₂CO₃), respectivamente. O ácido carbônico é convertido em H₂O e CO₂ pela anidrase carbônica (CA) IV, permitindo que essas moléculas atravessem a membrana celular e entrem na célula, onde a CA II reconverte o CO₂ em ácido carbônico. O ácido carbônico então se dissocia em um próton e um íon bicarbonato, permitindo que o próton seja reutilizado pela H⁺-ATPase ou pelo NHE3. A glutamina é metabolizada em dois íons amônio (NH₄⁺) e duas moléculas de α-cetoglutarato (α-KG), resultando na formação de dois ânions bicarbonato. Três ânions bicarbonato são co-transportados com o sódio pelo co-transportador sódio-bicarbonato (NBCe1) no lado basolateral da célula. O amônio é excretado da PTC substituindo prótons no NHE3 ou como amônia (NH₃), por difusão através da membrana celular, onde pode se ligar a um próton e formar amônio [104]. Fone: Adaptado de SPELLER, J. (2025).
Na doença renal crônica (DRC), a acidose metabólica se desenvolve porque a carga diária de ácido excede a capacidade dos rins de excretar prótons e gerar íons bicarbonato [19,20]. A dieta ocidental típica contribui para essa condição, pois tende a ser acidogênica devido ao baixo consumo de frutas e vegetais, que produzem bases, em comparação com o alto consumo de proteínas de origem animal e cloreto de sódio, que são formadores de ácido.
A excreção de ácido é prejudicada na DRC devido à perda de néfrons funcionais e à disfunção das células tubulares causada pela fibrose túbulo-intersticial. Esse desequilíbrio favorece um estado de retenção de ácido e, ao longo do tempo, leva ao desenvolvimento de acidose metabólica.
Além disso, certos medicamentos usados no tratamento da DRC podem contribuir para o desenvolvimento da acidose metabólica. Isso inclui inibidores da enzima conversora de angiotensina (IECA), bloqueadores dos receptores da angiotensina (BRA) e inibidores do co-transportador de sódio-glicose tipo 2 (iSGLT2). Os IECA e BRA podem reduzir a concentração sérica de bicarbonato ao diminuir a secreção de H⁺ mediada pela aldosterona no túbulo coletor, resultando na retenção de ácido [16].
Além de inibir a reabsorção de sódio e glicose no túbulo proximal, os iSGLT2 também bloqueiam o antiporte sódio-hidrogênio (NHE3), reduzindo assim a secreção proximal de H⁺ [21]. Em casos graves, os iSGLT2 podem causar cetoacidose potencialmente fatal, mesmo com níveis normais ou levemente elevados de glicose no sangue [22].
Por outro lado, os diuréticos tiazídicos e de alça podem aumentar a concentração sérica de bicarbonato [16]. No entanto, os diuréticos não devem ser prescritos exclusivamente com o objetivo de elevar a concentração sérica de bicarbonato.
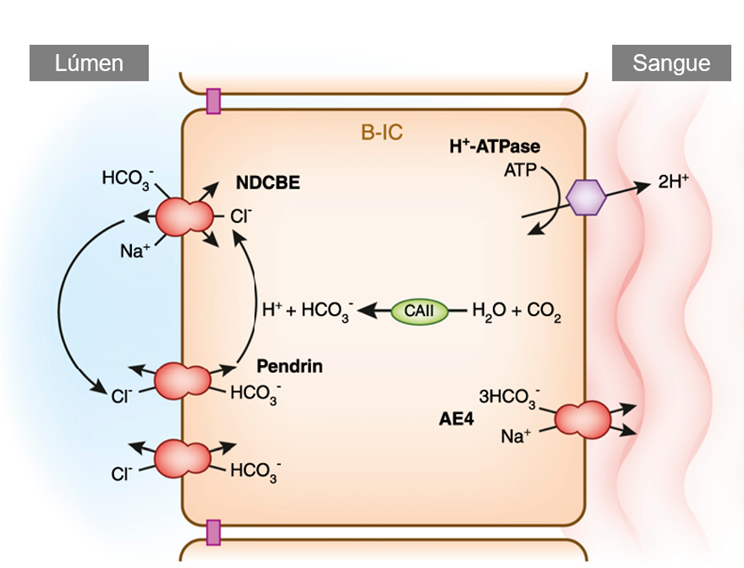
Figura 2. Principais componentes da regulação ácido-base em uma célula α-intercalada (IC). Sob a maioria das circunstâncias, todo o bicarbonato (HCO₃⁻) filtrado no glomérulo já foi reabsorvido quando o filtrado atinge esse segmento do rim. Qualquer fosfato monohidrogenado (HPO₄²⁻) restante, que ainda não tenha tamponado um próton (H⁺), pode se ligar a um próton secretado pela H⁺-ATPase ou pela H⁺/K⁺-ATPase. A amônia proveniente da medula renal é transportada para o fluido luminal por meio das glicoproteínas Rhesus (Rhcg e Rhbg) e se liga a prótons, formando amônio (NH₄⁺). Os prótons e o bicarbonato são gerados pela ação da anidrase carbônica II (CA II) intracelular. O bicarbonato é reabsorvido por meio do trocador basolateral cloreto-bicarbonato, enquanto o cloreto sai da célula por um canal específico e pode ser reutilizado pelo mesmo trocador [105]. Fonte: Adaptado de ROY, A., AL-BATAINEH, M.M., & PASTOR-SOLER, N.M. (2015).
3. Acidose Metabólica na Doença Renal Crônica (DRC)
A acidose metabólica manifesta-se clinicamente por uma redução na concentração de bicarbonato, geralmente medida como o CO₂ total em uma amostra venosa. Embora as amostras arteriais sejam consideradas o padrão-ouro para a avaliação do equilíbrio ácido-base sistêmico, a punção arterial é mais difícil do que a venopunção, além de ser dolorosa e apresentar o risco de isquemia na mão caso a circulação colateral esteja comprometida.
O diagnóstico de acidose metabólica crônica na DRC é geralmente estabelecido quando o CO₂ total venoso está abaixo de 22 mEq/L em mais de uma medição [23–25]. A partir desse ponto, o tratamento da acidose metabólica crônica na DRC é recomendado, na expectativa de que melhore os desfechos clínicos dos pacientes.
No entanto, há fortes evidências de que o balanço positivo de ácido está presente mesmo em pacientes com DRC que não apresentam uma redução da concentração de bicarbonato ou de CO₂ total. Vallet et al. demonstraram que a excreção líquida de ácido urinário (NAE) era menor do que a produção líquida de ácido endógeno (NEAP) em pacientes com DRC, embora a concentração média de CO₂ total sérico estivesse dentro da faixa normal [19].
A excreção urinária de amônio é um dos principais determinantes da excreção renal de ácido e diminui à medida que a DRC progride. Em um estudo pós-hoc realizado com afro-americanos com DRC secundária à hipertensão, níveis mais baixos de amônio urinário foram associados a um risco 2,5 vezes maior de desenvolvimento de acidose metabólica dentro de um ano [26].
Além disso, ambos os estudos demonstraram que níveis reduzidos de amônio urinário estavam associados a um risco aumentado de progressão da DRC, independentemente da concentração sérica de CO₂ total [19,26]. Essas observações indicam que:
- A retenção de ácido ocorre em pacientes com DRC que apresentam um aparente equilíbrio ácido-base normal, um estado frequentemente denominadoacidose metabólica subclínicaouacidose metabólica eubicarbonatêmica.
- A medição do amônio urinário pode identificar indivíduos com DRC que poderiam se beneficiar da terapia alcalina antes do desenvolvimento da acidose metabólica manifesta.
- O tamponamento ósseo pode compensar o desequilíbrio entre a carga ácida e a excreção renal de ácido, mantendo um pH e uma concentração de bicarbonato normais [4].
- O tratamento da acidose metabólica subclínica na DRC, mesmo quando o bicarbonato sérico ou o CO₂ total estão normais, pode ter efeitos positivos sobre os ossos, os rins e potencialmente outros órgãos nos pacientes com DRC.
4. Efeitos Adversos da Acidose Metabólica Crônica na DRC
Os rins são tanto a causa da acidose metabólica crônica na DRC quanto o órgão-alvo dos danos mediados pelo ácido. Os mecanismos conhecidos que contribuem para a lesão renal induzida pelo ácido são, na verdade, respostas compensatórias ativadas para prevenir a acidose metabólica. Esses mecanismos incluem o aumento da produção renal de amônio e a ativação do sistema renina-angiotensina-aldosterona (RAAS) e da endotelina-1 (ET-1) para facilitar a excreção de ácido pelos rins.
O aumento dos níveis teciduais de amônio promove fibrose túbulo-intersticial por meio da ativação da via alternativa do complemento dentro dos rins [27–30]. A endotelina-1 (ET-1) estimula as trocas Na⁺/H⁺ nos túbulos proximal e distal, reduz a secreção distal de bicarbonato e aumenta a atividade da H⁺-ATPase ao promover a secreção de aldosterona pelas adrenais [31,32]. No entanto, a ET-1 também apresenta efeitos pró-inflamatórios e estimula a fibrose renal por meio do fator de crescimento transformador β1 (TGF-β1) e do fator de crescimento do tecido conjuntivo [32–38].
A angiotensina II (AT-II) também está envolvida no dano renal mediado pelo ácido. Sua atividade aumenta em resposta à acidose metabólica para facilitar a atividade do trocador Na⁺/H⁺ no túbulo proximal e a excreção de amônia no fluido tubular. A AT-II também estimula a produção de aldosterona e ET-1, que podem aumentar a secreção de H⁺ ao intensificar a atividade da H⁺-ATPase nas células intercalares do néfron distal [39,40].
Embora essas respostas adaptativas ajudem a reduzir a carga ácida, elas também têm efeitos prejudiciais sobre a saúde renal. Além disso, o acúmulo de ácido pode contribuir para o dano renal por outras vias, incluindo inflamação, resistência à insulina e estresse oxidativo [41–45].
Os efeitos adversos do acúmulo de ácido na função renal são sustentados por estudos observacionais realizados em indivíduos com DRC, incluindo crianças e receptores de transplante renal. Nessas pesquisas, níveis baixos de CO₂ total sérico foram identificados como um fator de risco independente para a progressão da disfunção renal e para a mortalidade [8–15].
Além disso, níveis reduzidos de CO₂ total também foram associados ao desenvolvimento de DRC, sugerindo uma possível relação entre a ingestão dietética de ácido e o risco de desenvolver a doença [46–48].
5. Consequências Evidentes da Acidose Metabólica Crônica no Funcionamento do Organismo.
A acidose metabólica também está associada à desmineralização óssea e ao catabolismo muscular [4–7]. Estudos pioneiros demonstraram que a acidificação aumenta a atividade dos osteoclastos, inibe a atividade dos osteoblastos e causa hipercalciúria, levando a um balanço negativo de cálcio em humanos [5,49,50]. Além disso, concentrações reduzidas de bicarbonato sérico têm sido associadas a menores densidades minerais ósseas [51] e a uma maior taxa de perda de conteúdo mineral ósseo [52].
Uma análise aprofundada da qualidade óssea em pacientes com DRC e acidose metabólica mostrou que essa condição está associada ao aumento dos marcadores de remodelação óssea e a uma menor densidade óssea no rádio. Alterações longitudinais demonstraram expansão cortical da matriz óssea mineral, porém com evidências de deterioração do osso trabecular [53].
Com relação ao metabolismo proteico e à massa muscular, a acidose metabólica causa catabolismo proteico por meio da ativação de ligases de ubiquitina dependentes de acidificação [6]. Estudos observacionais em humanos indicam que essa condição afeta negativamente o desempenho muscular, pois níveis reduzidos de bicarbonato sérico estão associados a menor força muscular, pior aptidão cardiorrespiratória e redução da função física [54–56]. Esses achados reforçam a recomendação de corrigir a acidose metabólica por meio da terapia alcalina.
Estudos observacionais também demonstram que a acidose metabólica está associada a um maior risco de mortalidade por todas as causas [9,57,58]. Esse aumento na mortalidade provavelmente está relacionado a um maior risco de eventos cardiovasculares, como descrito no Systolic Blood Pressure Intervention Trial (SPRINT), em receptores de transplante renal e em uma ampla coorte de pacientes ambulatoriais [2,3,59]. Os mecanismos que ligam a acidose metabólica a desfechos cardiovasculares adversos são multifatoriais, mas podem incluir inflamação, estresse oxidativo e calcificação vascular.
6. Efeitos da Terapia Alcalina Farmacológica na DRC
O tratamento farmacológico da acidose metabólica na DRC é relativamente simples, sendo geralmente iniciado quando o CO₂ total sérico permanece consistentemente abaixo de 22 mEq/L (Figura 3).
Os sais alcalinos à base de sódio são geralmente preferidos em relação aos sais à base de potássio, pois os pacientes com DRC frequentemente fazem uso de inibidores do sistema renina-angiotensina-aldosterona (RAASis) e têm risco aumentado de desenvolver hipercalemia. No entanto, vale destacar que a administração de álcalis à base de potássio pode ter benefícios, considerando preocupações sobre a carga de sódio no controle da pressão arterial e na excreção urinária de cálcio.
Uma meta-análise de ensaios clínicos nos quais o bicarbonato de sódio foi a intervenção não encontrou evidências de que esse composto aumente a pressão arterial [60]. Além disso, em uma análise secundária do estudo Bicarbonate Administration to Stabilize Estimated Glomerular Filtration Rate (BASE) Pilot Trial, o bicarbonato de sódio não foi associado a um aumento na excreção urinária de cálcio [61]. O uso de álcalis à base de potássio pode ser considerado em pacientes selecionados, desde que os níveis séricos de potássio sejam monitorados de perto. No entanto, o bicarbonato de potássio não está amplamente disponível, enquanto o citrato de potássio é comumente utilizado no tratamento da nefrolitíase.
Entre os álcalis à base de sódio, o bicarbonato de sódio é mais utilizado do que o citrato de sódio e tem sido o foco principal de estudos clínicos recentes. Além disso, um novo agente em investigação, o veverimer, atua como um ligante gastrointestinal de ácido clorídrico [62]. O bicarbonato de sódio tem sido usado por décadas e é geralmente seguro e bem tolerado, o que levou a um grande entusiasmo sobre seu potencial para mitigar os efeitos adversos da acidose metabólica.
7. Efeitos Renais
Resultados de estudos com amostras pequenas a moderadasepelo menos dois anos de seguimento sugerem que o tratamento da acidose metabólica manifesta com bicarbonato de sódio pode preservar a função renal [37,63].
O estudo Use of Bicarbonate in CKD (UBI), o maior ensaio clínico realizado até o momento sobre bicarbonato de sódio (N = 796), demonstrou que o tratamento ativo reduziu os riscos de:
- Duplicação da creatinina sérica em 64%;
- Progressão para doença renal terminal (ESKD) em 50%;
- Mortalidade em 57% [64].
Além disso, há evidências de que a terapia alcalina farmacológica pode preservar a função renal em indivíduos com DRC que apresentam concentrações normais de bicarbonato sérico, ou seja, aqueles com acidose metabólica subclínica [65].
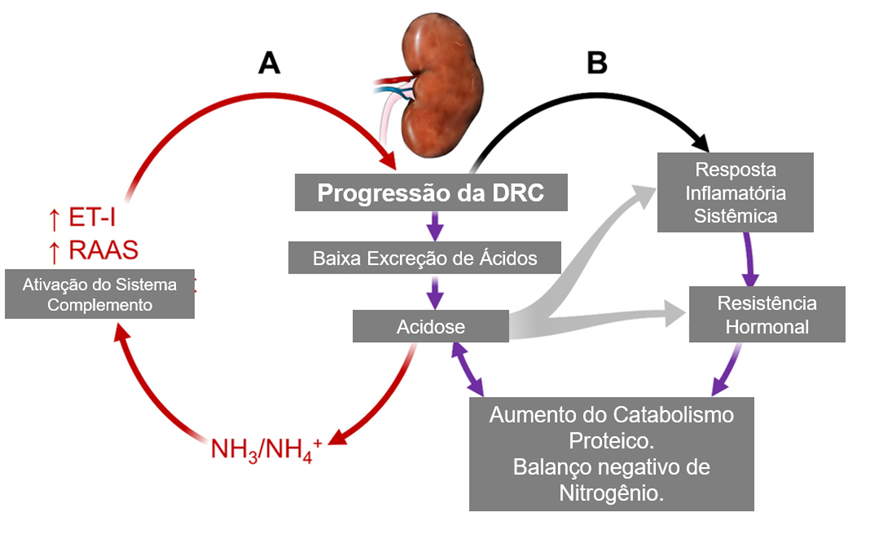
Figura 3. Estrutura Conceitual do Espectro de Retenção Ácida na Doença Renal Crônica. Pacientes com CO₂ total sérico < 22 mEq/L apresentam acidose metabólica e o maior nível de retenção ácida. Formas mais leves de retenção ácida, denominadas acidose metabólica subclínica, provavelmente ocorrem quando o CO₂ total sérico está entre 22 e 28 mEq/L. Acima de 28 mEq/L, o distúrbio ácido-base pode ser alcalose metabólica ou acidose respiratória com compensação metabólica. Para fins de alcalinização, terapias nutricionais podem ser consideradas quando o CO₂ total sérico for ≤28 mEq/L, desde que a concentração sérica de potássio seja monitorada, mantendo-se geralmente abaixo de 5,0 mEq/L. As intervenções farmacológicas devem ser reservadas para pacientes com CO₂ total sérico < 22 mEq/L [106] . Fonte: ZHA, Y.; QIAN, Q., (2017).
O estudo Use of Bicarbonate in CKD (UBI), que é o maior ensaio clínico conduzido até o momento sobre bicarbonato de sódio (N = 796), demonstrou que o tratamento ativo reduziu os riscos de:
- Duplicação da creatinina sérica em 64%
- Progressão para doença renal terminal (ESKD) em 50%
- Mortalidade em 57% [64]
Além disso, há indícios de que a terapia alcalina farmacológica pode preservar a função renal em indivíduos com DRC que apresentam concentrações normais de bicarbonato sérico, ou seja, aqueles com acidose metabólica subclínica [65].
No entanto, outros estudos não demonstraram um efeito positivo da terapia alcalina em pacientes com DRC e acidose metabólica. Entre esses estudos, destacam-se:
- Preserve-Transplant Study: ensaio clínico de dois anos realizado em receptores de transplante renal, que não demonstrou benefícios com a terapia alcalina [66].
- BiCARB Trial: estudo no qual o tratamento com bicarbonato de sódio foi associado a maiores taxas de hospitalização e pior desempenho físico [67].
- VALOR–CKD Trial: ensaio que avaliou o ligante gastrointestinal de ácido clorídrico veverimer na progressão da DRC em pacientes com acidose metabólica manifesta, sem evidências de efeitos positivos sobre a função renal [62].
- VA–Bicarb Study e Alkali Therapy in CKD Trial: estudos que avaliaram indivíduos com acidose metabólica subclínica (concentrações normais de CO₂ total sérico) e não demonstraram efeitos positivos do bicarbonato de sódio sobre a função renal [68,69].
Além disso, o BASE Pilot Trial observou um aumento dose-dependente na relação albumina/creatinina urinária (ACR), o que pode sugerir potenciais riscos dessa terapia [70]. No entanto, essa descoberta pode ter sido um achado isolado, pois não foi observada em outros ensaios clínicos. Ensaios futuros sobre bicarbonato de sódio devem monitorar alterações na relação albumina/creatinina urinária (ACR).
Assim, os efeitos da terapia alcalina sobre a saúde renal em indivíduos com DRC permanecem inconclusivos. Embora estudos mais recentes, como o Preserve-Transplant Study e o VALOR–CKD Trial, tenham apresentado resultados negativos, ainda pode haver justificativa suficiente para a realização de um ensaio clínico robusto e bem delineado para determinar se o tratamento com bicarbonato de sódio pode ter efeitos renoprotetores em pacientes com DRC.
8. Efeitos sobre os Ossos
Os estudos sobre os efeitos da suplementação alcalina na saúde óssea em pacientes com DRC são limitados.
- Em um estudo, o tratamento da acidose metabólica com bicarbonato de sódio atenuou discretamente o aumento dos níveis de hormônio da paratireoide intacto (iPTH) ao longo de três meses [72].
- Em outro estudo realizado com indivíduos com DRC e acidose metabólica manifesta, o bicarbonato de sódio não apresentou efeitos significativos sobre iPTH, telopetídeo C-terminal do colágeno tipo I (CTX-1) ou propeptídeo N-terminal intacto do pró-colágeno tipo I (P1NP). No entanto, observou-se um aumento nos níveis séricos do fator de crescimento de fibroblastos-23 intacto (iFGF-23), biomarcador associado a um maior risco de complicações cardiovasculares [73].
- Uma análise secundária do BASE Pilot Trial também não encontrou efeitos do bicarbonato de sódio sobre iPTH, CTX-1, P1NP, iFGF-23, fosfatase alcalina específica do osso (B-SAP), fosfatase ácida resistente ao tartarato 5b (TRAP5b) ou metabólitos da vitamina D [61].
- O Alkali Therapy in CKD Trial não demonstrou efeito positivo do bicarbonato de sódio sobre a densidade mineral óssea (DMO) em comparação ao placebo [69].
Por outro lado, em receptores de transplante renal com acidose metabólica, o tratamento com citrato de potássio melhorou a histomorfometria óssea, preservando os níveis de B-SAP, CTX-1 e P1NP, mas não afetou o iPTH, os metabólitos da vitamina D ou a DMO ao longo de um ano [74].
A evidência mais forte do benefício da terapia alcalina na saúde óssea provém de estudos realizados em mulheres pós-menopáusicas sem DRC, nas quais a maioria das intervenções utilizou álcalis à base de potássio [75–77]. Ainda não está claro se essa diferença se deve à natureza do cátion (potássio vs. sódio) ou à influência de múltiplos fatores na saúde óssea dos pacientes com DRC.
Um grande desafio na pesquisa sobre acidose metabólica e saúde óssea é que os estudos frequentemente utilizam biomarcadores e medidas indiretas, em vez de avaliar diretamente a incidência de fraturas, o que poderia fornecer dados mais informativos sobre os reais impactos do tratamento alcalino.
9. Efeitos sobre os Músculos e o Metabolismo Proteico
Os efeitos do tratamento da acidose metabólica na saúde muscular e no catabolismo proteico ainda não foram tão bem estudados quanto seus impactos sobre os rins e os ossos em pacientes com DRC.
- Um estudo randomizado e aberto demonstrou que a correção da acidose metabólica com bicarbonato de sódio (N = 67) aumentou a circunferência muscular do braço, reduziu a aparição de nitrogênio proteico e aumentou os níveis séricos de albumina ao longo de dois anos, em comparação ao grupo placebo (N = 67) [63].
- Em um estudo de braço único realizado com 20 pacientes com DRC e CO₂ total sérico entre 20–24 mEq/L, o tratamento com bicarbonato de sódio melhorou os tempos no teste de sentar e levantar e reduziu a excreção urinária de nitrogênio ureico, sugerindo que o catabolismo proteico foi reduzido. No entanto, não houve efeito sobre a força de preensão manual, o que sugere que os álcalis podem ter um impacto maior sobre a musculatura dos membros inferiores [78].
10. Efeitos Cardiovasculares
Os efeitos cardiovasculares do tratamento da acidose metabólica na DRC ainda não estão completamente esclarecidos.
Por um lado, existem duas preocupações principais relacionadas ao uso de álcalis à base de sódio:
- A carga de sódio pode causar retenção de líquidos e aumento da pressão arterial.
- A terapia pode levar a uma maior necessidade de ajuste na medicação anti-hipertensiva.
No entanto, os dados clínicos apresentam resultados conflitantes:
- Uma meta-análise de cinco ensaios clínicos em que os participantes com DRC receberam bicarbonato de sódio ou citrato de sódio não identificou aumento significativo no peso corporal total, na pressão arterial sistólica ou na pressão arterial diastólica. No entanto, a terapia foi associada a um risco 38% maior de intensificação do tratamento anti-hipertensivo e a um risco 39% maior de intensificação do tratamento diurético [79].
- Uma meta-análise subsequente, que incluiu 14 ensaios clínicos e mais de 2000 indivíduos, não encontrou evidências de que o bicarbonato de sódio aumentasse a pressão arterial sistólica ou levasse a um aumento no uso de anti-hipertensivos ou diuréticos [60].
Em modelos experimentais animais de hipertensão (ratos Dahl sensíveis ao sal, ratos com infusão crônica de angiotensina II e ratos alimentados com acetato de desoxicorticosterona e sal), o aumento da pressão arterial foi observado apenas quando o sódio foi administrado em conjunto com o ânion cloreto, mas não com outros ânions, como bicarbonato. Isso sugere que os efeitos do sódio na pressão arterial podem ser dependentes do ânion coadministrado [80–85].
Uma segunda preocupação cardiovascular em relação ao bicarbonato de sódio é a possibilidade de que ele promova a calcificação vascular. A calcificação vascular é comum em pacientes com DRC e está associada a maior mortalidade por todas as causas e eventos cardiovasculares [86].
As evidências que sustentam essa preocupação vêm, em grande parte, de estudos experimentais em animais, nos quais a calcificação foi intensificada em ambientes alcalóticos e reduzida em ambientes acidóticos [87–89]. No entanto, não há evidências em humanos de que o bicarbonato de sódio agrave a calcificação vascular.
Por outro lado, a acidose metabólica tem sido associada a um maior risco de mortalidade e eventos cardiovasculares, e os resultados do UBI Study sugerem que o tratamento da acidose metabólica na DRC reduz a mortalidade [64].
Um possível mecanismo para esse efeito protetor é a melhoria da função vascular, medida pela dilatação mediada pelo fluxo (FMD) [73]. No entanto, esse benefício pode ser específico para pacientes com acidose metabólica manifesta, pois o tratamento com bicarbonato de sódio em indivíduos com DRC e concentrações normais de bicarbonato não afetou a FMD [90].
Outro mecanismo potencialmente benéfico pode estar relacionado ao aumento dos níveis séricos de Klotho, uma proteína cuja elevação está associada a menor risco de doenças cardiovasculares [91]. Em uma análise post hoc do BASE Trial, foi observado que o bicarbonato de sódio aumentou os níveis séricos de Klotho de maneira dose-dependente ao longo de 28 semanas [61].
Esse aumento nos níveis de Klotho parece estar ligado à elevação do pH urinário, que ativa o receptor sensor de cálcio (CaSR) no túbulo distal contorcido, região onde o Klotho está altamente expresso na superfície celular. A ativação do CaSR estimula a protease ADAM10, que cliva o Klotho ligado à membrana, liberando-o para a circulação sistêmica [92].
Como o Klotho é considerado uma proteína “anti-envelhecimento”, futuros estudos sobre os efeitos cardiovasculares da terapia com bicarbonato de sódio e sua relação com Klotho e vias associadas devem ser incentivados.
11.Terapia Alcalina Nutricional na DRC
As terapias farmacológicas fornecem bases na forma de bicarbonato ou citrato (este último é metabolizado em bicarbonato no fígado) para mitigar o excesso de ácido na DRC.
A dieta ocidental é altamente acidogênica, pois contém baixa ingestão de frutas e vegetais (que produzem bases) e alto consumo de proteínas animais, conservantes e cloreto de sódio.
As proteínas animais são ricas em metionina e cisteína, aminoácidos que contêm enxofre e que, ao serem metabolizados, formam ácido sulfúrico. Portanto, o aconselhamento nutricional pode ser uma estratégia eficaz para reduzir a carga ácida na DRC.
De forma simples, o aumento do consumo de frutas e vegetais, aliado à redução do consumo de proteínas animais, pode ser recomendado para pacientes motivados, desde que a concentração sérica de potássio seja monitorada.
12. Evidências da Terapia Nutricional Alcalina
Estudos observacionais e intervencionistas fornecem suporte para essas recomendações:
- Estudos observacionais:
- Maiores cargas ácidas dietéticas foram associadas a menor taxa de filtração glomerular estimada (eGFR) em participantes do NHANES 1999–2004 [93].
- Participantes do NHANES III com DRC que estavam no tercil mais alto da carga ácida dietética apresentaram risco 3 vezes maior de progressão para doença renal terminal (ESKD) [94].
- Receptores de transplante renal com alta carga ácida dietética também tiveram maior risco de perda do enxerto renal [95].
- Estudos de intervenção nutricional:
- A dieta DASH (Dietary Approaches to Stop Hypertension) pode ser uma ferramenta útil para orientar os pacientes a consumirem uma dieta alcalinizante. Estudos demonstram que baixa adesão à dieta DASH está associada ao desenvolvimento e à progressão da DRC para ESKD [96,97].
- Estudos em pacientes com DRC atribuída à hipertensão mostram que uma dieta rica em frutas e vegetais, reduzindo o PRAL (Potencial de Carga Ácida Renal) em 50%, resultou em redução de marcadores urinários de dano renal, como ACR, TGF-β1 e N-acetil beta-D-glicosaminidase (NAG) em 30 dias [98].
- Em pacientes com DRC estágio 3 e bicarbonato sérico entre 22–24 mEq/L, a redução do PRAL com frutas e vegetais ou com bicarbonato de sódio (0,3 mEq/kg/dia) preservou a eGFR melhor do que os cuidados habituais ao longo de 36 meses [100].
13. Benefícios em Estágios Avançados da DRC
Os benefícios da terapia alcalina nutricional parecem se estender para estágios mais avançados da DRC (estágios 4 e 5).
- Em um estudo com pacientes com DRC estágio 4 e bicarbonato sérico < 22 mEq/L, a dieta rica em frutas e vegetais reduziu os níveis urinários de ACR, TGF-β1 e NAG [99].
- Estudos adicionais devem explorar os efeitos dessa abordagem em pacientes com DRC causada por diabetes mellitus, pois a maioria dos estudos foi realizada em indivíduos com DRC secundária à hipertensão, que geralmente têm menor risco de progressão da doença.
Além da redução da carga ácida, dieta rica em frutas e vegetais pode proteger os rins por outros mecanismos:
- Baixo teor de sódio, auxiliando no controle da pressão arterial.
- Baixo teor de fósforo biodisponível, reduzindo a calcificação vascular e a hipertrofia ventricular esquerda por meio da modulação do FGF-23.
- Alto teor de fibras, que pode melhorar o microbioma intestinal e reduzir a produção e absorção de toxinas urêmicas.
Uma segunda estratégia nutricional para reduzir a carga ácida é a diminuição do consumo de proteína animal, já que cisteína e metionina são metabolizadas em ácido sulfúrico.
- No estudo Modification of Diet in Renal Disease (MDRD), a dieta pobre em proteínas (0,58 g/kg/dia) não mostrou benefícios claros na função renal em comparação à dieta padrão (1,3 g/kg/dia) [101].
- A dieta muito pobre em proteínas (0,28 g/kg/dia) foi associada a maior mortalidade, e, portanto, restrição excessiva de proteínas não é recomendada [102].
Assim, estratégias nutricionais alcalinizantes devem ser consideradas para todos os pacientes com DRC e CO₂ total ≤ 28 mEq/L, pois valores acima disso sugerem alcalose metabólica ou acidose respiratória compensada.
O principal risco da suplementação com frutas e vegetais é a hipercalemia, tornando necessária a monitorização rigorosa do potássio sérico.
14. Conclusão
A acidose metabólica crônica é uma complicação frequente da doença renal crônica (DRC) e está associada a uma série de desfechos negativos, incluindo progressão acelerada da insuficiência renal, alterações musculoesqueléticas, distúrbios metabólicos e maior risco cardiovascular. Os mecanismos subjacentes incluem a diminuição da excreção renal de ácido, o comprometimento dos processos de tamponamento sistêmico e as respostas adaptativas deletérias dos sistemas hormonais e inflamatórios.
A terapia alcalina farmacológica com bicarbonato de sódio ou citrato de potássio tem sido amplamente estudada e pode oferecer benefícios significativos na preservação da função renal e na redução de complicacões sistêmicas. No entanto, os dados sobre sua eficácia permanecem inconclusivos, com estudos demonstrando tanto efeitos renoprotetores quanto resultados não favoráveis ou neutros. Ademais, preocupações sobre potenciais efeitos adversos, como sobrecarga de sódio e risco de calcificação vascular, reforçam a necessidade de estudos adicionais para melhor definir os grupos que mais se beneficiam da terapia alcalina.
A terapia nutricional alcalina, baseada no aumento do consumo de frutas e vegetais e na redução da ingesta de proteínas de origem animal, representa uma alternativa promissora para a gestão da acidose metabólica na DRC. Estudos sugerem que essa estratégia pode contribuir para a melhora da taxa de filtração glomerular, reduzir marcadores de lesão renal e modular fatores de risco cardiovasculares. Entretanto, a necessidade de monitorização rigorosa da hipercalemia é um desafio clínico relevante para a implementação dessa abordagem.
Diante do impacto negativo da acidose metabólica na DRC, torna-se fundamental um manejo personalizado que considere o estágio da doença, as comorbidades e o perfil metabólico de cada paciente. Investigações futuras devem explorar a melhor combinação entre intervenções farmacológicas e nutricionais, bem como determinar biomarcadores mais precisos para a identificação precoce de pacientes que poderiam se beneficiar da correção do estado ácido-base. Dessa forma, avanços no entendimento da acidose metabólica na DRC e em suas abordagens terapêuticas podem contribuir para a melhoria da qualidade de vida e dos desfechos clínicos desses pacientes.
REFERÊNCIAS
1. JAGER, K. J.; KOVESDY, C.; LANGHAM, R.; ROSENBERG, M.; JHA, V.; ZOCCALI, C. A single number for advocacy and communication—Worldwide more than 850 million individuals have kidney diseases. Nephrology Dialysis Transplantation, v. 34, p. 1803–1805, 2019.
2. COLLISTER, D.; FERGUSON, T. W.; FUNK, S. E.; REAVEN, N. L.; MATHUR, V.; TANGRI, N. Metabolic Acidosis and Cardiovascular Disease in CKD. Kidney Medicine, v. 3, p. 753–761.e1, 2021.
3. DOBRE, M. et al. Serum bicarbonate and cardiovascular events in hypertensive adults: Results from the Systolic Blood Pressure Intervention Trial. Nephrology Dialysis Transplantation, v. 35, p. 1377–1384, 2020.
4. BUSHINSKY, D. A.; CHABALA, J. M.; GAVRILOV, K. L.; LEVI-SETTI, R. Effects of in vivo metabolic acidosis on midcortical bone ion composition. American Journal of Physiology, v. 277, p. F813–F819, 1999.
5. KRIEGER, N. S.; SESSLER, N. E.; BUSHINSKY, D. A. Acidosis inhibits osteoblastic and stimulates osteoclastic activity in vitro. American Journal of Physiology, v. 262, p. F442–F448, 1992.
6. BAILEY, J. L. et al. The acidosis of chronic renal failure activates muscle proteolysis in rats by augmenting transcription of genes encoding proteins of the ATP-dependent ubiquitin-proteasome pathway. Journal of Clinical Investigation, v. 97, p. 1447–1453, 1996.
7. MAY, R. C.; KELLY, R. A.; MITCH, W. E. Metabolic acidosis stimulates protein degradation in rat muscle by a glucocorticoid-dependent mechanism. Journal of Clinical Investigation, v. 77, p. 614–621, 1986.
8. DOBRE, M. et al. Persistent high serum bicarbonate and the risk of heart failure in patients with chronic kidney disease (CKD): A report from the Chronic Renal Insufficiency Cohort (CRIC) study. Journal of the American Heart Association, v. 4, e001599, 2015.
9. KOVESDY, C. P.; ANDERSON, J. E.; KALANTAR-ZADEH, K. Association of serum bicarbonate levels with mortality in patients with non-dialysis-dependent CKD. Nephrology Dialysis Transplantation, v. 24, p. 1232–1237, 2009.
10. NAVANEETHAN, S. D. et al. Serum bicarbonate and mortality in stage 3 and stage 4 chronic kidney disease. Clinical Journal of the American Society of Nephrology, v. 6, p. 2395–2402, 2011.
11. PARK, S. et al. Metabolic Acidosis and Long-Term Clinical Outcomes in Kidney Transplant Recipients. Journal of the American Society of Nephrology, v. 28, p. 1886–1897, 2017.
12. RAPHAEL, K. L. et al. Serum bicarbonate and mortality in adults in NHANES III. Nephrology Dialysis Transplantation, v. 28, p. 1207–1213, 2013.
13. TANGRI, N. et al. Metabolic acidosis is associated with increased risk of adverse kidney outcomes and mortality in patients with non-dialysis dependent chronic kidney disease: An observational cohort study. BMC Nephrology, v. 22, p. 185, 2021.
14. HARAMBAT, J. et al. Metabolic acidosis is common and associates with disease progression in children with chronic kidney disease. Kidney International, v. 92, p. 1507–1514, 2017.
15. BROWN, D. D. et al. Low Serum Bicarbonate and CKD Progression in Children. Clinical Journal of the American Society of Nephrology, v. 15, p. 755–765, 2020.
16. RAPHAEL, K. L. et al. Prevalence of and risk factors for reduced serum bicarbonate in chronic kidney disease. Nephrology, v. 19, p. 648–654, 2014.
17. MORANNE, O. et al. Timing of onset of CKD-related metabolic complications. Journal of the American Society of Nephrology, v. 20, p. 164–171, 2009.
18. HAMM, L. L.; NAKHOUL, N.; HERING-SMITH, K. S. Acid-base homeostasis. Clinical Journal of the American Society of Nephrology, v. 10, p. 2232–2242, 2015.
19. VALLET, M. et al. Urinary ammonia and long-term outcomes in chronic kidney disease. Kidney International, v. 88, p. 137–145, 2015.
20. NAGAMI, G. T.; HAMM, L. L. Regulation of acid-base balance in chronic kidney disease. Advances in Chronic Kidney Disease, v. 24, p. 274–279, 2017.
21. ONISHI, A. et al. A role for tubular Na⁺/H⁺ exchanger NHE3 in the natriuretic effect of the SGLT2 inhibitor empagliflozin. American Journal of Physiology-Renal Physiology, v. 319, p. F712–F728, 2020.
22. PALMER, B. F.; CLEGG, D. J. Euglycemic ketoacidosis as a complication of SGLT2 inhibitor therapy. Clinical Journal of the American Society of Nephrology, v. 16, p. 1284–1291, 2021.
23. K/DOQI, NATIONAL KIDNEY FOUNDATION. Clinical practice guidelines for nutrition in chronic renal failure. American Journal of Kidney Diseases, v. 35, p. S17–S104, 2000.
24. KIDNEY DISEASE: IMPROVING GLOBAL OUTCOMES (KDIGO) CKD WORK GROUP. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney International Supplements, v. 3, p. 1–150, 2013.
25. RAPHAEL, K. L. Metabolic acidosis and subclinical metabolic acidosis in CKD. Journal of the American Society of Nephrology, v. 29, p. 376–382, 2018.
26. RAPHAEL, K. L. et al. Urine ammonium predicts clinical outcomes in hypertensive kidney disease. Journal of the American Society of Nephrology, v. 28, p. 2483–2490, 2017.
27. NATH, K. A.; HOSTETTER, M. K.; HOSTETTER, T. H. Pathophysiology of chronic tubulo-interstitial disease in rats. Interactions of dietary acid load, ammonia, and complement component C3. Journal of Clinical Investigation, v. 76, p. 667–675, 1985.
28. TOLINS, J. P.; HOSTETTER, M. K.; HOSTETTER, T. H. Hypokalemic nephropathy in the rat. Role of ammonia in chronic tubular injury. Journal of Clinical Investigation, v. 79, p. 1447–1458, 1987.
29. MORITA, Y. et al. Complement activation products in the urine from proteinuric patients. Journal of the American Society of Nephrology, v. 11, p. 700–707, 2000.
30. RAPHAEL, K. L. et al. Association between urine ammonium and urine TGF-beta1 in CKD. Clinical Journal of the American Society of Nephrology, v. 13, p. 223–230, 2018.
31. KOHAN, D. E. et al. Physiology of endothelin and the kidney. Comprehensive Physiology, v. 1, p. 883–919, 2011.
32. KHANNA, A.; SIMONI, J.; WESSON, D. E. Endothelin-induced increased aldosterone activity mediates augmented distal nephron acidification as a result of dietary protein. Journal of the American Society of Nephrology, v. 16, p. 1929–1935, 2005.
33. KOHAN, D. E.; BARTON, M. Endothelin and endothelin antagonists in chronic kidney disease. Kidney International, v. 86, p. 896–904, 2014.
34. WESSON, D. E.; DOLSON, G. M. Endothelin-1 increases rat distal tubule acidification in vivo. American Journal of Physiology-Renal Physiology, v. 273, p. F586–F594, 1997.
35. WESSON, D. E. et al. Dietary protein induces endothelin-mediated kidney injury through enhanced intrinsic acid production. Kidney International, v. 71, p. 210–217, 2007.
36. PHISITKUL, S. et al. Dietary protein causes a decline in the glomerular filtration rate of the remnant kidney mediated by metabolic acidosis and endothelin receptors. Kidney International, v. 73, p. 192–199, 2008.
37. PHISITKUL, S. et al. Amelioration of metabolic acidosis in patients with low GFR reduced kidney endothelin production and kidney injury, and better preserved GFR. Kidney International, v. 77, p. 617–623, 2010.
38. WESSON, D. E.; SIMONI, J. Acid retention during kidney failure induces endothelin and aldosterone production, which lead to progressive GFR decline, a situation ameliorated by alkali diet. Kidney International, v. 78, p. 1128–1135, 2010.
39. WESSON, D. E.; JO, C. H.; SIMONI, J. Angiotensin II-mediated GFR decline in subtotal nephrectomy is due to acid retention associated with reduced GFR. Nephrology Dialysis Transplantation, v. 30, p. 762–770, 2015.
40. WESSON, D. E.; JO, C. H.; SIMONI, J. Angiotensin II receptors mediate increased distal nephron acidification caused by acid retention. Kidney International, v. 82, p. 1184–1194, 2012.
41. BENTO, L. M. et al. Effects of NH₄Cl-induced systemic metabolic acidosis on kidney mitochondrial coupling and calcium transport in rats. Nephrology Dialysis Transplantation, v. 22, p. 2817–2823, 2007.
42. PICKERING, W. P. et al. Nutrition in CAPD: Serum bicarbonate and the ubiquitin-proteasome system in muscle. Kidney International, v. 61, p. 1286–1292, 2002.
43. SCHINDLER, R. Causes and therapy of microinflammation in renal failure. Nephrology Dialysis Transplantation, v. 19, supl. 5, p. V34–V40, 2004.
44. FARWELL, W. R.; TAYLOR, E. N. Serum anion gap, bicarbonate and biomarkers of inflammation in healthy individuals in a national survey. Canadian Medical Association Journal, v. 182, p. 137–141, 2010.
45. KOBAYASHI, S. et al. Insulin resistance in patients with chronic kidney disease. American Journal of Kidney Diseases, v. 45, p. 275–280, 2005.
46. DRIVER, T. H. et al. Low serum bicarbonate and kidney function decline: The Multi-Ethnic Study of Atherosclerosis (MESA). American Journal of Kidney Diseases, v. 64, p. 534–541, 2014.
47. GOLDENSTEIN, L. et al. Serum bicarbonate concentrations and kidney disease progression in community-living elders: The Health, Aging, and Body Composition (Health ABC) Study. American Journal of Kidney Diseases, v. 64, p. 542–549, 2014.
48. SHAH, S. N. et al. Serum bicarbonate levels and the progression of kidney disease: A cohort study. American Journal of Kidney Diseases, v. 54, p. 270–277, 2009.
49. LEMANN, J. Jr.; LITZOW, J. R.; LENNON, E. J. The effects of chronic acid loads in normal man: Further evidence for the participation of bone mineral in the defense against chronic metabolic acidosis. Journal of Clinical Investigation, v. 45, p. 1608–1614, 1966.
50. LEMANN, J.; LITZOW, J. R.; LENNON, E. J. Studies of the mechanism by which chronic metabolic acidosis augments urinary calcium excretion in man. Journal of Clinical Investigation, v. 46, p. 1318–1328, 1967.
51. CHEN, W.; MELAMED, M. L.; ABRAMOWITZ, M. K. Serum bicarbonate and bone mineral density in US adults. American Journal of Kidney Diseases, v. 65, p. 240–248, 2015.
52. TABATABAI, L. S. et al. Arterialized venous bicarbonate is associated with lower bone mineral density and an increased rate of bone loss in older men and women. Journal of Clinical Endocrinology & Metabolism, v. 100, p. 1343–1349, 2015.
53. LEVY, R. V. et al. Comprehensive associations between acidosis and the skeleton in patients with kidney disease. Journal of the American Society of Nephrology, v. 34, p. 668–681, 2023.
54. YENCHEK, R. et al. Association of serum bicarbonate with incident functional limitation in older adults. Clinical Journal of the American Society of Nephrology, v. 9, p. 2111–2116, 2014.
55. ABRAMOWITZ, M. K.; HOSTETTER, T. H.; MELAMED, M. L. Association of serum bicarbonate levels with gait speed and quadriceps strength in older adults. American Journal of Kidney Diseases, v. 58, p. 29–38, 2011.
56. ABRAMOWITZ, M. K.; HOSTETTER, T. H.; MELAMED, M. L. Lower serum bicarbonate and a higher anion gap are associated with lower cardiorespiratory fitness in young adults. Kidney International, v. 81, p. 1033–1042, 2012.
57. NAVANEETHAN, S. D.; BEDDHU, S. Associations of serum uric acid with cardiovascular events and mortality in moderate chronic kidney disease. Nephrology Dialysis Transplantation, v. 24, p. 1260–1266, 2009.
58. RAPHAEL, K. L. et al. Higher serum bicarbonate levels within the normal range are associated with better survival and renal outcomes in African Americans. Kidney International, v. 79, p. 356–362, 2011.
59. DJAMALI, A. et al. Metabolic acidosis 1 year following kidney transplantation and subsequent cardiovascular events and mortality: An observational cohort study. American Journal of Kidney Diseases, v. 73, p. 476–485, 2019.
60. BENYON-COBB, B. et al. Effect of sodium bicarbonate on systolic blood pressure in CKD: A systematic review and meta-analysis. Clinical Journal of the American Society of Nephrology, v. 18, p. 435–445, 2023.
61. RAPHAEL, K. L. et al. Oral sodium bicarbonate and bone turnover in CKD: A secondary analysis of the BASE Pilot Trial. Journal of the American Society of Nephrology, v. 35, p. 57–65, 2024.
62. TANGRI, N. et al. VALOR-CKD: A multicenter, randomized, double-blind placebo-controlled trial evaluating veverimer in slowing progression of chronic kidney disease in patients with metabolic acidosis. Journal of the American Society of Nephrology, v. 35, p. 311–320, 2024.
63. DE BRITO-ASHURST, I. et al. Bicarbonate supplementation slows progression of CKD and improves nutritional status. Journal of the American Society of Nephrology, v. 20, p. 2075–2084, 2009.
64. DI IORIO, B. R. et al. Treatment of metabolic acidosis with sodium bicarbonate delays progression of chronic kidney disease: The UBI Study. Journal of Nephrology, v. 32, p. 989–1001, 2019.
65. MAHAJAN, A. et al. Daily oral sodium bicarbonate preserves glomerular filtration rate by slowing its decline in early hypertensive nephropathy. Kidney International, v. 78, p. 303–309, 2010.
66. MOHEBBI, N. et al. Sodium bicarbonate for kidney transplant recipients with metabolic acidosis in Switzerland: A multicentre, randomised, single-blind, placebo-controlled, phase 3 trial. The Lancet, v. 401, p. 557–567, 2023.
67. BiCARB STUDY GROUP. Clinical and cost-effectiveness of oral sodium bicarbonate therapy for older patients with chronic kidney disease and low-grade acidosis (BiCARB): A pragmatic randomised, double-blind, placebo-controlled trial. BMC Medicine, v. 18, p. 91, 2020.
68. RAPHAEL, K. L. et al. Sodium bicarbonate supplementation and urinary TGF-beta1 in nonacidotic diabetic kidney disease: A randomized, controlled trial. Clinical Journal of the American Society of Nephrology, v. 15, p. 200–208, 2020.
93. BANERJEE, T. et al. Dietary acid load and chronic kidney disease among adults in the United States. BMC Nephrology, v. 15, p. 137, 2014.
94. BANERJEE, T. et al. High dietary acid load predicts ESRD among adults with CKD. Journal of the American Society of Nephrology, v. 26, p. 1693–1700, 2015.
95. YEUNG, S. M. H. et al. Net endogenous acid excretion and kidney allograft outcomes. Clinical Journal of the American Society of Nephrology, v. 16, p. 1398–1406, 2021.
96. REBHOLZ, C. M. et al. DASH (Dietary Approaches to Stop Hypertension) diet and risk of subsequent kidney disease. American Journal of Kidney Diseases, v. 68, p. 853–861, 2016.
97. BANERJEE, T. et al. Poor accordance to a DASH dietary pattern is associated with higher risk of ESRD among adults with moderate chronic kidney disease and hypertension. Kidney International, v. 95, p. 1433–1442, 2019.
98. GORAYA, N. et al. Dietary acid reduction with fruits and vegetables or bicarbonate attenuates kidney injury in patients with a moderately reduced glomerular filtration rate due to hypertensive nephropathy. Kidney International, v. 81, p. 86–93, 2012.
99. GORAYA, N. et al. A comparison of treating metabolic acidosis in CKD stage 4 hypertensive kidney disease with fruits and vegetables or sodium bicarbonate. Clinical Journal of the American Society of Nephrology, v. 8, p. 371–381, 2013.
100. GORAYA, N. et al. Treatment of metabolic acidosis in patients with stage 3 chronic kidney disease with fruits and vegetables or oral bicarbonate reduces urine angiotensinogen and preserves glomerular filtration rate. Kidney International, v. 86, p. 1031–1038, 2014.
101. KLAHR, S. et al. The effects of dietary protein restriction and blood-pressure control on the progression of chronic renal disease. Modification of Diet in Renal Disease Study Group. New England Journal of Medicine, v. 330, p. 877–884, 1994.
102. MENON, V. et al. Effect of a very low-protein diet on outcomes: Long-term follow-up of the Modification of Diet in Renal Disease (MDRD) Study. American Journal of Kidney Diseases, v. 53, p. 208–217, 2009.
103. GORAYA, N.; WESSON, D. E. Management of the metabolic acidosis of chronic kidney disease. Advances in Chronic Kidney Disease, v. 24, p. 298–304, 2017.
104. SPELLER, J. (2025). Urinary Regulation of Acid-Base Balance. TeachMePhysiology, [s.d.]. Disponível em: https://teachmephysiology.com/urinary-system/regulation/urinary-acid-base/. Acesso em: 17 mar. 2025.
105. ROY, A.; AL-BATAINEH, M. M.; PASTOR-SOLER, N. M. Collecting duct intercalated cell function and regulation. Clinical Journal of the American Society of Nephrology, v. 10, n. 2, p. 305–324, 2015. Disponível em: https://www.semanticscholar.org/paper/Collecting-duct-intercalated-cell-function-and-Roy-Al-bataineh/0c4e5ea335d1e809d07ab7e238007113660c8644/figure/6. Acesso em: 17 mar. 2025.
106. ZHA, Y.; QIAN, Q., (2017). Protein nutrition and malnutrition in CKD and ESRD. Nutrients, v. 9, n. 3, p. 1-15, 2017.
1 Discente do Curso Superior de Farmácia, Centro Universitário Santa Rita, Conselheiro Lafaiete – MG;
2 Enfermeira, Universidade Federal de Goiás, Goiânia – GO;
3 Discente do Curso Superior de Biomedicina, Pontifícia Universidade Católica (PUC-MINAS), Betim-MG;
4 Discente do Curso Superior de Farmácia, Centro Universitário Santa Rita, Conselheiro Lafaiete – MG;
5 Discente do Curso Superior de Biologia, Universidade Estácio de Sá, Belo Horizonte –MG;
6 Discente do Curso Superior de Biomedicina, Universidade Estácio de Sá, Goiânia – GO;
7 Biólogo, Secretaria Municipal de Educação (SEMED), Morrinhos – GO;
8 Discente do Curso Superior de Enfermagem, FACULDADE ISEIB DE BETIM (FISBE), Betim – MG;
9 Biomédico, Hospital João XXIII (FHEMIG), Belo Horizonte – MG;
10 Psicólogo, Hospital João XXIII (FHEMIG), Belo Horizonte – MG.
