REGISTRO DOI: 10.69849/revistaft/fa10202503082115
Marcus Alexandre Borges Pires1,
José Carlos Guimarães Junior2,
Mário Junior Saviato3
ABSTRACT
Development and functional morphology of the foregut of larvae and megalopa of Minuca rapax (Herbest, 1804) (Decapoda, Brachyura). The knowledge of feeding behavior of larvae and megalopa of decapod may be considered of real importance for obtaining successful larval culture. Information on morphological development of the foregut may be used as contribution in larval culture, because its reveals king of food or, weather there is lecithotrophy at some, or even, at whole larval cycle. The structural development of the foregut and digestive function were examined in the present study, for larvae and megalopa of M. rapax, they were obtained under laboratory rearing. After hatching, larvae were cultured in recipients (150 mL, salinity 30), at density of 10 larvae/recipient. Samples were immersed in potassium hydroxide solution, 5% (p/v) and observed under microscope. The zoeal foreguts bear a developed and functional cardiopyloric valve and filter press. The megalopa shows a specialized and complex gastric mill. The results of this study reveal feeding is necessary during all M. rapax larval culture and, support previous suppositions that feeding larval and post larval behavior is related with the morphological characteristics of the foreguts.
Keywords: Fiddler crab, Minuca rapax, larval morphology, foregut, digestive system.
RESUMO
O conhecimento do comportamento alimentar de larvas e megalopa de crustáceos decápodes é considerado de grande importância para obtenção do sucesso em cultivos larvais. Informações sobre o desenvolvimento morfológico do estômago poderão ser usadas como contribuição em cultivos, pois eles revelam o tipo de alimento, ou, se ocorre lecitotrofia em alguns ou até mesmo em todo ciclo larval. O desenvolvimento da estrutura do estômago e da função digestiva foi examinado, no presente estudo, em larvas e megalopa de Minuca rapax, obtidos em cultivo no Laboratório. Após a eclosão, larvas foram cultivadas em recipientes (150 mL, salinidade 30), na densidade de 10 larvas/recipiente. Amostras foram imersas em solução aquosa de hidróxido de potássio (KOH) a 5% (p/v) e observadas em microscópio. Os estômagos dos zoeae possuem válvula cárdio-pilórica e filtro pilórico desenvolvido e funcional. O megalopa exibe um complexo e especializado moinho gástrico. Os resultados deste estudo revelam que a alimentação é necessária durante todo cultivo de M. Rapax e, fortalece suposições anteriores que o comportamento alimentar de larva e megalopa está diretamente relacionada com as características morfológicas dos estômagos.
Palavras-Chave: Caranguejo chama-maré, Minuca rapax, morfologia larval, estômago, sistema digestivo.
1. INTRODUÇÃO
A alimentação é um importante fator interferindo de forma decisiva no cultivo de larvas de crustáceos. Para se obter sucesso no cultivo de decápodes é importante que se tenha conhecimento sobre o alimento adequado para as larvas e pós-larvas. Entretanto, pouco se sabe a respeito da alimentação apropriada para o desenvolvimento completo, ou de alguns estágios, em larvas deste grupo.
Evidências de abstinência de alimento, por exemplo, foram observadas em larvas durante a fase transitória (puerulus) para várias espécies do gênero Panulirus, Jasus e Palinurus (KITTAKA 1988, 1994; KITTAKA & IKEGAMI 1988, KITTAKA et al. 1997). Durante esse período essas espécies não se alimentam, pois ocorrem grandes mudanças morfológicas no sistema digestivo durante a metamorfose pela redução de mandíbulas e número de cerdas e apêndices bucais pouco desenvolvidos (NISHIDA et al. 1990, WOLFE & FELGENHAUER 1991, MIKAMI & TAKASHIMA 1993, LEMEENS & KNOTT 1994). Abrunhosa & Kittaka (1997a, b) observaram fato semelhante em caranguejos pertencentes ao gênero Paralithodes (importante recurso pesqueiro do Pacífico Norte), estes não se alimentam no estágio megalopa (fase transitória), e mais recentemente a mesma observação foi feita durante a fase zoea do thalassinídeo Lepidophthalmus siriboia (ABRUNHOSA et al., 2006).
A observação do comportamento e aspectos da morfologia larval de espécies cultivadas em pequena escala em laboratório serve de base para a compreensão das complexas relações biológicas e ecológicas que ocorrem na natureza (ANGER, 2001). Em relação à análise morfológica do sistema digestivo (apêndices bucais e moinho gástrico), este estudo poderá contribuir para aumento na taxa de sobrevivência da criação e aprimoramento de novos métodos de cultivo através da escolha e utilização de dietas mais eficazes e mais viáveis economicamente (ABRUNHOSA & KITTAKA, 1997a,b; ABRUNHOSA & MELO, 2002; ABRUNHOSA et al., 2003).
Em estudos anteriores, as observações sobre o desenvolvimento do estômago e de apêndices bucais têm, indiscutivelmente, contribuído para entender o hábito alimentar de espécies utilizadas na aqüicultura, auxiliando na identificação de alimentos adequados e na obtenção de condições satisfatórias de cultivo larval, consequentemente aumentando a taxa de sobrevivência durante o desenvolvimento larval (NISHIDA et al., 1990; MINAGAWA & TAKASHIMA, 1994; ABRUNHOSA & KITTAKA, 1997a).
Em geral, muitos estudos foram focados principalmente mostrando os aspectos morfológicos e funcionais dos estômagos de crustáceos decápodes adultos (MEISS & NORMAN, 1977; KUNZE & ANDERSON, 1979; SUTHERS & ANDERSON, 1981; SUTHERS, 1984; SKILLETER & ANDERSON, 1986; MIKAMI & TAKASHIMA, 1993; PINN et al., 1999; JHA & HOMECHAUDHURI, 2001; BROSING et al., 2002; CASTRO & BOND-BUCKUP, 2003). Entretanto, poucos esforços foram feitos para se conhecer este funcionamento em larvas e pós-larvas de crustáceos o que representa uma lacuna para o entendimento da biologia destes indivíduos, apesar de alguns trabalhos semelhantes serem realizados em pequena escala no Brasil.
Este estudo investiga um pequeno crustáceo da família Ocypodidae, o caranguejo M. rapax, que geralmente vive em tocas escavadas no substrato lodoso na vizinhança de manguezais, ao longo de rios, riachos e em lagoas nas regiões tropicais e subtropicais. Esta espécie possui ampla distribuição geográfica, podendo ser encontrada na Flórida, Golfo do México, Antilhas, Venezuela e no Brasil (do Pará até Santa Catarina) (MELO, 1996).
Em relação ao cultivo larval, Simith et al. (2014), reportaram que M. rapax tem o ciclo larval constituído por 5 estágios zoea e 1 megalopa, durante a realização do teste de salinidade. O presente estudo descreve e compara a morfologia do estômago de M. rapax, nos diferentes estágios de zoeae I, V e megalopa, e discute sobre a relação com sua funcionalidade.
2. MATERIAL E MÉTODOS
Obtenção das larvas
Uma fêmea ovígera de M. rapax foi coletada manualmente no manguezal do estuário do Rio Caeté, próximo ao portinho (Figura 1), na região bragantina (Bragança, Pará), cidade situada a 210 km de Belém, entre as coordenadas (S 01°02’55.4”; W 046°45’15.8”), e foi transportada para o Laboratório de Carcinologia do Instituto de Estudos Costeiros e Estuarinos da Universidade Federal do Pará.
No laboratório, a fêmea foi lavada com água marinha e acondicionada em um aquário de vidro de 5 L, contendo água marinha filtrada e com mesma salinidade do ambiente em que foi coletada. Ela permaneceu nesta condição até o momento da eclosão.
Cultivo
Após a eclosão, ocorrida no dia seguinte à chegada da fêmea, as larvas foram retiradas e transferidas para 10 recipientes contendo de 150 ml de água marinha (salinidade 30) na densidade de 10 larvas/recipiente. Foram realizados monitoramentos diários da qualidade da água onde foram mensurados pH, temperatura e salinidade, ocorreu troca total de água a cada 2 dias.
As larvas foram alimentadas com náuplios recém eclodidos de Artemia e adultos de rotífero Brachionus plicatilis. Microalga Thalassiosira sp foram adicionadas ao cultivo.
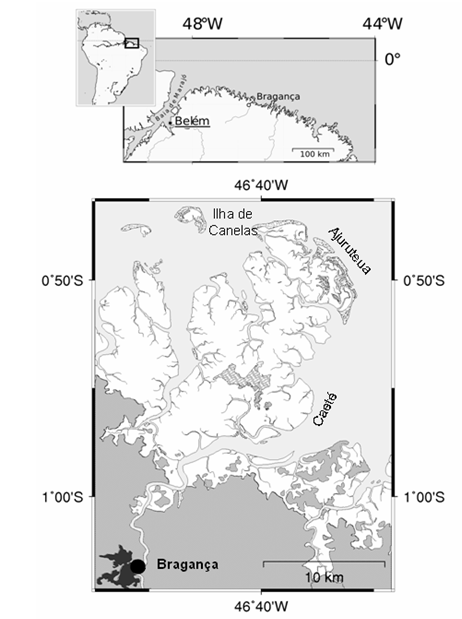
Figura 1: Mapa ilustrando o ponto de coleta na península Bragantina (modificado de MEHLIG, 2001)
Preparação das larvas para a dissecação
Para dissecação dos estômagos foram utilizados 10 indivíduos do primeiro e últimos estágios larvais e megalopa. A metodologia aplicada foi similar a aquela utilizada por Abrunhosa et al. (2003).
As amostras foram fixadas em solução aquosa de formol a 10% (v/v), por 24 horas, posteriormente foram imersas em solução aquosa de hidróxido de potássio (KOH) a 5% (p/v) aquecida em estufa a 80°c por 30 minutos. Em seguida, as amostras foram lavadas em água destilada e imersas em solução de álcool etílico 70% e glicerol (1:1).
Ilustração e descrição do estômago.
Após o tratamento citado anteriormente, os indivíduos foram colocados em lâminas contendo álcool etílico 70% + glicerol (1:1). A dissecação foi realizada sob microscópio óptico binocular ZEISS com auxílio de agulhas finas (BD Ultra-Fine®, 12.7 x 0,33mm). Os estômagos foram extraídos e transferidos para outras lâminas, onde foram corados com solução azul de metileno a 1%.
Os estômagos foram observados em vista lateral, dorsal e ventral e, ilustrados em vista lateral direita através de desenho manual com auxílio de um disco micrômetro e régua. A nomenclatura da descrição dos estômagos segue os reportados por Meiss & Normann (1977), Nishida et al. (1990), Abrunhosa & Kittaka (1997a) e Abrunhosa et al. (2003).
3. RESULTADOS
Cultivo larval
O desenvolvimento completo de M. rapax consistiu de 5 estágios zoeae e 1 megalopa. A sobrevivência dos estágios larvais zoea foi elevada, em torno de 85%. O desenvolvimento larval teve uma duração de 10 a 12 dias até as larvas alcançarem a fase de megalopa (Figura 2). A sobrevivência total das larvas até o estágio de megalopa foi de 80%.
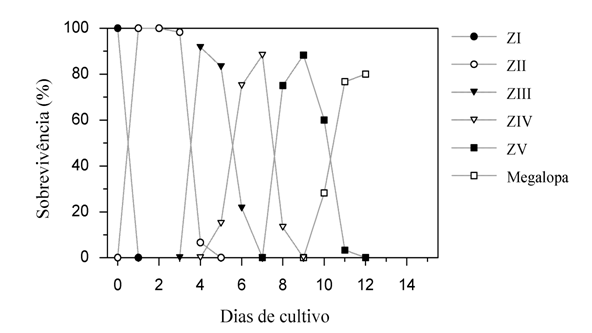
Figura 2: Sobrevivência das larvas ao longo do cultivo em salinidade 30.
Morfologia do estômago das larvas
O primeiro e último estágio larval de M. rapax apresentaram nos estômagos: válvula cárdio-pilórica separando a câmara cardíaca da câmara pilórica; e o filtro pilórico, o qual se torna especializado durante o desenvolvimento das larvas.
Há um grau de especialização do estômago ao longo do desenvolvimento larval, onde se percebe um aumento no número de cerdas, tamanho e conformação dos mesmos. Durante a metamorfose de larva para pós-larva ocorre grande alteração morfológica nos estômagos, como o surgimento de ossículos e dentes do moinho gástrico.
Os estômagos foram observados e descritos apenas no primeiro e último estágio larval e megalopa, pois entre os estágios larvais do zoea I a zoea V ocorrem pouquíssimas mudanças morfológicas, o que justifica a não descrição destes estágios neste trabalho.
Descrição morfológica dos estômagos
Zoea I (Figura 3)
Estômago simples, quitinoso, desprovido de estruturas rígidas e mede 1,1 mm.
Câmara cardíaca: pouco mais larga que a câmara pilórica; parede cardíaca desprovida de cerdas; numerosas cerdas finas na base do assoalho; válvula cárdio-pilórica arredondada e robusta, com várias cerdas em toda sua extensão e apresentando fortes cerdas na porção posterior.
Câmara pilórica: com cerdas finas em toda porção posterior, filtro pilórico largo e desenvolvido ocupando toda a porção inferior da câmara, numerosas cerdas na crista interampulária.
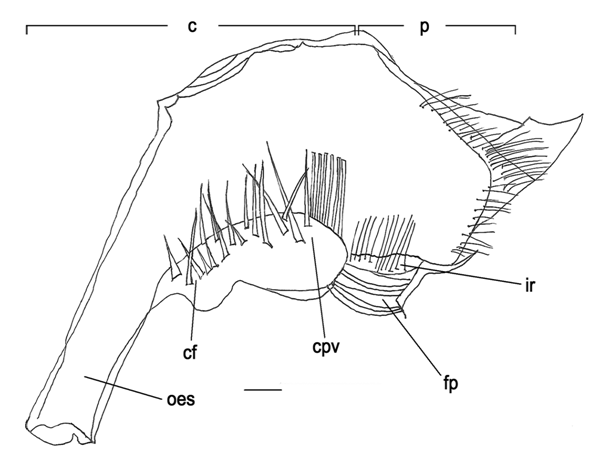
Figura 3. Minuca rapax. Estômago do zoea I em vista lateral (direita). Barras de escala = 0.3mm. Abreviações: fp= filtro pilórico; ir= crista interampulária; cpv= válvula cárdio-pilórica; cf= assoalho cardíaco; oes= esôfago; c= câmara cardíaca; p= câmara pilórica.
Zoea V (Figura 4)
Estômago mais complexo que o estágio I desprovido de estruturas rígidas; comprimento total 1,8 mm.
Câmara cardíaca: teto apresentando finas cerdas no assoalho com fileiras de cerdas alongadas e finas na porção anterior, porção posterior com numerosas cerdas longas e rígidas; parede da câmara cardíaca desprovida cerdas, válvula cárdio-pilórica arredondada e larga com fortes cerdas em quase toda sua extensão.
Câmara pilórica: cerca de 2/5 da câmara cardíaca; com finas cerdas na porção posterior do teto; filtro pilórico especializado, ocupando toda a porção inferior da câmara; crista interampulária com fileiras de cerdas alongadas e médias; rede ampulária visivelmente desenvolvida e funcional.
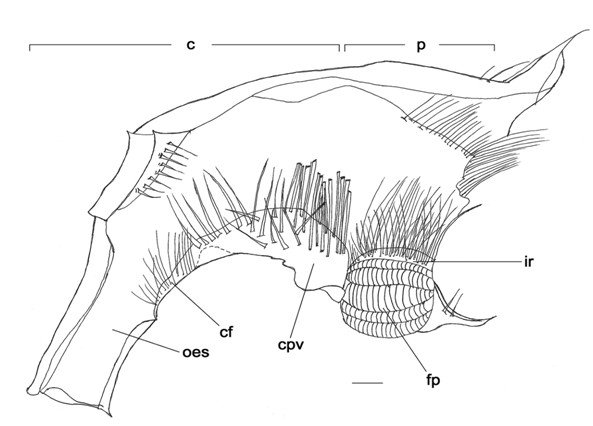
Figura 4. Minuca rapax. Estômago do zoea V (último estágio larval) em vista lateral (direita). Barras de escala = 0.4mm. Abreviações: fp= filtro pilórico; ir= crista interampulária; cpv= válvula cardio-pilórica; cf= assoalho cardíaco; oes= esôfago; c= câmara cardíaca; p= câmara pilórica.
Megalopa (Figura 5)
Estômago com moinho gástrico desenvolvido apresentando válvula esofagal e outras estruturas rígidas; comprimento total 3,8 mm.
Câmara cardíaca: alargada dorso-lateralmente pelas placas e ossículos do moinho gástrico (cerca de 3 vezes o comprimento da câmara pilórica); assoalho apresenta-se quase verticalmente; numerosos ossículos do moinho gástrico presentes (fig. 5), tais como: mesocardíaco, pterocardíaco, zigocardíaco (sustentando os dentes laterais), urocardíaco (suportando o dente medial), propilórico, exopilórico e pilórico. Outros ossículos também são encontrados como: pré-pectinal, pectinal, pós-pectinal, exopilórico, subdentado, lateral cardíaco inferior e lateral da válvula cárdio-pilórica; válvulas cárdio-pilórica especializada e robusta, com cerdas firmes ma porção superior.
Câmara pilórica: com finas cerdas na porção posterior do teto; filtro pilórico especializado com a rede ampulária bem desenvolvida e funcional; crista interampulária com fileiras de cerdas alongadas. Alguns ossículos presentes (fig. 5): uropilórico, pleuropilórico anterior, pleuropilórico posterior, pleuropilórico mediano, pré-ampulário, inferior pilórico posterior e inferior pilórico anterior.
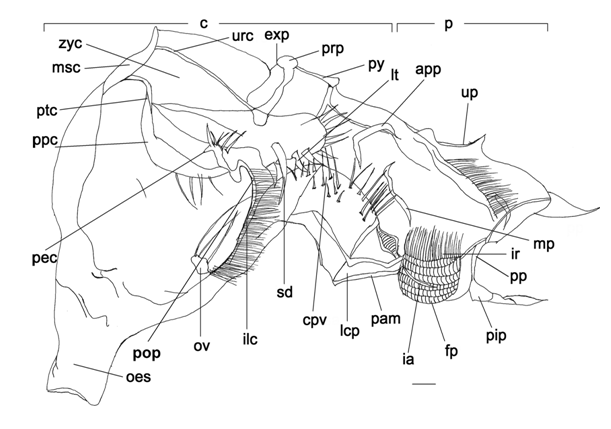
Figura 5. Minuca rapax. Estômago do megalopa em vista lateral (direita). Barras de escala =0.4mm. Abreviações: app = ossículo pleuropilórico anterior (um par); c = câmara cardíaca; cpv = vávula cardiopilórica; exp = ossículo exopilórico (um par); fp = filtro pilórico; ia = ossiculo ampulário inferior, ir = crista interampulária; ilc = ossiculo lateral cardíaco anterior; lcp = ossículo lateral da vávula cardiopilórica; lt = dente lateral (um par); mp = ossículo pleuropilórico mediano (um par); msc = ossículo mesocardíaco (um); oes = esôfago; p = câmara pilórica; ov = válvula esofagal; p = câmara pilórica; pam = ossículo pré-ampulário; pec = ossículo pectinal (um par); pip = ossículo inferior pilórico posterior (um); pop = ossículo pós-pectinal (um par); pp = ossículo pleuro pilórico posterior (um par); ppc = ossículo pré- pectinal (umpar); prp = ossículo propilórico (um); ptc = ossiculo pterocardíaco; py = ossículo pilórico (um); sd = ossículo subdentado (um par); up = ossículo uropilórico (um, as vezes dois); urc = ossículo urocardíaco (um); zyc = ossículo zygocardíaco (um par).
4. CONSIDERAÇÕES FINAIS
A espécie M. rapax possui uma vida larval considerada relativamente curta quando comparada a outras larvas de decápodes como palaemonídeos do gênero Macrobrachium (QUADROS et al., 2004). Deste modo, 5 estágios zoea e 1 megalopa é, em geral, o que ocorre nos cultivos dos demais brachyuras. No entanto, algumas larvas de decápodes possuem um período ainda mais reduzido de estágios, como é o caso do thalassinídeo Lepidophthalmus siriboia que foi reportada como tendo apenas 3 estágios zoae e 1 megalopa (ABRUNHOSA et al., 2006). Para esta espécie foi ainda constatada a completa lecitotrofia ocorrendo em seu desenvolvimento.
O prolongado desenvolvimento larval pode implicar a não ocorrência da lecitotrofia. As observações do presente estudo apontam que o estômago em todos os estágios de zoea apresenta cerdas específicas na válvula cárdio-pilórica e no filtro pilórico, este fato sugere fortemente que esta espécie necessita de alimento externo para completar seu desenvolvimento larval.
O estômago observado no zoea I de M. rapax é morfologicamente simples, porém provido de cerdas específicas e um filtro pilórico aparentemente funcional (figura 3). Essas estruturas estão presentes na maioria das larvas de decápodes (zoea), sendo uma característica destes. Observações semelhantes foram realizadas em Sesarma curacaoense e S. rectum por (MELO et al., 2006; ABRUNHOSA et al., 2008). Os apêndices bucais também são desenvolvidos e funcionais. Isto sugere que as larvas de zoea I de M. rapax estão aptas a se alimentarem de partículas moles como náuplios recém eclodidos de Artemia, rotíferos ou microalgas. Isso coincide com aqueles trabalhos realizados para larvas de outros decápodes (FACTOR, 1989; NISHIDA et al., 1990; ABRUNHOSA & KITTAKA, 1997a,b; ABRUNHOSA & MELO, 2002; ABRUNHOSA et al., 2003).
Assim como no estágio larval I, o estômago de zoea V também não possui moinho gástrico. No entanto, pode-se observar um aumento no grau de especialização do estômago com o incremento de cerdas, principalmente na válvula cárdio-pilórica e na complexidade do filtro pilórico (Figura 4), sugerindo que o estômago dos zoea não tem função de triturar ou moer, mas de misturar os alimentos com enzimas digestivas. Fato este que coincide com trabalhos publicados sobre larvas de decápodes (NISHIDA et al., 1990; ABRUNHOSA & KITTAKA, 1997a,b; ABRUNHOSA & MELO, 2002; ABRUNHOSA et al., 2003). Deste modo, não é recomendável utilizar partículas duras de alimento durante o cultivo larval de M. rapax.
De acordo com os resultados do presente estudo, após a metamorfose para megalopa, ocorre uma brusca mudança morfológica no estômago de M. rapax, tornando-se bastante complexo com o surgimento do moinho gástrico com ossículos e dentes laterais fortes e calcificados (Figura 5). A presença dessas estruturas rígidas e calcificadas indica que os indivíduos pertencentes a este estágio estão aptos a ingerir partículas alimentares mais duras, diversificando assim a sua dieta. Observações similares foram relatadas para a espécie Ucides cordatus (ABRUNHOSA et al., 2003).
REFERÊNCIAS BIBLIOGÁFICAS
ABRUNHOSA, F. A. & KITTAKA, J. Functional morphology of mouthparts and foregut of the last zoea, glaucothoe and first juvenile of the king crabs Paralithodes camtschaticus, P. brevipes and P. platypus. Fisheries Science, Tóquio, v. 63, n. 6, p. 923- 930, 1997a.
ABRUNHOSA, F. A. & KITTAKA, J. Morphological changes in the midgut gland and hindgut during the larval and postlarval development of the red king crab Paralithodes camtschaticus. Fisheries Science, Tóquio, v. 63, n. 5, p. 746-754, 1997b.
ABRUNHOSA, F. A. & MELO, M. A. Morfologia comparative do estômago do primeiro e último estágios zoea e juvenile I de Macrobrachium rosenbergii (De Man, 1879) (Decapoda, Ocypodidae). Revista Ciência Agronômica, v. 33, n. 2, p. 65-68, 2002.
ABRUNHOSA, F. A., MELO, M. A. & ABRUNHOSA, J. P. Development and functional morphology of the foregut of larvae and postlarva of Ucides cordatus (Decapoda, Ocypodidae). Nauplius, v. 11, n. 1, p. 37-43, 2003.
ABRUNHOSA, F. A., MELO, M., LIMA, J. F. & ABRUNHOSA, J. Developmental morphology of mouthparts and foregut of the larvae and postlarvae of Lepidophthalmus siriboia Felder & Rodrigues, 1993 (Decapoda: Callianassidae). Acta amazônica, v. 36, n. 3, p. 335-342, 2006.
ABRUNHOSA, F. A. & MELO, M. Development and functional morfology of the foreguts of larvae and potlarvae of three crustacean decapods. J. Biol., v. 68, p. 221-228. 2008.
ANGER, K. The biology of Decapod Crustacean Larvae. In: VONK, R. Crustacean Issues 14. Lisse: A. A. Balkema Publishers, 2001. p. 109 – 144.
BRÖSING, A.; RICHTER, S.; SCHOLTZ, G. The foregut-ossicle system of Dromia wilsoni, Dromia personata and Lauridromia intermedia (Decapoda, Brachyura, Dromiidae), studied with a new staining method. Arthropod Structure & Development, Seewiesen, v. 30, n. 4, p. 329 – 338, 2002.
CASTRO, T.S.; BOND-BUCKUP, G. The morphology of cardiac and pyloric foregut of Aegla platensis Schmitt (Crustacea: Anomura: Aeglidae). Memoirs of Museum Victoria, Melbourne, v. 60, n. 1, p. 53 – 57, 2003.
FACTOR, J. R. Development of the feeding apparatus in decapods crustaceans. In: Felgenhauer, B. E., Watling, L., Thistle, A. B. Crustacean issues, 1989, n. 6, p. 185-203.
JHA, A.; HOMECHAUDHURI, S. Understanding the gastric mill structure of a macrophagous shrimp Metapenaeus monoceros (Fabricius). Current Science, Bangalore, v. 80, n. 5, p. 620 – 622, 2001.
KITTAKA, J. Culture of the palinurid Jassus lalandii from egg to puerulus. Nippon Suisan Gakkaishi, v. 54, n. 1, p. 87-93, 1988.
KITTAKA, J. & IKEGAMI, E. Culture of the palinurid Panulirus elephas from egg stage to puerulus. Nippon Suisan Gakkaishi, v. 54, n. 7, p. 1149-1154, 1988.
KITTAKA, J. Larval rearing. In: B. F. Phillips, J. S. Cobb & J. Kittaka. Spiny lobster management, 1994, p. 402-423.
KITTAKA, J., ONO, K. & BOOTH, J. D. Complete development of the green rock lobster Jassus verreauxi from egg to juvenile stage. Bull. Mar. Sci., v. 61, p. 57-71, 1997.
KUNZE, J. & ANDERSON, D. T. Functional morphology of the mouthparts and gastric mill in the hermit crab Clibanarius taeniatus (Milene Edwards), Clibanarius virescens (krauss), Paguristes squamosus McCulloch and Dardanus setifer (Milene Edwards) (Anomura: Paguridae). Austr. J. Mar. Fresh. Res., v. 30, p. 683-722, 1979.
LEMMENS, J. W. T. J. & KNOTT, B. Morphological changes in external and internal feeding structures during the transition phyllosoma-juvenile in the western rock lobster (Panulirus Cygnus, Decapoda: Palinuridae). J. Morph., v. 220, n. 271-280, 1994.
MELO, G. A. S. 1996, Manual de identificação dos Brachyura (caranguejos e siris) do litoral Brasileiro. 1º ed. São Paulo: editora Plêiade, FADESP., 1996, 453 p.
MELO, A. M., ABRUNHOSA, F. A. & SAMPAIO, I. The morphology of the foregut of larvae of postlarva and Sesarma curacaoense De Man, 1892: a species with facultative lecithotrophy during larval development. Acta amazonica, v. 36, n. 6, p. 375-380, 2006.
MEISS, D. E. & NORMAN, R. S. Comparative study of the stomatogastric system of several decapod Crustacea. J. Morph., v. 152, p. 21-54, 1977.
MEHLIG, U. Aspects of tree primary production in an equatorial mangrove forest in Brazil. ZMT Contributions 14, Center for Tropical Marine Ecology (ZMT), Bremen, Alemanha, 2001, 155p.
MIKAMI, S. & TAKASHIMA, F. Development of the proventriculos in larvae of the slipper lobster, Ibacus ciliatus (Decapoda, Scyllaridae). Aquaculture, 116: 199-217, 1993.
MINAGAWA, M. & TAKASHIMA, F. Developmental changes in larval mouthparts and foregut in the red frog crab, Ranina ranina (Decapoda: Raninidae). Aquaculture, v. 126, p. 61-71, 1994.
NISHIDA, S., QUIGLEY, B. D., BOOTH, J. D., NEMOTO, T. & KITTAKA, J. Comparative morphology of the mouthparts and foregut of the final stage phyllosoma, puerulus, and postpuerulus of the rock lobster Jasus edwardsii (Decapoda: Palinuridae). J. Crust. Biol., v. 10, p. 293-305, 1990.
PINN, E. H. NIKELL, L. A., ROGERSON A. & ARKINSON, R. J. A. Comparison of gut morphology and gut microflora of seven species of mud shrimp (Crustacea: Decapoda: Thalassinidae). Mar. Biol., v. 133, p.103-114, 1999.
QUADROS, M. L. A., 2004, Reprodução do camarão-canela Macrobrachium Acanthurus em condições controladas de laboratório e montagem de um Atlas para identificação de estágios larvais. Disponível em: <http://www2.ufpa.br/rcientifica/ed_anteriores/pdf/ed_04_mlaq.pdf> Acesso em: 26 fev. 2025.
RIEGER, P. J. Desenvolvimento larval de Uca (Minuca) vocator (Herbest, 1804). (Crustacea, Decapoda, Ocypodidae), em laboratório. Náuplius, v. 7, p. 1-32, 1999.
SIMITH, D. J. B., PIRES, M. A. B., ABRUNHOSA, F. A., MACIEL, C. R.; DIELE, K. Is larval dispersal a necessity for decapod crabs from the Amazon mangroves? Response of Uca rapax zoeae to different salinities and comparison with sympatric species. Journal of Experimental Marine Biology and Ecology, v. 457, p. 22 – 30, 2014.
SKILLETER, G. A. & ANDERSON, D. T. Functional morphology of the chelipeds, mouthparts and gastric mill of Ozius truncates (Milne Edwards) (Xanthidae) and Leptograpsus variegates (Fabricius) (Grapsidae) (Brachyura). Aust. J. Mar. Freshwater Res., v. 35, p. 785-792, 1986.
SUTHERS, I. M. & ANDERSON, D. T. Functional morphology of mouthparts and gastric mill of Ibacus peronii (Leach) (Paninura: Scyllaridae). Aust. J. Mar. Freshwater Res., v. 32, p. 931-944, 1981.
SUTHERS, I. M. Functional morphology of the mouthparts and gastric mill in Penaeus plebejus Hess (Decapoda: Penaeidae). Aust. J. Mar. Freshwater Res., v. 35, p. 785-792, 1984.
WOLFE, S. H. & FELGENHAUER, B. E. Mouthpart and foregut ontogeny in larval, postlarval, and juvenile spiny lobster Panulirus argus Latreille (Decapoda: Palinuridae). Zool. Scripta., v. 20, p. 57-75, 1991.
1Doutorando em Ciências Biológicas Laboratório de Carcinologia / Instituto de Estudos Costeiros (IECOS), Universidade Federal do Pará (UFPA), Campus Universitário de Bragança. Alameda Leandro Ribeiro s/n, Bairro: Aldeia, 68600-000, Bragança, PA, Brasil marcusalexandre159@gmail.com
2https://orcid.org/0000-0002-8233-2628 Doutor em Biodiversidade e Biotecnologia Governo do Distrito Federal -GDF, SIA Trecho 5, lote 4255profjc65@hotmail.com
3Doutor em Biodiversidade e Biotecnologia- Rede Bionorte https://orcid.org/0000-0002-8757-7915 msaviato@yahoo.com.br Federal University of Amapá – UNIFAP, Rod. Juscelino Kubitscheck, km 02 – CEP: 68.903-419 – Macapá/AP
