REGISTRO DOI: 10.69849/revistaft/cs10202502241524
Elaine de Oliveira Bastos de Aviz1
Vera Lucia Gomes Martins2
Resumo
As cirurgias cardíacas podem ser realizadas em qualquer idade, embora o risco de complicações em cirurgias muito invasivas e relativamente longas seja maior em idosos e crianças de baixo peso. Na grande maioria dessas intervenções, contam com a circulação extracorpórea que revolucionou as cirurgias cardíacas. A circulação extracorpórea (CEC) consiste na substituição temporária do coração e dos pulmões por uma máquina durante alguns procedimentos cirúrgicos, tornando o tempo cirúrgico mais seguro e eficiente. O objetivo do estudo foi descrever as funções que devem ser realizadas pelo perfusionista durante a circulação extracorpórea em pacientes pediátricos submetidos a cirurgia cardiovascular. Foi realizada uma revisão sistemática da literatura através do banco de dados do Scielo e PubMed com artigos em inglês e português entre os anos 2012 e 2023.
Palavras-chave: Circulação extracorpórea. Cirurgia cardíaca pediátrica. Perfusão.
Introdução
A cirurgia cardíaca é uma forma de tratamento de patologias coronarianas e miocárdicas que visa aumentar a sobrevida e a qualidade de vida do paciente. Porém, este tipo de cirurgia está relacionado a efeitos deletérios sobre os principais sistemas corporais, como os sistemas cardiovascular, nervoso central, digestivo, renal e respiratório. Neste contexto, as complicações pulmonares emergem como uma causa importante de aumento da morbimortalidade no pós-operatório.1 As opções terapêuticas da insuficiência coronária incluem tanto o tratamento clínico, através de medicamentos, quanto o cirúrgico.2
A cirurgia cardiovascular é um procedimento de alta complexidade e na maioria das vezes de longa duração, sendo utilizada a circulação extracorpórea (CEC) em grande parte dos procedimentos, por oferecer um campo cirúrgico limpo e seguro. O circuito de CEC possui dois reservatórios, tendo o reservatório venoso a função de receber o sangue proveniente da drenagem venosa e o reservatório de cardiotonia a função de receber o sangue proveniente do campo operatório, recuperado por aspiração. Além disso, a técnica conta com um oxigenador acoplado a um permutador de calor. Entre o oxigenador e a cânula arterial, é instalado filtro de linha arterial.3,4 A CEC ou perfusão extracorpórea é uma técnica em constante evolução, hoje os seus princípios básicos já são bem estabelecidos. Os seus efeitos sobre o organismo humano ainda não estão inteiramente conhecidos, assim como a fisiopatologia de diversas reações do organismo a esse procedimento. As intercorrências da resposta inflamatória desencadeada pela CEC são multifatoriais. Dessa forma, há sincronia entre diversos mecanismos pró-inflamatórios e, esta ação conjunta, resulta na violação da homeostase. Esta sinergia usualmente ocorre entre processos bioquímicos, hormonais e célulares podendo ser corrompida por alguns eventos inerentes à CEC.5
A pergunta norteadora do estudo foi: Quais seriam as principais ações realizadas pelo perfusionista na condução da circulação extracorpórea em pacientes submetidos a cirurgias cardiovasculares? Diante do exposto, o objetivo do estudo foi descrever as funções que devem ser realizadas pelo perfusionista durante a circulação extracorpórea em pacientes submetidos a cirurgias cardiovasculares.
Materiais e Métodos
Foi realizada uma revisão sistemática da literatura científica através do banco de dados do Scielo e PubMed com artigos em inglês e português entre os anos 2012 e 2023. Os critérios de inclusão foram artigos completos em inglês e português publicados utilizando os descritores de circulação extracorpórea; cirurgia cardíaca pediátrica; perfusão. Foram excluídos os artigos sem conformidade com a inclusão.
Resultados e Discussão
Foram analisados 14 artigos científicos com a utilização da perfusão extracorpórea em cirurgia cardíaca pediátrica.
A cirurgia cardíaca é um procedimento utilizado no tratamento de enfermidades cardiovasculares graves e apresenta taxas significativas de complicações pós operatórias. Entre elas, estão as complicações respiratórias, como a redução da oxigenação, da função pulmonar, da força muscular respiratória e, até mesmo, alterações radiológicas como atelectasias e derrames pleurais, que aumentam o risco de morbimortalidade pós-operatória.6
As cirurgias podem ser realizadas em qualquer idade, embora o risco de complicações em cirurgias muito invasivas e relativamente longas seja maior em idosos e crianças de baixo peso. O tempo de anestesia, necessidade e tempo de circulação extracorpórea, local da incisão, drenos torácicos, tempo de cirurgia e trauma cirúrgico também podem gerar complicações. Além disso, a duração da ventilação mecânica e o tempo de sedação prolongado podem diminuir a força muscular — o que provoca perda da mobilidade e um período mais longo na Unidade de Terapia Intensiva (UTI).3
O tratamento de crianças cardiopatas varia de acordo com a gravidade da anomalia. Intervenções mais simples incluem resolução da alteração via cateterismo cardíaco. Outras são oclusão da persistência do canal arterial, implante de stent e dilatação com balão para obstrução pulmonar. Pacientes com cardiopatias mais graves necessitam de maiores intervenções, muitas delas podendo requerer uma série de cirurgias, iniciadas nos primeiros meses de vida e se estendendo, em média, até os três anos de idade. A indicação do tipo de cirurgia dependerá da gravidade da cardiopatia, sendo indicadas as cirurgias paliativas em casos mais complexos, de forma inicial, até a compensação do quadro e condições de idade e peso para a correção total.7
Criada em 1950 pelo cirurgião cardíaco John H. Gibbon, e utilizada pela primeira vez com sucesso em um humano pelo mesmo em 1952, a CEC é uma técnica que permite o desvio da circulação sanguínea do sistema venoso para o circuito da CEC, que replica a função do coração e dos pulmões por meio de uma bomba e um oxigenador. O sangue é devolvido ao sistema circulatório do paciente a partir de uma cânula arterial, percorrendo novamente o sistema venoso até ser novamente desviado, para que o coração permaneça imóvel e sem sangue, o que pode ser entendido como circulação artificial.7;8
A CEC permite que lesões cardíacas sejam restauradas, dando ao cirurgião a oportunidade de trabalhar de forma segura e realizar a correção de defeitos, considerados impossíveis em outras formas. Esta técnica deverá ser realizada de forma perfeita de entrosamento de toda equipe envolvida, para que nenhum detalhe escape à observação correta, evitando, colocar em risco a vida do paciente ou sua integridade física e mental. Procedimento considerado de alta complexidade, onde os profissionais, realize-o com segurança, precisam deter de conhecimentos profundos, de forma que as decisões sejam automáticas e imediatas. Para adquirir estas habilidades, se faz necessário os conhecimentos teóricos sólidos e treinamento exaustivo.8
O controle da CEC é feito através de uma máquina coração-pulmão (CP), que faz a propulsão e aspiração do sangue. A máquina é constituída por um painel de controle, oxigenador (que fica acoplado a um permutador de calor e entre o oxigenador e a cânula arterial, é instalado um filtro de linha arterial), reservatório, bomba arterial que substitui a função contráctil do coração, cardioplegia (sistema de mistura de sangue e solução cardioplégica) e tubos ou cânulas (arterial e venosos) (Figuras 1).8
Figura 1. Modelo de máquina coração-pulmão: A – Aspirador aórtico, B – Aspirador de cardiotomia/campo operatório, C – Aspirador ventricular, D – Bomba arterial, E – Retorno venoso, F – Oxigenador de membrana.
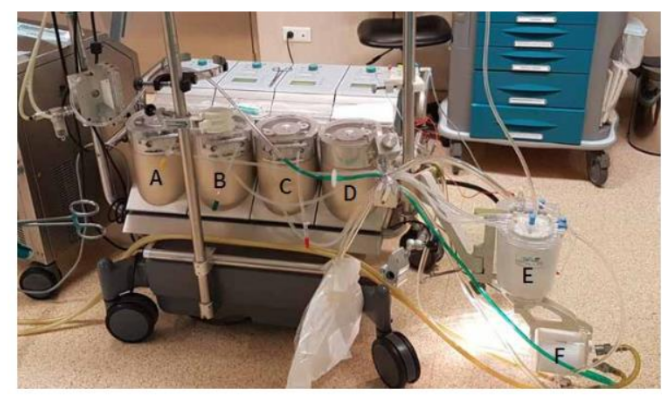
É utilizada em cirurgias cardíacas, cujo paciente é ligado ao circuito artificial que deverá desviar o fluxo do sangue, impedindo que o mesmo chegue ao coração e ao mesmo tempo garantindo a manutenção das funções vitais do paciente, principalmente garantindo a oxigenação do tecido sanguíneo. Apesar de ser uma prática comumente realizada, principalmente para cirurgias cardíacas, podem surgir complicações decorrentes do uso da CEC.9
O reservatório de cardioplegia é um sistema para coleta de sangue oxigenado do paciente ou solução cristaloide específica destinada para proteção do miocárdio. Na verdade, a proteção miocárdica pode ser obtida com o auxílio de soluções cardioplégicas acrescidas de substratos, ou elementos que possibilitem a proteção desejada.10
O desenvolvimento de métodos de proteção e ressuscitação miocárdica tem evoluído de forma rápida e consistente nos últimos anos, principalmente devido ao estabelecimento de bases fundamentais para o entendimento do metabolismo cardíaco e técnicas que permitem seu emprego de maneira eficiente e prática. O agente cardioplégico ideal necessita ter alguns requisitos tais como: 1. Indução rápida e eficaz da parada cardíaca com o miocárdio relaxado e pouquíssimo consumo do ATP; 2. Possui efeitos protetores para retardar a lesão celular irreversível causada pela isquemia global; 3. Poder de reverter a parada cardíaca com a frequência cardíaca e força de contração para fins de desmame precoce do CEC; e 4. Baixa toxicidade.11
De acordo com as normas da Sociedade Brasileira de Circulação Extracorpórea (SBCEC), o profissional perfusionista deve: I. Planejar, organizar e executar as ações relacionadas às funções cardiocirculatórias e respiratórias; II. Preservar as funções metabólicas e orgânicas dos pacientes que estão sendo submetidos a cirurgia; III. Monitorar os padrões fisiológicos vitais; IV. Preparar e administrar soluções cardioplégicas e renoplégicas; V. Realizar, interpretar e corrigir parâmetros laboratoriais durante a circulação extracorpórea, sob orientação médica; VI. Realizar, interpretar e controlar o tempo de coagulação ativada nos indivíduos heparinizados; VII. Prever, requisitar e controlar os materiais e equipamentos que são utilizados nos procedimentos de circulação extracorpórea; VIII. Examinar e testar os componentes da máquina coração-pulmão e realizar o controle e manutenção; IX. Obter informações com equipe médica a respeito da história clínica do paciente e verificar a existência de outras condições que podem influenciar no estado de saúde geral do paciente. X. Obter dados biométricos do paciente, como peso, altura, idade, superfície corpórea, para calcular o fluxo de sangue, gases, volume de líquidos etc.; XI. Calcular as doses de heparina para anticoagulação sistêmica e de protamina; XII. Decidir junto a equipe médica qual o tipo de circuito e cânula adequada para cada caso; XIII. Obter do anestesiologista os parâmetros hemodinâmicos do paciente, como a indução anestésica; XIV. Executar a circulação do sangue e a oxigenação extracorpórea sob comando de um cirurgião, observando as pressões arteriais e venosas; XV. Induzir o grau de hipotermia sistêmica, determinado pelo cirurgião; XVI. Administrar os medicamentos necessários ao paciente, no circuito, sob orientação da equipe médica, como por exemplo vasopressores, inotrópicos, vasodilatadores, agentes anestésicos etc. XVII. Encerrar o procedimento, retornando à ventilação ao anestesista após coração reassumir as funções; XVIII. Preencher a ficha de perfusão que deve conter todos os dados relativos aos procedimentos, bem como informações a respeito do balanço hídrico e sanguíneo; XIX. Realizar assistência circulatória mecânica ou temporária.12
As soluções cardioplégicas hipercalêmicas preservam o miocárdio sendo consideradas padrão ouro na perfusão extracorpórea em cirurgias cardíacas. A associação dessas soluções com o sangue do próprio paciente permite uma redução nas dosagens das enzimas cardíacas e marcadores de reperfusão.11
Complicações ao uso da circulação extracorpórea
Um dos principais efeitos da CEC é uma reação inflamatória generalizada. Essa resposta inflamatória pode causar danos aos órgãos e implicar disfunções, sendo uma grande preocupação quanto à recuperação de pacientes de cirurgias cardíacas no pós-operatório os efeitos neurológicos que podem ocorrer.13
De acordo com Butz et al.14, as complicações em relação ao uso de CEC podem estar relacionadas aos seguintes fatores: à canulação da aorta e da artéria femoral, exposição sanguínea que pode facilitar inflamações, ou ainda ocorrer uma reação inflamatória sistêmica. As complicações neurológicas ocorrem, em suma, em pacientes que tiveram quadros de embolia aérea, nos quais as bolhas de ar provocam obstrução dos vasos no cérebro, ou ainda, provenientes do uso de heparina para aumento da ação antitrombina, evitando a coagulação sanguínea, o que pode evitar a formação de coágulos, mas também causar sangramentos no pós-operatório, os quais podem ocorrer em vasos cerebrais, afetando as capacidades neurológicas dos pacientes.
Segundo Santos et al.10, a saída da perfusão é o período mais crítico e delicado, em que a comunicação entre cirurgião e perfusionista é de extrema importância. Neste momento, os pulmões e o coração retornam às suas funções e é necessário que ocorra um período de assistência destes órgãos. Os batimentos cardíacos voltam lentamente e as áreas de atelectasias pulmonares são removidas. Também neste período podem ser administradas medicações necessárias ao equilíbrio do paciente como drogas vasoativas e inotrópicas. Portanto, a saída de CEC deve ser lenta e gradativa, com reposição lenta do volume do reservatório venoso de acordo com o pedido do cirurgião e com as respostas do paciente.
CONCLUSÃO
Após a introdução da CEC como ferramenta de sustentação à cirurgia cardíaca, foi possível ampliar os benefícios aos pacientes com cardiopatias congênitas e adquiridas, sendo possível modificar seu curso natural com significativo aumento de sobrevida.
Até o momento, as modalidades de cardioproteção mais utilizadas em cirurgia cardíaca com CEC são a infusão de soluções de cardioplegia nas suas diversas modalidades e hipotermia regional e sistêmica, que conseguem efetivamente reduzir o consumo de oxigênio miocárdico e preservar a função contrátil.
REFERÊNCIAS
1. CORDEIRO, A.L.L.; et al. Associação da mecânica respiratória com a oxigenação e duração da ventilação mecânica no pós-operatório de cirurgia cardíaca. International Journal of Cardiovascular Sciences, v. 31, n. 3, p. 244-249, 2018.
2. SANTOS, C.A.; et al. Risk factors for mortality of patients under going coronary artery by-pass graft surgery. Rev. Bras. Cir. Cardiovasc., v. 4, n. 29, p. 513-520, 2014.
3. SANTOS, A. C. Reabilitação e assistência respiratória no pós-operatório de cirurgia cardíaca. Ribeirão Preto: Sec. Est. Saúde SP, 2018.
4. CANEO, LF.; JATENE, MB.; YATSUDA N.; GOMES, WJ. Uma reflexão sobre o desempenho da cirurgia cardíaca pediátrica no Estado de São Paulo. Braz Journal Cardiovasc Surg.; v.27, p.457-62, 2012.
CARVALHO FILHO, É.B.; et al. Vacuum-assisted drainage in cardiopulmonary bypass: advantages and disadvantages. Revista Bras Cir Cardiovasc.; v.29, n.2, p. 266271, 2014.
5. BECCARIA, L.M.; et al. Complicações Pós-Operatórias Em Pacientes Submetidos À Cirurgia Cardíaca Em Hospital De Ensino. Revista Arquivos de Ciências Da Saúde, v.22, n.3, p.37, 2015.
6. GRAETZ, J. P.; MORENO, M. A. Efeitos da aplicação da pressão positiva expiratória final no pós-operatório de revascularização do miocárdio. Fisioterapia e Pesquisa, São Paulo, v. 22, n. 1, p. 17-22, 2015.
7. SARKAR, M.; PRABHU, V. Basics of cardiopulmonary bypass. Indian journal of anaesthesia, v. 61, n. 9, p. 760–767, 2017.
8. LIMA, G.; CUERVO, M. Mecanismo da Circulação Extracorpórea e Eventos Neurológicos em Cirurgia Cardíaca. Revista da Sociedade Portuguesa de Anestesiologia, v. 28, n. 1, 2019.
9. BRAGA, D.; BRANDÃO, M.A. Avaliação diagnóstica do risco de sangramento em cirurgia cardíaca com circulação extracorpórea. Rev. Latino-Am. Enfermagem; v.26, 2018.
10. SANTOS, A.A.T.; et al. Circulação Extracorpórea. In: GARZESI, A.M.; Garcia, L.R.; Felício, M.L. Cirurgia Cardíaca do Adulto. 2018. E-book. Disponível em: https://hcfmb.unesp.br/wp-content/uploads/2018/04/cirurgiacardiacaadulto-1.pdf. Acesso: 03 junho de 2023.
11. ABDOUNI, A.A. Proteção Miocárdica na Cirurgia Cardíaca – Qual o Método Ideal? Arq. Bras. Cardiologia, São Paulo, v. 115, n. 2, p.251-252, 2020.
12. FELÍCIO, ACA.; OLIVEIRA, MHS.; NICOLINI PINTO, NA. O Papel do Biomédico na Perfusão Extracorpórea. 2022. 37p. Trabalho de Conclusão de Curso (Bacharel em Biomedicina). Universidade São Judas, São Bernardo do Campo, São Paulo, 2022.
13. COVALSKI, D.; et al. Pós-operatório de cirurgias cardíacas: complicações prevalentes em 72 horas. Rev. Enferm. UFSM, v. 11, p.75, 2021.
14. BUTZ, M.; et al. Decreasing postoperative cognitive deficits after heart surgery: protocol for a randomized controlled trial on cognitive training. Trials, v. 20, n. 1, p. 733, 2019.
1Instituto Nacional de Cardiologia, Rio de Janeiro, Brasil. nanyfisio.eb@gmail.com
2Instituto Nacional de Cardiologia, Rio de Janeiro, Brasil. verachico@yahoo.com.br
