REGISTRO DOI: 10.69849/revistaft/pa10202502240634
Amanda G M R da Fonseca S Contini
Estevan M S Contini
RESUMO
Este estudo aborda o Diabetes Mellitus (DM), uma doença crônica de alta prevalência global, caracterizada por distúrbios no metabolismo da glicose devido à deficiência ou resistência à insulina. A pesquisa revisou a fisiopatologia do diabetes, destacando a importância da glicose no organismo, os mecanismos de secreção da insulina pelo pâncreas e os diferentes tipos da doença, incluindo Diabetes Tipo 1, Tipo 2 e Diabetes Gestacional. Foram analisados os métodos diagnósticos, como glicemia de jejum, teste oral de tolerância à glicose e hemoglobina glicada, e os principais sintomas da doença, como poliúria, polidipsia e polifagia. O tratamento do diabetes envolve mudanças no estilo de vida, uso de hipoglicemiantes orais, terapia com insulina e abordagens inovadoras, como o transplante de células das ilhotas pancreáticas e pesquisas com células-tronco. As complicações do diabetes, tanto agudas quanto crônicas, incluem cetoacidose diabética, neuropatia, nefropatia, retinopatia e doenças cardiovasculares, sendo o controle rigoroso da glicemia essencial para minimizar seus impactos. A prevenção e a educação em saúde são fundamentais para reduzir a incidência da doença, por meio da conscientização sobre fatores de risco modificáveis, estratégias de rastreamento precoce e implementação de políticas públicas eficazes. A análise dos resultados demonstrou a necessidade de um manejo multidisciplinar, incluindo a integração de avanços científicos, acesso a tratamentos inovadores e suporte educacional para garantir um melhor prognóstico e qualidade de vida aos pacientes diabéticos. Assim, conclui-se que a combinação de medidas preventivas, estratégias terapêuticas eficazes e investimento contínuo em pesquisa é essencial para o controle da doença e a redução de suas complicações.
Palavras-chave: Diabetes Mellitus, Insulina, Hiperglicemia, Tratamento, Prevenção, Complicações.
ABSTRACT
This study addresses Diabetes Mellitus (DM), a chronic disease with a high global prevalence, characterized by glucose metabolism disorders due to insulin deficiency or resistance. The research reviewed the pathophysiology of diabetes, highlighting the importance of glucose in the body, insulin secretion mechanisms by the pancreas, and the different types of the disease, including Type 1, Type 2, and Gestational Diabetes. Diagnostic methods such as fasting blood glucose, oral glucose tolerance test, and glycated hemoglobin were analyzed, along with the main symptoms of the disease, such as polyuria, polydipsia, and polyphagia. Diabetes treatment involves lifestyle changes, oral hypoglycemic agents, insulin therapy, and innovative approaches, such as pancreatic islet cell transplantation and stem cell research. Diabetes complications, both acute and chronic, include diabetic ketoacidosis, neuropathy, nephropathy, retinopathy, and cardiovascular diseases, with strict glycemic control being essential to minimize their impact. Prevention and health education are crucial in reducing disease incidence through awareness of modifiable risk factors, early screening strategies, and the implementation of effective public policies. The analysis of results demonstrated the need for a multidisciplinary approach, integrating scientific advancements, access to innovative treatments, and educational support to ensure a better prognosis and quality of life for diabetic patients. Thus, it is concluded that the combination of preventive measures, effective therapeutic strategies, and continuous investment in research is essential for disease control and the reduction of its complications.
Keywords: Diabetes Mellitus, Insulin, Hyperglycemia, Treatment, Prevention, Complications.
1. INTRODUÇÃO
A compreensão dos conceitos de saúde e doença é fundamental para o estudo das patologias que acometem o organismo humano. Segundo Porth, a saúde pode ser definida como um estado de completo bem-estar físico, mental e social, enquanto a doença corresponde a um desequilíbrio nesse estado, caracterizado por anormalidades funcionais ou estruturais que afetam o funcionamento do corpo. A patologia, portanto, busca compreender as causas, os mecanismos e os efeitos das doenças, auxiliando no desenvolvimento de métodos para diagnóstico, tratamento e prevenção.
Dentro desse contexto, o Diabetes Mellitus (DM) é uma doença metabólica crônica que se destaca pela hiperglicemia persistente, resultante de falhas na produção ou na ação da insulina, hormônio responsável pelo controle dos níveis de glicose no sangue. O DM pode ser classificado em diferentes tipos, sendo os mais comuns o Diabetes Tipo 1 (DM1), o Diabetes Tipo 2 (DM2) e o Diabetes Gestacional. O primeiro está relacionado a uma destruição autoimune das células beta pancreáticas, levando à deficiência absoluta de insulina, enquanto o segundo está associado à resistência à insulina e a uma resposta inadequada das células beta pancreáticas. O Diabetes Gestacional, por sua vez, ocorre durante a gravidez devido a alterações hormonais que interferem no metabolismo da glicose.
O diabetes é uma das doenças crônicas não transmissíveis (DCNTs) mais prevalentes no mundo, representando um problema de grande impacto na saúde pública global. Segundo dados epidemiológicos, a incidência do Diabetes Mellitus Tipo 1 no Brasil é de aproximadamente 7,6 casos para cada 100 mil indivíduos abaixo de 15 anos de idade, enquanto o Diabetes Tipo 2 acomete tanto jovens quanto idosos, totalizando cerca de 5 milhões de pessoas no país. Em escala mundial, estima-se que, em 2014, cerca de 120 milhões de pessoas eram diagnosticadas com diabetes, com projeções indicando um aumento exponencial desse número, podendo atingir 300 milhões de casos até 2025. A preocupação com a disseminação da doença se deve não apenas à sua alta prevalência, mas também às suas complicações microvasculares e macrovasculares, que incluem retinopatia diabética, insuficiência renal, neuropatia periférica e risco aumentado de doenças cardiovasculares.
O Diabetes Tipo 2 é a forma predominante da doença, correspondendo a cerca de 90% dos casos diagnosticados. Esse tipo está fortemente relacionado a fatores ambientais e comportamentais, como sedentarismo, obesidade e dietas ricas em carboidratos simples e gorduras saturadas. Além disso, estudos apontam que a história familiar da doença, o uso prolongado de determinados medicamentos e a síndrome metabólica são fatores de risco determinantes para o desenvolvimento do DM2. A resistência à insulina, característica dessa condição, compromete o metabolismo energético e favorece o acúmulo de gordura hepática, aumentando o risco de esteatose hepática e disfunções cardiovasculares.
Diante desse cenário preocupante, o presente artigo tem como objetivo aprofundar a compreensão sobre os impactos da glicose no organismo, os principais fatores de risco associados ao desenvolvimento do Diabetes Mellitus e as opções terapêuticas disponíveis para o seu controle. Será abordado o papel crucial do pâncreas e do fígado no metabolismo da glicose, os mecanismos fisiopatológicos da doença e os tratamentos convencionais e inovadores, incluindo medicação hipoglicemiante, terapia com insulina, mudanças no estilo de vida e avanços em transplantes de células pancreáticas e cirurgias metabólicas. A partir desse estudo, espera-se contribuir para a disseminação do conhecimento sobre a doença, promovendo maior conscientização sobre a importância do diagnóstico precoce e das estratégias de prevenção e manejo do diabetes, visando à melhora na qualidade de vida dos indivíduos acometidos pela enfermidade.
2. REFERENCIAL TEÓRICO
2.1 Fisiopatologia do Diabetes Mellitus
2.1.1. Conceitos Básicos
Papel da Glicose no Organismo e Seu Metabolismo
A glicose é um monossacarídeo fundamental para o metabolismo celular, sendo a principal fonte de energia do organismo. Conforme Porth, a glicose é um substrato essencial para o funcionamento das células, especialmente as do sistema nervoso central, uma vez que o cérebro não possui reservas significativas desse carboidrato e depende de um suprimento contínuo pela corrente sanguínea. Durante o metabolismo celular, a glicose é convertida em ATP, através de processos como a glicólise, o ciclo de Krebs e a cadeia transportadora de elétrons, garantindo energia para as funções fisiológicas do organismo (PORTH, 2018, p. 19864).
A homeostase da glicose depende da interação entre o fígado, o pâncreas e os tecidos periféricos. O fígado regula os níveis glicêmicos através da glicogênese (armazenamento de glicose na forma de glicogênio) e da gliconeogênese (produção de glicose a partir de substratos não glicídicos). Em períodos de jejum ou baixa ingestão de carboidratos, o fígado libera glicose na corrente sanguínea por meio da glicogenólise, impedindo quedas bruscas nos níveis glicêmicos (GUYTON & HALL, 2011, p. 2555).
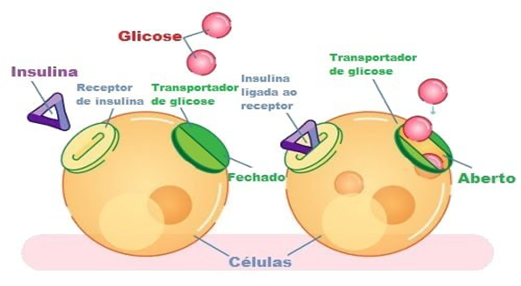
O pâncreas desempenha um papel crucial nesse processo por meio da secreção de insulina, hormônio produzido pelas células beta das Ilhotas de Langerhans. A insulina atua facilitando a entrada de glicose nas células, especialmente no tecido muscular e adiposo, além de inibir a gliconeogênese e a lipólise (PORTH, 2018, p. 1944). Quando a glicemia se eleva após a ingestão alimentar, a insulina é liberada de maneira pulsátil, promovendo o armazenamento da glicose e evitando sua toxicidade no sangue. No entanto, em indivíduos com Diabetes Mellitus, esse equilíbrio é interrompido devido a uma produção insuficiente de insulina ou à resistência dos tecidos a sua ação, resultando em hiperglicemia crônica.
O metabolismo da glicose também está relacionado a outros hormônios que desempenham papel no controle da glicemia, como o glucagon, que estimula a liberação de glicose pelo fígado, e a somatostatina, que inibe a secreção de insulina e glucagon (PORTH, 2018, p. 1944). O desequilíbrio entre esses hormônios pode levar a alterações metabólicas significativas, como a produção excessiva de corpos cetônicos, que, quando em excesso, podem desencadear a cetoacidose diabética, um quadro clínico grave associado ao Diabetes Tipo 1.
Glicemia Normal e Valores Diagnósticos para Hiperglicemia
A glicemia é a concentração de glicose na corrente sanguínea, e sua regulação é essencial para o funcionamento adequado do organismo. Segundo Guyton & Hall (2011, p. 2556), os valores normais de glicemia variam entre 70 mg/dL e 99 mg/dL em jejum, garantindo a homeostase metabólica. Quando esses níveis são alterados de forma persistente, ocorre um estado de hiperglicemia, que pode ser classificado conforme os seguintes critérios diagnósticos estabelecidos pela American Diabetes Association (ADA, 2020):
- Glicemia normal: 70-99 mg/dL em jejum.
- Pré-diabetes: 100-125 mg/dL em jejum.
- Diabetes Mellitus: ≥126 mg/dL em jejum, confirmado por dois exames distintos.
Além da glicemia de jejum, outros exames laboratoriais são fundamentais para o diagnóstico e monitoramento do Diabetes Mellitus:
- Teste Oral de Tolerância à Glicose (TOTG): avalia a resposta glicêmica após a ingestão de 75g de glicose. Valores acima de 200 mg/dL, duas horas após a ingestão, são indicativos de diabetes (ADA, 2020).
- Hemoglobina Glicada (HbA1c): reflete a média da glicemia nos últimos 2 a 3 meses, sendo valores superiores a 6,5% diagnósticos para diabetes (PORTH, 2018, p. 2556).
- Glicemia Pós-Prandial: mede a glicose no sangue após uma refeição. Valores acima de 140 mg/dL indicam comprometimento da regulação glicêmica (GUYTON & HALL, 2011, p. 2555).
A hiperglicemia crônica, característica do diabetes, é resultado de alterações na produção e ação da insulina. No Diabetes Tipo 1, há uma destruição autoimune das células beta pancreáticas, levando a uma deficiência absoluta de insulina (PORTH, 2018, p. 1944). Já no Diabetes Tipo 2, ocorre resistência à insulina nos tecidos periféricos e uma secreção inadequada desse hormônio, resultando em níveis elevados de glicose no sangue (ADA, 2020).
A hiperglicemia prolongada pode levar a complicações graves, tanto agudas quanto crônicas. Entre as complicações agudas, destaca-se a cetoacidose diabética (CAD), causada pelo acúmulo de corpos cetônicos no sangue, e o estado hiperglicêmico hiperosmolar (EHH), condição associada ao Diabetes Tipo 2 que pode levar ao coma (PORTH, 2018, p. 1944). As complicações crônicas incluem neuropatia diabética, retinopatia, nefropatia e aumento do risco cardiovascular, sendo que esses desfechos estão diretamente relacionados ao mau controle glicêmico ao longo do tempo. O monitoramento constante da glicemia e a adoção de estratégias para o controle metabólico são essenciais para reduzir as complicações do diabetes. Mudanças no estilo de vida, como alimentação balanceada, prática de atividade física e uso de medicamentos hipoglicemiantes, desempenham um papel fundamental no manejo da doença, prevenindo suas complicações e melhorando a qualidade de vida dos pacientes (GUYTON & HALL, 2011, p. 2555).
Figura 1 – hormônio de insulina ocasionado pela desordem da célula beta pancreática
2.1.2. Papel do Pâncreas e das Células Beta
Estrutura e Função do Pâncreas
O pâncreas é um órgão de dupla função, atuando tanto no sistema digestório quanto no sistema endócrino. Estruturalmente, localiza-se na cavidade abdominal, entre o estômago e o duodeno, sendo responsável por secretar enzimas digestivas essenciais e hormônios reguladores do metabolismo energético (GUYTON & HALL, 2011, p. 891).
A porção exócrina do pâncreas é composta por ácinos pancreáticos, que produzem enzimas digestivas, como a amilase pancreática, lipase e proteases, liberadas no intestino delgado para facilitar a digestão dos macronutrientes. Já a porção endócrina é formada pelas Ilhotas de Langerhans, que contêm diferentes tipos celulares, sendo as células beta responsáveis pela secreção de insulina, hormônio fundamental para o metabolismo da glicose (PORTH, 2018, p. 1945).
Além das células beta, as Ilhotas de Langerhans incluem:
- Células alfa – secretam glucagon, hormônio que eleva a glicemia.
- Células delta – produzem somatostatina, regulando a secreção de insulina e glucagon.
- Células PP – sintetizam o polipeptídeo pancreático, que influencia a função gastrointestinal.
O equilíbrio entre esses hormônios garante a homeostase glicêmica, evitando oscilações extremas nos níveis de glicose no sangue, o que é essencial para a manutenção das funções fisiológicas normais do organismo (ADA, 2020).
Figura 2 – Pâncreas

Mecanismo de Secreção da Insulina pelas Células Beta
A secreção de insulina pelas células beta ocorre em resposta direta ao aumento da glicose no sangue, funcionando por um mecanismo altamente regulado. Após a ingestão de alimentos, a glicose é absorvida no intestino e transportada para a corrente sanguínea, onde entra nas células beta por meio do transportador GLUT-2 (PORTH, 2018, p. 1946).
Uma vez dentro da célula, a glicose sofre fosforilação pela enzima glicocinase, iniciando sua metabolização na via glicolítica. Esse processo gera ATP, que promove o fechamento dos canais de potássio sensíveis ao ATP (KATP), levando à despolarização da membrana celular. A despolarização ativa os canais de cálcio dependentes de voltagem, permitindo a entrada de cálcio, que desencadeia a exocitose dos grânulos de insulina armazenados, liberando o hormônio na circulação (GUYTON & HALL, 2011, p. 893).
A liberação de insulina ocorre em duas fases:
- Fase Rápida: Ocorre nos primeiros minutos após o estímulo glicêmico e corresponde à liberação imediata da insulina armazenada.
- Fase Lenta: Ocorre de forma contínua e progressiva, envolvendo a síntese de nova insulina pelas células beta.
Além da glicose, outros fatores influenciam a secreção de insulina, como os hormônios incretínicos (GLP-1 e GIP), ácidos graxos, aminoácidos e a estimulação pelo sistema nervoso parassimpático. No Diabetes Mellitus Tipo 1, a destruição autoimune das células beta leva a uma deficiência absoluta de insulina, enquanto no Diabetes Tipo 2, ocorre uma falha progressiva na secreção desse hormônio, associada à resistência periférica à insulina (ADA, 2020).
Regulação da Glicose pelo Fígado e pelo Sistema Endócrino
O fígado desempenha um papel central na regulação da glicose, atuando como um reservatório metabólico. Ele armazena glicose na forma de glicogênio durante períodos de alimentação e a libera na corrente sanguínea por meio da glicogenólise e gliconeogênese em momentos de jejum (GUYTON & HALL, 2011, p. 896).
A regulação hepática da glicose é controlada por hormônios, sendo os principais:
- Insulina: Estimula a glicogênese e inibe a gliconeogênese e a lipólise.
- Glucagon: Estimula a glicogenólise e a gliconeogênese, aumentando a glicemia.
- Cortisol: Induz a gliconeogênese hepática, favorecendo a hiperglicemia.
- Adrenalina e noradrenalina: Ativam a quebra de glicogênio e mobilizam substratos energéticos.
No estado pós-prandial, a insulina predomina, promovendo o armazenamento da glicose. Já no estado de jejum, a ação do glucagon, cortisol e catecolaminas estimula a liberação de glicose pelo fígado para manter a homeostase energética (PORTH, 2018, p. 1947).
No diabetes, esse equilíbrio é comprometido. No Diabetes Tipo 1, a ausência de insulina impede a inibição da gliconeogênese hepática, favorecendo a hiperglicemia. No Diabetes Tipo 2, a resistência à insulina no fígado resulta em uma produção excessiva de glicose, agravando o quadro de hiperglicemia crônica (ADA, 2020).
Portanto, a interação entre o pâncreas, o fígado e os hormônios metabólicos é essencial para o controle da glicemia, sendo o desbalanço nesse eixo um fator determinante na fisiopatologia do diabetes. Estratégias terapêuticas que visam restaurar esse equilíbrio metabólico são fundamentais para a prevenção e o manejo da doença.
2.1.3. Tipos de Diabetes
O Diabetes Mellitus (DM) é uma doença metabólica caracterizada pela hiperglicemia crônica resultante de falhas na secreção de insulina, na ação desse hormônio ou em ambos os mecanismos. Dependendo da sua etiologia e fisiopatologia, o diabetes pode ser classificado em Diabetes Mellitus Tipo 1 (DM1), Diabetes Mellitus Tipo 2 (DM2) e Diabetes Gestacional (DMG). Além disso, a resistência à insulina também está fortemente associada à Síndrome Metabólica, um conjunto de alterações metabólicas que aumentam o risco cardiovascular (PORTH, 2018, p. 1950).
1- Diabetes Mellitus Tipo 1 (DM1)
Natureza Autoimune
O Diabetes Mellitus Tipo 1 é uma doença autoimune caracterizada pela destruição seletiva das células beta pancreáticas mediada pelo sistema imunológico, levando à deficiência absoluta de insulina (ADA, 2020). Esse processo resulta da ativação de linfócitos T autorreativos, que atacam as células beta das Ilhotas de Langerhans, prejudicando a produção do hormônio responsável pela regulação glicêmica (GUYTON & HALL, 2011, p. 897).
O início do DM1 ocorre frequentemente na infância ou adolescência, mas pode ser diagnosticado em qualquer idade. Estudos indicam que a destruição autoimune das células beta pode ocorrer de forma rápida ou progressiva, dependendo da presença de autoanticorpos específicos, como os autoanticorpos anti-GAD (ácido glutâmico descarboxilase), anti-insulina e anti-ilhotas pancreáticas (PORTH, 2018, p. 1952).
Fatores Genéticos e Ambientais
A predisposição genética desempenha um papel fundamental no desenvolvimento do DM1. Mutações nos genes do Complexo Principal de Histocompatibilidade (HLA), principalmente HLA-DR3 e HLA-DR4, aumentam significativamente o risco da doença. No entanto, fatores ambientais também atuam como gatilhos para a ativação do processo autoimune (ADA, 2020).
Dentre os fatores ambientais associados ao desenvolvimento do DM1, destacam-se:
- Infecções virais (como os vírus Coxsackie, citomegalovírus e rubéola).
- Deficiência de vitamina D, que pode influenciar a resposta imune.
- Exposição precoce a proteínas do leite de vaca, possivelmente alterando a resposta imunológica intestinal (GUYTON & HALL, 2011, p. 899).
Dependência de Insulina
Pela destruição progressiva das células beta, os pacientes com DM1 tornam-se completamente dependentes de insulina exógena para o controle da glicemia. Sem a administração de insulina, a glicose não pode ser utilizada adequadamente pelas células, resultando em hiperglicemia severa e no risco de cetoacidose diabética (CAD), uma complicação grave caracterizada pelo acúmulo de corpos cetônicos no sangue (PORTH, 2018, p. 1953).
2- Diabetes Mellitus Tipo 2 (DM2)
Resistência à Insulina e Deficiência Secretória
O Diabetes Mellitus Tipo 2 é a forma mais prevalente da doença, representando cerca de 90% dos casos de diabetes no mundo. Diferentemente do DM1, o DM2 não resulta de um processo autoimune, mas sim de resistência à insulina associada a uma disfunção progressiva das células beta pancreáticas (ADA, 2020).
A resistência à insulina ocorre quando os tecidos-alvo, como fígado, músculos e tecido adiposo, deixam de responder adequadamente à ação da insulina. Como compensação, o pâncreas aumenta a produção do hormônio para manter a glicemia sob controle. Com o tempo, a capacidade das células beta de secretar insulina se esgota, levando à hiperglicemia persistente (GUYTON & HALL, 2011, p. 900).
Fatores de Risco
O DM2 está fortemente associado a fatores ambientais e comportamentais, incluindo:
- Sedentarismo: a inatividade física reduz a captação de glicose pelos músculos, favorecendo a resistência à insulina.
- Obesidade: a adiposidade visceral (gordura abdominal) libera citocinas pró-inflamatórias, como o TNF-α e a IL-6, que interferem na sinalização da insulina (PORTH, 2018, p. 1955).
- Alimentação inadequada: dietas ricas em carboidratos refinados e gorduras saturadas contribuem para o desenvolvimento da resistência à insulina.
- Histórico familiar: indivíduos com parentes de primeiro grau com DM2 apresentam maior risco de desenvolver a doença (ADA, 2020).
Tratamento Inicial
O tratamento inicial do DM2 foca mudanças no estilo de vida, incluindo:
- Reeducação alimentar, priorizando alimentos com baixo índice glicêmico.
- Atividade física regular, melhorando a sensibilidade à insulina.
- Redução do peso corporal, auxiliando na reversão da resistência à insulina.
Quando essas intervenções não são suficientes para manter a glicemia sob controle, são introduzidos hipoglicemiantes orais, como a metformina, que reduz a produção hepática de glicose e melhora a sensibilidade à insulina (GUYTON & HALL, 2011, p. 902).
3- Diabetes Gestacional
O Diabetes Gestacional (DMG) ocorre devido a alterações hormonais na gravidez, que reduzem a sensibilidade à insulina, levando à hiperglicemia transitória. Hormônios como o lactogênio placentário humano e o cortisol interferem na ação da insulina, aumentando a demanda pancreática para manter a homeostase glicêmica (PORTH, 2018, p. 1957).
Riscos para Mãe e Bebê
O DMG aumenta os riscos de complicações para a mãe e o bebê, incluindo:
- Macrossomia fetal (bebês com peso superior a 4 kg, aumentando o risco de cesárea).
- Hipoglicemia neonatal devido ao hiperestímulo da insulina fetal.
- Maior risco de desenvolver DM2 tanto para a mãe quanto para a criança ao longo da vida (ADA, 2020).
O rastreamento do DMG é essencial e deve ser realizado entre 24 e 28 semanas de gestação, por meio do Teste Oral de Tolerância à Glicose (TOTG) (GUYTON & HALL, 2011, p. 903).
4- Diabetes e Síndrome Metabólica
A Síndrome Metabólica é um conjunto de fatores de risco que inclui hipertensão arterial, obesidade central, dislipidemia e resistência à insulina. Essa condição aumenta significativamente o risco de doença cardiovascular e Diabetes Mellitus Tipo 2 (PORTH, 2018, p. 1959).
A resistência à insulina é um fator-chave na fisiopatologia da síndrome, pois leva à hiperglicemia, inflamação crônica e disfunção endotelial, contribuindo para o desenvolvimento de complicações metabólicas e cardiovasculares (ADA, 2020).
2.2. Diagnóstico e Avaliação Clínica
O diagnóstico do Diabetes Mellitus (DM) é baseado na avaliação da glicemia plasmática e em testes laboratoriais que analisam a homeostase glicêmica a curto e longo prazo. A identificação precoce da hiperglicemia é essencial para evitar complicações metabólicas e reduzir a progressão da doença. Para isso, os principais exames diagnósticos incluem glicemia de jejum, teste de tolerância à glicose (TOTG) e hemoglobina glicada (HbA1c), além de outros exames complementares que avaliam disfunções metabólicas associadas ao diabetes (ADA, 2020).
2.2.1. Principais Exames
1- Glicemia de Jejum
A glicemia de jejum é um dos exames mais utilizados para o rastreamento e diagnóstico do diabetes. Consiste na medição da concentração de glicose plasmática após um período de 8 a 12 horas sem ingestão calórica, refletindo o equilíbrio entre a produção hepática de glicose e a captação periférica pelo tecido muscular e adiposo (PORTH, 2018, p. 1960).
Os valores de referência estabelecidos pela American Diabetes Association (ADA) para a glicemia de jejum são:
- Glicemia normal: 70 a 99 mg/dL.
- Pré-diabetes: 100 a 125 mg/dL.
- Diabetes Mellitus: ≥ 126 mg/dL em duas medições distintas.
A hiperglicemia detectada nesse exame pode ser consequência de resistência à insulina e/ou falha na secreção do hormônio pelas células beta pancreáticas, indicando um comprometimento do metabolismo glicídico (GUYTON & HALL, 2011, p. 906).
Embora seja um exame acessível e de baixo custo, a glicemia de jejum apresenta limitações, como variações interindividuais e influência de fatores momentâneos, como estresse e infecções. Por isso, sua confirmação é recomendada por meio de testes complementares (ADA, 2020).
2- Teste de Tolerância à Glicose (TOTG)
O Teste Oral de Tolerância à Glicose (TOTG) avalia a capacidade do organismo de metabolizar a glicose após um desafio glicêmico padronizado. Para a realização do exame, o paciente ingere 75 g de glicose anidra dissolvida em 250 mL de água, e a glicemia é medida em diferentes momentos, sendo a avaliação mais relevante realizada duas horas após a ingestão da glicose (PORTH, 2018, p. 1962).
Os valores de referência para o TOTG são:
- Glicemia normal: < 140 mg/dL após 2 horas.
- Pré-diabetes (tolerância à glicose diminuída): 140 a 199 mg/dL após 2 horas.
- Diabetes Mellitus: ≥ 200 mg/dL após 2 horas.
Esse teste é amplamente utilizado para diagnosticar Diabetes Gestacional, sendo recomendado entre a 24ª e 28ª semanas de gestação para avaliar a resposta metabólica da gestante à carga glicêmica (ADA, 2020).
Embora o TOTG seja um exame mais sensível do que a glicemia de jejum para detectar disfunções na homeostase glicêmica, ele exige preparo adequado e controle rigoroso das condições de realização, além de apresentar maior variabilidade intraindividual (GUYTON & HALL, 2011, p. 907).
3- Hemoglobina Glicada (HbA1c)
A Hemoglobina Glicada (HbA1c) é um exame que reflete a média da glicemia nos últimos 2 a 3 meses, permitindo uma avaliação do controle glicêmico a longo prazo (PORTH, 2018, p. 1963). Diferente dos testes anteriores, a HbA1c não exige jejum, tornando-se uma ferramenta diagnóstica prática e confiável.
O exame mede a fração de hemoglobina A ligada irreversivelmente à glicose, sendo a glicação diretamente proporcional à concentração de glicose circulante. Os valores de referência estabelecidos pela ADA são:
- Glicemia normal: HbA1c < 5,7%.
- Pré-diabetes: HbA1c entre 5,7% e 6,4%.
- Diabetes Mellitus: HbA1c ≥ 6,5%.
O uso da HbA1c no diagnóstico do diabetes é reconhecido por sua baixa variabilidade diária e ausência de interferência por fatores transitórios, como alimentação ou estresse. No entanto, algumas condições clínicas podem afetar sua interpretação, como anemias, hemoglobinopatias e doenças renais crônicas, que alteram o tempo de vida dos eritrócitos e, consequentemente, os níveis de HbA1c (ADA, 2020).
Além de ser um exame diagnóstico, a HbA1c é amplamente utilizada para monitorar a eficácia do tratamento do diabetes. Pacientes diabéticos devem manter a HbA1c abaixo de 7% para reduzir o risco de complicações micro e macrovasculares (GUYTON & HALL, 2011, p. 908).
4- Outros Exames Laboratoriais para Avaliação Metabólica
Além dos testes primários para diagnóstico do diabetes, outros exames laboratoriais são recomendados para avaliar possíveis complicações metabólicas associadas:
- Frutosamina: Mede a glicação de proteínas séricas e reflete a glicemia nas últimas duas a três semanas, sendo útil para pacientes com alterações no metabolismo eritrocitário que interferem na HbA1c (PORTH, 2018, p. 1965).
- Insulinemia e Peptídeo C: Avaliam a produção endógena de insulina, auxiliando na diferenciação entre Diabetes Tipo 1 e Tipo 2. Níveis reduzidos de peptídeo C indicam falência das células beta pancreáticas, caracterizando DM1 (ADA, 2020).
- Perfil lipídico: Pacientes diabéticos frequentemente apresentam dislipidemia, com aumento dos triglicerídeos e LDL-colesterol e redução do HDL-colesterol, aumentando o risco cardiovascular (GUYTON & HALL, 2011, p. 909).
- Microalbuminúria: Detecta lesões renais iniciais causadas pela hiperglicemia crônica, sendo um marcador precoce de nefropatia diabética (ADA, 2020).
A avaliação metabólica completa é essencial para um diagnóstico preciso e um manejo clínico adequado, permitindo a detecção precoce de complicações e a adoção de estratégias preventivas para melhorar a qualidade de vida dos pacientes com diabetes.
2.2.2. Sintomas do Diabetes
O Diabetes Mellitus (DM) pode ser assintomático em seus estágios iniciais, especialmente no Diabetes Tipo 2 (DM2), no qual a resistência à insulina se desenvolve de maneira progressiva. No entanto, no Diabetes Tipo 1 (DM1), onde ocorre uma destruição autoimune das células beta pancreáticas e uma deficiência absoluta de insulina, os sintomas surgem rapidamente e podem evoluir para quadros clínicos graves. A manifestação dos sintomas está diretamente relacionada à hiperglicemia persistente, que altera o metabolismo energético e compromete a homeostase do organismo (PORTH, 2018, p. 1966).
Os sintomas clássicos do diabetes incluem poliúria (excesso de urina), polidipsia (sede excessiva), polifagia (aumento do apetite) e perda de peso inexplicável. A poliúria ocorre devido ao aumento da filtração glomerular de glicose, que ultrapassa o limite de reabsorção renal (180 mg/dL). Como consequência, a glicose é eliminada na urina, promovendo uma diurese osmótica, que leva a um maior volume urinário. Esse fenômeno pode resultar na produção de mais de 3 litros de urina por dia, aumentando o risco de desidratação e desequilíbrios hidroeletrolíticos (GUYTON & HALL, 2011, p. 910). A polidipsia ocorre como um mecanismo compensatório à perda excessiva de líquidos. A desidratação celular ativa os osmorreceptores hipotalâmicos, estimulando a sensação de sede e aumentando a ingestão hídrica (PORTH, 2018, p. 1967). Já a polifagia está associada à incapacidade das células em utilizar a glicose circulante devido à deficiência ou resistência à insulina, levando o organismo a compensar a falta de energia por meio de um aumento do apetite. No entanto, apesar da hiperalimentação, os pacientes diabéticos frequentemente apresentam perda de peso inexplicável, especialmente no DM1, pois a ausência de insulina impede o armazenamento de glicose e mobiliza as reservas de gordura e proteínas como fontes alternativas de energia (ADA, 2020).
Nos estágios mais avançados da doença, os pacientes podem desenvolver complicações microvasculares e macrovasculares decorrentes da hiperglicemia crônica. As complicações microvasculares incluem retinopatia diabética, nefropatia diabética e neuropatia periférica, resultantes do dano progressivo aos capilares sanguíneos. A retinopatia diabética é uma das principais causas de cegueira evitável no mundo, enquanto a nefropatia pode evoluir para insuficiência renal crônica e necessidade de diálise. A neuropatia periférica, por sua vez, compromete a função sensitiva e autonômica, predispondo os pacientes a úlceras e infecções nos membros inferiores, podendo levar à amputação (PORTH, 2018, p. 1968).
Já as complicações macrovasculares englobam doenças cardiovasculares, como infarto agudo do miocárdio e acidente vascular cerebral (AVC), devido à aterosclerose acelerada associada ao diabetes. A hiperglicemia crônica promove inflamação endotelial, disfunção vascular e aumento da agregação plaquetária, favorecendo a formação de placas ateromatosas e o risco de trombose arterial (ADA, 2020). Além disso, pacientes com diabetes frequentemente apresentam hipertensão arterial, dislipidemia e obesidade visceral, fatores que potencializam o risco cardiovascular e contribuem para a progressão da doença.
Diante desse cenário, a identificação precoce dos sintomas do diabetes é essencial para a implementação de estratégias terapêuticas que visam evitar complicações metabólicas e melhorar a qualidade de vida dos pacientes. O monitoramento da glicemia e a adesão a um plano terapêutico individualizado são fundamentais para o controle da doença e a redução de seus impactos sistêmicos (GUYTON & HALL, 2011, p. 912).
2.3. Tratamento e Controle do Diabetes
O tratamento do Diabetes Mellitus (DM) envolve uma abordagem multidisciplinar que visa controlar os níveis glicêmicos, prevenir complicações e melhorar a qualidade de vida dos pacientes. O controle do diabetes não depende apenas do uso de medicações, mas, sobretudo, de mudanças no estilo de vida que contribuem para a melhora da sensibilidade à insulina e do metabolismo glicêmico. A adoção de hábitos saudáveis, como uma alimentação equilibrada, a prática regular de exercícios físicos e a manutenção do peso corporal adequado, é fundamental para o sucesso terapêutico, principalmente no Diabetes Tipo 2 (DM2), onde a resistência à insulina é um dos principais fatores fisiopatológicos da doença (PORTH, 2018, p. 1970).
2.3.1. Mudanças no Estilo de Vida
A alimentação desempenha um papel central no controle do diabetes, sendo recomendado um plano alimentar individualizado, baseado no controle do consumo de carboidratos e no aumento da ingestão de fibras. Carboidratos refinados e de alto índice glicêmico, como pães brancos, açúcares, refrigerantes e doces, devem ser evitados, pois causam rápidas elevações da glicemia, dificultando seu controle. Em contrapartida, a preferência deve ser por carboidratos complexos, presentes em grãos integrais, legumes, verduras e leguminosas, que promovem uma absorção mais lenta da glicose, reduzindo picos glicêmicos e melhorando a resposta insulínica (GUYTON & HALL, 2011, p. 914). O aumento do consumo de fibras solúveis, encontradas na aveia, na linhaça e nas frutas com casca, auxilia no retardo da absorção de glicose no intestino e contribui para a redução da resistência à insulina (ADA, 2020). Além disso, a ingestão de gorduras saudáveis, como as presentes no azeite de oliva, no abacate e nas oleaginosas, é incentivada, pois melhora a resposta inflamatória e protege contra as complicações cardiovasculares associadas ao diabetes (PORTH, 2018, p. 1972).
Outro fator essencial no manejo do diabetes é a prática regular de exercícios físicos, que melhora significativamente a sensibilidade à insulina e o metabolismo glicídico. A atividade física estimula a captação da glicose pelos músculos independentemente da insulina, reduzindo a glicemia de forma natural. Exercícios aeróbicos, como caminhada, corrida, natação e ciclismo, são recomendados, pois aumentam o consumo energético e favorecem a regulação do metabolismo. Além disso, o treinamento de resistência, com exercícios de força e musculação, contribui para o aumento da massa muscular, o que melhora ainda mais a captação de glicose e reduz a resistência periférica à insulina (GUYTON & HALL, 2011, p. 915). A recomendação da American Diabetes Association (ADA) sugere pelo menos 150 minutos semanais de atividade física moderada, distribuídos ao longo da semana, para otimizar os benefícios metabólicos e reduzir o risco de complicações (ADA, 2020).
O controle do peso corporal e a redução do sedentarismo também são fundamentais para o manejo do diabetes, especialmente no DM2, onde o excesso de gordura abdominal está diretamente relacionado à resistência insulínica. A obesidade visceral promove a liberação de citocinas inflamatórias, como TNF-α e IL-6, que interferem na sinalização da insulina e agravam o quadro metabólico. A redução de 5% a 10% do peso corporal pode melhorar significativamente o controle glicêmico e diminuir a necessidade de medicação (PORTH, 2018, p. 1975). A adoção de um estilo de vida mais ativo, com pequenas mudanças diárias, como evitar longos períodos sentado, caminhar após as refeições e utilizar escadas em vez de elevadores, pode impactar positivamente o metabolismo da glicose e reduzir o risco de complicações do diabetes (GUYTON & HALL, 2011, p. 916).
Portanto, a modificação do estilo de vida é um dos pilares mais importantes no tratamento do diabetes, sendo capaz de melhorar a resposta insulínica, reduzir a glicemia e prevenir complicações a longo prazo. Quando aliadas a um plano terapêutico adequado, essas mudanças contribuem para um melhor prognóstico da doença e aumentam a qualidade de vida dos pacientes diabéticos (ADA, 2020).
2.3.2. Uso de Medicamentos
O tratamento medicamentoso do Diabetes Mellitus (DM) é uma estratégia essencial para o controle da glicemia, reduzindo o risco de complicações microvasculares e macrovasculares. A escolha do medicamento depende do tipo de diabetes, da gravidade da hiperglicemia e da resposta do paciente ao tratamento. No Diabetes Tipo 1 (DM1), onde há destruição autoimune das células beta pancreáticas, a terapia com insulina é indispensável para suprir a deficiência do hormônio. Já no Diabetes Tipo 2 (DM2), o tratamento inicial geralmente envolve hipoglicemiantes orais, que atuam na melhora da resistência à insulina e na regulação da secreção pancreática de insulina, podendo ser associados à insulina conforme a progressão da doença (PORTH, 2018, p. 1978).
Os hipoglicemiantes orais são amplamente utilizados no tratamento do DM2 e atuam por diferentes mecanismos. A metformina é a primeira escolha terapêutica para a maioria dos pacientes e age reduzindo a produção hepática de glicose via inibição da gliconeogênese e aumentando a sensibilidade dos tecidos periféricos à insulina, facilitando a captação de glicose pelos músculos e pelo tecido adiposo. Além disso, melhora a função endotelial e auxilia na perda de peso, sendo particularmente indicada para pacientes com obesidade associada ao diabetes (GUYTON & HALL, 2011, p. 918). As sulfonilureias, como a glibenclamida e a gliclazida, estimulam a secreção de insulina pelas células beta pancreáticas ao bloquear os canais de potássio dependentes de ATP, promovendo a despolarização celular e a liberação de insulina. Esses fármacos são eficazes na redução da glicemia, mas apresentam o risco de hipoglicemia, especialmente em idosos ou pacientes com insuficiência renal (ADA, 2020).
Outra classe importante de hipoglicemiantes são os inibidores da SGLT2, como a dapagliflozina e a empagliflozina, que atuam na eliminação de glicose pela urina ao inibir a reabsorção tubular de glicose nos rins. Além do efeito hipoglicemiante, esses medicamentos apresentam benefícios cardiovasculares e renais, reduzindo a pressão arterial e a progressão da nefropatia diabética. No entanto, o uso desses fármacos pode aumentar o risco de infecções do trato urinário e genital, devido ao aumento da excreção de glicose na urina (PORTH, 2018, p. 1980).
A terapia com insulina é essencial para todos os pacientes com DM1 e também pode ser necessária em casos avançados de DM2, quando há falência progressiva das células beta pancreáticas. Existem diferentes tipos de insulina, classificadas de acordo com seu tempo de ação. As insulinas de ação rápida (como a insulina lispro e asparte) têm início de ação em poucos minutos e são utilizadas para controle pós-prandial da glicemia. Já as insulinas de ação intermediária (como a NPH) e de longa duração (como a insulina glargina e a degludeca) são usadas para garantir uma liberação sustentada de insulina, mantendo os níveis glicêmicos estáveis ao longo do dia (GUYTON & HALL, 2011, p. 920).
O esquema de aplicação da insulina deve ser individualizado, considerando fatores como padrão alimentar, rotina de atividades físicas e sensibilidade à insulina. O regime basal-bolus é um dos mais utilizados, combinando uma insulina basal (de longa duração) para manter a glicemia estável ao longo do dia com doses de insulina de ação rápida antes das refeições, ajustadas de acordo com a ingestão de carboidratos. O monitoramento da glicemia é fundamental para evitar episódios de hipoglicemia e hiperglicemia, sendo recomendado o uso de medidores de glicemia capilar ou sensores contínuos de glicose para melhor controle metabólico (ADA, 2020).
A escolha do tratamento medicamentoso deve levar em conta não apenas a eficácia glicêmica, mas também o perfil de segurança e os efeitos colaterais de cada classe de fármacos. A abordagem ideal inclui monitoramento regular, ajustes terapêuticos e a adoção de um plano alimentar e de exercícios adequado, garantindo um controle glicêmico eficaz e prevenindo as complicações associadas ao diabetes (PORTH, 2018, p. 1982).
Figura 3 – Tratamentos

2.3.3. Tratamentos Inovadores
O avanço das pesquisas científicas tem possibilitado o desenvolvimento de tratamentos inovadores para o Diabetes Mellitus (DM), visando melhor controle glicêmico, redução da dependência de insulina e prevenção das complicações metabólicas. Entre as terapias emergentes, destacam-se o transplante de células das ilhotas pancreáticas, a cirurgia bariátrica no tratamento do Diabetes Mellitus Tipo 2 (DM2) grave e as pesquisas sobre células-tronco e imunomodulação, que buscam alternativas para reverter ou controlar a progressão da doença (PORTH, 2018, p. 1985).
O transplante de células das ilhotas pancreáticas é uma estratégia promissora para pacientes com Diabetes Tipo 1 (DM1), nos quais há destruição autoimune das células beta produtoras de insulina. Esse procedimento consiste na extração e infusão de células das Ilhotas de Langerhans de um doador falecido para o fígado do paciente diabético, onde essas células passam a produzir e secretar insulina de maneira autônoma. O objetivo desse transplante é restaurar a homeostase glicêmica e reduzir a necessidade de administração exógena de insulina. No entanto, um dos principais desafios desse tratamento é a necessidade de terapia imunossupressora contínua, para evitar a rejeição das células transplantadas, o que pode aumentar o risco de infecções e efeitos colaterais associados à imunossupressão prolongada (ADA, 2020). Embora essa técnica tenha apresentado resultados promissores, sua aplicação ainda é limitada pela escassez de doadores e pela resposta imunológica do receptor, sendo indicada para pacientes com hipoglicemias severas frequentes ou controle glicêmico instável, que não respondem ao tratamento convencional (GUYTON & HALL, 2011, p. 922).
A cirurgia bariátrica tem se consolidado como uma alternativa eficaz para o tratamento do DM2 grave, especialmente em pacientes obesos que apresentam IMC superior a 35 kg/m². Os mecanismos pelos quais a cirurgia bariátrica melhora o controle do diabetes vão além da perda de peso, envolvendo alterações hormonais e metabólicas que melhoram a sensibilidade à insulina e a secreção de incretinas. Procedimentos como o bypass gástrico promovem uma modificação no trânsito intestinal, aumentando a secreção de GLP-1 (peptídeo semelhante ao glucagon tipo 1), que potencializa a liberação de insulina e reduz a glicemia. Além disso, a redução do estômago diminui a absorção de glicose e altera a produção de hormônios gastrointestinais, favorecendo o controle glicêmico (PORTH, 2018, p. 1987). Estudos demonstram que até 80% dos pacientes submetidos à cirurgia bariátrica apresentam remissão do diabetes, com normalização dos níveis glicêmicos e redução da necessidade de medicamentos (ADA, 2020). No entanto, a cirurgia não é isenta de riscos e pode causar deficiências nutricionais, complicações cirúrgicas e necessidade de suplementação vitamínica prolongada, sendo indicada para pacientes com DM2 que não conseguem obter controle metabólico adequado com o tratamento convencional (GUYTON & HALL, 2011, p. 924).
As pesquisas sobre células-tronco e imunomodulação representam uma das áreas mais inovadoras no tratamento do diabetes. No caso do DM1, onde há destruição autoimune das células beta pancreáticas, a terapia com células-tronco visa reparar ou regenerar o tecido pancreático, promovendo a produção endógena de insulina. As células-tronco mesenquimais, por exemplo, apresentam propriedades anti-inflamatórias e imunomoduladoras, podendo reduzir a resposta autoimune contra as células beta e retardar a progressão da doença. Já em pacientes com DM2, a utilização de células-tronco pode auxiliar na regeneração pancreática e na restauração da função das células beta, melhorando a secreção de insulina e reduzindo a resistência periférica ao hormônio (PORTH, 2018, p. 1988).
Outra abordagem inovadora envolve o uso de imunoterapia para modular a resposta autoimune no DM1. Pesquisas recentes investigam o bloqueio de células T autorreativas e o uso de vacinas imunológicas que poderiam prevenir a destruição das células beta em estágios iniciais da doença. Estudos com anticorpos monoclonais, como o teplizumabe, mostraram resultados promissores ao atrasar a progressão do DM1 em indivíduos de alto risco, sugerindo que a intervenção imunológica pode ser uma ferramenta essencial para prevenir ou retardar a necessidade de insulina em pacientes recém-diagnosticados (ADA, 2020).
Embora esses tratamentos inovadores ainda estejam em fases experimentais ou apresentem limitações quanto à sua aplicabilidade clínica em larga escala, eles representam avanços significativos na busca por terapias mais eficazes e menos invasivas para o controle do diabetes. O desenvolvimento de novas técnicas e a evolução da medicina regenerativa podem, no futuro, transformar a maneira como o diabetes é tratado, reduzindo sua progressão e proporcionando maior qualidade de vida aos pacientes (GUYTON & HALL, 2011, p. 926).
2.4. Complicações do Diabetes
O Diabetes Mellitus (DM) é uma doença crônica que, quando não controlada, pode levar a complicações graves, tanto agudas quanto crônicas, comprometendo a qualidade de vida e aumentando a morbimortalidade dos pacientes. As complicações do diabetes são decorrentes da hiperglicemia prolongada, que promove danos a diversos órgãos e sistemas. As complicações agudas estão relacionadas a alterações metabólicas severas, como a cetoacidose diabética (CAD), o estado hiperglicêmico hiperosmolar e episódios de hipoglicemia grave, enquanto as complicações crônicas afetam os pequenos e grandes vasos sanguíneos, resultando em doenças microvasculares e macrovasculares (PORTH, 2018, p. 1990).
2.4.1. Complicações Agudas
A cetoacidose diabética (CAD) é uma complicação metabólica grave, mais frequente em pacientes com Diabetes Tipo 1 (DM1), causada pela deficiência absoluta de insulina. A ausência do hormônio impede a captação de glicose pelos tecidos, levando o organismo a mobilizar ácidos graxos como fonte alternativa de energia. Esse processo resulta na produção excessiva de corpos cetônicos, que acidificam o sangue e desencadeiam um quadro clínico caracterizado por hiperglicemia grave (>250 mg/dL), acidose metabólica (pH <7,3) e cetonemia. Os principais sintomas incluem náuseas, vômitos, dor abdominal, respiração de Kussmaul (respiração profunda e rápida) e hálito cetônico. Se não tratada prontamente com insulinoterapia, hidratação intravenosa e reposição de eletrólitos, a CAD pode evoluir para choque hipovolêmico e coma diabético (ADA, 2020).
O estado hiperglicêmico hiperosmolar (EHH) é uma complicação aguda mais comum no Diabetes Tipo 2 (DM2) e ocorre em pacientes com hiperglicemia extrema (glicemia >600 mg/dL) associada a desidratação severa e osmolaridade plasmática elevada (>320 mOsm/L). Diferente da CAD, esse quadro não apresenta cetose significativa, pois ainda há secreção residual de insulina. O EHH é frequentemente precipitado por infecções, desidratação e uso inadequado de medicamentos antidiabéticos, podendo levar à alteração do estado mental, convulsões e coma. O tratamento envolve hidratação vigorosa, administração de insulina e correção de distúrbios hidroeletrolíticos (GUYTON & HALL, 2011, p. 930).
A hipoglicemia induzida por medicação é uma complicação frequente em pacientes diabéticos em uso de insulina ou hipoglicemiantes orais, como as sulfonilureias. A queda excessiva da glicemia (<70 mg/dL) pode ocorrer devido ao uso inadequado da medicação, ao jejum prolongado ou à prática intensa de exercícios físicos sem ajuste na dose de insulina. Os sintomas incluem tremores, sudorese, taquicardia, tontura, confusão mental e, em casos graves, convulsões e coma hipoglicêmico. O manejo da hipoglicemia envolve a administração imediata de carboidratos de rápida absorção (15 a 20 g de glicose) e, em casos graves, o uso de glucagon injetável para reverter a crise (PORTH, 2018, p. 1992).
2.4.2. Complicações Crônicas
As complicações crônicas do diabetes ocorrem devido à exposição prolongada à hiperglicemia, que leva a alterações estruturais nos vasos sanguíneos e no sistema nervoso. Essas complicações são divididas em microvasculares (afetando pequenos vasos) e macrovasculares (afetando grandes artérias e o sistema cardiovascular).
A) Complicações Microvasculares
A retinopatia diabética é uma das principais causas de cegueira evitável no mundo e resulta do dano progressivo aos vasos sanguíneos da retina. A hiperglicemia crônica leva ao espessamento da membrana basal dos capilares retinianos, favorecendo a formação de microaneurismas, hemorragias e proliferação de neovasos anômalos. Essa condição pode evoluir para edema macular diabético e descolamento de retina, causando perda visual irreversível. O rastreamento oftalmológico periódico e o controle rigoroso da glicemia são essenciais para prevenir a progressão da retinopatia (ADA, 2020).
A nefropatia diabética é uma complicação renal progressiva caracterizada pelo aumento da excreção urinária de albumina (microalbuminúria), que pode evoluir para insuficiência renal crônica e necessidade de hemodiálise. A hiperglicemia promove hiperfiltração glomerular, inflamação e fibrose renal, comprometendo a função dos néfrons. O rastreamento precoce da função renal e o controle da pressão arterial com inibidores da ECA ou bloqueadores do receptor de angiotensina II são estratégias eficazes para retardar a progressão da nefropatia (GUYTON & HALL, 2011, p. 932).
A neuropatia periférica é uma complicação neurológica comum em diabéticos, resultante da lesão dos nervos periféricos, levando a sintomas como dormência, formigamento, dor neuropática e perda da sensibilidade nos membros inferiores. O dano neural ocorre devido ao acúmulo de produtos finais da glicação avançada (AGEs) e à disfunção microvascular, predispondo os pacientes a úlceras nos pés e infecções de difícil cicatrização. A neuropatia pode ser tratada com analgésicos, antidepressivos tricíclicos e anticonvulsivantes, além de medidas preventivas, como o uso de calçados adequados e inspeção diária dos pés (PORTH, 2018, p. 1994).
B) Complicações Macrovasculares
As complicações macrovasculares do diabetes estão associadas a um aumento significativo do risco cardiovascular, resultando em infarto do miocárdio, acidente vascular cerebral (AVC) e doença arterial periférica. A hiperglicemia crônica contribui para o processo aterosclerótico, levando à inflamação endotelial, disfunção vascular e formação de placas de ateroma. Pacientes diabéticos apresentam um risco até quatro vezes maior de eventos cardiovasculares, sendo essencial o controle da glicemia, da pressão arterial e dos níveis lipídicos para reduzir esses riscos (ADA, 2020).
O pé diabético é uma complicação grave que resulta da combinação de neuropatia periférica e doença vascular periférica. A perda da sensibilidade nos pés favorece o surgimento de lesões que podem evoluir para úlceras crônicas e infecções profundas. A isquemia decorrente da doença arterial periférica compromete a cicatrização, aumentando o risco de amputação de membros inferiores. Estratégias preventivas incluem a educação dos pacientes para o cuidado diário dos pés, o uso de calçados adequados e o tratamento precoce de lesões (PORTH, 2018, p. 1996).
O diabetes é uma doença sistêmica que exige monitoramento contínuo e estratégias preventivas eficazes para reduzir o impacto de suas complicações. O controle rigoroso da glicemia, a adesão ao tratamento medicamentoso e a modificação do estilo de vida são fundamentais para prevenir ou retardar as complicações associadas à doença e melhorar a qualidade de vida dos pacientes diabéticos (GUYTON & HALL, 2011, p. 934).
2.5. Prevenção e Educação em Saúde
A prevenção do Diabetes Mellitus (DM) é um dos principais desafios da saúde pública, considerando o impacto crescente da doença e suas complicações na qualidade de vida dos indivíduos e nos sistemas de saúde. Estratégias eficazes de prevenção e educação em saúde são essenciais para reduzir a incidência do diabetes, melhorar o diagnóstico precoce e promover a adesão ao tratamento. A conscientização sobre fatores de risco modificáveis, o rastreamento populacional e a implementação de políticas públicas voltadas para a educação em saúde desempenham um papel fundamental no combate à progressão da doença e na mitigação de suas consequências (PORTH, 2018, p. 2000).
A conscientização sobre os fatores de risco modificáveis é um dos pilares da prevenção do diabetes, especialmente do Diabetes Tipo 2 (DM2), cuja etiologia está fortemente associada a hábitos de vida inadequados. Entre os principais fatores de risco estão sedentarismo, alimentação rica em açúcares e gorduras saturadas, obesidade, tabagismo e consumo excessivo de álcool. A adoção de hábitos saudáveis, como a prática regular de atividade física, a reeducação alimentar e o controle do peso corporal, pode reduzir significativamente o risco de desenvolvimento do DM2. Evidências demonstram que indivíduos que adotam um estilo de vida saudável apresentam uma redução de até 58% no risco de desenvolver diabetes, destacando a importância de campanhas educativas e intervenções precoces para conscientização da população sobre a necessidade de mudanças comportamentais (ADA, 2020).
O rastreamento e o diagnóstico precoce do diabetes são fundamentais para evitar complicações metabólicas e garantir um tratamento mais eficaz. O rastreamento deve ser realizado especialmente em grupos de risco, como indivíduos com histórico familiar de diabetes, obesidade, hipertensão arterial e dislipidemia. A glicemia de jejum, o teste oral de tolerância à glicose (TOTG) e a hemoglobina glicada (HbA1c) são exames amplamente utilizados para a detecção precoce da doença. O diagnóstico precoce permite intervenções mais eficazes, prevenindo a progressão da doença e reduzindo o risco de complicações microvasculares e macrovasculares. Além disso, programas de monitoramento contínuo da glicemia em pacientes pré-diabéticos são fundamentais para evitar a conversão para diabetes estabelecido e para promover mudanças no estilo de vida (GUYTON & HALL, 2011, p. 940).
As políticas públicas e os programas de educação para prevenção do diabetes desempenham um papel crucial no enfrentamento da doença em larga escala. Governos e instituições de saúde têm implementado estratégias voltadas para a promoção da saúde e prevenção de doenças crônicas, visando a redução da incidência do diabetes e de suas complicações. Entre essas iniciativas, destacam-se a criação de diretrizes para alimentação saudável, incentivo à prática de atividades físicas, restrições ao consumo de alimentos ultraprocessados e campanhas educativas sobre fatores de risco. Além disso, a disponibilização de exames de rastreamento gratuito e o acesso facilitado a medicamentos e tratamentos são medidas essenciais para garantir que a população tenha condições de prevenir e controlar o diabetes de forma eficaz (PORTH, 2018, p. 2002).
Os programas educativos para pacientes diabéticos também são fundamentais para garantir a adesão ao tratamento e a compreensão da doença. A educação em saúde deve ser contínua e adaptada às necessidades de cada paciente, abordando temas como autocontrole glicêmico, uso correto de medicamentos, prevenção de complicações e importância do acompanhamento médico regular. Estudos demonstram que pacientes que participam de programas educativos apresentam melhores índices de controle glicêmico, menor incidência de complicações e maior qualidade de vida (ADA, 2020).
Diante da crescente prevalência do diabetes, a prevenção e a educação em saúde devem ser prioridades na agenda global de saúde pública. A combinação de estratégias individuais e coletivas, incluindo mudanças no estilo de vida, rastreamento precoce e políticas públicas eficazes, é essencial para reduzir o impacto da doença e promover um futuro mais saudável para a população. A implementação de programas de conscientização, incentivo à alimentação equilibrada e atividades físicas, além do acesso ampliado a exames diagnósticos e tratamentos, são medidas fundamentais para o combate ao diabetes e a melhoria da qualidade de vida dos indivíduos afetados pela doença (GUYTON & HALL, 2011, p. 942).
3. RESULTADOS E DISCUSSÃO
Os resultados deste estudo demonstram a importância do controle glicêmico e das estratégias terapêuticas para a redução das complicações do Diabetes Mellitus (DM). A análise da literatura permitiu compreender que, embora os avanços no diagnóstico e no tratamento tenham melhorado o manejo da doença, ainda existem desafios relacionados à adesão ao tratamento, acesso a terapias inovadoras e implementação de políticas públicas eficazes. O diabetes continua sendo um problema global de saúde pública, com taxas crescentes de incidência e morbimortalidade, tornando essencial a adoção de abordagens preventivas e terapêuticas mais acessíveis e eficientes.
As mudanças no estilo de vida, como alimentação equilibrada, atividade física e controle do peso corporal, continuam sendo fundamentais para o manejo do diabetes, especialmente no DM2. A literatura indica que pacientes que adotam hábitos saudáveis podem reduzir significativamente o risco da doença. No entanto, um dos principais desafios é a baixa adesão a essas mudanças, evidenciando a necessidade de suporte contínuo, programas educativos e acompanhamento multidisciplinar para garantir que os pacientes sigam as recomendações de forma eficaz.
O tratamento medicamentoso evoluiu significativamente, e a metformina permanece como a primeira escolha para o controle do DM2 devido ao seu efeito na resistência à insulina e seu perfil de segurança. Outras opções, como inibidores da SGLT2 e análogos de GLP-1, têm demonstrado benefícios adicionais na proteção cardiovascular e renal. Entretanto, muitos pacientes ainda enfrentam dificuldades no acesso a esses medicamentos, seja por fatores econômicos ou falta de conhecimento sobre a terapia, o que reforça a necessidade de políticas públicas que garantam acesso a tratamentos modernos e eficazes.
Os tratamentos inovadores, como transplante de células das ilhotas pancreáticas, cirurgia bariátrica e pesquisas com células-tronco, apresentam avanços promissores para casos graves de diabetes. Apesar disso, o alto custo, os riscos associados e a necessidade de acompanhamento rigoroso limitam sua aplicabilidade em larga escala. Além disso, a cirurgia bariátrica, embora eficaz na remissão do DM2 em muitos casos, exige mudanças comportamentais permanentes para evitar a recidiva da doença, o que representa um desafio para os pacientes.
As complicações do diabetes, como retinopatia, nefropatia e neuropatia diabética, ainda são uma preocupação significativa, especialmente quando o diagnóstico é tardio. A literatura destaca que muitos pacientes só descobrem a doença quando já apresentam complicações graves, o que reforça a necessidade de rastreio precoce e acompanhamento contínuo. Além disso, a educação em saúde se mostra essencial para melhorar o autocuidado dos pacientes, reduzindo o risco de complicações e melhorando a adesão ao tratamento.
Este estudo reitera a importância de uma abordagem multidisciplinar e integrada para o controle do diabetes, combinando prevenção, diagnóstico precoce e tratamento adequado. A sinergia entre avanços científicos, políticas públicas e programas educativos é essencial para melhorar a qualidade de vida dos pacientes e reduzir os impactos da doença. O sucesso na gestão do diabetes não depende apenas dos tratamentos disponíveis, mas também de estratégias eficazes para garantir que os pacientes tenham acesso, conhecimento e suporte para seguir um tratamento contínuo e preventivo.
4. CONCLUSÕES
Os achados deste estudo reforçam que o Diabetes Mellitus (DM) é uma doença crônica de grande impacto na saúde pública, exigindo estratégias eficazes de prevenção, diagnóstico precoce e tratamento. A revisão da literatura demonstrou que, apesar dos avanços nas abordagens terapêuticas e no desenvolvimento de novas tecnologias, a prevalência da doença continua a crescer, especialmente devido ao aumento do sedentarismo, da obesidade e da má alimentação. Esse cenário ressalta a necessidade de ações mais efetivas para controle do diabetes, integrando políticas públicas, educação em saúde e inovação terapêutica.
O controle do diabetes depende não apenas de intervenções médicas, mas também de mudanças no estilo de vida, incluindo alimentação equilibrada, prática regular de atividade física e manutenção do peso corporal adequado. No entanto, a adesão a essas mudanças ainda é um grande desafio, o que evidencia a importância de programas educativos e suporte contínuo para os pacientes. A abordagem interdisciplinar, com o envolvimento de profissionais da saúde, familiares e redes de apoio, é essencial para garantir que os pacientes consigam seguir as recomendações e evitar complicações da doença.
A terapêutica medicamentosa avançou significativamente, com a introdução de novas classes de hipoglicemiantes orais e terapias inovadoras, como os inibidores da SGLT2 e análogos do GLP-1, que não apenas melhoram o controle glicêmico, mas também reduzem o risco cardiovascular. No entanto, desafios como acesso limitado a medicamentos modernos e dificuldades na adesão ao tratamento ainda persistem, tornando fundamental a ampliação das políticas de acesso a medicamentos e o fortalecimento da atenção primária para garantir um acompanhamento adequado dos pacientes diabéticos.
As pesquisas sobre tratamentos inovadores, como o transplante de células das ilhotas pancreáticas, a cirurgia bariátrica e as terapias com células-tronco, demonstram grande potencial no manejo da doença, especialmente para casos mais graves e de difícil controle. No entanto, tais abordagens ainda apresentam limitações quanto à viabilidade em larga escala, seja pelo custo elevado, pela necessidade de imunossupressão ou pela complexidade dos procedimentos. Diante disso, torna-se essencial continuar investindo em estudos científicos e na viabilização dessas terapias, tornando-as mais acessíveis para a população.
As complicações do diabetes continuam sendo um dos maiores desafios no manejo da doença, uma vez que muitos pacientes só são diagnosticados quando já apresentam sequelas, como retinopatia, nefropatia e neuropatia diabética. A implementação de estratégias de rastreamento precoce e a ampliação da educação em saúde são fundamentais para reduzir o número de casos diagnosticados tardiamente. Além disso, a adoção de tecnologias no monitoramento do diabetes, como sensores contínuos de glicose e plataformas digitais para acompanhamento médico, pode contribuir significativamente para a melhora do controle glicêmico e prevenção de complicações.
Diante do exposto, conclui-se que o sucesso no controle do diabetes depende de uma abordagem multidisciplinar e integrada, que inclua prevenção, diagnóstico precoce, tratamento adequado e suporte educacional aos pacientes. A sinergia entre avanços científicos, políticas públicas e educação em saúde é essencial para reduzir a incidência da doença, melhorar a qualidade de vida dos pacientes e minimizar os impactos socioeconômicos do diabetes. Portanto, torna-se indispensável o fortalecimento das ações preventivas, o aprimoramento das estratégias de tratamento e o investimento contínuo em pesquisa para tornar as terapias mais acessíveis e eficazes no combate ao diabetes.
REFERÊNCIAS BIBLIOGRÁFICAS
AMERICAN DIABETES ASSOCIATION (ADA). Standards of Medical Care in Diabetes – 2020. Diabetes Care, v. 43, Suplemento 1, p. S1-S212, 2020. Disponível em: https://diabetesjournals.org/care/article/43/Supplement_1/S1/. Acesso em: 05 fev. 2025.
GUYTON, A. C.; HALL, J. E. Tratado de Fisiologia Médica. 13. ed. Rio de Janeiro: Elsevier, 2011.
PORTH, C. M. Patofisiologia: Conceitos das Alterações da Saúde. 9. ed. Rio de Janeiro: Guanabara Koogan, 2018.

