REGISTRO DOI: 10.69849/revistaft/fa10202502211646
Fernanda Augusta Costa Takeuti1,
Carla Rose de Freitas2,
Orientador: Josimar Barbosa da Silva3,
Luis Arthur Moura Guirello4,
Isabella Morais Tavares Huber5
RESUMO
O melanoma é a forma mais agressiva e letal de câncer de pele, com um aumento significativo em sua incidência global nas últimas cinco décadas. Entre os principais fatores de risco, destacam-se a predisposição genética e a exposição ambiental, sendo a radiação ultravioleta (UV) o elemento modificável mais relevante. As estratégias terapêuticas variam conforme o estágio da doença, abrangendo desde a excisão cirúrgica – considerada o padrão-ouro para lesões iniciais – até abordagens mais complexas, como imunoterapia, terapias-alvo, quimioterapia e combinações dessas modalidades. A cirurgia, quando realizada com margens de segurança adequadas, é crucial para prevenir recidivas, enquanto, em estágios avançados, desempenha um papel paliativo. Nos últimos anos, a introdução de terapias adjuvantes, como imunoterapias e inibidores de BRAF e MEK, revolucionou o manejo do melanoma, proporcionando aumento significativo na sobrevida e na qualidade de vida dos pacientes. Além disso, o uso da radioterapia em casos selecionados e o avanço de terapias emergentes ampliam as perspectivas de tratamento.
Palavras-chave: Neoplasia cutânea. Terapia adjuvante. Imunoterapia. Cirurgia oncológica. Metástase.
ABSTRACT
Melanoma is the most aggressive and lethal form of skin cancer, with its global incidence increasing significantly over the past five decades. Key risk factors include genetic predisposition and environmental exposure, with ultraviolet (UV) radiation being the most significant modifiable factor. Therapeutic strategies vary according to the disease stage, ranging from surgical excision—considered the gold standard for early lesions—to more complex approaches such as immunotherapy, targeted therapy, chemotherapy, and combined regimens. Surgical excision with appropriate safety margins is essential to prevent recurrence, while in advanced stages, surgery often serves a palliative role. In recent years, the introduction of adjuvant therapies, including immunotherapies and BRAF and MEK inhibitors, has revolutionized melanoma management, significantly improving survival rates and quality of life. Additionally, the use of radiotherapy in selected cases and the development of emergent therapies broaden the treatment landscape.
Keywords: Cutaneous neoplasia. Melanoma. Adjuvant therapy. Immunotherapy. Oncologic surgery. Metastasis.
INTRODUÇÃO
O melanoma cutâneo é uma neoplasia maligna que se origina nos melanócitos, células responsáveis pela produção do pigmento melanina, localizadas principalmente na camada basal da epiderme. Embora seja mais comum na pele, o melanoma também pode surgir em outras localizações onde melanócitos estão presentes, como olhos, mucosas e sistema nervoso central, devido à migração das células da crista neural durante o desenvolvimento embrionário. Historicamente, o melanoma era considerado uma neoplasia rara, mas sua incidência aumentou drasticamente em países desenvolvidos desde a década de 1950, tornando-se uma das neoplasias cutâneas com maior impacto na mortalidade global (MARTINCORENA et al., 2015).
A sobrevivência dos pacientes com melanoma varia amplamente de acordo com o estágio da doença. Enquanto a taxa de sobrevida em cinco anos para melanomas em estágio inicial (estágio 0) é de 97%, ela cai para apenas 10% em casos de doença metastática avançada (estágio IV) (TARHINI et al., 2019). Apesar de mais prevalente em indivíduos de pele clara, o melanoma é responsável por uma alta taxa de mortalidade, sendo uma das neoplasias malignas mais comuns em indivíduos jovens, frequentemente diagnosticada cerca de uma década antes de outros tumores sólidos, como os de mama, cólon e pulmão (FERLAY et al., 2015).
Os avanços no entendimento das bases moleculares do melanoma revolucionaram sua abordagem terapêutica. A identificação de mutações ativadoras no gene BRAF, presente em cerca de 50% dos melanomas, foi um marco no desenvolvimento de terapias-alvo. Essas mutações, principalmente a substituição V600E, levam à ativação constitutiva da via de sinalização MAPK (mitogen-activated protein kinase), que promove a proliferação e sobrevivência celular. Inibidores de BRAF, como vemurafenibe e dabrafenibe, associados ao uso de inibidores de MEK, como trametinibe e cobimetinibe, têm demonstrado resultados promissores, prolongando a sobrevida de pacientes com melanoma avançado e mutação confirmada (RIBAS et al., 2021; DUMMER et al., 2018).
As terapias-alvo têm se consolidado como uma das opções mais eficazes para pacientes com melanoma avançado. O tratamento combinado de inibidores de BRAF e MEK não apenas potencializa a resposta terapêutica, mas também reduz a resistência adquirida frequentemente observada com o uso isolado de inibidores de BRAF. Ensaios clínicos, como o estudo COLUMBUS, demonstraram que essa estratégia combinada aumenta significativamente a sobrevida livre de progressão e a sobrevida global em comparação aos tratamentos convencionais (DUMMER et al., 2018).
Além das terapias-alvo, a imunoterapia também desempenha um papel fundamental no manejo do melanoma metastático. Agentes como os anticorpos monoclonais anti-PD-1 (pembrolizumabe e nivolumabe) e anti-CTLA-4 (ipilimumabe) têm revolucionado o tratamento, ativando o sistema imunológico do paciente para combater as células tumorais. No entanto, as terapias-alvo continuam sendo a principal abordagem para pacientes com mutações específicas no gene BRAF, destacando a importância de testes moleculares no diagnóstico e na escolha do tratamento (HEISTEIN; ACHARYA, 2020).
Embora a ressecção cirúrgica continue sendo o tratamento principal para melanomas localizados (estágios I a IIIB), pacientes com doença avançada ou metastática frequentemente requerem abordagens combinadas. A excisão cirúrgica, com margens de segurança adequadas (0,5 cm para melanomas in situ, 1 cm para tumores com espessura de até 2 mm e 2 cm para tumores mais espessos), é crucial para o controle local da doença. Entretanto, terapias adjuvantes, como os inibidores de BRAF e MEK, têm demonstrado grande eficácia na prevenção de recorrências e no controle da doença residual (JEMAL et al., 2006; VRIES et al., 2006).
Pacientes com metástases à distância apresentam prognóstico reservado, com sobrevida média de apenas 6 a 9 meses e taxas de sobrevida em cinco anos inferiores a 5% (GELLER et al., 2007). Nesse contexto, as terapias-alvo e a imunoterapia representam um avanço significativo, permitindo o controle da doença em muitos casos que anteriormente eram considerados intratáveis.
Este artigo tem como objetivo revisar as características clínicas e moleculares do melanoma cutâneo, com ênfase nas estratégias terapêuticas mais recentes, especialmente aquelas que envolvem o uso de inibidores de BRAF e MEK. A análise dos resultados de estudos recentes reforça a importância da personalização do tratamento com base no perfil genético do tumor, demonstrando os avanços na luta contra uma das neoplasias mais desafiadoras da oncologia dermatológica.
METODOLOGIA
A presente pesquisa foi conduzida por meio de uma revisão bibliográfica de literatura, com o propósito de reunir, organizar e analisar informações relevantes acerca do melanoma cutâneo e suas abordagens terapêuticas. O levantamento de dados foi realizado em fontes amplamente reconhecidas na área da saúde, com a Biblioteca Virtual em Saúde (BVS) sendo utilizada como principal plataforma de pesquisa. As bases de dados consultadas incluíram a Scientific Electronic Library Online (SciELO) e a Literatura Latino-Americana e do Caribe em Ciências da Saúde (LILACS), além de livros especializados relacionados à temática.
Para garantir a relevância e qualidade dos artigos selecionados, foi realizada uma busca direcionada com o uso dos Descritores em Ciências da Saúde (DeCS). As palavras-chave utilizadas foram: melanoma, tratamento de melanoma e neoplasia maligna de pele. A fim de refinar os resultados e otimizar a especificidade da busca, os descritores foram combinados por meio do operador booleano “AND”.
Os critérios de inclusão definidos para esta revisão foram: artigos publicados entre 2005 e 2024, redigidos em português ou inglês, disponíveis integralmente em formato digital, e que abordassem de forma abrangente o melanoma e seus tratamentos. Paralelamente, foram excluídos trabalhos que não estivessem disponíveis na íntegra, publicações duplicadas nas bases de dados, dissertações e teses acadêmicas, bem como estudos fora do intervalo temporal estabelecido.
Após a realização da busca inicial, os resumos dos artigos identificados foram avaliados de forma criteriosa, a fim de determinar sua pertinência em relação aos objetivos da pesquisa. Foram excluídos trabalhos que não apresentaram textos na íntegra, artigos repetidos nas bases de dados, em formato de dissertações e teses e os que não atenderam ao período cronológico estabelecido. Esse processo sistemático permitiu a obtenção de dados consistentes, relevantes e embasados por evidências científicas robustas, assegurando a confiabilidade dos resultados apresentados.
CLASSIFICAÇÃO
De acordo com Heinstein e Acharya (2020), os melanomas podem ser subdivididos em quatro principais subtipos, com base em características clínicas e histológicas:
1. Melanoma de Disseminação Superficial
Corresponde a aproximadamente 70% dos casos, sendo o subtipo mais comum. Está relacionado à exposição solar intermitente, predominando nas costas dos homens e na região posterior das pernas em mulheres. Apresenta significativa variabilidade de cor, podendo incluir castanho, marrom, preto, cinza, violeta, rosa e, raramente, azul ou branco. As lesões comumente têm bordas bem definidas, frequentemente irregulares, com áreas que se assemelham a penínsulas. Observa-se, frequentemente, uma superfície com pápula palpável ou nódulo elevado, às vezes proeminente (Markovic et al., 2007).
2. Melanoma Nodular
Esse subtipo representa cerca de 5% dos casos e é mais frequente em homens com idades entre 50 e 60 anos, localizando-se predominantemente no tronco e nos membros. Sem uma fase de crescimento radial, apresenta progressão vertical direta, o que confere maior potencial metastático. Clinicamente, as lesões têm coloração homogênea, variando de marrom a preto ou azul-escuro, e muitas vezes são nódulos ulcerados, placas elevadas ou pólipos. Histologicamente, caracteriza-se pela predominância de células tumorais invasivas na derme. Aproximadamente 50% dessas lesões são acrômicas e frequentemente relacionam-se à exposição solar intermitente (Duncan, 2009).
3. Melanoma Lentigo Maligno
Responsável por 4% a 15% dos casos, encontra-se associado à exposição solar crônica, predominando em idosos. Seu desenvolvimento pode ocorrer lentamente ao longo de décadas antes de invadir a derme papilar. Lesões planas, de largos diâmetros, apresentam bordas irregulares e coloração heterogênea (tons marrons e pretos sobre fundo castanho). Essas lesões ocorrem principalmente na cabeça e no pescoço e destacam-se, histologicamente, pela proliferação de melanócitos na camada basal da epiderme (Duncan, 2009).
4. Melanoma Lentiginoso Acral
Embora raro em caucasianos (aproximadamente 5% dos casos), é a forma mais prevalente em indivíduos asiáticos, hispânicos e africanos. Afeta idosos, localizando-se nas palmas das mãos, plantas dos pés, dedos e leitos ungueais, especialmente dos polegares ou dedões. Predomina no sexo feminino e está associado à pele glabra (Markovic et al., 2007).
Além dos tipos principais mencionados, destaca-se o melanoma desmoplásico, mais prevalente em indivíduos entre 60 e 70 anos, principalmente na cabeça e no pescoço. Embora possa ocorrer em diferentes áreas cutâneas e mucosas, predomina em homens. Clinicamente, essas lesões são amelanóticas, apresentando-se como placas ou nódulos de coloração eritematosa, clara ou pálida, especialmente em regiões com danos solares. Diagnosticamente, destaca-se a positividade para S100, característica que pode dificultar a diferenciação de tecidos cicatriciais. Frequentemente há infiltração perineural e invasão nervosa, associadas a altas taxas de recorrência local. Embora raramente metastatize para linfonodos, metástases pulmonares são observadas em estágios avançados (Markovic et al., 2007).
Entre os subtipos, o melanoma de disseminação superficial permanece o mais prevalente (cerca de 70% dos casos), seguido pelo melanoma nodular (15% a 30% dos casos). Já os subtipos lentigo maligno e lentiginoso acral representam menos de 10% dos diagnósticos (Heistein, 2014).
ESTADIAMENTO DO MELANOMA
De acordo com Heinstein e Acharya (2020), existem quatro sistemas principais para o estadiamento do melanoma:
Escala de Clark: avalia a profundidade da lesão em função das camadas da pele atingidas.
Escala de Breslow: determina a espessura do melanoma na pele, sendo um fator importante na definição do prognóstico (Imagem 1).
Sistema TNM (Tumor, Nodo, Metástases): avalia a espessura da lesão e a disseminação para linfonodos ou tecidos distantes. É amplamente utilizado pelo American Joint Committee on Cancer (AJCC) para estadiamento clínico (Imagem 2).
Sistema Numérico (Estágios 0 a 4): combina informações sobre profundidade da lesão e os critérios do TNM.
No sistema numérico, o Estágio 0 caracteriza o melanoma in situ, restrito à epiderme, enquanto o Estágio 4 indica disseminação metastática para outros órgãos. Esses sistemas de classificação não apenas impactam no prognóstico, mas também orientam de forma precisa as decisões terapêuticas, respaldando-se em ciência baseada em evidências (Miller; Mihm, 2006).
IMAGEM 1: ESCALA CLARK E ESCALA BRESLOW
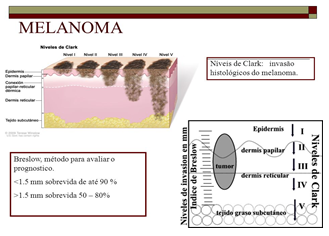
FONTE: PALENCIA, (s.d)
IMAGEM 2: ESTADIAMENTO TNM
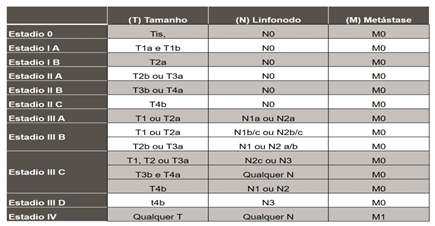
FONTE: AJCC (2019)
IMAGEM 2: ESTADIAMENTO NUMÉRICO
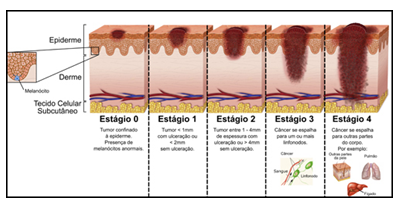
FONTE: PANENCIA (s.d)
EPIDEMIOLOGIA
A incidência global de melanoma cutâneo tem apresentado um aumento anual superior ao de qualquer outro tipo de câncer, excetuando o câncer de pulmão em mulheres. O melanoma é significativamente mais prevalente em indivíduos brancos, quando comparados a negros e asiáticos. Além disso, sua incidência varia consideravelmente entre os países, o que se deve, em grande parte, a diferenças no fenótipo da pele entre as populações e aos níveis de exposição à radiação solar (Ali et al., 2013).
Diferentemente de outros tumores sólidos, o melanoma acomete predominantemente indivíduos jovens e de meia-idade, com a idade média de diagnóstico em torno de 57 anos. A incidência aumenta linearmente entre os 25 e 50 anos, sendo mais frequente entre homens. Em mulheres, contudo, observa-se uma redução na incidência após essa faixa etária. Globalmente, o melanoma é o quinto câncer mais comum entre os homens e o sétimo nas mulheres, correspondendo a cerca de 5% dos novos diagnósticos oncológicos no mundo. Estima-se que até 75% dos pacientes diagnosticados com melanoma tenham menos de 70 anos, evidenciando sua alta prevalência entre adultos mais jovens. Além disso, o melanoma é a terceira principal causa de óbitos entre todas as neoplasias, destacando sua gravidade, especialmente em populações mais jovens, quando comparado a outros tumores sólidos, mais prevalentes em idosos (Ghazawi et al., 2019; Donley et al., 2019).
FATORES DE RISCO
A radiação ultravioleta (UV), especialmente o espectro UV-B, é o principal fator de risco ambiental para o desenvolvimento do melanoma. A exposição intensa e intermitente à radiação UV está associada a um aumento significativo no risco, sendo as queimaduras solares na infância ou adolescência um fator agravante. Fontes artificiais de UV, como câmaras de bronzeamento, também elevam substancialmente o risco dessa neoplasia. Em contrapartida, outros fatores ambientais, como o tabagismo, não demonstraram associação relevante com o melanoma (Gilchrist et al., 1999; Gandini et al., 2004; Ali; Yousaf; Larkin, 2013; Archier et al., 2012).
Fatores relacionados ao hospedeiro, como a presença de nevos melanocíticos, histórico familiar e suscetibilidade genética, desempenham papel central na gênese do melanoma. Cerca de 25% dos casos têm origem em nevos pré-existentes, sendo o risco maior em indivíduos com nevos atípicos ou de grande tamanho. Em termos genéticos, polimorfismos no gene MC1R, associados a fenótipos como cabelos ruivos, pele clara e olhos claros, aumentam a sensibilidade à radiação UV. Além disso, 7% a 15% dos casos estão relacionados a histórico familiar, com destaque para mutações germinativas em genes como CDKN2A e CDK4, associados à síndrome FAMMM (Goldstein; Tucker, 2001; Dessinioti et al., 2011; Soura et al., 2016).
Doenças hereditárias, como xeroderma pigmentoso, síndrome de Li-Fraumeni e síndrome de Lynch tipo II, também elevam o risco de melanoma, reforçando a importância da avaliação genético-familiar nos casos suspeitos (Goldstein; Tucker, 2001; Soura et al., 2016).
AVALIAÇÃO CLÍNICA
A avaliação clínica do melanoma deve incluir a inspeção detalhada da cadeia linfática regional e o exame completo da lesão suspeita. Lesões suspeitas necessitam de biópsia excisional, que fornece amostras de espessura total da pele, essenciais para um diagnóstico histológico preciso e para a classificação tumoral. Técnicas como curetagem ou eletrodissecção são inadequadas nesse contexto (Hayek et al., 2018).
A espessura de Breslow é o principal indicador prognóstico para melanomas em estágios iniciais (I e II) e determina as margens cirúrgicas, além de auxiliar na indicação de biópsia do linfonodo sentinela e tratamentos adjuvantes. Estudos laboratoriais, como hemograma completo, painel metabólico e lactato desidrogenase, são frequentemente indicados, complementados por exames de imagem, como PET-CT, que é particularmente eficaz para a detecção de metástases (Janz et al., 2018; Barker; Salama, 2018).
Exames adicionais, como ultrassonografia para linfonodos comprometidos, ressonância magnética cerebral e tomografia computadorizada de tórax, abdômen e pelve, são recomendados em casos avançados, permitindo um estadiamento completo e preciso para orientar as decisões terapêuticas (Barker; Salama, 2018).
DIAGNÓSTICO
A detecção precoce do melanoma maligno continua a ser um fator crucial na redução da mortalidade associada a essa neoplasia. O prognóstico do melanoma está diretamente relacionado à profundidade da lesão, que tende a aumentar com o tempo, reforçando a importância do diagnóstico e tratamento oportunos. Diferentemente de outros tipos de câncer, o melanoma possui a vantagem de ser uma neoplasia cutânea, o que facilita sua detecção precoce por técnicas não invasivas. Ainda assim, o exame patológico permanece como o padrão-ouro para confirmação diagnóstica.
O diagnóstico inicial pode ser realizado por meio da avaliação clínica da lesão cutânea a olho nu, com base na “regra ABCDE”, que identifica: A: assimetria, B: borda irregular, C: variações de cor, D: diâmetro maior que 6 mm e E: elevação ou evolução da lesão. No entanto, o diagnóstico visual apresenta limitações, com taxas de precisão aproximadas de 80% entre dermatologistas e cerca de 30% entre especialistas não dermatológicos (Heinstein, 2015; Sboner et al., 2003).
Com o avanço da tecnologia, os métodos de detecção evoluíram significativamente, visando melhorar a eficácia diagnóstica e reduzir os casos de falsos negativos. O uso de dermatoscópios e microscópios de superfície cutânea permite uma visualização mais detalhada das lesões. Além disso, sistemas digitais avançados, como o sistema automatizado de diagnóstico de melanoma (MEDS), integram algoritmos de classificação para analisar características da lesão, proporcionando maior precisão diagnóstica (Shain; Bastian, 2016).
Pesquisas recentes também têm se concentrado na identificação de marcadores biológicos específicos do melanoma para prever o curso da doença. Por exemplo, análises de sangue em pacientes considerados livres de câncer podem detectar células de melanoma e marcadores de mRNA, auxiliando na estimativa da probabilidade de remissão em casos metastáticos. Outro marcador molecular relevante é o fator de transcrição da Microftalmia (Mitf), que é exclusivamente expresso em melanócitos de melanoma. Estudos mostram que o anticorpo Mitf pode identificar lesões melanocíticas que não são detectadas por marcadores convencionais, como HMB-45 e S-100 (Lee et al., 2013; Bartlett; Karakousis, 2015).
O estadiamento do melanoma desempenha um papel vital no planejamento terapêutico, fornecendo ferramentas para avaliar o prognóstico do paciente e elaborar estratégias de tratamento que maximizem as chances de recuperação ou sobrevida prolongada. Entretanto, a variabilidade inter e intraobservador no diagnóstico de neoplasias melanocíticas, especialmente em casos com características histológicas ambíguas, representa um desafio significativo. Essa variabilidade deve-se, em parte, à subjetividade inerente às observações visuais no diagnóstico e prognóstico. Assim, métodos mais objetivos estão sendo desenvolvidos para aprimorar a precisão e a reprodutibilidade no diagnóstico do melanoma (Elmore et al., 2017; Scolyer et al., 2011; Mehnert et al., 2012; Li et al., 2006; Horn et al., 2013).
Entre as tecnologias mais recentes, destacam-se métodos de imagem não invasivos pré-biópsia e técnicas quantitativas pós-biópsia, como hibridização fluorescente in situ (FISH), hibridização genômica comparativa (CGH), sequenciamento genético, espectrometria de massa (MS) e imunohistoquímica (IHC). Essas abordagens têm sido cada vez mais utilizadas para melhorar a detecção e o diagnóstico do melanoma (Kim; Meehan, 2017).
Os fatores prognósticos do melanoma cutâneo desempenham um papel crucial na determinação dos desfechos clínicos e na definição das estratégias terapêuticas. Dentre os principais aspectos que influenciam negativamente o prognóstico, destaca-se a espessura do tumor, sendo que lesões mais espessas estão associadas a um pior desfecho. O comprometimento linfonodal também é um indicador importante, uma vez que a presença de células tumorais nos linfonodos regionais caracteriza a doença em estágio III, aumentando a gravidade do quadro.
Outro fator relevante é o número de linfonodos positivos, que está diretamente relacionado a um prognóstico mais desfavorável. A presença de metástases à distância, característica da doença em estágio IV, também implica em uma significativa redução da taxa de sobrevida. Além disso, a localização anatômica do melanoma influencia os desfechos, sendo que lesões localizadas no tronco ou na face apresentam prognósticos piores em comparação às localizadas nas extremidades.
A presença de ulceração é outro fator associado a um pior desfecho clínico, enquanto a regressão histológica, embora controversa, pode ter implicações prognósticas. Por fim, o sexo masculino está relacionado a resultados menos favoráveis em comparação às mulheres, reforçando a complexidade dos fatores que impactam o curso da doença.
DIAGNÓSTICO DIFERENCIAL
O diagnóstico diferencial do melanoma é extenso e engloba uma ampla gama de lesões benignas, pré-malignas e malignas. Entre as lesões benignas, destacam-se a ceratose seborreica, os nevos melanocíticos benignos, os nevos azuis e algumas lesões vasculares, como os angiomas de aranha e os granulomas piogênicos.
Já entre as lesões pré-malignas, incluem-se os nevos displásicos e a ceratose actínica pigmentada, que demandam atenção especial devido ao seu potencial de evolução.
Por fim, no grupo das lesões malignas, encontram-se o carcinoma de células escamosas, o carcinoma basocelular pigmentado, o fibroxantoma atípico, o tumor epitelioide, o hemangioma histiocitoide, o melanoma lentigo maligno, a micose fungoide, o tumor de células fusiformes pigmentadas e o carcinoma sebáceo. A correta diferenciação entre essas condições é essencial para o manejo clínico adequado, uma vez que muitas dessas lesões podem apresentar características clínicas e histológicas semelhantes ao melanoma, exigindo um diagnóstico detalhado e preciso (Heinstein, 2014; Heinstein; Acharya, 2020).
ABORDAGEM TERAPÊUTICA
A maioria dos pacientes com melanoma recém-diagnosticado apresenta a doença em estágio inicial. Embora o melanoma represente uma parcela menor entre os cânceres de pele, ele é responsável pela maior parte das mortes relacionadas a esses tipos de neoplasia devido à sua agressividade e alta capacidade de metastatização. Nos últimos anos, avanços significativos nas abordagens terapêuticas têm proporcionado novas perspectivas para os pacientes.
A cirurgia permanece como a primeira linha de tratamento para melanomas localizados. A excisão cirúrgica com margens de segurança adequadas é essencial para prevenir recidivas. Margens recomendadas incluem 5 mm para lesões in situ, 1 cm para espessura de Breslow <2 mm e 2 cm para espessura ≥2 mm (Cho et al., 2019). A biópsia do linfonodo sentinela é indicada em tumores >0,8 mm ou ulcerados, auxiliando no estadiamento e na definição de terapias adjuvantes (Balch et al., 2009). Em melanomas metastáticos, a cirurgia pode ser utilizada de forma paliativa para aliviar sintomas associados a massas tumorais (Raedler, 2015).
A terapia adjuvante, incluindo imunoterapias e terapias-alvo, revolucionou o manejo do melanoma em estágios avançados. Inibidores de checkpoint imunológico, como pembrolizumabe e nivolumabe, bloqueiam proteínas reguladoras do sistema imunológico, como PD-1 e CTLA-4, aumentando a capacidade do sistema imunológico de atacar as células tumorais (Robert et al., 2015).
Pacientes com mutações no gene BRAF, identificadas em cerca de 50% dos melanomas, podem ser tratados com inibidores de BRAF (vemurafenibe e dabrafenibe) combinados a inibidores de MEK (trametinibe e cobimetinibe), estratégia que demonstrou melhorar significativamente a sobrevida livre de progressão e a sobrevida global (Larkin et al., 2014; Long et al., 2014). Estudos como o COLUMBUS destacam a eficácia da combinação de encorafenibe e binimetinibe, que apresentou maior sobrevida e menor toxicidade em comparação ao uso isolado de inibidores de BRAF (Dummer et al., 2018).
A radioterapia tem papel complementar em casos selecionados, como metástases cerebrais, com destaque para técnicas avançadas, como a radioterapia estereotáxica, que permite a entrega precisa de altas doses de radiação ao tumor enquanto preserva os tecidos saudáveis (Harrington et al., 2016). No entanto, sua eficácia é limitada em melanomas metastáticos.
Embora a quimioterapia, como a dacarbazina, tenha sido amplamente utilizada no passado, seu impacto na sobrevida é modesto, com taxas de resposta de 15% a 20% (Yu et al., 2017). Com a introdução de imunoterapias e terapias-alvo, a quimioterapia é atualmente reservada para casos específicos. Terapias emergentes, como o uso de vírus oncolíticos, também têm ganhado destaque. O talimogene laherparepvec (T-VEC), aprovado para melanoma avançado, demonstrou eficácia ao infectar e destruir seletivamente células tumorais, estimulando uma resposta imunológica local (Harrington et al., 2016).
Nos últimos anos, terapias emergentes têm ampliado as perspectivas no manejo do melanoma. Uma dessas inovações é o uso de anticorpos biespecíficos, que direcionam simultaneamente células T aos antígenos tumorais, intensificando a resposta imunológica contra as células malignas. Além disso, avanços na terapia celular, como o uso de linfócitos infiltrantes de tumor (TILs), têm demonstrado resultados promissores em pacientes com melanoma metastático resistente a outras terapias. Essa abordagem consiste em expandir e reintroduzir linfócitos retirados do tumor do próprio paciente, potencializando a resposta imunológica antitumoral. Outro destaque recente é o uso de moduladores do microambiente tumoral, que visam reverter a imunossupressão local no tumor, melhorando a eficácia de imunoterapias convencionais. Esses avanços representam passos importantes na busca por terapias mais eficazes e personalizadas no tratamento do melanoma (Ribas et al., 2021; Sarnaik et al., 2021).
CONCLUSÃO
O melanoma, embora represente uma fração relativamente pequena entre os cânceres de pele, continua sendo uma das neoplasias mais letais devido à sua agressividade, alta capacidade de metastatização e resistência ao tratamento em estágios avançados. Contudo, os avanços nos métodos diagnósticos e nas abordagens terapêuticas ao longo das últimas décadas têm transformado o manejo dessa doença, trazendo perspectivas mais promissoras para os pacientes.
A excisão cirúrgica, realizada com margens de segurança adequadas, permanece como a base do tratamento curativo para o melanoma localizado. Essa abordagem não apenas reduz as taxas de recidiva, mas também melhora significativamente a sobrevida global quando realizada precocemente, reforçando a importância do diagnóstico precoce e do estadiamento preciso. Em estágios avançados, a cirurgia desempenha um papel paliativo essencial, oferecendo alívio de sintomas e contribuindo para a qualidade de vida.
A introdução de terapias adjuvantes, como os inibidores de checkpoint imunológico (anti-PD-1, anti-CTLA-4) e as terapias-alvo (inibidores de BRAF e MEK), revolucionou o tratamento do melanoma metastático, transformando uma doença outrora fatal em uma condição potencialmente controlável. A personalização do tratamento, baseada no perfil molecular do tumor, tem se consolidado como um marco importante na oncologia, permitindo intervenções mais eficazes e direcionadas. Além disso, estratégias emergentes, como o uso de vírus oncolíticos, terapias celulares com linfócitos infiltrantes de tumor (TILs) e anticorpos biespecíficos, têm ampliado o arsenal terapêutico, oferecendo novas oportunidades para pacientes refratários às terapias convencionais.
A radioterapia estereotáxica e outras técnicas de alta precisão representam ferramentas complementares valiosas, especialmente em casos de metástases cerebrais e outras localizações de difícil acesso cirúrgico. Essas abordagens, quando integradas a terapias sistêmicas, têm demonstrado potencial para melhorar os desfechos clínicos em cenários complexos.
Apesar dos avanços, o melanoma permanece um desafio clínico que exige uma abordagem multimodal e interdisciplinar. A combinação de intervenções cirúrgicas, terapias adjuvantes e estratégias emergentes destaca a importância da pesquisa contínua e do desenvolvimento de novas tecnologias. Além disso, a implementação de programas de rastreamento e prevenção, aliados à conscientização sobre fatores de risco, é crucial para reduzir a morbimortalidade associada a essa neoplasia.
Portanto, o tratamento do melanoma evoluiu de forma significativa, mas ainda demanda esforços colaborativos entre pesquisadores e clínicos para superar as limitações atuais. A integração de terapias inovadoras, aliada a um diagnóstico precoce e a uma abordagem personalizada, é essencial para melhorar os resultados clínicos e a qualidade de vida dos pacientes acometidos por esta forma agressiva de câncer de pele.
REFERÊNCIAS:
DUMMER, R.; ASCIERTO, P. A.; GOGAS, H.; ARANCE, A.; CHIARION-SILENI, V.; TSCHERPEL, C.; et al. Overall survival in COLUMBUS: A phase III trial of encorafenib plus binimetinib versus vemurafenib or encorafenib in BRAF-mutant melanoma. Journal of Clinical Oncology, v. 36, n. 35, p. 3863-3871, 2018.
RIBAS, A.; HAMID, O.; DAUD, A.; HU-LIESKOVAN, S.; PFEIFFER, J.; YEARLEY, J. H.; et al. Association of pembrolizumab with tumor response and survival among patients with advanced melanoma. JAMA, v. 325, n. 17, p. 1706-1717, 2021.
SARNAIK, A.; HAMID, O.; KHUSHALANI, N. I.; LE, D. T.; MCDEVITT, J.; SANGHVI, P.; et al. Lifileucel, a tumor-infiltrating lymphocyte therapy, in metastatic melanoma. Journal of Clinical Oncology, v. 39, n. 24, p. 2656-2666, 2021.
DUMMER, R.; ASCIERTO, P. A.; GOGAS, H.; et al. Overall survival in COLUMBUS: A phase III trial of encorafenib plus binimetinib versus vemurafenib or encorafenib in BRAF-mutant melanoma. Journal of Clinical Oncology, v. 36, n. 35, p. 3863-3871, 2018.
FERLAY, J.; SOERJOMATARAM, I.; DIKSHIT, R.; et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. International Journal of Cancer, v. 136, p. E359-E386, 2015.
GELLER, A. C.; SWETTER, S. M.; BROOKS, K.; et al. Screening, early detection, and trends for melanoma: Current status (2000–2006) and future directions. Journal of the American Academy of Dermatology, v. 57, p. 555–572, 2007.
HEISTEIN, J. B.; ACHARYA, A. S. Melanoma maligno. Medscape. Disponível em: www.ncbi.nlm.nih.gov. Acesso em: 26 out. 2020.
JEMAL, A.; SIEGEL, R.; WARD, E.; et al. Cancer statistics, 2006. CA: a cancer journal for clinicians, v. 56, n. 2, p. 106–130, 2006.
MARTINCORENA, I.; ROSHAN, A.; GERSTUNG, M.; et al. High burden and pervasive positive selection of somatic mutations in normal human skin. Science, v. 348, n. 6237, p. 880–886, 2015.
RIBAS, A.; HAMID, O.; DAUD, A.; et al. Association of pembrolizumab with tumor response and survival among patients with advanced melanoma. JAMA, v. 325, n. 17, p. 1706-1717, 2021.
JEMAL A., SIEGEL R., WARD E, et al. Estatísticas do câncer, 2006. CA Cancer J Clin. 2006; 56 (2): 106-130.
VRIES E, BRAY FI, COEBERGH JW, et al. Mudança da epidemiologia do melanoma cutâneo maligno na Europa 1953–1997: tendências crescentes na incidência e mortalidade. Br J Dermatol. 2006.
GELLER AC, SWETTER SM, BROOKS K, et al. Triagem, detecção precoce e tendências para melanoma: situação atual (2000–2006) e direções futuras. J Am Acad Dermatol. 2007.
MARTINCORENA I, ROSHAN A, GERSTUNG M, et al. Alta carga e seleção positiva generalizada de mutações somáticas na pele humana normal. Ciência, 2015 . 348 ( 6237 ): 880–886.
FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Incidência e mortalidade por câncer em todo o mundo: Fontes, métodos e principais padrões em GLOBOCAN 2012. Int J Cancer. 2015.
TARHINI A, ATZINGER C, GUPTE-SINGH K, et al. Padrões de tratamento e resultados para pacientes com estágio III irressecável e melanoma metastático nos EUA. J Comp Eff Res. Maio de 2019; 8 (7): 461-473.
HAYEK SA, MUNOZ A, DOVE JT, et al. Hospital-Based Study of Compliance with NCCN Guidelines and Predictive Factors of Sentinel Lymph Node Biopsy in the Setting of Thin Melanoma using the National Cancer Database. Am Surg. 01 de maio de 2018; 84 (5): 672-679.
JANZ TA, NESKEY DM, NGUYEN SA, et al. A imagem do cérebro é necessária no diagnóstico de melanomas cutâneos de cabeça e pescoço? Am J Otolaryngol. 2018 setembro – outubro; 39 (5): 631-635.
BARKER CA, SALAMA AK. Novas Diretrizes da NCCN para Melanoma e Tratamento de Melanoma Metastático Distante Recorrente ou Progressivo. J Natl Compr Canc Netw. Maio de 2018; 16 (5S): 646-650.
SBONER A, ECCHER C, BLANZIERI E, et al. Um sistema de classificação múltipla para o diagnóstico precoce de melanoma. Artif Intell Med. 2003; 27 : 29–44.
BEDDINGFIELD FC. Epidemiologia do Melanoma . Oncologista. 2003; 8 : 459–65.
HEISTEIN JB. Melanoma. Medscape. 2014. Disponível em:< http://emedicine.medscape.com/article/1295718-overview#aw2aab6b2> Acessado em 26 de jul. de 2024.
SHAIN AH, BASTIAN BC. De melanócitos a melanomas. Nat Rev Cancer . 2016, 16 ( 6 ): 345–358. 2016.
BARTLETT EK, KARAKOUSIS G. Fatores de estadiamento e prognóstico atuais no melanoma . Surg Oncol Clin N Am, 2015. 24 ( 2 ): 215–227.
HEISTEIN JB; ACHARYA, AS. Melanoma Maligno. Medscape. 2020. Disponível em:< https://www.ncbi.nlm.nih.gov/books/NBK470409/> Acessado em 26 de out. de 2020.
MILLER AJ, MIHM MC., Jr. Melanoma. N Engl J Med. 2006; 355 : 51–65.
ALI Z, YOUSAF N, LARKIN J. Melanoma epidemiology, biology and prognosis. Supl. EJC 2013; 11 : 81–91.
TARHINI A, ATZINGER C, GUPTE-SINGH K, JOHNSON C, MACAHILIG C, RAO S. Padrões de tratamento e resultados para pacientes com estágio III irressecável e melanoma metastático nos EUA. J Comp Eff Res. Maio de 2019; 8 (7): 461-473.
GHAZAWI FM, DARWICH R, LE M, RAHME E, ZUBAREV A, MOREAU L, BURNIER JV, SASSEVILLE D, BURNIER MN, LITVINOV IV. Tendências da incidência do melanoma uveal no Canadá: um estudo nacional abrangente de base populacional. Br J Ophthalmol. Dezembro 2019; 103 (12): 1872-1876.
DONLEY GM, LIU WT, PFEIFFER RM, MCDONALD EC, PETERS KO, TUCKER MA, CAHOON EK. Fatores reprodutivos, uso de hormônios exógenos e incidência de melanoma entre mulheres nos Estados Unidos. Br J Cancer. Abril de 2019; 120 (7): 754-760.
DUNCAN LM. A classificação do melanoma cutâneo. Hematol Oncol Clin North Am 23 : 501 – 513 , 2009.
MARKOVIC SN ,ERICKSON LA ,RAO RD, et al. Grupo de estudo de melanoma do Mayo Clinic Cancer Center: Malignant melanoma in the 21st century, part 1: epidemiology, risk factors, screening, prevention, and diagnosis. Mayo Clin Proc 3: 364-380, 2007.
ALI Z, YOUSAF N, LARKIN J. Melanoma epidemiology, biology and prognosis. Supl. EJC 2013; 11 : 81–91.
FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Incidência e mortalidade por câncer em todo o mundo: Fontes, métodos e principais padrões em GLOBOCAN 2012. Int J Cancer. 2015; 136 : E359 – E386.
GANDINI S, SERA F, CATTARUZZA MS, PASQUINI P, et al. Meta-análise de fatores de risco para melanoma cutâneo: II. Exposição ao sol. Eur J Cancer. 2005; 41: 45–60.
ARCHIER E, DEVAUX S, CASTELA E, GALLINI A, et al. Riscos carcinogênicos da terapia com psoraleno UV-A e terapia UV-B de banda estreita na psoríase crônica em placas: uma revisão sistemática da literatura. J Eur Acad Dermatol Venereol. 2012; 26 (Suplemento 3): 22–31.
RUSSO AE, TORRISI E, BEVELACQUA Y, PERROTTA R, et al. Melanoma: Patogênese molecular e terapias alvo emergentes (revisão) Int J Oncol. 2009; 34 : 1481–1489.
HAWKES JE, TRUONG A, MEYER LJ. Predisposição genética para melanoma. Semin Oncol. 2016; 43: 591–597.
BEVONA C, GOGGINS W, QUINN T, et al. Melanoma Cutâneo associado a nevo. Arch Dermatol. 2003; 139: 1620–1624. doi: 10.1001 / archderm.139.12.1620.
GANDINI S, SERA F, CATTARUZZA MS, PASQUINI P, et al. Meta-análise de fatores de risco para melanoma cutâneo: I. Nevos comuns e atípicos. Eur J Cancer. 2005; 41: 28–44.
DESSINIOTI C, ANTONIOU C, KATSAMBAS A, et al. Variantes do receptor de melanocortina 1: papel funcional e associações pigmentares. Photochem Photobiol. 2011; 87 : 978–987.
GOLDSTEIN AM, TUCKER MA. Epidemiologia genética do melanoma cutâneo: Uma perspectiva global. Arch Dermatol. 2001; 137: 1493–1496.
SOURA E, ELIADES PJ, SHANNON K, STRATIGOS AJ, TSAO H. Hereditary melanoma: Update on syndromes and management: Genetics of family atypical multiple mole melanoma syndrome. J Am Acad Dermatol. 2016; 74: 395–407.
SAMLOWSKI WE, MOON J, WITTER M, et al. Alta frequência de metástases cerebrais após terapia adjuvante para melanoma de alto risco. Cancer Med. 2017; 6 (11): 2576–2585.
YU S, LI A, LIU Q, et al. Células T receptoras de antígenos quiméricos: uma nova terapia para tumores sólidos. J Hematol Oncol. 2017; 10 (1): 78.
CASTLE BT, MCCUBBIN S, PRAHL LS, et al. Mecanismos de estabilização cinética pelos fármacos paclitaxel e vinblastina. Mol Biol Cell. 2017; 28 (9): 1238–1257.
RESERVA J, JANECZEK M, JOYCE C, et al. Uma análise retrospectiva da adesão à vigilância de pacientes após tratamento de melanoma cutâneo primário. J Clin Aesthet Dermatol. Dezembro de 2017; 10 (12): 44-48.
RAEDLER LA. Opdivo (nivolumabe): o segundo inibidor PD-1 recebe aprovação da FDA para melanoma irressecável ou metastático. Benefícios de medicamentos para a saúde Am. 2015; 8 (recurso de especificação): 180–183.
FRANKLIN C, LIVINGSTONE E, ROESCH A, SCHILLING B, SCHADENDORF D. Imunoterapia no melanoma: avanços recentes e direções futuras. Eur J Surg Oncol. 2017; 43 (3): 604–611.
YU S, LI A, LIU Q, et al. Células T receptoras de antígenos quiméricos: uma nova terapia para tumores sólidos. J Hematol Oncol. 2017; 10 (1): 78.
MERHAVI-SHOHAM E, ITZHAKI O, MARKEL G, et al. Terapia celular adotiva para melanoma metastático. Cancer J. 2017; 23 (1): 48–53.
1Médica – Residente de Clinica Médica
2Médica
3Preceptor da Residência de Clinica Médica UNICESUMAR
4Oncologista Clínico, Coordenador do Hospital do Câncer de Maringá – PR e Preceptor do Programa de Residência em Oncologia- UNICESUMAR
5Oncologista Clínica e Oncogenética em Maringá – PR
