FROM PREMATURITY TO CHILD DEVELOPMENT: A LITERATURE REVIEW ON THE IMPACTS AND DIAGNOSIS ON THE DEVELOPMENT OF PREMATURE CHILDREN
REGISTRO DOI: 10.69849/revistaft/dt10202502192252
Luciana Pagliarin Branco1
Nadia Cristina Valentini2
Resumo
Crianças prematuras são mais suscetíveis a riscos no neurodesenvolvimento em comparação com crianças nascidas a termo, devido à exposição de fatores biológicos e desfechos clínicos adversos, os quais podem comprometer a função motora, cognitiva e linguística. Alterações no neurodesenvolvimento detectadas precocemente, possibilitam o encaminhamento para intervenções nos primeiros meses de vida, otimizando benefícios e reduzindo riscos de futuras deficiências. Esta revisão de literatura tem como objetivo descrever os processos de neurodesenvolvimento de crianças prematuras, os desfechos clínicos adversos associados à prematuridade e os comprometimentos neurológicos que podem ocorrer nesse grupo. A importância dessa revisão reside na necessidade de compreender os impactos da prematuridade no desenvolvimento, o que possibilita a implementação de intervenções precoces e estratégias eficazes para mitigar riscos e promover um desenvolvimento saudável. Método: Foi realizada busca online nas bases de dados Medline, LILACS, Google Scholar, PubMed e SciELO entre janeiro de 2024 e janeiro de 2025, com referências datadas de 1978 a 2025; abrangendo 127 artigos, 06 documentos oficiais de órgãos governamentais e 02 livros. Esta revisão narrativa aborda os seguintes tópicos: (1) neurogênese; (2) desenvolvimento infantil; (3) desenvolvimento motor, cognitivo e de linguagem em crianças prematuras; (4) diagnóstico precoce de crianças prematuras, (5) desfechos clínicos adversos da prematuridade, (6) comprometimentos neurológicos na prematuridade, (7) fatores contextuais e o desenvolvimento da criança prematura. A literatura revisada reforça a necessidade de um acompanhamento contínuo e especializado, para assegurar que as crianças prematuras tenham acesso a cuidados adequados e intervenções precoces, fundamentais para o seu desenvolvimento integral.
Palavras chaves: Desenvolvimento infantil. Prematuridade. Diagnóstico Precoce.
Abstract
Premature children are more susceptible to neurodevelopmental risks than full-term children, due to exposure to numerous biological factors and unfavorable clinical outcomes, which can compromise motor, cognitive, and linguistic development. If neurodevelopmental alterations are detected early, it is possible to intervene and refer to interventions in the first months of life, optimizing benefits and reducing the risk of future disabilities. This literature review aims to describe the neurodevelopmental process of premature children, the unfavorable clinical outcomes associated with prematurity, and the neurological impairments that may occur in this group. The importance of this review lies in the need to understand the impacts of prematurity on child development, which enables the implementation of early interventions and effective strategies to mitigate risks and promote health development. Method: Online research was conducted in Medline, LILACS, Google Scholar, PubMed, and SciELO databases between January 2024 and January 2025, with references dated between 1978 and 2025 consisting of 127 articles, 07 official documents from government organizations, and 02 books. This narrative review approach the following topics: (1) neurogenesis; (2) child neurodevelopment; (3) motor, cognitive, and language development in premature children; (4) early diagnosis of premature children; (5) unfavorable clinical outcomes of prematurity, (6) neurological impairments in prematurity, (7) contextual factors and the development of premature children. The reviewed literature reinforces the need for continuous and specialized monitoring to ensure that premature children have access to adequate care and early interventions, which are crucial for their comprehensive development.
Keywords: Child Development. Prematurity. Early Diagnosis.
INTRODUÇÃO
O parto prematuro é definido como aquele que ocorre antes de completar 37 semanas de gestação (WORLD HEALTH ORGANIZATION, 2018). Estima-se que, anualmente, cerca de 30 milhões de bebês nasçam prematuros em todo o mundo (WORLD HEALTH ORGANIZATION, 2018). No Brasil, em 2012, o país ocupava a 10ª posição entre os com maior número de nascimentos prematuros, representando 11,5% de todos os nascimentos (MINISTÉRIO DA SAÚDE, 2011). Dados mais recentes do Sistema de Informações sobre Nascidos Vivos (SINASC), referentes a 2019, indicam que o Brasil ainda apresenta 11,03% de nascimentos prematuros, totalizando 2.849.146 nascidos vivos (MARTINELLI et al., 2021).
As complicações associadas à prematuridade são as principais responsáveis pelo elevado índice de mortalidade entre crianças com menos de cinco anos (BELL et al., 2022; CHAWANPAIBOON et al., 2019; HENTGES et al., 2014; LEAL; DA GAMA, 2014). Além disso, crianças nascidas prematuras estão mais propensas a atrasos no neurodesenvolvimento, especialmente quando comparadas a bebês nascidos a termo (DUBOIS et al., 2021; GIACHETTA et al., 2014; JARJOUR, 2015). O nascimento prematuro interrompe o desenvolvimento e o crescimento cerebral intrauterino, tornando o cérebro mais vulnerável a lesões no sistema nervoso central e aumentando o risco de infecções e inflamações (PANCERI et al., 2020). Os desfechos do neurodesenvolvimento das crianças prematuras estão intimamente ligados aos fatores de risco e proteção a que são expostas.
Embora o avanço nos cuidados de atenção neonatal tenha contribuído significativamente para a sobrevivência de recém-nascidos prematuros, especialmente os de muito baixo peso, a prematuridade ainda impõe desafios consideráveis para o desenvolvimento dessas crianças (SILVEIRA et al., 2018). A implementação de medidas como o incentivo ao aleitamento materno, programas de imunização, ampliação da cobertura de serviços de saúde e melhorias no saneamento básico têm sido fundamentais na redução da mortalidade infantil (SILVEIRA et al., 2018). No entanto, essas crianças continuam vulneráveis a complicações crônicas que impactam negativamente seu crescimento (HOU; TANG; AGARWAL, 2020) e desenvolvimento (MAKROPOULOS et al., 2016).
Dessa forma, esta revisão de literatura tem como objetivo descrever os processos de neurodesenvolvimento de crianças prematuras, os desfechos clínicos adversos associados à prematuridade e os comprometimentos neurológicos que podem ocorrer nesse grupo. A importância dessa revisão reside na necessidade de compreender de maneira abrangente os impactos da prematuridade no desenvolvimento das crianças, o que possibilita a implementação de intervenções precoces e estratégias eficazes para mitigar os riscos e promover um desenvolvimento saudável.
DESENVOLVIMENTO
A busca online nas bases Medline, LILACS, Google Scholar, PubMed e SciELO foi realizada entre janeiro de 2024 e janeiro de 2025, com referências datadas de 1978 a 2025; abrangendo 127 artigos, 06 documentos oficiais de órgãos governamentais e 02 livros. Esta revisão narrativa aborda os seguintes tópicos: (1) neurogênese; (2) desenvolvimento infantil; (3) desenvolvimento motor, cognitivo e de linguagem em crianças prematuras; (4) diagnóstico precoce de crianças prematuras; (5) desfechos clínicos adversos da prematuridade, incluindo hemorragia periventricular, leucomalácia periventricular, enterocolite necrosante, displasia broncopulmonar, sepse neonatal e retinopatia da prematuridade; (6) comprometimentos neurológicos na prematuridade, como paralisia cerebral, transtorno de atenção e hiperatividade, transtorno do espectro autista; (7) fatores contextuais e o desenvolvimento da criança prematura.
1. NEUROGÊNESE
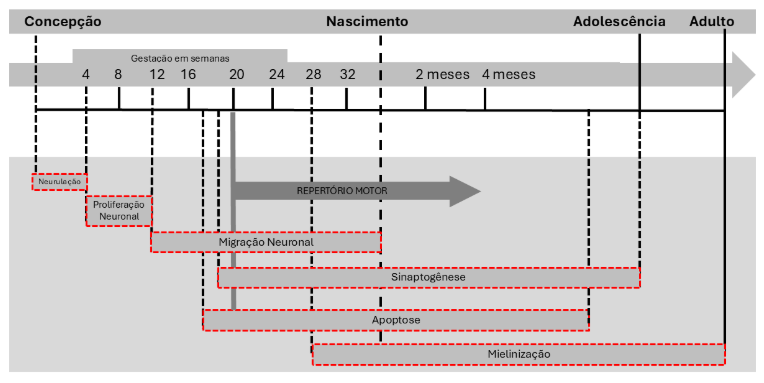
A imaturidade do sistema nervoso central do feto caracteriza uma das principais razões para desfechos adversos no neurodesenvolvimento do prematuro (HINOJOSA-RODRÍGUEZ et al., 2017; LOCATELLI et al., 2010; NOVAK; MORGAN, 2019; SILVEIRA et al., 2018). O desenvolvimento começa ainda nas primeiras semanas de gestação com a proliferação de neurônios nas camadas germinais próximas aos ventrículos. As primeiras conexões sinápticas são formadas por volta da quinta semana de gestação (GEORGE et al., 2018; TAU; PETERSON, 2010). Em seguida, os neurônios migram de maneira ordenada para seus locais de destino e começam a se diferenciar, formando dendritos e axônios, realizando a produção de neurotransmissores e sinapses (LOCATELLI et al., 2010; NOVAK; MORGAN, 2019). Mesmo com atividades de formação neuronal precoce, o córtex cerebral com 20 semanas ainda é liso, apresentando apenas a formação da fissura de Sylvian. No intervalo entre 20 e 40 semanas ocorre crescimento cerebral majoritário, aumentando 90% seu peso de maneira relativamente linear (FINDER et al., 2020; LOCATELLI et al., 2010; VAN BAAR et al., 2005). A proliferação neuronal ocorre entre quatro e doze semanas de gestação e a migração para o córtex, onde exercerão suas funções ao longo da vida, tem um pico de atividade a partir de doze semanas de gestação até o nascimento. Já a sinaptogênese (organização) inicia por volta 18 semanas de gestação e continua após o nascimento, até a adolescência (FINDER et al., 2020).
Em contrapartida, o processo de mielinização inicia apenas com 29 semanas de idade gestacional e persiste até a vida adulta (CERISOLA et al., 2019). Com 34 semanas, o cérebro apresenta somente 65% do peso esperado (HINOJOSA-RODRÍGUEZ et al., 2017). Ao completar 40 semanas os giros e sulcos primários, secundários e terciários do córtex estarão formados (GEORGE et al., 2015; KINNEY, 2006), Durante o intervalo de 36 a 40 semanas a proporção de matéria branca mielinizada no cérebro aumenta de 1 a 5%, porém células neurais podem ser suscetíveis à hipóxia perinatal ou à isquemia neste período, interrompendo tratos neurais da substância branca nos lobos frontal e temporal acarretando lesões irreversíveis (CERISOLA et al., 2019; TAU; PETERSON, 2010).
É na fase final da gestação que as principais mudanças referentes ao sistema neurológico ocorrerão através da origem e proliferação de neurônios, sinaptogênese, crescimento de axônios e mielinização (HINOJOSA-RODRÍGUEZ et al., 2017; TAU; PETERSON, 2010). Especialmente no último trimestre de gestação que o feto deverá receber estímulos sensoriais sobre os sistemas vestibular, táctil, cinestésico e auditivo (GALLINI et al., 2021; VANDERVEEN et al., 2009). Apesar das aquisições neuronais prévias, o cérebro do prematuro está vulnerável a exposição de toxinas ambientais como a carência nutricional, o abuso de álcool e outras drogas e a prematuridade, podendo interromper a mielinização e, consequentemente, favorecer desfechos negativos no neurodesenvolvimento (CERISOLA et al., 2019). Compreender o crescimento e desenvolvimento cerebral do recém-nascido prematuro favorece o diagnóstico e/ou prognóstico em crianças em risco de desenvolver alterações do desenvolvimento (CERISOLA et al., 2019; DUBOIS et al., 2021). Alterações precoces das redes cerebrais demonstram correlação com déficits específicos em escores cognitivos, de linguagem e motor aos 2 anos de idade (DUBOIS et al., 2021). A Figura 1 apresenta os principais eventos do desenvolvimento cerebral.
Figura 1 – Principais eventos no desenvolvimento do sistema nervoso central adaptada de TAU
2. NEURODESENVOLVIMENTO INFANTIL
O neurodesenvolvimento é um processo multifatorial, dinâmico e de grande complexidade envolvendo aspectos motores, cognitivos e sociais que estão presentes ao longo da vida do ser humano (GALLAHUE; OZMUN; GOODWAY, 2013). É especialmente durante os primeiros mil dias de vida a fase de maior plasticidade neural favorecendo oportunidades de aprendizado (BROTHERTON et al., 2021), acelerada maturação dos sistemas, especialmente os sistemas nervoso e cardiorrespiratório, do crescimento associado a novas habilidades, promovendo controle e destreza que irão repercutir ao longo de toda a vida (DA CUNHA; LEITE; DE ALMEIDA, 2015; HERTHER; GERZSON; DE ALMEIDA, 2020; VALENTINI et al., 2019, 2021) e são intimamente dependentes e moldados pelas experiências e estímulos ambientais (GIACHETTA et al., 2014; HADDERS-ALGRA, 2018; PANCERI et al., 2020; VALENTINI et al., 2021).
As transformações observadas ao longo dos primeiros anos de vida demonstram a complexidade, não linearidade e a auto-organização do desenvolvimento, somado a ação do ambiente que pode agir positivamente, favorecendo a exploração e interação com o meio (TUSOR et al., 2014; VALENTINI et al., 2021; YAARI et al., 2018). Entretanto, pode dificultar e diminuir o ritmo de aquisições por restringir as possibilidades de aprendizado pela pobre exploração e interação. Dentre as principais causas que influenciam o atraso no neurodesenvolvimento encontra-se a idade gestacional, o baixo peso ao nascer (CHAWANPAIBOON et al., 2019), os distúrbios cardiovasculares, respiratórios e neurológicos (GALLINI et al., 2021), as infecções neonatais (BELL et al., 2022; LINSELL et al., 2016), a desnutrição (HADDERS-ALGRA, 2018), e a necessidade de hospitalizações no primeiro ano de vida (PANCERI et al., 2020). Quanto maior o número de fatores de risco atuantes, maior será a possibilidade do comprometimento do neurodesenvolvimento e a possível incidência de desordens (DE BORBA; PEREIRA; VALENTINI, 2017; DOS SANTOS CHIQUETTI; VALENTINI, 2020; HASS et al., 2022; PANCERI et al., 2022; PEREIRA; VALENTINI; SACCANI, 2016).
Juntamente aos riscos biológicos, as vulnerabilidades ambientais podem influenciar negativamente a evolução do neurodesenvolvimento (SILVEIRA et al., 2018), evidenciando a interação e reciprocidade destes processos nas adaptações do indivíduo em seu ambiente (BEAUREGARD et al., 2018; PANCERI et al., 2020; VALENTINI et al., 2021). Os fatores contextuais críticos de maior interferência no neurodesenvolvimento incluem a idade materna (CHAWANPAIBOON et al., 2019; DE BORBA; PEREIRA; VALENTINI, 2017; GIACHETTA et al., 2014; MARQUES; VALENTINI; MÜLLER, 2024; PANCERI et al., 2022) as práticas maternas (BORBA; VALENTINI, 2024; DE BORBA; PEREIRA; VALENTINI, 2017a; KOH, 2017; LIMA et al., 2025; MARQUES; VALENTINI; MÜLLER, 2024; SILVEIRA et al., 2024; VALENTINI et al., 2021), grau de instrução dos pais (HASS et al., 2022; LIMA et al., 2025; SACCANI et al., 2013), renda familiar (YAARI et al., 2018), os tipos de brinquedos disponíveis (DE BORBA; PEREIRA; VALENTINI, 2017; HASS et al., 2022), e as oportunidades ambientais para o desenvolvimento (DE BORBA; PEREIRA; VALENTINI, 2017; MARQUES; VALENTINI; MÜLLER, 2024; PEREIRA; VALENTINI; SACCANI, 2016; ZAJONZ; MÜLLER; VALENTINI, 2008).
A interação com o principal cuidador, em geral sendo a mãe, é outro fator crítico ao processo de desenvolvimento da criança (HADDERS-ALGRA, 2018; LIMA et al., 2025). É através do vínculo e da construção de relações sociais que a criança neste período e no decorrer da infância garantirá os cuidados básicos para a sua sobrevivência e suporte emocional para que se desenvolva como membro da sociedade (PICCININI; SEIDL-DE-MOURA, 2007). A sensibilidade dos pais e cuidadores para interpretar os sinais emitidos e as necessidades da criança e respondê-la da maneira adequada (CALDAS; ET AL., 2018; FERNANDES; ET AL, 2017) são fundamentais para a qualidade do seu desenvolvimento além da promoção de competência e autonomia (BOZICEVIC; ET AL, 2022).
A criança desde o nascimento estará engajada em interagir e modular a responsividade da mãe, através do choro para a sua aproximação e da sua capacidade de identificar características maternas como odor e traços faciais. Cuidados caracterizados por sensibilidade e responsividade tendem a promover confiança emocional da criança com seu cuidador, nela própria e no mundo (PICCININI; SEIDL-DE-MOURA, 2007). Ao longo dos primeiros dois anos de vida, as crianças estabelecem interações com seus cuidadores de forma ativa, tomando a iniciativa do contato (LIMA et al., 2025; SILVEIRA et al., 2024). Demonstrações de emoções e sentimentos, sorrisos espontâneos evidenciam a capacidade infantil de explorar o ambiente em busca de novas interações (PAPALIA; OLDS; FELDMAN, 2013).
As interações sociais, por outro lado, podem sofrer influências negativas. Situações de negligência, ausência de proteção, atenção e responsividade enfraquecem as interações sociais e alterações como a diminuição do crescimento encefálico e corporal além de prejuízos no neurodesenvolvimento (ROCHA et al., 2020; SANSAVINI; ET AL, 2015; SOARES; SILVA; ZUANETTI, 2017). Outra situação que promove prejuízo nas interações é de origem biológica, caracterizada pelo nascimento prematuro (SACCANI et al., 2013). Crianças nascidas precocemente apresentam imaturidade sistêmica e tem menores interações eficazes com suas mães do que os nascidos a termo (LIMA et al., 2025; PICCININI; SEIDL-DE-MOURA, 2007).
Essas crianças possuem o cérebro ainda imaturo, dificultando a capacidade de organizar respostas comportamentais a estímulos ambientais e interagir com seus cuidadores (BEAUREGARD et al., 2018). A internação do RN prematuro caracteriza uma separação física e emocional da díade, a mãe terá diversas experiências estressoras devido a presença de barreiras físicas como a incubadora e de equipamentos de saúde presos ao corpo do seu filho (BEAUREGARD et al., 2018; MEDOFF-COOPER et al., 2015). Nesse contexto de intensivismo e fragilidade clínica do RN podem ocorrer interações de alto risco, desencadeando interações insatisfatórias e angustiantes para as mães (BOZICEVIC; et al, 2022) consequentemente, comprometendo conexões emocionais e responsividade materna (ROCHA et al., 2020; WHITE-TRAUT et al., 2018).
Vários estudos também evidenciam que as habilidades motoras, cognitivas e de linguagem ao longo do desenvolvimento infantil estão relacionadas e interferem umas nas outras (LIN; HSU; CHANG, 2020; VALENTINI et al., 2021), atrasos em um domínio do comportamento humano afeta os outros domínios (PANCERI et al., 2020). Considerando tais fragilidade de crianças prematuras, o comportamento motor, cognitivo e de linguagem necessitam do acompanhamento longitudinal devido a maior tendência dessa população em apresentar desordens do desenvolvimento (VALENTINI et al., 2019) e atrasos no neurodesenvolvimento mesmo quando não há lesões neurológicas permanentes (HINOJOSA-RODRÍGUEZ et al., 2017; MAITRE et al., 2020; SACCANI et al., 2018).
3. CRIANÇA PREMATURA
O nascimento de um bebê prematuro é definido pela idade gestacional (IG) menor que 37 semanas, classificados como prematuros extremos (< 28 semanas), muito prematuros (< 32 semanas), moderados (de 32 a 34 semanas) e tardios (entre 34 a 37 semanas). Também são categorizados conforme o peso de nascimento, entre: baixo peso ao nascer (< 2500g), muito baixo peso ao nascer (< 1500g) e extremo baixo peso ao nascer (<1000g). A associação entre idade gestacional e baixo peso ao nascer representa um dos fatores de risco mais significativos de mortalidade e morbidade infantil (BELL et al., 2022; CHAWANPAIBOON et al., 2019; PUTHUSSERY et al., 2018).
De todos os bebês nascidos vivos em 2010, mais de 11% nasceram prematuros. Essa condição afeta tanto países desenvolvidos, como os Estados Unidos, e os em desenvolvimento como o Brasil (LEE; BLENCOWE; LAWN, 2019). Com o passar dos anos, observa-se crescente incidência de parto prematuro e consequentemente à morte e a deficiências subsequentes, representando um impacto significativo na saúde pública em todos os países. Um estudo realizado na Inglaterra analisou uma coorte de prematuros tardios em comparação a bebês nascidos a termo e revelou que crianças prematuras têm o dobro do risco de apresentar comprometimentos no desenvolvimento neurológico aos 2 anos de idade, sendo o desenvolvimento cognitivo a área mais impactada. (RYSAVY et al., 2021).
Anualmente, em todo o mundo, cerca de 30 milhões de bebês nascem prematuros. Destes, 74% dos nascem com idade moderada/tardia, 10% muitos prematuros e 16% nascem com idade extrema. Sendo a prematuridade a principal causa de mortalidade em crianças menores de 5 anos de vida (WORLD HEALTH ORGANIZATION, 2018). Neuroanatomicamente, prematuros com IG <32 possuem redução de volume nas regiões frontotemporais e hipocampo, e estão relacionados com fatores pós-natais, como a displasia broncopulmonar, a hemorragia intraventricular, a exposição a esteroides, a oxigenoterapia e sedação (DECAMPO; HWANG, 2018; DUBOIS et al., 2021; OPHELDERS et al., 2020). Já, os prematuros moderados e tardios têm volume cerebral inferior quando comparados a crianças à termo, especialmente em corpo caloso, estruturas cinzentas profundas, apresentando redução da mielinização no ramo posterior da cápsula interna e giros com padrão imaturo no equivalente a termo, mesmo na ausência de lesão neurológica (REAM; LEHWALD, 2017).
Os avanços tecnológicos e as melhorias de cuidado na área da saúde desde o período pré-natal, juntamente com possibilidades de seguimento em UTIN, aumentaram a taxa de sobrevivência de bebês prematuros. Porém, as morbidades persistiram, com incapacidade de desenvolvimento e declínio na qualidade de vida (VALIZADEH et al., 2017). O tratamento intensivo prolongado (GALLINI et al., 2021) e a vulnerabilidade sistêmica, favorecem distúrbios nos primeiros estágios de desenvolvimento do cérebro, que podem afetar os diversos blocos do desenvolvimento neuronal que ainda estão em construção no indivíduo (GIACHETTA et al., 2016; VALENTINI et al., 2021).
Consequentemente ao nascer, a criança prematura evidencia uma maturação neurológica fragilizada, com a desvantagem de nascimento abrupto e diminuição da permanência no ambiente intrauterino. Crianças prematuras apresentam em geral hipotonia, hipoatividade (BARRADAS et al., 2006; HADDERS-ALGRA, 2018), inibição de postura flexora (BARRADAS et al., 2006; GIACHETTA et al., 2014; HADDERS-ALGRA, 2018), e em tentativas de ganhar estabilidade postural, a criança adota a postura de hiperextensão cervical (DUSING et al., 2013), a qual dificulta o desenvolvimento da mobilidade e aquisição de contração muscular (GIACHETTA et al., 2014; GUIMARÃES et al., 2011). Essa redução de tônus e controle postural dificulta a ação muscular diante das demandas ambientais (DE BORBA; SACCANI; VALENTINI, 2013; VALENTINI et al., 2019).
Além de todas as restrições, os prematuros apresentam pouca variabilidade de movimento e um pobre controle para desempenho de posturas sustentadas contra a gravidade (DUSING, 2016; PANCERI et al., 2022), resultando em atraso de aquisições motoras, como, por exemplo, o controle de cabeça e o alcance. Quando associadas às complicações clínicas, essas restrições influenciam negativamente as experiências motoras espontâneas e o processo de desenvolvimento em longo prazo, como por exemplo, a capacidade de transferir e modificar a distribuição do peso corporal para a adequada movimentação funcional, o ganho do controle de cabeça e as primeiras tentativas de alcance. As complicações mais graves foram encontradas no grupo de prematuros extremos e, em seguida, no grupo de muito prematuros, apresentando os resultados de avaliações de neurodesenvolvimento mais baixos e atrasos motores, cognitivos e de linguagem (VALENTINI et al., 2021). Essas restrições combinadas afetam a comunicação e interação social destas crianças (DUSING, 2016; WHITE-TRAUT et al., 2018).
3.1. DESENVOLVIMENTO MOTOR
O desenvolvimento motor é determinado pela interação entre os estímulos sensoriais, do comportamento do indivíduo e de seu ambiente, mediante diferentes tarefas (NOVAK; MORGAN, 2019; PANCERI et al., 2020; SANGKARIT et al., 2021). Um bebê recém-nascido utiliza informações aferentes fornecidas pela exploração do ambiente gerado através dos movimentos corporais já presentes em vida intrauterina, conhecidos como Movimentos Gerais (DOS SANTOS CHIQUETTI; VALENTINI, 2020; EINSPIELER; PEHARZ; MARSCHIK, 2016; GIACHETTA et al., 2014; HADDERS-ALGRA, 2018). Os movimentos gerais possuem padrões e características específicas por semanas após o nascimento. Posteriormente, esse padrão de movimento fetal é substituído por movimentos transitórios qualitativamente diferentes, que brevemente serão substituídos por comportamentos manipulativos voluntários (PEYTON; SCHREIBER; MSALL, 2018). Consequentemente, a partir do terceiro mês o bebê torna-se mais bem adaptado ao ambiente e suas exigências, respondendo as demandas de diferentes tarefas.
O aumento de força da criança cresce progressivamente. Consequentemente, controle postural se modifica, através do movimento da cabeça, o controle visual, a evolução no padrão de sucção, a vocalização, o sorriso e as expressões de prazer social, especialmente durante o manejo materno (CRISTINA et al., 2021; DE BORBA; PEREIRA; VALENTINI, 2017; PANCERI et al., 2020). Entretanto, o bebê prematuro demonstra movimentos simples e de padrões repetitivos, com limitado controle postural, sendo incapaz de manter seus membros fora da superfície de apoio em comparação com crianças nascidas a termo, que têm a capacidade de movimentos antigravitacionais e realizar movimentos de chutes recíprocos (DUSING, 2016; SACCANI et al., 2018; VALENTINI et al., 2019).
Crianças prematuras apresentam em geral escores motores inferiores a seus pares em todas as faixas etárias a partir de dois meses (SACCANI et al., 2018; SYNNES et al., 2017; TAMPLAIN et al., 2020; VALENTINI; SACCANI, 2011). Essa trajetória difere das crianças a termo mesmo quando adotada a correção de idade gestacional, demonstrando que prematuros apresentam desenvolvimento mais lento, com dificuldades específicas na movimentação antigravitacional e nas transferências de posturas (PANCERI et al., 2022; SACCANI et al., 2018; VALENTINI et al., 2019). Essas alterações de desenvolvimento motor podem ser um primeiro sinal de desordem ou atraso motor, que podem ser detectados nos bebês prematuros ainda nos primeiros meses de vida (BARBOSA; CAMPBELL; BERBAUM, 2007; YAARI et al., 2018), mesmo na ausência de um diagnóstico neurológico. Desfechos negativos, sejam leves ou severos, estão entre os principais problemas de desenvolvimento de bebês prematuros e, portanto, considerados em risco para atrasos no neurodesenvolvimento (FORMIGA; VIEIRA; LINHARES, 2015; HASS et al., 2022; JONES et al., 2018; MAITRE et al., 2020; PANCERI et al., 2022). As diferenças observadas reforçam a necessidade do acompanhamento de crianças prematuras em diferentes faixas etárias de forma longitudinal (SACCANI et al., 2018; VALENTINI et al., 2021).
3.2. DESENVOLVIMENTO COGNITIVO
O desenvolvimento cognitivo é um processo global e multifatorial, vulnerável a desordens neuromotoras, de maneira direta ou indireta. As habilidades cognitivas desenvolvem-se paralelamente e com uma íntima relação com outros domínios do neurodesenvolvimento, destacando-se, principalmente, as habilidades motoras finas e manipulativas, as habilidades oculomotoras e de planejamento motor (NOVAK; MORGAN, 2019; PANCERI et al., 2020; PASCAL et al., 2018).
A variedade de experiências perceptivas contribui para potencializar o desenvolvimento cognitivo dos bebês através da interação da criança com objetos, símbolos e outras crianças (PEREIRA; VALENTINI; SACCANI, 2016). A interação da criança com seus cuidadores, nas diferentes formas de diálogo, reconhecimento de partes do corpo, estimula a aquisição de diferentes posturas, quer seja durante o manuseio ou brincadeiras (BEAUREGARD et al., 2018; PASCAL et al., 2018). A socialização e formação de vínculo mãe-bebê são positivamente relacionadas ao desenvolvimento cognitivo (KOH, 2017). Um dos momentos de intensa interação entre a mãe e o bebê é a amamentação, onde através da estimulação sensorial e tátil ocorre a otimização do desenvolvimento cognitivo (DE BORBA; SACCANI; VALENTINI, 2013; MAITRE et al., 2020; SACCANI et al., 2018).
Os prematuros necessitam de se adaptar de forma abrupta a um ambiente repleto de ruídos, luzes, manipulação excessiva, punções e exames, além dos procedimentos clínicos primordiais (DUSING, 2016; GIACHETTA et al., 2016). A rotina do ambiente de terapia intensiva neonatal faz com que a criança prematura seja muito estimulada, levando a estresse elevado devido a procedimentos dolorosos diariamente (YAARI et al., 2018). A soma desses fatores, a exposição ambiental a estímulos estressores, favorece um alto risco de lesões neurológicas, especialmente para os nascidos de idade extrema (EINSPIELER; PEHARZ; MARSCHIK, 2016; PANCERI et al., 2020). Consequentemente, crianças prematuras apresentam o dobro do risco de incapacidades do desenvolvimento neurológico aos dois anos de idade, decorrente do maior acometimento de habilidades cognitivas quando comparadas aos seus pares nascidos a termo (ELBASAN et al., 2017).
3.3. DESENVOLVIMENTO DE LINGUAGEM
A linguagem envolve a capacidade de comunicação e contribui para o desenvolvimento social, emocional além da aprendizagem escolar. Ela ainda influencia na qualidade da saúde mental, inserção no mercado de trabalho com repercussões expressivas nos planos social e econômico (GOUVEIA et al., 2020). A aquisição e desenvolvimento da linguagem dependem inicialmente da maturação auditiva, especificamente da via auditiva central para crianças prematuras (PERISSINOTO; TAMANAHA, 2020).
Segundo dados do Ministério da Saúde, sabe-se que bebês prematuros têm chances elevadas de atraso no desenvolvimento da linguagem, no prejuízo, por exemplo, de reconhecimento de objetos e figuras, a obediência após comando verbal (MINISTÉRIO DA SAÚDE, 2011). Podem ainda apresentar menor vocabulário, alterações pragmáticas, em participar e manter atividades dialógicas e capacidade na formação de frases e sentenças aos dois anos (SOARES; SILVA; ZUANETTI, 2017). Já na idade pré-escolar, as alterações fonológicas e dificuldades em narrativas são prevalentes e em casos graves, as dificuldades de linguagem podem persistir até a idade escolar e comprometer o desempenho cognitivo da criança (MINISTÉRIO DA SAÚDE, 2011a; PANCERI et al., 2022).
O desenvolvimento da linguagem recebe estimulação precoce desde o período intrauterino com o reflexo de sucção (FRANZ et al., 2018; GIACHETTA et al., 2016). Após o nascimento, com o estímulo da amamentação, o treinamento de sucção e potencializado; a criança exercita os lábios, língua, bochecha e músculos da boca, contribuindo para o crescimento ósseo e organização respiratória síncrona com processos de deglutição (GALLINI et al., 2021; PASTRO et al., 2021) e da linguagem (PERISSINOTO; TAMANAHA, 2020). Brincadeiras ativas que favoreçam maior liberdade de exploração do movimento permitem maior interação social, que por sua vez, melhora as habilidades de linguagem (VALENTINI et al., 2021).
Ainda, a aquisição da linguagem está relacionada a variáveis sociodemográficas, psicossociais e da experimentação sensorial da criança desde os primeiros meses de vida através da socialização e descobertas do meio onde está inserida, especialmente através do cuidado e do relacionamento estabelecido com a mãe (KOH, 2017; PANCERI et al., 2020; VALENTINI et al., 2021). Ao longo da infância, fatores ambientais interferem no desenvolvimento da linguagem, por exemplo, em bebês com atraso no desenvolvimento motor observou-se acréscimo de fatores de riscos biológicos associado a menores oportunidades no ambiente (CHIQUETTI; VALENTINI; SACCANI, 2020), podendo interferir na aquisição da linguagem. Níveis mais baixos de educação formal da mãe (PANCERI et al., 2020), menor qualidade de diálogo entre pais e filhos (GIACHETTA et al., 2014a), número de filhos em casa, número de consultas de pré-natal e convivência dos pais (VALENTINI et al., 2021) representam maior vulnerabilidade socioeconômica e são fatores comumente associados ao desenvolvimento da linguagem, repercutindo em escores mais baixos de linguagem em crianças prematuras.
4. DIAGNÓSTICO PRECOCE DE CRIANÇAS PREMATURAS
Qualquer falha em adquirir funcionalidade adequada à idade caracteriza o atraso no desenvolvimento e pode envolver um ou mais domínios do comportamento humano (ALY; TAJ; IBRAHIM, 2010; BHUTTA et al., 2014). Distinguir as variações naturais deste processo requer o reconhecimento dos padrões de comportamento esperados para a faixa etária e uma análise criteriosa do ambiente em que a criança está inserida (LINSELL et al., 2016). Avaliações de desempenho na primeira infância possuem diferentes finalidades, como distinguir os bebês com desenvolvimento adequado dos com comportamento motor atípico, avaliar as mudanças do repertório motor ao longo da internação e acompanhamento ambulatorial, predizendo futuros problemas do desenvolvimento (GIACHETTA et al., 2014; VALENTINI et al., 2019).
A avaliação do neurodesenvolvimento de crianças prematuras é um importante marcador de saúde, fundamental para o monitoramento das habilidades cognitivas, de linguagem e motoras (BELL et al., 2022). A detecção precoce de atrasos no desempenho motor de prematuros extremos e muito prematuros é essencial, pois é a partir dela, que o tratamento adequado será oferecido, podendo reduzir atuais e futuras deficiências motoras, cognitivas e sociais. O diagnóstico do desenvolvimento motor e de possíveis diferenças na trajetória de aquisições motoras de crianças nascidas prematuras é um indicador relevante para a promoção da saúde e bem-estar da criança. Deste modo, anormalidades motoras são o primeiro alerta para que profissionais de saúde propiciem a adequada avaliação contínua, encaminhamento e tratamento de crianças com riscos estabelecidos (SACCANI et al., 2018). O diagnóstico motor precoce além de predizer desordens do movimento possibilita também orientar pais quanto ao melhor manejo com os bebês (CHIQUETTI; VALENTINI; SACCANI, 2020; PANCERI et al., 2020)
Destaca-se ainda que os exames de avaliação clínica (função motora, neurológica ou neurocomportamental) somados a imagem cerebral realizada durante internação: ultrassonografia na beira do leito e ressonância magnética (RM) pré-alta hospitalar, são técnicas complementares para identificar marcadores estruturais e funcionais de lesão e desenvolvimento cerebral (GEORGE et al., 2018). Os sinais e sintomas clínicos de desordens do neurodesenvolvimento evoluem antes dos 2 anos, portanto, uma combinação de ferramentas padronizadas deve ser usada para prever o risco em conjunto com a história clínica (NOVAK; MORGAN, 2019). As avaliações realizadas nos primeiros meses de vida no ambiente hospitalar possibilitam o mapeamento das necessidades de cada criança e quais as habilidades precisam ser desenvolvidas durante a hospitalização e após a alta hospitalar (MAITRE et al., 2020; PANCERI et al., 2020; SILVEIRA et al., 2018).
Especificamente é de extrema relevância a avaliação de crianças prematuras, pois para essas crianças existe um maior risco de desenvolver comprometimentos no desenvolvimento motor, cognitiva e de linguagem (CHIQUETTI; VALENTINI; SACCANI, 2020; SACCANI et al., 2018; VALENTINI et al., 2019),uma vez que a exposição a lesões cerebrais precoces compromete o desenvolvimento cerebral (GEORGE et al., 2018). Esses insultos tendem a ser agravados nos RNs que tiveram hemorragia periventricular, muitas vezes paralisia cerebral (BOLISETTY et al., 2014; MAITRE et al., 2020). A avaliação precoce e o acompanhamento longitudinal do neurodesenvolvimento podem facilitar o início da intervenção ainda nos primeiros meses de vida; otimizando os resultados interventivos em decorrência da grande plasticidade neural e prevenindo deficiências futuras no neurodesenvolvimento (GEORGE et al., 2018). A intervenção precoce apropriada favorece ainda a diferenciação das fibras musculares e, consequentemente, o desenvolvimento dos tônus postural, da função motora e na aquisição de novas habilidades (VALIZADEH et al., 2017). Para que isso ocorra, a avaliação no período neonatal é primordial, com testes que permitam avaliar as os reflexos, tônus musculares, os movimentos antigravitacionais e de deslocamento, e os movimentos espontâneos de exploração do ambiente (SACCANI et al., 2018).
Apesar da importância da análise de neurodesenvolvimento precoce para aprimorar resultados provenientes da plasticidade cerebral nos primeiros meses de vida, o diagnóstico muitas vezes é consolidado por volta dos 24 meses de idade, quando muitos desfechos adversos já estão (VALENTINI et al., 2021). O diagnóstico precoce alinha-se com a necessidade de promover o atendimento humanizado e com múltiplos olhares para a criança prematura e suas famílias, especialmente as que vivem em vulnerabilidade socioeconômica, oferecendo suporte para o enfrentamento das situações advindas da demanda de cuidado do seu filho prematuro e suas possíveis complicações de desenvolvimento e saúde.
5. DESFECHOS CLÍNICOS ADVERSOS DA PREMATURIDADE
É ainda durante o período gestacional que uma importante etapa do neurodesenvolvimento ocorre, especialmente o terceiro trimestre de gestação é sensível para o desenvolvimento cerebral pela exponencial criação de células da glia e neurônios, além do crescimento de cerca de 90% do cérebro em seu tamanho (HINOJOSA-RODRÍGUEZ et al., 2017). As complicações do bebê prematuro são divididas em complicações de curto prazo, que ocorrem no período neonatal, e sequelas de longo prazo, como deficiências de neurodesenvolvimento, em crianças que sobrevivem e recebem alta da unidade de terapia intensiva neonatal (UTIN). Estudos sobre a prevalência de atrasos em prematuros extremos e moderados ainda são investigados, além de desordens e deficiências sutis serem frequentemente subdiagnosticadas (BELL et al., 2022; HODEL et al., 2017; VALENTINI et al., 2021).
As principais complicações clínicas decorrentes do nascimento prematuro incluem a hemorragia periventricular (GIACHETTA et al., 2016), leucomalácia periventricular (CERISOLA et al., 2019), enterocolite necrosante (BELL et al., 2022), displasia broncopulmonar (NUNES et al., 2020), sepse neonatal (PROCIANOY; SILVEIRA, 2020), retinopatia grave da prematuridade (ROP) (PASTRO et al., 2021).
5.1. HEMORRAGIA PERIVENTRICULAR
A hemorragia periventricular (HPIV) acomete a matriz germinativa do cérebro do bebê, área responsável pela formação de células neuronais e da glia do cérebro imaturo (GIACHETTA et al., 2014; HADDERS-ALGRA, 2018; PANCERI et al., 2020; VALENTINI et al., 2021;ROMANTSIK; CALEVO; BRUSCHETTINI, 2017). Estudos neuropatológicos sugerem que a hemorragia ocorra dentro da rede capilar – esta complexa configuração de numerosos vasos de paredes finas que se comunica livremente com o sistema venoso e ocupa espaços de zonas de fronteira entre artérias e veias cerebrais profundas são suscetíveis à hipóxia e/ou aumento da pressão venosa (BOLISETTY et al., 2014). A incidência da HPIV em prematuros com muito baixo peso ao nascer, monitorada desde os anos 80 tem diminuído ao longo dos anos, entretanto ainda acomete cerca de 20% dos prematuros (HÅKSTAD; OBSTFELDER; ØBERG, 2018;MAITRE et al., 2020; ØBERG et al., 2012).
A classificação de gravidade da HPIV é de I a IV (PAPILLE; ET AL, 1978), mensurada pela extensão do sangramento que pode estender-se até o sistema ventricular adjacente, podendo ser unilateral ou bilateral, com graus simétricos ou assimétricos. À medida que o feto amadurece, a matriz germinativa tende a involuir a partir da 28ª semana de gestação e é ausente no nascimento de idade de termo. Em prematuros, além de o processo evolutivo estar incompleto, um sistema de suporte estrutural ineficiente torna essa região ainda mais vulnerável a insultos, especialmente em situações de instabilidade clínica (LOCATELLI et al., 2010; SHERLOCK et al., 2005). Com prognóstico de morbidade neonatal, mortalidade e desenvolvimento de sequelas neurológicas de longo prazo nos sobreviventes, em até 39,6% dos prematuros (KATO et al., 2013; MCLEAN et al., 2018; NOVAK; MORGAN, 2019; SHERLOCK et al., 2005). Crianças prematuras extremas, acometidas por classificação III e IV, tendem a apresentarem maiores danos no neurodesenvolvimento (BELL et al., 2022; MCLEAN et al., 2018; TAU; PETERSON, 2010).
5.2. LEUCOMALÁCIA PERIVENTRICULAR
A leucomalácia periventricular (LPV) ou lesão da substância branca está fortemente associada com alta prevalência de paralisia cerebral e significativos déficits motor e cognitivo (CERISOLA et al., 2019b; GIACHETTA et al., 2014). A LPV caracteriza-se pelo infarto isquêmico na área da substância branca cerebral adjacente aos ventrículos laterais, comumente em prematuros com sepse. O componente difuso do acometimento da LPV tem forte relação com desfechos adversos visuais, cognitivos e comportamentais (MAITRE et al., 2020).
Outras complicações neurológicas no bebê prematuro incluem infarto hemorrágico periventricular e dilatação ventricular pós-hemorrágica (PROCIANOY; KOCH; SILVEIRA, 2009), causadas por dificuldades de autorregulação do fluxo sanguíneo cerebral no entorno da matriz germinativa (BOLISETTY et al., 2014) .A presença destes insultos determina um prognóstico reservado de morbidade neonatal, mortalidade e desenvolvimento de sequelas neurológicas de longo prazo nos sobreviventes, em até 39,6% em prematuros extremos (KATO et al., 2013; MAITRE et al., 2020).
5.3. ENTEROCOLITE NECROSANTE
A enterocolite necrosante (ECN) uma das mais graves, devastadoras e desafiadoras doenças que comprometem o bebê prematuro com menos de 1.500g, é relacionada à imaturidade do sistema imunológico e da função intestinal do prematuro e sua incidência varia de 4% a 13%, tratando-se, portanto, de uma doença com nítida predominância em RN pré-termo com relação inversa ao peso de nascimento e idade gestacional (IG) (BOARDMAN; COUNSELL, 2020). A ECN possui diferentes e múltiplos fatores desencadeantes entre eles a oferta inadequada de oxigênio ao trato gastrointestinal, existência de flora bacteriana entérica patogênica e potencialmente invasiva além da presença de substrato para proliferação bacteriana na dieta enteral (GEORGE et al., 2018).
A apresentação clínica do prematuro doente inclui distensão abdominal, aumento de resíduo gástrico e/ou resíduo gástrico bilioso, muco e/ou sangue nas fezes, piora clínica com letargia, apneia e acidose. A investigação necessita de rapidez no diagnóstico que pode ser amparado em exames de imagem como raio-x e ecografia abdominal, porém seu perfil é majoritariamente clínico, podendo ser abrupto e de rápida evolução para o óbito, ou pode de evolução lenta e pouco definida (GIACHETTA et al., 2016; RUGOLO, 2005). O tratamento cirúrgico é frequentemente necessário, e os sobreviventes apresentam maior risco de prejuízo crescimento em longo prazo e comprometimento do neurodesenvolvimento, com significante risco para atrasos nos domínios cognitivos e de linguagem (HOU; TANG; AGARWAL, 2020b).
5.4. DISPLASIA BRONCOPULMONAR
A displasia broncopulmonar (DBP) é caracterizada como uma injúria pulmonar precoce acometendo o pulmão imaturo, o que leva à necessidade de suplementação de oxigênio e outras terapias medicamentosas (DE ÁVILA KFOURI et al., 2017; SHI et al., 2020). Está associada com problemas no crescimento e maior susceptibilidade de crianças com DBP em desenvolver infecções graves por vírus respiratórios na primeira infância, nesta situação a taxa de internação hospitalar atinge 17% e uma importante causa de morbidade a curto e longo prazo (JOHNSTON et al., 2012; NOVAK; MORGAN, 2019; SHI et al., 2020; YAARI et al., 2018), principalmente quando evoluem para bronquiolite obliterante, estão relacionadas com frequentes reinternações hospitalares após o período neonatal, maiores taxas de falha no crescimento e desnutrição crônica, situações que são responsáveis por atraso significativo no neurodesenvolvimento do RN prematuro (MINISTÉRIO DA SAÚDE, 2011a).
5.5. SEPSE NEONATAL
A sepse neonatal é uma síndrome clínica com alterações hemodinâmicas e clínicas, decorrentes da presença de microrganismos patogênicos (bactérias, vírus ou fungos) em fluido estéril, como sangue ou líquor cefalorraquidiano (LCR) no primeiro mês de vida (GIACHETTA et al., 2014; MA et al., 2015; SYNNES et al., 2017). É classificada como sepse precoce, presente durante as primeiras 72 horas de vida, adquirida no periparto, com agentes etiológicos do trato geniturinário materno ou sepse tardia, quando iniciam após 72 horas de vida e ocorrem mais frequentemente em bebês que permanecem hospitalizados por longos períodos. Independente do período de acometimento é uma causa frequente de sequelas neurológicas (PROCIANOY; SILVEIRA, 2020). Episódios de crises convulsivas, lesões hemorrágicas e isquêmicas cerebrais e outros insultos neurológicos são os principais desfechos adversos decorrentes de quadros de infecção de sepse, afetando o neurodesenvolvimento e em especial o desenvolvimento motor. Posterior a internação, esses pacientes apresentam maior probabilidade de serem diagnosticados com paralisia cerebral. Ainda mais, é frequente complicações graves que podem levar a cegueira e a surdes (HENTGES et al., 2014).
5.6. RETINOPATIA DA PREMATURIDADE
A retinopatia da prematuridade (ROP) é uma enfermidade vasoproliferativa secundária à vascularização inadequada da retina imatura e permanece como uma das principais causas de cegueira e baixa visão infantil (KAYTON et al., 2018). O nascimento prematuro interrompe o crescimento vascular normal, com adicional obliteração de alguns vasos (GIACHETTA et al., 2016; MINISTÉRIO DA SAÚDE, 2011; RYSAVY et al., 2021). À medida que o RN se desenvolve, a demanda metabólica da retina aumenta, instalando-se a hipóxia em decorrência da não vascularização. Dentre os principais fatores de risco para a ROP estão o APGAR menor que 7 no 5º minuto, flutuação nos níveis de oxigênio nas primeiras semanas de vida, oxigenoterapia, necessidade de ventilação mecânica, transfusão sanguínea, persistência do canal arterial, baixo peso, asfixia perinatal, gestação múltipla, sepse e meningite (KAYTON et al., 2018; KENYHERCZ; SVEDA; NAGY, 2020; PASTRO et al., 2021). Em modelos animais, foi comprovada a associação entre hipóxia e oclusão vascular. Estima-se que haja no mundo cerca de 1,5 milhão de crianças cegas, consequentemente a ROP, sendo categorizada conforme a gravidade, localização, extensão em horas e existência de doença associada (GALLINI et al., 2021)
A gravidade do quadro de comprometimento da ROP varia de 1 (leve) a 5 (mais grave) porém em crianças com acometimento no estágio III já provocam atrasos no neurodesenvolvimento da criança e comprometimento de sua qualidade de vida, com sérias consequências a longo prazo, envolvendo aspectos sensoriais, psicológicos e motores (NOVAK; MORGAN, 2019). Quanto mais precoce o diagnóstico, maior a chance de prevenir agravos na socialização, inserção escolar e outros núcleos (LEE; BLENCOWE; LAWN, 2019; PASTRO et al., 2021).
6. COMPROMETIMENTOS NEUROLÓGICOS NA PREMATURIDADE
Os desfechos clínicos adversos neonatais estão associados a menor renda familiar, portanto tendo um caráter de risco ambiental relevante, afetando o desenvolvimento cognitivo, motor e de linguagem dos prematuros (PANCERI et al., 2020). Panceri e colaboradores em 2022 reportam prejuízo no desenvolvimento em 51% das crianças no âmbito motor, 46% cognitivo e 23% em linguagem em uma população de crianças nascidas com idade extrema (PANCERI et al., 2022), repercutindo em consequentes comprometimentos neurológicos que podem se manifestar em caráter persistente com sequelas neurossensoriais definitivas e severas em entre 4 e 20% dos prematuros (FUENTEFRIA; SILVEIRA; PROCIANOY, 2017). Alterações transitórias também podem ser observadas acometendo de 40 a 80% dos prematuros as quais tendem a desaparecer em torno do segundo ano de vida (FORMIGA; VIEIRA; LINHARES, 2015b; GOLIN et al., 2022; PANCERI et al., 2022; PASCAL et al., 2018; RUGOLO, 2005b; SACCANI et al., 2018). Além disso, destaca-se uma incidência elevada de alterações neurológicas subsequentes nessa população, como por exemplo, a elevada prevalência de paralisia cerebral, o transtorno de atenção e hiperatividade, e o transtorno do espectro do autismo.
6.1. PARALISIA CEREBRAL
A paralisia cerebral (PC) tem a maior prevalência de doenças neurológicas da infância, acometendo 2,1 a cada 1000 nascidos vivos no mundo, porém para prematuros menores de 28 semanas o índice consideravelmente maior, com 100 casos a cada 1000 nascidos vivos (BOLISETTY et al., 2014; MAITRE et al., 2020). A PC é caracterizada pela desordem do movimento, decorrente de defeito ou lesão do cérebro imaturo onde a criança apresenta debilidades variáveis na coordenação da ação muscular e dificuldade de sustentação postural ou realizar movimentos fisiológicos (BOLISETTY et al., 2014; MAITRE et al., 2020).
O comprometimento neuromotor da PC apresenta diferentes topografias, caracterizando partes distintas do corpo acometidas, em diplegia, hemiparesia e quadriplegia (GIACHETTA et al., 2016; MAITRE et al., 2020). A classificação baseada nas alterações clínicas dos tônus musculares e no tipo de desordem do movimento pode produzir o tipo espástico, discinético ou atetóide, atáxico, hipotônico e misto. A espasticidade é um dos componentes da síndrome do neurônio motor superior que resulta em fraqueza muscular, hipertonia, hiperreflexia, presença do sinal de Babinski onde o reflexo cutâneo-muscular é patológico. A espasticidade afeta o posicionamento articular, impedindo a movimentação do músculo ou grupo muscular antagonista, prejudicando a deambulação e as atividades de vida diária da criança (ASSIS-MADEIRA; CARVALHO, 2018). A gravidade da PC pode ainda ser caracterizada como leve, moderada ou grave, baseada no meio de locomoção da criança (MAITRE et al., 2020). Em casos de maior complexidade, as deficiências cognitivas e sensoriais podem estar associadas, como por exemplo, 6,9% de crianças com transtorno do espectro autista tem PC (HERTHER; GERZSON; DE ALMEIDA, 2020).
6.2. TRANSTORNO DE ATENÇÃO E HIPERATIVIDADE
O TDAH é caracterizado por episódios contrastantes de desatenção e hiperatividade ou impulsividade maior que o esperado. Para crianças e adolescentes é presente em 5,3% da população. Crianças com TDAH costumam apresentar menor desempenho escolar (FRANZ et al., 2018) e de autoestima (GIACHETTA et al., 2014). Frequentemente diagnosticados em idade escolar com prejuízo no desenvolvimento motor, além de frequente nas crianças nascidas prematuras associação de depressão e ansiedade quando comparadas com seus pares e pode permanecer ao longo da vida em cerca de 2,5% da população mundial (FRANZ et al., 2018; MINISTÉRIO DA SAÚDE, 2011). A avaliação inclui critérios formais para o diagnóstico, baseados em questionário específico, preenchido pela família e escola.
6.3. TRANSTORNO DO ESPECTRO AUTISTA (TEA)
O TEA é um transtorno do desenvolvimento neurológico, caracterizado por dificuldades de comunicação e interação social e pela presença de comportamentos e/ou interesses repetitivos ou restritos (DEPARTAMENTO CIENTÍFICO DE PEDIATRIA DO DESENVOLVIMENTO E COMPORTAMENTO, 2019; PERISSINOTO; TAMANAHA, 2020). O diagnóstico da TEA leva em consideração a história desde o nascimento e fatores como prematuridade, hipoxemia e isquemia ((SARABETH; FEINBERG; SILVERSTEIN, 2018). A prevalência da TEA entre prematuros tem aumentado desde 2014 nos Estados Unidos da América (EUA), de um caso a cada 58 crianças (GARCIA; HALL-LANDE; NYE-LENGERMAN, 2019), esta prevalência pode estar também relacionada à sobrevivência também aumentada de prematuros extremos. Indivíduos com TEA apresentam comportamentos disruptivos, humor flutuante de ansiedade e depressão, além de dificuldades na sociabilidade (HINOJOSA-RODRÍGUEZ et al., 2017; PERISSINOTO; TAMANAHA, 2020).
Manifestando-se em indivíduos de diversas etnias e em todos os grupos socioeconômicos, porém tem prevalência maior em meninos. Segundo a Sociedade Brasileira de Pediatria, as alterações frequentemente observadas nos domínios da comunicação social, linguagem, comportamentos repetitivos entre 12 e 24 meses têm sido propostos como marcadores de identificação precoce para o autismo. Este aspecto tardio de diagnóstico tem sido associado diretamente com baixa renda familiar, etnia, pouco estímulo, pouca observação sobre o desenvolvimento (ARAUJO et al., 2023). Alguns marcadores potencialmente importantes no primeiro ano de vida de crianças prematuras com TEA incluem atraso no desenvolvimento motor (PERISSINOTO; TAMANAHA, 2020), sensibilidade diminuída a recompensas sociais (SARABETH; FEINBERG; SILVERSTEIN, 2018), afeto negativo e dificuldade no controle da atenção (ARAUJO et al., 2023). Estima-se que 30% do total de casos apresenta deficiência intelectual.
7. FATORES CONTEXTUAIS E O DESENVOLVIMENTO DA CRIANÇA PREMATURA
A interação entre a criança e seu pais começa ainda na gestação e é intensificada no nascimento, progredindo ao longo da infância (BRAREN et al., 2021; DUSING, 2016a; ROCHA et al., 2020). A interação precoce entre mãe e filho, logo após o parto garante a qualidade da interação da díade, fortalece o vínculo e influencia positivamente no desenvolvimento da criança (SOARES; SILVA; ZUANETTI, 2017) ainda, repercute melhores índices de sobrevivência e crescimento (ROCHA et al., 2020).
Múltiplos domínios de interações são observados na primeira infância. A partir do desenvolvimento de habilidades motoras, cognitivas e de linguagem a criança promove uma contínua interação com as pessoas próximas e o ambiente a sua volta (PANCERI et al., 2022). Quando as mães compartilham o afeto, a atenção, e reagem as ações de seus filhos, estes avançam em sua comunicação e linguagem, desenvolvimento cognitivo e social na percepção do seu ambiente e da sua capacidade de agir e reagir (ROCHA et al., 2020). No primeiro ano de vida é esperado que a criança desenvolva habilidades de alcance e exploração de objetos, sentar-se de forma independente, engatinhar e ficar de pé. Na transição para a marcha ocorre, por exemplo, mudanças qualitativas da comunicação infantil, tornando-se mais proativos na interação social além de apresentarem maior produção de vocalizações e gestos dirigidos ao adulto (IVERSON, 2021).
Embora as interações mãe-bebê estejam diretamente relacionadas a resultados do desenvolvimento da relação entre os integrantes da díade, essa relação também é influenciada por fatores intrínsecos (biológicos) na mãe, por exemplo, o humor, idade e depressão pós parto e de fatores extrínsecos (ambientais) ou ainda contextuais de suporte social, condição socioeconômica, profissão e condição conjugal que são considerados mediadores da construção e mediação dessa relação (AURELI; PRESAGHI; GARITO, 2022; ROCHA et al., 2020). A qualidade do relacionamento entre mãe e filho, sua interação e sincronia raramente é avaliada nas consultas médicas muitas vezes curtas, com enfoque na vacinação, ganho de peso e saúde da criança. Profissionais da saúde devem considerar uma breve triagem durante as avaliações médicas e de desenvolvimento de rotina (ROCHA et al., 2020).
A prematuridade possui destaque entre os fatores de impacto da interação mãe-bebê além de influenciar no neurodesenvolvimento infantil (SANSAVINI; ET AL, 2015). Mães de bebês prematuros podem precisar de maior auxílio para leitura de gestos e interações do bebê além do impacto direto da aproximação tardia (ROCHA et al., 2020). Mães e pais que são mais receptivos e sensíveis aos seus filhos prematuros podem facilitar o desenvolvimento de competências sociais das crianças ainda em ambiente hospitalar (PICCININI; SEIDL-DE-MOURA, 2007; SANSAVINI; ET AL, 2015). Em uma revisão sistemática realizada em 2020, foi descrito como agravantes da interação mãe-bebê o nascimento prematuro, a idade infantil, nascimentos múltiplos, e para a mãe quadros de ansiedade, exposição a opioides, passagem por orfanato e registro criminal afetaram a interação e o desenvolvimento infantil (ROCHA et al., 2020). Entretanto, destaca-se que um estudo recente de meta-análise evidencia que crianças prematuras possuem mães responsivas a seus filhos e mais sensíveis a suas necessidades dos mesmos (BILGIN; WOLKE, 2015). Esses resultados contraditórios demonstram a necessidade de se estudar as díades de interação de mães com seus prematuros.
O ambiente doméstico é um recurso fundamental para o desenvolvimento infantil, especialmente nos primeiros anos de vida. O espaço em que a criança cresce, assim como as oportunidades de exploração e estímulo disponíveis, pode tanto favorecer quanto limitar seu neurodesenvolvimento (PEREIRA; VALENTINI; SACCANI, 2016). O interior da casa e seus arredores são os primeiros ambientes que as crianças irão conhecer, explorar e interagir, favorecendo o desenvolvimento de habilidades sociais, as quais potencializam as oportunidades para aprender e brincar (ZOGHI et al., 2019). Por meio de diferentes recursos como os objetos, lugares, brinquedos, superfícies, eventos, interações com pares e adultos, a criança é exposta a diferentes oportunidades de ação e interação ao meio. Ainda, cada um desses recursos terá diferente proposito considerando a idade e a fase de desenvolvimento da criança (FLÔRES et al., 2019). A exposição da criança a brinquedos adequados para a sua idade e exploração do ambiente em que vive favorece e otimiza a aquisição de novas habilidades motoras grossas e finas (CUNHA; MIQUELOTE; SANTOS, 2018). A vizinhança e os arredores do domicílio também influenciam o desenvolvimento infantil, ambientes com diferentes graus de urbanização podem favorecer ou restringir a mobilidade independente e o comportamento motor das crianças (FLÔRES et al., 2019).
A fragilidade de recursos no ambiente doméstico, mais recorrente em famílias com menor poder socioeconômico, repercutem negativamente no desenvolvimento por estimular por um menor tempo as crianças, com por expô-las a oportunidades mais restritas para explorar objetos e o espaço físico do chão (CUNHA; MIQUELOTE; SANTOS, 2018). Outro fator determinante para a qualidade do ambiente doméstico é o nível de educação formal dos cuidadores, influenciando nas possibilidades de interação entre pais e filhos, assim como na oferta de recursos que favorecem o desenvolvimento infantil na residência (PANCERI et al., 2022; PUTHUSSERY et al., 2018). Pais com menor escolaridade, tem menor tempo disponível para cuidar de seus filhos. Por exemplo, mães com menor escolaridade dedicam em média 4,5 horas a menos nos cuidados com os filhos, semanalmente do que as mães com escolaridades superiores a ensino médio. A escolaridade materna influencia a quantidade e a qualidade das oportunidades no lar para o desenvolvimento infantil (FLÔRES et al., 2019).
Outros fatores de risco para o desenvolvimento de prematuros são a idade materna avançada e o menor número de consultas pré-natal. O Ministério da Saúde brasileiro (MINISTÉRIO DA SAÚDE, 2011) chama a atenção para o número abaixo do recomendado de visitas pré-natal por gestantes de baixa renda, e este fator tem sido apontado como associado com a prematuridade para o período. Outro fator associado com a prematuridade é o aumento também crescente de mulheres em idade reprodutiva (acima dos 45 anos) associados ao acesso de métodos de reproduções assistidas; este fator aumenta assim a possibilidade de gestações múltiplas com parto pré-termo (MARTINELLI et al., 2021).
Dessa forma, fatores contextuais como a baixa escolaridade materna e paterna, menores condições socioeconômicas, maior idade maternal são importantes fatores de risco associados à prematuridade (CHIQUETTI, 2020; PANCERI et al., 2020; SACCANI et al., 2013; SILVEIRA et al., 2018). Destaca-se que famílias, com menor poder socioeconômico, podem ser estimuladas a promover recursos para o desenvolvimento através de ações de saúde e o acompanhamento do neurodesenvolvimento para o desenvolvimento de uma rotina de brincadeiras adequadas ao desenvolvimento e incentivos a oferecer mais oportunidades para as crianças (CUNHA; MIQUELOTE; SANTOS, 2018). Essas oportunidades são ainda mais importantes para crianças prematuras, muitas vezes privadas de experiências motoras, cognitivas ou sociais devido as múltiplas vulnerabilidades e a fatores de risco ambientais (MOREIRA et al., 2014; SPITTLE et al., 2009; SUIKKANEN et al., 2021). Um contexto de desenvolvimento estimulante pode contribuir para a compensação de atrasos no desenvolvimento, especialmente em crianças prematuras, ressaltando-se assim a importância da estrutura familiar (PANCERI et al., 2022; ROCHA et al., 2020; VANES et al., 2023; ZAGO et al., 2017). Consequentemente, examinar as oportunidades de interação da criança com cuidadores e as oportunidades no contexto de desenvolvimento são essenciais para a melhor compreensão deste fenômeno multifatorial.
CONCLUSÃO
Esta revisão de literatura evidencia os diversos aspectos do neurodesenvolvimento de crianças prematuras, destacando os riscos associados à prematuridade e suas implicações clínicas a longo prazo. A detecção precoce de alterações no neurodesenvolvimento é crucial para o direcionamento das intervenções adequadas, as quais podem otimizar os resultados e minimizar o impacto de comprometimentos neurológicos. A compreensão dos desfechos adversos e dos fatores contextuais que influenciam o desenvolvimento dessas crianças é essencial para a implementação de estratégias preventivas e terapêuticas eficazes, visando um desenvolvimento saudável e o bem-estar da criança prematura. Deste modo, a literatura analisada reforça a necessidade de um acompanhamento contínuo e especializado, para assegurar que as crianças prematuras tenham acesso a cuidados adequados e intervenções precoces, fundamentais para o seu desenvolvimento integral.
REFERÊNCIAS
ALY, Z.; TAJ, F.; IBRAHIM, S. Missed opportunities in surveillance and screening systems to detect developmental delay: A developing country perspective. Brain and Development, v. 32, n. 2, p. 90–97, 2010.
ARAUJO, R. G. A. et al. AUTISMO, NEURODIVERSIDADE E ESTIGMA: PERSPECTIVAS POLÍTICAS E DE INCLUSÃO. Psicologia Escolar e Educacional, v. 27, p. e247367, 20 out. 2023.
ASSIS-MADEIRA, E.; CARVALHO, S. Paralisia cerebral e fatores de risco ao desenvolvimento motor: uma revisão teórica. Cad. Pós-Graduação em Distúrbios do Desenvolv., v. 9, n. 1, p. 142–163, 2018.
AURELI, T.; PRESAGHI, F.; GARITO, M. C. Mother-infant co-regulation during infancy: Developmental changes and influencing factors. Infant behavior & development, v. 69, 1 nov. 2022.
BARBOSA, V. M.; CAMPBELL, S. K.; BERBAUM, M. Discriminating infants from different developmental outcome groups using the Test of Infant Motor Performance (TIMP) item responses. Pediatric Physical Therapy, v. 19, n. 1, p. 28–39, 2007.
BARRADAS, J. et al. Relationship between positioning of premature infants in Kangaroo Mother Care and early neuromotor development. Jornal de Pediatria, v. 82, n. 6, p. 475–480, 2006.
BEAUREGARD, J. L. et al. Preterm Birth, Poverty, and Cognitive Development. Pediatrics, v. 141, n. 1, p. e20170509, 1 jan. 2018.
BELL, E. F. et al. Mortality, In-Hospital Morbidity, Care Practices, and 2-Year Outcomes for Extremely Preterm Infants in the US, 2013-2018. JAMA, v. 327, n. 3, p. 248–263, jan. 2022.
BHUTTA, Z. A. et al. Can available interventions end preventable deaths in mothers, newborn babies, and stillbirths, and at what cost? The Lancet, v. 384, n. 9940, p. 347–370, 26 jul. 2014.
BILGIN, A.; WOLKE, D. Maternal Sensitivity in Parenting Preterm Children: A Meta-analysis. Pediatrics, v. 136, n. 1, p. e177–e193, 1 jul. 2015.
BOARDMAN, J. P.; COUNSELL, S. J. Invited Review: Factors associated with atypical brain development in preterm infants: insights from magnetic resonance imaging. Neuropathology and Applied Neurobiology, v. 46, n. 5, p. 413–421, 2020.
BOLISETTY, S. et al. Intraventricular hemorrhage and neurodevelopmental outcomes in extreme preterm infants. Pediatrics, v. 133, n. 1, p. 55–62, 2014.
BORBA, L. S. DE; VALENTINI, N. C. ADOLESCÊNCIA E MATERNIDADE: FATORES DE RISCO E ESTRATÉGIAS DE PROTEÇÃO PARA O DESENVOLVIMENTO INFANTIL. Revista ft, p. 08–09, 17 out. 2024.
BOZICEVIC, L.; ET AL. Psychological Well-Being, Prenatal Attachment, and Quality of Early Mother-Infant Interaction: A Pilot Study With a Sample of Mothers With or Without Cancer History. . Frontiers in Psychology, v. 13, 2022.
BRAREN, S. H. et al. Prenatal mother–father cortisol linkage predicts infant executive functions at 24 months. Developmental psychobiology, v. 63, n. 7, p. e22151, 1 nov. 2021.
BROTHERTON, H. et al. Impact of early kangaroo mother care versus standard care on survival of mild-moderately unstable neonates <2000 grams: A randomised controlled trial. EClinicalMedicine, v. 39, 2021.
CALDAS, I. F. R.; ET AL. The socio-communicative development of preterm infants is resistant to the negative effects of parity on maternal responsiveness. . Frontiers in Psychology, v. 9, 2018.
CERISOLA, A. et al. ARTÍCULO ESPECIAL MECANISMOS DE LESIÓN CEREBRAL EN NIÑOS PREMATUROS Principales tipos de lesiones encefálicas en los prematuros Métodos de diagnóstico: valor de las diferentes pruebas , alcances y limitaciones Dificultades en el análisis de los factores. MEDICINA, v. 79, p. 10–14, 2019a.
CHAWANPAIBOON, S. et al. Global, regional, and national estimates of levels of preterm birth in 2014: a systematic review and modelling analysis. The Lancet Global Health, v. 7, n. 1, p. e37–e46, 2019.
CHIQUETTI, E. M. D. S. Validação e normatização do “Test Of Infant Motor Performance” (TIMP) para aplicação clínica e científica no Brasil. UFRGS, 2018.
CHIQUETTI, E. M. DOS S.; VALENTINI, N. C.; SACCANI, R. Validation and Reliability of the Test of Infant Motor Performance for Brazilian Infants. Physical and Occupational Therapy in Pediatrics, v. 40, n. 4, p. 470–485, 2020.
CRISTINA, A. et al. Estimulação precoce em crianças prematuras durante visita domiciliar Early stimulation in premature children during home visit Estimulación temprana en niños prematuros durante la visita domiciliaria. Research Society and Development. v. 2021, n. Cd, p. 1–15, 2021.
CUNHA, A. B.; MIQUELOTE, A. F.; SANTOS, D. C. C. Motor affordance at home for infants living in poverty: A feasibility study. Infant behavior & development, v. 51, p. 52–59, 1 maio 2018.
DA CUNHA, A. J. L. A.; LEITE, Á. J. M.; DE ALMEIDA, I. S. The pediatrician’s role in the first thousand days of the child: the pursuit of healthy nutrition and development. Jornal de Pediatria (Versão em Português), v. 91, n. 6, p. S44–S51, 2015.
DE ÁVILA KFOURI, R. et al. DIRETRIZES PARA O MANEJO DA INFECÇÃO CAUSADA PELO VÍRUS SINCICIAL RESPIRATÓRIO (VSR)-2017 DIRETRIZES Departamentos Científicos de Cardiologia, Imunizações, Infectologia, Neonatologia e Pneumologia Colaboradores: Revisores. Sociedade Brasileira de Pediatria, p. 1–20, 2017.
DE BORBA, L. S.; PEREIRA, K. R. G.; VALENTINI, N. C. Motor and cognitive development predictors of infants of adolescents and adults mothers. Journal of Physical Education (Maringa), v. 28, n. 1, p. 1–16, 2017.
DE BORBA, L. S.; SACCANI, R.; VALENTINI, N. C. Desenvolvimento motor de crianças nascidas pré-termo e a termo avaliadas com a escala motora infantil de alberta. Temas sobre Desenvolv., v. 19, n. 105, p. 130–135, 2013.
DECAMPO, D.; HWANG, M. Characterizing the Neonatal Brain With Ultrasound Elastography. Pediatr. Neurol., v. 86, p. 19–26, 2018.
DEPARTAMENTO CIENTÍFICO DE PEDIATRIA DO DESENVOLVIMENTO E COMPORTAMENTO. Transtorno do Espectro do Autismo – Manual de Orientação. Soc. Bras. Pediatr., v. 05, p. 60, 2019.
DOS SANTOS CHIQUETTI, E. M.; VALENTINI, N. C. Test of infant motor performance for infants in brazil: Unidimensional model, item difficulty, and motor function. Pediatr. Phys. Ther., v. 32, n. 4, p. 390–397, 2020.
DUBOIS, J. et al. MRI of the Neonatal Brain: A Review of Methodological Challenges and Neuroscientific Advances. Journal of magnetic resonance imaging : JMRI, v. 53, n. 5, p. 1318–1343, maio 2021.
DUSING, S. C. et al. Early complexity supports development of motor behaviors in the first months of life. Dev. Psychobiol., v. 55, n. 4, p. 404–414, 2013.
DUSING, S. C. Postural variability and sensorimotor development in infancy. Developmental Medicine and Child Neurology, v. 58, p. 17–21, 2016.
EINSPIELER, C.; PEHARZ, R.; MARSCHIK, P. B. Movimentos irregulares – pequenos na aparência, porém enormes no impacto. J. Pediatr. (Rio. J)., v. 92, n. 3, p. S64–S70, 2016.
ELBASAN, B. et al. “The effects of family-centered physiotherapy on the cognitive and motor performance in premature infants”. Infant Behavior and Development, v. 49, n. 16, p. 214–219, 2017.
FERNANDES, P. T. S.; ET AL. Desenvolvimento neuropsicomotor de recém-nascidos prematuros: uma revisão sistemática. ConScientiae Saúde, v. 16, abr. 2017.
FINDER, M. et al. Two-Year Neurodevelopmental Outcomes after Mild Hypoxic Ischemic Encephalopathy in the Era of Therapeutic Hypothermia. JAMA Pediatr., v. 174, n. 1, p. 48–55, 2020.
FLÔRES, F. S. et al. Affordances for Motor Skill Development in Home, School, and Sport Environments: A Narrative Review. Perceptual and motor skills, v. 126, n. 3, p. 366–388, 1 jun. 2019.
FORMIGA, C. K. M. R.; VIEIRA, M. E. B.; LINHARES, M. B. M. Avaliação do desenvolvimento de bebês nascidos pré-termo: a comparação entre idades cronológica e corrigida. Revista Brasileira de Crescimento e Desenvolvimento Humano, v. 25, n. 2, p. 230–236, 2015.
FRANZ, A. P. et al. Attention-Deficit/Hyperactivity Disorder and Very Preterm/Very Low Birth Weight: A Meta-analysis. Pediatrics, v. 141, n. 1, p. e20171645, 1 jan. 2018.
FUENTEFRIA, R. DO N.; SILVEIRA, R. C.; PROCIANOY, R. S. Desenvolvimento motor de prematuros avaliados pela Alberta Infant Motor Scale: artigo de revisão sistemática. J. Pediatr. (Rio. J)., v. 93, n. 4, p. 328–342, 2017.
GALLAHUE, D. L.; OZMUN, J. C.; GOODWAY, J. D. Compreendendo o desenvolvimento motor: bebês, crianças, adolescentes e adultos. AMGH Editora ed. [s.l: s.n.].
GALLINI, F. et al. Neurodevelopmental outcomes in very preterm infants: The role of severity of Bronchopulmonary Dysplasia. Early Hum. Dev., v. 152, n. September 2020, p. 105275, 2021a.
GALLINI, F. et al. Neurodevelopmental outcomes in very preterm infants: The role of severity of Bronchopulmonary Dysplasia. Early Human Development, v. 152, n. September 2020, p. 105275, 2021b.
GARCIA, S.; HALL-LANDE, J.; NYE-LENGERMAN, K. Factors Influencing Low Prevalence of Neurodevelopmental Disabilities Among US Hispanic/Latino Children. Journal of Racial and Ethnic Health Disparities, v. 6, n. 6, p. 1107–1121, 1 dez. 2019.
GEORGE, J. M. et al. PPREMO: A prospective cohort study of preterm infant brain structure and function to predict neurodevelopmental outcome. BMC Pediatrics, v. 15, n. 1, p. 1–17, 2015.
GEORGE, J. M. et al. Relationship between very early brain structure and neuromotor, neurological and neurobehavioral function in infants born <31 weeks gestational age. Early Human Development, v. 117, n. December 2017, p. 74–82, 2018.
GIACHETTA, L. et al. Perinatal events and motor performance of children born with ELBW and nondisabled. Clinics in Perinatology, v. 41, n. 1, p. 1–7, 2014.
GIACHETTA, L. et al. Characterization of the motor performance of newborns in a neonatal unit of tertiary level. Rev. Assoc. Med. Bras., v. 62, n. 6, p. 553–560, 2016.
GOLIN, M. O. et al. “The Value of Clinical Examination in Preterm Newborns after Neonatal Sepsis: A Cross-sectional Observational Study.” Dev. Neurorehabil., v. 25, n. 2, p. 80–86, 2022.
GOUVEIA, A. S. DE et al. Desenvolvimento de linguagem e das habilidades auditivas em prematuros adequados e pequenos para a idade gestacional: idade cronológica entre 18 e 36 meses. CoDAS. SciELO Brasil, 2020.
GUIMARÃES, C. L. N. et al. Desenvolvimento motor avaliado pelo Test of Infant Motor Performance: Comparação entre lactentes pré-termo e a termo. Revista Brasileira de Fisioterapia, v. 15, n. 5, p. 357–362, 2011.
HADDERS-ALGRA, M. Early human motor development: From variation to the ability to vary and adapt. Neurosci. Biobehav. Rev., v. 90, n. January, p. 411–427, 2018.
HÅKSTAD, R. B.; OBSTFELDER, A.; ØBERG, G. K. A qualitative study of clinical reasoning in physiotherapy with preterm infants and their parents: Action and interaction. Physiotherapy Theory and Practice, v. 34, n. 9, p. 692–704, 2018.
HASS, J. V. et al. Risk Factors for cognitive, motor and language development of preterm children in the first year of life. Revista paulista de pediatria : orgao oficial da Sociedade de Pediatria de Sao Paulo, v. 41, p. e2021165, 2022.
HENTGES, C. R. et al. Association of late‐onset neonatal sepsis with late neurodevelopment in the first two years of life of preterm infants with very low birth weight. Jornal de Pediatria, v. 90, n. 1, p. 50–57, 2014.
HERTHER, D. S.; GERZSON, L. R.; DE ALMEIDA, C. S. Fase da lesão cerebral e o diagnóstico cinético-funcional de sujeitos com paralisia cerebral. ConScientiae Saúde, v. 18, n. 3, p. 352–365, 2020.
HINOJOSA-RODRÍGUEZ, M. et al. Clinical neuroimaging in the preterm infant: Diagnosis and prognosis. NeuroImage: Clinical, v. 16, n. August, p. 355–368, 2017.
HODEL, A. S. et al. Early executive function differences in infants born moderate-to-late preterm. Early human development, v. 113, p. 23–30, out. 2017.
HOU, W.; TANG, P. H.; AGARWAL, P. The most useful cranial ultrasound predictor of neurodevelopmental outcome at 2 years for preterm infants. Clinical Radiology, v. 75, n. 4, p. 278–286, 2020.
IVERSON, J. M. Developmental Variability and Developmental Cascades: Lessons from Motor and Language Development in Infancy. Current directions in psychological science, v. 30, n. 3, p. 228, 1 jun. 2021.
JARJOUR, I. T. Neurodevelopmental Outcome After Extreme Prematurity: A Review of the Literature. Pediatric Neurology, v. 52, n. 2, p. 143–152, 2015.
JOHNSTON, C. et al. I Brazilian guidelines for respiratory physiotherapy in pediatric and neonatal intensive care units. Revista Brasileira de Terapia Intensiva, v. 24, n. 2, p. 119–129, 2012.
JONES, R. M. et al. Outcome following preterm intraventricular haemorrhage – what to tell the parents. Paediatrics and Child Health (United Kingdom), v. 28, n. 9, p. 431–435, 2018.
KATO, T. et al. Associations of Preterm Births with Child Health and Development: Japanese Population-Based Study. The Journal of Pediatrics, v. 163, n. 6, p. 1578- 1584.e4, 1 dez. 2013.
KAYTON, A. et al. A Review of Oxygen Physiology and Appropriate Management of Oxygen Levels in Premature Neonates. Adv. Neonatal Care, v. 18, n. 2, p. 98–104, 2018.
KENYHERCZ, F.; SVEDA, B.; NAGY, B. E. Koraszülöttek kétéves kori pszichomotoros fejlettsége a leggyakoribb krónikus utóbetegségek tekintetében. Orv. Hetil., v. 161, n. 5, p. 183–192, 2020.
KINNEY, H. C. The Near-Term (Late Preterm) Human Brain and Risk for Periventricular Leukomalacia: A Review. Seminars in Perinatology, v. 30, n. 2, p. 81–88, 2006.
KOH, K. Maternal breastfeeding and children’s cognitive development. Social Science & Medicine, v. 187, p. 101–108, 2017.
LEAL, M. DO C.; DA GAMA, S. G. N. Nascer no brasil. Cad. Saude Publica, v. 30, n. SUPPL1, p. 2014, 2014.
LEE, A. C.; BLENCOWE, H.; LAWN, J. E. Small babies, big numbers: global estimates of preterm birth. The Lancet Global Health, v. 7, n. 1, p. e2–e3, 2019.
LIMA, B. P. et al. Maternal parenting skills, adverse clinical outcomes, and contextual factors in low-income families: Associations and predictors of the neurodevelopment of preterm children in the first two years of life. Infant Behavior and Development, v. 78, p. 102006, 1 mar. 2025.
LIN, C.-Y.; HSU, C.-H.; CHANG, J.-H. Neurodevelopmental outcomes at 2 and 5 years of age in very-low-birth-weight preterm infants born between 2002 and 2009: A prospective cohort study in Taiwan. Pediatrics and neonatology, v. 61, n. 1, p. 36–44, fev. 2020.
LINSELL, L. et al. Prognostic factors for cerebral palsy and motor impairment in children born very preterm or very low birthweight: A systematic review. Developmental Medicine and Child Neurology, v. 58, n. 6, p. 554–569, 2016.
LOCATELLI, A. et al. Antenatal variables associated with severe adverse neurodevelopmental outcome among neonates born at less than 32 weeks. European Journal of Obstetrics and Gynecology and Reproductive Biology, v. 152, n. 2, p. 143–147, 2010.
MA, L. et al. Effect of early intervention on premature infants’ general movements. Brain and Development, v. 37, n. 4, p. 387–393, 1 abr. 2015.
MAITRE, N. L. et al. Network implementation of guideline for early detection decreases age at cerebral palsy diagnosis. Pediatrics, v. 145, n. 5, 2020.
MAKROPOULOS, A. et al. Regional growth and atlasing of the developing human brain. NeuroImage, v. 125, p. 456–478, 2016.
MARQUES, L. F.; VALENTINI, N. C.; MÜLLER, A. B. Riscos clínicos e contextuais em crianças prematuras: revisão narrativa e perspectivas de prevenção. Revista ft, p. 13–14, 10 out. 2024.
MARTINELLI, K. G. et al. Prematuridade no Brasil entre 2012 e 2019: dados do Sistema de Informações sobre Nascidos Vivos. Revista Brasileira de Estudos de População, v. 38, p. e0173, 8 out. 2021.
MCLEAN, G. et al. Three-dimensional ultrasound cranial imaging and early neurodevelopment in preterm growth-restricted infants. Journal of Paediatrics and Child Health, v. 54, n. 4, p. 420–425, 2018.
MEDOFF-COOPER, B. et al. Multisensory intervention for preterm infants improves sucking organization. Adv. Neonatal Care, v. 15, n. 2, p. 142–149, 2015.
MINISTÉRIO DA SAÚDE. Atenção à saúde do recém-nascido: cuidados com o recém-nascido pré-termo. [s.l: s.n.], 2011.
MOREIRA, R. S. et al. Factors influencing the motor development of prematurely born school-aged children in Brazil. Research in Developmental Disabilities, v. 35, n. 9, p. 1941–1951, 2014.
NOVAK, I.; MORGAN, C. High-risk follow-up: Early intervention and rehabilitation. 1. ed. [s.l.] Elsevier B.V., 2019. v. 162
NUNES, C. R. et al. Use of Azithromycin for the Prevention of Lung Injury in Mechanically Ventilated Preterm Neonates: A Randomized Controlled Trial. Neonatology, v. 117, n. 4, p. 522–528, 2020.
ØBERG, G. K. et al. Study protocol: An early intervention program to improve motor outcome in preterm infants: A randomized controlled trial and a qualitative study of physiotherapy performance and parental experiences. BMC Pediatrics, v. 12, n. 1, p. 15, 2012.
OPHELDERS, D. R. M. G. et al. Preterm Brain Injury, Antenatal Triggers, and Therapeutics: Timing Is Key. Cells, v. 9, n. 8, 2020.
PANCERI, C. et al. Neonatal Adverse Outcomes, Neonatal Birth Risks, and Socioeconomic Status: Combined Influence on Preterm Infants’ Cognitive, Language, and Motor Development in Brazil. Journal of Child Neurology, v. 35, n. 14, p. 989–998, 2020.
PANCERI, C. et al. Motor development in the first year of life predicts impairments in cognition and language at 3 years old in a Brazilian preterm cohort of low-income families . Frontiers in Neuroscience, 2022.
PAPALIA, D. E.; OLDS, S. W.; FELDMAN, R. D. Desenvolvimento humano. Artmed ed. Porto Alegre, 2013.
PAPILLE, L.; ET AL. Incidence and evaluation of subependymal haemorrhage: a study of children with a birthweight less than 1500g. J Pediatr, v. 92, 1978.
PASCAL, A. et al. Neurodevelopmental outcome in very preterm and very-low-birthweight infants born over the past decade: a meta-analytic review. Developmental medicine and child neurology, v. 60, n. 4, p. 342–355, abr. 2018.
PASTRO, J. et al. Comorbidades e procedimentos assistenciais correlatos ao desenvolvimento de retinopatia da prematuridade. Semina: Ciências Biológicas e da Saúde, v. 42, n. 2, p. 115, 2021.
PEREIRA, K. R. G.; VALENTINI, N. C.; SACCANI, R. Brazilian infant motor and cognitive development: Longitudinal influence of risk factors. Pediatrics International, v. 58, n. 12, p. 1297–1306, 2016.
PERISSINOTO, J.; TAMANAHA, A. C. Perspectivas atuais na avaliação e na intervenção dos transtornos do neurodesenvolvimento: transtorno do espectro autista. Avaliação da fala e da linguagem: perspectivas interdisciplinares em Fonoaudiologia, p. 237, 2020.
PEYTON, C.; SCHREIBER, M. D.; MSALL, M. E. The Test of Infant Motor Performance at 3 months predicts language, cognitive, and motor outcomes in infants born preterm at 2 years of age. Developmental Medicine and Child Neurology, v. 60, n. 12, p. 1239–1243, 2018.
PICCININI, C. A.; SEIDL-DE-MOURA, M. L. Observando a interação pais bebêcriança: Diferentes abordagens teóricas e metodológicas. Casa do Psicólogo, v. s. l., 2007.
PROCIANOY, R. S.; KOCH, M. S.; SILVEIRA, R. C. Neurodevelopmental outcome of appropriate and small for gestational age very low birth weight infants. Journal of Child Neurology, v. 24, n. 7, p. 788–794, 2009.
PROCIANOY, R. S.; SILVEIRA, R. C. The challenges of neonatal sepsis management. Jornal de Pediatria, v. 96, p. 80–86, 2020.
PUTHUSSERY, S. et al. Effectiveness of early intervention programs for parents of preterm infants: A meta-review of systematic reviews. BMC Pediatrics, v. 18, n. 1, p. 1–18, 2018.
REAM, M. A.; LEHWALD, L. Neurologic Consequences of Preterm Birth. Curr. Neurol. Neurosci. Rep., v. 18, n. 8, 2017.
ROCHA, N. A. C. F. et al. Impact of mother–infant interaction on development during the first year of life: A systematic review. Journal of Child Health Care, v. 24, n. 3, p. 365–385, 2020.
ROMANTSIK, O.; CALEVO, M. G.; BRUSCHETTINI, M. Head midline position for preventing the occurrence or extension of germinal matrix-intraventricular hemorrhage in preterm infants. Cochrane Database Syst. Rev., v. 2017, n. 7, 2017.
RUGOLO, L. M. S. DE S. Crescimento e desenvolvimento a longo prazo do prematuro extremo. J. Pediatr. (Rio. J)., v. 81, n. 1, p. 101–110, 2005.
RYSAVY, M. A. et al. The relationship of neurodevelopmental impairment to concurrent early childhood outcomes of extremely preterm infants. Journal of Perinatology, v. 41, n. 9, p. 2270–2278, 2021.
SACCANI, R. et al. Associations of biological factors and affordances in the home with infant motor development. Pediatrics International, v. 55, n. 2, p. 197–203, 2013.
SACCANI, R. et al. Motor development’s curves of premature infants on the first year of life according to Alberta Infant Motor Scale. Fisioterapia em Movimento, v. 31, n. 0, p. 1–9, 2018.
SANGKARIT, N. et al. Segmental assessment of trunk control in moderate-to-late preterm infants related to sitting development. Children, v. 8, n. 9, p. 1–9, 2021.
SANSAVINI, A.; ET AL. Dyadic co-regulation, affective intensity and infant’s development at 12 months: A comparison among extremely preterm and full-term dyad. Infant behavior & development, v. 40, p. 29–40, 2015.
SARABETH, B. F.; FEINBERG, E.; SILVERSTEIN, M. Improving Screening for Autism Spectrum Disorder: Is It Time for Something New? Pediatrics, v. 141, n. 6, 1 jun. 2018.
SHERLOCK, R. L. et al. Neurodevelopmental sequelae of intraventricular haemorrhage at 8 years of age in a regional cohort of ELBW/very preterm infants. Early Human Development, v. 81, n. 11, p. 909–916, 2005.
SHI, Y. et al. A Review on Non-invasive Respiratory Support for Management of Respiratory Distress in Extremely Preterm Infants . Frontiers in Pediatrics , 2020. Disponível em: <https://www.frontiersin.org/articles/10.3389/fped.2020.00270>
SILVEIRA, R. C. et al. Early intervention program for very low birth weight preterm infants and their parents: A study protocol. BMC Pediatr., v. 18, n. 1, p. 1–11, 2018.
SILVEIRA, R. C. et al. Parent-Guided Developmental Intervention for Infants With Very Low Birth Weight: A Randomized Clinical Trial. JAMA Network Open, v. 7, n. 7, p. e2421896–e2421896, 1 jul. 2024.
SOARES, A. C. C.; SILVA, K. DA; ZUANETTI, P. A. Variáveis de risco para o desenvolvimento da linguagem associadas à prematuridade. Audiology – Communication Research, v. 22, n. 0, p. 1–7, 2017.
SPITTLE, A. J. et al. Predicting motor development in very preterm infants at 12 months’ corrected age: The role of qualitative magnetic resonance imaging and general movements assessments. Pediatrics, v. 123, n. 2, p. 512–517, 2009.
SUIKKANEN, J. et al. Reaction times, learning, and executive functioning in adults born preterm. Pediatric research, v. 89, n. 1, p. 198–204, 1 jan. 2021.
SYNNES, A. et al. Determinants of developmental outcomes in a very preterm Canadian cohort. Archives of disease in childhood. Fetal and neonatal edition, v. 102, n. 3, p. F235–F234, maio 2017.
TAMPLAIN, P. et al. Assessment of motor development in childhood: Contemporary issues, considerations, and future directions. Journal of Motor Learning and Development, v. 8, n. 2, p. 391–409, 2020.
TAU, G. Z.; PETERSON, B. S. Normal development of brain circuits. Neuropsychopharmacology, v. 35, n. 1, p. 147–168, 2010.
TUSOR, N. et al. Brain Development in Preterm Infants Assessed Using Advanced MRI Techniques. Clin. Perinatol., v. 41, n. 1, p. 25–45, 2014.
VALENTINI, N. C. et al. Motor trajectories of preterm and full‐term infants in the first year of life. Pediatrics International, p. 967–977, 2019.
VALENTINI, N. C. et al. Early Detection of Cognitive, Language, and Motor Delays for Low-Income Preterm Infants: A Brazilian Cohort Longitudinal Study on Infant Neurodevelopment and Maternal Practice . Frontiers in Psychology, 2021.
VALENTINI, N. C.; SACCANI, R. Escala Motora Infantil de Alberta: Validação para uma população gaúcha. Rev. Paul. Pediatr., v. 29, n. 2, p. 231–238, 2011.
VALIZADEH, L. et al. Effect of Early Physical Activity Programs on Motor Performance and Neuromuscular Development in Infants Born Preterm: A Randomized Clinical Trial. J. Caring Sci., v. 6, n. 1, p. 67–79, 2017.
VAN BAAR, A. L. et al. Very preterm birth is associated with disabilities in multiple developmental domains. J. Pediatr. Psychol., v. 30, n. 3, p. 247–255, 2005.
VANDERVEEN, J. A. et al. Early interventions involving parents to improve neurodevelopmental outcomes of premature infants: A meta-analysis. J. Perinatol., v. 29, n. 5, p. 343–351, 2009.
VANES, L. et al. Longitudinal neonatal brain development and socio-demographic correlates of infant outcomes following preterm birth. Developmental Cognitive Neuroscience, v. 61, p. 101250, 1 jun. 2023.
WHITE-TRAUT, R. C. et al. Relationship between mother-infant mutual dyadic responsiveness and premature infant development as measured by the Bayley III at 6 weeks corrected age. Early Human Development, v. 121, n. October 2017, p. 21–26, 2018.
WORLD HEALTH ORGANIZATION. Survive & thrive. [s.l: s.n.]. v. 29
YAARI, M. et al. Early developmental trajectories of preterm infants. Research in Developmental Disabilities, v. 81, p. 12–23, 2018.
ZAGO, J. T. DE C. et al. Associação entre o desenvolvimento neuropsicomotor e fatores de risco biológico e ambientais em crianças na primeira infância. Revista CEFAC, v. 19, n. 3, p. 320–329, jun. 2017.
ZAJONZ, R.; MÜLLER, A. B.; VALENTINI, N. C. a Influência De Fatores Ambientais No Desempenho Motor E Social De Crianças Da Periferia De Porto Alegre. Revista da Educação Física/UEM, v. 19, n. 2, p. 159–171, 2008.
ZOGHI, A. et al. The Impact of Home Motor Affordances on Motor, Cognitive and Social Development of Young Children. Iranian Journal of Child Neurology, v. 13, n. 2, p. 61, 1 mar. 2019.
1Fisioterapeuta e Mestra em Ciências do Movimento Humano na Escola Superior de Educação Física, Fisioterapia e Dança (ESEFID) da Universidade Federal do Rio Grande do Sul
2Ph.D. Health and Human Performance. Professora titular da Escola de Educação Física da Universidade Federal do Rio Grande do Sul
