HONEY FROM TIÚBA BEES (MELIPONA FASCICULATA) FROM PARÁ: A PHYSICOCHEMICAL AND COMPARATIVE STUDY
REGISTRO DOI: 10.69849/revistaft/fa10202502082357
Marcos Vinicios Pompeu Amaro1, Gilberto Nascimento do Vale2, Matheus Ramon Blanco Camarão3, Márcio Henrique Santos Souza4, Alfredo Gabryell Bastos de Abreu5, Ernani de Sousa Lobato Junior6, Ewerton Carvalho de Souza7, Antonio dos Santos Silva8
RESUMO
O Estado do Pará apresenta grande diversidade de flora e fauna, apresentando diversas espécies de abelhas nativas sem ferrão, em especial a abelha Melipona fasciculata, conhecida como Tiúba ou uruçu cinzenta, produtora de mel muito apreciado na região amazônica. O presente estudo teve como foco a caracterização físico-química de amostras de mel da referida espécie, provenientes de dois municípios paraenses e a distinção das amostras conforme sua localidade de origem. Foram empregados métodos físico-químicos já estabelecidos na literatura da área e análise multivariada para a discriminação pretendida. Os resultados demonstraram que as amostras eram de boa qualidade, havendo alguns parâmetros que demonstraram dependência com a localidade de produção, e foi possível discriminar as amostras de acordo com a origem das amostras.
Palavras-chave: Controle Químico. Meliponicultura. Produto de Origem Animal.
SUMMARY
The State of Pará has a great diversity of flora and fauna, featuring several species of native stingless bees, especially the Melipona fasciculata bee, known as Tiúba or gray uruçu, which produces honey that is highly appreciated in the Amazon region. The present study focused on the physical-chemical characterization of honey samples of this species, from two municipalities in Pará and the distinction of the samples according to their location of origin. Physicochemical methods already established in the literature and multivariate analysis were used for the intended discrimination. The results demonstrated that the samples were of good quality, with some parameters that demonstrated dependence on the location of production, and it was possible to discriminate the samples according to the origin of the samples.
Keywords: Chemical Control. Meliponiculture. Product of Animal Origin.
1. INTRODUÇÃO
O mel consiste em um produto natural, de natureza líquida e de origem animal, sendo viscoso, aromático e doce, que é produzido pelas abelhas melíferas tendo como base o néctar coletado nas flores das plantas, que sofre maturação nas colmeias, apresentando uma composição variável conforme a espécie de abelha, sua origem floral, flutuações do teor de néctar, de condições geográficas (solo, clima, altitude, etc.) e climáticas, além da gestão dos apicultores ou dos meliponicultores, o que afeta seu flavor, cor e aroma (Freitas et al., 2022), podendo ser obtido a partir do néctar das flores (mel floral), de secreções de partes vivas das plantas ou de excreções de insetos sugadores de partes vivas das plantas, quando é, então, denominado de “mel de melato” (Campos; Modesta, 2000).
Rybak-Chmielewska (2004) relatam que a abelha produz o mel com base em transformações e adições de compostos específicos, fazem a desidratação, deposição e armazenamento do favo de mel, objetivando estimular o seu amadurecimento, e, desta forma, o mel passa a ser um produto extremamente concentrado em açúcares, com destaque para a D-glicose e D-frutose.
O mel é um alimento de grande valor nutritivo, além de ser fonte de recursos terapêuticos e cosméticos graças a sua composição complexa que engloba diversas vitaminas, compostos fenólicos, sais minerais, carboidratos, flavonoides e outras substâncias que lhe atribui propriedades biológicas importantes, tais como atividade antimicrobiana, anti-inflamatória e antioxidante (Freitas et al., 2022), sendo um produto único, dotado de inúmeras propriedades terapêuticas, que é utilizado pela medicina popular sob diversas formas e associações como fitoterápicos (Pereira et al., 2003).
O conhecimento do potencial fitoterápico do mel é antigo e através dos séculos as suas propriedades cicatrizantes foram sendo descobertas, em muitos casos relatou-se a capacidade de reduzir as infecções de feridas (Escobar; Xavier, 2013).
Segundo Ananias (2010), o Brasil apresenta uma variabilidade climática que permite a produção do mel ao longo do ano todo, sendo que a diferença entre os locais, os tipos de clima e floradas contribuem para tornar o mel um produto diversificado e com diversas texturas, aromas, gostos e cores.
As abelhas nativas sem ferrão, ou meliponídeos, pertencem à subfamília Meliponinae (Hymenoptera, Apidae), e são assim denominadas por apresentarem o ferrão atrofiado. Tais abelhas são animais sociais, dóceis, de fácil manejo e necessitam de pouco investimento para a sua criação, sendo de ampla distribuição geográfica no Brasil, referindo-se a mais de 400 espécies, distribuídas em 27 gêneros de invertebrados (SILVA et al., 2016). Dentre dessas espécies, há a Tiúba ou uruçu-cinzenta (Melipona fasciculata) que é uma espécie polinizadora brasileira de ecossistemas naturais que ocorrem em regiões de transição entre a floresta amazônica, o Cerrado e a Caatinga, produtora de um mel que chega a custar até mais do que o dobro do valor do mel de Apis mellífera (Fernandez; Rosa; Conti-Silva, 2018).
Venturieri, Rodrigues e Pereira (2005) constataram que a polinização de açaizeiros (Euterpe oleracea Mart) no estado do Pará é feita por diversos insetos, entre eles se destacando as abelhas de diversos gêneros como a. mellífera e a M. fasciculata. Tais insetos se mostram de suma importância para a reprodução do açaizeiro, que floresce principalmente entre fevereiro e maio, época de pouca oferta de pólen e néctar.
Pelo exposto, fica claro a importância de estudos físico-químicos de mel de Tiúba ou uruçu-cinzenta de maneira a contribuir com o conhecimento sobre esse produto e auxiliar no seu controle de qualidade. Sendo assim, o presente trabalho teve a intenção de trazer os resultados alcançados para méis da espécie Melipona fasciculata coletados e produzidos por apicultores de dois municípios do Nordeste do Pará, tanto do ponto de vista físico-químico, quanto por métodos estatísticos multivariados, buscando discriminar as amostras de acordo com a sua localidade geográfica.
2. REVISÃO DA LITERATURA
2.1 O Mel
Conforme a IN n° 11 de 2000 do MAPA, o mel de abelha pode ser legalmente definido como sendo “o produto alimentício produzido pelas abelhas melíferas, a partir do néctar das flores ou das secreções procedentes de partes vivas das plantas ou de excreções de insetos sugadores de plantas que ficam sobre partes vivas de plantas, que as abelhas recolhem, transformam, combinam com substâncias específicas próprias, armazenam e deixam madurar nos favos da colmeia” (Brasil, 2000).
Por sua vez, o mel de abelhas sem ferrão pode ser definido como sendo o “mel de abelha social sem ferrão, o produto alimentício produzido por essas abelhas a partir do néctar das flores ou das secreções procedentes de partes vivas de plantas ou de excreções de insetos sugadores que ficam sobre partes vivas de plantas, que as abelhas recolhem, transformam, combinam com substâncias específicas próprias, armazenam e deixam maturar nos potes das colônias” (Bahia, 2014).
De acordo com Brasil (2023), quando se compara os meles das abelhas Apis mellífera com os meles das abelhas da tribo Meliponini, estes últimos apresentam aparência mais líquida, sabores mais ácidos e aromas diversificados, o que leva a não haver sentido em comparar esses distintos produtos na tentativa de estabelecer parâmetros únicos, cabendo a cada tipo ser abordado de maneira específica.
Técnicas analíticas são cada vez mais importantes para que haja um estabelecimento de parâmetros físico-químicos de cada um dos diversos tipos de mel existentes, de tal forma que se possam identificar possíveis adulterações do produto, e definir padrões de qualidade dos méis, de tal forma que eles se tornem mais competitivos em um mercado cada vez mais exigente (Oliveira; Medeiros; Moraes, 2017; Freitas et al., 2022).
Em se tratando do clima, a produção do mel é mais propícia em áreas que possuem estações muito bem definidas. Pois, após o período das chuvas a quantidade de flores vai ser maior. Além disso, é preciso haver controle da temperatura para não ocorrer grandes alterações tendo em vista a necessidade de manter o apiário entre 20º e 30° C (SEBRAE, 2019).
O mel é constituído essencialmente por diversos açúcares e outros componentes como ácidos orgânicos, enzimas, e partículas sólidas coletadas pelas abelhas, sendo que sua aparência oscila entre quase incolor a marrom escuro, podendo ser fluido, viscoso ou até mesmo sólido, além disso, seu sabor e aroma variam de acordo com a origem da planta (Silva, 2008). Ele também apresenta propriedades essenciais para a manutenção da saúde como o estímulo da atividade antioxidante no organismo e a capacidade de favorecer a proteção contra doenças do trato digestório, conferindo-lhe um aspecto mais abrangente, no qual, além de ser um produto feito para adoçar, é capaz também de auxiliar no tratamento de doenças (Silva et al., 2008).
Nos estudos realizados por Aroucha et al. (2008), o mel mostrou uma atividade anti-inflamatória, analgésica, sedativa e expectorante do mel, sendo que umas das substâncias que contribui para isso é a presença do H2O2, que causaria danos às células bacterianas (Brudzynski, 2011). Além disso, de acordo com Da Silva (2013), os compostos fenólicos nele presentes também colaboram para promover a ação antioxidante.
2.2 Mel e o Ser Humano
O mel é um dos alimentos mais antigos ligado à história humana e que sempre atraiu a atenção do homem, especialmente pelas características adoçantes. Mas, sua utilização vai além do uso como alimento, também como medicamento, devido às suas propriedades antissépticas, como conservante de frutas e grãos, e até mesmo como oferenda aos deuses (Silva, 2008).
De acordo com Santos (2015), o momento exato da história no qual o ser humano percebeu a possibilidade de usar o mel como alimento é desconhecido, contudo, é possível afirmar que já se tinha conhecimento dele ainda nos momentos iniciais do processo de manuseio das primeiras ferramentas. Posteriormente, durante o Egito antigo, a prática da apicultura tornou-se um serviço bastante comum e o mel era um alimento muito apreciado pelo faraó. O mel era o medicamento mais popular, participando de 500 dos 900 remédios da época, com registros decifrados, além de ser a primeira fonte de açúcar utilizada pelo homem, era símbolo de fartura (Couto; Couto, 2002).
Os índios da tribo Kaiapó já detinham conhecimentos sobre as flores fornecedoras de néctar de qualidade, que eram coletadas pelas abelhas sem ferrão e tal tribo conhecia 34 espécies distintas de abelhas sem ferrão que eles criavam e faziam uso de seus méis e cerumes para fins medicinais e cerimoniais religiosos, além de as usarem como polinizadores naturais e conhecerem bem seus hábitos (Carvalho et al., 2005; Contopassi-Laurino et al., 2006).
A apicultura brasileira, como atividade empresarial, é bastante recente, tendo sido introduzida pelos imigrantes europeus, com uma evolução lenta e, até a década de 1950, o Brasil produzia somente cerca de 4 mil toneladas/ano, que era voltada apenas para o consumo interno, mas a partir de 1956 foram introduzidas no Brasil as abelhas africanas, trazidas pelo geneticista Warwick Estevam Kerr, quando ocorreu, acidentalmente, o cruzamento natural com as abelhas europeias anteriormente trazidas pelos imigrantes, gerando um híbrido, mais resistente às doenças e com maior capacidade produtiva, sendo que tais “abelhas africanizadas”, como passaram a ser denominadas, são atualmente 90 % das abelhas existentes no país e houve, então, um grande salto produtivo de mel (De Paula, 2008).
2.3 A Espécie Tiúba ou Uruçu Cinzenta
A espécie Melípona fasciculata (urucu cinzenta) (Figura 1) ocorre na região nordeste da Amazônia, nos estados do Pará; Tocantins, Maranhão e Piauí, sendo relativamente rara em áreas de terra firme, porém muito comum nas regiões de mangue, onde ainda há bastantes árvores com ocos suficientemente grandes para abrigar suas famílias, sendo que a siriúba ou mangue seriva (Avicennnia nítida, Avicenniaceae) é uma das espécies arbóreas que costuma acolher ninhos de M. fasciculata (Venturieri; Raiol; Pereira, 2003; Garmes, 2017).
Figura 1. Fotografia de uma abelha Tiúba (M. fasciculata) em flor de açaizeiro

Fonte: Garmes (2017)
Esta espécie produz mel de excelente qualidade e em boa quantidade, que, no nordeste amazônico, se origina principalmente de floradas das espécies botânicas: caju (Anacardium occidentale, Anacardiaceae), caju-açu (A. giganteum, Anacardiaceae), siriúba (Avicennia nítida, Avicenniaceae), sapateira (Miconia minutiflora, Melastomataceae) e lacre (Vismia guianensis, Clusiaceae) que apresentam período de floração coincidente com a época de menores índices pluviométricos da região (julho a dezembro), com maior produção melífera entre setembro e novembro, sendo o mel armazenado em potes constituídos quase que exclusivamente de cera (Venturieri; Raiol; Pereira, 2003).
O mel da abelha nativa Tiúba “oferece um gosto ácido e menor teor de açúcar é um produto muito apreciado no mercado local e regional e recebe uma atenção ainda maior por não ser produzido em grande escala”, destaca Garmes (2017).
3. METODOLOGIA
3.1 Aquisição das Amostras
Foram obtidas 10 amostras, sendo cinco provenientes de cada uma das 2 localidades/municípios do Nordeste do Pará. Elas foram coletadas em apiários e/ou cooperativas de apicultores e foram transportadas ao Laboratório de Física Aplicada à Farmácia (LAFFA), da UFPA, sendo mantidas em temperatura ambiente e no seu próprio recipiente, sob o abrigo da luz direta. As dez amostras de mel de Melipona fasciculata são oriundas dos seguintes municípios: Tracuateua (comunidade de Flecheira), denominadas de amostras A1 a A5; Capitão Poço (comunidade Santa Luzia), denominadas de amostras B1 a B5. Ambos os municípios pertencem a região do Nordeste paraense.
3.2 Análises Físico-Químicas das Amostras de Mel
As doze análises físico-químicas realizadas seguiram metodologias oficiais já estabelecidas na literatura da área (AOAC, 2000; BRASIL, 2000; ADOLFO LUTZ, 2008).
A determinação de umidade, de sólidos solúveis totais (SST) e densidade do mel foram realizadas utilizando o método refratométrico, tendo sido utilizado um refratômetro portátil da marca INSTRUTHERM, modelo ART-90, específico para méis e similares, para onde foram transferidas 3 gotas de cada uma das amostras para sobre o prisma do aparelho, e realizada a leitura em cada uma das três escalas internas ao aparelho. A umidade foi lida em escala que varia de 12 a 27 %, com intervalo de 1 %; o teor de SST na escala entre 58º Brix a 90º Brix, em intervalos de 0,5º Brix; e a densidade na escala em graus Baumé, sendo que a conversão de graus Baumé para densidade, ocorreu por meio da equação (1), em que d é a densidade e ºBe é o valor de graus Baumé lido diretamente no refratômetro. A cada leitura, o prisma foi limpo com água destilada e seco com papel toalha.
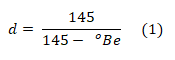
Para a determinação da condutividade elétrica (CE) e do pH, foram pesados 5,0 g de mel em um Erlenmeyer de 125 mL e depois a alíquota foi diluída com 75 mL de água destilada. A solução formada foi homogeneizada se agitando o sistema por 30 minutos e, em seguida, realizada a leitura através da introdução do eletrodo de um condutivímetro portátil modelo AKSO, AK51, previamente calibrado com solução de 143 µS/cm, sendo o valor encontrado lido de forma direta no visor do aparelho, e de um pHmetro de bancada da marca GONDO, modelo PP-206K, previamente calibrando em dois pontos com soluções padrão de pH 4,00 e pH 7,00, e os valores de pH obtidos diretamente no display do aparelho.
A viscosidade foi determinada através do emprego de viscosímetros manuais do tipo Copos Ford (número 4 e 5), da marca NALGON. O Copo Ford foi preenchido com a amostra de mel, estando tapado o orifício, enchido até o nível máximo, e nivelado com uma espátula para retirar o excesso de produto. O orifício foi liberado e o cronômetro acionado no mesmo instante. A partir da primeira interrupção do fluxo, o cronômetro foi parado e anotado o tempo de escoamento, em segundos. Ao final da leitura de cada amostra foi realizado lavagem do viscosímetro para o início de novo procedimento. O tempo de escoamento foi transformado para viscosidade através das equações (2) e (3) para os Copos Ford tipo 4 e 5, respectivamente, fornecida pelo fabricante dos aparelhos, em que v é a viscosidade (em cSt) e t é o tempo de escoamento medido em segundos (s). O emprego de mais de um aparelho foi necessário porque há um tempo mínimo, de 20 s, para se empregar determinado copo Ford, o que depende da viscosidade do mel.
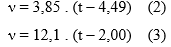
A determinação de sólidos insolúveis totais (SIT) foi realizada através da metodologia gravimétrica. Papeis de filtro foram previamente secos a 105º C por 3 h e resfriados em dessecador até temperatura ambiente, sendo, então, suas massas aferidas. Foram pesados 2,0 g de amostra em béquer de 100 mL, e a esta massa foi adicionado uma quantidade inespecífica de água destilada aquecida a 80º C, que seria necessária para dissolver o mel. Em seguida, a solução foi filtrada em papel de filtro qualitativo, postas em funil de polietileno e em provetas. O papel de filtro e o béquer foram lavados sucessivas vezes até a ausência de açúcares. Após a filtração e lavagem do papel de filtro, estes foram secos a 105º C por 6 h e resfriados em dessecador até temperatura ambiente e depois pesados em balança analítica. O teor de SIT foi determinado através da equação (4), em que mf é a massa do papel filtro após a filtração; ms é a massa do papel filtro seco; e ma é massa total da amostra.
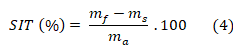
A determinação de turbidez utilizou um turbidímetro digital da marca POLICONTROL, modelo T 1000 WT, com faixa de trabalho de 0 a 1000 Unidades de Turbidez Nefelométrica (NTU). O procedimento para a determinação ocorreu através do preparo de uma solução do mel a ser analisado. Assim, com o auxílio de um béquer e balança analítica foram pesados 2,00 g de amostra, adicionados 100 mL de água destilada e homogeneizada. A solução formada foi transferida cuidadosamente para as cubetas até o nível marcado e os valores de turbidez lidos diretamente no display do aparelho. A acidez foi determinada através do método titulométrico, empregando a volumetria de neutralização. Foi pesado 5,00 g de amostra e diluído com 75 mL de água destilada. A solução resultante foi titulada com uma solução padronizada 0,01 mol L-1 de NaOH, empregando como indicador a fenolftaleína a 1%. O ponto de viragem da titulação foi apontado pelo aparecimento de coloração rosa na solução e anotado o volume de NaOH gasto na bureta. A acidez foi determinada pela equação (5), em que V é o valor em mL de solução de NaOH 0,01mol L-1 gasto na titulação; F é o fator de correção da solução de NaOH 0,01mol L-1; N é a concentração de NaOH e A é a massa da amostra
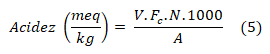
Para a determinação de cor de mel se utilizou um espectrofotômetro UV-Vis, operando em comprimento de onda de 560 nm, com cubetas de volume igual a 4,5 mL e 1 cm de caminho óptico, além de se usar glicerina pura como referência. Através da leitura direta do visor do equipamento, a absorbância foi registrada e posteriormente transformada para mm de Pfund, de acordo com a Tabela 1.

Para a determinação de cinzas totais (CT), foram pesados 2,0 g de mel em cadinhos de porcelana de 75 mL, de forma alta, que foi antecipadamente seco em estufa a 105º C por 24 h. Logo após, foi processado a incineração do conjunto de cadinho mais mel, onde foi colocado em forno mufla a 450ºC até as amostras serem convertidas a cinzas brancas, que foi esfriada em dessecador até a temperatura ambiente, e pesadas. O teor de cinzas foi determinado através da equação (6), onde mf é a massa após a incineração; mc é a massa do cadinho; e mi é a massa inicial do mel.
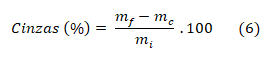
A determinação dos açúcares redutores (AR) se deu pelo método de Lane-Eynon, com a utilização do reagente de Fehling, cujo fundamento se dá pelo de que os sais cúpricos, em solução de tartarato de potássio ou sal de Rochelle (solução de Fehling), sofrem redução sob altas temperaturas, por aldoses ou cetoses, sendo transformados em sais cuprosos que são vermelhos, e se precipitam perdendo a cor azul inicial (Figura 2). Quando o tartarato se liga ao cobre forma um complexo solúvel, evitando a formação do hidróxido cúprico insolúvel que teria lugar se a solução alcalina apresenta-se cobre livre (Tavares et al., 2010).
Figura 2. Reação do complexo cúprico com AR formando precipitado de óxido cuproso
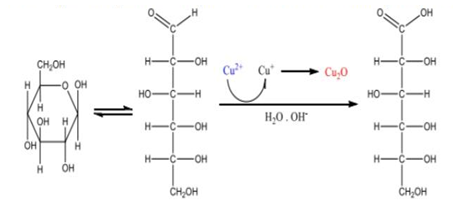
Fonte: Freitas et al. (2020)
Para determinar os teores de AR das amostras deste trabalho, foi preparado, para cada uma das amostras, uma solução de mel a 20 % (m/v) em um balão volumétrico de 100,0 mL e desta se retirou uma alíquota de 10,0 mL e transferido para outro balão volumétrico de 100,0 mL, completado o volume com água destilada e transferido a solução para uma bureta de 25,0 mL. Foi medido, com uma pipeta volumétrica, 5 mL de cada uma das soluções de Fehling A e B para Erlenmeyer de 250,0 mL e adicionado 20,0 mL de água destilada, e aquecida até a ebulição. Mantendo a ebulição, foi adicionado uma a duas gotas de solução de azul de metileno a 1% e titulada até a descoloração do indicador, obedecendo o tempo da titulação de até 3 minutos. Os resultados foram encontrados utilizando a equação (7), onde T é o título da solução de Fehling; V é o volume em mL de amostra gasta na titulação; e m é a massa da amostra, expresso em gramas.
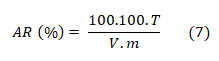
3.3 Análises Estatísticas Realizadas
A análise descritiva básica para cada uma das doze variáveis estudadas foi executada no programa Excel 2010 e seus resultados expressos em termos de médias e seus respectivos desvios padrões. Testes de t de Student, para dados não pareados, foram conduzidos via programa MINITAB 18 em cada variável para investigar a diferença entre as amostras de acordo com sua origem. As análises estatísticas multivariadas foram executadas no programa MINITAB 18, sendo que a análise de componentes principais (ACP) foi conduzida com dados padronizados e a análise hierárquica de agrupamentos (AHA) foi realizada se considerando distâncias euclidianas e ligações simples e resultados expressos em termos de similaridade entre as amostras, em um dendrograma. O nível de 95 % de significância foi considerado em todo o tratamento estatístico.
4. RESULTADOS E DISCUSSÕES
Os resultados obtidos para as doze variáveis físico-químicas estão dados nas Tabelas 2 e 3
Tabela 2. Resultados de CE, pH, viscosidade, SIT, SST e densidade encontrados para as amostras de mel Melipona fasciculata do Nordeste do Pará
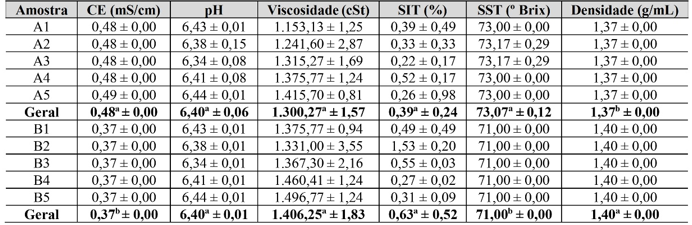
Legenda: Amostras de A1 a A5 são méis provenientes do município de Tracuateua e as amostras B1 a B5 são provenientes de Capitão Poço. CE = condutividade elétrica; SIT = sólidos insolúveis totais; SST=sólidos solúveis totais. Letras iguais sobre as médias das duas localidades em relação às mesmas variáveis significa não haver diferença significativa de acordo com teste t de Student para dados não pareados, a um nível de 95 % de significância.
Tabela 3. Resultados de umidade, turbidez, cor, acidez, AR e cinzas encontrados para as amostras de mel Melipona fasciculata do Nordeste do Pará.
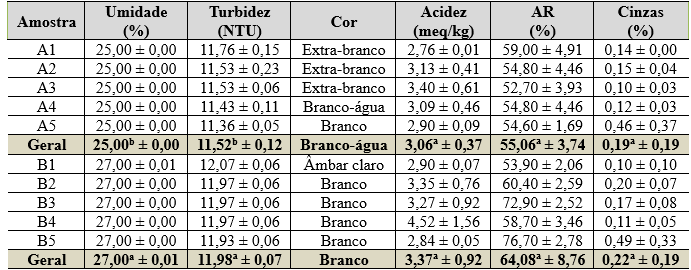
Legenda: Amostras de A1 a A5 são méis provenientes do município de Tracuateua e as amostras B1 a B5 são provenientes de Capitão Poço. AR = açúcares redutores. Letras iguais sobre as médias das duas localidades em relação a mesmas variável significa não haver diferença significativa de acordo com teste t de Student para dados não pareados, a um nível de 95 % de significância.
A CE média dos méis foi de 0,48 mS/cm (Tracuateua) e de 0,37 mS/cm (Capitão Poço), havendo diferenças significativas entre elas, conforme a localidade de origem. Esses resultados são superiores aos encontrados por Silva (2010), que foram entre 0,14 mS/cm e 0,35 mS/cm para méis de Apis mellífera, também do Nordeste do Pará. Porém estão dentro da faixa entre 0,288 mS/cm e 0,725 mS/cm obtida por dos Santos, Angulo e dos Santos (2021), em méis de Melípona seminigra merrillae, conhecida popularmente como Uruçu-Boca-de Renda, provenientes do município de Rio Branco, no Acre. Na legislação Brasileira não há limites estipulados para essa propriedade do mel, todavia, na legislação internacional há adoção da faixa entre 0,20 e 0,80 mS/cm como aceitável para a CE de méis, estando os valores encontrados no presente trabalho totalmente dentro do intervalo mínimo e máximo (CAC, 1990). De acordo com Gois et al. (2013), a CE apresenta substancial importância por fornecer informações se o mel pode ou não ser estocado durante o inverno ou ser refrigerado, pois fazem com que alguns constituintes sejam impróprios para as abelhas em período com temperaturas negativas. A CE sofre influência dos açúcares e do teor de cinzas, sendo também um bom critério para a identificação da origem floral do mel, pois méis com diferentes origens florais apresentam resultados diferentes, e, geralmente méis de melato apresentam valores de CE elevada, enquanto méis monoflorais apresentam valores inferiores (Santos; Angulo; Santos, 2021). A comunidade de Flecheira, no município de Tracuateua, se situa as proximidades da costa atlântica do Estado do Pará, ao passo que a comunidade de Santa Luzia, em capitão Poço, se encontra distante da costa atlântica, o que pode interferir na CE, uma vez que a salinidade do mar pode chegar até ao néctar das flores em Tracuateua.
Em termos de pH, os valores médios encontrados foram de 6,40 para os méis de ambas as localidades. Esses resultados sugerem que a localidade geográfica pode não ser indicativa de alteração desta propriedade. Os resultados médios obtidos estão bem superiores aos encontrados por Santos, Angulo e Santos (2021), em méis florais de Melípona seminigra merrillae, provenientes do município de Rio Branco, no Acre, que variou entre 3,05 e 4,02, e aos resultados de Castro et al. (2022), que obtiveram um pH médio de 3,4 para méis de Melipona (Michmelia) paraensis Ducke oriundos de Mojuí dos Campos, no Estado do Pará. Os resultados de pH do presente estudo são também superiores a valores de pH obtidos em estudos de mel de Apis mellífera, tais como os encontrados por Menezes, Mattietto e Lourenço (2018), que obtiveram uma média de 3,46; os de q De Moura Júnior et al. (2021) que encontraram um valor igual a 3,12; e os de Abadio Finco, Souza e Silva (2010) que encontraram pH médio igual a 3,7 (pH mínimo = 3,4 e pH máximo = 4,2). A legislação brasileira também não possui valores definidos para essa propriedade físico-química, mas esta caracterização é importante, pois ela avalia a qualidade dos méis tanto do ponto de vista fermentativo, quanto ao processo de adulteração (Welke et al., 2008). Há de ser ressaltado que tal parâmetro é fundamental para a atividade antimicrobiana e antifúngica, de forma que o baixo pH pode deixar o mel suscetível ao crescimento de fungos (Gois et al., 2013), sendo que as amostras de Capitão Poço foram as mais suscetíveis a essa ação. Santos, Angulo e Santos (2021) destacam ainda que o pH sofre a influência da origem botânica do mel, sendo geralmente inferior a 4,0 para o mel de origem floral e superior a 4,5 para o mel de melato. Desta forma os méis de ambas as localidades devem ser méis de melato.
Os resultados obtidos para a viscosidade dos méis foram: 1.300,27 cSt (Tracuateua) e 1.406, 25 cSt (Capitão Poço), sendo esses valores significativamente iguais entre si. Santos, Angulo e Santos (2021) obtiveram uma variação de viscosidade para amostras de mel de abelha da espécie Melípona seminigra merrillae de 245 cSt a 1.249 cSt, sendo que o maior valor se aproximou do encontrado para as amostras. Além do mais, Sodré et al. (2007) encontraram viscosidade mínima para méis A. mellífera de 1.130 cSt e máximos de 2.080 cSt, valores estes dentro da faixa para as maiorias das amostras pesquisadas. As propriedades reológicas dos méis são dependentes de vários fatores, como: conteúdo de água, temperatura, composição, proteínas, açúcares, proteínas, entre outros. Além do mais, a viscosidade é uma das propriedades mais importantes do mel, por afetar os aspectos sensoriais do alimento e de processamento deste. Portanto, dentro do processo de controle de qualidade, a determinação deste parâmetro pode ser essencial para linhas de produção, planejamento de equipamentos e processos (Parpellim, 2016; Queiroz et al., 2007; Yanniotis, Skaltsi, Karaburnioti, 2006). Dado a sua importância, a legislação nacional e internacional carece de valores específicos para essa propriedade.
As médias obtidas para a análise de SIT foram de 0,39 % (Tracuateua) e 0,63 % (Capitão Poço), sendo esses valores significativamente distintos entre si. A legislação nacional estabelece um limite máximo de SIT de 0,1 % (Brasil, 2000). Desta forma, todos os méis analisados extrapolaram tal limite, e transgrediram o que determina a IN de nº 11 de 2000, que determina que as análises macro e microscópicas devem estar livres de insetos, larvas, cera, areia, entre outros. Porém, isso ocorreu também em estudo de mel feito por Silva (2010), que encontrou 25 % de suas amostras com valores superiores ao máximo estabelecido na legislação. Dias et al. (2009) descobriu diferentes porcentagens de SIT para seis amostras de mel, que apresentaram intervalos de 0,04 % a 0,32 %. Os estudos de Castro et al. (2022), com mel de Melipona (Michmelia) paraensis Ducke, obtiveram um SIT médio de 0,76, valor esse superior aos encontrados no presente estudo. Castro et al. (2022) sugerem que a causa de um valor elevado de SIT em mel pode se dever a extrações inadequadas do mel, ou ele não ter passado por filtração, condições de processamento comuns ao aproveitamento artesanal desse tipo de mel e que reflete no aumento do teor SIT. A presença de quantidade considerável de SIT pode estar atrelada a vários fatores: quantidade significativa de matéria terrosa, partes de inseto (inclusive resíduos das próprias abelhas), não decantação e/ou filtração no final do processo de retirada do mel, alterando a pureza do mel (Dias et al., 2009).
Os valores médios encontrados para os méis de Tracuateua foi o mais elevado em termos de SST (73,07º Brix), seguido dos méis de Capitão Poço (71,00º Brix). Não existe limite legal para essa propriedade do mel de Melipona fasciculata, haja vista que inexiste na legislação brasileira valores máximos ou mínimos para tal propriedade. Lacerda et al. (2010) encontraram resultados para SST que variaram de 77,00º Brix a 83,30º Brix para méis do Sudoeste da Bahia. Méis de Apis mellífera produzidos no sertão Paraibano tiveram valores de SST que variaram de 61,7º Brix a 81,17º Brix e estão dentro da faixa dos obtidos para as seis amostras de municípios do Nordeste do Pará (Oliveira et al., 2013). Porém, foram totalmente contrários a aqueles analisados por Santos (2016) para amostras de méis de Apis da comunidade Solta no município de Carolina (MA), pois o autor encontrou SST mínimo de 78,2º Brix e máxima 82,3º Brix e média das dez amostras de 80,80º Brix, não sendo compatíveis com os resultados obtidos no presente trabalho. O teor de SST fornece informações a respeito dos sólidos que estão dissolvidos em água, expresso em gramas, e está intrinsecamente relacionado à quantidade de açúcares no mel, sendo em grande quantidade neste alimento (Gois et al., 2015).
Os resultados médios para densidade do mel foram de 1,37 g/mL (Tracuateua) e 1,40 g/mL (Capitão Poço), sendo significativamente diferentes entre si, o que sugere uma variação da densidade de acordo com a localidade de coleta do mel. A legislação nacional e a internacional carecem de limites para essa propriedade física dos méis de abelha. No entanto, Silva (2010) teve resultados de densidade mínimos de 1,376 g/mL e máximos de 1,415 g/ mL, com uma média de 1,405 g/mL, onde todos os valores estiveram concatenados com o do presente estudo. Bendini e Souza (2008) também estiveram alinhados com os valores das densidades dos méis de todos os municípios, onde dispuseram de uma média de 1,41 g/mL e intervalos de 1,34 g/mL a 1,44 g/mL para a região do Nordeste do Brasil. Por outro lado, Silva et al. (2018) alcançaram valores de 1,41 g/mL a 1,49 g/mL para méis comercializados em feiras livres do município de Assis de Chateaubriand, Paraná, sendo então, todas as amostras divergentes com os resultados encontrados.
Os valores médios encontrados para umidade dos méis foram de: 25,00 % (Tracuateua) e 27,00 % (Capitão Poço), sendo esses valores significativamente distintos entre si, sugerindo uma variação de umidade de acordo com o local de coleta. A legislação brasileira (Brasil, 2000) define o limite máximo de umidade para méis de 20 %, porém essa legislação trata de mel de Apis mellífera, e não de méis de Meliponas, que, em diversos estudos apontam uma divergência muito grande de teores de umidade de mel de Meliponas em comparação ao de Apis mellífera. Porém, as amostras estiveram próximas dos valores pesquisados por Silva (2011) em mel de abelhas jandaíra (Meilipona subnitida D) com resultados que variaram de 22,3 % a 24,4 %. Noronha (1997) estabeleceu que os méis de Apis com valores de umidade acima de 18 % ficam suscetíveis a fermentação por ação de bactérias e leveduras, podendo comprometer a qualidade do produto e sua estabilidade. É importante ressaltar que em região costeira, como Tracuateua, o teor de umidade pode ser acima do especificado por conta da propriedade de higroscopicidade do mel.
As médias de turbidez encontradas foram de 11,52 UNT (Tracuateua) e 11,98 UNT (Capitão Poço), que são significativamente diferentes. A legislação não estabelece os limites definidos de turbidez para méis de Melipona fasciculata, porém, para Huidobro e Simal (1984) é um parâmetro para o seu controle de qualidade, haja vista que está relacionada à quantidade de matéria em suspensão, que pode corresponder a outras partes que não seja o mel. Tal característica, fornece valores quantitativos de substâncias em função da turbidez das suspensões, na qual apresenta proporcionalidade ao efeito Tyndall. Okaneku et al. (2020) realizaram análises de turbidez em três amostras de méis de abelha A. mellifera adquiridas em uma feira livre do município de Manaus, em diferentes meses. Os resultados desses autores foram bem acima dos encontrados no presente trabalho.
As amostras de Tracuateua apresentaram uma coloração que as classifica como sendo “branco-água” e as de Capitão poço como sendo “branco”. Esses valores estão consonantes com a legislação brasileira (2000) que define a aceitabilidade do mel, enquanto os aspectos de cores, variações dentro do branco-água a âmbar escuro. As amostras de mel mais escuras apresentam maior atividade antioxidante por conta da maior presença de compostos fenólicos, sendo um alimento apropriado para uma alimentação saudável (Gomes, 2009). Alves et al. (2010) encontrou um perfil de cores obtidas em amostras de M. fasciculata entre 5 % de cor branco, 50 % de cor âmbar claro, 5 % de cor branco-água, e 35 % de cor extra-branco. Freitas et al. (2022) encontraram cores de méis de Apis da região da Ilha do Marajó que variaram do âmbar extra-claro ao âmbar-escuro que estão dentro do limite legal, contudo, divergentes para a amostras de Capitão Poço, mas concordantes com as de Tracuateua. Vale ressaltar, que pelo estudo do autor ser realizado com méis de Apis em região do Norte paraense, a diversidade botânica, fatores climáticos, armazenamento, minerais, temperatura do mel durante na colmeia, localização geográfica pode ser determinante para esta característica sensorial (Mantilla et al., 2012; Gois et al., 2013), ao comparar com as outras seis localidades do Nordeste Paraense. Durante o processo de extração do mel é importante cuidados durante a sua manipulação, tendo em vista que pode ocorrer contaminação, perpassando desde a escolha do recipiente para armazenagem, contato com resíduos, fuligem de fumaça, local inapropriado, entre outros (Mantilla et al., 2012).
Os valores médios para os teores de acidez foram de 3,06 meq/kg (Tracuateua) e 3,37 meq/kg (Capitão Poço), não havendo diferença significativa entre esses valores. Todas as amostras estão de acordo com o que determina a Instrução Normativa Nº 11 do Ministério da Agricultura, Pecuária e Abastecimento, que estabelece que a acidez máxima em méis deve ser de até 50 meq/kg (Brasil, 2000). Dessa forma, esses valores indicam a inexistência de fermentação nos méis, aprovando as amostras investigadas. Sodré et al. (2007) encontraram um valor mínimo de 10 meq/kg e máximo de 42 meq/kg para méis Apis do Ceará, enquanto Welke et al. (2008) obtiveram médias de 30,1 a 39,8 meq/kg, valores estes que estão bem acima para os resultados das duas localidades estudadas, mas ainda dentro do especificado pela legislação. Júnior et al. (2020) encontrou resultados mais próximos com o do presente estudo, que foram entre 1,68 meq/kg e 4,70 meq/kg.
As médias obtidas para os AR foram de 55,06 % (Tracuateua) e 64,08 % (Capitão Poço), não havendo diferenças significativas entre essas médias, bem como estão dentro do preconizado pela legislação brasileira (entre 55 % e 65 %) (Brasil, 2000). Em relação ao âmbito da legislação internacional, é estabelecido valor máximo de AR de 60 %, fazendo com as que as amostra de Capitão Poço estejam acima do limite estipulado (CAC, 2001). Caracterizando mel de M. fasciculata produzido na região do cerrado maranhense, Holanda et al. (2012) encontraram valor médio de AR de 60,68 %, estando próximas das amostras das duas localidades aqui estudadas. Dessa forma, é válido salientar que este parâmetro contribui na pressão osmótica de méis de abelha, contribuindo na sua conservação, haja vista que o açúcar em grande quantidade, cria um meio inóspito para o desenvolvimento de bactérias, algumas leveduras e mofos (Gava, 1984; Silva, 2006). Isso sugerem também que as amostras que estiveram abaixo do limite nacional, são suscetíveis a reprodução e ação desses microrganismos.
As amostras de Capitão Poço foram as que tiveram os maiores teores de CT (0,22 %), em comparação às amostras de Tracuateua (0,19 %). Por ser uma determinação intrinsecamente ligada à pureza, a legislação nacional determina como limite máximo para o teor de CT de mel de abelha o valor de 0,60 % (ou 0,6g/100g) (Brasil, 2000). Assim sendo, a maioria das amostras, estiveram concordantes com o limite legal estipulado, comprovando a pureza dos méis testados. As 10 amostras de méis M. fasciculata analisadas por Holanda et al. (2012) tiveram um teor de CT médio de 0,21 %, o que está dentro dos valores obtidos no presente estudo. O teor de CT também se relaciona com a quantidade de sais existentes nas amostras, pois esses não sofrem “queima” a 400º C, restando nas cinzas. Desta forma, é válida a discussão feita para o caso da CE, em termos de proximidades das localidades em relação ao Oceano Atlântico.
4.1 Resultados das Análises Estatísticas Multivariadas
A aplicação da técnica de ACP aos dados das cinco variáveis que mostram diferença significativa entre os grupos de amostras das 2 localidades (Tabelas 2 e 3) gerou o gráfico contido na Figura 3 que representa a relação entre as duas primeiras componentes principais geradas pela técnica empregada.
Figura 3. Gráfico das duas primeiras componentes principais
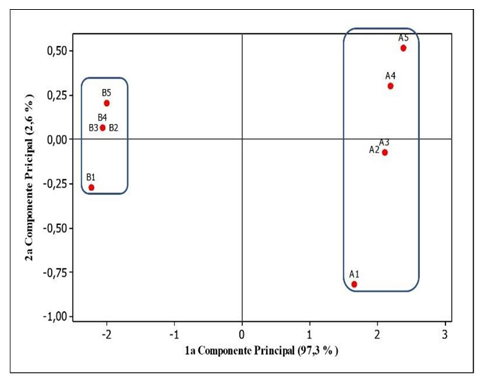
Legenda: Amostras de A1 a A5 são méis provenientes do município de Tracuateua e as amostras B1 a B5 são provenientes de Capitão Poço.
Analisando a Figura 3, se percebe de modo claro a formação de dois grupos de amostras, sendo um formado exclusivamente pelas amostras provenientes de Tracuateua (amostras A), localizado de modo disperso no lado direito do gráfico, nos 1º e 4º quadrantes, e um segundo grupo menos disperso, formado somente pelas amostras de Capitão Poço (amostras B), localizado à esquerda do gráfico, ocupando majoritariamente o 2º quadrante, com apenas uma única amostra no 3º quadrante (B1). Como as duas primeiras componentes principais juntas explicam 99,9 % (Figura 3) do modelo de separação, estas duas são suficientes para as análises, estando suas equações apresentadas no sistema de equações (8).

Através do sistema de equações (8) se percebe que para a formação da primeira componente principal ,todas as cinco variáveis contribuíram de forma homogênea, pois seus pesos, em módulo, são aproximados (entre 0,429 e 0,452), e, desta forma, contribuem equitativamente para a separação dos dois grupos de amostras ao longo de da 1ª CP. Ao passo que a formação da segunda componente principal foi devida basicamente por uma única variável, a turbidez das amostras (módulo do peso igual a 0,901), o que leva ao fato de ser praticamente tal variável responsável para dispersão das amostras ao longo do eixo y (segunda CP), sentida sobretudo no grupo das amostras de A, à direita do gráfico.
A aplicação da técnica de AHA aos dados das cinco variáveis que mostram diferença significativa entre os grupos de amostras das duas localidades (Tabelas 2 e 3), considerando a padronização dos dados, distâncias euclidianas e ligações completas entre amostras, gerou o dendrograma contido na Figura 4 que representa a relação de similaridade entre todas dez amostras investigadas.
Figura 4. Dendrograma para as amostras de mel estudadas
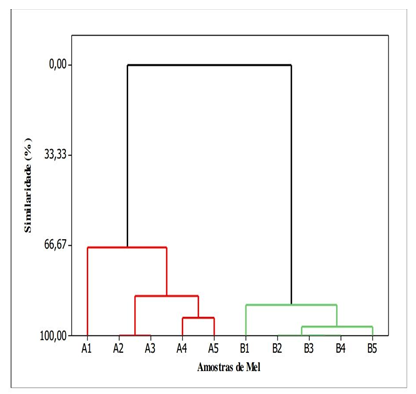
Legenda: Amostras de A1 a A5 são méis provenientes do município de Tracuateua e as amostras B1 a B5 são provenientes de Capitão Poço.
No dendrograma se observa que as amostras de Tracuateua (amostras A) e as amostras de Capitão Poço (amostras B), apresentam uma similaridade de 0 % entre si, ou seja, são, do ponto de vistas das cinco variáveis utilizadas na técnica, completamente diferentes. Também se percebe que as amostras A2 e A3 apresentam 100 % de similaridade, ou seja, são idênticas, o que explica a aparição de apenas quatro pontos na Figura 3 contidos no grupo das amostras de A. Já as amostras B2, B3 e B4 também apresentaram 100 % de semelhança entre si, explicando, por sua vez, a existência de apenas três pontos no grupo de amostras B da Figura 3.
Os resultados obtidos através das duas técnicas multivariadas são concordantes e evidenciam que o mel de abelha Tiúba dependem de sua origem geográfica, isto é, apresentam propriedades físico-químicas diferentes conforme sua origem e isso pode ser empregado para o controle de qualidade do produto, pois pode permitir distingui-los. Essa distinção encontrada também foi encontrada por de Moura Júnior et al. (2021) ao estudarem méis oriundos do nordeste paraense e da espécie Apis mellífera, encontrando uma discriminação das amostras em quatro grupos de acordo com os quatro municípios de origem do mel.
5. CONSIDERAÇÕES FINAIS
As amostras de mel de Tracuateua e de Capitão Poço, de maneira geral, se mostraram de boa qualidade, necessitando apenas de alguns cuidados quanto do ponto de vista de sua estocagem/armazenamento. De preferência que sejam guardadas refrigeradas, e ao abrigo da luz.
Algumas variáveis estudadas sugerem que as amostras de mel de Melipona fasciculata ou Tiúba, provenientes de Tracuateua e de Capitão Poço sejam méis de melato e não méis florais.
As diferenças encontradas em valores de condutividade elétrica entre as amostras provenientes de uma comunidade de Tracuateua, Flecheira, situada às proximidades da costa atlântica do Estado do Pará, e as amostras provenientes de Capitão Poço, da comunidade de Santa Luzia, que fica distante do litoral paraense, pode ser devida a influência da salinidade advinda das águas oceânicas que podem chegar aos néctares das flores em Tracuateua, o que não seria possível em Capitão Poço.
Os teores de cinzas encontrados também foram maiores nas amostras oriundas de Tracuateua, o que também pode estar vinculado a presença de mais sais provenientes do Oceano Atlântico, os quais não são incinerados na temperatura da mufla, permanecendo nas cinzas das amostras.
As variáveis estudadas, em conjunto com análises estatísticas multivariadas executadas permitem uma distinção clara e precisa dos méis de acordo com sua procedência geográfica, sendo possível se diferenciar as amostras de acordo com sua procedência geográfica.
REFERÊNCIAS
ADOLFO LUTZ. Métodos físico-químicos para análise de alimentos. 4ª ed. São Paulo, 2008.
ALVES, R. M. O. et al. Características físico-químicas de amostras de mel de Melipona mandacaia Smith (Hymenoptera: Apidae). Food Science and Technology, v. 25, p. 644-650, 2005.
ANANIAS, K. R. Avaliação das condições de produção e qualidade do mel de abelhas (Apis melliferas L.) produzida na microrregião de Pires do Rio, no estado de Goiás. 2010. 70 f. Dissertação (Mestre em Ciência e Tecnologia de Alimentos) – Escola de agronomia e engenharia de alimentos: Universidade Federal de Goiás, Goiás, 2010.
AOAC. Association of Official Analytical Chemists. Official Methods of Analysis of AOC International. 17 ed. Horwitz, W. Association of Official Analytical Chemists: Gaithersburg, MD, 2000. p. 22 – 33.
AROUCHA, E. M. M.; DE OLIVEIRA, A. J. F., NUNES, G. H. S., MARACAJÁ, P. B.; SANTOS, M. C. A. Qualidade do mel de abelha produzidos pelos incubados da Iagram E Comercializado No Município De Mossoró/RN. Revista Caatinga. Mossoró, v. 21, n. 1, p.211-17, jan./mar., 2008.
ARRUDA, C. M. F. Características Físico-Químicas e Polínicas de Amostras de Méis de Apis mellífera L., 1758 (Hymenoptera, Apidae) da Região da Chapada do Araripe, Município de Santana do Cariri, Estado do Ceará. Dissertação (Mestrado em Entomologia) – Escola Superior de Agricultura “Luiz de Queiroz” – Universidade de São Paulo, 2003. 86 p.
BAHIA. Portaria ADAB n° 207 de 21 de novembro de 2014. Regulamento Técnico de Identidade e Qualidade do Mel de Abelha social sem ferrão, gênero Melipona. Agência Estadual de Defesa Agropecuária da Bahia – ADAB. Governo da Bahia.
BERTOLDI, F. C. GONZAGA, L.; REIS, V. D. A. Características físico-químicas do mel de abelhas africanizadas (Apis mellífera scutellata), com florada predominante de hortelã-do-campo (Hyptis crenata), produzido no Pantanal. In: IV Simpósio sobre Recursos Naturais e Sócio-econômicos do Pantanal. Anais… Corumbá, 2004.
BRASIL. Instrução Normativa n° 11, de 20 de outubro de 2000. Regulamento Técnico de Identidade e Qualidade do Mel. Ministério da Agricultura, Pecuária e Abastecimento, Gabinete do Ministro.
BRASIL. Características Físico-Químicas dos Principais Produtos Meliponícolas e Legislações e Regulamentos Técnicos de Identidade e Qualidade (RTIQs) na Meliponicultura. Brasília, DF: MAPA, 2023.
BRUDZYNSKI, K.; ABUBAKER, K.; CASTLE, A. Re-examining the role of hydrogen peroxide in bacteriostatic and bactericidal activities of honey. Frontiers in microbiology, v. 2, p. 213, 2011.
CAC. CODEX ALIMENTARIUS COMMISSION. CAC/VOL III, Suppl. 2. ed. 1. Roma: FAO/WHO, 1990.
CAMARGO, R. C. R. de. Produção do Mel. Sistemas de Produção, Teresina: Embrapa, 2002.
CAMPOS, G.; MODESTA, R. C. D. Diferenças sensoriais entre mel floral e mel de melato. Rev. Inst. Adolfo Lutz, v. 59, n. 1-2, p. 7-14, 2000.
CARVALHO, C. A. L., SOUZA, B. A., SODRÉ, G. S., MARCHINI, L. C., ALVES, R. M. O. Mel de abelhas sem ferrão: contribuição para a caracterização físico-química. Série Meliponicultura – No 4. 1ª edição, Cruz das Almas – Bahia. 32p, 2005.
CARVALHO. R. G. Apis Mellifera: reprodução, polinização e produção de mel. 2010. 36f. Monografia (Bacharelado e Licenciatura em Ciências Biológicas). Faculdades Integradas Fafibe, Bebedouro, 2010.
CASTRO, L. O.; DOS SANTOS, C. C.; REBELO, T. R. L.; LOPES, A. C.; VIANA, A. F. DA S.; MOREIRA, D. K. T.; DA SILVA, B. A.. Determinação das propriedades físico-químicas e constituição melissopalinológica do mel de Melipona (Michmelia) paraenses Ducke (Jandaíra) originário de Mojuí dos Campos–PA. Brazilian Journal of Development, Curitiba, v.8, n.4, p. 23744-23758, apr., 2022.
CORTOPASSI-LAURINO, M., IMPERATRIZ-FONSECA, V. L., ROUBIK, D. W., DOLLIN, A., HEARD, T. AGUILAR, I., VENTURIERI, G. C., EARDLEY, C., NOGUEIRA-NETO, P. Global meliponiculture: challenges and opportunities. Apidologie, 37, 275-292, 2006.
COUTO, R. H. N.; COUTO, L. A. Apicultura: Manejo e produtos. 2. ed. Jaboticabal: FUNEP, 191 p., 2002.
DA SILVA, I. A. A.; DA SILVA, I. A. A.; DA SILVA, T. M. S.; CAMARA, C. A.; QUEIROZ, N.; MAGNANI, M.; DE NOVAIS, J. S.; DE SOUZA, A. G. Phenolic profile, antioxidant activity and palynological analysis of stingless bee honey from Amazonas, Northern Brazil. Food chemistry, v. 141, n. 4, p. 3552-3558, 2013. DOI: 10.1016/j.foodchem.2013.06.072.
DE MOURA JÚNIOR, J. M. N.; NEGRÃO, C. A. B.; ROCHA, R. M.; DE SOUZA; E. C.; SILVA, A. S. Estudo Físico-Químico e Quimiométrico de Méis do Estado do Pará. Rev. Virtual Quim., 13 (1), 222-233, 2021.
DE PAULA, J. Mel do Brasil. As exportações brasileiras de mel no período de 2000/2006 e o papel do SEBRAE. Brasília: SEBRAE, 2008.
ESCOBAR, A. L. S.; XAVIER, F. B. Propriedades fitoterápicas do mel de abelhas. Uningá Journal, v. 37, n. 1, 2013.
FERNANDES, R. T.; ROSA, I. G.; CONTI-SILVA, A. C. Microbiological and physical-chemical characteristics of honeys from the bee Melipona fasciculata produced in two regions of Brazil. Ciência Rural, v.48, n.5, 2018. DOI: http://dx.doi.org/10.1590/0103-8478cr20180025.
FRERITAS, E. P. B.; CRAVEIRO, R. S.; ASSUNÇÃO, J. M. B.; LOPES, Y. M. S.;MODESTO JÚNIOR, E. M.; SOUZA, R. F. Caracterização físico-química em méis de abelhas produzidos no município de Cachoeira do Arari – Ilha de Marajó, Pará. Research, Society and Development, v. 11, n. 3, e34811326532, 2022.
GAVA, A. J. Princípios de Tecnologia de Alimentos. Editora Nobel. São Paulo – SP, 1984..
GARMES, M. Pesquisadora identifica mel da abelha Tiúba, 2017. Disponível em: https://www2.unesp.br/sharer.php?noticia=28574. Acesso em: 10 de janeiro de 2025.
HOLANDA, C. A. et al. Qualidade dos méis produzidos por Melipona fasciculata Smith da região do cerrado maranhense. Química Nova, v. 35, p. 55-58, 2012.
LIRA, A. F.; SOUSA, J. P. L. DE. M.; LORENZON, M. C. A.; VIANNA, C. A. F. J.; CASTRO, R. N. ESTUDO COMPARATIVO DO MEL DE Apis mellifera COM MÉIS DE MELIPONÍNEOS. Acta Veterinaria Brasilica, v. 8, n. 3, p. 169-178, 2014.
MEIRELES, S.; CANÇADO, I. A. C. MEL: PARÂMETROS DE QUALIDADE E SUAS IMPLICAÇÕES PARA A SAÚDE. SynThesis Revista Digital FAPAM, Pará de Minas, v. 4, n. 4, 207-219, abr. 2013.
OLIVEIRA, F. D. C.; MEDEIROS, C. D. C.; MORAES, F. A. D. S. Análise de mel de abelha coletado em comércio informal na cidade de Teresina, PI. Higiene Alimentar, 3 (268-269), p.01-05, 2017.
PEREIRA, F. de M.; Lopes, M. T. do R.; Camargo, R. C. R. de; Vilela, S. L. de O. Produção de mel. Embrapa Meio-Norte, versão virtual. 2003. Disponível em: <http://sistemasdeproducao.cnptia.embrapa.br/Fontes HTML/Mel/SPMel/index.htm> Acesso em 25 mai 2024.
RYBAK-CHMIELEWSKA, H.; SZCZÊSNA, T. HPLC study of chemical composition of honeybee (Apis mellifera L.) venom. Journal of Apicultural Science, v. 48, n. 2, p. 103-109, 2004.
SANTOS, F. C. F.; ANGULO, E. L. H.; SANTOS, M. E. C.. Caracterização físico-química de amostras do mel de abelhas nativas. Scientia Naturalis, Rio Branco, v. 3, n. 8, p. 2366-2382, 2021.
SANTOS, J. O. dos. Um estudo sobre a evolução histórica da apicultura. 2015. 95 f. Dissertação (Mestrado em Sistemas Agroindustriais) – Departamento de Ciências e Tecnologia: Universidade Federal de Campina Grande, Pombal, 2015.
SEBRAE. Serviço Brasileiro de Apoio às Micro e Pequenas Empresas. Conheça as Técnicas de Manejo para a Produção do Mel. 2019. Disponível em: https://www.sebrae.com.br/sites/PortalSebrae/artigos/conheca-tecnicas-de-manejo-para-a-producao-do-mel,8068fa2da4c72410VgnVCM100000b272010aRCRD. Acesso em: 04 março 2024.
SILVA, E. V. C. Caracterização e pasteurização de méis de abelhas Melípona fasciculata (Uruçu cinzenta) e Apis mellifera (Africanizada). Dissertação (Mestrado em Tecnologia deAlimentos) – Universidade Federal do Pará, 2006. 66 p.
SILVA, J. B.; COSTA, K. M. F. M.; COELHO, W. A. C.; PAIVA, K. A. R.; COSTA, G. A. V.; SALATINO, A.; FREITAS, C. I. A.; BATISTA, J. S. Quantificação de fenóis, flavonoides totais e atividades farmacológicas de geoprópolis de Plebeia aff. Flavocincta do Rio Grande do Norte. Pesq. Vet. Bras., 36(9), p.874-880, 2016. DOI: http://dx.doi.org/10.1590/s0100-736×2016000900014.
SILVA, R. A. da et al. Composição e propriedades terapêuticas do mel de abelha. Alimentos e Nutrição Araraquara, v. 17, n. 1, p. 113-120, 2008.
SOUZA, L. B. S. Caracterização Físico-Química e Microbiológica do Mel de Abelhas (Apis Mellifera) Produzido no Território Rural de Identidade Parque das Emas –Goiás. 58 p. Dissertação (Mestrado) – Instituto Federal de Educação, Ciência e Tecnologia Goiano – Campus Rio Verde Diretoria de Pesquisa de Pós-Graduação Programa de Pós-Graduação em Tecnologia de Alimentos, Goiás, 2017.
TAVARES, J. T. Q., CARDOSO, R. L., COSTA, J. A., FADIGAS, F. S., FONSECA, A. A.. Interferência do ácido ascórbico na determinação de açúcares redutores pelo método de Lane e Eynon. Química Nova, 33(4), 1-8., 2010.
VARGAS, T. Avaliação da Qualidade do Mel Produzido na Região dos Campos Gerais do Paraná. Dissertação (Mestrado em Ciência e Tecnologia de Alimentos) – Universidade Estadual de Ponta Grossa, 2004. 134 p.
VENTURIERI, G. C.; RAIOL, V. F. O.; PEREIRA, C. A. B. Avaliação da introdução da criação de Melípona fasciculata (Apidae: Meliponina), entre os agricultores familiares de Beagança – Pa, Brasil. Revista Biota Neotropica, v. 3. n.2, 2003.
VENTURIERI, G. C.; RODRIGUES, S. T.; PEREIRA, C. A. B. As Abelhas e As Flores do Açaizeiro (Euterpe oleracea Mart. – Arecaceae). Revista Mensagem Doce, no80, mar. 2005. Disponível em: www.apacame.com.br. Acessado em: 20 de maio de 2024.
VISCONDE, J. V. et al. Estrutura organizacional da atividade apícola nos municípios de Silvânia, Vianópolis e Orizona, Goiás. 2016. 86 f. Dissertação (Mestre em Zootecnia) – Escola de veterinária e zootecnia: Universidade Federal de Goiás, Goiânia, 2016.
1Discente do Curso Superior de Farmácia do Instituto de Ciências da Saúde da UFPA, Campus Belém, e-mail: marcos.amaro@ics.ufpa.br
2Discente do Curso Superior de Farmácia do Instituto de Ciências da Saúde da UFPA, Campus Belém, e-mail: gilberto.vale@ics.ufpa.br
3Discente do Curso Superior de Farmácia do Instituto de Ciências da Saúde da UFPA, Campus Belém, e-mail: matheusramon93@gmail.com
4Discente do Curso Superior de Farmácia do Instituto de Ciências da Saúde da UFPA, Campus Belém, e-mail: marciohenriquesantossouza@gmail.com
5Discente do Curso Superior de Farmácia do Instituto de Ciências da Saúde da UFPA, Campus Belém, e-mail: gabryellbastos80@gmail.com
6Discente do Curso Superior de Farmácia do Instituto de Ciências da Saúde da UFPA, Campus Belém, e-mail: ernani.junior@ics.ufpa.br
7Docente do Curso Superior de Agronomia do Instituto de Ciências Agrárias da UFRA, Campus Belém. Doutor em Química (PPGQ/UFPA). e-mail: ewerton.carvalho@ufra.edu.br.
8Docente do Curso Superior de Farmácia do Instituto de Ciências da Saúde da UFPA, Campus Belém. Doutor em Química (PPGQ/UFPA). e-mail: ansansil@ufpa.br.

