THE ROLE OF IFN-Y AND IL-10 AS BIOMARKERS IN HYPERKETONEMIA IN PLACENTAL TISSUES OF DAIRY COWS: A LITERATURE REVIEW
REGISTRO DOI: 10.69849/revistaft/th102412272105
Luís Eduardo Rangel Batinga de Oliveira 1
Marcelo Ribeiro de Souza ²
Paulo Roberto Eleutério de Souza 3
Pierre Castro Soares 4
Resumo
A IFN-y e IL-10 são citocinas produzidas por células do sistema imunológico e estão envolvidas no processo de regulação do sistema imunológico e no surgimento de fenômenos inflamatórios. Além disso, tem sido alvo de estudos que associam a sua expressão ao desenvolvimento de síndromes metabólicas como a Hipercetonemia, caracterizada pela concentração de corpos cetônicos elevados nos tecidos e fluidos do corpo (sangue, leite e urina). Dessa forma o presente estudo, visou realizar uma revisão de literatura que aborde, a importância e impacto da bovinocultura, o metabolismo energético, proteico e hormonal desses animais e explorar a relação entre as citocinas IFN-y e IL-10 e o processo inflamatório em animais com a hipercetonemia, de forma a conhecer o impacto dessas citocinas no processo de regulação no metabolismo de vacas leiteiras . A revisão é descritiva e qualitativa, fundamentando-se em artigos publicados nas plataformas National Center for Biotechnology, Scientific Electronic Library Online e Sciencedirect no período entre 1995-2024 e também em sites governamentais do Instituto brasileiro de geografia e estatística (IBGE) de 2017- 2023. O metabolismo energético em animais com hipercetonemia está associado a eventos que causam redução na quantidade de glicose disponível no sangue e elevação de corpos cetônicos no organismo. As citocinas pró- inflamatórias e anti-inflamatórias podem atuar como parâmetro inflamatórios no organismo, havendo estudos que demonstram correlação entre surgimento de doenças metabólicas e inflamação. Entretanto, essa relação ainda não é totalmente esclarecida, sendo necessário estudos complementares que abordem a relação entre processos inflamatórios e o desenvolvimento de síndromes metabólicas.
Palavras chaves: Cetose. Citocinas. Corpos cetônicos. Interleucina. Patologia.
Abstract
IFN-y and IL-10 are cytokines produced by cells of the immune system and are involved in the process of regulating the immune system and in the emergence of inflammatory phenomena. In addition, they have been the subject of studies that associate their expression with the development of metabolic syndromes such as hyperketonemia, characterized by the concentration of elevated ketone bodies in the tissues and fluids of the body (blood, milk and urine). Thus, the present study aimed to carry out a literature review that addresses the importance and impact of cattle farming on the energy, protein and hormonal metabolism of these animals and to
explore the relationship between the cytokines IFN-y and IL-10 and the inflammatory process in animals with hyperketonemia, in order to understand the impact of these cytokines on the regulation process in the metabolism of dairy cows. The narrative review is descriptive and qualitative, based on articles published on the National Center for Biotechnology, Scientific Electronic Library Online and Sciencedirect platforms between 1995-2024 and also on government websites of the Brazilian Institute of Geography and Statistics (IBGE) from 2017-2023. Energy metabolism in animals with hyperketonemia is associated with events that cause a reduction in the amount of glucose available in the blood and an increase in ketone bodies in the body. Pro-inflammatory and anti-inflammatory cytokines can act as inflammatory parameters in the body, and there are studies that demonstrate a correlation between the emergence of metabolic diseases and inflammation. However, this relationship is not yet fully clarified, requiring complementary studies that address the relationship between inflammatory processes and the development of metabolic syndromes.
Keywords: Ketosis, Cytokines, Ketone bodies, Interleukin, Pathology
Introdução
A bovinocultura é fundamental para a economia brasileira, destacando-se como uma das principais atividades agropecuárias do país. O Brasil possui o segundo maior rebanho bovino do mundo, lidera as exportações globais de carne bovina e está entre os maiores produtores de leite. A atividade gera empregos, promove renda e impulsiona o desenvolvimento regional (IBGE,2022, LUNA et al.,2023).
A hipercetonemia geralmente ocorre em períodos de lactação, onde a demanda energética do organismo é mais elevada devido a produção de leite, deixando o animal em estado de balanço energético negativo (BEN). Em condições saudáveis o indivíduo irá utilizar das suas reservas energéticas, para suprir esses gastos de energia acentuada, entretanto existe um limite a ser usado dessa reserva, ao ser atingido determinado nível os ácidos graxos não serão mais gastos, o que levará ao seu acúmulo no fígado onde estes são convertidos em corpos cetônicos (ALLEN e PIANTONI, 2013).
O metabolismo energético, proteico e hormonal é crucial para entender a hipercetonemia, especialmente durante o período de transição nas vacas leiteiras. Nesse momento, o metabolismo energético se altera devido ao aumento de corpos cetônicos, afetando também o metabolismo hepático e a produção de proteínas. Hormônios como insulina, glucagon e cortisol regulam as vias metabólicas para manter o equilíbrio do organismo. Alterações na interação desses sistemas podem agravar o quadro metabólico, prejudicando a saúde e a produtividade do animal (DUFFIELD,2000, ALLEN e PIANTONI, 2013).
As citocinas pró e anti-inflamatórias têm sido alvo de estudos que relacionam o surgimento de processos de inflamação com o aparecimento de doenças metabólicas, podendo atuar de forma prognóstica como biomarcadores em animais acometidos por distúrbios no metabolismo energético. (BRODZKI et. al 2021).
A hipercetonemia é uma patologia de grande relevância no meio da pecuária, pois além de atingir o bem-estar do animal, afeta diretamente o processo de produção, causando perdas econômicas significativas (SANTOS, 2011). Dessa forma, o seguinte trabalho busca abordar a importância e o impacto da bovinocultura, o metabolismo energético, proteico e hormonal desses animais e explorar a relação entre as citocinas IFN-y e IL-10 e o processo inflamatório em animais com a hipercetonemia, de forma a conhecer o impacto desses biomarcadores no processo de regulação metabólica em animais com a patologia.
2.0 Importância e o Impacto da Bovinocultura
Desde os primórdios do desenvolvimento da indústria no Brasil, a pecuária sempre obteve um papel de destaque e com relevância significativa na economia do país, seja por aspectos históricos, geográficos ou socioeconômicos. Dessa forma, proporcionando a geração de empregos em diversos setores da economia e desenvolvendo renda social, impactando diretamente no cenário nacional e figurando entre os principais produtores em nível global (EMBRAPA, 2017, LUNA et al., 2023).
Atualmente, o Brasil encontra-se com um total de 234,3 milhões de cabeças de gado, segundo último censo realizado em 2022, tal número é responsável por deixá- lo em uma posição de destaque como o segundo maior rebanho bovino do mundo. Além disso, lidera o ranking mundial como o maior exportador de carne bovina e ocupa o sexto lugar como maior produção leiteira (IBGE, 2022).
No âmbito regional, o Nordeste brasileiro representa 12,9% do rebanho bovino no país, apresentando um desempenho crescente e com aumento expressivo dos números de cabeças de gado (IBGE, 2017). Além disso, apresenta uma produção de 5,1 milhões de litros de leite, que é responsável por uma taxa de crescimento expressiva, se expandindo em maior velocidade que a produtividade brasileira (IBGE, 2022). No estado de Pernambuco, a bovinocultura tem recebido cada vez mais investimento e segundo últimos dados do IBGE no ano de 2022, ocupa a 2 º colocação
em produção de leite na região Nordeste, tendo produzido 1,17 bilhões de litros de leite, o que representa 60,64 % da renda obtida com produtos de origem animal.
A utilização de novas tecnologias e pesquisas voltadas para o monitoramento no desenvolvimento de animais com capacidade de produção mais elevadas, tem sido uma tendência cada vez maior do mercado de produção. Relacionados a um aumento nesse processo, a identificação de possíveis patologias de maneira precoce nesses animais é de extrema importância, especialmente no período de transição, fase mais crítica no metabolismo desses animais (SOUZA e SOUZA, 2012).
Entre as patologias que comumente afetam os bovinos destaca-se a cetose metabólica, que apresenta impacto na produção de leite, saúde e bem-estar do animal e rentabilidade dos rebanhos, além de causar perdas econômicas significativas para os produtores de gado leiteiro. (LEBLANC, 2010, SOUZA et al.,2019).
3.0 Período de transição e Balanço energético negativo (BEN)
O período de transição em vacas leiteiras é descrito como a fase compreendida entre as três últimas semanas do período gestacional e as três semanas seguintes à realização do parto. Essa fase é responsável por levar a uma série de modificações fisiológicas no organismo do animal que passa a necessitar de uma maior demanda energética que muitas vezes não consegue ser suprida com a ingestão de nutrientes por meio da alimentação (GRUMMER,1995; RABELO e CAMPOS, 2009).
Alterações metabólicas nesse período são inevitáveis, onde é possível notar uma redução na ingestão de matéria seca que por consequência leva a um balanço energético negativo (BEN), alterações no metabolismo hepático e mudanças nas concentrações dos hormônios (GRUMMER,1995; RABELO e CAMPOS,2009). Devido a essas mudanças torna-se um grande desafio para as vacas leiteiras, que tentam manter uma homeostase, com diferentes fatores atuando e influenciando nesse processo (MOTA, 2006).
O surgimento de doenças metabólicas está associado ao período de transição, como sendo um ponto significativo relacionado ao desenvolvimento de patologias, onde foi observado que 70% das doenças surgem nos animais ou acontecem nesse intervalo de tempo (ORTOLANI, 2009).
Um déficit causado no metabolismo energético devido a diferença entre a ingestão de calorias necessárias e o que é ingerido pelo animal, levando a uma maior mobilização das reservas energéticas, devido a uma menor concentração de glicose disponível no organismo, caracteriza-se como BEN (RABELO e CAMPOS, 2009).
A diminuição de glicose no metabolismo está atrelada a alguns fenômenos como a menor ingestão do consumo matéria seca, que pode se dar por motivos diferentes entre eles: a mudanças na dieta, estresse metabólico, alterações hormonais, além da diminuição do espaço ruminal pela pressão exercida do útero no período gestacional (GRUMMER, 1995, INGVARTSEN e ANDERSEN, 2000). O BEN, portanto, é um quadro comumente observado em vacas no período de transição. Dessa forma, o metabolismo desses animais apresenta mecanismos adaptativos que atuam priorizando os tecidos que necessitam de glicose, porém, tais mecanismos quando se encontram em sobrecarga, acabam não conseguindo controlar esse processo o que leva ao desenvolvimento de síndromes metabólicas como a cetose (RABELO e CAMPOS, 2009).
4.0 Hipercetonemia e cetose metabólica
Os corpos cetônicos acumulados no organismo são moléculas provenientes da quebra da gordura no fígado, servindo de reserva energética, quando sua principal fonte de energia (glicose) se encontra em concentrações reduzidas no corpo. Devido a esse processo, os corpos cetônicos ao serem encontrados em quantidade elevadas no sangue caracteriza a hipercetonemia (DUFFIELD, 2009).
Já a cetose metabólica é um estado patológico regularmente presente em vacas em que concentrações de acetoacetato, acetona e β-hidroxibutirato podem ser observadas em níveis elevados em tecidos do organismo e em fluidos corporais (SCHEIN, 2012).
A cetose pode ser classificada em subclínica e clínica. Na fase subclínica da doença não é observado sinal clínico presente nesses animais, porém alterações na disponibilidade de glicose e a elevação dos corpos cetônicos podem ser notadas. Já no estágio clínico, podem ser observadas a redução na produção leiteira, perda do peso corporal, anorexia, hipoglicemia, e até mesmo, em alguns casos, desordens nervosas. A presença de acetona na urina pode servir como um indicador da elevação dos corpos cetônicos no corpo. Além disso, o hálito cetônico presentes nesses animais, e os níveis de glicose presente no sangue, têm concentrações reduzidas sendo observado valores entre 20 e 40 mg/dL (1,12-2,24 mmol/L) (VEENHUIZEN et al, 1991, SOUZA, 2012 , SCHEIN, 2012).
Dados da literatura retratam que a concentração de β-hidroxibutirato ≥ 1,2 mmoL/L é utilizada como referência para a hipercetonemia em vacas. Sendo assim, a hipercetonemia abrange o estágio clínico e subclínico dessa desordem metabólica, uma vez que fazem parte da mesma patologia apenas em estágios diferentes, sendo o animal hipercetonêmico o termo mais adequado para utilização (GORDON, LE BLANC, DUFFIELD, 2013).
A realização de um diagnóstico desse quadro se faz através de teste em leite, urina e sangue desses animais para avaliar os níveis de corpos cetônicos, sendo utilizado o β-hidroxibutirato como referência por sua maior estabilidade e concentração no organismo (DUFFIELD, 2009, McART et al., 2013).
Portanto, o acompanhamento de sinais clínicos, a observação do comportamento animal e da condição corporal da vaca são condutas que devem ser realizadas, devido a implicações como: redução na produção de leite, impacto na saúde e reprodução desses animais levando ao desenvolvimento de outras doenças como deslocamento do abomaso, metrite, mastite e uma perda da condição corporal (McART et al., 2013).
Em decorrência desse distúrbio metabólico que leva a prejuízos econômicos e no processo de produção, cada dia mais estudos são realizados de forma a observar fatores que podem estar relacionados, como alterações hormonais e o desenvolvimento de processos inflamatórios por meio de citocinas, importantes reguladores do sistema imunológico (FRANCISCO, HERNANDEZ e SIRO, 2006, ZHANG et al., 2016).
5.0 Perfil Energético
O metabolismo energético dos ácidos graxos livres (AGL), ou ácidos graxos voláteis (AGV) são essenciais no metabolismo dos ruminantes, sendo a principal fonte de energia desses animais, produzidos através da fermentação no rúmen. Existem três tipos principais: Ácido acético ou acetato, ácido propiônico também conhecido como propionato e o Ácido Butírico ou butirato (SCHEIN, 2012).
O Ácido Acético tem a sua oxidação podendo ser realizada por diferentes tecidos, e por meio da gordura do leite, a qual foi inserida pela glândula mamária é utilizado no metabolismo dos lipídios. Já o butirato é convertido em acetoacetil-CoA, onde haverá sua parcial oxidação, podendo seguir duas vias, a primeiro formando diretamente corpos cetônicos e a segunda a qual é transformado em acetil-CoA inserindo-se no ciclo de Krebs (PUCHALSKA, 2017).
O Propionato entra diretamente no ciclo de Krebs no trecho da succinil-CoA que o converte em glicose sendo um dos principais responsáveis pela produção de glicose nos animais ruminantes. O Ácido propiônico é o único dos três Ácidos graxos que é considerado glicogênico, enquanto os demais são cetogênicos, portanto o mesmo está relacionado ao processo de hipoglicemia, quando ocorre a sua redução no organismo (NRC, 2001).
Em estado de hiperglicemia, comumente o metabolismo do organismo sofrerá com uma redução da insulina e um aumento do glucagon no plasma, isso proporciona uma maior atividade dos hormônios lipase sensível no tecido adiposo. Sendo assim, os níveis de oxalacetato são diminuídos, fazendo com que ocorra uma menor intensificação da realização do ciclo de Krebs e consequente utilização do acetil-CoA que se agrupam formando os corpos cetônicos (SCHEIN, 2012).
5.1 Ácidos Graxos Não Esterificados (AGNE)
Os ácidos graxos não esterificados (AGNE) podem ser encontrados em tecidos do corpo em concentrações pequenas, mas que também podem ser utilizadas como fonte de energia em estado de jejum.
Sendo assim, os AGNE são fonte de energia alternativa à glicose durante períodos de baixa ingestão de carboidratos (NRC, 2001). As alterações no metabolismo devido ao período de transição causam um desequilíbrio energético e consequente aumento nos níveis de corpos cetônicos no organismo (RABELO e CAMPOS, 2009). Isso se dá devido ao aumento na necessidade de ingestão de glicose em vacas leiteiras durante o período de lactação que passam a utilizar os ácidos graxos como reservas energéticas (SHEIN, 2012).
Há três vias metabólicas possíveis para os AGNE, a primeira é a betaoxidação ou oxidação completa liberando CO2 e gerando energia para o fígado. A segunda via é uma oxidação parcial que forma corpos cetônicos que são utilizados em diferentes tecidos. Enquanto a terceira via conhecida como reesterificação é caracterizada por metabolizar e armazenar os triglicerídeos. (AROEIRA,1998).
Na betaoxidação ocorre a quebra de ácidos graxos, processo que gera a liberação de CO2 e energia na forma de ATP, gerando como produto final a Acetil Co- A. (GONZALES e SILVA, 2017). O fígado, todavia, estará sobrecarregado ao realizar a lipólise constante e o excesso dessa reação no organismo causa uma saturação. O organismo então inicia o processo de esterificação das moléculas de gordura, proporcionando o surgimento das lipoproteínas de baixa densidade (VLDL) que tem por finalidade realizar o transporte de triglicerídeos pela corrente sanguínea (RABELO e CAMPOS,2009).
A última via é a oxidação parcial dessas moléculas, que realizam essa reação sem provocar saturação no organismo, o que causa o acúmulo dos corpos cetônicos, o acetoacetato, acetona e β-hidroxibutirato (BHB) (GONZALES e SILVA,2017). O esquema resume as vias de acúmulo de ácidos graxos no metabolismo dos ruminantes, sendo representado através da figura 1.
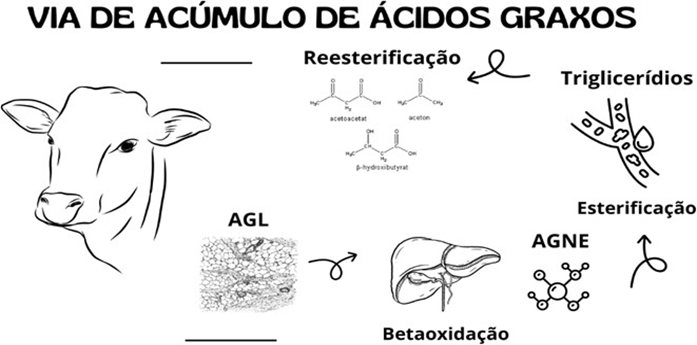
Fonte: O Autor
5.2 Glicose
A glicose é uma das principais fontes energéticas em bovinos juntamente com ácidos graxos voláteis (AGVS), pois é essencial para o metabolismo, onde apresenta ação específica nas hemácias, cérebro, placenta, feto e lactação. Diferentemente de animais monogástricos, como os seres humanos, em bovinos a obtenção de glicose ocorre mediante a sua produção no fígado em um processo chamado de gliconeogênese, visto que obter glicose tendo como fonte a dieta nutricional é algo escasso (GRUMMER ,1993).
A gliconeogênese é uma via metabólica que produz glicose através de precursores não glicídicos. Esse processo é de fundamental importância para que as necessidades energéticas do animal possam ser atingidas, portanto a sua regulação é um ponto de destaque importante, podendo ser feita pela ação de hormônios e também pelas disponibilidades desses precursores entre eles: Propionato, aminoácidos, lactato e glicerol (LARSEN, 2013, GONZÁLES e SILVA, 2017).
A insulina e o glucagon são hormônios que regulam diretamente essa via metabólica. A insulina inibe processos que elevam os níveis de glicose no sangue, promovendo o armazenamento de nutrientes e a utilização de glicose pelas células. Em contraste, o glucagon favorece o aumento dos níveis de glicose no sangue, estimulando a gliconeogênese (DUEHLMEIER et al., 2013).
Em estado de hipercetonemia, diminuição da glicose disponível, há uma queda na produção de insulina pelas células beta pancreáticas, fazendo com que sua captação seja reduzida, restringindo-se a órgãos e tecidos vitais. No tecido adiposo será ativada a lipólise, liberando os ácidos graxos para serem utilizados como fonte de energia, porém como possíveis consequência tem-se o acúmulo de corpos cetônicos e o fígado gorduroso (AROEIRA, 1998; DUEHLMEIER et. al., 2013, GONZÁLEZ e SILVA, 2017).
5.3 β-hidroxibutirato (BHB)
O β-hidroxibutirato (BHB) é o corpo cetônico mais abundante presente no organismo dos ruminantes. Sua produção se dá através do metabolismo de ácidos graxos não esterificados (AGNE), no período de BEN há uma maior mobilização de ácidos graxos do tecido adiposo para o fígado que serão oxidados produzindo Acetil-CoA entrando na via da cetogênese, produzindo entre outros corpos cetônicos o BHB (KERWIN et al., 2023).
O BHB é utilizado como fonte de energia ao ser convertido em Acetil-coA entrando no ciclo de Krebs e gerando o ATP. Apresenta função importante no metabolismo energético como sinalizador metabólico, influenciando na regulação do apetite e na expressão de genes que atuam nesse metabolismo (PUCHALSKA, 2017).
A presença do BHB tem implicações diretas no desempenho dos animais, no processo de produção em especial de vacas leiteiras. As concentrações de BHB são utilizadas como valores de referência e indicação de distúrbios metabólicos. No sangue, esse corpo cetônico se caracteriza por se manter mais estável, assim auxiliando no diagnóstico da hipercetonemia em ruminantes através de kits já especializados vendidos comercialmente (JEZEK et al.,2017, BENEDET et al., 2019).
6.0 Perfil Hormonal
As alterações no metabolismo energético desses animais juntamente com um déficit nutricional podem levar a desequilíbrio dos hormônios, sendo assim a avaliação de perfil hormonal é de fundamental importância, devido a sua atuação de forma concomitante na regulação sistêmica do organismo. Hormônios como, insulina, Glucagon e cortisol, apresentam atuação em vias diretas no metabolismo da glicose e sobre condições de maior estresse no organismo. Entender essa relação pode auxiliar no manejo nutricional e tratamento da hipercetonemia, além de possibilitar melhor compreensão dos fenômenos biológicos que levam ao surgimento desta síndrome metabólica (DUFFIELD, 2000, BOBE et al.,2004).
6.1 Insulina
A insulina é um hormônio de composição peptídica, produzidas por células beta pancreáticas que apresenta ação anabólica, favorecendo a síntese de glicogênio, proteínas e acúmulo de gordura no corpo, tendo sua ação principalmente no fígado, músculo e adipócitos. Esse hormônio encontra-se envolvido em processos metabólicos cruciais no organismo, com vias que atuam de forma direta na homeostase, atuando de forma a balancear o metabolismo (GONZALES e SILVA, 2017).
Dentre as ações da insulina no organismo, destaca-se a captação da glicose, promovendo a sua inserção na célula, estimulando os transportadores de glicose a estarem na superfície celular, processo que garante a redução dos níveis de glicose no sangue. Atua na produção do glicogênio, que serve como reserva energética, e pode ser mobilizado quando os níveis de glicose diminuem. Além disso, estimula a síntese de algumas proteínas envolvidas no crescimento e reparo tecidual (SALTIEL e KAHN, 2001, PETERSEN e SHULMAN,2018).
Nos adipócitos, a insulina estimula a lipogênese, convertendo a glicose em ácidos graxos, que se acumulam no organismo. Esse hormônio também inibe a lipólise que bloqueia a quebra desses ácidos graxos, priorizando a utilização da glicose como fonte de energia (HERDT,2000).
A resistência à insulina é um dos principais fatores associados à alteração no metabolismo, pois esta impede a captação eficiente de glicose pelas células, causando um aumento dos níveis desse carboidrato no sangue. Devido a menor eficiência desse hormônio, o metabolismo dos lipídeos é alterado, fazendo com que a regulação da lipólise seja afetada, isso leva os ácidos graxos livres a serem transportados ao fígado, onde são convertidos em corpos cetônicos. Em animais com hipercetonemia, a ação da insulina é afetada diretamente por alterações no metabolismo que gera um efeito em cascata em que a resistência a insulina possibilita maior mobilização dos corpos cetônicos, paralelamente atuando na limitação no processo de captação de glicose (HERDT,2000, KOSTER e OPSOMER,2013).
6.2 Glucagon
O Glucagon é um hormônio produzido pelas células alfa do pâncreas, com ação catabólica, tendo função antagônica à insulina, sendo assim responsável pela degradação do glicogênio, lipídeos e proteínas, elevando assim o nível de glicose no sangue durante períodos de déficit energético. Esse hormônio desempenha um papel fundamental aumentando a glicose, em condições de jejum ou estresse, de forma a proporcionar ao corpo energia suficiente para realizar as funções necessárias adequadamente (GONZÁLEZ e SILVA,2017).
A atuação do glucagon no metabolismo energético é ampla, no fígado apresenta ação direta estimulando a glicogenólise, quebra do glicogênio, se tornando glicose, sendo liberada na corrente sanguínea, esse processo é fundamental para que se evite a hipoglicemia. É responsável também por estimular a via da gliconeogênese, produzindo glicose, através de compostos na glicídicos, como glicerol e aminoácidos. Nos adipócitos, tem atuação quebrando os triglicerídeos em ácidos graxos e glicerol, processo conhecido como lipólise, além de interagir com a insulina para manter o equilíbrio energético dentro do metabolismo (RAMNANAM et al., 2011, UNGER e CHERRINGTON,2012).
No estado de hipercetonemia, o metabolismo desses animais terá atuação mais acentuada do glucagon, promovendo a lipólise e a cetogênese, processo pelo qual os ácidos graxos são convertidos em corpos cetônicos no fígado. O glucagon atua em parceria com a insulina dando homeostase no metabolismo da glicose e dos ácidos graxos, porém devido às alterações ocorridas na hipercetonemia esse equilíbrio é perturbado, fazendo com que maiores concentrações glucagon promovam a produção de corpos cetônicos (BAIRD,1982, MUTEL et al., 2011).
6.3 Cortisol
O cortisol é um hormônio esteroide, produzido nas células das adrenais, que tem atuação diversa no organismo, entre elas : resposta ao estresse, sendo liberado na corrente sanguínea após situações de luta ou fuga, garantindo maior energia para reagir a situações de risco; regula o metabolismo , degradando proteínas que serão transformadas em glicose; controla a pressão arterial, favorecendo a constrição e dilatação de vasos sanguíneos; ajuda no ciclo circadiano e tem ação anti-inflamatória (GONZÁLEZ e SILVA,2017).
No metabolismo energético, a ação hormonal do cortisol favorece a gliconeogênese, fornecendo glicose para o cérebro e outros tecidos que necessitam do uso imediato, em estado de jejum. A lipólise também é estimulada por esse hormônio, elevando os níveis de ácidos graxos livres. Nos músculos esqueléticos, o cortisol estimula o catabolismo proteico, fornecendo substrato para gliconeogênese (HARRY e SECKL, 2011, PERRY,2017).
No contexto dos animais hipercetonêmicos, o cortisol tem atuação aumentando a gliconeogênese e para fornecer substratos para esse processo, atua promovendo a lipólise (quebra de gorduras) e a proteólise (degradação de proteínas). Outro papel é na resposta ao estresse, tentando manter a homeostase do metabolismo, além disso pode ter efeitos catabólicos, causando uma perda de massa muscular e o agravamento do estado nutricional do animal, contribuindo para agravar o balanço energético negativo (GRUMMER,1995, HERDT,2000).
7.0 Perfil Proteico
Proteínas são macromoléculas essenciais para o funcionamento do organismo e atuam no metabolismo em diferentes funções, destacando-se a atuação na aceleração de reações químicas; transporte de íons, nutrientes e hormônios; são componentes musculares; geram e transmitem impulsos nervosos e estão presentes na proteção imunológica (LEHNINGER et al., 2017).
7.1 Proteínas totais
As proteínas totais são a soma de todas as proteínas presentes no plasma sanguíneo. Essas proteínas são frequentemente utilizadas como parâmetro para identificação de anormalidades em exames de laboratório, analisando as funções hepáticas, estado nutricional e alterações metabólicas. A composição dessas proteínas é principalmente de Albumina, que é sintetizada no fígado e tem ação no transporte de substâncias e na manutenção da pressão osmótica; e as globulinas, que são um grupo de proteínas envolvidos no sistema imunológico também atua no transporte de lipídios (HALL e GUYTON, 2020, MEDLINE, 2023).
No contexto de animais com hipercetonemia, as proteínas totais podem ser afetadas em seus níveis, pois esse distúrbio metabólico atinge o funcionamento hepático que está atrelado tanto ao metabolismo de corpos cetônicos como à síntese de proteínas. A sobrecarga do fígado, pode afetar a síntese de proteínas como albumina e globulinas, que são os componentes essenciais das proteínas totais (OGGIANO et al., 2010, SOUTO et al., 2013).
7.2 Albumina
A albumina é a proteína presente em maior concentração no plasma sanguíneo, sendo essencial no controle da pressão oncótica, ajudando a regular o equilíbrio de fluidos entre o sangue e os tecidos, evitando o acúmulo de água nos tecidos e formação de edemas. Essa proteína também pode ser utilizada como reserva proteica, em situações de jejum sendo degradada em aminoácidos para servir de substrato para formação de novas proteínas. Outra atuação descrita é na manutenção do ph do sangue, sendo utilizada como proteína tampão; e no transporte de substâncias como AGL, hormônios (como a tiroxina e o cortisol), vitaminas, íons (como cálcio e magnésio), e medicamentos (GONZÁLEZ e SILVA, 2017, LEHNINGER et al., 2017).
Em períodos de lactação em que vacas apresentam BEN, as concentrações de albumina podem diminuir, devido às vacas direcionarem mais nutrientes para a produção de leite, afetando a síntese de proteínas. Além disso, é uma proteína sensível à disponibilidade de aminoácidos, sendo afetada por dietas com baixo teor de proteína, podendo resultar em níveis reduzidos no plasma. Dessa forma, a albumina pode ser usada como um marcador clínico, de condições metabólicas e nutricionais no organismo (OLIVEIRA et.al,2014).
7.3 Globulinas
As globulinas são um grupo de proteínas presente no plasma sanguíneo que estão envolvidas em diversos processos no organismo. As imunoglobulinas ou anticorpos apresentam papel imunológico fundamental, identificando e neutralizando agentes patológicos e infecciosos, como bactérias e vírus, proporcionado resposta imune e protegendo o corpo contra infecções (JORRITSMA et al., 2003, KANEKO et al., 2008).
No metabolismo de vacas leiteiras, as globulinas estão envolvidas no metabolismo energético, ajudando no transporte de ácidos graxos. Além disso, a saúde e bem-estar animal podem estar relacionadas aos níveis de globulinas no corpo, apresentando um menor risco de surgimento de distúrbios metabólicos. Uma produtividade leiteira mais eficiente pode estar associada à saúde imunológica, sendo usada muitas vezes como parâmetro o nível de globulinas no corpo (JORRITSMA, et al., 2003, SORDILLO e RAPHAEL, 2013).
7.4 Ureia
A ureia é um composto nitrogenado produzido no fígado, podendo ser utilizada no metabolismo de proteínas, especialmente na reciclagem desse composto, que ocorre no rúmen. Microrganismos ruminais podem utilizar esse composto para produção de nitrogênio através de proteínas microbianas que são uma fonte de proteína de qualidade para o ruminante, que ao serem digeridas liberam aminoácidos essenciais que são absorvidos e utilizados pelo animal (KOHN et.al, 2005, SADJADIAN, et al., 2013).
Alterações nas concentrações de ureia em ruminantes, podem ser indicações de alterações no metabolismo. Níveis diminuídos estão associados a deficiência no consumo de proteínas, indicando que a dieta não está adequada ao animal, também pode apontar para um baixo nível do suprimento de nitrogênio não proteico. Já uma presença maior da ureia pode indicar excesso de proteína e que o animal não está utilizando com eficácia o nitrogênio disponível, levando a um desperdício e maior excreção desse composto pela urina (KOHN et al.,2005, GONZÁLEZ e SILVA, 2017).
7.5 Creatinina
A creatinina é um metabólito que se origina da creatina, sendo produzido nos músculos e filtrado nos rins. Alterações nas concentrações de creatinina no sangue podem indicar um funcionamento inadequado dos rins, através da taxa de filtração glomerular (TGF), visto que, sua excreção é realizada nos rins e não sofre processo de reabsorção (THRALL, 2015).
Em animais hipercetonêmicos, alterações nos níveis de creatinina podem indicar modificações no metabolismo e disfunções renais secundárias a essa condição. Com o acúmulo de corpos cetônicos, devido a hipercetonemia, as alterações no metabolismo de lipídios e carboidratos podem afetar outros sistemas, como o renal. Em etapas mais graves da doença, o comprometimento dos rins pode ocorrer, sendo fundamental o acompanhamento desse composto como um biomarcador que indica a qualidade e saúde nos rins (SANTOS et al., 2011).
8.0 Citocinas e Hipercetonemia
As citocinas são glicoproteínas extracelulares de baixo peso molecular que estão relacionadas ao sistema imunológico na regulação de processos inflamatórios, controle de infecções e desenvolvimento de patologias no organismo. O mecanismo de ação das citocinas se dá através da sua ligação a receptores específicos que atuam sobre uma célula-alvo, dessa forma desencadeando uma cascata de sinalização celular que resulta em alterações na expressão gênica e na atividade da célula, inibindo ou ativando funções celulares (ABBAS,2018).
Estudos apontam para uma relação entre o desenvolvimento de desordens metabólicas, entre elas a hipercetonemia e alterações nos níveis de citocinas no metabolismo. Sendo assim, podendo ser utilizados como marcadores inflamatórios indicando possíveis alterações que levam ao surgimento de patologias (ZHANG et al., 2016, WU et al., 2020).
Para se manter a homeostase imunológica é necessário haver equilíbrio entre os níveis de citocinas pró e anti-inflamatórias. O quadro de hipercetonemia pode causar um desequilíbrio levando a uma resposta inflamatória exagerada ou inadequada (MIKULA et al., 2021).
8.1 Citocinas pró-inflamatórias
As citocinas pró inflamatórias são aquelas que favorecem o desenvolvimento de processos inflamatórios no organismo. Entre elas destaca-se: fator de necrose tumoral alfa (TNF-α), a interleucina-1 beta (IL-1β), a interleucina-6 (IL-6), e o Interferon gama (IFN-Y) (ZHANG et al., 2016).
O estresse oxidativo pode induzir a ativação de vias inflamatórias aumentando assim os níveis de citocinas pró inflamatórias, além disso esses corpos cetônicos interagem com vias de sinalização das células que também favorecem um aumento dessas citocinas (MIKULA et al., 2021).
Estudos revelam que níveis de TNF-α, IL-6 e IL-1β, podem estar elevadas devido a presença de corpos cetônicos que intensificam uma resposta inflamatória, além disso, essas citocinas são conhecidas por interferir na via de sinalização da insulina, aumentando o processo de resistência à insulina e favorecendo a hipercetonemia (BRAFORD, 2019, BRODZKI et al., 2021). Processos Inflamatórios crônicos juntamente com o estresse oxidativo são responsáveis pelo comprometimento do sistema imunológico desses animais, aumentando a probabilidade de surgimento de novas doenças (BRADFORD, 2019).
8.1.1 Interferon gama (IFN-y)
O IFN-y é uma citocina pró-inflamatória que tem atuação na resposta imunológica, protegendo contra infecções virais e bacterianas e envolvida em processos inflamatórios e autoimunes. A sua produção é realizada por células T auxiliares (Th1), células T citotóxicas (CTLs) e células NK (natural killer). Essa citocina está envolvida no processo de ativação dos macrófagos, células importantes para realizar a fagocitação de organismo invasores, atuando também promovendo a diferenciação celular das células T, essencial na resposta imune celular (IVASHKIV, 2018; YAO et al., 2022).
O IFN-y tem sido apontado como um fator envolvido no metabolismo da glicose, aumentando a captação desse carboidrato, assim permitindo uma maior disponibilidade para as células do sistema imunológico realizarem suas funções vitais. o mesmo também influencia a mobilização de ácidos graxos promovendo a lipólise, que fornece energia e substratos para células do sistema imunológico durante a resposta inflamatória (BOULANGÉ et al., 2016).
A resistência à insulina pode ser mediada pela IFN-y, pois ao favorecer a inflamação é reduzida a captação de glicose pelos tecidos, forçando a utilizar ácidos graxos como fonte alternativa de energia, o que aumenta a produção de corpos cetônicos (FAHED et al., 2021).
No tecido placentário de humano, a IFN-Y atua protegendo o feto e a placenta contra infecções, especialmente as virais que possam atingir o organismo. Outra atuação descrita é na regulação da resposta imune da mãe e a proteção do feto, sendo necessário o equilíbrio para que se tenha um desenvolvimento fetal saudável (KOPITAR-JERALA, 2017, HOO et al., 2020).
Em animais hipercetonêmicos a IFN-y se relaciona com o estresse metabólico no pós-parto, devido a demanda de energia alta necessária para a produção de leite. Estresse esse que se torna exacerbado pelo processo inflamatório, favorecendo o acúmulo de corpos cetônicos e levando a hipercetonemia (SORDILLO e AITKEN, 2009).
Estudos mostram que concentrações elevadas da IFN-Y podem estar associadas ao comprometimento do sistema imunológico, pois a inflamação crônica está relacionada a uma maior incidência de hipercetonemia, influenciando assim na resposta imune à saúde do rebanho (WILLIAMS et al., 2005, LEWIS, 2004).
8.2 Citocinas Anti-inflamatórias
As citocinas anti-inflamatórias têm papel fundamental em controlar o processo de inflamação regulando o metabolismo de forma a evitar fenômenos inflamatórios e são produzidas por células do sistema imunológico, como linfócitos e macrófagos (ABBA et al.,2018). No metabolismo energético, citocinas anti-inflamatórias como Interleucina 10 (IL-10), Interleucina 13 (IL-13) e Fator de crescimento transformador beta (TGF-β) atuam de forma a regular e aumentar a sensibilidade à insulina, ajudam na regulação do metabolismo de lipídios, além de diminuir a inflamação, beneficiando a homeostase metabólica e reduzindo o desenvolvimento de doenças metabólicas crônicas (CHOE et al., 2016).
8.2.1 Interleucina-10 (IL-10)
A IL 10 é uma citocina produzida por células do sistema imunológico, entre elas Linfócitos T, Linfócitos B, células dendríticas e macrófagos, que apresenta ação anti- inflamatória no organismo. Apresenta papel importante regulando a resposta imune e mantendo a homeostase, tendo destaque no controle da produção de citocinas pró- inflamatórias, inibe a ativação de células imunes e promove a tolerância imunológica impedindo respostas autoimunes (CHOI, 2007).
Em tecidos placentários humanos a IL-10 desempenha papel fundamental ajudando na criação de um ambiente imuno tolerante na interface materno-fetal. Além disso, sua produção é realizada por algumas células presentes na placenta como citotrofoblastos, sincitiotrofoblastos e células de Hofbauer (macrófagos placentários), ressaltando a sua importância em modular a resposta imunológica. Estudos apontam que clinicamente níveis baixos de IL-10 estão associados a pré-eclâmpsia (pressão arterial elevada levando a complicações na gestação). Essa citocina também atua no controle e regulação da quantidade de citocinas pró inflamatórias, levando a homeostase necessária para o desenvolvimento saudável do feto (SVENSSON- ARVELUND et al., 2015, TAUBER et al., 2024).
No contexto da hipercetonemia, a IL-10 pode atuar no organismo controlando uma resposta inflamatória que é intensificada no período de transição devido ao estresse metabólico. Dessa forma atuando no controle da produção de citocinas pró inflamatórias como a IL-6, IL-1 e TNF. No Processo de regulação da resposta imune, a IL-10 promove uma maior estabilidade ao ajudar no combate a infecções, visto que a hipercetonemia pode estar associada a uma imunossupressão temporária, o que leva a uma maior probabilidade no desenvolvimento de doenças infecciosas (SARAIVA e O’ GARRA, 2010, PUCHALSKA e CRAWFORD, 2017).
Pesquisas têm apontado que níveis mais elevados de IL-10 estão associados a uma melhor resposta imunológica e controle no combate a desordens no metabolismo, atuando de uma forma a reduzir os danos causados por essa patologia através do controle do processo inflamatório. É sugerido que essa interleucina tenha uma atuação como marcador biológico, visto que seus níveis já foram observados em maiores concentrações antes mesmo de ser notada a elevação do β-hidroxibutirato no corpo desses animais (BRODZKI et.al 2021, ZHANG et al., 2016, VOLP et al., 2008).
9.0 Considerações finais
As citocinas pró e anti-inflamatória tem sido alvo de estudos recentes, em que se relaciona os seus níveis presentes no organismo como fatores relevantes no regulamento sistêmico. Para reduzir os danos da hipercetonemia no organismo, têm- se utilizado abordagens integradas que considerem tanto o manejo nutricional quanto a modulação da resposta inflamatória são essenciais para otimizar a saúde e a produtividade dos bovinos leiteiros.
Entretanto, essa relação entre as citocinas estudadas e o surgimento da cetose metabólica ainda não são totalmente esclarecidas. Portanto faz-se necessário estudos complementares que abordem a relação entre processos inflamatórios e o desenvolvimento de síndromes metabólicas em bovinos de forma que possam proporcionar novas perspectivas e soluções para o manejo da hipercetonemia em rebanhos bovinos.
Referências
ABBAS, A. K.; LICHTMAN, A. H. H.; PILLAI, S. Imunologia Celular E Molecular. 9. ed. [s.l.] Elsevier Editora Ltda, 2018.
ALLEN, M. S.; PIANTONI, P. Metabolic control of feed intake: implications for metabolic disease of fresh cows. Veterinary Clinics of North America: Food Animal Practice, v. 29, n. 2, p. 279–297, 2013.
ALVES, N. G.; PEREIRA, M. N.; COELHO, R. M. Nutrição e reprodução em vacas leiteiras. Revista Brasileira de Reprodução Animal, n. 6, p. 118–124, 2009.
ARAÚJO, C. A. S. C.; MINERVINO, A.H.H, SOUSA, R.S, OLIVEIRA, F.L.C, RODRIGUES, F.A.M.L, MORI, C.S, ORTOLANI, E.L. Validation of a handheld β- hydroxybutyrate acid meter to identify hyperketonaemia in ewes. Peer Journals, 8:e8933, 2020.
BOULANGÉ, C.L., NEVES, A.L., CHILLOUX, J. et al. Impact of the gut microbiota on inflammation, obesity, and metabolic disease. Genome medicine, v. 8, n. 1, p. 42, 2016.
BRODZKI, P; MARCZUK, J; LISIEKSA, U; SZCZUBIAL, M ; BRODZKI, A; GORZKOS, H, Kulpa K. Comparative evaluation of cytokine and acute-phase protein concentrations in sera of dairy cows with subclinical and clinical ketosis as a different view of the causes of the disease. Veterinary world, v. 14, n. 6, p. 1572–1578, 2021.
CHOE, SS, Huh JY, Hwang IJ, Kim JI and Kim J.B. Adipose tissue remodeling: Its role in energy metabolism and metabolic disorders. Frontiers in endocrinology, v. 7, p. 30, 2016.
CHOI, K. M, RYU, O. H, LEE, K. W, KIM, H.Y, SEO, J.A, KIM S.G, et al. Serum adiponectin, interleukin-10 levels and inflammatory markers in the metabolic syndrome. Diabetes research and clinical practice, v. 75, n. 2, p. 235–240, 2007.
DUFFIELD, T. F. LISSEMORE, K.D, McBRIDE, B.W, LESLIE, K.E. Impact of hyperketonemia in early lactation dairy cows on health and production. J. Dairy Sci., v. 92, p. 571–580, 2009.
DUFFIELD, T. Subclinical ketosis in lactating dairy cattle. Veterinary clinics of north america: Food animal practice, v.16, n.2, p.231-253, 2000.
EUSTÁQUIO FILHO, A. et al. Balanço energético negativo. Pubvet, Londrina, v. 4, n. 11, p. 780-787, 2010.
FAHED, G.; AOUN, L.; BOU ZERDAN, M.; ALLAM, S.; Bou Zerdan, M.; BOUFFERRA, Y.; ASSI , H.I. Metabolic syndrome: Updates on pathophysiology and management in 2021. International journal of molecular sciences, v. 23, n. 2, p. 786, 2022.
FRANCISCO, G. Serum markers of vascular inflammation in dyslipidemia. Clin Chim Acta, v. 369, p. 1–16, 2006.
GORDON, J. L.; LEBLANC, S. J.; DUFFIELD, T. F. Ketosis treatment in lactating dairy cattle. The Veterinary clinics of North America. Food animal practice, v. 29, n. 2, p. 433–445, 2013.
GONÇALVES, L. P.; DIAS, D. A.; OLIVEIRA, L. A.; ALMEIDA, R. M.; SILVA, F. C.; CARVALHO, J. F. Avaliação do perfil metabólico de vacas da raça Holandesa durante o período de transição. Pesquisa veterinaria brasileira [Brazilian journal of veterinary research], v. 35, n. 3, p. 281–290, 2015.
GONZALEZ, F.D.D; SILVA, S.C. Introdução a bioquímica clínica veterinária. 3 Ed. UFRGS 2017.
GONZÁLEZ, F. H. D. CORRÊA, M. N.; SILVA, S. C. Transtornos metabólicos nos animais domésticos. Ed. 2º. Porto Alegre: UFRGS, 2017. 344p.
GRUMMER, R. R. Impact of changes in organic nutrient metabolism on feeding the transition dairy cow. Journal of animal science, v. 73, n. 9, p. 2820, 1995.
HALL, John E.; GUYTON, Arthur C. Textbook of medical physiology. 14. ed. Philadelphia: Elsevier, 2020.
HARRIS, A.; SECKL, J. Glucocorticoids, prenatal stress and the programming of disease. Hormones and behavior, v. 59, n. 3, p. 279–289, 2011.
HERDT, T. H. Ruminant adaptation to negative energy balance: Influences on the etiology of ketosis and fatty liver. Veterinary Clinics: Food Animal Practice, v. 16, p. 215–230, 2000.
HOO, R.; NAKIMULI, A.; VENTO-TORMO, R. Innate immune mechanisms to protect against infection at the human decidual-placental interface. Frontiers in immunology, v. 11, 2020.
IBGE – Instituto Brasileiro de Geografia e Estatística. Indicadores IBGE: Estatística da Produção Pecuária outubro a dezembro de 2022. 2023. Disponível em: < https://www.ibge.gov.br/novo-portal-erramos/36469-atualizacao-da-publicacao- indicadoresibge-estatistica-da-producao-pecuaria-out-dez-2022.html.>. Acesso em: 07 de Maio de 2024.
IBGE – Instituto Brasileiro de Geografia e Estatística: PESQUISA DA PECUÁRIA MUNICIPAL. Rio de Janeiro:SIDRA, 2017.(Sistema IBGE de Recuperação Automática.Disponível em: https://sidra.ibge.gov.br/pesquisa/ppm/tabelas/brasil/2017. Acesso em: 08 de Maio de 2024.
INGVARTSEN, K. L.; ANDERSEN, J. B. Integration of metabolism and intake regulation: a review focusing on periparturient animals. Journal of dairy science, v. 83, n. 7, p. 157–1597, 2000.
IVASHKIV, L. B. IFNγ: signalling, epigenetics and roles in immunity, metabolism, disease and cancer immunotherapy. Nature reviews. Immunology, v. 18, n. 9, p. 545–558, 2018.
JORRITSMA, R., WENSING, T., KRUIP, T. A, VOS, P. L, NOORDHUZEIN, J. P. Metabolic changes in early lactation and impaired reproductive performance in dairy cows. Veterinary research, v. 34, n. 1, p. 11–26, 2003.
KANEKO, J. J.; HARVEY, J. W.; BRUSS, M. L. Clinical biochemistry of domestic animals. 6. [s.l.] Academic Press, 2008.
KOHN, R. A.; DINNEEN, M. M.; RUSSEK-COHEN, E. Using blood urea nitrogen to predict nitrogen excretion and efficiency of nitrogen utilization in cattle, sheep, goats, horses, pigs, and rats. Journal of animal science, v. 83, n. 4, p. 879–889, 2005.
KOPITAR-JERALA, N. The role of interferons in inflammation and inflammasome activation. Frontiers in immunology, v. 8, p. 873, 2017.
LEBLANC, S. Monitoring metabolic health of dairy cattle in the transition period. Journal of reproduction and Development, v.56, n.S, p.S29-S35, 2010.
LEWIS, G. S. Steroidal regulation of uterine immune defenses. Animal reproduction science, v. 82–83, p. 281–294, 2004.
LEHNINGER, A. L.; NELSON, D. L.; MICHAEL, M. Principles of Biochemistry. 7th ed. New York: W.H. Freeman, 2017.
LITTLE, T. M.; HILLS, F. J. Agricultural experimentation: design and analysis. New York: John Wiley, 1978, 350p.
McART, J. A. A.; NYDAM, D. V.; OETZEL, G. R.; et al. Elevated non-esterified fatty acids and b-hydroxybutyrate and their association with transition dairy cow performance. The Veterinary Journal, v. 198, p. 560–570, 2013.
MIKUŁA, R; PRUSZYŃSKA-OSZMAŁEK, E ; PSZCZOŁA, M; ŁYCZKO, A; KOSTRO, K; NOWICKA, K; KOWALCZYK, A; KAMEL, R; KOŁODZIEJCZYK, N; WÓJTOWICZ, J; CIĄŻYŃSKA, M; KACZMARKOWSKA, J; NOWAKOWSKI, P; BOGUSŁAWSKA-TRYK, M; KOŁACZ, R. Changes in metabolic and hormonal profiles during transition period in dairy cattle – the role of spexin. BMC Veterinary Research, v. 17, p. 359, 2021.
PUCHALSKA, P.; CRAWFORD, P. A. Multi-dimensional roles of ketone bodies in fuel metabolism, signaling, and therapeutics. Cell metabolism, v. 25, n. 2, p. 262–284, 2017.
RAMNANAM, C.J., EDGERTON, D. S., KRAFT, G., & CHERRINGTON, A. D. Physiologic action of glucagon on liver glucose metabolism. Diabetes, obesity & metabolism, v. 13 Suppl 1, p. 118–125, 2011.
RABELO, E. CAMPOS, B. G. Fisiologia do período de transição. Ciência Animal Brasileira/Brazilian Animal Science, Goiânia, 2009.
RUTHERFORD. A. J, OIKONOMOU, G.; SMITH, R. F. The effect of subclinical ketosis on activity at estrus and reproductive performance in dairy cattle. Journal of Dairy Science, v. 99, n. 6, p. 4808-4815, June 2016.
SANTOS, J. E. P. Distúrbios metabólicos. In: BERCHIELLI, T. T.; PIRES, A. V.; OLIVEIRA, S. G. (Org.). Nutrição de ruminantes. 2. ed. Jaboticabal: Funep, 2011. p. 439-520.
SARAIVA, M.; O’GARRA, A. The regulation of IL-10 production by immune cells. Nature reviews. Immunology, v. 10, n. 3, p. 170–181, 2010.
SCHEIN, I. H.Cetose dos ruminantes. 2012. 35 p. Programa de Pós-graduação em Ciências Veterinárias, Universidade Federal do Rio Grande do Sul, Porto Alegre, 2012.
SVENSSON-ARVELUND, J., MEHTA, R.B., LINDAU, R., MIRRASEKHIAN, E., RODRIGUEZ-MARTINEZ, H., BERG, G., LASH, G.E, JENMALM, M.C, ERNERUDH,J .The human fetal placenta promotes tolerance against the semiallogeneic fetus by inducing regulatory T cells and homeostatic M2 macrophages. The journal of immunology, v. 194, n. 4, p. 1534–1544, 2015.
SORDILLO, L. M.; AITKEN, S. L. Impact of oxidative stress on the health and immune function of dairy cattle. Veterinary immunology and immunopathology, v. 128, n. 1–3, p. 104–109, 2009.
SOARES, G. S. L. Adaptive changes in blood biochemical profile of dairy goats during the period of transition. Revue Médicine Vétérinaire, p. 65–75, 2018.
SOUTO, R. J. C.; et al. Biochemical, endocrine, and histopathological profile of liver and kidneys of sheep with pregnancy toxemia. Pesquisa Veterinária Brasileira, v.39, n.10, p.780- 788, 2019.
SOUTO, R. J. C.; et al. Achados Bioquímicos, Eletrolíticos e Hormonais de Cabras Acometidas com Toxemia da Prenhez. Pesquisa Veterinária Brasileira, v. 33, n. 10, p.1174-1182, 2013.
SOUTO, R. J. C.; AFONSO, J. A. B. Toxemia da Prenhez. In: RIET-CORREA, F.; et al. Doenças de Ruminantes e Eqüídeos. 4. ed. São Paulo: MedVet, 2023. p.427-433.
SOUZA, R.C, SOUZA, R. C. Prevalência e diagnóstico de cetose bovina no Brasil e em Minas Gerais. Revista VeZ em Minas • Nº 126 • Jul./Ago./Set. 2015 • Ano XXIV.
TAUBER, Z, BURIANOVA, A, KOUBOVA K, MRSTIK, M, JIRKOVKA, M and CIZKOVA, K. The interplay of inflammation and placenta in maternal diabetes: insights into Hofbauer cell expression patterns. Frontiers in immunology, v. 15, 2024.
TAU, G, ROTHMAN, P. Biologic functions of the IFN-gamma receptors. Allergy. 1999 Dec;54(12):1233-51.
THRALL, M. A. Hematologia e Bioquímica Clínica Veterinária. 2ed. Rio de Janeiro: Guanabara Koogan, 2015, 678p
UNGER, R. H.; CHERRINGTON, A. D. Glucagonocentric restructuring of diabetes: a pathophysiologic and therapeutic makeover. The journal of clinical investigation, v. 122, n. 1, p. 4–12, 2012.
VOLP, A. C. P, ALFENAS, R. C. G; COSTA, N. M. B, MINIM, V. P. R, STRINGUETA, P.C, BRESSAN, J. Capacidade dos biomarcadores inflamatórios em predizer a síndrome metabólica: Inflammation biomarkers capacity in predicting the metabolic syndrome. Arquivos brasileiros de endocrinologia e metabologia, v. 52, n. 3, p. 537–549, 2008.
YAO, M, CHEN, Z, HE, X, LONG, J, XIA, X, LI, Z, YANG, Y, Ao L, XING, W, LIAN, Q, LIANG, H, XU, X. Cross talk between glucose metabolism and immunosuppression in IFN-γ-primed mesenchymal stem cells. Life science alliance, v. 5, n. 12, p. e202201493, 2022.
ZHANG, G., HAILEMARIAM, D., DERVISHI, E., GOLDANSAZ, S. A., DENG, Q., DUNN, S. M. and AMETAJ, B. N. Dairy cows affected by ketosis show alterations in innate immunity and lipid and carbohydrate metabolism during the dry off period and postpartum. Res Vet Sci. 2016.
Email: Eduardorangel612@gmail.com
