REGISTRO DOI: 10.69849/revistaft/th102412061633
Michelle Pinto Barro
INTRODUÇÃO
Proteger o coração de danos isquêmicos é um componente crítico de toda cirurgia cardíaca. Casos em uso de circulação extracorpórea (CEC) com pinçamento aórtico prejudicam a circulação coronariana e o suprimento de oxigênio necessário ao metabolismo aeróbio. Sem alterar as demandas metabólicas do coração, cerca de 15 a 20 minutos de isquemia podem resultar em danos irreversíveis e disfunção miocárdica. A estratégia para resolver esse dilema tem sido a redução intraoperatória do metabolismo cardíaco por meio de hipotermia e solução cardioplégica, que prolongaram com sucesso a duração segura do tempo de pinçamento cruzado (1).
O termo cardioplegia, se entendido literalmente como sendo a parada ou paralisia do coração, tem seu significado mais oculto baseado na exegese do termo, que corresponde a agressão, golpe, ataque, ferimento ou injúria do coração, muito diferente, portanto, do conceito geral que parece querer relacionar automaticamente cardioplegia com proteção miocárdica. Na verdade, a proteção miocárdica pode ser obtida com o auxílio de soluções cardioplégicas acrescidas de substratos, ou elementos que possibilitem a proteção desejada (2).
O desenvolvimento de uma técnica sofisticada de proteção miocárdica foi um importante catalisador na evolução da cirurgia cardiovascular moderna. A falha em proteger adequadamente o coração pode levar a consequências adversas graves, incluindo infarto do miocárdio, lesão de isquemia-reperfusão e síndrome cardíaca de baixo débito. Tais complicações estão associadas a internações mais prolongadas na unidade de terapia intensiva (UTI) e no hospital (3).
A solução cardioplégica deve promover a cardioplegia com segurança, criar condições favoráveis para a produção contínua de energia e eliminar os efeitos deletérios da isquemia e reperfusão. Para tanto, a composição da solução deve ter elementos que propiciem: 1. Parar o coração imediatamente, evitando depleção de energia; 2. Esfriar o miocárdio, diminuindo a demanda metabólica, ou, quando mantido aquecido, fornecer fluxo suficiente para manutenção do metabolismo aeróbio; 3. Fornecer substratos para o metabolismo aeróbio ou anaeróbio, ou ambos; 4. Ter efeito tampão contra acidose, que impede o metabolismo; 5. Estabilizar a membrana com drogas específicas; 6. Evitar o edema pela hiperosmolaridade (4).
Esta revisão tem como objetivo examinar os avanços mais recentes, as técnicas disponíveis e os desafios ainda existentes no uso da cardioplegia em cirurgias cardíacas. Busca-se oferecer uma análise abrangente e fundamentada que auxilie na identificação de estratégias mais eficazes e seguras para a proteção miocárdica. Ao abordar essas questões, espera-se contribuir para a melhoria contínua dos resultados cirúrgicos e para a otimização do cuidado ao paciente, promovendo desfechos mais favoráveis e redução de complicações associadas ao procedimento e injúria de reperfusão.
HISTÓRICO
Desde as primeiras cirurgias cardíacas com circulação extracorpórea (CEC) em 1953 com Dr. Gibbon no Massachusetts General Hospital, têm se estudado diversos métodos de proteção miocárdica, que permitissem cirurgias mais extensas do coração, com maior tempo de pinçamento da aorta. Nas primeiras cirurgias, a hipotermia vinha sendo o método de proteção miocárdica, mas mostrou-se insuficiente para tempos mais longos de isquemia (5)
Uma das preocupações mais urgentes após a cirurgia cardíaca aberta é o dano miocárdico perioperatório. Os cirurgiões devem equilibrar suas ações entre manter um campo imóvel e sem sangue para facilitar a precisão cirúrgica e limitar o dano miocárdico intraoperatório. A temperatura ideal para proteção miocárdica ainda é debatida. A hipotermia foi usada como base para a preservação miocárdica desde sua descoberta na década de 1950 até o início da década de 1990. O conceito de parada miocárdica foi introduzido pela primeira vez em 1955 por Melrose e colegas e era tradicionalmente realizado com o uso de solução cardioplégica hipotérmica enriquecida com potássio. Ainda frustrado pelas más condições operacionais e pela ameaça de embolia gasosa, Denis Melrose introduziu a cardioplegia com citrato de potássio em 1955. Na conclusão de sua comunicação histórica, Melrose afirmou que “este método pode oferecer uma oportunidade para uma cirurgia útil no coração imóvel, sem o perigo de embolia gasosa”. É interessante notar que Melrose não enfatizou o conceito de proteção miocárdica em seu relato. Na verdade, o pioneiro da cardioplegia cristaloide, Mark Braimbridge, declarou: “Todo o nosso edifício de proteção miocárdica cardioplégica foi construído com base no acaso. No final da década de 1950 e início da década de 1960, os investigadores questionavam a segurança da cardioplegia potássica. Em 1957, Peter Allen e C. Walton Lillehei alertou que a parada por citrato de potássio deve ser evitada, se possível, em pacientes que apresentem lesão miocárdica extensa por qualquer causa. Outros relataram a ocorrência frequente de disritmia após citrato de potássio (6).
Em 1977, foi relatado que a cardioplegia sanguínea terminal quente limitava a lesão de reperfusão após cardioplegia hipotérmica, e os resultados de estudos subsequentes mostraram recuperação acelerada e redução do distúrbio metabólico com esse método. Em 1983, a indução quente seguida de cardioplegia fria foi sugerida para proteção miocárdica. com base na premissa de que a indução de cardioplegia no coração isquêmico e com depleção de energia e substrato é a primeira fase da reperfusão e que a indução quente poderia ressuscitar ativamente o coração (7)
INJÚRIA DE REPERFUSÃO
Danos de reperfusão referem-se à necrose miocárdica irreversível observada durante a restauração da circulação coronariana após circulação extracorpórea. Graves distúrbios estruturais, funcionais e metabólicos comumente encontrados durante a reperfusão incluem edema miocárdico, acúmulo de cálcio celular, depleção de fosfato e glicogênio de alta energia e comprometimento da utilização cardíaca de oxigênio e substrato, com desempenho hemodinâmico suprimido. Acredita-se que tal dano resulte de lesão isquêmica oculta, ocorrida durante o pinçamento aórtico e desmascarada pela reperfusão, e/ou pela ativação de certos processos metabólicos durante a sequência isquêmico-reperfusional (8).
A lesão de reperfusão está, em grande parte, relacionada com a duração e gravidade anteriores da isquemia, porque a isquemia prepara o terreno para a lesão de reperfusão subsequente. Por exemplo, acredita-se que os radicais de oxigênio sejam gerados principalmente durante os primeiros momentos da reperfusão, com uma geração menor, mas persistente, durante as fases posteriores da reperfusão, momento em que o oxigênio contínuo está sendo fornecido ao miocárdio. Assim, o ambiente para a geração de radicais de oxigénio foi criado pelo evento isquémico, mas o oxigénio adequado (e a presença de geradores chave, tais como neutrófilos) para a produção de radicais não estão disponíveis até à reperfusão (9).
A ausência de oxigênio e substratos metabólicos para os cardiomiócitos que ocorre durante a isquemia pode causar alterações funcionais, estruturais e metabólicas. Durante a isquemia, as células miocárdicas passam do metabolismo aeróbico para o anaeróbico, resultando no acúmulo de lactato e na geração de acidose, levando à diminuição do pH intracelular, enquanto a contração miocárdica é prejudicada devido a alterações na homeostase do íon cálcio (10)
Baseado nestes conhecimentos e na descrição de Heyndrickx et al., em 1975, observa-se que a depressão miocárdica pós-isquemia/reperfusão é gerada por dois fatores: pela ligação de radicais livres de oxigênio liberadas no momento da reperfusão e pelo aumento da concentração intracelular de cálcio (calcium overload), que ocorre tanto durante a isquemia quanto durante a reperfusão, levando a uma grave disfunção sistólica e diastólica, que pode perdurar por minutos ou dias após a cirurgia cardíaca, trazendo tona a necessidade de proteção miocárdica durante a cardioplegia (4).
TIPOS DE CARDIOPLEGIA
O princípio básico de qualquer solução cardioplégica é o desacoplamento eletromecânico, que influencia as concentrações de íons extracelulares e intracelulares. Com isso, o consumo de energia do miocárdio é reduzido significativamente e a tolerância à isquemia é aumentada. Nos últimos anos, várias soluções cardioplégicas diferentes foram desenvolvidas, que são baseadas em uma solução eletrolítica cristalóide ou no sangue do paciente com eletrólitos adicionados. Contudo, não existem diretrizes ou recomendações nacionais ou internacionais para a escolha de soluções cardioplégicas para diferentes procedimentos de cirurgia cardíaca. Portanto, a seleção é amplamente baseada nas preferências pessoais do cirurgião. Além disso, isto deve ser constantemente adaptado às novas condições (11).
CARDIOPLEGIA SANGUINEA
No final da década de 1970, novas ideias influentes vieram dos protagonistas da cardioplegia sanguínea (Buckberg 1979; Barner et al. 1979). Assim Buckberg (como principal protagonista) afirmou ter encontrado uma solução para as discrepâncias entre diferentes “escolas” cristalóides de pensamento e prática. Com base na experiência inicial de Melrose, ele propôs o uso do sangue como veículo para um tipo extracelular, com níveis elevados de potássio e cardioplegia à base de cálcio reduzido. Uma série de vantagens aparentes foram propostas, como administrações regulares intermitentes para manter o metabolismo aeróbio, tamponamento pelo sangue em um pH ideal, e prevenção oncótica do inchaço celular e melhora na distribuição capilar (12)
A introdução da cardioplegia sanguínea seguiu a demonstração de que o miocárdio, mesmo parado e hipotérmico, mantinha a atividade celular, cujas necessidades poderiam ser melhor atendidas, com a oferta de oxigênio durante a administração das soluções (13). É uma solução rotineira e convencional que tem sido proposta como técnica segura e confiável para proteção miocárdica. Seu alto teor de potássio causa parada diastólica por meio da despolarização da membrana dos miócitos. O sangue, como meio de administração de cardioplegia, tem maior capacidade de transporte de oxigênio e está menos associado à hemodiluição (14).
Grande quantidade de reservas de ATP pode ser gasta no breve período de atividade eletromecânica antes da parada cardíaca farmacológica . Ocorre metabolismo aeróbico, com conseqüente aumento de produção de energia, quando a célula miocárdica, submetida à parada isquêmica, recebe oxigênio. Assim, com a reinfusão de cardioplegia sangüínea, os níveis de energia celular podem ser refeitos, graças ao metabolismo aeróbico (15).
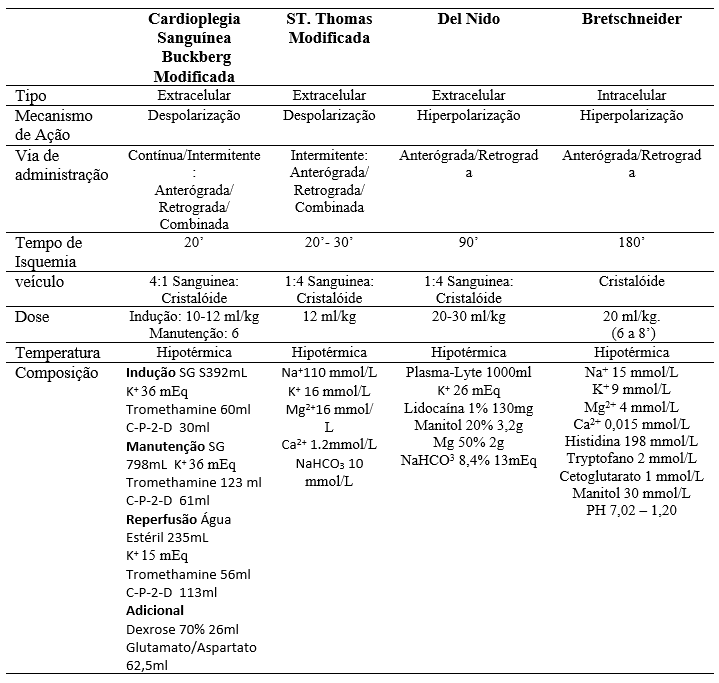
A cardioplegia de Buckberg modificada é uma solução à base de dextrose em solução salina normal com cloreto de potássio como agente despolarizante, trometamina como tampão e citrato fosfato dupla dextrose como quelante de cálcio e fornece sangue do paciente oxigenado 4:1 ao cristalóide. A solução de cardioplegia de Buckberg é administrada em três soluções: indução, manutenção e reperfusão. Durante a cirurgia cardíaca, uma dose de solução de indução é administrada primeiro para parar o coração e depois, a cada 15-20 minutos durante o curso da operação, a solução de manutenção é administrada para manter a parada cardíaca e para repor oxigênio e nutrientes ao coração. A dose de indução e manutenção são administradas a 4 C. O “hot shot” de reperfusão é administrado a 37°C imediatamente antes da remoção da pinça cruzada aórtica. A solução de reperfusão contém glutamato e aspartato, que são substratos de açúcar para fornecer nutrientes ao coração logo antes de ele começar a bater novamente (16).
CARDIOPLEGIA CRISTALÓIDE SANGUÍNEA
CARDIOPLEGIA ST THOMAS
Em 1975, a solução cardioplégica nº 1 do St. Thomas’ Hospital (STH) foi introduzida na prática clínica. Esta solução, que foi formulada com base em vários estudos experimentais em ratos e em cães, estendeu consideravelmente a duração da parada isquêmica tolerável sob condições normotérmicas e hipotérmicas. A solução foi preparada adicionando-se uma ampola de 20 ml contendo cloreto de potássio 16 mmol/L, cloreto de magnésio 16 mmol/L e procaína 1 mmol/L a 1 L de solução de Ringer. Esta solução teve então ampla utilização clínica em todo o mundo (17).
As investigações continuaram com o objetivo de descobrir como a composição desta solução poderia ser modificada para melhorar a proteção do coração. Como resultado, vários anos depois, foi desenvolvida uma formulação melhorada desta solução, conhecida como solução STH modificada ou solução STH No. 2 (STH 2). Embora ambos os tipos de soluções contivessem concentrações aumentadas de magnésio (16 mmol/L) e concentrações normais de íons cálcio, elas diferiam nas concentrações de íons potássio. O primeiro STH continha íons potássio na concentração de 20 mmol/L, enquanto o segundo continha um teor menor, ou seja, 16 mmol/L. O mecanismo responsável pelos efeitos destas soluções baseia-se na parada diastólica via despolarização da membrana (10).
A cardioplegia sanguínea com solução de São Tomás II é uma cardioplegia extracelular com alta concentração de potássio, que atua predominantemente por despolarização da membrana celular. Este método de parada envolve a perfusão de doses repetitivas de cardioplegia uma vez a cada 20-30 minutos. A dosagem repetitiva pode interromper a operação e resultar em proteção miocárdica inadequada se o momento da cardioplegia não for seguido adequadamente (18). Foram observados aumentos na acidose miocárdica entre as doses, afetando negativamente o resultado pós-operatório. Assim, seria benéfico se o intervalo entre as doses cardioplégicas pudesse ser aumentado, reduzindo assim o número de doses necessárias durante a cirurgia (19).
DEL NIDO
Pesquisadores da Universidade de Pittsburgh (Pittsburgh, PA) desenvolveram uma nova formulação para proteção miocárdica no início da década de 1990. Esta equipe, liderada por Pedro del Nido, Hung Cao-Danh, K. Eric Sommers e Akihiko Ohkado, acabou por patentear esta solução. Modificações foram feitas na solução original e agora é chamada de cardioplegia del Nido na literatura e na prática clínica (20).
Del Nido é uma solução extracelular acalcêmica de cardioplegia (alto teor de potássio e sódio, zero cálcio). A hiperpolarização das membranas durante a parada isquêmica reduz as necessidades metabólicas miocárdicas e, conseqüentemente, aumenta a proteção miocárdica, como evidenciado em estudos anteriores. Este princípio forma o núcleo da Del Nido, com o uso exclusivo de um bloqueador dos canais de sódio causando polarização da membrana do miócito. Além disso, medidas para reduzir a sobrecarga intracelular de cálcio no despinçamento pela inclusão de sulfato de magnésio na solução proporcionam proteção adicional, especialmente em corações pediátricos com capacidade imatura de manipulação de cálcio (21).
A cardioplegia Del Nido (DN) consiste em uma proporção de 1:4 de solução de mistura de sangue-cristalóide. É preparado com Plasma-Lyte, que possui quantidade semelhante de eletrólito ao líquido extracelular. A cardioplegia DN exerce seu efeito proporcionando parada hipercalêmica. Ao contrário da cardioplegia sanguínea, contém magnésio, manitol e lidocaína. Enquanto o magnésio evita o acúmulo de íons cálcio intracelulares, a lidocaína bloqueia os canais de sódio e prolonga a duração da parada hiperpolarizante. Além disso, o manitol reduz o edema miocárdico aumentando a osmolaridade e remove os radicais livres. Embora a cardioplegia DN seja uma cardioplegia extracelular, ela pode proporcionar longos períodos de parada. Proporciona parada cardioplégica por mais de 90 minutos com dose única (22).
Os desenvolvedores da caridoplegia DN recomendam uma dose de indução de 20 ml/kg, com dose máxima de parada de 1.000 ml em pacientes com peso superior a 50 kg. Doses adicionais da cardioplegia DN são preferíveis em corações hipertrofiados, insuficiência aórtica ou doença arterial coronariana significativa. Uma dose de 10 ml/kg pode ser usada quando o tempo de clampeamento esperado for inferior a 30 minutos (21).
No entanto, a parte cristalóide da cardioplegia DN pode estar ligada com hemodiluição que causa problemas na estratégia de conservação do sangue. Esta desvantagem pode ser resolvida substituindo a parte cristalóide da DN pelo sangue total coletado do oxigenador. A cardioplegia DN de sangue total tem muitos atributos adicionais, como acesso gratuito, eliminação de radicais, melhor fornecimento de oxigênio e redução no grau de hemodiluição e edema miocárdico. Vários estudos mostraram que a cardioplegia sanguínea total tem vantagens adicionais em relação à cardioplegia tradicional em termos de menor permanência na UTI e internação hospitalar estadia, incidências infrequentes de síndrome de baixo débito cardíaco pós-operatório, baixo pós-operatório lesão renal e melhor proteção miocárdica na cirurgia de revascularização do miocárdio. Por outro lado, alguns relatórios descreveram maior taxa de lesão renal aguda, mortalidade hospitalar e transfusão de sangue em pacientes idosos que receberam cardioplegia de sangue total em comparação com cardioplegia diluída (23).
Em um estudo retrospectivo por C. Eris, M. Engin, B. Erdolu et al. com o objetivo de comparar os resultados operatórios e pós-operatórios imediatos do uso da solução del Nido (DN) com a tradicional cardioplegia sanguínea em cirurgia aórtica de adultos, demonstrou que em comparação com o cardioplegia sanguínea convencional, a DN proporcionou tempos de clampeamneto significativamente mais curtos, reduziu a necessidade de desfibrilação intraoperatória, reduziu os níveis pós-operatórios de troponina de alta sensibilidade com resultados clínicos precoces comparáveis para pacientes adultos submetidos à cirurgia aórtica. A DN é uma alternativa segura e eficiente à solução tradicional de cardioplegia sanguínea em cirurgia cardíaca aórtica em adultos (24).
CARDIOPLEGIA CRISTALÓIDE
CUSTODIOL
A solução Histidina-Triptofano-Cetoglutarato (HTK), desenvolvido pelo fisiologista alemão Hans Jürgen Bretschneider na Universidade de Göttingen no início dos anos 1970 (com a marca Custodiol® pela Essential Pharmaceuticals), Durham, NC, EUA, foi proposto como um substituto para agentes sanguíneos e outras cardioplegias convencionais, com até a 3 h de proteção miocárdica em conjunto com hipotermia (25). Além disso, esta solução foi introduzida na prática clínica em 1977 e modificada na década de 1980. Embora a solução HTK tenha sido destinada principalmente ao uso em cirurgia cardíaca, ela encontrou lugar na preservação de outros órgãos, como fígado, pâncreas e rins. Atualmente, após modificações posteriores, está disponível como Custodiol® e tem sido amplamente aplicado como estratégia cardioplégica para proteção miocárdica (10).
A solução HTK (Custodiol ®) é uma solução cristaloide com baixa concentração de sódio e cálcio, que atua causando a hiperpolarização da membrana plasmática do miócito pela depleção do sódio no espaço extracelular, induzindo parada cardíaca na diástole (ao contrário da cardioplegia convencional – despolarizante)5. Contém também vários outros componentes benéficos: histidina/cloridrato de histidina, que fornece capacidade tampão para tratar a acidose induzida por isquemia; triptofano, que protege as membranas celulares; alfa-cetoglutarato, que ajuda a estabilizar as membranas celulares e serve de substrato para o metabolismo anaeróbico; e manitol, que mantém a osmolalidade do ambiente celular e, assim, previne o edema celular (3). A solução HTK tem sido aclamada como proteção ideal das cirurgias cardíacas de longa duração, sendo utilizada de rotina no transplante cardíaco, cirurgias pediátricas complexas, aneurismas de aorta e reoperações valvares na maioria dos centros, por oferecer proteção miocárdica por até 3 horas com infusão única da solução. Entretanto, esta solução requer cuidados específicos, como o manuseio da hipervolemia (são 20 – 25 ml/kg de solução infundidos logo após o pinçamento da aorta) e da acidose metabólica, comuns com a utilização desta solução (5)
Kantathut N, et al (2019) realuzou um estudo comparativo sobre a eficácia da cardioplegia del Nido modificada e da solução HTK (Custodiol) em cirurgias valvares, levantou se o questionamento sobre qual técnica proporciona melhor proteção miocárdica. Ambos os métodos apresentaram resultados semelhantes em relação aos níveis de troponina T e fração de ejeção. Contudo, del Nido destacou-se pela menor incidência de fibrilação ventricular após a remoção do pinçamento aórtico, menor necessidade de transfusões e tempos reduzidos de internação hospitalar. Apesar disso, ambos os grupos demonstraram mortalidade hospitalar nula e taxas de sobrevida equivalentes a longo prazo, confirmando a eficácia de ambas as estratégias em diferentes contextos cirúrgicos (26).
Apesar do seu uso generalizado na Europa, existem muito poucos dados comparando a eficácia do Custodiol com sangue convencional ou cardioplegia cristalóide. Há também escassez de dados comparando o Custodiol com outras soluções para preservação do coração em transplantes. Existe preocupação quanto à adequação da proteção miocárdica oferecida por apenas uma dose de cardioplegia. Da mesma forma, foram levantadas preocupações sobre a hiponatremia que se segue à administração rápida do elevado volume necessário desta solução cardioplégica com baixo teor de sódio
(27)
TABELA 1 – TIPOS DE CARDIOPLEGIA
CARDIOPLEGIA NORMOTÉRMICA VERSUS HIPOTERMIA
O debate sobre a temperatura ideal da cardioplegia durante a cirurgia cardíaca tem sido um dos aspectos mais importantes da proteção miocárdica. As primeiras técnicas cardioplégicas usavam soluções cristaloides frias para iniciar e manter a parada cardíaca durante a cirurgia cardíaca e permaneceram como a pedra angular da prática cirúrgica cardíaca desde sua introdução no início da década de 1950. Embora possa diminuir a demanda miocárdica de oxigênio e o risco de dano isquêmico, a cardioplegia fria pode inibir as enzimas miocárdicas e resultar no atraso na recuperação cardíaca metabólica e funcional após a cirurgia. Na esperança de maximizar a proteção miocárdica intraoperatória, a cardioplegia sanguínea quente foi introduzida pela primeira vez na década de 1970, e a técnica de indução quente seguida de cardioplegia fria ou reperfusão terminal de cardioplegia quente (hot-shot) foi aplicada clinicamente e considerada eficaz para proteção miocárdica. Posteriormente, perfusões contínuas e intermitentes de cardioplegia sanguínea quente foram introduzidas na década de 1980 e provaram fornecer excelente proteção miocárdica durante cirurgia cardíaca (28).
A importância da hipotermia foi introduzida pela primeira vez por Bigelow e colegas, e Shumway,e Lower, através do uso de hipotermia sistêmica ou tópica. Os benefícios da hipotermia foram enfatizados pelos primeiros estudos do laboratório do Dr. Hearse em Londres, que mostram maior recuperação percentual da função contrátil em corações que ficaram isquêmicos por sessenta minutos à medida que a temperatura miocárdica diminuiu de 36 para 4°C. À medida que a temperatura miocárdica durante a isquemia diminui, a extensão da recuperação funcional pós-isquêmica aumenta substancialmente. Estudos subsequentes também demonstraram que a parada cardíaca é aditiva à cardioproteção da hipotermia (9)
Na maioria dos estudos, foram comparadas cardioplegia fria e quente. Nas metanálises publicadas por Abah et al. em 2012 e por Fan et al. em 2018, a cardioplegia sanguínea fria e quente não foi significativamente diferente em relação à mortalidade geral, infarto do miocárdio (IM), síndrome de baixo débito cardíaco, uso de balão intra-aórtico (BIA) ou desenvolvimento de ritmo de fibrilação atrial (FA), embora os grupos com cardioplegia quente tiveram melhor desempenho hemodinâmico e menor lesão cardiocitária (29)
TÉCNICA DE INFUSÃO DA CARDIOPLEGIA
A cardioplegia é administrada a partir de um recipiente ou com a ajuda de uma bomba de roletes – parte da máquina coração-pulmão. No primeiro caso, temos uma solução pré-misturada em um recipiente que pode ser pressurizado ou a solução pode ser infundida em pressão hidrostática, ajustando a altura do recipiente sobre o coração para manter uma pressão específica relativa. No segundo cenário, a máquina oferece alguns benefícios, como controle da pressão de entrega, vazão e temperatura. Quanto à via de administração cardioplégica – existe a infusão anterógrada (na raiz da aorta/óstios coronarianos, enxertos), retrógrada (seio coronariano) ou combinada. A dose total pode ser calculada em mL/kg, em minutos para o tempo total de infusão ou, em alguns centros, é preferida a administração contínua. No caso de uma válvula aórtica competente, a infusão na raiz da aorta pode ser realizada com segurança. A cardioplegia é administrada por meio de um cateter colocado entre a pinça aórtica e os óstios coronários. Deve-se ter cuidado durante a administração cardioplégica em relação a: aplicação de pressão, distensão do ventrículo esquerdo (VE), avaliação palpatória da pressão na aorta ascendente, cessação da atividade eletromecânica e lavagem da solução através do cateter de ventilação do VE. A alta pressão de infusão pode causar edema miocárdico e lesões coronarianas; a dilatação do VE pode induzir disfunção pós-operatória do VE (25)
Em 1955, LILLEHEI et al. usaram pela primeira vez a perfusão retrógrada do seio coronário para operações da valva aórtica. Passados 15 anos, entretanto, a cardioplegia anterógrada continuava a ser o método mais empregado nas intervenções para revascularização do miocárdio; porém o aumento da complexidade das operações despertou o interesse pela cardioplegia retrógrada. Em 1992, 72% dos cirurgiões cardiovasculares dos Estados Unidos utilizavam a cardioplegia retrógrada; diferente de 1985, quando 90% deles nunca haviam utilizado o método (30). O método de cardioplegia retrógrada é considerado superior nos pacientes com lesão importante do tronco da artéria coronária esquerda e nos pacientes submetidos a uma nova cirurgia de revascularização miocárdica (reoperação) (31)
DESAFIOS
Apesar do progresso considerável nas últimas décadas, os desafios no campo da cardioplegia continuam. O principal desafio atual é a falta de soluções ideais para parada cardíaca e de estratégias ideais para seu uso. Embora uma variedade de preparações para cardioplegia esteja disponível, desde cristaloides até soluções sanguíneas, a literatura científica não determinou qual é a melhor e que proporciona o menor número de complicações e os melhores resultados para os pacientes. Outro desafio é a necessidade de personalizar soluções de cardioplegia em múltiplos níveis de complexidade. Idade, comorbidades, função ventricular e complexidade do procedimento são importantes na seleção da proteção miocárdica adequada. Porém, devido à falta de protocolo, é impossível fazer isso de forma eficaz. Além disso, a lesão de isquemia-reperfusão continua a ser uma questão importante. Mesmo com o uso de soluções avançadas de cardioplegia, não é possível proteger completamente os cardiomiócitos durante a fase de reperfusão. Portanto, é crucial encontrar formas de minimizá-los para melhorar os resultados pós-operatórios e reduzir a mortalidade e morbidade associadas. Finalmente, a falta de estudos comparativos randomizados e controlados de diversas soluções e tipos de cardioplegia dificulta o desenvolvimento de diretrizes. A resolução destes problemas requer investigação e inovação contínuas, e a colaboração entre diferentes disciplinas é fundamental.
CONCLUSÃO
Atualmente, não existem diretrizes definitivas que recomendem o uso de uma solução cardioplégica específica, e a literatura ainda não comprova a superioridade de uma solução sobre outra. A padronização do método ou da solução ideal continua sendo um tema controverso, em grande parte devido à escassez de estudos que comparem de forma clara e detalhada as vantagens e desvantagens das diversas soluções disponíveis. Embora cada solução tenha sido avaliada individualmente quanto ao seu impacto nos desfechos clínicos, ainda são limitadas as pesquisas que realizam comparações diretas entre elas, o que dificulta a formulação de um consenso robusto na prática clínica.
Fato é que existem cardioplegia hipotérmicas ou isotérmicas, sanguíneas ou cristaloides, anterógradas e/ou retrógradas, tempo-dependente ou dose-dependente, com tempo de isquemia curto ou longo e de baixo ou alto volume. A programação cirúrgica deve levar em consideração as características do paciente a ser operado e o tempo cirúrgico previsto. Padronizar um tipo de cardioplegia no seu serviço pode ser muito conveniente e seguro, todavia quanto mais diversificado são os casos operados, maior deve ser a gama de técnicas disponíveis para melhor se adequar às necessidades dos pacientes.
REFERÊNCIA:
Fryer, M. L., & Balsam, L. B. (2022). Commentary: Single-dose cardioplegia: Adjusting the brew. The Journal of Thoracic and Cardiovascular Surgery, 163(6), e449–e450.
Oliveira, M. A. B., Godoy, M. F., Braile, D. M., & Lima-Oliveira, A. P. M. (2005). Solução cardioplégica polarizante: estado da arte. Brazilian Journal of Cardiovascular Surgery, 20(1), 61–67.
Vivacqua, A., Robinson, J., Abbas, A. E., Altshuler, J. M., Shannon, F. L., Podolsky, R. H., & Sakwa, M. P. (2020). Single-dose cardioplegia protects myocardium as well as traditional repetitive dosing: A noninferiority randomized study. The Journal of Thoracic and Cardiovascular Surgery, 159(5), 1887–1894.e3.
Cressoni, E. S., Avanci, L. E., Braile, D. M., Cicogna, A. C., Lima-Oliveira, A. P. M., Gerez, M. A. E., & Martins, A. S. (2008). Proteção miocárdica ao coração hipertrofiado: o eterno desafio. Revista Brasileira de Cirurgia Cardiovascular, 23(1), 97–107.
Abdouni, A. A. (2020). Proteção miocárdica na cirurgia cardíaca – Qual o método ideal? Arquivos Brasileiros de Cardiologia, 115(2), 251–252.
Shiroishi, M. S. (1999). Myocardial protection: The rebirth of potassium-based cardioplegia. Journal of Cardiac Surgery, 26(1), 5–13. DOI: 10.1111/j.1540-8191.1999.tb00092.x.
James, T. M., Nores, M., Rousou, J. A., Lin, N., & Stamou, S. C. (2020). Warm blood cardioplegia for myocardial protection: Concepts and controversies. Texas Heart Institute Journal, 47(2), 115–120.
Kao, R. L., & Magovern, G. J. (1986). Prevention of reperfusional damage from ischemic myocardium. The Journal of Thoracic and Cardiovascular Surgery, 91(1), 163–170.
Vinten-Johansen, J., & Thourani, V. H. (2000). Myocardial protection: An overview. The Journal of Extra-Corporeal Technology, 32(1), 48–61.
Bradić, J., Andjić, M., Novaković, J., Jeremić, N., & Jakovljević, V. (2023). Cardioplegia in open heart surgery: Age matters. Journal of Clinical Medicine, 12(4), 1698.
Glöckner, A., Ossmann, S., Ginther, A., Kang, J., Borger, M. A., Hoyer, A., & Dieterlen, M. T. (2021). Relevance and recommendations for the application of cardioplegic solutions in cardiopulmonary bypass surgery in pigs. Biomedicines, 9(12), 1279.
Gunnes, S., & Jynge, P. (2011). Fundamentals of the Past: Cardioplegia: The First Period Revisited. Springer.
Souza, M. H. L., & Elias, D. O. (2006). Fundamentos da Circulação Extracorpórea (2nd ed.). Rio de Janeiro.
Sen, O., Aydin, U., Kadirogullari, E., Güler, S., Gonca, S., Solakoğlu, S., Karaçalılar, M., Timur, B., & Onan, B. (2022). Custodiol versus blood cardioplegia: Comparison of myocardial immunohistochemical analysis and clinical outcomes. Brazilian Journal of Cardiovascular Surgery, 37(5), 680–687.
Murad, H., de Queiroz, A. D. R., de Mattos, S. C., Piedade, M. M., de Albuquerque, P. C. C., Murad, L. H. F., Pereira, G. C., Bastos, E. S., & Jazbik, A. P. (1983). Proteção miocárdica por cardioplegia sanguínea durante circulação extracorpórea. Avaliação ultraestrutural miocárdica no cão. Arquivos Brasileiros de Cardiologia, 41(4), 231–239.
Kim, K., Ball, C., Grady, P., & Mick, S. (2014). Use of del Nido cardioplegia for adult cardiac surgery at the Cleveland Clinic: Perfusion implications. Journal of Extra-Corporeal Technology, 46, 317–323.
Ledingham, S. J. M., Braimbridge, M. V., & Hearse, D. J. (1987). The St. Thomas’ Hospital cardioplegic solution. The Journal of Thoracic and Cardiovascular Surgery, 93(2), 219–223.
Mohammed, S., Menon, S., Gadhinglajkar, S. V., Baruah, S. D., Ramanan, S. V., Gopalakrishnan, A., P R, S., & Dharan, B. S. (2022). Clinical outcomes of del Nido cardioplegia and St Thomas blood cardioplegia in neonatal congenital heart surgery. Annals of Cardiac Anaesthesia, 25(1), January-March.
Mishra, P., Jadhav, R. B., Mohapatra, C. K. R., Khandekar, J., Raut, C., Ammannaya, G. K., Seth, H. S., Singh, J., & Shah, V. (2016). Comparison of del Nido cardioplegia and St. Thomas Hospital solution – two types of cardioplegia in adult cardiac surgery. Kardiochirurgia i Torakochirurgia Polska, 13(4), 295–299.
Matte, G. S., & del Nido, P. J. (2012). History and use of del Nido cardioplegia solution at Boston Children’s Hospital. The Journal of ExtraCorporeal Technology, 44, 98–103.
Valooran, G. J., Nair, S. K., Chandrasekharan, K., Simon, R., & Dominic, C. (2016). del Nido cardioplegia in adult cardiac surgery – scopes and concerns. Perfusion, 31(1), 6–14.
Sanrı, U. S., Özsin, K. K., Toktaş, F., & Yavuz, Ş. (2021). Comparison of Del Nido Cardioplegia and Blood Cardioplegia in Terms of Development of Postoperative Atrial Fibrillation in Patients Undergoing Isolated Coronary Artery Bypass Grafting. Braz J Cardiovasc Surg, 36(2), 158–164.
Haider, A., Khwaja, I. A., Khan, A. H., Yousaf, M. S., Zaneb, H., Qureshi, A. B., & Rehman, H. (2021). Efficacy of Whole-Blood Del Nido Cardioplegia Comared with Diluted Del Nido Cardioplegia in Coronary Artery Bypass Grafting: A Retrospective Monocentric Analysis of Pakistan. Medicina (Kaunas), 57(9), 918.
Eris, C., Engin, M., Erdolu, B., & As, A. K. (2022). Comparison of del Nido Cardioplegia vs. Blood Cardioplegia in Adult Aortic Surgery: Is the Single-Dose Cardioplegia Technique Really Advantageous? Asian Journal of Surgery, 45(11), 1122-1127.
Ghiragosian, C., Harpa, M., Stoica, A., Sânziana, F. O., Bălău, R., Al Hussein, H., Ghiragosian-Rusu, S. E., Neagoe, R. M., & Suciu, H. (2022). Theoretical and Practical Aspects in the Use of Bretschneider Cardioplegia. Journal of Clinical Medicine, 9(6), 178.
Kantathut, N., Luangpatom-aram, K., Khajarern, S., Leelayana, P., & Cherntanomwong, P. (2023). Comparison of Single-Dose Cardioplegia in Valvular Heart Surgery: Lactated Ringer’s-Based del Nido vs. Histidine-Tryptophan-Ketoglutarate Cardioplegia Solution. Braz J Cardiovasc Surg, 38(6), e20220447.
Edelman JJB, Seco M, Dunne B, Matzelle SJ, Murphy M, Joshi P, et al. Custodiol for myocardial protection and preservation: a systematic review. Ann Cardiothorac Surg. 2013;2(6):717-28.
Fan, Y., Zhang, A.-M., Xiao, Y.-B., Weng, Y.-G., & Hetzer, R. (2010). Warm versus cold cardioplegia for heart surgery: A meta-analysis. European Journal of Cardio-Thoracic Surgery, 37(4), 912-919.
Saclı H, Kara I, Diler MS, Percin B, Turan AI, Kırali K. The relationship between the use of cold and isothermic blood cardioplegia solution for myocardial protection during cardiopulmonary bypass and the ischemia–reperfusion injury. Ann Thorac Cardiovasc Surg. 2019;25:296-303.
Paes Leme, M., Jazbik, A., Murad, H., Bastos, E., Brito, J. D., Giambroni, R., Azevedo, J. A., & Feitosa, L. (1997). Cardioplegia retrógrada atrial: estudo clínico. Revista Brasileira de Cirurgia Cardiovascular, 12(2), 169-175.
Sobrosa, C. G., Jansson, E., Kaijser, L., & Bomfi, M. (2005). Metabolismo miocárdico após cardioplegia sangüínea hipotérmica retrógrada contínua com indução anterógrada normotérmica. Braz. J. Cardiovasc. Surg., 20(4), 466-472.
