BACTERIAL ENDOCARDITIS
REGISTRO DOI: 10.69849/revistaft/ch10202411300938
Juliana Dias Borges1
Resumo
A endocardite bacteriana é uma inflamação do endocárdio causado por bactérias, que afetam principalmente as válvulas cardíacas e pode levar a complicações graves. Este estudo teve como objetivo investigar a endocardite bacteriana, com foco nas causas, sintomas, diagnósticos e tratamentos, assim como, analisar casos clínicos específicos para demonstrar as variações na manifestação e no manejo da condição. Trata-se de uma revisão integrativa da literatura, com pesquisa nas bases de dados Springer Link, PubMed e Google Scholar, em trabalhos publicados em um período de dez anos (2014 a 2024). As causas da endocardite bacteriana variaram entre os estudos, como patógenos Staphylococcus aureus, Lactobacillus acidophilus, Enterococcus faecium, e Streptococcus viridans e, complicações associadas à Covid-19. Os sintomas comuns foram febres, mialgia, falta de ar, edema e fraqueza. O diagnóstico foi feito por ecocardiografia e hemoculturas, revelando vegetações cardíacas e abscessos. Os tratamentos incluíram antibióticos como nafcilina, vancomicina e meropenem, como também, cirurgias em casos mais graves. A combinação de tratamento antimicrobiano e intervenção cirúrgica mostrou-se mais eficaz na redução da mortalidade e das complicações.
Palavras-chave: endocárdio, inflamação, endocardite bacteriana.
Abstract
Bacterial endocarditis is an inflammation of the endocardium caused by bacteria, which mainly affect the heart valves and can lead to serious complications. This study aimed to investigate bacterial endocarditis, focusing on the causes, symptoms, diagnosis and treatments, as well as to analyze specific clinical cases to demonstrate the variations in the manifestation and management of the condition. This is an integrative literature review, with research in the Springer Link, PubMed and Google Scholar databases, in works published in a ten-year period (2014 to 2024). The causes of bacterial endocarditis varied between studies, such as pathogens Staphylococcus aureus, Lactobacillus acidophilus, Enterococcus faecium, and Streptococcus viridans and complications associated with Covid-19. Common symptoms were fever, myalgia, shortness of breath, edema and weakness. The diagnosis was made by echocardiography and blood cultures, revealing cardiac vegetations and abscesses. Treatments included antibiotics such as nafcillin, vancomycin and meropenem, as well as surgery in more severe cases. The combination of antimicrobial treatment and surgical intervention was shown to be more effective in reducing mortality and complications.
Keywords: endocardium, inflammation, bacterial endocarditis.
Introdução
A endocardite é um dos diagnósticos mais ameaçadores em cirurgia cardíaca1 e refere-se à inflamação do endocárdio, uma camada interna do coração. Quando essa inflamação é provocada por agentes infecciosos, como fungos e vírus, é classificada como endocardite infecciosa. Porém, se houver um estado de bacteremia, ou seja, presença de bactérias na corrente sanguínea, e essas bactérias colonizarem os tecidos cardíacos já comprometidos, causando infecção local, essa condição é chamada de endocardite bacteriana2.
A endocardite pode ser classificada em dois tipos principais: a aguda que progride de forma rápida, com febre e danos graves às estruturas cardíacas, com risco de morte em poucas semanas se não tratada; e a subaguda, com curso lento, podendo durar semanas ou meses com progressão gradual, podendo se agravar se houver evento embólico significativo ou ruptura de estruturas cardíacas3.
Particularmente, a endocardite bacteriana, uma condição rara e muitas vezes fatal, antes da antibioticoterapia, é uma infecção que atinge o endocárdio, estando associada às válvulas cardíacas4,5. A sua incidência anual tem uma variação que depende do contexto geográfico e socioeconômico, com taxas entre 3 a 10 casos por 100.000 pessoas4.
Tem como principal característica a formação de vegetações intracardíacas, principalmente nas válvulas, em aglomerados compostos por plaquetas, fibrinas infectada, células inflamatórias e bactérias em diferentes fases de crescimento2,4. Os patógenos bacterianos acessam a corrente sanguínea e aderem a válvulas cardíacas danificadas ou as superfícies do endocárdio. Os microfilmes bacterianos podem levar a destruição valvar, ocasionar a insuficiência cardíaca, êmbolos sépticos e complicações graves6.
Diante disso, este estudo tem como objetivo investigar a endocardite bacteriana, com foco nas causas, sintomas, diagnósticos e tratamentos, assim como, analisar casos clínicos específicos para demonstrar as variações na manifestação e no manejo da condição.
Métodos
Trata-se de uma revisão integrativa da literatura, com síntese do conhecimento e de resultados de estudos realizados na prática. Para isso, seguiu-se as seguintes etapas: elaboração da problemática; pesquisa de estudos em bases de dados; extração de dados e registro em planilha dos principais resultados; avaliação e interpretação; comparação e integração dos estudos.
Foi utilizado a estratégia PICOS (acrônimo para P: paciente, I: intervenção, C: comparação/controle, O: resultado, S: Study design): P (Indivíduos com diagnóstico de endocardite bacteriana); I (tratamentos com antibióticos, intervenção cirúrgica, outros); C: (tratamento padrão versus regimes mais novos); O (Redução da mortalidade, controle da infecção, prevenção de complicações, melhorias nos desfechos); S (Relato de caso, revisão, estudo retrospectivo, coorte). Com isso, pretende-se responder a seguinte problemática: Qual a eficácia do tratamento antimicrobiano em comparação ao tratamento combinado com intervenção cirúrgica na redução da mortalidade e complicações em pacientes com endocardite bacteriana?
Para responder essa pergunta foi realizada uma busca nas bases de dados Springer Link, PubMed e Google Scholar, em trabalhos publicados em um período de dez anos (2014 a 2024), dando prioridades a publicações mais recentes, principalmente dos últimos cinco anos.
Critérios de inclusão e exclusão
Os critérios de inclusão foram 1) estudos que envolvem indivíduos diagnosticados com endocardite bacteriana (de diferentes etiologias); 2 ) Trabalhos que avaliem o uso de tratamento antimicrobiano, intervenção cirúrgica ou combinação de ambos; 3) Estudos que comparem o tratamento padrão com regimes mais novos ou combinações de tratamentos, incluindo tratamentos cirúrgicos; 4) Estudos que apresentem resultados relacionados à redução da mortalidade, controle da infecção, prevenção de complicações e melhoria dos desfechos clínicos; 4) Estudos publicados entre 2014 e 2024, com prioridade para estudos dos últimos cinco anos.
Foram excluídos 1) estudos que não incluíam pacientes com diagnóstico de endocardite bacteriana; 2) Trabalhos que não abordaram o uso de tratamento antimicrobiano, intervenção cirúrgica ou combinação dos dois; 3) Estudos que não abordem a comparação entre os tratamentos padrões e alternativos e, que não explorem os desfechos de interesse (mortalidade, controle da infecção, outro); 4) Estudos publicados antes de 2014. A Figura 1 mostra como foi realizado o processo de inclusão e exclusão dos estudos.
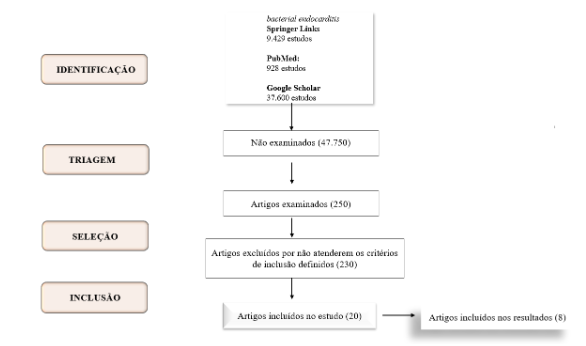
Figura 1 – Processo de seleção dos estudos.
Fonte: Autores (2024)
Organização dos dados
As principais informações dos estudos foram organizadas no Quadro 1, como ano, autor, tipo de estudo, bases de dados, revista. No Quadro 2 foram apresentados a síntese dos estudos realizados na prática.
Análise dos dados
Os dados incluídos na pesquisa foram analisados e as principais informações sintetizadas, interpretadas e comparadas, com integração dos estudos.
Resultados
O Quadro 1 apresenta os estudos incluídos nesta revisão integrativa da literatura (20 estudos) sobre a “Endocardite Bacteriana”, dividido em ano, autor, tipo de estudo, base de dados utilizadas e, a revista em que foi publicado o artigo. Dos estudos incluídos neste estudo, 14 (quatorze) foram extraídos da base de dados PubMed, 4 (quatro) do Google Scholar e 2 (dois) estudos da Springer Link.
Quadro 1 – Estudos incluídos nesta revisão.
ANO AUTOR TIPO DE ESTUDO BASE DE DADOS REVISTA 2014 Barroso2 revisão Google scholar Rev. Ciênc. Estud. Acad. Med. 2015 Kim7 relato de caso PubMed Circulation 2016 Encarnacion8 relato de caso PubMed Tex Heart Inst J. 2017 Vilcant3 revisão Google scholar Europe PMC 2018 Haas9 coorte PubMed Int J Cardiol 2019 Teixeira4 revisão narrativa Google scholar Rev. Soc. Port. Anestesiol. 2019 Paraguassu5 revisão Google scholar OHDM-Oral Health Dent Manag. 2019 Ostovar1 retrospectivo PubMed Thorac Cardiovasc Surg 2019 Liesenborghs10 análise PubMed Eur Heart J 2019 Damlin11 coorte PubMed BMC Infect Dis 2020 Amir12 relato de caso PubMed Int J Infect Dis 2021 Babes13 retrospectivo PubMed Medicina 2021 Bajdechi14 relato de caso PubMed Exp Ther Med 2022 Deppe15 retrospectivo PubMed Clin Oral Investig 2022 Thoresen16 retrospectivo PubMed BMC Oral Health 2023 Barahimi17 relato de caso Springer Link J Med Case Rep 2023 Bele6 revisão PubMed Cureus 2024 Ishikawa18 relato de caso Springer Link J. Thorac Cardiovasc Surg Cases 2024 Rasmussen19 revisão PubMed Clin Microbiol Infect 2024 Fragner20 relato de caso PubMed Cureus
Fonte: Dados da Pesquisa.
Fonte: Autores (2024)
O Quadro 2 apresenta um resumo dos casos de endocardite bacteriana abordados em diferentes estudos, com destaque para a idade dos pacientes, causas, sintomas, exames realizados, tratamentos e desfechos clínicos.
Quadro 2 – Síntese dos estudos incluídos empíricos na revisão.
Autor, ano Paciente (n)Idade CausaSintomas Exames Tratamento Desfecho Kim7 et al., 2015 n: 1 (homem)Idade: 37 anos Histórico Clínico: Grande defeito septal atrial secundum
Tratamento: Fechamento transcateter com oclusor septal Amplatzer de 24 mm
Sintomas:Febre alta (até 40 °C) por 4 dias,Mialgia,Desenvolvimento de múltiplas lesões maculares eritematosas: Palmas das mãos e solas dos pés (Pequenas e indolores, compatíveis com lesões de Janeway)
Evento anterior a febre: Raspagem periodontal sem profilaxia antibiótica.hemoculturas desenvolveram Staphylococcus aureus
Ecocardiografia Transesofágica:Massa hiperecogênicaTamanho: 2,1 × 1,4 cmPresa ao lado atrial direito do ASOEnvolve a borda aórtica, estendendo-se até a fibrosa intervalvar
Compatível com abscesso da raiz aórticacirurgia para remover o ASO Pós-operatório: Tratamento antibiótico (6 semanas)
Medicações: Nafcilina, Rifampicina, Gentamicina
Sem complicações adicionais
Alta após recuperação completaEncarnacion8 et al., 2016 n: 1 (homem)Idade: 48 anos Histórico: taquicardia supraventricular paroxística,regurgitação aórtica leve e implantação (4 anos antes) de pontes dentárias superiores e inferiores
Sintomas: falta de ar ao esforço, aumento do edema de extremidade inferior, 3 meses de febre intermitente (100,4 a 102,9 °F) e dor abdominal no quadrante superior esquerdo.Distensão venosa jugular: 12 cmSopro holossistólico grau III/IV na borda esternal inferior esquerdaCrepitações nas bases pulmonares bilateralmenteEsplenomegaliaEdema depressível 3+ bilateralmente até os joelhosMáculas vermelhas dispersas anteriores às canelas
Resultados Laboratoriais: Pancitopenia, Insuficiência renal aguda, Hipoalbuminemia, Contagem de glóbulos brancos: 3,9 × 10³/μL, Hemoglobina: 7,1 g/dL, Contagem de plaquetas: 114 × 10³/μL, Creatinina sérica: 4,51 mg/dL, Albumina: 2,3 g/dL, Análise de urina: muitas bactérias, cilindros hialinos e granulares, hematúria microscópica, 50 glóbulos brancos por campo de alta potência, Hemoculturas positivas para Lactobacillus acidophilusEcocardiograma: Fração de ejeção do ventrículo esquerdo: 0,60; Defeito do septo ventricular membranoso com massa vegetativa móvel (1,1 cm); Dilatação leve da raiz aórtica, Regurgitação aórtica leveTratamento Antibiótico: Vancomicina empírica e piperacilina/tazobactam; Mudança para penicilina no dia 4 após identificação de L. acidophilus; Duração: 6 semanasSensibilidade do Microrganismo: Resistente à vancomicina; Suscetível a: Penicilina, Daptomicina, Linezolida, Gentamicina, Eritromicina, Clindamicina Alta inicial: após 17 dias de tratamento.Readmissão: 8 dias depois com erupção cutânea e piora da dispneia; suspeita de reação à penicilina.Tratamento: Penicilina substituída por daptomicina.Exame: Ecocardiograma (aneurisma do seio de Valsalva rompido).Cirurgia: Reparação da fístula do seio de Valsalva. Substituição da valva aórtica.Pós-operatório: alergia à daptomicina; tratado com clindamicina.Recuperação: completou a terapia antibiótica e retornou à atividade normal, sem novas hospitalizações. Amir12 et al., 2020 n: 1 (homem)Idade: 61 anos Causa:complicações da doença Covid-19SintomasFalta de ar, febre (38,4ºC), dor no peito e tosse leve FísicoPA: 133/68 mmHg, Pulso: 92 bpm, Temperaturas: 37,3 °C, FR: 26 rpm, SatO2: 94%Roncos pulmonares, sopros cardíacos, nódulos de Osler, hemorragias em estilhaços
ETT: folheto mitral instável com uma vegetação (10 mm × 3 mm), produzindo regurgitação mitral grave, dilatação do coração esquerdo e átrio direito e regurgitação moderada da aorta oxigênio via cânula nasal, diurético de alça, reidratação de fluidos com 1,5 l de cloreto de sódio a 0,9%, moxifloxacino 400 mg, N -acetilcisteína 200 mg a cada 8 horas, hepatoproteção e ramipril 2,5 mg a cada 24 horas No 6º dia, melhora dos sintomas clínicos, sinais vitais nos limites normaisNo 10º dia, resolução das anormalidades pulmonares Babes13 et al., 2021 n: 92 (53,3% homens)Idade: média de 63,80 ± 13,45 anos Sintomas falta de ar, sopro cardíaco, febreSinais palidez, perda de peso e anorexia eletrocardiograma;ecocardiografia transtorácica; ecocardiografia transesofágica Antibioticoterapiacirurgia cardiovascular (67,4%)
No hospital, morte em 33,7%Preditores independentes da mortalidade foram insuficiência cardíaca congestiva e choque sépticoBajdechi14 et al., 2021 n: 1 (mulher)
Idade: 73 anosSintomastosse, falta de ar e fadiga devido a Covid-19; dispneia, com insuficiência respiratória aguda
Complicações: Febre, piora do estado geral no 14º dia, procalcitonina elevada.ecocardiografia transtorácica
Diagnóstico: Endocardite infecciosa por Enterococcus faecium, com vegetação na válvula mitralMeropenem e linezolida (substituída por teicoplanina após trombocitopenia). Falência múltipla de órgãos e óbito após 25 dias de internação. Barahimi17 et al., 2023
Caso 1n: 1 (mulher)Idade: 51 anos
Caso 2n: 1 (mulher)Idade: 63 anos
Causa:complicações da doença Covid-19
SintomasCaso 1febre, fraqueza e sintomas de monoartrite
Caso 2fraqueza, falta de ar e suor extremoCaso 1Artrocentese (detectou MRSA em hemoculturas)
Ecocardiografia transtorácica (vegetação na válvula tricúspide, insuficiência tricúspide, derrame pericárdico)
Angiografia coronária, ultrassonografia Doppler, ultrassonografia abdominopélvica (sem embolias ou anormalidades significativas)
Tomografia de tórax (padrão de árvore em brotamento, cavitação multilobar)
Caso 2Ecocardiografia transtorácica (vegetação na válvula mitral, regurgitação mitral moderada)Tomografia de tórax (consolidações irregulares, opacidades em vidro fosco)Hemoculturas (detecção de MRSA)Caso 1Antibioticoterapia com meropenem e vancomicinaSubstituição da TVR com válvula mecânica Saint Jude
Caso 2Antibioticoterapia com meropenem e vancomicinaSubstituição da MVR após degeneração da válvula mitralCaso 1Recuperação excelente após cirurgia, com melhora completa da tosse, dispneia e movimentos. Alta com sinais de acompanhamento.
Caso 2Recuperação satisfatória após MVR, com melhora completa da falta de ar e fraqueza. Alta com acompanhamento.Ishikawa18 et al., 2024 n: 1 (mulher)Idade: 17 anos Causa: Lesão traumática dos vasos por uso inadequado de lentes de contatoSintomas: febre alta, fadiga geral e visão turva Achado: Vegetação em movimentoLocalização: Folheto posterior da válvula mitralAssociação: Regurgitação leve da válvula mitral Intervenções Iniciais: Plastia da válvula mitral; Remoção dos locais infecciososComplicação: Recidiva da infecção (19 dias após)Intervenção Secundária: Substituição da válvula mitral por bioprótese Pós-operatório Imediato: Evolução tranquilaAcompanhamento (3 anos após): Ecocardiografia transtorácica: Sem evidências de reinfecção.Valores de PCR: Permaneceram normais Fragner20 et al.2024 n: 1 (mulher)Idade: 53 anos Sintomas: Fadiga, artralgias, cefaleia, febre, palpitações, perda de peso TC de abdômen/pelve: Infartos renais esplênicos e bilaterais
ETT: Vegetações nas válvulas mitral e aórtica, regurgitação grave
Microbiologia: Hemoculturas positivas para Streptococcus viridansComplicações: Aneurisma micótico, acidente vascular cerebral embólico, ruptura do aneurisma. Estado mental alterado e déficits neurológicos
Intervenções: Antibióticos, várias neurocirurgias, intubação, traqueostomiaDeterioração clínica e morte meses após internação
Legenda: ASO: oclusor septal Amplatzer; ECG: eletrocardiograma; ETT: ecocardiograma transtorácico; MVR: válvula mitral; MRSA: Staphylococcus aureus resistente à meticilina; PCR: Reação em Cadeia da Polimerase; TVR: válvula tricúspide; TC: Tomografia computadorizada
Causas
Ao analisar os estudos foi possível perceber que as causas da endocardite bacteriana variaram entre os estudos, o que mostra uma diversidade de agentes etiológicos e fatores predisponentes identificados. Os autores Kim7 et al. associaram a infecção a Staphylococcus aureus, com evidências de um histórico de infecções prévias como fator predisponente. Encarnacion8 et al. identificaram Lactobacillus acidophilus em um paciente com condições cardíacas subjacentes e uso de cateter. Enquanto Bajdechi14 et al. vincularam a infecção a Enterococcus faecium, relacionada Covid-19. Barahimi17 et al. destacaram a infecção por MRSA (Staphylococcus aureus resistente à meticilina), e complicações da Covid-19, e Fragner20 et al. relatou um caso com Hemoculturas positivas para Streptococcus viridans e complicações.
Sintomas
Os sintomas relatados foram febre alta7,8,17,20, mialgia e lesões eritematosas nas palmas das mãos e solas dos pés7, falta de ar8,12,14, edema nas extremidades inferiores e febre intermitente8, dor no peito12, tosse, fadiga14,20, fraqueza17, palpitações e perda de peso20.
Diagnóstico
Os métodos diagnósticos utilizados nos estudos foram a ecocardiografia, hemoculturas e análises laboratoriais. A ecocardiografia transesofágica revelou um abscesso da raiz aórtica7 e massa vegetativa móvel no septo ventricular8. A ecocardiografia apresentou vegetação mitral grave e dilatação cardíaca12.
Através de hemoculturas um estudo diagnosticou endocardite por Enterococcus faecium14 e, a presença de MRSA (Staphylococcus aureus resistente à meticilina) foi identificada em hemoculturas e ecocardiografia17. Outro estudo identificou infartos renais e vegetações em válvulas20.
Tratamentos
Os tratamentos foram variados, dependendo do agente patogênico. Foi utilizado nafcilina, rifampicina e gentamicina após a cirurgia para remoção de oclusor septal Amplatzer7. Outro estudo iniciou com vancomicina e piperacilina/tazobactam, mudando para penicilina após a identificação de L. acidophilus8. Em um estudo, o tratamento incluiu diuréticos, reidratação e moxifloxacino12, enquanto outro estudo usou meropenem e linezolida14. Outros estudos utilizaram meropenem e vancomicina17 e, antibióticos, neurocirurgias20.
Discussão
Esta revisão integrativa evidenciou uma variação na faixa etária dos pacientes, com predominância dos adultos mais velhos, com idades que variou de 51 a 73 anos de idade12,13,14,17, com predomínio do sexo masculino7,8,12,13.
Os principais fatores de riscos para a endocardite incluem a idade acima de 60 anos, sexo masculino, uso de drogas injetáveis, histórico prévio de endocardite, dentição precária ou procedimentos odontológicos; presença de válvula protética ou dispositivo intracardíaco, doenças valvares como doença cardíaca reumática, prolapso da válvula mitral e regurgitação mitral, cardiopatias congênitas, como válvula aórtica bicúspide e tetralogia de Fallot; uso de cateter intravenoso permanente, imunossupressão e pacientes em hemodiálise3.
A endocardite é frequentemente causada por estreptococos do grupo viridans Streptococcus gallolyticus, Staphylococcus aureus, estafilococos coagulase-negativos; organismos do grupo HACEK (Haemophilus, Aggregatibacter, Cardiobacterium, Eikenella e Kingella) e enterococos3. Os estudos incluídos nesta revisão identificaram Staphylococcus aureus, Lactobacillus acidophilus, Enterococcus faecium, MRSA (Staphylococcus aureus resistente à meticilina) e, Streptococcus viridans.
Alguns estudos desta revisão apontam algumas causas como complicações da Covid-1912,14,17, lentes de contato18, implantação de pontes dentárias8, transcateter com oclusor septal Amplatzer7. Tendo em vista que a origem das bactérias está relacionada à cavidade oral e dentes (26%), trato gastrointestinal (12,5%), abuso de drogas (5%), pele (5%), trato urinário (4%), iatrogênica (9%) e outra origem (5,5%), e indeterminadas (33%)15. As infecções dentárias são uma das principais causas de bacteremia (presença de bactérias no sangue) que pode levar à endocardite bacteriana2,15,16.
A ecocardiografia é fundamental para o diagnóstico da endocardite bacteriana, sendo que a ecocardiografia transesofágica (ETE) mais sensível que a transtorácica (ETT), principalmente nos casos de complicações graves. Os resultados laboratoriais podem incluir os marcadores inflamatórios elevados e alterações na urina. O tratamento inicial deve cobrir o Staphylococcus, Streptococcus e Enterococcus com antibióticos, como vancomicina e gentamicina, com duração de até 6 semanas, a depender do patógeno3.
O risco de endocardite infecciosa (EI) em pacientes com bacteremia gram-positiva varia conforme os fatores relacionados à bacteremia e ao paciente. A avaliação do risco pode ser facilitada pela revisão dos sinais e sintomas, o que ajuda a determinar a necessidade de exames de imagem para a EI. Dentre os exames, o ETT é fundamental para investigar a endocardite em pacientes com bacteremia por Staphylococcus aureus e, quando este não descarta a endocardite infecciosa, recomenda-se o ETE, principalmente em pacientes com prótese valvar. Se os dois exames citados não detectarem a EI, mas existe uma alta suspeita, novas investigações devem ser adicionadas, como a tomografia cardíaca e PET-CT com 18F-FDG19.
O estudo de Ishikawa18 et al. descreve um raro caso de endocardite associada ao uso inadequado de lentes de contato, em que os sintomas iniciais foram interpretados como efeitos de uma infecção sistêmica, levando um atraso no manejo. A infecção só foi confirmada após resultados bacterianos no sangue. Apesar das intervenções cirúrgicas para a remoção de vegetações e reparo da válvula mitral, a persistência da infecção exigiu uma nova abordagem, que resultou na substituição da válvula por bioprótese, e, o acompanhamento pós-operatório foi a longo, que mostrou uma recuperação completa.
Por outro lado, Barahimi17 et al. observaram após um período assintomático, novos episódios de endocardite, o que levou a hipótese de infecções secundárias, após o uso de imunossupressores durante a pandemia da Covid-19. Esse achado mostra a necessidade de uma vigilância contínua em pacientes que possam ser considerados curados, pois novas infecções podem ocorrer devido à imunidade comprometida.
Amir12 et al. contribuem para a discussão ao destacar que a Covid-19 complicou o diagnóstico de condições cardíacas concomitantes, como a presença de sintomas respiratórios e cardíacos que podem confundir o diagnóstico de endocardite. Os autores diagnosticaram a endocardite pelos critérios modificados de Duke, embora as culturas negativas, devido a administração de antibióticos, dificultaram a identificação do agente.
A endocardite bacteriana é menos comum em pacientes com Covid-19, mas sua etiologia difere dos casos sem infecção por SARS-CoV-2. No entanto, a síndrome inflamatória e respiratória causada pelo vírus pode mascarar os sintomas, dificultando o diagnóstico14.
Adicionalmente, Babes13 et al. (2021) forneceram uma perspectiva epidemiológica, em que revelou que a idade avançada está associada a maior incidência de endocardite, o que alinha ao fato de que os pacientes mais velhos apresentarem mais comorbidades e fragilidades. O Staphylococcus aureus foi o microrganismo mais identificado, especialmente em pacientes com válvulas protéticas.
Além disso, a análise de Liesenborghs10 et al. e Damlin11 et al. revelam as características patogênicas dos agentes mais comuns, como o Staphylococcus aureus e estreptococos, e suas associações com vegetações nas válvulas cardíacas, o que implica na necessidade de um manejo específico e de estratégias de profilaxia para prevenir complicações.
Uma análise de coorte retrospectiva examinou o risco de endocardite bacteriana (EB) após o implante de válvulas pulmonares e evidenciaram que as válvulas Melody® apresentaram um risco de EB até 8 vezes maior em comparação com outras opções. Pacientes com condutos jugulares bovinos também apresentaram um risco aumentado de EB9.
Kim7 et al. afirmam que a profilaxia da endocardite e a terapia antiplaquetária são recomendadas por seis meses após o implante de dispositivos, para prevenir as complicações tardias até que os dados conclusivos sejam obtidos.
Na presente revisão, cerca de dois estudos apontaram a vancomicina8,17 e a gentamicina7,8, como parte do tratamento. Um estudou evidenciou a endocardite por Lactobacillus, que é considerada rara, com 0,05% a 0,4% dos casos de endocardite, geralmente, está associado a doença cardíaca estrutural, procedimentos invasivos, válvulas protéticas e intervenções dentárias. O tratamento consiste na combinação de penicilina e gentamicina8. Já Fragner20 et al. enfatizam a importância de um manejo mais agressivo, mesmo em pacientes assintomáticos, com o intuito de evitar as complicações graves.
As limitações do estudo incluem a variabilidade dos agentes etiológicos entre os estudos analisados, o que aponta uma diversidade de fatores predisponentes para a endocardite bacteriana. Essa diversidade dificulta a padronização dos protocolos de diagnóstico e o tratamento, tendo em vista que os diferentes patógenos requerem uma abordagem distinta.
Considerações finais
A análise dos casos clínicos específicos, permitiu observar variações na manifestação da doença e nas abordagens terapêuticas, com destaque para um manejo individualizado. Esta revisão reforça que o diagnóstico precoce preciso é fundamental para aumentar as chances de sucesso no tratamento e reduzir as complicações.
Em relação à eficácia do tratamento antimicrobiano isolado em comparação com o tratamento combinado com a intervenção cirúrgica, os resultados indicam que, nos casos mais graves ou complicados, a combinação dessas duas abordagens mostrou ser eficaz na redução da mortalidade e das complicações. A intervenção cirúrgica, quando indicada, pode eliminar as fontes de infecção e reparar os danos estruturais no coração, sendo complementado com o tratamento antimicrobiano.
Estudos futuros podem refinar as indicações para o tratamento cirúrgico precoce em pacientes com endocardite bacteriana, para identificar subgrupos que se beneficiam mais dessa abordagem, assim como, estudos que comparem tratamentos exclusivamente antimicrobianos com os combinados com cirurgia, podem esclarecer a eficácia na redução de recidivas e complicações.
Referências
1. Ostovar R, Schroeter F, Kuehnel RU, Erb M, Filip T, Claus T, Albes JM. Endocarditis: An Ever Increasing Problem in Cardiac Surgery. Thorac Cardiovasc Surg. 2019 Dec;67(8):616-623. doi: 10.1055/s-0039-1688475. Epub 2019 May 1. PMID: 31042804.
2. Barroso MG, Cortela DDCB, Mota WP. Endocardite bacteriana: da boca ao coração. Revista Ciência e Estudos Acadêmicos de Medicina. 2014;2:47-57.
3. Vilcant V, Hai O. Bacterial endocarditis. Europe PMC 2017.
4. Teixeira J, Marques A. Profilaxia da Endocardite Bacteriana: Estado da Arte. Revista da Sociedade Portuguesa de Anestesiologia. 2019;28(3):174-180.
5. Paraguassu ÉC, Voss D, Alcolumbre SB, Fernandes I, Bacelar EDPDS, Junior JTC. Association of Bacterial Endocarditis and Buccomaxillofacial Surgery: Review of Current Medical Literature. OHDM-Oral Health and Dental Management. 2019;18.
6. Bele A, Wagh V, Munjewar PK. A Comprehensive Review on Cardiovascular Complications of COVID-19: Unraveling the Link to Bacterial Endocarditis. Cureus. 2023 Aug 24;15(8):e44019. doi: 10.7759/cureus.44019. PMID: 37746510; PMCID: PMC10517725.
7. Kim DJ, Shim CY, You SC, Lee SH, Hong GR. Late Bacterial Endocarditis and Abscess Formation After Implantation of an Amplatzer Septal Occluder Device. Circulation. 2015 Jun 23;131(25):e536-8. doi: 10.1161/CIRCULATIONAHA.115.016339. PMID: 26099960.
8. Encarnacion CO, Loranger AM, Bharatkumar AG, Almassi GH. Bacterial Endocarditis Caused by Lactobacillus acidophilus Leading to Rupture of Sinus of Valsalva Aneurysm. Tex Heart Inst J. 2016 Apr 1;43(2):161-4. doi: 10.14503/THIJ-15-5121. PMID: 27127435; PMCID: PMC4845580.
9. Haas NA, Bach S, Vcasna R, Laser KT, Sandica E, Blanz U, Jakob A, Dietl M, Fischer M, Kanaan M, Lehner A. The risk of bacterial endocarditis after percutaneous and surgical biological pulmonary valve implantation. Int J Cardiol. 2018 Oct 1;268:55-60. doi: 10.1016/j.ijcard.2018.04.138. PMID: 30041803.
10. Liesenborghs L, Meyers S, Lox M, Criel M, Claes J, Peetermans M, Trenson S, Vande Velde G, Vanden Berghe P, Baatsen P, Missiakas D, Schneewind O, Peetermans WE, Hoylaerts MF, Vanassche T, Verhamme P. Staphylococcus aureus endocarditis: distinct mechanisms of bacterial adhesion to damaged and inflamed heart valves. Eur Heart J. 2019 Oct 14;40(39):3248-3259. doi: 10.1093/eurheartj/ehz175. PMID: 30945735; PMCID: PMC7963134.
11. Damlin A, Westling K, Maret E, Stålsby Lundborg C, Caidahl K, Eriksson MJ. Associations between echocardiographic manifestations and bacterial species in patients with infective endocarditis: a cohort study. BMC Infect Dis. 2019 Dec 16;19(1):1052. doi: 10.1186/s12879-019-4682-z. PMID: 31842764; PMCID: PMC6916238.
12. Amir M, Djaharuddin I, Sudharsono A, Ramadany S. COVID-19 concomitant with infective endocarditis: A case report and review of management. Int J Infect Dis. 2020 Sep;98:109-112. doi: 10.1016/j.ijid.2020.06.061. Epub 2020 Jun 20. PMID: 32574691; PMCID: PMC7305871.
13. Babeș EE, Lucuța DA, Petcheși CD, Zaha AA, Ilyes C, Jurca AD, Vesa CM, Zaha DC, Babeș VV. Clinical Features and Outcome of Infective Endocarditis in a University Hospital in Romania. Medicina (Kaunas). 2021 Feb 10;57(2):158. doi: 10.3390/medicina57020158. PMID: 33578787; PMCID: PMC7916483.
14. Bajdechi M, Vlad ND, Dumitrascu M, Mocanu E, Dumitru IM, Cernat RC, Rugină S. Bacterial endocarditis masked by COVID-19: A case report. Exp Ther Med. 2022 Feb;23(2):186. doi: 10.3892/etm.2021.11109. Epub 2021 Dec 30. PMID: 35069867; PMCID: PMC8764899.
15. Deppe H, Reitberger J, Behr AV, Vitanova K, Lange R, Wantia N, Wagenpfeil S, Sculean A, Ritschl LM. Oral bacteria in infective endocarditis requiring surgery: a retrospective analysis of 134 patients. Clin Oral Investig. 2022 Jul;26(7):4977-4985. doi: 10.1007/s00784-022-04465-2. Epub 2022 Mar 22. PMID: 35316412; PMCID: PMC9276723.
16. Thoresen T, Jordal S, Lie SA, Wünsche F, Jacobsen MR, Lund B. Infective endocarditis: association between origin of causing bacteria and findings during oral infection screening. BMC Oral Health. 2022 Nov 15;22(1):491. doi: 10.1186/s12903-022-02509-3. PMID: 36376875; PMCID: PMC9664784.
17. Barahimi E, Defaee S, Shokraei R, Sheybani-Arani M, Salimi Asl A, Ghaem HM. Bacterial endocarditis following COVID-19 infection: two case reports. J Med Case Rep. 2023 Jun 16;17(1):274. doi: 10.1186/s13256-023-03970-6.
18. Ishikawa S, Matsunaga H, Mishima H, Katayama Y, Yuri K, Ohashi K, et al. Bacterial endocarditis caused by contact lens usage. General Thoracic and Cardiovascular Surgery Cases. 2024;3(1):22. https://doi.org/10.1186/s44215-024-00134-w
19. Rasmussen M, Gilje P, Fagman E, Berge A. Bacteraemia with gram-positive bacteria-when and how do I need to look for endocarditis? Clin Microbiol Infect. 2024 Mar;30(3):306-311. doi: 10.1016/j.cmi.2023.08.027. Epub 2023 Sep 1. PMID: 37659693.
20. Fragner M, Srivats SS, Elsaygh J, Pink K. Subacute Multivalvular Bacterial Endocarditis Complicated by Ruptured Mycotic Aneurysm and the Impact of Gender on Early Surgical Intervention. Cureus. 2024 May 6;16(5):e59771. doi: 10.7759/cureus.59771. PMID: 38846208; PMCID: PMC11154016.
1 Graduada em Medicina e Residente em Cardiologia da Universidade Federal do Tocantins

