REGISTRO DOI: 10.69849/revistaft/pa10202411301652
Kellen Cristinne Da Silva
Prof. Orientador: Msc. Waleska Lazaretti
RESUMO
Existe um grande número de pessoas que frequentam as Unidades Básicas de Saúde (UBS) diariamente, sejam eles profissionais ou pacientes, que carregam em si uma carga variada de microrganismos, entre eles encontram-se as bactérias. As pessoas ficam expostas a esse risco biológico e as infecções relacionadas à assistência de saúde (IRAS) são um assunto de importância médica, pela presença de infecções de bactérias multirresistentes cada vez mais frequentes nos estabelecimentos de saúde. O presente estudo tem como finalidade investigar a prevalência e o perfil de resistência de bactérias presentes em superfícies inanimadas nas Unidades Básicas de Saúde de Cascavel/PR, avaliando o risco associado à transmissão de infecções bacterianas resistentes aos pacientes. Para isso, foram coletadas um total de 13 amostras de diferentes tipos de superfícies inanimadas provenientes de algumas áreas da UBS localizada no Bairro Neva em Cascavel/ PR. As amostras foram analisadas nos laboratórios do Centro Universitário Univel para a identificação do tipo e espécie de bactérias presentes nas superfícies escolhidas. Das 13 amostras apenas 09 apresentaram crescimento microbiano, destas, 5 foram classificadas como Cocos Gram Positivos (CGP), Estafilococos Coagulase Negativos (ECN), enquanto as outras 4 amostras foram classificadas como Bacilos Gram Negativos (BGN). As amostras de BGN foram identificadas como sendo duas de Proteus penneri, uma de Morganella morganni e uma de Hafnia alvei. Após realização do antibiograma destas amostras pode-se confirmar que nenhuma das bactérias eram resistentes a antibióticos e, como foi observado pouco crescimento das placas, acredita-se que o local segue as recomendações de higienização das superfícies e objetos.
Palavras-chave: Bactérias resistentes, IRAS, UBS.
1 INTRODUÇÃO
No ambiente encontram-se diversas espécies de microrganismos, estes, podem ser benéficos ou maléficos a saúde dos seres humanos, dentre esses, encontra-se as bactérias, organismos unicelulares que habitam diferentes tipos de lugares, sendo encontradas principalmente na pele, mucosas e no trato intestinal dos seres humanos. Dependendo do tipo de bactéria, contribuem com a homeostasia do organismo ou causar patologias (VALADÃO e MIKALOUSKI, 2018).
Há um grande número de pessoas que frequentam os estabelecimentos de saúde, como as Unidades Básicas de Saúde (UBS), e diariamente profissionais e pacientes carregam com si uma carga variada de microrganismos. Essas pessoas ficam expostas a diferentes riscos, sendo o risco biológico o mais comum. Por esse motivo, há uma grande preocupação em relação a esse assunto já que as infecções relacionadas à assistência de saúde (IRAS) possuem agentes infecciosos dos mais variados e resistentes, podendo prolongar as hospitalizações, elevando assim os custos ao sistema de saúde, pacientes e familiares, e no pior dos casos levar pacientes a óbito (SANTOS, 2014).
As IRAS são consideradas como qualquer infecção adquirida após a entrada do paciente em estabelecimentos de saúde que apareça durante ou após a alta e que esteja relacionada a procedimentos realizados durante o período de estadia do paciente no local (REZENDE; ARANTES; ROSA, 2015).
As superfícies dos estabelecimentos de saúde atuam como um reservatório de microrganismos, os quais podem entrar em contato com os pacientes de forma direta ou indireta por meio dos profissionais de saúde, que ao passarem em várias áreas da unidade de saúde, podem propagar e levar esses microrganismos para diferentes lugares e pessoas (VALADÃO e MIKALOUSKI, 2018). Nessas superfícies podem se alojar diversos microrganismos de relevância epidemiológica, como Enterococcus resistente à vancomicina (VRE), Acinetobacter spp., Clostridium difficile, Staphylococcus aureus, entre outros (ALFA et. al, 2015).
Dessa forma, os antibióticos possuem um papel importante para o tratamento dessas bactérias, reduzindo o número de mortes causadas por infecções bacterianas. Contudo, já se observam microrganismos resistentes a alguns antimicrobianos devido ao uso indiscriminado. Os mecanismos responsáveis por essas resistências são bem definidos e estão relacionados a questões genéticas e bioquímicas, como: produção de enzimas que degradam antimicrobianos, redução da permeabilidade da membrana externa, mecanismos naturais de excreção de substâncias tóxicas resultantes do metabolismo bacteriano e alteração ou bloqueio do sítio alvo do antibiótico (DE MESQUITA, 2011).
As Unidades Básicas de Saúde (UBS) têm como função desenvolver ações de promoção, prevenção e reabilitação da saúde, de forma a intervir no processo de saúde-doença da população. Elas têm como objetivo atender 80% dos problemas de saúde da população, sem que possuam a necessidade de encaminhamento para hospitais. É necessário que os profissionais atuantes na área utilizem os equipamentos de segurança e compreendam os procedimentos corretos de descarte e limpeza dos materiais utilizados no ambiente, evitando contágio para os pacientes e demais profissionais que se encontram no local (VALADÃO e MIKALOUSKI, 2018).
Apesar do grande número de atendimentos efetuados nessas unidades, são raros os estudos sobre a prevalência de microrganismos nesses locais, sendo imprescindível a investigações da presença deles nas superfícies e o risco para os profissionais e pacientes (MARQUES; COLOMBO, 2019). Nesse contexto, este estudo visa a investigação da prevalência e do perfil de resistência de bactérias presentes em superfícies inanimadas nas UBS de Cascavel, sendo que, será avaliado o risco associado à transmissão destas infecções aos pacientes que frequentam as UBS.
2 METODOLOGIA
Foram coletadas um total de 13 amostras de diferentes superfícies inanimadas em algumas salas da UBS localizada no bairro Neva em Cascavel – PR, os locais coletados foram: recepção (bancada e cadeira); consultório (mesa); sala de pré-consulta (esfigmomanômetro, balança dos bebês, descanso do braço e mesa); sala de vacinação (mesa e balcão); sala de injetáveis (descanso de braço e maca); sala de procedimentos (descanso de braço e balcão. Todas as amostras foram coletadas antes da limpeza diária, no período diurno, através do rolamento dos swabs nas superfícies dos locais selecionados.
Não foi utilizado desinfetante antes da coleta das amostras, nem padronizado os tamanhos das áreas coletadas. Os swabs, após aplicação, foram introduzidos em tubo com 1 ml de caldo Stuart. Em seguida, transportou-se até o Laboratório Escola do Centro Universitário UNIVEL, onde realizou-se a semeadura em Placas de Petri contendo meio de cultura (Ágar MacConkey e Ágar sangue), e, posteriormente levadas para estufa a 37°C onde permaneceram durante 24 horas.
Após crescimento microbiano, realizou-se uma análise macroscópica das colônias formadas com posterior identificação através da leitura em lâmina e coloração de Gram, e bioquímica, utilizando as provas da catalase e coagulase para bactérias Cocos Gram Positivas (CGP) e oxidase para bactérias Bacilo Gram Negativos (BGN), além de realizar o Enterokit, que possui as provas bioquímicas necessárias para a identificação de Enterobactérias. Após, foi verificado o perfil de suscetibilidade antimicrobiana utilizando o método de disco-difusão em ágar.
Após a obtenção das análises microbiológicas, os resultados foram tabulados no aplicativo Microsoft Excel com o objetivo de comparar e discutir esses dados com outros estudos realizados e determinar a relevância dos resultados obtidos.
3 RESULTADOS E DISCUSSÃO
Dentre as 13 amostras coletadas, apenas 9 apresentaram crescimento para no mínimo um microrganismo. O número de amostras, locais coletados e crescimento bacteriano das amostras são apresentados na Tabela 1.
Tabela 1: Tabela das amostras, locais coletados e crescimento bacteriano. Fonte: autoria própria. Cascavel, PR, Brasil, 2024.

Das amostras positivas para crescimento bacteriano, 5 (55,5%) tiveram crescimento de Cocos Gram Positivos (CGP) e 4 (44,4%) crescimento de Bacilos Gram Negativos (BGN). As amostras apresentaram mesmo padrão de resultados, amostras CGP foram positivas para catalase e negativas para coagulase, e, amostras BGN foram negativas para oxidase.
Foi realizado o Enterokit nas amostras 02, 04, 05 e 07. Os resultados do Enterokit assim como o número da amostra são demonstrados na Tabela 2.
Tabela 2: Tabela com resultados dos Enterokit realizados em algumas amostras. Fonte: autoria própria. Cascavel, PR, Brasil, 2024.

A partir dos resultados apresentados na Tabela 2, foi possível identificar as bactérias, para isso, utilizou-se da Probac como meio de identificação, assim, constatou-se que a amostra 02 apresentava Morganella morganii, as amostras 04 e 07 continham Proteus penneri e, a amostra 05 Hafnia alvei. Realizou-se os antibiogramas com estas amostras, utilizando-se dos antibióticos de maior relevância e utilização, foram eles: Meropenem (MER), Ciprofloxacino (CIP), Ceftriaxona (CRO), Amoxicilina (AMC), Peracilina (PIP) e Cefepime (CPM), os resultados do antibiograma, assim como o número da amostra e classificação sensível (S) ou resistente (R) são apresentados na Tabela 3. Os resultados foram baseados no BrCAST, organização que promove a padronização e qualidade dos testes de susceptibilidade antimicrobiana no Brasil.
Tabela 3: Tabela de resultados do antibiograma dos BGN. Fonte: autoria própria. Cascavel, PR, Brasil, 2024.
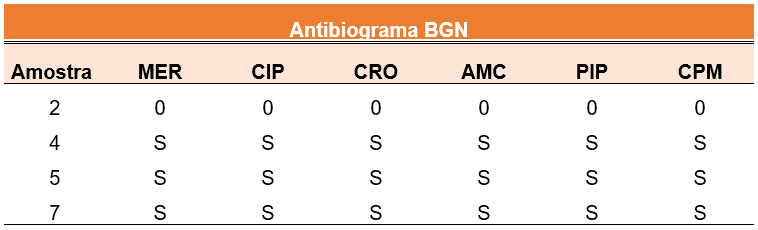
A amostra 02 não apresentou crescimento em 24 ou 48 horas, sem motivo aparente. Identificou-se que, 3 das 4 amostras foram coletadas na sala de pré-consulta, onde realiza-se a triagem dos pacientes, e 1 amostra na cadeira da recepção.
Duas amostras apresentavam Proteus penneri, essa espécie causa patogenia em humanos, em uma menor escala quando comparado a outras espécies de Proteus, podendo ser responsável por infecções graves, como as infecções do trato urinário (KISHORE, 2012; KRAJDEN et al., 1987). Além disso, já foi isolado causando doenças em camarões, que são constantemente consumidos por humanos e potencialmente podem vir a transmitir a bactéria para quem os consomem ou manipulam (CAO et al., 2014ª).
Enquanto uma amostra apresentava Morganella morganii, bactéria que faz parte das bactérias de importância clínica, sendo frequentemente encontrada na flora intestinal normal dos humanos, é um patógeno oportunista que possui potencial de causar infecção, além disso, é conhecida por causar vários tipos de doenças, como infecções intra-abdominais (SAKAGUCHI et al., 2014).
A outra amostra apresentava Hafnia alvei, única do seu gênero que apresenta relevância, tanto na indústria alimentícia, quanto na clínica, sendo recorrentemente associada a gastroenterites, septicemias e infecções do trato urinário (CHEN et al., 2010).
Além disso, as amostras CGP – ECN também foram submetidas ao antibiograma, com antibióticos de relevância para essa classe, sendo eles: Gentamicina (GEN), Clindamicina (CLI), Vancomicina (VAN), Oxacilina (OXA), Ciprofloxacino (CIP) e Penicilina G (PEN), os resultados do antibiograma assim como o número da amostra e classificação sensível (S), resistente (R) ou formação do halo (H) são apresentados na tabela 4. Resultados baseados no BrCAST.
Tabela 4: Tabela de resultados do antibiograma dos CGP – ECN. Fonte: autoria própria. Cascavel, PR, Brasil, 2024.
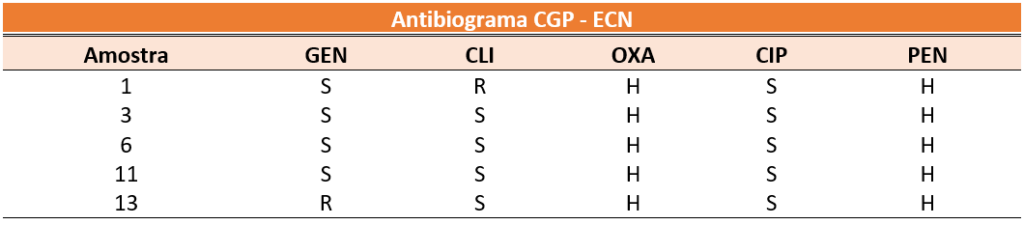
Não foi possível determinar o perfil da OXA e PEN, visto que, para determinação do perfil seria necessário que o antibiótico Cefoxitina fosse utilizado, já que o perfil da OXA e da PEN depende exclusivamente da resistência ou sensibilidade do mesmo, entretanto houve formação do halo nestas amostras.
As amostras CGP coagulase negativas, classificadas como estafilococos coagulase-negativas (ECN), geralmente são encontrados na microbiota normal de pele e mucosas. Entretanto, são considerados como microrganismos oportunistas, capazes de produzir infecções graves em pacientes imunossuprimidos ou que fizeram grandes cirurgias e necessitaram de inserção de cateteres, sendo que, estes são reservatórios dessas bactérias, que aderem facilmente as superfícies (TEIXEIRA, 2009).
Nesse contexto, entende-se que a propagação destas bactérias em locais e objetos utilizados concomitantemente por pacientes e profissionais da saúde demonstram que, a contaminação de locais aparentemente limpos, reforça a disseminação destes patógenos, já que, muitas vezes medidas eficazes de limpeza acabam sendo negligenciadas. A contaminação destas superfícies pode ser evitada com uma correta higienização das mãos dos profissionais da saúde antes e após contato direto com os pacientes, além de uma higienização dos instrumentos utilizados no atendimento dos mesmos (OLIVEIRA; DAMASCENO, 2010).
A contaminação de IRAS nas superfícies além de serem um problema para os pacientes no desenvolvimento de doenças, também causam transferência de genes de resistência a antimicrobianos, deixando-os resistentes e dificultando seus tratamentos (CORRÊA et al., 2021).
A resistência antimicrobiana é uma preocupação crescente em todo mundo, essa, pode ser desenvolvida por diversos fatores, entre eles a indicação inadequada da droga, o uso indiscriminado, interrupção do tratamento sem completar o ciclo, venda sem prescrição médica e outros. Sabe-se que grande parte dos isolados apresentam resistência a vários antimicrobianos, estes chamados de multirresistentes, trazem consigo um grande problema com relação ao tratamento, já que, muitas vezes é necessário utilizar-se de vários antimicrobianos para combater uma bactéria, e nem sempre dá certo (TEIXEIRA, 2009).
Neste estudo não foi observada resistência aos antibióticos nos microrganismos estudados, entretanto vale ressaltar que a UBS estudada, aparentemente, faz uma boa higienização do local e materiais, demonstrado pelo não crescimento microbiano em algumas placas.
4 CONCLUSÃO
Através dos resultados analisados percebeu-se que a UBS analisada segue os padrões e normas de higienização das superfícies e objetos, visto que, as placas apresentaram crescimento de apenas uma bactéria cada e em locais específicos, que são muito utilizados por pacientes. Outrora, devem ser criadas estratégias como forma de evitar que continuem a ocorrer. Para isso, estudos e cursos de atualizações deverão ser incluídos no treinamento dos profissionais que estarão atuando na área, a fim de eliminar esta problemática, levando a informação e deixando claro a importância da higienização não só das superfícies como também das mãos dos profissionais da saúde.
REFERÊNCIAS BIBLIOGRÁFICAS
ALFA, M. J. et al. Use of a daily disinfectant cleaner instead of a daily cleaner reduced hospital-acquired infection rates. American Journal of Infection Control, Canadá, v. 43, n. 2, p. 141-146, fev. /2015. Disponível em: https://www.ajicjournal.org/article/S0196-6553(14)01284-X/fulltext Acesso em: 1 mai. 2024.
CAO, H. et al. Identification of a Proteus penneri isolate as the causal agent of red body disease of the cultured white shrimp Penaeus vannamei and its control with Bdellovibrio bacteriovorus. Antonie Van Leeuwenhoek, v. 105, p. 423–430, 2014a. Dísponivel em: https://pubmed.ncbi.nlm.nih.gov/24271474/ Acesso em 17 nov. 2024.
CHEN, TR; WEI, QK; CHEN, YJ. Pseudomonas spp. and Hafnia alvei growth in UHT milk at cold storage. Food Control, v.22, n.5, p.697-701, 2011. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S0956713510003361 Acesso em 17 nov. 2024.
Corrêa ER, Machado AP, Bortolini J, Miraveti J de C, Corrêa LVA, Valim MD. Bactérias resistentes isoladas de superfícies inanimadas em um hospital público. Cogitare enferm. [Internet]. Disponível em: http://dx.doi.org/10.5380/ce.v26i0.74774 Acesso em 15 de nov. 2024.
DE MESQUITA, A. Q. Mecanismos de Resistência a Antimicrobianos. Universidade Federal De Goiás, 2011. Disponível em: https://files.cercomp.ufg.br/weby/up/67/o/semi2011_Adriano_Queiroz_1c.pdf Acesso em: 21 mai. 2024.
HEIKENS, E. et al. Comparison of genotypic and phenotypic methods for species level identification of Clínical isolates of coagulase-negative staphylococci. Journal of Clinical Microbiology, v. 43, n. 5, p. 2286-2290, 2005. Disponível em: https://journals.asm.org/doi/full/10.1128/jcm.43.5.2286-2290.2005 Acesso em 16 nov. 2024
KISHORE, J. Isolation, identification \& characterization of Proteus penneri-a missed rare pathogen. The Indian Journal of Medical Research, v. 135, n. 3, p. 341, 2012. Disponível em: https://pubmed.ncbi.nlm.nih.gov/22561620/ Acesso em 17 nov. 2024.
KRAJDEN, S. et al. Expanded clinical spectrum of infections caused by Proteus penneri. Journal of Clinical Microbiology, v. 25, n. 3, p. 578–579, 1987. Disponível em: https://pubmed.ncbi.nlm.nih.gov/3571463/ Acesso em 16 nov. 2024.
MARQUES, J. C. F; COLOMBO, T. E. Isolamento e identificação de bactérias presentes em superfícies inanimadas de uma unidade básica de saúde no interior de São Paulo. J Health Sci Inst., Brasil, v. 37, n. 4, p. 329-334, dez./2019. Disponível em: https://pesquisa.bvsalud.org/portal/resource/pt/biblio-1359241?src=similardocs Acesso em: 30 jan. 2024.
OLIVEIRA, Adriana Cristina de; DAMASCENO, Quésia Souza. Superfícies do ambiente hospitalar como possíveis reservatórios de bactérias resistentes: uma revisão. Revista da Escola de Enfermagem da USP, v. 44, p. 1118-1123, 2010. Disponível em: https://www.scielo.br/j/reeusp/a/DnKVnQF8BFkbXht8ngNrfLR/ Acesso em 18 nov. 2024.
REZENDE, C; ARANTES, T. M; ROSA, N. R. Identificação bacteriológica em banheiros de unidades básicas de saúde de municípios do Noroeste Paulista, Brasil. Infarma – Ciências Farmacêuticas, São Paulo, v. 27, n. 1, p. 28-32, mar./2015. Disponível em: https://revistas.cff.org.br/?journal=infarma&page=article&op=view&path%5B%5D=681 Acesso em: 5 mar. 2024.
Sakaguchi S, Nishi K, Yamashita Y, Hiratsuka T, Hara S, Okayama A: White urine due to urinary tract infection. Kidney Int. 2014, 86:655. 10.1038/ki.2014.23. Disponível em: https://www.kidney-international.org/article/S0085-2538(15)30318-5/fulltext Acesso em: 16 nov. 2024.
SANTOS, L. et al. Contagem de microrganismos em determinados locais da unidade básica de saúde em Aspásia-SP. UNIFUNEC CIÊNCIAS DA SAÚDE E BIOLÓGICAS, São Paulo, v. 3, n. 6, p. 1-13, dez./2020. Disponível em: https://seer.unifunec.edu.br/index.php/rfce/article/view/3443 Acesso em: 4 mar. 2024.
TEIXEIRA, Cristina Ferreira et al. Estafilococos coagulase-negativa: um risco real para a saúde pública. 2009. Tese de Doutorado. Disponível em: https://www.arca.fiocruz.br/handle/icict/4009 Acesso em 20 de nov. 2024.
VALADÃO, F. D. C; MIKALOUSKI, U. Análise microbiológica em unidade de saúde: Staphylococcus aureus. Revista Terra & Cultura: Cadernos de Ensino e Pesquisa, Brasil, v. 34, n. 66, p. 36-46, jul./2018. Disponível em: http://periodicos.unifil.br/index.php/Revistateste/article/view/320 Acesso em: 6 mar. 2024.
