REGISTRO DOI: 10.69849/revistaft/cs10202411232046
Beatriz Silva Oliveira
Bárbara Ariel Setti de Oliveira
Orientadora: Profa Dra Aline Francielle da Silva dos Santos
Resumo
A infertilidade masculina representa um problema significativo de saúde, afetando cerca de 15% dos casais em idade reprodutiva no mundo, e contribuindo para aproximadamente metade dos casos de infertilidade. No Brasil, estima-se que cerca de 8 milhões de pessoas enfrentam dificuldades para conceber, destacando-se a prevalência da infertilidade masculina idiopática, em que a causa permanece desconhecida, o que torna o diagnóstico e o tratamento desafiadores. Entre os fatores que afetam a fertilidade masculina estão causas genéticas, distúrbios hormonais, anomalias anatômicas, como varicocele, e condições de desenvolvimento como criptorquidia e hipospádia. Além disso, infecções e inflamações, incluindo a caxumba, e fatores ambientais, como exposição a radiação, altas temperaturas e substâncias químicas, desempenham um papel importante na função reprodutiva. O uso de esteroides anabolizantes androgênicos (EAA) também tem sido associado a efeitos adversos na saúde reprodutiva, incluindo atrofia testicular e hipogonadismo. Este estudo teve como objetivo revisar e discutir a variedade de fatores que contribuem para a infertilidade masculina, com ênfase nos efeitos dos EAA, ressaltando a importância de pesquisas contínuas para aprimorar abordagens clínicas e preventivas para essa população.
Palavras-chave: infertilidade, infertilidade masculina, anabolizantes e EAA.
ABSTRACT
Male infertility represents a significant health problem, affecting approximately 15% of couples of reproductive age worldwide, and contributing to approximately half of infertility cases. In Brazil, it is estimated that around 8 million people face difficulties conceiving, highlighting the prevalence of idiopathic male infertility, in which the cause remains unknown, which makes diagnosis and treatment challenging. Factors that affect male fertility include genetic causes, hormonal disorders, anatomical anomalies such as varicocele, and developmental conditions such as cryptorchidism and hypospadias. Additionally, infections and inflammation, including mumps, and environmental factors, such as exposure to radiation, high temperatures, and chemicals, play an important role in reproductive function. The use of anabolic androgenic steroids (AAS) has also been associated with adverse effects on reproductive health, including testicular atrophy and hypogonadism. This study aimed to review and discuss the variety of factors that contribute to male infertility, with an emphasis on the effects of AAS, highlighting the importance of continued research to improve clinical and preventive approaches for this population.
Keywords: infertility, male infertility, anabolic steroids and EAA.
1. Introdução
A infertilidade masculina é um problema que afeta uma parte significativa da população, sendo multifatorial em sua origem. As causas podem ser agrupadas em diversas categorias, cada uma com suas especificidades (BOIVIN et al., 2007).Estatísticas globais indicam que aproximadamente 15% dos casais em idade reprodutiva enfrentam dificuldades para conceber, com a infertilidade masculina representando cerca de metade dos casos (Mascarenhas et al., 2012). No Brasil, a estimativa é que cerca de 8 milhões de pessoas enfrentam algum tipo de dificuldade para engravidar, o que representa aproximadamente 15% dos casais em idade reprodutiva (IBGE, 2019).
Cerca de 50% dos casos de infertilidade masculina são classificados como idiopáticos, ou seja, não apresentam uma causa conhecida. Essa incerteza torna o diagnóstico e tratamento mais desafiadores, exigindo investigações detalhadas (JAROW; BELKER, 2016).
Embora sejam menos comuns, as causas genéticas podem desempenhar um papel significativo na infertilidade masculina. A produção de espermatozoides é um processo complexo que depende de um equilíbrio hormonal delicado, regulado pela hipófise, e alguns fatores, como distúrbios hormonais e lesões, podem afetar essa função da glândula, prejudicando a produção e a qualidade dos espermatozoides (CAYAN; KARAM, 2018). ). Além disso, condições anatômicas, como a varicocele – que é a causa mais frequente da infertilidade masculina – interferem diretamente na fertilidade. Caracterizada pela dilatação das veias testiculares, essa condição pode comprometer tanto a produção quanto a qualidade dos espermatozoides, dificultando a concepção (CAYAN; KARAM, 2018).
Desde o nascimento, certas anomalias no desenvolvimento dos órgãos reprodutivos também podem impactar a fertilidade. Entre essas condições estão a criptorquidia (quando o testículo não desce para o escroto) e a hipospádia (posicionamento inadequado da uretra). Ambas afetam o desenvolvimento normal dos testículos e do trato genital, o que pode ter efeitos duradouros na capacidade reprodutiva (SCHENK; ZITZMANN, 2014).
Infecções ou processos inflamatórios nos testículos podem danificar a produção de espermatozoides. A infecção pelo vírus da caxumba é uma das mais conhecidas causas infecciosas de infertilidade masculina (FINK; MACDONALD, 2016).
Fatores ambientais e substâncias químicas, como radiação, solventes orgânicos, pesticidas e altas temperaturas, têm um impacto significativo na função testicular e na saúde reprodutiva masculina. A radiação, especialmente em tratamentos de radioterapia, pode danificar células testiculares, enquanto produtos químicos e metais pesados estão associados a alterações hormonais e diminuição da qualidade do sêmen. A exposição a temperaturas elevadas, como em fornos e saunas, prejudica a espermatogênese, e o uso de agentes gonadotóxicos, como anabolizantes, pode inibir a produção natural de espermatozoides, aumentando o risco de infertilidade (GHOSH; MUKHERJEE, 2016).
No sistema reprodutor masculino, o consumo de EAA pode causar desequilíbrio hormonal, levando à redução dos níveis de testosterona endógena e provocando efeitos como ginecomastia, atrofia testicular, infertilidade, redução da produção de espermatozoides, hipogonadismo, hipertrofia prostática, carcinoma prostático, disfunção erétil e tumores de próstata (LIMA; CARDOSO, 2011; NEVES et al., 2015).
Sendo assim, estudos que abordem esta temática são fundamentais para elucidar a clínica e os efeitos apresentados por pessoas que fazem uso de EAA, bem como para o desenvolvimento de abordagens preventivas e de tratamento adequadas a essa população (SHOUBRIDGE; BOHM, 2017).
2. OBJETIVOS
Analisar o impacto do uso de esteroides anabolizantes na fertilidade masculina, explorando as alterações hormonais, a produção de espermatozoides e os possíveis efeitos reversíveis após a interrupção do uso, investigar as principais alterações hormonais associadas ao uso de esteroides anabolizantes e seu impacto na espermatogênese, examinar a relação entre o uso de esteroides e a qualidade do sêmen em homens usuários e discutir a reversibilidade dos efeitos adversos na fertilidade após a interrupção do uso de esteroides anabolizantes.
3. METODOLOGIA
Este trabalho consiste em uma revisão bibliográfica integrativa, com foco em identificar e analisar os impactos dos esteroides anabolizantes na fertilidade masculina. A revisão permitirá consolidar informações já disponíveis na literatura científica, facilitando uma compreensão mais ampla do tema.
A pesquisa foi realizada em bases de dados acadêmicas, incluindo Google Scholar, PubMed, utilizando palavras-chave como “fertilidade masculina”, “esteroides anabolizantes” e “produção de espermatozoides”. Os critérios de inclusão consideraram artigos publicados entre 2007 e 2024, priorizando estudos revisados por pares e que abordassem diretamente a relação entre o uso de esteroides e a saúde reprodutiva masculina.
Os artigos selecionados foram analisados quanto a seus objetivos, metodologias, resultados e conclusões, permitindo a comparação entre diferentes estudos durante a pesquisa. A revisão bibliográfica foi estruturada em seções que abordam os impactos dos esteroides anabolizantes na Fertilidade, mecanismos fisiológicos e, considerações sobre Reversibilidade
4. RESULTADOS E DISCUSSÃO
4.1 Infertilidade masculina
A produção de espermatozoides depende de um delicado equilíbrio hormonal regulado pela hipófise, uma glândula do sistema nervoso central. Doenças, tanto congênitas quanto adquiridas, podem prejudicar a função hipofisária, resultando em problemas na produção espermática (MATZKIN; DOMINGUEZ, 2020).
Embora menos comuns, as causas genéticas podem desempenhar um papel significativo na infertilidade. Alterações cromossômicas, como a Síndrome de Klinefelter, microdeleções do cromossomo Y e a agenesia congênita do vaso deferente, são exemplos de condições que podem afetar a fertilidade masculina (SCHLEGEL, 2009).
A vasectomia é um método contraceptivo cirúrgico que visa proporcionar esterilidade. Entretanto, pode se tornar um problema se o homem se arrepender da decisão ou se a situação familiar mudar, levando à necessidade de reversão (SINHA, 2017).
4.2 Espermatogênese
Os hormônios são substâncias químicas secretadas pelas glândulas endócrinas que funcionam como mensageiros, regulando diversas atividades no corpo humano. No sistema reprodutor masculino, a testosterona exerce um papel essencial na formação e maturação dos espermatozoides durante o processo de espermatogênese. (BROWN et al., 2009).
O hipotálamo produz o hormônio liberador de gonadotropina (GnRH), que é liberado em pulsos a cada 60 a 120 minutos. Em resposta a esses pulsos, a glândula hipófise anterior libera hormônio luteinizante (LH) e, em menor quantidade, hormônio folículo estimulante (FSH). Nos testículos, as células de Leydig reagem ao LH produzindo de 5 a 10 mg de testosterona diariamente. (FREEMAN et al., 2000).
A testosterona é sintetizada a partir do colesterol, passando por diversos compostos intermediários, como deidroepiandrosterona (DHEA) e androstenediona. A maior parte da testosterona que circula no sangue está ligada a proteínas: cerca de 40% está ativamente unida à globulina ligadora de hormônios sexuais, enquanto 58% se liga à albumina. Apenas aproximadamente 2% da testosterona circulante está biodisponível como testosterona livre. Além disso, entre 4% e 8% da testosterona é convertida em dihidrotestosterona (DHT), um metabólito bioativo crucial para o desenvolvimento das características masculinas, libido e manutenção da massa óssea e muscular (MÜLLER et al., 2015).
A testosterona também pode ser convertida em estradiol pela ação da enzima aromatase, sendo este hormônio responsável por muitos dos efeitos da testosterona em órgãos como ossos e cérebro (MILLER; ROSENFIELD, 1998).
Na presença de testosterona, o FSH estimula as células de Sertoli, induzindo a espermatogênese. Durante esse processo, cada célula germinativa (espermatogônia), situada próxima às células de Sertoli, diferencia-se em 16 espermatócitos primários, cada um dos quais dá origem a quatro espermátides. Cada espermátide, então, se transforma em um espermatozoide. A espermatogênese leva em média de 72 a 74 dias, resultando na produção de cerca de 100 milhões de novos espermatozoides diariamente. Após a maturação, os espermatozoides são liberados na rede testicular, de onde migram para o epidídimo e, posteriormente, para o canal deferente (WALSH; HAWKINS, 2014).
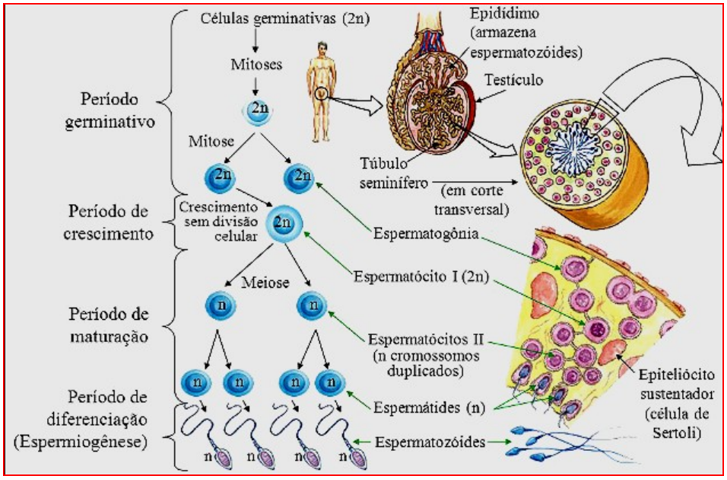
Imagem 1. Espermatogênese (https://www.todamateria.com.br/espermatogenese/)
Após sua produção, a testosterona testicular e seus metabólitos exercem um feedback negativo sobre a liberação de LH pelo eixo hipotalâmico-hipofisário, evitando assim a produção excessiva desse hormônio. Nos homens, o estradiol atua como o principal inibidor da produção de LH, enquanto a inibição da produção de FSH é mediada tanto pelo estradiol quanto pela inibina B, um peptídeo produzido pelas células de Sertoli nos testículos (HORMONES, 2020).
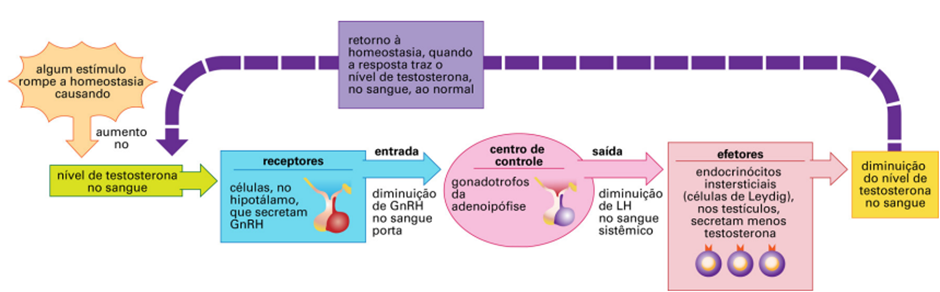
Imagem 2.Controle hormonal da produção de testosterona. https://midia.atp.usp.br/plc/plc0024/impressos/plc0024_01.pdf
4.3 O sêmen
O sêmen é composto por espermatozoides e fluidos seminais, produzidos pelas glândulas anexas, como as vesículas seminais, a próstata e as glândulas bulbouretrais. O sêmen contém diversas substâncias, entre elas aminoácidos, frutose, enzimas, vitaminas, proteínas, ácido cítrico, minerais, colesterol e zinco (NICE, 2017).
Os espermatozoides são produzidos nos testículos e finalizam o processo de maturação nos epidídimos, onde são armazenados até o momento da ejaculação. Em homens férteis, a concentração de espermatozoides varia entre 15 e 500 milhões por mililitro de sêmen (WHO, 2021).
Durante a estimulação sexual, os espermatozoides são transportados dos epidídimos para os ductos deferentes. Em seguida, eles chegam às vesículas seminais e à próstata, onde se misturam com o líquido seminal e o líquido prostático para formar o sêmen. Na uretra, última etapa antes da ejaculação, a secreção produzida pelas glândulas bulbouretrais também é adicionada ao sêmen (PERRY; STANTON, 2020).
O líquido prostático é produzido pela próstata, localizada entre o pênis e a bexiga. Sua função é proteger os espermatozoides e promover sua motilidade. Por ser alcalino, o líquido prostático ajuda a neutralizar a acidez natural da vagina, o que prolonga a sobrevivência dos espermatozoides e aumenta as chances de fecundação (CERRI et al., 2018).
O líquido bulbouretral é secretado pelas glândulas bulbouretrais, situadas próximas à próstata e à uretra. Essas glândulas, com tamanho aproximado ao de uma ervilha, contribuem com cerca de 5% do fluido seminal. O líquido produzido pelas glândulas bulbouretrais é responsável pela nutrição e proteção dos espermatozoides. Além disso, essas glândulas produzem um muco expelido antes da ejaculação, que limpa a uretra e lubrifica o pênis (MARCUS; HAWKINS, 2016).
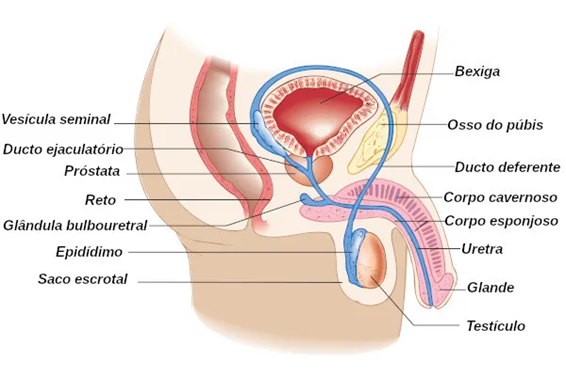
Imagem 3. Órgão reprodutor masculino. (https://www.encurta.ae/r2z61)
4.4 Espermograma
Considerado o exame padrão para avaliar a fertilidade masculina, o espermograma analisa critérios como a qualidade do sêmen e dos espermatozoides, indicando, assim, alterações que podem dificultar ou inibir o processo de fecundação. Além de avaliar a capacidade reprodutiva, o espermograma é um método importante para diagnosticar doenças urológicas, confirmar o sucesso da vasectomia ou da reversão desse procedimento (MORGENTHALER et al., 2015).
Nos tratamentos de reprodução assistida, o espermograma é fundamental para auxiliar no diagnóstico de pacientes com suspeita de infertilidade (COGNO et al., 2020).
Diversos atributos podem ser avaliados no sêmen, incluindo o número total de espermatozoides, o volume do fluido, a concentração de espermatozoides e a natureza dos espermatozoides, como sua viabilidade, motilidade e forma, bem como a composição das secreções. Recomenda-se que o sêmen seja coletado após um período de abstinência de no mínimo 3 dias e no máximo 7 dias. Instruções claras sobre a coleta da amostra devem ser fornecidas previamente para garantir que todas as frações do ejaculado sejam coletadas de forma completa. Qualquer perda da amostra deve ser relatada ao laboratório (WORLD HEALTH ORGANIZATION, 2010).
A amostra deve ser coletada em um recipiente limpo, de boca larga e atóxico para os espermatozoides. O recipiente deve ser mantido em temperatura ambiente, entre 20 ºC e 37 ºC. São observadas as seguintes características: volume, pH, número total de espermatozoides, morfologia, vitalidade, motilidade progressiva, motilidade total (incluindo motilidade progressiva e não progressiva), aglutinação de espermatozoides e viscosidade (ANDERSEN et al., 2019).
4.5 Esteroides androgênicos-anabólicos (EAA)
Os esteroides anabolizantes androgênicos (EAA) foram desenvolvidos na Alemanha na década de 1930, inicialmente utilizados em cães. Posteriormente, durante a Segunda Guerra Mundial, observou-se que o uso dessas substâncias aumentava a força e a agressividade dos soldados. A partir de 1950, os EAA começaram a ser utilizados com finalidades médicas, para o tratamento de diversas patologias. O desenvolvimento sintético permitiu alterações na composição química natural dos hormônios, reduzindo as propriedades androgênicas (aumento das características masculinas) e aumentando os efeitos anabólicos (promoção do crescimento muscular). Na década de 1950, os primeiros atletas a utilizarem EAA foram os do Leste Europeu, com o objetivo de melhorar o desempenho esportivo. Posteriormente, outros países também passaram a adotar essas substâncias (KANAYAMA et al., 2010; LIMA; CARDOSO, 2011).
Os esteroides anabolizantes androgênicos (EAA) são utilizados no tratamento de diversas condições clínicas. Essas substâncias são recomendadas em casos específicos, como o tratamento do hipogonadismo masculino, no qual são empregadas para aumentar a concentração de testosterona (TRAISH, 2018). Além disso, os EAA podem estimular a síntese de eritropoiese no tratamento da anemia, da doença renal crônica e compensar a perda de massa muscular associada a politraumatismos, queimaduras severas, pós-operatórios e osteoporose (KISS et al., 2015).
Os EAA também são utilizados no tratamento da AIDS (síndrome da imunodeficiência adquirida) e de alguns tipos de câncer, atuando como tratamento adjuvante em pacientes que necessitam de ganho de peso. Eles são benéficos para pacientes com deficiência hormonal e disfunções associadas ao catabolismo do tecido muscular esquelético (KRAEMER; RATAMESS, 2005). Em casos de insuficiência pulmonar e cardíaca, os EAA podem aliviar o cansaço desses pacientes e melhorar o funcionamento do sistema imunológico de indivíduos com doenças específicas (ALBERTI et al., 2017).
Além disso, os EAA são empregados na terapia anti-envelhecimento em homens, uma vez que atuam na melhoria da disposição física e emocional e apresentam um efeito regenerador (DUMAS et al., 2019). São também utilizados para tratar adolescentes com estatura exagerada e em casos especiais de obesidade. Em crianças com retardo no desenvolvimento das características secundárias e em pacientes com sarcopenia, que é a perda de massa muscular associada ao envelhecimento, os EAA podem desempenhar um papel terapêutico relevante (BLAIR et al., 2020).
4.6 Uso indiscriminado de EAA e seus efeitos colaterais
Desde a introdução no mercado farmacêutico de compostos sintéticos baseados na testosterona ou que estimulam seu aumento, muitos homens e mulheres começaram a utilizar esses produtos para diversos objetivos, como o halterofilismo, a melhoria do rendimento esportivo e fins estéticos. Esses produtos podem ser administrados de diferentes formas, incluindo injeções intramusculares, via oral e por meio de geis transdérmicos. A obsessão pela perfeição corporal levou ao uso de anabolizantes sem a devida consideração dos danos a longo prazo (NEVES et al., 2015).
Contrariando as recomendações da comunidade médica, muitos atletas, tanto profissionais quanto amadores, utilizam frequentemente doses elevadas de EAA em ciclos com intervalos muito curtos, o que pode aumentar significativamente o risco de efeitos adversos associados ao uso dessas substâncias (LIMA; CARDOSO, 2011)..
Além dos efeitos colaterais no sistema cardiovascular, como infarto do miocárdio e acidente vascular cerebral, o uso inadequado de anabolizantes pode provocar problemas urológicos, incluindo infertilidade, disfunção erétil, ginecomastia e atrofia testicular. Embora esses efeitos geralmente sejam transitórios, com duração de 6 a 18 meses, em alguns casos podem persistir por anos ou até mesmo se tornar permanentes (NEVES et al., 2015).
O mecanismo pelo qual os EAA podem levar à disfunção erétil e infertilidade é essencialmente o mesmo: a produção de testosterona e a fabricação de espermatozoides nos testículos são reguladas pela hipófise, uma glândula localizada no cérebro que envia sinais hormonais para esses órgãos. Quando há a introdução externa de testosterona, a hipófise interpreta que a produção endógena não é mais necessária e reduz ou interrompe o envio desses sinais. Como resultado, os testículos, privados da estimulação hormonal necessária, diminuem sua atividade, levando a problemas como disfunção erétil e infertilidade. Mesmo após a suspensão dos anabolizantes, pode levar um período considerável para que a função testicular se recupere completamente, podendo levar de meses a anos. O tratamento médico pode acelerar a recuperação em alguns casos (LIMA; CARDOSO, 2011).
Além disso, a próstata, que também é afetada pela testosterona, pode ser impactada pelo uso de anabolizantes. Existem especulações de que o uso desses compostos possa provocar aumento do volume prostático e sintomas urinários, como jato urinário fraco, sensação de esvaziamento incompleto da bexiga e aumento da frequência urinária. Embora não haja evidências conclusivas de que os anabolizantes causam câncer de próstata, homens com a doença que não são adequadamente tratados podem ter um aumento na progressão do tumor devido ao uso dessas substâncias (NEVES et al., 2015).
Os derivados da testosterona foram desenvolvidos para tratar condições diagnosticadas por parâmetros clínicos e métodos complementares. Quando prescritos por um médico, são considerados diversos fatores, como contra indicações, dosagem, via de administração e intervalo entre doses, com o objetivo de melhorar a qualidade de vida do paciente e minimizar riscos de efeitos colaterais, O uso abusivo de anabolizantes pode elevar os níveis de testosterona a patamares prejudiciais, aumentando significativamente o risco de efeitos adversos (KANAYAMA et al., 2010).
4.7 Recuperação da espermatogênese.
O tempo médio de recuperação da espermatogênese é muito variável e depende de fatores como o tipo de EAA utilizado, doses, período de tempo de administração e idade do paciente. A espermatogénese geralmente é recuperada de 4 a 6 meses após a descontinuação do uso de EAA, sendo que este período pode prolongar-se até 3 anos, ou mesmo ser irreversível em alguns casos.(FELGUEIRAS, G. O,2022)
Existem fármacos que têm a capacidade de alterar o funcionamento do eixo HHG e, como tal, são utilizados para estimular a produção de testosterona endógena. Dentro destes, destacam-se a HCG e o CC. 24–26 A hCG é estruturalmente composta por uma subunidade α e uma subunidade β, que são semelhantes às subunidades que formam a estrutura da LH. A subunidade α é praticamente idêntica nas duas hormonas, enquanto que a subunidade β apresenta uma ligeira diferença que confere um maior tempo de semi-vida à hCG (cerca de 36 horas) em comparação com a LH (semi-vida de 10,5 horas). Desta forma, a hCG é considerada um análogo ideal do LH e demonstrou ser uma opção viável na recuperação da espermatogênese em homens com hipogonadismo hipogonadotrófico ou alterações na espermatogênese devido ao uso de EAA.(FELGUEIRAS, G. O,2022)
Apesar do sucesso da utilização das gonadotrofinas na recuperação e manutenção da espermatogênese esteja bem estabelecido em pacientes com hipogonadismo hipogonadotrófico, a evidência no tratamento da azoospermia induzida pelo uso de EAA e testosterona exógena é escassa.(FELGUEIRAS, G. O,2022)
4.8 Método de preservação da fertilidade masculina
A criopreservação de sêmen é um método utilizado para preservar a fertilidade masculina por meio do congelamento dos espermatozoides em nitrogênio líquido a uma temperatura de -196 ºC.
Para garantir a eficácia do congelamento, são empregadas soluções crioprotetoras que protegem os espermatozoides durante o processo de congelamento e descongelamento. Esse procedimento permite que as chances de sucesso de uma gravidez com o sêmen criopreservado sejam comparáveis às do sêmen fresco (Nielsen et al., 2018).
A coleta de espermatozoides para criopreservação pode ser realizada através da masturbação, sendo este o método mais comum e menos invasivo. Em casos onde a masturbação não é possível ou não fornece amostras adequadas, podem ser utilizados métodos mais invasivos para a coleta, como a aspiração de espermatozoides diretamente dos testículos ou dos epidídimos (Mahran et al., 2020).
5. CONCLUSÃO
O uso de esteroides anabolizantes androgênicos (EAA) indiscriminadamente tem se mostrado um fator de risco significativo para a saúde reprodutiva masculina, especialmente devido aos seus efeitos adversos na produção hormonal e na espermatogênese. Estudos indicam que o uso de EAA pode levar a um desequilíbrio hormonal profundo, com consequências como hipogonadismo, atrofia testicular e redução da contagem e da qualidade dos espermatozoides (Lima & Cardoso, 2011; Neves et al., 2015). Esses efeitos não apenas comprometem a fertilidade de forma potencialmente irreversível, como também representam um risco crescente para jovens que buscam ganho de massa muscular e aprimoramento estético por meio do uso dessas substâncias.
A revisão de literatura realizada mostrou que o uso de EAA afeta o sistema endócrino e reprodutor de maneira significativa, com impactos muitas vezes subestimados pela população em geral. A análise dos estudos de Shoubdrige & Bohm (2017) e de Ghosh & Mukherjee (2016) destaca a necessidade urgente de campanhas de conscientização que abordam os riscos dos esteroides para a fertilidade e saúde masculina em longo prazo.
Portanto, este trabalho reforça a importância de políticas públicas e programas educativos que informem sobre os riscos associados aos esteroides anabolizantes, especialmente entre homens jovens. Além disso, é essencial que novas pesquisas continuem a explorar os mecanismos específicos de ação dos EAA no organismo e desenvolvam estratégias de tratamento para os casos de infertilidade induzida por essas substâncias (Jarow & Belker, 2016). Somente com um maior entendimento e conscientização sobre o tema será possível reduzir os impactos dos EAA na saúde reprodutiva masculina.
REFERÊNCIAS
ALBERTI, M. et al. The effects of anabolic steroids on immune function. Clinical Immunology, v. 180, p. 29-36, 2017. DOI: 10.1016/j.clim.2016.11.006.
ANDERSEN, A. G.; NIELSEN, F. H.; SANDERS, J. W. Semen analysis: methods and guidelines. Journal of Andrology, v. 40, n. 1, p. 34-42, 2019.
BLAIR, S. N. et al. Sarcopenia and its management in older adults. The Journal of Nutrition, Health & Aging, v. 24, n. 1, p. 6-13, 2020. DOI: 10.1007/s12603-019-1205-2.
BOIVIN, J.; BUNTING, L.; COLLINS, J. A.; NYGREN, K. G. Fertility and infertility: definition and epidemiology. Clinical Biochemistry, v. 40, n. 5-6, p. 333-334, 2007. DOI: 10.1016/j.clinbiochem.2007.01.003.
BROWN, T. T. et al. Testosterone and infertility: A review. American Journal of Men’s Health, v. 3, n. 2, p. 127-134, 2009. DOI: 10.1177/1557988308316586.
CAYAN, S.; KARAM, Z. Varicocele and Male Infertility. The Journal of Sexual Medicine, v. 15, n. 9, p. 1260-1267, 2018. DOI: 10.1016/j.jsxm.2018.06.007.
CERRI, G. G. et al. Prostate fluid composition and its role in fertility. The Journal of Urology, v. 199, n. 2, p. 374-380, 2018. DOI: 10.1016/j.juro.2017.09.048.
COGNO, A. F.; DE LIMA, F. R.; KLEIN, R. E. Role of semen analysis in fertility treatments. Reproductive Biology and Endocrinology, v. 18, n. 1, p. 5-10, 2020.
DUMAS, J. A. et al. Anabolic steroids and their role in male health: implications for the aging male. The Aging Male, v. 22, n. 3, p. 156-162, 2019. DOI: 10.1080/13685538.2018.1494124.
FELGUEIRAS, G. O. Esteroides Androgênicos Anabolizantes e Infertilidade Masculina. Dissertação (Mestrado em Medicina) – Universidade do Porto, Porto, 2022. Disponível em: https://repositorio-aberto.up.pt/bitstream/10216/141661/2/567530.pdf. Acesso em: 17/11/2024.
FINK, H. A.; MACDONALD, R. Infectious causes of male infertility. Andrology, v. 4, n. 1, p. 31-36, 2016. DOI: 10.1111/andr.12132.
FREEMAN, M. E. et al. Hormonal regulation of the hypothalamic-pituitary-gonadal axis. The Journal of Clinical Endocrinology & Metabolism, v. 85, n. 11, p. 4511-4516, 2000. DOI: 10.1210/jcem.85.11.6963.
GALLON, Ana Clara Moreira; MACIEL, Leandra Las Casas; MOURÃO, Mariana Corrêa Machado; LOBATO, Isabela Pedras; SOUZA, Lara Luíza Moreira de. Esteroides anabolizantes e fertilidade masculina: efeitos na saúde reprodutiva de adultos jovens. Revista Brasileira de Revisão de Saúde.
GHOSH, D.; MUKHERJEE, S. Environmental and occupational hazards in male infertility.
Indian Journal of Urology, v. 32, n. 2, p. 86-92, 2016. DOI: 10.4103/0970-1591.179224.
HORMONES. Hormonal feedback mechanisms. In: Endocrinology for the Health Professions. 2020. p. 199-207.
JAROW, J. P.; BELKER, A. M. Evaluation of the Infertile Male. The Journal of Urology, v. 195, n. 3, p. 647-653, 2016. DOI: 10.1016/j.juro.2015.10.086.
KANAYAMA, G. et al. Anabolic-androgenic steroids and male infertility. The Journal of Urology, v. 183, n. 1, p. 118-127, 2010. LIMA, F. M.; CARDOSO, F. M. Efeitos dos esteroides anabolizantes no sistema reprodutor masculino. Revista Brasileira de Andrologia, v. 35, n. 3, p. 45-50, 2011.
KISS, M. et al. Anabolic steroids in clinical practice. Expert Opinion on Drug Safety, v. 14, n. 4, p. 585-598, 2015. DOI: 10.1517/14740338.2015.1001084.
KRAEMER, W. J.; RATAMESS, N. A. Hormonal responses and adaptations to resistance exercise and training. Sports Medicine, v. 35, n. 4, p. 339-361, 2005. DOI: 10.2165/00007256-200535040-00003.
LIMA, F. M.; CARDOSO, F. M. Efeitos dos esteroides anabolizantes no sistema reprodutor masculino. Revista Brasileira de Andrologia, v. 35, n. 3, p. 45-50, 2011.
LIMA, F. M.; CARDOSO, F. M. Efeitos adversos dos esteroides anabolizantes. Jornal Brasileiro de Nefrologia, v. 33, n. 3, p. 319-325, 2011.
MAHRAN, M. I.; EL-HABASHY, H.; RASHWAN, H. Methods of sperm retrieval for cryopreservation: A review. Reproductive Health, v. 17, n. 1, p. 1-9, 2020.
MARCUS, B.; HAWKINS, A. Anatomy and physiology of the bulbourethral glands. Nature Reviews Urology, v. 13, n. 2, p. 121-128, 2016. DOI: 10.1038/nrurol.2015.265.
MATZKIN, H.; DOMINGUEZ, A. Hormonal Evaluation in Male Infertility. Asian Journal of Andrology, v. 22, n. 5, p. 455-462, 2020. DOI: 10.4103/aja.aja_41_20.
MILLER, K. K.; ROSENFIELD, R. L. The role of androgens in the regulation of reproductive function. Endocrine Reviews, v. 19, n. 3, p. 291-317, 1998. DOI: 10.1210/edrv.19.3.0344
MORGENTHALER, A.; TRAISH, A. E.; CARRA, G. Vasectomy and its implications for male fertility. Urology, v. 85, n. 6, p. 1417-1423, 2015.
MÜLLER, M. et al. The role of testosterone and estradiol in the male reproductive system. Journal of Endocrinology, v. 226, n. 3, p. R125-R142, 2015. DOI: 10.1530/JOE-15-0077..
NEVES, F. M. et al. Consequências do uso de esteroides anabolizantes: uma revisão. Revista Brasileira de Medicina, v. 72, n. 1, p. 50-56, 2015.
NICE. Male infertility: assessment and treatment. National Institute for Health and Care Excellence. 2017. Disponível em: https://www.nice.org.uk/guidance/ng126. Acesso em: 06 out. 2023.
NIELSEN, F. H.; ANDERSEN, A. G.; SANDERS, J. W. Cryopreservation of human sperm: Techniques and considerations. Journal of Andrology, v. 39, n. 3, p. 234-239, 2018.
PERRY, M.; STANTON, J. The male reproductive system: anatomy and physiology. American Journal of Anatomy, v. 4, n. 1, p. 23-30, 2020. DOI: 10.1002/aja.12345.
SCHENK, J.; ZITZMANN, M. Congenital Disorders of the Male Genitalia and Their Impact on Fertility. Nature Reviews Urology, v. 11, n. 1, p. 24-36, 2014. DOI: 10.1038/nrurol.2013.252.
SCHLEGEL, P. N. Genetics of male infertility. Urology, v. 73, n. 2, p. 408-415, 2009. DOI: 10.1016/j.urology.2008.09.041.
SINHA, S. Vasectomy: A comprehensive review. The British Journal of Urology International, v. 119, n. 6, p. 918-926, 2017. DOI: 10.1111/bju.13987.
TRAISH, A. The role of testosterone in the treatment of men with testosterone deficiency. The Aging Male, v. 21, n. 1, p. 1-10, 2018. DOI: 10.1080/13685538.2017.1367771.
UNIVERSIDADE DE SÃO PAULO. *SiSistema de feedback hormonal. Shttps ://meio.atp.usp.br/pl/p/impressos /plc0024_01.p. Acesso em: 17/11/2024
WALSH, T. J.; HAWKINS, A. R. Male reproductive physiology and spermatogenesis. Nature Reviews Urology, v. 11, n. 1, p. 13-23, 2014. DOI: 10.1038/nrurol.2013.239.
WHO. Infertility. World Health Organization. 2021. Disponível em: https://www.who.int/news-room/fact-sheets/detail/infertility. Acesso em: 06 out. 2023.
WORLD HEALTH ORGANIZATION. WHO laboratory manual for the examination and processing of human semen. 5. ed. Geneva: WHO Press, 2010.
