REGISTRO DOI: 10.69849/revistaft/th102411231427
Marina Morais Freitas
Orientador: Prof. Dr. Cláudio Carlos da Silva
ABSTRACT
The genotoxicity and mutagenicity potential of a substance can be assessed using cellular analysis and the mitotic index of dividing cells during the cell cycle of a test organism, as well as by analyzing events such as chromatid breaks, loss of entire chromosomes and their fragments, and the formation of micronuclei. Investigation of genotoxicity in plants has emerged as a viable strategy for evaluating the mutagenic potential of substances in therapies, as well as for monitoring environmental quality. Among the various bioassays used, the Allium cepa system stands out due to its simplified methodology, reduced operational costs, and efficacy validated by international bodies. The objective of this study was to evaluate the toxicity and genotoxicity of bisphenol A – glycidyl methacrylate (BisGMA), a composite resin widely used in dentistry. Despite its popularity, recent studies have raised concerns about its safety, including potential toxic and genotoxic effects, highlighting the need for investigation. In this study, three different concentrations of BisGMA composite resin – Opallis Flow® color A1 diluted in water heated up to 60°C were used, employing the Allium cepa test. Additionally, a negative control with mineral water and a positive control with Paracetamol 750 mg were used. Tests with Allium cepa revealed significant variations in mitotic indices in response to treatments, with solution B (BisGMA concentration of 5 mg/mL in distilled water) showing noteworthy results. Chromosomal aberrations such as migration errors and micronucleated cells were observed in all treatments except solution B after 24 hours. Although statistically significant differences were not found between treatments and controls, the results indicate the need for further studies to deepen the understanding of the genotoxic potential of the substances tested.
Keywords: Composite resin, Allium cepa, BisGMA, Toxicity.
RESUMO
O potencial de genotoxicidade e mutagenicidade de uma substância pode ser avaliado utilizando a análise celular e o índice mitótico de células em divisão durante o ciclo celular de um organismo teste, e pela análise de eventos, como quebras cromatídicas, perdas de cromossomos inteiros e de seus fragmentos, assim como a formação de micronúcleos. A investigação da genotoxicidade em plantas emerge como uma estratégia viável para avaliar o potencial mutagênico de substâncias em terapias, bem como para monitorar a qualidade ambiental. Dentre os diversos bioensaios utilizados, destaca-se o sistema Allium cepa devido à sua metodologia simplificada, custo operacional reduzido e eficácia validada por órgãos internacionais. O objetivo deste estudo foi avaliar a toxicidade e a genotoxicidade do bisfenol A – glicidil metacrilato (BisGMA), resina composta amplamente utilizada na odontologia Apesar de sua popularidade, estudos recentes levantaram preocupações sobre sua segurança, incluindo possíveis efeitos tóxicos e genotóxicos, destacando a necessidade de investigação. Neste estudo, foram utilizadas três concentrações diferentes da resina composta BisGMA – Opallis Flow® cor A1 diluídas em água sob aquecimento de até 60oC, utilizando o teste Allium cepa. Adicionalmente foi utilizado um controle negativo com água mineral e um controle positivo com Paracetamol 750 mg. Os testes com Allium cepa revelaram variações significativas nos índices mitóticos em resposta aos tratamentos, destacando-se a solução B (concentração de BisGMA 5mg/mL em água destilada). Aberrações cromossômicas, como erros de migração e células micronucleadas, foram observadas em todos os tratamentos, exceto na solução B após 24 horas. Embora não tenham sido encontradas diferenças estatisticamente significativas entre os tratamentos e os controles, os resultados indicam a necessidade de estudos complementares para uma compreensão mais aprofundada do potencial genotóxico das substâncias testadas.
Palavras-chave: Resina composta, Allium cepa, BisGMA, Toxicidade.
1.INTRODUÇÃO
As resinas compostas à base de bisfenol A – glicidil metacrilato (BisGMA), originalmente concebidas por Bowen na década de 1960 sofreram modificações destinadas a aprimorar suas propriedades mecânicas e estéticas. Simultaneamente, à medida que os pacientes buscam cada vez mais uma estética excepcional ao sorrir, houve um impulso para o desenvolvimento de resinas que, além de restaurar a forma e função dentária, contribuem para a harmonia natural do sorriso. Assim sendo, em virtude da capacidade de restabelecer a estética do sorriso, proporcionar restaurações tanto em dentes posteriores quanto anteriores e apresentar um custo inferior em comparação aos sistemas cerâmicos, o uso de resinas compostas tornou-se difundido na prática odontológica global, graças à sua variedade destes atributos positivos (LIMA et al., 2016).
Diversos materiais compósitos desempenham um papel fundamental na odontologia para a restauração de cavidades dentárias, devido à sua excelente afinidade à superfície dentária, rápida polimerização e resultados estéticos altamente satisfatórios. O BisGMA é uma resina composta comumente utilizada em odontologia, constituindo-se de uma base de resina associada a agentes de ligação dentinária. No entanto, estudos revelam que o BisGMA pode ser liberado de restaurações odontológicas fotopolimerizáveis após 24 horas de polimerização. Esta substância é facilmente absorvida pelo trato gastrointestinal, disseminando-se amplamente por todo o corpo humano. A liberação de BisGMA no organismo pode desencadear reações inflamatórias e/ou imunológicas. Pesquisas recentes destacaram que o BisGMA pode induzir danos celulares, alterações genéticas e provocar respostas inflamatórias em células da polpa dentária, linfócitos e macrófagos, conforme evidenciado por estudos in vitro. Apesar das evidências apresentadas, os mecanismos pelos quais o BisGMA induz tais alterações ainda não foram completamente esclarecidos. O entendimento desses processos é crucial para a avaliação dos riscos associados ao uso de resinas compostas na prática odontológica, bem como para o desenvolvimento de estratégias mais seguras e eficazes no campo da restauração dentária (KUAN et al., 2012).
Diversas substâncias odontológicas, tais como resina composta, cimentos de ionômero de vidro e amálgama, têm sido amplamente utilizadas na restauração de cavidades cariadas, exibindo diferentes níveis de eficácia. No entanto, o procedimento de capeamento indireto da polpa dentária humana utilizando resinas compostas pode desencadear a formação de odontoblastos reativos e provocar uma resposta inflamatória nos tecidos circundantes, sendo observado em uma proporção significativa de casos de restaurações desse tipo. Adicionalmente, o capeamento direto da polpa dentária exposta, empregando adesivos dentinários seguidos pelo preenchimento com resina composta, pode resultar em uma resposta inflamatória que varia de moderada a grave. Essa condição pode, em última instância, levar à formação de abscesso, indicando um desafio adicional associado a esse tipo de abordagem restaurativa. Esses desafios ressaltam a importância de uma abordagem cuidadosa e criteriosa na seleção de materiais e técnicas odontológicas. Garantir o sucesso nas restaurações dentárias não apenas contribui para a saúde bucal a longo prazo, mas também destaca a necessidade de aprimorar continuamente os métodos clínicos e materiais utilizados na prática odontológica (CHANG et al., 2010).
Os monômeros encontrados em resinas compostas, como dimetacrilato de trietilenoglicol (TEGDMA), 2-hidroxi-etilmetacrilato (HEMA) e BisGMA, têm a capacidade de se dissipar das restaurações e dos agentes de ligação da dentina, afetando a atividade das células da polpa dentária. A quantidade de monômeros liberados para a polpa dentária é influenciada pela solubilidade nos fluidos teciduais ou dentina, pela gravidade da cárie dentária e pela espessura remanescente da dentina após a remoção da cárie. Além disso, os monômeros de resina podem ser degradados pela esterase salivar. É importante destacar que o BisGMA liberado pode ser absorvido pelo estômago e intestino, distribuindo-se rapidamente pelo corpo. Posteriormente, é metabolizado e excretado na forma de BisGMA, ácido metacrílico e bisfenol-A-bis (2,3-dihidroxipropil) na urina de animais sob experimentação clínica/laboratorial. Uma questão importante reside na possibilidade desses monômeros liberados induzirem citotoxicidade, inflamação tecidual ou outros efeitos adversos, necessitando assim de estudos adicionais (CHANG et al., 2010).
Associadas a esse fator, as avaliações clínicas e laboratoriais destacam uma correlação entre o grau de conversão e as propriedades físico-mecânicas das resinas, tais como estabilidade de cor, resistência ao desgaste, à flexão ou à tração. A densidade de potência emitida pelas fontes de luz deve situar-se entre 300 mW/cm2 e 400 mW/cm2 para assegurar uma polimerização adequada de um incremento de resina composta com espessura entre 1,5 mm e 2 mm (LIMA et al., 2016).
A eficácia da unidade fotopolimerizadora está intrinsecamente relacionada à sua capacidade de emitir uma densidade de fótons suficiente para a absorção adequada, promovendo uma maior excitação das moléculas de canforoquinona (fotoiniciador) e, assim, favorecendo a polimerização. Durante esse processo, as moléculas de fotoiniciadores são ativadas pela luz, desencadeando a ativação subsequente dos monômeros, que reagem entre si para formar a cadeia polimérica. Contudo, é possível que alguns monômeros não reajam completamente, permanecendo aprisionados dentro da estrutura da resina polimerizada. Além de apresentarem potenciais problemas citotóxicos, esses monômeros não reagidos podem solubilizar-se na cavidade bucal, gerando espaços vazios na restauração e propiciando o surgimento de cáries secundárias o que acabam por se tornar um grande problema em consequência (KUAN et al., 2012; LIMA et al., 2016).
Estudos indicam que monômeros de resina, como TEGDMA, HEMA e BisGMA, podem induzir citotoxicidade diferencial e apoptose nas células da polpa dentária humana. A citotoxicidade causada pelos monômeros de resina é geralmente atribuída à geração de espécies reativas de oxigênio (ROS) e à depleção de glutationa (GSH). Além disso, os monômeros de resina podem ser metabolizados em intermediários reativos, como ácido metílico 2,3-epóxi-2-metilpropiônico (EMPME), ácido metacrílico (MA), ácido 2,3-epóxi-2-metil-propiônico (EMPA) e éter bisfenol-A-bis(2,3-dihidroxipropil), contribuindo ainda mais para a toxicidade dos monômeros por meio do aumento das ROS celulares, moléculas altamente reativas contendo oxigênio, que são produzidas durante vários processos metabólicos nas células (CHANG et al. 2010; KUAN et al. 2012; LIMA et al. 2016).
O crescimento celular e a apoptose são regulados pela progressão do ciclo celular, a qual é controlada por genes como CDK1, CDC25C, CDCNB1 e H3P23. Estudos sugerem que os monômeros de resina, como TEGDMA e HEMA, podem induzir alterações do ciclo celular e apoptose por meio da produção de ROS. No entanto, são limitados os estudos que investigam se o BisGMA altera a progressão do ciclo celular e os genes relacionados em níveis de RNA e proteína (CHANG et al., 2010).
A hemeoxigenase-1 (HMOX1) responde ao estresse oxidativo e pode desempenhar papel importante na proteção celular e na resolução da inflamação para manter a homeostase tecidual. A HMOX1 tem a capacidade de metabolizar e gerar produtos como monóxido de carbono (CO), biliverdina/bilirrubina e ferro ferroso. O CO pode suprimir a sinalização inflamatória, enquanto a biliverdina e a bilirrubina têm propriedades antioxidantes. Estudos mostram que o H2O2, um tipo de espécie reativa de oxigênio (ERO), pode estimular a expressão da HMOX1 em células da polpa dentária. Além disso, diversos monômeros de resina, como TEGDMA, HEMA e BisGMA, têm sido associados à produção de ERO em células da polpa dentária. Portanto, é interessante investigar se o BisGMA pode estimular a expressão da HMOX1 por meio da produção de ROS, suas vias de sinalização e o papel da HMOX1 na regulação da citotoxicidade do BisGMA (CHANG et al. 2010; KUAN et al. 2012).
O método de avaliação de alterações cromossômicas em raízes de Allium cepa é reconhecido como um teste eficiente para análise e monitoramento in situ da genotoxicidade e da mutagenicidade de substâncias, validado pelo Programa Internacional de Segurança Química (IPCS, OMS) e pelo Programa Ambiental das Nações Unidas – UNEP (BAGATINI; DA SILVA; TEDESCOLL, 2007).
Em seus estudos, Fiskesjo entre os anos de 1993/1994, ressaltou a importância e a utilidade dos sistemas de teste realizados em vegetais na avaliação dos riscos de genotoxicidade. Destacou que, apesar das diferenças metabólicas entre plantas e animais, existem similaridades relevantes, enfatizando a significância da ativação de pró-mutagênicos em plantas, especialmente considerando que os seres humanos consomem plantas tratadas com agentes químicos.
Os organismos vivos estão continuamente expostos a substâncias genotóxicas e/ou mutagênicas que podem resultar em danos celulares. Tais danos podem ser causados por agentes químicos, físicos ou biológicos que impactam processos vitais, como a duplicação e transcrição gênica, promovendo alterações cromossômicas, dentre outras. Estas mudanças podem culminar no desenvolvimento de câncer e morte celular (BAGATINI; DA SILVA; TEDESCOLL, 2007).
Dentre os vegetais, as espécies do gênero Allium são frequentemente utilizadas em estudos que visam compreender os mecanismos básicos e determinar os efeitos de diferentes agentes químicos. Na família Allium, a diversidade Allium cepa é amplamente reconhecida pela Royal Swedish Academy of Sciences como organismo modelo, sendo considerada um padrão de excelência na avaliação de efeitos clastogênicos e aneugênicos sobre o material genético (PARVAN et al., 2020).
Os estudos citogenéticos de espécies vegetais fornecem informações sobre alterações cromossômicas nas plantas devido à presença de agentes mutagênicos ou resultantes de seu metabolismo. A análise dos agentes mutagênicos em núcleos eucarióticos é realizada por métodos citológicos. A mutação pode ocorrer devido à ação de compostos químicos, ambientais e radioativos, bem como à estabilidade intrínseca dos ácidos nucleicos. Os agentes mutagênicos podem ser detectados citologicamente pela inibição do ciclo celular, interrupção em metáfases, indução de alterações numéricas e estruturais nos cromossomos e trocas entre cromátides irmãs, entre outros. Além de sua ampla utilização nos testes de citotoxicidade/mutagenicidade de plantas medicinais, o sistema de teste de Allium cepa pode ser empregado para monitorar a poluição ambiental e avaliar o potencial mutagênico de diversos compostos químicos. As células meristemáticas das raízes das plantas são indicadores adequados para detectar efeitos clastogênicos causados por poluentes do ambiente, especialmente para monitorar a contaminação da água e do solo (BAGATINI; DA SILVA; TEDESCOLL, 2007).
É importante ressaltar que esses testes são altamente sensíveis e possuem uma boa correlação com outros sistemas de teste, o que possibilita realizar múltiplas exposições ao mesmo composto para fins de monitoramento, aumentando significativamente sua versatilidade. Além de serem fáceis de serem realizados, com custo extremamente baixo, esses testes apresentam um crescimento rápido de suas raízes e permitem uma análise fácil devido à geração de muitas células em divisão (PARVAN et al., 2020).
O método do teste de Allium cepa é amplamente utilizado devido à sua sensibilidade e facilidade de execução. Os resultados obtidos através da análise dos padrões nucleolares atípicos revelam a presença de células com nucléolos heteromórficos, ou seja, com tamanhos e formas diferentes do usual. Essa evidência indica possíveis danos no processo de formação dos nucléolos, o que pode estar relacionado a exposição a substâncias tóxicas. Além disso, o aparecimento de micronúcleos é um importante indicador de quebra cromossômica. Essa condição resulta em células com fragmentos de cromossomos separados do núcleo principal. A presença de micronúcleos é um reflexo claro de distúrbios no processo de divisão celular, o que pode ser causado por substâncias genotóxicas (BAGATINI; DA SILVA; TEDESCOLL, 2007).
As substâncias genotóxicas podem causar danos ao material genético nas células por meio de interações com a sequência e a estrutura do DNA. Essas interações podem levar a anomalias cromossômicas em células de Allium cepa, o que contribui para a avaliação do potencial genotóxico de compostos químicos. Os agentes genotóxicos têm a capacidade de afetar a organização das organelas e compartimentos celulares, bem como alterar o ciclo celular, prejudicando suas fases normais. Essas alterações podem levar à formação de células aberrantes e até mesmo induzi-las à morte (PARVAN et al., 2020).
Nesse sentido, os testes de citotoxicidade e/ou genotoxicidade realizados utilizando o sistema teste Allium cepa fornecem informações valiosas sobre possíveis danos moleculares e genéticos causados por substâncias químicas. Essa análise tem sido fundamental para a segurança e proteção da saúde humana e do meio ambiente (BAGATINI; DA SILVA; TEDESCOLL, 2007).
Diversos mecanismos de manutenção da homeostase celular estão associados à divisão celular, ao metabolismo celular e à morte celular. A falha na reparação desses mecanismos pode levar à transformação neoplásica e ao início da formação de tumores. Portanto, as células não reparadas são direcionadas para a morte celular, conhecida como apoptose na patologia ou morte celular programada, com o objetivo de evitar o desenvolvimento de tumores. Portanto, é crucial investigar os fatores e as substâncias que podem interferir no ciclo celular, modificando-os de uma forma irreversível, o que pode ser o início de uma série de problemas de saúde, que podem ser minimizados, ou no melhor cenário extintos, totalmente evitados, como investigado neste estudo (PARVAN et al. 2020).
2. REVISÃO DA LITERATURA
2.1. Reabilitação Estética Odontológica (REO) e o Uso de Restauradores Dentários Compostos
A reabilitação estética odontológica (REO) refere-se a um conjunto de procedimentos odontológicos que têm como objetivo melhorar a aparência estética e funcional dos dentes e da região bucal de um paciente. Esse tipo de reabilitação é frequentemente procurado por pessoas que desejam corrigir imperfeições estéticas, como dentes desalinhados, descoloridos, pigmentados, desgastados, fraturados ou ausentes. A REO pode envolver uma combinação de diferentes tratamentos, dependendo das necessidades específicas de cada paciente. Esses procedimentos são realizados com base em um diagnóstico preciso, considerando as necessidades e expectativas do paciente, bem como aspectos funcionais, estéticos e de saúde bucal, com o objetivo de proporcionar um sorriso mais atraente, natural e funcional, melhorando a qualidade de vida do paciente (GUPTA et al. 2012).
Em questão da saúde bucal, destaca-se a cárie dentária (CD), doença oral comum que resulta da desmineralização progressiva do esmalte dentário e, eventualmente, da dentina. Essa desmineralização pode ser causada por ácidos produzidos por bactérias presentes na placa bacteriana, uma película pegajosa que se forma sobre os dentes. A CD é a doença crônica odontológica mais comum de adultos e crianças em muitas partes do mundo. Uma vez estabelecida, a cárie dentária requer tratamento para evitar a progressão da doença. Os materiais restauradores dentários compostos poliméricos são uma opção de tratamento, e são projetados para substituir o tecido biológico, tanto na aparência quanto na função (ROCHA et al., 2023).
O uso global de restauradores dentários compostos poliméricos está aumentando como resultado de vários fatores, incluindo estética melhorada, facilidade de manuseio e potencial de afinidade química com o tecido dentário, bem como percepções negativas e/ou restrições ao uso de amálgama de mercúrio. Em 2010, os restauradores dentários compostos poliméricos foram utilizados em aproximadamente 65% de todas as restaurações dentárias realizadas nos Estados Unidos (MOILANEN, DAHMS, HOBERMAN, 2013).
Face ao desenvolvimento de novos materiais, especialmente de origem resinosa com propriedades restaurativas estéticas e funcionais dos dentes, a Odontologia vem substituindo o modelo de ação intervencionista por procedimentos preventivos e de preservação com mínima restauração (LÓPEZ, PONTES, TENÓRIO, 2015).
Primariamente, são a abordagem mais conservadora na reabilitação estética e funcional em pacientes jovens, como na agenesia dos incisivos laterais superiores. Além disso, possuem uma extensa gama de finalidades, como selante de fissuras e fossas, cimento cimentante ou material temporário e adesivo para bráquetes ortodônticos e próteses (ROCHA et al., 2023).
O desenvolvimento de materiais restauradores odontológicos compósitos com desempenho e biocompatibilidade aceitáveis é extremamente desafiador. O produto resultante deve ter uma vida útil estável de vários anos, além da capacidade de reagir rapidamente no ambiente clínico para formar um polímero reticulado com alto módulo, alta dureza e alta temperatura de transição vítrea. Ao mesmo tempo, o material deve corresponder à expansão térmica do dente, minimizar componentes extraíveis e absorção de umidade, ser química e toxicologicamente inerte, ter potencial mínimo de retração e estresse de encolhimento e apresentar aparência estética. Até o momento, as formulações de resinas de metacrilato representam a abordagem mais bem sucedida comercialmente para atender aos complexos critérios de desempenho para essa categoria de materiais odontológicos, e os compósitos contemporâneos à base de metacrilato atualmente dominam o mercado comercial (MOILANEN, DAHMS, HOBERMAN, 2013).
Apesar de os compósitos de resina dentária terem melhorado suas propriedades físico-químicas, a preocupação com sua toxicidade intrínseca permanece alta. Alguns componentes das resinas compostas restauradoras são liberados no ambiente bucal inicialmente durante a reação de polimerização e posteriormente devido à degradação do material (GUPTA et al., 2012).
As necessidades estéticas do paciente fizeram com que o especialista clínico realizasse cada vez mais restaurações com resinas compostas, mesmo em superfícies que sofram diretamente a ação de grandes cargas mastigatórias, em especial as superfícies oclusais dos dentes posteriores ao nível das cúspides de trabalho e as funcionais da parte anterior. No entanto, o alto nível de desgaste que apresentam, resultado da carga que ocorre sobre eles em muitos casos, pode levar à diminuição da dimensão vertical e afetar o equilíbrio do sistema estomatognático, além de possibilitar a ingestão de resíduos tóxicos da resina, liberados pelo atrito associado ao calor dos alimentos (SILVA, DA SILVA, MENDONÇA, 2018).
2.2. Restauradores Dentários Compostos
Segundo ROCHA e colaboradores (2023) o BPA (bisfenol A) é um composto químico amplamente utilizado na produção de plásticos e resinas enquanto o BisGMA (metacrilato de glicidil de bisfenol A) é um monômero largamente utilizado na fabricação de resinas compostas dentárias. Trata-se de um composto sintético, derivado do bisfenol A, sendo conhecido por suas propriedades de polimerização, que o tornam adequado para uso em odontologia estética. O BisGMA apresenta propriedades essenciais de resistência mecânica, polimerização rápida e baixa retração que são chaves para o desempenho funcional de compósitos odontológicos, e por esse motivo tem sido muito utilizado como resina acrílica na odontologia.
O início da comercialização de compósitos odontológicos à base de BisGMA ocorreu na década de 1960. Embora a identificação de monômeros alternativos para o desenvolvimento de novos produtos continue sendo uma área ativa de pesquisa, estima-se que o BisGMA seja um componente em mais de 70% de todos os restauradores compostos atualmente comercializados (MOILANEN, DAHMS, HOBERMAN, 2013).
O BPA, presente nas resinas, é um dos resíduos tóxicos mais preocupantes. Assim como outros compostos naturais e sintéticos, ele tem a capacidade de imitar as ações do hormônio estrogênio em células vivas e animais. Essa atividade estrogênica tem sido associada a alguns problemas de saúde, tais como câncer de mama e de próstata, distúrbios metabólicos e disfunção reprodutiva (SILVA, DA SILVA, MENDONÇA, 2018).
Segundo os estudos de DURSUN e colaboradores (2016) além do BPA e BisGMA, as resinas restauradoras poliméricas podem apresentar o dimetacrilato (Bis-DMA), policarbonato modificado (PC BisGMA), bisfenol A glicol dimetacrilato etoxilado (Bis-EMA) e 2,2-Bis[(4-metacriloxipolietoxi) fenil] propano (Bis-MPEPP). A presença de BPA e o BisGMA devido à degradação/hidrólise do Bis-DMA e demais derivados tem sido relatada. O BisGMA é o monômero de base predominante usado no compósito resina-matriz, e sua estrutura química pode impedir a hidrólise, evitando a liberação do BPA. No entanto, o BPA pode ser uma impureza da fabricação de BisGMA se a polimerização não for completa (ROCHA et al. 2023). A Figura 1 apresenta em destaque as estruturas do BPA e BisGMA.
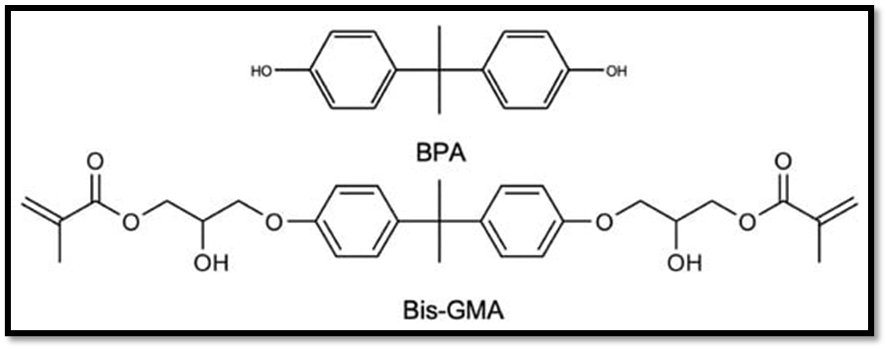
Figura 1. Estruturas químicas dos compostos Bisfenol A e BPA e Metacrilato de glicidil de bisfenol A (BisGMA) conforme ROCHA e colaboradores (2023).
Evidências indicam que a exposição ao BPA está associada a um risco aumentado de desenvolver diabetes mellitus tipo 2, obesidade, efeitos imunológicos adversos e alterações no desenvolvimento neuroendócrino. Além disso, foi sugerido que as exposições pré-natais ao BPA estão associadas ao desenvolvimento neurocomportamental infantil. As crianças associam positivamente restaurações compostas (com BPA) e transtorno de déficit de atenção e hiperatividade (ROCHA et al., 2023).
O BisGMA é uma das principais fontes de liberação de BPA de materiais de resina dental. Portanto, várias pesquisas propuseram uma nova formulação (usando dimetacrilatos não-BPA) para substituir o monômero BisGMA em formulações de resina para reduzir a exposição humana a derivados de BPA. Assim, o uretano-dimetacrilato (UDMA), outro monômero típico do dimetacrilato aplicado na odontologia, tem sido utilizado para substituir o BisGMA como resina base de materiais odontológicos. Infelizmente, a resina à base de UDMA apresentou uma limitação crítica em sua maior contração de polimerização. A maior contração de polimerização da resina a base de UDMA poderia levar a um gap marginal mais significativo entre o dente e as restaurações, desenvolvendo uma probabilidade complexa de cárie secundária (ROCHA et al., 2023).
A composição das resinas compostas inclui uma matriz orgânica e uma matriz inorgânica. Relativamente à matriz orgânica, temos como seus principais componentes o sistema ativador (este sistema é o responsável pelo começo da polimerização), os pigmentos e os inibidores da polimerização, que permitem aumentar o tempo de trabalho. Existem ainda as partículas de preenchimento, bem como agente de união (faz a ligação entre as partículas de preenchimento e a matriz orgânica da resina) (PACHECO, 2015).
Portanto, composições alternativas de monômeros de BisGMA foram introduzidas para resolver as limitações deste produto em termos de durabilidade e toxicidade. Uma alternativa aos compósitos de matriz resinosa à base de metacrilato é uma organocerâmica híbrida, conhecida como ORganically MOdified CERamic (ORMOCER, VOCO, Cuxhaven, Alemanha), que é um ORMOSIL (Organically Modified SILicate). Uma das características mais importantes do ORMOCER é a combinação de grupos polissiloxano com grupos metacrilato fotopolimerizáveis ligados covalentemente a cargas de sílica. O oxigênio é substituído por grupos orgânicos, desenvolvendo-se em um material polimerizado tridimensional com menos matriz orgânica do que os compósitos convencionais de matriz resinosa. ORMOCER fornece alta biocompatibilidade devido à inexistência de monômeros residuais, menor contração de polimerização, alta resistência ao desgaste, maior opacidade e melhores características de manuseio (ROCHA et al., 2023).
A retenção das resinas compostas aos tecidos dentais é um fator muito levado em consideração quando se deseja um procedimento eficiente associado ao fator estético também à conservação da estrutura dental quando da comparação com outras técnicas restauradoras, fato que vem aumentando consideravelmente o uso clínico das resinas e, por conseguinte, o consumo do bisfenol A presente no BisGMA, base dos compostos restauradores atuais. O fomento no emprego das resinas compostas como material restaurador é motivo de preocupação entre os pesquisadores que veem na toxicidade de alguns dos seus componentes possíveis efeitos nocivos à saúde (SILVA, DA SILVA, MENDONÇA, 2018).
A maioria dos revestimentos dentários fotopolimerizáveis contêm uma mistura cuidadosamente selecionada de monômeros acrílicos mono e multifuncionais, sendo o BisGMA, um dos mais amplamente utilizados (SILVA, DA SILVA, MENDONÇA, 2018).
O principal componente da saliva é a água. Como o compósito de resina é um material polar, as moléculas de água podem penetrar facilmente na rede polimérica, permitindo a difusão de monômeros e/ou aditivos não ligados ou não polimerizados da rede de materiais. Portanto, pode-se esperar que um material dentário polimérico típico fique saturado com seu ambiente aquoso dentro de um a dois meses após a colocação (GUPTA et al., 2012).
Os polímeros podem ser degradados em soluções aquosas através de dois mecanismos principais: hidrólise passiva e reação enzimática. A extensão da degradação enzimática está provavelmente relacionada com a extensão da polimerização da resina, porque os grupos ésteres podem estar mais disponíveis para ataque em redes mais frouxamente cruzadas. No entanto, a composição dos monômeros que produzem a rede é de importância primária na determinação da extensão da degradação, especialmente quando as enzimas são responsáveis (GUPTA et al., 2012).
Durante a exposição ao ambiente oral, a biodegradação de materiais compósitos resinosos também pode ser induzida pela fadiga, que é causada por cargas repetitivas relativamente fracas, como a força mastigatória comum. A aplicação contínua de cargas mecânicas e ambientais leva à degradação progressiva e ao início e crescimento de trincas, resultando em falha catastrófica das resinas. Este processo é ainda auxiliado por vazios pré-existentes introduzidos durante o processamento do material e tensões residuais (GUPTA et al., 2012).
Comer e beber rotineiramente podem induzir mudanças na temperatura intraoral. Essas mudanças de temperatura produzem um ambiente antagônico para os materiais, pois eles têm um coeficiente de expansão térmica diferente em relação ao dente natural. As flutuações térmicas encontradas in vivo podem induzir tensões superficiais devido aos altos gradientes térmicos próximos à superfície que, por sua vez, podem levar à degradação desses materiais. A ingestão diária de alimentos e bebidas também pode afetar os materiais odontológicos pelo seu efeito direto ou sua capacidade de alterar os valores de pH intraoral (GUPTA et al., 2012).
Uma interação entre micróbios orais e a rede polimérica também pode ocorrer, embora existam poucas informações atuais sobre essa possibilidade. Um estudo in vitro mostrou que bactérias podem colonizar superfícies de resina composta e que a rugosidade superficial do material aumentou após incubação com bactérias, sugerindo alguma degradação superficial. É provável que essa degradação superficial seja resultado de ácidos produzidos pelas bactérias. Em geral, esses fatores são responsáveis pela degradação coletiva do polímero. Por exemplo, o efeito da água na saliva pode ser agravado com forças mastigatórias ou mudanças térmicas (GUPTA et al. 2012).
O aumento na concentração de BisGMA leva ao aumento da viscosidade das soluções (maior peso molecular e menor mobilidade das moléculas de BisGMA) devido às diferentes estruturas moleculares dos monômeros que compõe as soluções. Por este motivo é muito empregado pelos fabricantes de resinas compostas, pois a alta viscosidade do monômero de BisGMA atua como diluente de compostos de menor viscosidade, agindo como facilitador para se alcançar uma viscosidade ideal que permita a incorporação das partículas no processamento destes compósitos (SILVA, DA SILVA, MENDONÇA, 2018).
As resinas possuem uma porção orgânica (monômeros) responsável pela contração e degradabilidade do material, e outra inorgânica (carga), que aumenta sua viscosidade (vidros de quartzo, bário, silicato, alumínio e sílica coloidal), e cuja adição diminui a fração orgânica e aumenta a resistência. Assim, conforme suas aplicações clínicas (mudança de formato dental, restauração de fraturas, preenchimento de cavidades provocadas por cárie, minimização de imperfeições do esmalte dentário etc.), existem formulações resinosas mais viscosas ou mais fluídas que melhor são aplicadas a cada situação (LÓPEZ, 2015).
Os monômeros utilizados como matéria-prima da porção orgânica, como BisGMA (bisfenol glicidilmetacrilato), TEGDMA (trietilenoglicol dimetacrilato), UDMA (uretano dimetacrilato) e HEMA (hidroxietil metacrilato), apresentam pesos moleculares, propriedades hidrofílicas, reatividade e viscosidade variados, o que altera a velocidade de formação de seu polímero final. Quanto mais polimerizado e biocompatível for o material, menor será o número de monômeros livres, porém o ambiente bucal sofre constantes alterações que acarretam a decomposição e liberação destes. Ao interagirem com distintos receptores e estruturas celulares, disparam reações tóxicas, alérgicas, infamatórias e carcinogênicas – não só para cavidade oral, mas também para via gastrointestinal e demais tecidos que os absorverem. Isso é motivo de preocupação para a saúde tanto do paciente quanto do profissional que o trata, visto que monômeros de baixo peso molecular atravessam luvas e são absorvidos através da epiderme (LÓPEZ, 2015).
O TEGDMA é hidrofílico e interfere nos tecidos bucais. O composto pode penetrar membranas e reage com moléculas intracelulares. Especificamente, os aditivos de glutationa-TEGDMA são formados um mecanismo que reduz a potência desintoxicante celular (GUPTA et al., 2012).
2.3. Contexto Histórico das Resinas Restauradoras & Saúde
O BPA foi descoberto em 1831 pelo químico russo A.P. Dianin, mas em 1905, o alemão T. Zincke aprimorou sua síntese, por meio da condensação da acetona com dois equivalentes de fenol e ácido clorídrico como catalisador, ou uma resina de poliestireno sulfonada e concentração maior de fenol para garantir a reação. Em meados de 1930 já se sabia que o BPA era um análogo do estrogênio utilizado para acelerar o crescimento de gado e aves e aumentar a produção de prolactina em mulheres, ainda que outros estudos realizados em diferentes condições tenham reforçado a influência sobre a biossíntese de estrógeno e proliferação de células da hipófise anterior primária e GH3, mas não sobre a produção de prolactina, ou às funções da tireóide e de células assassinas naturais (LÓPEZ, 2015).
Em 1953, de forma independente, H. Schnell e D. Fox desenvolveram processos de síntese de policarbonato – polímero este bastante estável, flexível e resistente. A partir de então, tem sido usado na produção de resinas epoxi e derivados para confecção de garrafas descartáveis, recipientes para armazenamento de alimentos, tubulações de água, retardador de chama, adesivos, etc., com novas aplicações sendo continuamente desenvolvidas (revestimento interno de latarias, material odontológico a base de BisGMA, como resinas de restaurações provisórias e compostas, cimentos resinosos e de ionômero, coroas protéticas, dessensibilizantes dentinários, restauradores estéticos, lentes de óculos, discos compactos, material elétrico/eletrônico, eletrodomésticos, tintas em pó, papel térmico, etc.) (LÓPEZ, 2015).
Na prática odontológica, após a escultura para efetuar restaurações, as resinas epóxi são usadas combinando adesivos e agentes de presa (catalisador ou endurecedor, derivado de amina ou ácidos anidridos). O BPA é sujeito a polimerização iniciada por ativação química (produtos autopolimerizáveis que utilizam peróxido de benzoíla como iniciador) ou radiação luminosa (fotopolimerizáveis) a 400-500 nm. Esta última excita (triplete) o fotoiniciador estável canforoquinona e abstrai um próton da amina alifática aceleradora, formando um complexo excitado que origina dois radicais livres (LÓPEZ, 2015).
Os monômeros e produtos que não participam da polimerização podem ou reagir com átomos de hidrogênio e oxigênio ou com grupos de radicais carbônicos retidos no material restaurador, facilitando sua transformação, ou entrar em contato com a polpa dental através dos túbulos dentinários. Podem também permanecer na cavidade bucal, aumentando o risco de carcinogênese num ambiente já em constante exposição a outros agentes mutagênicos (álcool, fumo, radiação solar, variações de temperatura, agressões físicas e processos infamatórios) (LÓPEZ, 2015).
A ingestão diária desse composto pode ter efeitos nocivos à saúde humana (SILVA, DA SILVA, MENDONÇA, 2018). Nas fases iniciais da inflamação, os macrófagos desempenham funções importantes como a destruição de patógenos, remoção de neutrófilos apoptóticos e apresentação de antígenos aos linfócitos T. Os macrófagos podem iniciar uma resposta imune liberando citocinas pró-inflamatórias, como a interleucina (IL)-1β e IL-6. A produção de óxido nítrico (NO) por meio da sintase induzível (iNOS) em macrófagos é essencial para combater agentes infecciosos intracelulares. Além disso, espécies reativas de oxigênio (EROs), como o ânion superóxido, peróxido de hidrogênio e radical hidroxila, também desempenham um papel crucial na manutenção do microambiente. No entanto, a produção excessiva de NO e EROs pode causar danos às células e aos tecidos, levando ao desenvolvimento de inflamação. A compreensão dos mecanismos pelos quais o BisGMA induz inflamação é um campo em constante investigação (KUAN et al. ,2012).
Os compósitos podem conter BPA como uma impureza do processo de síntese de BisGMA, mas também há indicações de que o BPA pode ser liberado de compósitos após a degradação de BisGMA. A liberação de 24 horas de BPA de materiais dentários pode ser relevante em pacientes com múltiplas grandes restaurações e que materiais dentários à base de resina podem representar uma fonte relevante de BPA ao lado de alimentos contaminados, especialmente em caso de grandes e/ou múltiplas restaurações, sendo necessárias maiores investigações, especialmente em relação à segurança de restaurações em resina composta em crianças. No entanto, até o momento, nenhuma organização regulatória ou profissional expressou preocupação com os efeitos dos bisfenóis nos materiais dentários sobre a saúde (GUPTA et al., 2012).
2.4. Toxicidade do BPA, BisGMA e seus derivados relacionados ao uso odontológico
As propriedades estrogênicas do BPA são conhecidas desde a década de 1930, porém, só recentemente os resultados dos estudos com ele desenvolvidos sugerem que a exposição ao BPA, mesmo aquelas na faixa geralmente comercializada, podem ter efeitos adversos na saúde humana e especialmente no desenvolvimento infantil. Os autores afirmam ainda que mais de 2 milhões de toneladas do produto são produzidas por ano com previsão de 6% a 10% de crescimento na demanda futura (SILVA, DA SILVA, MENDONÇA, 2018).
O bisfenol A diminui a síntese de nefrina e podocina, proteínas de clivagem de filtração envolvidas tanto nos mecanismos de proteinúria (é um bom preditor da progressão da doença renal) como na sobrevivência de podócitos (compõe a formação da cápsula glomerular do rim) (SILVA, DA SILVA, MENDONÇA, 2018).
Monómeros BisGMA e UDMA têm efeitos nocivos sobre os fibroblastos da gengiva humana, designadamente, efeitos citotóxicos e genotóxicos, ou seja, para além de matarem as células (citotoxicidade) afetam diretamente a estrutura da cadeia dupla de DNA (genotoxicidade). Também foi afirmado por outros autores que os monómeros das resinas são muito tóxicos para os fibroblastos gengivais, nomeadamente quando postos em contacto com o BisGMA e o UDMA (PACHECO, 2015).
Por outro lado, em um estudo recente, os pesquisadores concluíram que, independentemente do tempo de ativação da luz, a resina composta experimental apresentou efeitos leves ou nenhum tóxico para as células MDPC-23 semelhantes aos odontoblastos. No entanto, intensos efeitos citotóxicos ocorreram quando o material à base de resina não foi fotopolimerizado, ou não fotopolimerizada devidamente (GUPTA et al. 2012).
O acabamento e o polimento também são essenciais para eliminar a camada externa rica em resina que pode ser a fonte de monômeros não reagidos efluídos na cavidade oral. Vários estudos têm demonstrado diferentes procedimentos de acabamento e polimento, como a utilização de brocas de acabamento multilaminadas de metal de 12 pontos e discos Sof-Lex, que são defendidos por proporcionar a superfície mais lisa (ROCHA et al. 2023).
Ao avaliar os efeitos do BPA no Sagui comum adulto (Callithrix jacchus) cuja espermatogênese guarda semelhanças com a humana, foi possível observar alterações ultra estruturais na morfologia testicular causadas pelo BPA, entre elas efeitos degenerativos na membrana basal, nas células de Sertoli, nas células de Leydig e em outras células germinativas em desenvolvimento, podem ser indicativas de uma produção perturbada de espermatozóides (SILVA, DA SILVA, MENDONÇA, 2018).
Ainda na área de reprodução humana, a gonadotrofina coriônica humana (hCG) é um hormônio de considerável importância no estabelecimento, promoção e manutenção da gravidez. Em uma extensa revisão de trabalhos científicos, ficou esclarecido que a exposição a produtos químicos de desregulação endócrina, particularmente do bisfenol A, podem alterar a produção de hCG e através desta ação exercer uma grande variedade de complicações na gravidez, como abortos, anomalias cromossômicas fetais, pré-eclâmpsia, distúrbios no crescimento e desenvolvimento fetal, doenças trofoblásticas gestacionais entre outras (SILVA, DA SILVA, MENDONÇA, 2018).
O aumento da concentração de substâncias tóxicas, nomeadamente dos monómeros BisGMA e MMA, pode levar à diminuição de leucócitos para o local onde está a ocorrer a inflamação. Estas substâncias podem alterar a normal função da célula, contribuindo assim para reações biológicas adversas (PACHECO, 2015).
Atualmente, os sistemas de resinas mais utilizados na odontologia são os metacrilatos. Esses sistemas consistem em uma matriz orgânica polimerizável que contém monômeros de base, como o bisfenol A-glicidil metacrilato (BISGMA), o dimetacrilato de uretano (UDMA) e monômeros diluentes, como o dimetacrilato de trietilenoglicol (TEGDMA).
Os monômeros de metacrilato desempenham um papel fundamental na obtenção das características desejadas dos materiais odontológicos à base de resina. A polimerização desses monômeros é induzida pela luz, no entanto, alcançar uma reação completa ainda é um desafio. De acordo com a literatura, a polimerização ideal para compósitos odontológicos fotopolimerizáveis recém-produzidos é em torno de 30-40%, podendo chegar a 50-70% após 24 horas. Devido à polimerização relativamente pobre, é possível ocorrer a liberação de monômeros de resina não reagidos dos compósitos odontológicos, principalmente nas primeiras 24 horas após a aplicação. Esses monômeros continuam a ser liberados por vários dias após a polimerização, tanto devido à presa incompleta como pela degradação natural. Esse processo prejudica a biocompatibilidade, uma vez que há evidências de que esses monômeros perturbam o ambiente, influenciando a função de diferentes tipos de células. Como resultado, reações biológicas adversas a componentes da resina, como toxicidade local e sistêmica, reações pulpares, alergias, genotoxicidade e citotoxicidade, têm sido relatadas (GAJEWSKI et al., 2012).
O monómero BisGMA é liberado da resina composta fotopolimerizada, apenas 24h depois de ter ocorrido a contração de polimerização. A partir daí, ele pode ser rapidamente incorporado no estômago ou intestinos e ser assim distribuído pelo organismo (PACHECO, 2015).
Estudos in vitro e in vivo identificaram claramente que esses componentes das resinas compostas restauradoras são tóxicos (GUPTA et al., 2012). Qualquer incapacidade ou resposta inflamatória excessiva pode levar a danos nos tecidos. Nessa situação, quando uma restauração de resina composta entra em contato com os tecidos gengivais e libera monômeros no local, pode causar mudanças nos processos celulares periodontais, agindo como um fator estressor local (GAJEWSKI et al., 2012).
Os adesivos dentários contêm o BisGMA. A presença desse componente em materiais odontológicos pode ocasionar danos às células humanas. Estudos utilizando um teste de toxicidade in vitro do BisGMA em leucócitos polimorfonucleares de pacientes saudáveis e com neoplasia maligna. Os resultados indicaram que o BisGMA pode ser considerado um agente tóxico para os leucócitos polimorfonucleares (AMORIM et al., 2023).
O bisfenol A (BPA) é um componente orgânico da família dos aromáticos amplamente utilizado como monômero em adesivos dentários, resinas compostas, resinas acrílicas e selantes odontológicos. É encontrado também em mamadeiras, garrafas, embalagens de alimentos, entre outros materiais. No entanto, devido aos efeitos nocivos relatados na literatura, o BPA vem sendo retirado de uso na última década pelo órgão regulador no Brasil – ANVISA, que tem a responsabilidade de regular e fiscalizar produtos e serviços que possam representar riscos à saúde da população brasileira (CHANG et al., 2010).
No âmbito odontológico, são necessários estudos adicionais sobre a utilização do BisGMA em materiais odontológicos. Uma extensa revisão de literatura realizada por AMORIM e colaboradores (2023) evidencia uma relação prejudicial entre o BPA e a saúde humana, abrangendo áreas como fertilidade, produção hormonal, distúrbios endometriais, distúrbios metabólicos e formação de células cancerígenas. Diante disso, este estudo avaliou o potencial carcinogênico do adesivo dentinário AdperMR Single Bond 2, que contém BisGMA e BPA, utilizando Drosophila Melanogaster como modelo experimental por meio do Epithelial Tumor Test (ETT). É importante utilizar materiais odontológicos que não causem danos aos pacientes, considerando o contato direto com os tecidos dentários. Neste estudo, não foram avaliados componentes específicos do adesivo dentinário, mas sim o produto como um todo, diferenciando-se dos trabalhos publicados anteriormente. No entanto, os resultados obtidos indicaram um potencial carcinogênico semelhante aos encontrados em outros estudos, com uma relação inversamente proporcional entre a diluição do adesivo e o número de tumores, ou seja, quanto maior a diluição do adesivo, menor o número de tumores observados (AMORIM et al., 2023).
No entanto é importante ressaltar que todo procedimento sempre que possível, seja feito sob isolamento absoluto. Impedindo a deglutição de qualquer quantidade de produto mesmo que mínima, como é costumeiro o uso de pouca quantidade de adesivo e até mesmo resina composta na odontologia. Semelhante aos resultados de pesquisas anteriores, o BisGMA mostrou marcada citotoxicidade para células da polpa dentária analisada pelo ensaio de MTT – ensaio usado para medir a viabilidade celular ou a atividade metabólica de células vivas. O BisGMA reduziu a atividade mitocondrial desidrogenase das células pulpares em 49% e 88% nas concentrações de 0,1 e 0,25mM, respectivamente. Assim, o BisGMA também suprimiu a viabilidade das células pulpares em 61% e 99% nas concentrações de 0,1 e 0,25M, o que nos leva a concluir que restaurações de resina composta feitas mais próximas a polpa dentária, pode induzir a morte pulpar, e suas consequências, tais como: lesões periapicais, abscessos dento-alveolares, dentre outros, levando o paciente a um quadro de dor aguda (CHANG et al., 2010).
2.5. Demais efeitos das resinas compostas sobre a saúde
O metacrilato de glicidila (BisGMA), como já foi mencionado anteriormente, é um monômero presente na composição das resinas compostas, material amplamente usados em restaurações dentárias e que contém bisfenol A em sua composição. Embora o BPA seja um material resistente, sua liberação no ambiente oral é possível quando a polimerização é incompleta ou através de hidrólise provocada por certas condições de temperatura e pH, causando efeitos biológicos adversos nas células humanas.
Em experimento foi comprovado que o BisGMA tem efeito citotóxico e que mesmo com a polpa exposta a concentrações inferiores, é capaz de recuperar sua viabilidade, quando o BisGMA é removido (SILVA, DA SILVA, MENDONÇA, 2018).
O BisGMA também é considerado citotóxico com capacidade para alterar o ciclo celular e induzir o estresse oxidativo levando a apoptose e necrose de forma dependente da concentração. Estudos mostraram que o BisGMA é genotóxico para linfócitos humanos. Ele provocou rupturas severas de DNA de cadeia dupla em linfócitos humanos no plasmídeo de DNA isolado, sugerindo que o BisGMA pode interagir diretamente com o DNA e ser o responsável por um atraso do ciclo celular na fase S7 (SILVA et al., 2018).
A maioria dos estudos monitorou a liberação de BPA e negligenciou o BisGMA, alegando que o BPA pode ser encontrado em compósitos odontológicos, apresentando-se como uma impureza do processo de síntese e/ou possivelmente como um produto de degradação de monômeros à base de BPA, uma vez que o BPA em si não é um ingrediente intencional. Outra razão são os efeitos estrogênicos relatados para BPA, mas não para BisGMA. Embora os estudos se concentrem principalmente no BPA, que geralmente não é quantificado ou é qualificado em baixas concentrações, a toxicidade pode estar associada ao seu derivado, BisGMA, e outros análogos. O monômero BisGMA é considerado citotóxico e inflamatório. Além disso, altas doses de BisGMA têm sido associadas ao aumento do peso líquido uterino e do conteúdo de colágeno uterino em ratas ovariectomizadas e à redução da fertilidade em ratos machos (ROCHA et al., 2023).
Pacientes que utilizaram resina relataram reações alérgicas causadas por moléculas de BisGMA (SILVA, DA SILVA, MENDONÇA, 2018). Em um estudo que avaliou apoptose e necrose por citometria de fluxo, o monômero BisGMA foi testado em bactérias da microbiota periodontal. O estudo incubou BisGMA com P. gingivalis e concluiu que essa combinação induziu um aumento significativo na porcentagem de monócitos necróticos em comparação com o BisGMA isoladamente (GAJEWSKI et al., 2012).
2.6. Teste Allium cepa
A crescente liberação de agentes químicos perigosos no ambiente está comprometendo a estabilidade dos ecossistemas naturais, gerando preocupações significativas entre pesquisadores e entidades governamentais em relação à saúde dos organismos vivos. Os efeitos genotóxicos e mutagênicos desencadeados por essas substâncias emergem como questões críticas para os organismos expostos, devido ao potencial de causar danos genéticos e provocar uma gama de problemas de saúde. Vale destacar que tais alterações genéticas podem ser transmitidas para as gerações futuras, agravando ainda mais a situação. Diante desse cenário, têm sido desenvolvidos diversos ensaios de genotoxicidade e mutagenicidade, visando identificar compostos que interajam de maneira adversa com a estrutura do DNA. Essas avaliações desempenham um papel essencial na garantia da qualidade ambiental, fornecendo insights valiosos para a gestão e mitigação dos impactos decorrentes da exposição a agentes químicos prejudiciais. A implementação desses métodos é fundamental para preservar a integridade genética das populações e assegurar um ambiente saudável para as gerações presentes e futuras (LEME, APARECIDA, MORALES, 2009).
Os ensaios empregando bulbos de Allium cepa destacam-se por sua eficiência, apresentando baixo custo e curto período de execução, o que os torna valiosos para estudos direcionados à prevenção e controle de danos ambientais. Além dessa economia de recursos, esses ensaios demonstram elevada sensibilidade e uma correlação consistente com outros sistemas-teste, possibilitando a repetição de exposições ao mesmo composto para fins de monitoramento. Sua execução é facilitada pela simplicidade dos testes, que se traduz em um crescimento rápido das raízes e na geração abundante de células em divisão, simplificando a análise. Essa combinação de atributos não apenas otimiza custos e tempo, mas também confere robustez e versatilidade a esses ensaios, tornando-os instrumentos eficazes para avaliações contínuas do impacto de compostos ambientalmente relevantes (PARVAN et al., 2020).
O teste Allium cepa tem sido amplamente utilizado em diversas análises, abrangendo desde a avaliação da genotoxicidade de medicamentos até a análise de infusões de plantas medicinais e a verificação da qualidade das águas de rios. Quando necessário, esse método pode ser complementado pelo teste cometa, focado na análise da fragmentação do DNA celular, possibilitando uma correlação mais precisa dos efeitos encontrados e investigação mais aprofundada de suas causas. Assim, a realização do teste cometa fornece um complemento valioso aos ensaios de genotoxicidade, sugerindo, ainda, a inclusão de um número mais expressivo de bulbos para os grupos de controle, visando aprimorar o poder estatístico nas comparações entre os grupos analisados. Essa abordagem integrada fortalece a robustez das análises, proporcionando uma base sólida para a interpretação dos resultados e para a tomada de decisões fundamentadas em estudos que envolvem impactos ambientais (DE FREITAS, 2016; PARVAN et al., 2020).
No teste Allium cepa, o vegetal em questão atua como bioindicador, cujo desenvolvimento das raízes ocorre em meio aquoso, absorvendo os nutrientes essenciais para seu crescimento e desenvolvimento natural. Tem sido amplamente utilizado no monitoramento ambiental de cursos d’água e na exposição humana e animal, permitindo a detecção de contaminantes por meio da inibição macroscópica do desenvolvimento das raízes e da análise microscópica da divisão celular das células meristemáticas do vegetal (DE FREITAS, 2016; PARVAN et al., 2020).
A toxicidade pode ser observada macroscopicamente por meio de parâmetros como a inibição do crescimento das raízes, turgescência, presença de tumores, endurecimento e alteração de cor. O biomonitoramento, enquanto método experimental, oferece a vantagem de avaliar a resposta de organismos vivos à poluição, apresentando eficiência na monitorização de amplas áreas e por longos períodos, além da capacidade de avaliar elementos químicos em baixas concentrações ambientais. Essa abordagem integrativa fornece informações valiosas para a compreensão do impacto ambiental e a implementação de estratégias de gestão sustentável (DE FREITAS, 2016).
O Índice Mitótico (IM) é uma medida empregada na avaliação da citotoxicidade de diferentes agentes. Variações ascendentes ou descendentes no IM indicam níveis de citotoxicidade associados a um determinado agente. IMs significantemente inferiores ao controle negativo podem sugerir alterações nos organismos expostos devido à ação química. Em contrapartida, IMs superiores ao controle negativo resultam em um aumento na divisão celular, podendo ser prejudicial, levando a uma proliferação celular desordenada e à formação de tecidos tumorais (DE FREITAS, 2016).
A redução ou aumento do Índice Mitótico são indicadores cruciais para monitorar a poluição ambiental, especialmente no que se refere à avaliação de contaminantes tóxicos e citotóxicos. A diminuição do Índice Mitótico nas células meristemáticas de Allium cepa emerge como um método confiável para detectar a presença de agentes citotóxicos no ambiente, destacando-se como um teste sensível para estimar os níveis de poluição. Dessa forma, vários estudos têm empregado a avaliação do Índice Mitótico para detectar citotoxicidade, e a maioria deles tem obtido resultados satisfatórios nas análises propostas. Esse enfoque revela-se fundamental para uma compreensão mais precisa do impacto de agentes no ambiente, contribuindo para estratégias eficazes de monitoramento e mitigação (LEME, 2009; DE FREITAS, 2016).
As aberrações cromossômicas (AC) e erros de migração cromossômicas (EMC) podem manifestar-se espontaneamente ou como resultado da exposição a agentes físicos ou químicos, resultando em alterações na estrutura ou no número total de cromossomos. Essas mudanças podem ser desencadeadas por eventos como quebras de DNA, inibição da síntese de DNA ou replicação de DNA alterada e ação microtúbulo despolimerizante, contribuindo para uma segregação anormal dos cromossomos. Tais eventos podem ocorrer de maneira espontânea ou serem induzidas por agentes aneugênicos (PARVAN et al., 2020).
No contexto do teste utilizando Allium cepa, diversas formas de alterações cromossômicas são criteriosamente avaliadas nas distintas fases da divisão celular (prófase, metáfase, anáfase e telófase) para a detecção de anormalidades cromossômicas. Entretanto, essa análise exige um profundo entendimento das fases do ciclo celular e das possíveis anormalidades associadas. Isso pode representar um desafio quando o analista responsável carece de um conhecimento aprofundado em citogenética, evidenciando a importância da experiência prática no campo (LEME, 2009).
A compreensão dessas aberrações cromossômicas é fundamental para o monitoramento eficaz de agentes mutagênicos e genotóxicos no ambiente. A integração de termos como mutagênese e monitoramento fortalece a abordagem teórica, ressaltando a relevância dessa análise no contexto mais amplo da saúde ambiental e da prevenção de riscos genéticos.(LEME, 2009; DE FREITAS, 2016).
Testes de mutagenicidade utilizando-se Allium cepa são realizados desde o final da década de 30 e foram padronizados por Fiskejö em 1985. Esse teste constitui um ensaio muito sensível e confiável para monitoramento ambiental. Ele é baseado na avaliação do potencial genotóxico e mutagênico de substâncias químicas em espécies do gênero Allium, onde se registra as alterações na atividade mitótica (mudanças no índice mitótico); anormalidades mitóticas e aberrações cromossômicas em células meristemáticas das raízes dessa planta. A espécie é indicada pela sua elevada sensibilidade e excelente correlação com outros sistemas-teste, principalmente com os de mamíferos, fator relevante para avaliação mais minuciosa de riscos ambientais, bem como para análise de outros organismos alvos, como, por exemplo, o de seres humanos. O uso de Allium cepa, além das razões expostas, se dá pelo fato de que as células da raiz constituem um sistema conveniente tanto para parâmetros macroscópicos (crescimento, deformidade), quanto para parâmetros microscópicos (aberrações cromossômicas). A raiz é comumente a parte da planta que entra em contato com os poluentes do solo ou da água, ou mesmo das misturas ou soluções a serem testadas e avaliadas. A observação do sistema-teste do crescimento radicular tem mostrado que essa planta é bastante sensitiva quando da presença de contaminantes ambientais (substâncias solúveis em água), que nos leva a conclusão de que um dos princípios básicos para a execução de teste, é que a substância a ser avaliada seja necessariamente solúvel em meio aquoso (DE FREITAS, 2016).
O teste de Allium cepa, proposto por Levan em 1938, avalia os efeitos de produtos químicos nos cromossomos das plantas por meio da análise das células das pontas das raízes. Essas células permanecem em contato direto com a substância a ser testada por um determinado período. Em 1985, foram feitas as primeiras adaptações desse teste visando seu uso no monitoramento ambiental e na avaliação dos efeitos de misturas complexas em seres vivos. Segundo Levan em 1938, na forma original do teste de Allium cepa, o crescimento das raízes é iniciado em água pura. Quando as raízes atingem o comprimento de 1-2 cm, são realizados os tratamentos em intervalos de tempo específicos, como, por exemplo, 4 ou 24 horas. Após o tempo de contato, retirada da parte apical das raízes com auxílio de uma lâmina, como bisturi, por exemplo, fixação e coração com diferentes substâncias, como a orceína acética a 2% ou Carnoy, dentre outras que podem ser utilizadas sem comprometer a avaliação da genotoxidade (CARVALHO et al., 2018).
Após um levantamento bibliográfico com cerca de 44 artigos científicos, pode se concluir que não há padronização para o tamanho ideal dos bulbos, e de uma a vinte raízes, contando com uma média de 1.700 células para a investigação e contagem de micronúcleo, cerca de 490 células para aberrações cromossômicas. Outros autores investigaram um número diferente de células que puderam chegar até a um número de 8.000 mil células analisadas, sendo ainda em outros trabalhos com o total de 6.000 células analisadas, ou 5.000 células, que reforçam não haver um padrão, mas que é necessária uma análise de mais de 1.000 células para haver uma representatividade amostral. Após a etapa de fixação, é crucial o esmagamento das amostras como parte essencial do procedimento. Todos os autores mencionam essa etapa para permitir a observação das amostras em um microscópio óptico, geralmente utilizando aumentos de 40X, 400X e 1000X (DE FREITAS, 2016).
O sistema Allium cepa é considerado um bioindicador ideal, pois é reconhecido por sua confiabilidade comprovada por órgãos internacionais, bem como por sua sensibilidade e precisão. Além disso, possui uma metodologia simples, de baixo custo e de fácil execução, o que o torna amplamente utilizado pela comunidade científica para um primeiro rastreamento da citogenotoxicidade de infusões como quebras cromatídicas, pontes anafásicas, formação de micronúcleo, ou mesmo a destruição total do cromossomo, ou outras de alterações no processo de divisão celular. Embora o método original e o modificado tenham apresentado resultados satisfatórios, houve variações entre os autores em relação ao número de células analisadas, tipo de fixador, corante e tempo de contato com a substância teste. No entanto, o esmagamento da amostra para análise microscópica foi realizado em todos os casos (CARVALHO et al., 2018).
3 OBJETIVOS
3.1 Objetivo Geral
Avaliar o potencial genotóxico e mutagênico do composto BisGMA, em diferentes tempos de exposição e concentrações.
3.2 Objetivos Específicos
- Avaliar o potencial citotóxico do BisGMA em diferentes concentrações através da análise do índice mitótico em células meristemáticas radiculares apicais de Allium cepa.
- Investigar o potencial mutagênico do BisGMA por meio da análise de alterações de migração cromossômica em células meristemáticas radiculares apicais de Allium cepa.
- Identificar outras anomalias cromossômicas em células meristemáticas radiculares apicais de Allium cepa após exposição ao BisGMA.
- Quantificar outras anomalias cromossômicas em células meristemáticas radiculares apicais de Allium cepa após exposição ao BisGMA.
4. MATERIAIS E MÉTODOS
As etapas de preparo das soluções e dos bulbos, exposição dos bulbos, preparo e análises das lâminas foram desenvolvidas no Núcleo de Pesquisas Replicon (NPR) da Escola de Ciências Médicas e da Vida (ECMV) da Pontifícia Universidade Católica de Goiás (PUC Goiás).
4.1. Resina Composta Opallis Flow FGM® – Descrição do produto e preparo das soluções
Opallis Flow® é um compósito micro-híbrido de média viscosidade, fotopolimerizavél e radiopaco, indicado para restaurar pequenas cavidades dentárias, fazer selamento de fóssulas e fissuras e reparos em restaurações. O compósito pode ser utilizado, separadamente ou em combinação com Opallis® e a maioria das resinas compostas. A Figura 2 apresenta o produto comercial incluindo a seringa e ponteiras de aplicação.

A resina Opallis Flow® A1 é constituída por monômeros metacrílicos, canforoquinona, coiniciadores, estabilizantes, pigmentos e carha inorgânica silanizada composta de micropartículas de bário-alumínio borossilicato e partículas de dióxido de silício resultando em um percentual entre 70% e 74% em massa, e tamanho médio de partículas entre 0,5 e 1,0 mícron.
Foram preparadas três soluções da resina composta da marca comercial Opallis Flow®, na cor A1, sendo comercializadas em seringas de 2g e cinco ponteiras de aplicação descartáveis. Em um Becker de vidro estéril foram diluídos 2g da resina, sob agitação e aquecimento até 60oC, em água destilada nas concentrações 10mg/mL, 5mg/mL e 1mg/mL. As soluções foram mantidas em geladeira até o momento de uso.
4.2. Teste Allium cepa
4.2.1. Preparo e exposição dos bulbos de Allium cepa
Bulbos de Allium cepa foram adquiridos no comércio local e preparados de acordo com Fiskesjö (1993) com modificações. Foram retiradas as raízes e os catafilos ressecados dos bulbos. Adicionalmente os bulbos foram colocados na superfície de recipientes contendo água, na temperatura ambiente, para o crescimento das raízes por 48h.
Após as 48h de exposição dos bulbos na água, foi observada o crescimento de diversas raízes adventícias por bulbo com o tamanho aproximado de 1-2 cm.
Aproximadamente 20-30% das raízes adventícias recém-formadas foram coletadas e armazenadas sob refrigeração (±6oC) em solução álcool-ácida de Carnoy (3:1), em tubos cônicos de plástico. Estas raízes constituíram o grupo controle para amostras não expostas (CN) à resina Opallis Flow® A1.
Figura 3. Bulbos de Allium cepa expostos às diferentes concentrações da resina Opallis Flow® A1.
Os bulbos contendo as raízes remanescentes foram expostos durante 24h e 48h, às concentrações de 10mg/mL (A), 5mg/mL (B) e 1mg/mL (C) da resina Opallis Flow® A1. As exposições bulbares foram realizadas em triplicata. A Figura 3 apresenta a exposição das raízes às diferentes concentrações da resina Opallis Flow® A1.

Um grupo de bulbos foram expostos, por 24h, 48h e em triplicata, à solução de paracetamol a 750 mg/mL (marca comercial Altefar®), onde os comprimidos foram macerados manualmente e diluídos em água destilada. Esse grupo foi denominado de controle positivo (CP).
Após a exposição, os ápices das raízes adventícias (±2 cm) foram retirados e armazenados sob refrigeração (±6oC) em solução álcool-ácida de Carnoy (3:1), em tubos cônicos de plástico. Estas raízes constituíram o grupo controle positivo (CN) e grupos A, B e C correspondentes a exposição nas concentrações de 10mg/mL, 5mg/mL e 1mg/mL, respectivamente, da resina Opallis Flow® A1. A Figura 4 apresenta as amostras armazenadas sob refrigeração (±6oC) em tubos tipo Falcon de 15 mL contendo solução fixadora álcool-ácida.
4.2.2. Preparo das lâminas e análise citogenética
As lâminas foram preparadas no momento da análise citogenética. Para o preparo das lâminas, as raízes armazenadas foram hidrolisadas por 15 minutos em solução de hidrólise de HCl 1N à temperatura ambiente e coradas pela reação de Feulgen (orceína acética a 2%) por 10 minutos.

Em seguida foi removido, aproximadamente, 0,5 cm dos ápices radiculares meristemáticos e colocados em lâminas, desinfectadas e desengorduradas por solução de álcool etílico 70%. Os fragmentos das raízes foram triturados sob uma gota de ácido acético (0,45M) e posteriormente foram esmagados e selados por uma lamínula, e levados imediatamente para a análise microscópica.
A análise microscópica das lâminas foi realizada aleatoriamente, tanto nas raízes expostas, quanto ao tempo de exposição das amostras, que contavam com um grupo exposto em 24 horas e outro exposto por 48 horas, simulando as exposições aguda e crônica, respectivamente.
Foi utilizada microscopia de luz branca em microscópio binocular (Primo Star® – Carl Zeiss) com objetiva de 40X. Durante a análise foram consideradas 1000 células meristemáticas em intérfase para identificação de células binucleadas, células mitóticas em prófase, metáfase, anáfase e telófase, além da detecção da presença de micronúcleos e/ou erros de migração cromossômica.
4.3. Análise Estatística
Para avaliar os efeitos citotóxicos e genotóxicos, os dados coletados foram tabulados no Excel® 2021 e expressos como média e desvio padrão em percentual (frequência). Inicialmente, para a análise estatística, foi utilizado o teste não paramétrico de Kruskal-Wallis para comparar as médias do índice mitótico entre os tratamentos e o controle. Em seguida, para a análise das frequências de células com alterações nucleares e frequência de micronúcleos, foi utilizado o teste de regressão linear simples. Na análise final, foi aplicado o teste de Mann-Whitney com o objetivo de excluir falsos positivos. Todos os testes foram realizados utilizando o software GraphPad Prism 10, com um nível de significância de 5% (p≤0,05) (GraphPad Software, 2015).
5. RESULTADOS E DISCUSSÃO
Na metodologia foram sugeridas que seriam analisadas, aproximadamente 1.000 células para cada exposição, que somariam um total de 9.000 células analisadas, incluindo amostras do controle positivo, controle negativo, das soluções A, B e C, expostos por 24h e 48h. No entanto, em uma eventualidade, foram perdidas as amostras do grupo CP – 48h de exposição, assim, foram analisadas um total aproximado de 8.000 células. A Figura 5 apresenta algumas células observadas durante a análise citogenética realizada. Para a fase de análises as lâminas foram codificadas e analisadas pela mesma pessoa, evitando assim, possíveis divergências nos resultados.
5.1 Resultados Quantitativos
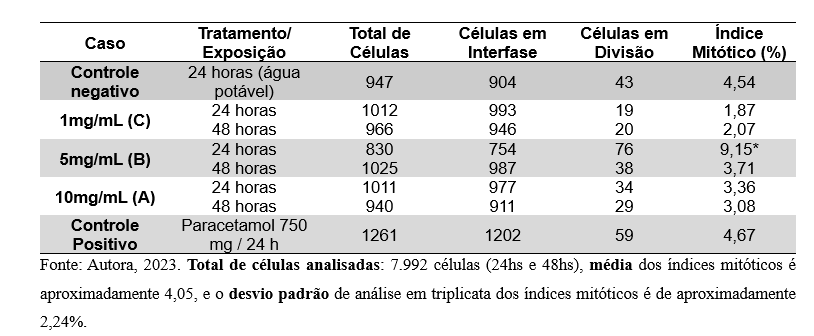
Na Tabela 1 estão apresentados o número total de células analisadas, o número de células observadas em intérfase e nas diferentes fases da divisão celular durante o ciclo celular das células meristemáticas radiculares de Allium cepa, bem como os valores do índice mitótico.
Tabela 1. Tratamentos e número total de células analisadas no ciclo celular (interfase, prófase, metáfase, anáfase, telófase) com o teste de Allium cepa tratadas com as Soluções 10mg/mL, 5mg/mL e 1mg/mL (A, B e C) com tempo de exposição de 24 e 48 horas e controle positivo e negativo.
Considerando os resultados apresentados no Gráfico 1, pode-se perceber que o tratamento/exposição das células com diferentes soluções resultou em alterações significativas em relação ao controle negativo. Considerando os índices mitóticos fornecidos para os diferentes tratamentos e exposições, é possível observar variações notáveis na atividade mitótica das células.
Gráfico 1. Gráfico de Linhas com a Variação dos Índices Mitóticos em Células Submetidas a Diferentes Tratamentos e Exposições.
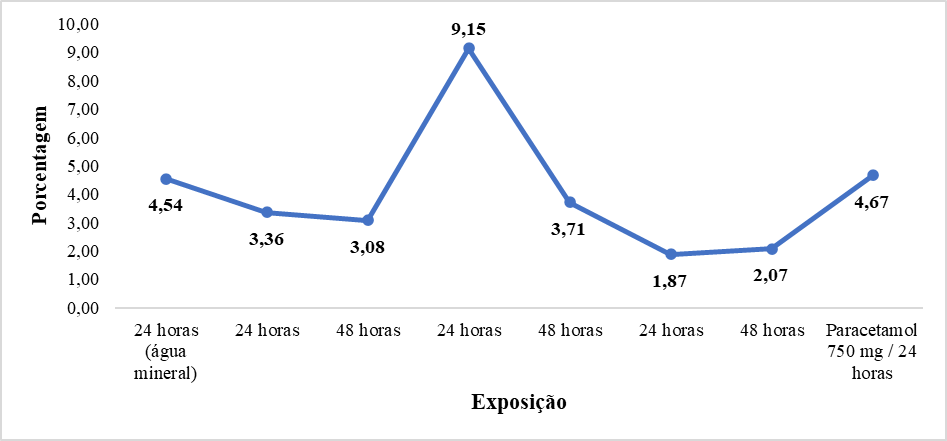
Fonte: Autora, 2023.
Notavelmente, destacou-se uma variabilidade expressiva no índice mitótico em relação à solução controle, especialmente nas amostras submetidas ao tratamento com a solução B, composta pela adição de 5mg de Opallis Flow. O incremento de aproximadamente 2 vezes (p≤0,05) sugere que o aumento na concentração do agente, implica, resultando em um aumento nas taxas de proliferação celular, no entanto sob exposição prolongada (48h) há nítida inibição nesse parâmetro. Segundo CARVALHO e colaboradores (2018) esse fenômeno sinaliza uma complexa interação entre a concentração do agente e a duração da exposição, evidenciando um mecanismo subjacente que influencia a dinâmica mitótica em células de Allium cepa. A diminuição do índice mitótico com o aumento da exposição de uma substância, mantendo a concentração, sugere um efeito adverso sobre a divisão celular. O índice mitótico é uma medida que indica a proporção de células em mitose em relação ao total de células observadas. Quando esse índice altera com o aumento e/ou com a diminuição da exposição à substância (por alteração no tempo e ou na concentração), pode-se aceitar que a substância interfere no processo normal do ciclo celular, inibindo a progressão celular, verificado pelas alterações observadas nas frequências das fases do ciclo celular que levam à mitose.
Adicionalmente, na concentração de 1mg/mL (Solução C) observa-se uma redução da frequência de células em mitose enquanto na concentração de 10mg/mL esse parâmetro se torna ainda menor, refletindo assim que BisGMA e demais substâncias presentes na resina Opallis Flow® A1 é capaz de interferir na dinâmica do ciclo celular.
Segundo DE FREITAS (2016), essa interferência pode ocorrer de diversas maneiras, tais como: indução de danos DNA, ação microtúbulo despolimerizante (afetando a formação do fuso mitótico ou interrompendo na segregação dos cromossomos durante a mitose devido o fator despolimerização dos microtúbulos constituídos de filamentos de tubulina) dentre outras ações. A alteração do índice mitótico sugere que as substâncias exercem um efeito inibitório ou excitatório sobre a divisão celular, o que pode ter implicações importantes em termos de toxicidade e/ou efeitos adversos sobre organismos expostos, sobretudo na indução tumoral.
Na Tabela 2, são apresentados o número total de células analisadas, bem como o número de células com alterações. As concentrações de 10mg/mL, 5mg/mL e 1mg/mL, inclusive os controles negativo e positivo, revelaram a presença de dois tipos distintos de alterações: erros de migração cromossômica e células micronucleadas.
Tabela 2. Número total de células analisadas, número de aberrações celulares e porcentagem de células aberrantes de pontas de raízes do teste de Allium cepa tratadas com as Soluções 10mg/mL, 5mg/mL e 1mg/mL (A, B e C) com tempo de exposição de 24 a 48 horas e controle positivo e negativo.
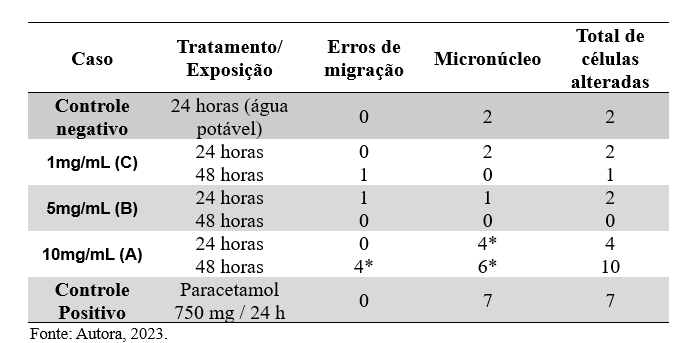
Considerando os resultados apresentados no Gráfico 2,observa-se a incidência de diferentes tipos de anormalidades celulares em resposta a diversos tratamentos. No grupo controle negativo, não foram observados erros de migração celular, mas dois micronúcleos foram identificados, resultando em um total de duas células aberrantes.
Gráfico 2. Gráfico de Linhas com a incidência de diferentes anormalidades celulares observadas nos Diferentes Tratamentos e Exposições.
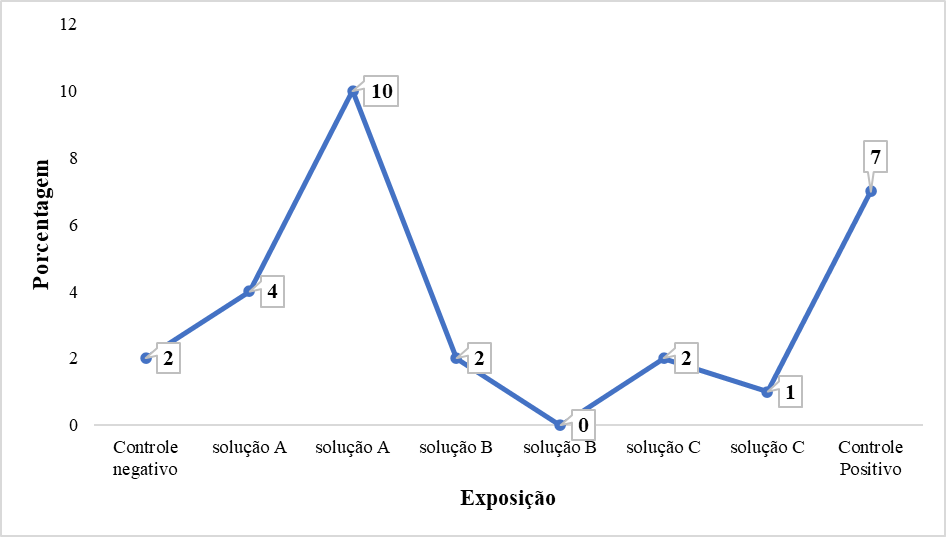
As alterações celulares foram detectadas em todos os tratamentos e em diferentes intervalos de tempo de exposição, para todas as amostras estudadas, excetuando os erros de migração cromossômica para alguns períodos de 24h de exposição. Segundo LEME (2009), em algumas condições específicas de exposição, tem sido observado que há uma lentidão nas manifestações celulares frente uma exposição a um determinado agente, sobretudo mutagênico. Provavelmente devido a necessidade de ajuste na fisiologia da exposição e no desenvolvimento das manifestações fenotípicas, refletindo assim, a necessidade de ampliar o tempo de exposição ao produto a ser avaliado. No entanto, tais manifestações não são completamente esclarecidas e necessitam de ampliar estudos nesse sentido.
Ao analisar as células com a exposição na concentração de 10mg/mL (solução A), submetida a um tempo de exposição de 24h e 48h, verificou-se um aumento em 2 vezes (p=0,03) no número de células com micronúcleos quando comparado com o grupo controle negativo, e aumentos significativos no número de células com erros de migração cromossômica e com micronúcleos quando também comparados com o grupo controle negativo, respectivamente.
Os erros de migração e as células micronucleadas representam dois importantes indicadores de danos genéticos. Os erros de migração, caracterizados por anomalias no processo de divisão celular, pode resultar na segregação incorreta dos cromossomos. Esse desvio permite originar células filhas com configurações cromossômicas anômalas, evidenciando a presença de agentes genotóxicos que interferem na fidelidade do processo mitótico. PARVAN e colaboradores (2020) afirmam que tais eventos podem ocorrer de maneira espontânea, mas que a indução por agentes mutagênicos/aneugênicos também são condições amplamente aceitas.
As células micronucleadas constituem um grupo de células que abrigam pequenos núcleos suplementares, denominados micronúcleos. Estes podem originar-se de cromossomos íntegros ou fragmentos cromossômicos que não se incorporaram corretamente no núcleo principal durante a divisão celular. A detecção de micronúcleos revela instabilidade genômica, e serve como um marcador sensível de danos genéticos.
Portanto, a identificação de erros de migração e a presença de células micronucleadas em testes de Allium cepa sugere o potencial genotóxico da substância avaliada. É relevante destacar que tais ensaios oferecem uma avaliação preliminar da genotoxicidade de uma substância. Ademais, novas investigações e estudos complementares são necessários para corroborar esses achados e obter uma compreensão abrangente do potencial genotóxico de um agente.
Segundo FREITAS (2016) a análise das alterações de migrações cromossômicas e/ou micronúcleos proporciona insights importantes sobre os efeitos potenciais dos extratos e soluções testadas sobre a estabilidade genômica das células estudadas. A presença dessas aberrações sugere uma interferência nos processos regulares de replicação genômica e segregação cromossômica, possivelmente devido à interação entre os componentes dos fitoconstituítes e/ou soluções, cujos mecanismos moleculares estão envolvidos na manutenção da integridade genômica.
A ausência e/ou as pequenas alterações observadas nas células expostas nas concentrações de 5mg/mL e 1mg/mL (solução B e C) após 24/48 horas de exposição é um achado significativo e pode indicar que o produto avaliado pode não apresentar efeitos tóxicos ao genoma nessas condições.
O controle negativo, representado pela exposição à água potável por 24 horas, exibiu um índice mitótico de 4.54%, enquanto as soluções 10mg/mL e 1mg/mL mostraram reduções para 3,36% e 1,87%, respectivamente, após o mesmo período. Por outro lado, a solução 5mg/mL apresentou um aumento acentuado no índice mitótico para 9,15% em 24 horas, seguido de uma queda para 3.71% após 48 horas. O controle positivo, representado pelo Paracetamol 750mg por 24 horas, demonstrou um índice mitótico de 4.67%. No entanto, são necessárias mais investigações para compreender completamente os efeitos de cada solução sobre as células em estudo.
A análise dos resultados revelou que os extratos não apresentaram potencial mutagênico e/ou citotóxico, segundo as condições testadas. Não foram encontradas diferenças estatisticamente significativas (exceto para alguns parâmetros), sobretudo para os parâmetros índice mitótico, frequência de micronúcleos e erros de migração cromossômica (metáfases e anáfases anormais) em células meristemáticas da raiz de Allium cepa entre os testes e seus controles no presente estudo.
Ao analisar separadamente o índice mitótico em células expostas a diferentes concentrações verificou-se, sem efeito significativo (p>0,05), porém, foi observado, que a concentração da solução B (5mg/mL) teve maior inibição da divisão das células meristemáticas radiculares, sobretudo para o tempo de exposição de 24 horas.
Nas células expostas à solução A (10mg/mL) por 24 horas, nenhum erro de migração foi detectado, mas quatro micronúcleos foram registrados, totalizando quatro células aberrantes. Entretanto, após 48 horas de exposição à solução A, quatro erros de migração celular foram observados, juntamente com seis micronúcleos, resultando em um total de dez células aberrantes. No grupo tratado com solução B (5mg/mL) por 24 horas, um erro de migração celular e um micronúcleo foram identificados, totalizando duas células aberrantes, enquanto nenhuma anormalidade foi observada após 48 horas de exposição.
Para o grupo exposto à solução C (1mg/mL) por 24 horas, não foram registrados erros de migração celular, mas dois micronúcleos foram identificados, totalizando duas células aberrantes. Por fim, após 48 horas de exposição à solução C, um erro de migração celular foi observado, mas nenhum micronúcleo foi detectado, totalizando uma célula aberrante. Esses resultados fornecem uma visão detalhada das diferentes respostas celulares aos tratamentos aplicados, destacando as variações na ocorrência de anormalidades celulares entre os grupos experimentais.
Não foram encontradas diferenças estatisticamente significativas para os parâmetros índice mitótico, frequência de micronúcleos e erros de migração cromossômica (metáfases e anáfases anormais) em células meristemáticas da raiz de Allium cepa entre os testes e seus controles no presente estudo.
6. CONCLUSÃO
Os resultados da análise do índice mitótico em células meristemáticas radiculares apicais de Allium cepa indicam que o BisGMA, especialmente na concentração de 5mg/mL (solução B), apresentou um significativo aumento no índice mitótico após 24 horas de exposição. Este achado sugere um potencial citotóxico do BisGMA em concentrações mais elevadas, enfatizando a necessidade de cautela no uso clínico deste composto.
A presença de erros de migração cromossômica e células micronucleadas após exposição ao BisGMA em todas as concentrações testadas, exceto na solução B após 48 horas, indica um potencial mutagênico das substâncias avaliadas. Essas anomalias são indicadores importantes de danos genéticos, reforçando a necessidade de avaliações mais detalhadas dos efeitos mutagênicos do BisGMA.
O estudo identificou outras anomalias cromossômicas em células de Allium cepa expostas ao BisGMA, corroborando os achados anteriores de danos genéticos potenciais causados por este composto. A quantificação dessas anomalias fornece dados adicionais sobre os efeitos adversos do BisGMA no material genético das células estudadas.
Esses resultados destacam a importância de estudos focalizados para uma compreensão aprofundada dos efeitos do BisGMA sobre a estabilidade genômica e a divisão celular. Os dados apresentados são fundamentais para orientar práticas seguras e eficazes no uso clínico de compostos odontológicos.
7. REFERÊNCIAS BIBLIOGRÁFICAS
Zeiger, E. What Is Needed For An Acceptable Antimutagenicity Manuscript. Mutation Research, V. 626, P. 1-3, 2007.
Alberts, B.; Johnson, A.; Lewis. J.; Raff, M.; Roberts, K.; Walter, P. Biologia Molecular Da Célula. 5ª Edição, Porto Alegre (Rs), Artmed, 2010.
Albertine, R. J. Et Al. Ipcs Guidelines For The Monitoring Of Genotoxic Effects Of Carcinogen In Human. Mutation Research – Reviews In Mutation Reseaech, V.463. Amsterdan, P. 111-172, 2000.
Almeida Neto, X. J. Et Al. Avaliação Do Efeito Mutagênico Da Palma Forrageira (Opuntia Fícus-Indica Mill) Através Do Teste Do Micronúcleo Em Medula Óssea De Ratos (Rattus Novergicus, Linhagem Wistar) In Vivo. Revista De Biologia E Ciência Da Terra, V. 5, N. 2, P.1-11, 2005.
Almeida, D. A.; Vieira, M. E. L. Avaliação Preliminar Da Genotoxicidade De Filtro Solar Em Astyanax Sp. 2013. 48f. Monografia (Trabalho De Conclusão De Curso Em Química Tecnológica Com Ênfase Em Química Ambiental) – Universidade Tecnológica Federal Do Paraná – Utfpr, Curitiba, 2013.
Al-Sabti, K. Micronuclei Induced By Selenium, Mercury, Methylmercure And Their Mistures In Binucleated Blocked Fish Erythrocyte Cells. Mutat. Res. V. 320, P. 157-163, 1991.
Andrade-Vieira, L. F. Et Al. Spent Pot Liner Z (Spl) Induced DNA Damage And Nuclear Alterations In Root Tip Cells Of Allium cepa As A Consequence 72 Of Programmed Cell Death. Ecotoxicology And Environmental Safety, New York, V. 74, N. 4, P. 882–888, 2011.
Andrade, H. H. R.; Lehmann, M. Teste Para Detecção De Mutação E Recombinação Somática (Smart) Em Drosófila Melanogaster. In: Mutagênese Ambiental. Canoas: Ulbra, 2003.
Ansari, R. A.; Rahman, S.; Kaur, M.; Anjum, S.; Raisuddin, S. In Vivo Cytogenetic And Oxidative Stress-Inducing Effects Of Cypermethrin In Freshwater Fish, Channa Punctata Bloch. Ecotoxicology And Environmental Safety, V. 74, P. 50-156, 2011.
Anvisa. 2010. Guia Para A Condução De Estudos Não Clínicos De Segurança Necessários Ao Desenvolvimento De Medicamentos. Gerência De Avaliação De Segurança E Eficácia – Gesef. Brasília.
Bagatini, M. Et Al. Uso Do Sistema Teste De Allium cepa Como Bioindicador De Genotoxicidade De Infusões De Plantas Medicinais. Rev. Bras. Farmacognosia, João Pessoa, V.17, N.3, P. 444-447, 2007.
Belcavello, L. Et Al. Citotoxicidade E Danos Ao Dna Induzidos Pelo Extrato De Zornia Diphylla, Uma Planta Medicinal. Cytotoxicity And Dna Damages Induced By The Zornia Diphylla Extract, A Medicinal Plant. Natureza On Line, Santa Tereza, V. 10, P. 140-145, 2012.
Bolognesi, C.; Hayashi, M. Micronucleus Assay In Aquatic Animals. Mutagenesis, 26, P. 205-213, 2011.
Cabrera, G. L.; Rodrigues, D. M. G. Genotoxicity Of Soil From Farmland Irrigated With Wastewter Using Three Plant Biossays. Mutat Res. 426, P. 211-214, 1999.
Camparoto, M. L.; Teixeira, R. O.; Mantovani, M. S.; Vicentini, V. E. P. Effects Of Maytenus Ilicifolia Mart. And Bauhinia Candicans Benth Infusions On Onion Rootip And Rat Bone-Marrow Cell. Genet Mol Biol, V. 25, P.85-89, 2002.
Caritá, R. & Marin-Morales. M. A. 2008. Induction Of Chromosome Aberrations In The Allium cepa Test System Caused By The Exposure Of Seeds To Industrial Effluents Contaminated With Azo Dyes. Chemosphere, 72(5): 722-725.
Caritá, R. Avaliação Do Potencial Genotóxico E Mutagênico De Amostras De Águas De Recursos Hídricos Que Recebem Efluentes Urbanos E Industrias Do Polo Ceramista Da Cidade De Santa Gertrudes – Sp. 2010. 187f. Dissertação (Mestrado Em Ciências Biológicas) – Universidade Estadual Paulista “Júlio De Mesquita Filho”, Instituto De Biociência, Rio Claro, 2010.
Carolina, R. S. Genética Toxicológica Da Chalcona Sulfonamida (Cpn): Evidências De Genotoxidade E Anti-Mutagenicidade Em Diferentes Sistemas-Teste In Vivo E In Vitro. 2015. 88f. Tese (Doutorado Em Ciências Biológicas) – Universidade Federal De Goiás, Goiânia, 2015.
Carvalho, J. C. T. Caesalpinia Ferrea (Pau-Ferro): Avaliação Da Atividade Anti-inflamatória e Analgésica. 1993. 72 F. Dissertação (Mestrado Em Fármacos E Medicamentos) – Faculdade De Ciências Farmacêuticas De Ribeirão Preto, Universidade De São Paulo, Ribeirão Preto, 1993.
Carvalho, M. B.; Ramirez, A.; Gattas, G. J. F.; Guedes, A. L.; Amar, A.; Rapoport, A. Barauna Neto,J.C.; Curioni, A. O. Correlação Entre A Evolução Clínica E A Frequência De Micronúcleos Em Células De Pacientes Portadores De Carcinomas Orais E Da Orofaringe. Rev. Assoc. Med. Bras., 48: 317-322, 2002.
Ceppi, M.; Biasotti, B.; Fenech, M.; Bonassi, S. Human Population Studies With The Exfoliated Buccal Micronucleus Assay: Statistical And Epidemiological Issues. Mutat. Res. 705, P. 11-19, 2010.
Collins A. The Comet Assay For Dna Damage And Repair. Molecular Biotechnology, 26: p.249-261, 2004.
Corrêa, A. X. R. Et Al. Genotoxicity Assessment Of Particulate Matter Emitted From Heavyduty Disel-Powered Vehicles Using The In Vivo Vicia Faba L. Micronucleus Test. Ecotoxicology And Environmental Safety, New York, V. 127, p. 199-204, 2016.
Costa, R. M. A.; Menk, C. F. M. Biomonitoramento De Mutagênese Ambiental. Biotecnologia: Ciência & Desenvolvimento, V. 2, N. 12, P. 24-26, 2000.
Da Cruz, A. D.; Mcarthur, A. G.; Silva, C. C.; Curado, M. P.; Glickmam, B. W. Human Micronucleus Counts Are Correlated With Age, Smoking, And Cesium- 137 Dose In The Goiânia (Brasil) Radiological Accident. Mutation Research Environmental. N°. 313, P. 57-68, 1994.
Deventer, K. Detection Of Genotoxic Effects On Cells Of Liver And Gill Of B. Rerio. By Means Of Single Cell Gel Electrophoresis. Environ. Contam. Toxicol. V. 56, P. 911-918, 1996.
Di Stasi; L. C.; Hiruma-Lima, C. A. Plantas Medicinais Na Amazônia E Na Mata Atlântica. 2ed. São Paulo: Unesp, 2002. 607p.
Dias, M. G.; Canto-Dorow, T. S.; Coelho, A. P. D.; Tedesco, S. B. Efeito Genotóxico E Antiproliferativo De Mikania Cordifolia (L. F.) Willd. (Asteraceae) Sobre O Ciclo Celular De Allium cepa L. Rev. Bras. Plantas Medicinais, Campinas, V. 16, N. 2, P. 203-208, 2014.
Eigenmann, C. H. The American Characidae. Memoirs Of The Museum Of Comparative Zoology (Harvard College), 1921. In: Agostinho, A. A.; Gomes, L. C. Reservatório De Segredo: Bases Ecológicas Para O Manejo. Maringá: Eduem, V. 43, N. 3, P. 209-310, 1997.
Eigenmann, C. H. The American Characidae. Memoirs Of The Museum Of Comparative Zoology (Harvard College), 1927. In: Agostinho, A. A.; Gomes, L. C. Reservatório De Segredo: Bases Ecológicas Para Manejo. Marigá: Eduem, V. 43, N. 4, P. 311-428, 1997.
Fabri, R. L.; Costa, J. A. B. M. Perfil Farmacognóstico E Avaliação Das Atividades Citotóxicas E Antibacteriana De Bromélia Antiacantha Bertol. Revista Eletrônica De Farmácia, V.9, N. 2, P. 37-48, 2012. Disponilvel Em: Http://Www.Revistas.Ufg.Br/Index.Php/ReF/Article/Viewfile/18427/11193.
Fachinetto, J. M.; Bagatini, M. D., Durigon, J.; Silva, A. C. F.; Tedesco, S. B. Efeito Anti-Proliferativo Das Infusões De Achyrocline Satureioides Dc (Asteraceae) Sobre O Ciclo Celular De Allium cepa. Revista Brasileira Farmacognosia, 17(1): 49-54. 2007.
Farias, E. M. F. G. Avaliação Da Toxicidade Aguda Do Extrato Metanólico De Folhas De Lippia Sidoides Cham. (Verbenaceae) In: Congresso Brasileiro De Química. Sociedade Brasileira De Química, Natal, 2007.
Farias, R. A. P. G.; Coelho, M. F. B.; Albuquerque, M. C. F.; Azevedo, R. A. B. Fenologia De Brosimum Gaudichaudii Trécul. (Moraceae) No Cerrado De Mato Grosso. Ciência Florestal, Santa Maria, V. 25, N. 1. P. 67-75, Jan/Mar, 2015.
Farias, R. A. P. G. Fenologia Distribuição Espacial, Germinação E Produção De Mudas De Brosimum Gaudichaudii Trécul. (Moraceae). 2009. 128f. Tese (Doutorado Em Agricultura Tropical) – Universidade Federal De Mato Grosso, Cuiabá, Mt, 2009.
Fenech, M. The In Vitro Micronucleus Technique. Mutation Research Fundamental And Molecular Mechanism Of Mutagenesis. Amsterdam, V. 455, N. 1-2, P. 81-95, 2000.
Fernandes, T. C. C. Investigação Dos Efeitos Tóxicos, Mutagênicos E Genotóxicos Do Herbicida Trifluralina, Utilizando Allium cepa E Oreochromis Niloticus Como Sistemas- Testes. 2005. 212f. Dissertação (Mestrado Em Biologia Celular E Molecular) – Instituto De Biociências. Universidade Estadual Paulista, Rio Claro, Sp, 2005.
Fernandes, T. C. C.; Mazzeo, D. E. C.; Marin-Morales, M. A. Mechanism Of Micronuclei Formation In Polyploidizated Cell Of Allium cepa Exposed To Trifluralin Herbicide. Pesticide Biochemistry And Physiology. San Diego, Calif, V. 88, N 3, P. 252-259, July 2007.
Fernandes, C. A.; Martins-Santos, I. C. Cytogenetic Studies In Two Populations Of The Astyanax Altiparanae (Pisces, Characiformes). Hereditas 141: P. 328-332.
Figueiredo, D. R. de. Avaliação da Citotoxicidade do Extrato Hídrico da Erva Doce (Pimpinela anisum L.) Através do Teste em Allium cepa L. 2014.
Figueiredo, F. R. G. Ensaios Mutagênicos Em Decocto De Cocholspermum Regium (Mart. Et. Schr.) Pilger (Bixaceae) Em Poecilia Reticulata E Linfócitos Humanos. 2012. 115f. Dissertação (Mestrado Em Ciências Ambientais E Saúde) – Pontifícia Universidade Católica De Goiás, Goiânia, 2012.
Fiskesjö, G. The Allium Test – An Alternative In Environmental Studies: The Relative Toxicity Of Metal Ions. Mutation Research – Fundamental And Molecular Mechanisms Of Mutagenesis, V. 197, N. 2, P. 243–260, 1988.
Fiskesjö, G. The Allium cepa Test In Wastewater Monitoring. Environmental Toxicology And Water Quality, New York, V.8, P.291-298, 1993.
Flores, M.; Yamaguchi, M. U. Teste Do Micronúcleo: Uma Triagem Para Avaliação Genotóxica. Revista Saúde E Pesquisa, V. 1, N. 3, P. 337-340, Set./Dez, 2008.
Griffiths, A. J. F.; Gelbart, W. M.; Miller, J. H.; Lewontin, R. C. Mutações Genicas, P. 177-208. In: Genética Moderna. Editora Guanabara Koogan, Rio De Janeiro, Rj, 2001.
Grisolia, C. K.; Rivero, C. L. G.; Starling, F. L. R. M.; Silva, I. C. R.; Barbosa, A. C.; Dorea, J. G. Profile Of Micronucleus Frequencies And Dna Damage. Caderno De Pesquisa. Série Biologia, Volume 23, Número 1.
Gontijo, A. M. M. C.; Tice, R. Teste do Cometa para Detecção de Dano no DNA E Reparo Em Células Individualizadas In: Mutagênese Ambiental. Canoas: Ulbra, 2003.
Haddad Junior, V. Skin Manifestation Caused By Brasilian Traumatic, Allergenic, And Venomous Plants: Main Species, Therapeutic And Preventive. The Journal Of Venomous Animals And Toxins Including Tropical Diseases, V. 10, P. 199-206, 2004.
Hartmann, A.; Speit, G. The Contribution Of Cytotoxicity To Dna- Effects In The Single Cell Gel Test (Comet Assay). Toxicology Letters, V. 90, P.183-188, 1997.
Hashimoto, G. (Ed.): “Illustrated Cyclopedia Of Brazilian Medicinal Plants” Aboc-Sha, Kamakura, P. 646, 1996.
Herrero, O. Et Al. Toxicological Evaluation Of Three Contaminants Of Emerging Corcern By Use Of The Allium cepa Test. Mutation Research. 743, P. 20-24, 2012.
Jacomassi, E.; Moscheta, I. S.; Machado, S. R. Morfoanatomia E Histoquímica De Brosimum Gaudichaudii Trécul (Moraceae). Acta Bot. Bras. 21 (3): 575-597. 2007.Parte Da Tese De Doutorado Da Primeira Autora, Universidade Estadual Paulista- Campos De Botucatu.
Kiss, I.; Kováts, N.; Szalay, T. Evaluation Of Some Alternative Guideline For Risk Assessment Of Various Habitats. Toxicology Letters, V. 140-141, 2003.
Klaude, M. Et Al. The Comet Assay: Mechanisms And Technical Considerations. Mutation Research – Dna Repair, Amsterdan, V. 363, P89-96, 1996.
Kumaravel, T. S. Et Al. Comet Assay Measurements: A Perspective. Cell Biology And Toxicology. 2007.
Lapa, A. J. Farmacologia E Toxicologia De Produtos Naturais. In: Simões C. M. O. (Ed). Farmacognosia Da Planta Ao Medicamento, Florianópolis Editora Da Universidade Federal De Santa Catarina, P. 181-196, 1999.
Lapa, A.J., Souccar, C., Lima-Landman, M.T.R., Godinho, R.O., Nogueira, T.C.M.L. Farmacologia E Toxicologia De Produtos Naturais. In Simões Cmo, Schenkel Ep, Gosmann G, Mello Jcp, Mentz La And Petrovick Pr (Org). Farmacognosia: Da Planta Ao Medicamento. 5.Ed. Porto Alegre: Ed. Universidade/Ufrgs, 2004.
Leão, A. R.; Cunha, L. C.; Parente, L. M. L.; Castro, L. C. M.; Chaul, A.; Carvalho, H. E.; Rodrigues, V. B.; Bastos, M. A. Avaliação Clínica e Toxicológica Preliminar Do Viticromim® Em Pacientes Com Vitiligo. Revista Eletrônica De Farmácia, V. Leme, D. M.; Marin-Morales, M. A. Allium Cepa Test In Environmental Monitoring : A Review On Its Application. Mutation Research. Amsterdam, V. 682, P. 71–81, 2009.
Lima, E. C.; Cury, A. E.; Fischmam, O. G.; Giesbrecht, A. M.; Paulo, M. Q. Lima, P. L. A.; Ribeiro, L. R. Teste De Mutação Gênica Em Células De Mamífero (Mouse Lymphoma Assay) In: Mutagênese Ambiental. Editora Da Ulbra. Canoas-Rs. 2003.
Lima, D. J. B. Estudo Da Atividade Anticâncer Da Marinobufagenina, Um Bufadienolídeo Extraído De Anfíbios Da Espécie Rhinella Marina. 2016. 90f. Dissertação (Mestrado Em Farmacologia) – Universidade Federal Do Ceará, Fortaleza, 2016.
Lima, F. C. T.; Malabarba, L. R. Et Al. Genera Incertae Sedis In Characidae In Reis R. E. Kullander S. O. Ferraris J. R. C. J. Check List Of The Freshwater Fishes Of South And Central America Edipucrs, Porto Alegre, Rs, P. 106-169, 2003.
Lourenço, M. V. Estudo Comparativo Dos Constituintes Químicos De Brosimum Gaudichaudii Tréc. E Do Medicamento “V”. 2001. 121f. Tese (Doutorado Em Química) Instituto De Química Universidade Estadual Paulista. Araraquara, Sp. 2001.
Lorenzi, H.; Matos, F. J. A. Plantas Medicinais No Brasil: Nativas E Exóticas. Nova Odessa, Sp, Instituto Plantarum, 2002.
Lorenzi, H.; Matos, J. A. Plantas Medicinais No Brasil: Nativas E Exóticas Cultivadas. 2. Ed. Nova Odessa, Sp, Instituto Plantarum, 520p. 2009.
Louvatel, K.; Zaions, M. I. M.; Arenhart, A. R. Avaliação Da Citotoxicidade E Genotoxicidade Dos Extratos De Stachys Byzantina C. Kock (Pulmonária) E Tropeaolum Majus L. (Capuchinha), Utilizando O Sistema Teste Allium cepa. Unoesc & Ciêcias – Acbs. Edição Especial. P.29-34, 2014.
Macedo, J. F. M.; Silva, M. S.; Batista, N. J. C.; Uchoa, V. T.; Alves, W. S. Estudo Da Genotoxicidade Do Extrato De Abelmoschus Esculentus (Quiabo) Pelo Teste De Allium cepa. Revista Saúde Em Foco, Teresina, V.1, N. 1, Art, 2, P. 15-28, 2014.
Maceda, E. B.; Grisolia, A. B.; Vaini, J. O.; Candido, L. S. Uso De Biomarcadores Para Monitoramento Das Águas Do Córrego Arara No Município De Rio Brilhante, Ms, Brasil. Ambiente & Água – An Interdisciplinary Journal Of Applied Science [En Linea] 2015, 10 (Enero-Marzo):Disponibleen:<Http://Www.Redalyc.Org/Articulo.Oa?Id=92832874011> Issn 1980-993x.
Manso, J.A.X.; Hanusch, A.L.; Machado, R.C.; Mattos, C.A.A.; Cunha, D.M.C.; Da Silva, C.C.; Da Cruz, A.D. Use Of Alcaline Comet Assay For Analysis Of Human T- Lymphocytes Exposed To Tisanes Infusion Of Momordica Charantia (Cucurbitaceae). 56º Congresso Brasileiro De Genetica. Resumo. 2010.
Marcon, L. Morfologia Ovariana No Lambari Astyanax Bimaculatus Sob Efeito Do Hormônio De Crescimento. Dissertação (Mestrado Em Medicina Veterinária) – Universidade Federal De Viçosa; 2008.
Martins, L.; Paz, A. V.; Brentano, D. M. Avaliação Da Geração De Micronúcleo Em Juvenis De Centropomus Parallellus (Robalo-Peva) Expostos A Diferentes Concentrações Salinas. Rtc, Florianópolis, Sc, V. 02, N. 01, P. 13-16, 2010.
Monteiro, V.; Cavalcante, D. G. S. M.; Viléla, M. B. F. A.; Martinez, C. B. R. In Vivo And In Vitro Exposures For The Evaluation Of The Genotoxic Effects Of Lead On The Neotropical Freshwater Fish Prochilodus Lineatus. Aquatic Toxicology, V. 104, N.3, P. 291-298, 2011.
Nakamura, E. S.; Kurosaki, U.; Arisawa , M.; Mukainaka, T.; Takayasu, J.; Okuda, M.; Tokuda, H.; Nishino, H.; Floriano Pastore, F. Cancer Chemopreventive Effects Constituents Of Caesalpinia Ferrea And Related Compounds. Cancer Letters, V. 177, P. 119-124, 2002ª
Nakamura, E. S.; Kurosaki, F.; Arissawa, M.; Mukainaka, T.; Takayasu, J.; Okuda, M. Tokuda, H.; Nisinho, H.; Pastore, J. R. F. Cancer Chemopreventive Effects Of A Brazilian Folk Medicine, Juca, On In Vivo Two-Stage Skin Carcino Genesis. Journal Of Ethnopharmacology, 81, P. 135-137, 2002b.
Nascimento, M. P. S. C. B et al. Potencial Forrageiro Do Pau-Ferro. In Boletim De Pesquisa E Desenvolvimento, 41. Teresina: Embrapa, Outubro, P. 16. 2002.
Oliveira, A. F.; Batista, J. S.; Paiva, E. S.; Silva, A. E.; Farias, Y. J. M. D.; Damasceno, C. A. R.; Brito, P. D.; Queiroz, S. A. C.; Rodrigues, C. M. F.; Freitas, C. I. A. Avaliação Da Atividade Cicatrizante Do Jucá (Caesalpinia Ferrea Mart. Ex Tul. Var. Ferrea) Em Lesões Cutâneas De Caprinos. Revista Brasileira De Plantas Medicinais, Botucatu, V. 12, N. 3, Set. 2010. Disponível Em: Http://Www.Scielo.Br/Scielo. Php?Script=Sci_Arttex&Pid=S151605722010000300007&Ing=En&Nrm=Iso.
Oliveira, A. F. Et Al. Avaliação Da Atividade Cicatrizante Do Jucá (Caesalpinia ferrea Mart. Ex Tul. Var. Ferrea) Em Lesões Cutâneas De Caprinos. Revista Brasileira De Plantas Medicinais, Botucatu, V.12, Set. 2010. Disponível Em<Http://Www.Scielo.Br/Scielo.Php?Acript=Sci_Arttex&Pid=S151605722010000300007&Ing=Em&Nrm=Isso>.
Oliveira, A. K. M.; Oliveira, N. A.; Resende, U. M.; Martins, P. F. R. B. Ethnobotany And Traditional Medicine Of The Inhabitants Of The Pantanal Negro Sub-Region And The Raizeiros Of Miranda And Aquidauna, Mato Grosso Do Sul, Brazil. Braz J Biol. 71 (Suppl.1): 283-9, 2011.
Oliveira, C. C. Estudos Toxicológicos Pré-Clínicos E Antitumorais Do Extrato Acetônico Das Folhas De Annona muricata L. 2012. 180f. Tese (Doutorado Em Farmacologia) –Universidade Federal Do Ceará, Fortaleza, 2012.
Oliveira, G. L.; Oliveira, A. F. M.; Andrade, L. H. C. Plantas Medicinais Utilizadas Na Comunidade Urbana De Muribeca. Norte Do Brasil. Acta Bot Bras. 24 (2): 571-7, 2010.
Oliveira, I. V. P. M. Avaliação Cicatricial Macroscópica Da Vagem E Da Casca Do Jucá
(Caesalpinia ferrea Mart. Ex Tul. Var. Ferrea) Em Lesões Cutâneas Em Asininos (Equus asinus). Acta Veterinaria Brasilica, V. 8, N. 2, P. 129-135, 2014.
Oliveira, Et Al. Levantamento Etnobotânico De Plantas Medicinais Utilizadas Pelos Moradores Do Povoado De Manejo, Lima Duarte – Mg. Rev. Bras. Pl. Med., Botucatu, V. 14. N. 2, P. 311-320, 2012.
Oliveira, L. M.; Voltolini, J. C.; Barbério. A. Potencial Mutagênico Dos Poluentes Na Água Do Rio Paraíba Do Sul Em Tremembé, Sp, Brasil, Utilizando O Teste Allium cepa. Ambi-Agua, Taubaté, V. 6, N. 1, P. 90-103, 2011.
Orsi, M. L.; Carvalho, E. D.; Foresti, F. Biologia Populacional De Astyanax altiparanae Garutti & Britski (Teleostei, Characidae) Do Médio Rio Paranapanema, Paraná, Brasil. Revista Brasileira De Zoologia, 21 (2): 207-218. 2004.
Ostling, O.; Johanson, K. J. Study Of Radiation- Induced Dna Damages In Individual Mammalian Cells. Biochem. Biophys. Res. Commun, V. 123, P. 291-298, 1984.
Palhares, D. Morfologia E Anatomia Do Caule E Do Sistema Subterrâneo De Brosimum gaudichaudii. 2004. 76f. Dissertação De (Mestrado) – Universidade De Brasília. 2004. Patwardhan, B. Ethnopharmacology And Drug Discovery. Journal Of Ethnopharmacology. Lausanne, V. 100, P. 50-52, 2005.
Peron, A. P.; Felipes, L.; Mattage, G. I.; Cantagalli, L. B.; Mauriucci, R. G.; Vicentini, V. E. P. Avaliação Mutagênica Das Plantas Medicinais Baccharis trimera Less. E Solanum melongena L. Em Células De Medula Óssea De Ratos Wistar. Revista Brasileira De Biociências, Porto Alegre, V. 6, N.2, P. 127-130, 2008.
Penteado, P. R. Diversidade Cromossômica E Molecular No Gênero Astyanax (Characiformes: Characidae). 2011. 58f. Dissertação (Mestrado Em Biologia Animal) –Universidade Federal De Viçosa, Viçosa Mg, 2011.
Pimenta, S. M. Adubação Em Mamacadela (Brosimum gaudichaudii Tréc.). 2002. 47f. Dissertação (Mestrado Em Agricultura Tropical) – Universidade Federal De Mato Grosso, Cuiabá-Mt, 2002.
Pina, C. D. S. Avaliação Da Exposição Profissional Ao Formaldeído: Efeito Genotóxico. Dissertação De (Mestrado). 2010. 77f. Instituto De Ciências Biomédicas Abel Salazar Da Universidade De Porto. 2010.
Pinho, D. S.; Sturbelle, R. T.; Martino-Roth, M. G.; Garcias, G. L. Avaliação Da Atividade Mutagênica Da Infusão De Baccharis trimera (Less.) Dc. Em Teste De Allium cepa E Teste De Aberrações Cromossômicas Em Linfócitos Humanos. Revista Brasileira De Farmacognosia, 20 (2), P. 165-170, 2010.
Poletto, P. O.; Diniz, A. P.; Bernardon, B.; Zan, R. A.; Ramos, L. J.; Meneguetti, D. U. O. Análise Da Mutagenicidade Do Extrato Hisrossolúvelde derris rariflora (Mart. Ex Benth, J. F. Macbr: Fabaceae), Timbó Amazônico, Através Do Teste Micronúcleo Em Allium cepa, Revista Pesquisa & Criação, V. 10, N. 1, P. 163-175, 2011.
Portela, A. C.; Souza. L. A. G.; Lopes, M. C. Organização Do Germoplasma De Leguminosas Arbóreas Do Inpa/Cpca: Fenologia E Desenvolvimento Inicial Das Espécies. In: Jornada De Iniciação Científica, 10.1, Pibic Cnpq/Inpa, Resumos Expandidos, P. 223-226. Manaus, 2001.
Pozetti, G. L. Brosimum Gaudichaudii Trecul (Moreceae): Da Planta Ao Medicamento. Revista De Ciências Farmacêuticas Básica E Aplicada. V. 6. N. 3. P. 159-166. 2005.
Ramsdorf, W. Avaliação Da Toxicidade Dos Compostos Fipronil, Nitrato De Chumbo E Naftaleno Em Peixes. Tese (Doutorado Em Ciências) – Universidade Federal Do Paraná, Curitiba, 2011.
Ramsdorf, W. Utilização De Duas Espécies De Astyanax (Astyanax Sp e A. Altiparanae) Como Bioindicadores De Região Contaminada Por Agrotóxico (Fazenda Cangüiri – Ufpr). Dissertação (Mestrado Em Genética) – Universidade Federal Do Paraná, Curitiba, 2007.
Ribeiro, J. E. L. S.; Hopkins, M. J. G.; Vicentini, A.; Sothers, C. A.; Costa, M. A. S.; Brito, J. M.; Souza, M. A. D.; Martins, L. H. P.; Lohmann, L. G.; Assunção, P. A. C. L.; Pereira, E. C.; Silva, C. F.; Mesquita, M. R.; Procópio, L. C. Flora Da Reserva Ducke: Guia De Identificação Das Plantas Vasculares De Uma Floresta De Terra Firme Na Amazônia Central. Manaus: Inpa, 1999. 816p.
Ribeiro, L.R.; Marques, E.K. A Importância Da Mutagenese Ambiental Na Carcinogenese Humana In: Mutagênese Ambiental. Editora Da Ulbra. Canoas-Rs. 2003.
Ribeiro, L.R.; Salvadori, D.M.F.; Marques, E.K. Mutagênese Ambiental. Editora Da Ulbra. Canoas-Rs. 2003.
Ribeiro, L. R. Teste De Micronúcleo Em Medula Óssea De Roedores In Vivo. In: Mutagênese Ambiental. Canoas: Ulbra, 2003.
Rodrigues, V. E. G.; Carvalho, D. A. Plantas Medicinais No Domínio Dos Cerrados. Larvas: Editora Ufla, 2001.
Rodrigues, V. E. G.; Carvalho, D. A. Plantas Medicinais No Domínio Dos Cerrados. Lavras: Editora Ufla, 2001a, P. 180, 2001.
Rodrigues, V. E. G.; Carvalho, D. A. Levantamento Etnobotânico De Plantas Medicinais No Domínio Do Cerrado Na Região Do Alto Do Rio Grande- Minas Gerais. Ciência E Agrotecnologia, V. 25, P. 102-123, 2001b.
Salvarori, D. M. F.; Ribeiro, L. R.; Fenech, M. Teste Do Micronúcleo Em Células Humanas In Vitro In: Mutagênese Ambiental. Canoas: Ulbra, Cap. 8, P. 201-223, 2003.
Sampaio, F. C.; Pereira, M. S. V.; Dias, C. S.; Costa, V. C. O.; Conde, N. C. O.; Buzalaf, A. R. In Vitro Antimicrobial Activity Of Caesalpinia Ferrea Martius Fruits Against Oral Pathogens. Journal Of Ethnopharmacology. V. 124, N 2, P. 289-294, 2009.
Sano, S. M.; Almeida, S. P. (Eds.) Cerrado: Ambiente E Flora. Planaltina: Embrapacpac, V.2, 1279p. 2008.
Scalon, M. C. S.; Rechenmacher, C. Et Al. Evaluation Of Sinos River Water Genotoxicity Using The Comet Assay In Fish. Braz. J. Biol., V. 70, N.4, (Suppl.) P. 1217-1222, 2010.
Silva, F. D. B.; Sales, M. A. G.; Sá, O. R. M.; Santana, G. M.; Deus, M. S. M.; Sousa, J. M. C.; Ferreira, P. M. P.; Peron, A. P.Potencial Citotóxico, Genotóxico E Citoprotetor De Extratos Aquosos De Caesalpinia Pyramidalis Tul., Caesalpinia Pulcherrima Sw. Revista Brasileira De Biociências, Porto Alegre, V. 13, N. 2, P. 101-109, Abri./Jun. 2015.
Silva, C. R.; Monteiro, M. R.; Caldeira, De-Araujo. A; Bezerra, R. J. C.A. Absence Of Mutagenic And Citotoxic Potentiality Of Senna (Cassia Angustifólia Vahl.) Evaluated By Microbiological Test. Rev Bras Farmacogn 14 (Supl. 1): 1-3. 2004.
Silva, J.; Erdtmann, B.; Henriques, J. A. P. Genética Toxicológica. Porto Alegre, Alcance. 422p. 2003.
Silvia, D. B.; Vieira, R. F.; Cordeiro, M. C. T.; Pereira, E. B. C.; Pereira, A. V. Propagação Vegetativa De Brosimum Gaudichaudii Tréc. (Mama-Cadela) Por Estacas De Raízes. Revista Brasileira De Plantas Medicinais, Botucatu, V. 13, N. 2, P. 151-156, 2011.
Silva, A. C.; Nepomuceno, J. C. Avaliação Da Frequência De Micronúcleos Em Eritrócitos Periféricos De Mandi-Amarelo (Pimelodus Maculatus) Do Rio Paranaíba. Rev. Do Núcleo Interdiciplinar De Pesquisa E Extensão Do Unipam, Patos De Minas, Unipam, V.1, N. 7, P. 167-179, 2010.
Sisinno, C. L. S.; Oliveira-Filho, E. C. Princípios De Toxicologia Ambiental. 1 Ed. Rio De Janeiro: Editora Interciência, 2013.
Souza-Filho, J. Efeitos Tóxicos E Genotóxicos Do Herbicida Roundup Transorb® Em Guppy (Poecilia Reticulata) Submetido A Tratamento Agudo. 2011. F146. Dissertação (Mestrado Em Biologia Celular E Molecular) – Universidade Federal Do Goiás.
Sólon, S.; Brandão, L. F. G.; Siqueira, J. M. O Gênero Cochlospermum Kunth Com Ênfase Nos Aspectos Etnobotânico, Farmacológicos, Toxicológicos E Químicos De Cochlospermum Regium (Mart. Et. Schr.) Pilger. Revista Eletrônica De Farmácia. V. Vi, N.3, P. 1-22, 2009.
Takahashi, C. S. Testes Citogenéticos In Vitro E Aneuploidia In: Mutagênese Ambiental. Canoas: Ulbra, Cap.6, P. 151-172, 2003.
Takeoka, G. R.; Dao, L. T. Antioxidant Constituent Of Almond [Prunus Dulcis (Mill.) D.A. Webb.] Hulls.J Agric Food Chem, V.51, P. 496-501, 2003.
Teixeira, R. O. Et Al. Assessment Of Two Medicinal Plants, Psidium Guajava L. And Achillea Millefolium L., In Vitro And In Vivo Assays. Genetics And Molecular Biology. Ribeirão Preto. V. 26, N. 4, P. 551-555. 2003.
Tice, R. R.; Agurell, E.; Anderson, D. Et Al. The Single Cell Gel/ Comet Assay: Guidelines For In Vitro And In Vivo Genetic Toxicology Testing. Environ. Mol. Mutagen. V. 35, P. 206-221, 2000.
Ventura, B. C. Et Al. Mutagenic And Genotoxic Effects Of The Atrazine Herbicide In Oreochromis Niloticus (Perciformes, Cichildae) Effected By The Micronuclei Test And The Comet Assay, Pest. Biochem, Physio. 90, 42-51, 2008.
Wyrepkowski, C. C.; Costa, D. L.; Sinhorin, A. P.; Vilegas, W.; De Grandis, R. A.; Resende, F. A.; Varanda, E. A. & Santos, L. C. Characterization And Quantification Of The Compounds Of The Ethanolic Extract From Caesalpinia Ferrea Stem Bark And Evaluation Of Their Mutagenic Activity. Molecules, 19 (10); 16039-16057, 2014.
