CLINICAL-RADIOLOGICAL PROFILE OF PEDIATRIC PATIENTS DIAGNOSED WITH COMPLICATED COMMUNITY-ABSORBED PNEUMONIA TREATED IN THE EMERGENCY ROOM OF THE TAGUATINGA REGIONAL HOSPITAL
REGISTRO DOI: 10.69849/revistaft/fa10202411122259
Ana Couto Lima1, Fernando de Velasco Lino2, Heloise Fernandes da Silva Bastos3, Renata Machado Bonfim4, Juliana Faleiro Pires5, Eduardo José Ferreira Sales6, Ana Carolina Buta Pereira7, Gabriela Ramos do Amaral8. Amanda Lopes de Alencar9
RESUMO
A pneumonia adquirida na comunidade complicada (PACC) decorre de complicações localizadas – derrame e/ou empiema pleural, pneumonia necrosante ou abscesso pulmonar – ou complicações sistêmicas. Um relato britânico informa que 3% das pneumonias em crianças evoluem para PACC. O diagnóstico requer exames de imagem – radiografia de tórax (RX), ultrassonografia de tórax (USG) e a tomografia de tórax (TC). A terapêutica é baseada na antibioticoterapia empírica, tendo o Streptococcus pneumoniae (SP) como o agente mais frequente. O objetivo do estudo é de identificar os pacientes atendidos no Pronto Socorro de Pediatria do Hospital Regional de Taguatinga (HRT), Distrito Federal, com diagnóstico de PACC no período de 01 de março de 2022 a 01 de março de 2024. A amostra total foi de 51 pacientes com PACC. Pode-se inferir que o perfil dos pacientes é de crianças hígidas, do sexo masculino e com menos de cinco anos de idade. Os sintomas característicos – tosse, taquipneia e febre – estavam presentes na maior parte dos casos na admissão. A persistência da febre além das 48-72h do início do tratamento ou seu ressurgimento após período afebril, a persistência e/ou surgimento de taquipneia e/ou tosse, a diminuição e/ou abolição do murmúrio vesicular à ausculta e a hipoxemia forneceram o padrão clínico evolutivo mais frequente. O RX de tórax fora o exame de imagem mais realizado, tendo como apresentação radiológica predominante a consolidação de forma isolada e os sinais radiológicos das complicações apresentadas. Dois casos com SP como agente etiológico foram identificados. A definição terapêutica foi variável e o desfecho foi favorável em todos os casos. O perfil clínico-radiológico dos pacientes mostrou ser compatível com os dados da literatura, no entanto, faltam estratégias quanto a condução uniforme da instituição para o cuidado com os pacientes com PACC.
Palavras-chave: Pneumonia Bacteriana, Derrame Pleural, Pneumonia Necrosante, Abscesso Pulmonar, Radiologia.
ABSTRACT
Complicated community-acquired pneumonia (CACP) results from localized complications – pleural effusion and/or empyema, necrotizing pneumonia or lung abscess – or systemic complications. A British report states that 3% of pneumonias in children progress to CACP. Diagnosis requires imaging tests – chest X-ray (X-ray), chest ultrasound (USG) and chest tomography (CT). Treatment is based on empirical antibiotic therapy, with Streptococcus pneumoniae (SP) as the most frequent agent. The objective of the study is to identify patients treated at the Pediatric Emergency Room of the Taguatinga Regional Hospital (HRT), Federal District, diagnosed with CACP between March 1, 2022 and March 1, 2024. The total sample consisted of 51 patients with CACP. It can be inferred that the profile of patients is healthy, male children under five years of age. The characteristic symptoms – cough, tachypnea and fever – were present in most cases at admission. Persistent fever beyond 48-72h after the start of treatment or its reappearance after an afebrile period, persistent and/or onset of tachypnea and/or cough, decreased and/or abolished breath soun ds on auscultation and hypoxemia provided the most frequent clinical pattern of evolution. Chest X-ray was the most frequently performed imaging exam, with the predominant radiological presentation being isolated consolidation and radiological signs of the complications presented. Two cases with PS as the etiological agent were identified. The therapeutic definition was variable and the outcome was favorable in all cases. The clinical and radiological profile of the patients was compatible with the data in the literature. However, there is a lack of strategies regarding uniform management of the institution for the care of patients with CCAP.
Keywords: Bacterial Pneumonia, Pleural Effusion, Necrotizing Pneumonia, Lung Abscess, Radiology.
1. INTRODUÇÃO
A pneumonia adquirida na comunidade (PAC) decorre do acometimento do parênquima pulmonar por agentes extra-hospitalares, sendo uma importante causa de hospitalização e de morte no mundo, representando 15,3% dos óbitos mundiais (BARSON, 2024; BUNTHI et. al., 2021).
Por sua vez, a pneumonia adquirida na comunidade complicada (PACC) se dá quando a PAC tem evolução com complicações localizadas, como derrame e/ou empiema pleural (DP / EP), pneumonia necrosante ou abscesso pulmonar (PN / AP) e/ou a manifestações que se dão de maneira sistêmica (sepse/choque séptico, insuficiência respiratória aguda grave, coagulação intravascular disseminada e outros) (SOCIEDADE BRASILEIRA DE PEDIATRIA – SBP, 2024).
A PACC pode surgir inicialmente com a doença ou ser decorrente da evolução da pneumonia sem complicações. Uma das formas de suspeitar-se das complicações ocorre quando não há melhora dos sintomas iniciais apresentados a partir de 48 a 72h do início do tratamento (SBP, 2024).
O diagnóstico da PAC, de maneira geral, é clínico. A Organização Mundial de Saúde (OMS) estabelece inclusive algoritmos a serem seguidos nos casos em que há recursos limitados locais. Porém, possuem baixa especificidade na detecção de PAC, ainda mais quando há sinais de gravidade, devendo-se ponderar com mais celeridade a necessidade de realização de exames complementares como a radiografia de tórax (RX), ultrassonografia de tórax (USG), exames laboratoriais e outros, como são nos casos de PACC (PERVAIZ et. al., 2018; PRESTES et. al., 2023).
O tratamento da doença inclui a antibioticoterapia e, em alguns casos, há necessidade de intervenção cirúrgica. Os casos devem ser individualizados, tomando-se a melhor decisão para o correto manejo da patologia (JANAHI; FAKHOURY, 2024).
Posto isso, este estudo tem por objetivo identificar os pacientes atendidos no Pronto Socorro de Pediatria do Hospital Regional de Taguatinga (HRT), Distrito Federal, com diagnóstico de PACC no período de 01 de março de 2022 a 01 de março de 2024, verificando se há comorbidades relacionadas, sinais e sintomas admissionais, curso clínico e evolução radiológica ao longo da internação, agentes etiológicos identificados ou não baseado na hemocultura e/ou solicitação de cultura do líquido pleural, além da terapêutica farmacológica adotada e ainda qual desfecho da patologia em questão.
Com informações concretas quanto ao comportamento da doença no âmbito hospitalar em estudo, poder-se-á criar estratégias e rotinas hospitalares bem elaboradas a fim de melhorar a assistência prestada aos usuários de saúde da unidade hospitalar.
2. REFERENCIAL TEÓRICO
Apenas em 2015, 921 mil mortes foram atribuídas a PAC em todo o mundo. No Brasil, no ano de 2017, a taxa de letalidade esteve em 0,7% e, apesar de não elevada, ainda assim é causa de inúmeras internações hospitalares (CARVALHO, 2020).
Devido à pandemia do coronavírus (COVID-19) em 2019, com os fechamentos que se sucederam, houve redução importante de infecções respiratórias, incluindo as causadas pelo pneumococo – Streptococcus pneumoniae (SP). De março de 2020 a fevereiro de 2021, quando os bloqueios e o isolamento social ainda eram presentes, a queda de casos foi expressiva. Com a retomada das atividades, a redução ainda era significativa, mas houve um aumento maior proporcional em crianças abaixo dos 15 anos de idade (BERTRAN, M. et. al., 2022).
Dados britânicos trazem que 3% dos casos de pneumonia em crianças evoluem para complicações, podendo estimar uma baixa frequência quanto a essa evolução de casos, no entanto, é evidente que os hospitais possuem casos de PACC de forma corriqueira. Demais informações relatadas por estudos canadenses e israelitas mostram que esses casos são maiores em crianças abaixo dos cinco anos de idade (BENEDICTIS et. al., 2020; ALEMAYHEU et. al., 2023).
Quanto aos tipos de complicações, o derrame pleural (DP) é didaticamente dividido em três estágios evolutivos da exsudação: o primeiro deles caracteriza-se pelo derrame parapneumônico simples – ocasionado pelo aumento do fluido intersticial pulmonar para espaço pleural e aumento da permeabilidade capilar, durando entre 24 a 72 horas. Posteriormente, evolui para fibrinopurulento – derrame parapneumônico complicado, onde há invasão do derrame por bactérias, formando- se o empiema, além da deposição de fibrina nas superfícies pleurais, o que espessa o exsudato e forma loculações, tendo duração de 7 a 10 dias. Por último, a fase de organização, que ocorre entre 2 a 4 semanas após a formação do empiema, é quando os fibroblastos crescem nas superfícies pleurais parietal e visceral, formando uma membrana que é inelástica, podendo prejudicar a função pulmonar (JANAHI; FAKHOURY, 2024; BENEDICTIS et. al., 2020). Os sintomas mais frequentes do DP incluem a febre e a tosse (presentes em aproximadamente 90% dos pacientes), mal- estar, taquipneia, piora do padrão respiratório, dor torácica hipotensão, sepse e choque séptico (JANAHI; FAKHOURY, 2024).
Já o empiema pode mimetizar uma PAC sem complicação, assim, pacientes com febre persistente e/ou com declínio clínico, após terapia adequadamente iniciada, devem ser prontamente reavaliados (BENEDICTIS et. al., 2024).
Por outro lado, descrita pela primeira vez em 1994, a pneumonia necrosante é decorrente da extensa destruição do tecido pulmonar, levando ainda a sua liquefação e perda de função. Inicialmente, ocorre a consolidação com necrose e rapidamente progride para cavitação. Essas cavitações podem, no entanto, coalescer, formando grandes cistos, ao que se parece com abscesso pulmonar. Porém, sua verdadeira fisiopatologia ainda não é bem esclarecida (BENEDICTIS et. al., 2020; CHEN et. al., 2023). Em geral, trata-se de crianças hígidas que evoluem com essa complicação. Os sorotipos do SP mais envolvidos em sua etiologia são o 3 e 14 (SCHVARTSMAN et al., 2023). Além dos sintomas já descritos quando se trata de DP, observa-se aqui maior duração da febre, além de anemia, fadiga, citando-se ainda a dor torácica, mudança da percussão e ausculta respiratória, com macicez e abolição de sons respiratórios, respectivamente (SBP, 2024; CHEN et. al., 2020).
No mais, o abscesso pulmonar, complicação rara, é uma cavidade, geralmente única, com parede espessada que contém material purulento em seu interior, resultado de supuração e necrose do parênquima pulmonar, sendo seu processo caracteristicamente lento (BENEDICTIS et. al., 2020). Os sintomas muito assemelham-se ao que foi exposto quando há DP, mas a tosse diferencia-se por ter padrão mais seca, no entanto, se ocorre ruptura do abscesso nos brônquios, a tosse torna-se excessivamente produtiva (SBP, 2024).
Cita-se ainda a pneumatocele ou cistos no parênquima pulmonar, que são complicações incomuns decorrentes de PAC graves. São lesões cavitárias, com paredes finas que são preenchidas por ar, podendo ser única ou múltiplas. Sua origem pode ser infecciosa – como na PAC – ou decorrente ainda de situações traumáticas, cirúrgicas ou mesmo de uma ventilação mecânica. Setenta por cento de sua etiologia infecciosa se dá pelo Staphylococcus aureus (FERNANDES; AZEVEDO, 2023).
Revisões sistemáticas e outros estudos mostram que o vírus sincicial respiratório é a causa mais comum de pneumonia em crianças entre 1 a 59 meses de idade, dados esses de hospitais da Ásia e África. Todavia, raramente são causa de PACC, sendo essa mais comum quando há coinfecção com bactérias e, apesar de não ser um achado universalmente aceito, o SP é o agente etiológico bacteriano mais comum (BENEDICTIS et. al., 2020; ALEMAYHEU et. al., 2023). Com o advento, no entanto, das vacinas bacterianas conjugadas, contra o Haemophilus influenzae tipo B (Hib) e as vacinas pneumocócicas conjugadas (VPC), principais agentes causadores da PAC bacteriana na infância até os cinco anos de idade, houveram reduções dos casos e mortes decorrentes da patologia (CARVALHO, 2020). Dessa forma, agentes como Streptococcus pyogenes, Staphylococcus aureus, Haemophilus influenzae, Mycoplasma pneumoniae e Pseudomonas aeruginosa passaram a ter maior expressividade na etiologia da PACC (BENEDICTIS et. al., 2020).
Em relação ao SP, bactéria causadora de doenças invasivas, é uma causa expressiva de morbimortalidade, havendo mais de 90 sorotipos diferentes detectáveis (PERDRIZET, 2021). As primeiras VPC são de 1990. Em 2010, o Brasil introduziu no Programa Nacional de Imunizações (PNI) a VPC 10 para todas as crianças abaixo dos dois anos de idade, em um esquema que contempla, atualmente, duas doses e um reforço. Estudos entre os anos 2000 e 2015, mostraram a redução de 40% da incidência de pneumonias causadas pelo SP no mundo, em especial à gravidade relacionada a elas, principalmente em países de baixa e média renda. Contudo, observou-se o aumento das doenças causadas pelos sorotipos que não estão inclusos nas VPC, em especial os sorotipos 19A, 3 e 6C com maior aumento. A maior preocupação dessa elevação dos sorotipos não vacinais está na maior virulência e resistência antimicrobiana dessas cepas (SOCIEDADE BRASILEIRA DE IMUNOLOGIA, SOCIEDADE BRASILEIRA DE INFECTOLOGIA, SOCIEDADE BRASILEIRA DE PEDIATRIA – SBIm, SBI, SBP, 2023; MZUMARA et. al., 2024).
Ademais, esses sorotipos – em especial o 3 e 19A, e os tipos 1, 5, 7F e 12 são os mais prevalentes quando se trata de PACC (TUOMANEN; KAPLAN; OLARTE, 2024).
Atualmente, são 3 tipos de VPC, a 10, que se encontra no calendário vacinal da rede pública de saúde, a 13, encontrada na rede particular e realizada para pessoas com alto risco no Sistema Único de Saúde (SUS), e, a mais recente, a VPC 15, possuindo 15 sorotipos, disponibilizada apenas em serviços particulares (SBIm, SBI, SBP, 2023).
Sendo assim, as vantagens da VPC 15 estariam na inclusão dos sorotipos 22F e 33F, não inclusos na VPC 13, na melhora da imunogenicidade do tipo 3 e na manutenção das respostas imunológicas já presentes nas VPC atuais. É indicada para pessoas de 6 semanas de vida a 17 anos de idade, podendo ser realizada de forma a permutar com a VPC 13 (SBIm, SBI, SBP, 2023).
As Sociedades Brasileiras de Pediatria (SBP), Imunizações (SBIm) e Infectologia (SBI) recomendam, dessa forma, a utilização da VPC 15 (ou VPC 13) substituindo a VPC 10, atentando-se para a idade de início do esquema vacinal, podendo ainda ampliá-lo com as vacinas mais atuais para àqueles que já iniciaram ou até mesmo completaram o esquema vacinal com a VPC 10 (SBIm, SBI, SBP, 2023). Perdrizet et. al, 2021 traz ainda que, caso o Brasil fosse alterar a VPC 10 para VPC 13 de forma universal, 170.191 casos de pneumonias seriam evitados em um período de 5 anos, estimando uma economia de 172 milhões de dólares.
A hipótese diagnóstica de PACC pode ser suspeitada em pacientes que já tenham iniciado o tratamento para PAC, cursando, posteriormente, sem melhora em 48-72h do início do tratamento (SBP, 2024). Outros trabalhos apontam que algumas associações podem ser estabelecidas para o diagnóstico inicial de PACC. Citam-se a idade do paciente: crianças abaixo dos dois anos de idade seriam mais suscetíveis a complicações; o período de duração da febre antes da admissão ser prolongado; dor torácica de caráter assimétrico; baixa contagem da série branca do hemograma; provas de atividade inflamatória aumentada; e uso de analgesia e/ou anti-inflamatório, como paracetamol e ibuprofeno, em um momento prévio ao início do tratamento. Todavia, são associações de difícil correlação e validação (BENEDICTIS et. al., 2024).
O RX de tórax é o ponto de partida para investigação das complicações na maior parte dos casos (BARSON, 2024). Ressalta-se, entretanto, a importância da US de tórax, sendo um método mais sensível que o RX de tórax no caso de detecção de DP de pequena monta, por exemplo, estimando o volume do DP (BENEDICTIS et. al., 2024). Além de poder visualizar características pulmonares que possam evoluir com outras complicações de uma pneumonia, podendo ainda ser utilizado para verificar como está a resposta ao tratamento instituído. Com isso, mostra ser superior a TC de tórax que, entre outros, é de maior custo, possui exposição à radiação alta e, em alguns casos, ainda há necessidade de sedação. No mais, não fornece dados úteis quando comparada às ultrassonografias. Deve ser realizada apenas quando há incerteza quanto ao diagnóstico e, quando houver necessidade de sua realização, deve ser feita com o auxílio do contraste (BENEDICTIS et. al., 2024; BARSON, 2024). Quanto à terapêutica, a literatura mostra que, por definição, a terapêutica adequada deve ser feita baseada na gravidade da doença, pela resistência local antimicrobiana e considerando se há comorbidades associadas presentes (BENEDICTIS et. al., 2024; SBP, 2024).
A princípio, o tratamento por via parenteral pode ser prolongado por duas ou três semanas (SBP, 2024). Nos casos de DP, se pequenos e sem maiores comprometimentos respiratórios, apenas a antibioticoterapia pode ser suficiente para o manejo da complicação. Importante salientar que o início precoce da medicação pode impedir a progressão do derrame e evitar um empiema pulmonar (BENEDICTIS et. al., 2024). Considerando um DP em crianças clinicamente bem, apenas a penicilina cristalina ou ampicilina (sem betalactamase) podem ser utilizadas (SBP, 2024). Há ainda a possibilidade de tratamento por via oral, domiciliar, para pequenos derrames e pacientes em bom estado geral, utilizando, portanto, amoxicilina ou amoxicilina com clavulanato ou cefuroxima (alternativas para pacientes alérgicos IgE mediados incluem levofloxacino, clindamicina e linezolida) (JANAHI; FAKHOURY, 2024). Já em casos graves, a ceftriaxona ou cefotaxima são bem indicadas. Nos locais onde a suspeita de Staphylococcus aureus resistentes à meticilina (MRSA) é elevada, a vancomicina deve ser adicionada à terapêutica já instituída. A clindamicina ou linezolina podem ser alternativas à vancomicina nesses casos. E ainda, a ceftarolina – cefalosporina de quinta geração – é uma alternativa válida em monoterapia, substituindo a vancomicina associada a ceftriaxona ou cefotaxima (SBP, 2024). Já para Schvartsman et. al., 2023, p. 329, quando há definição diagnóstica de PACC, deverá ser realizada a associação oxacilina e ceftriaxona ou cefuroxima.
Nas pneumonias complicadas que levam a grande gravidade, com necessidade de UTI e ventilação mecânica, a associação vancomicina, ceftriaxona ou cefotaxima e azitromicina deve ser considerada (SBP, 2024).
Nos casos de pneumonia necrosante e em abscesso pulmonar, a terapêutica via parenteral tem curso longo, a depender, é claro, da clínica do paciente, mas em média dura entre três e quatro semanas (SBP, 2024). Nesses casos, indica-se o uso da vancomicina, ceftriaxona ou cefotaxima ou cefepime (SBP, 2024; JANAHI; FAKHOURY, 2024). Mas, se ainda não utilizado, a ampicilina com sulbactam ou amoxicilina com clavulanato podem ser utilizados (SBP, 2024).
Quanto à susceptibilidade do SP à penicilina, a epidemiologia local deve ser avaliada para a decisão quanto à terapia mais bem indicada. Na era pós VPC 13, o sorotipo 19A diminuiu sua resistência às penicilinas. No entanto, os sorotipos 35B e 15A tornaram-se mais incidentes na resistência a medicamentos usados de forma frequente, podendo haver necessidade de utilização da vancomicina, linezolida e ceftarolina (TUOMANEN; KAPLAN; OLARTE, 2024).
Alguns estudos trazem as resistências aos antibacterianos pré e pós VPC 10, mostrando uma preocupante elevação da não suscetibilidade nos últimos anos em diferentes países. Em especial, destaca-se pelo aumento da cepa 19A e sua resistência, o que pode ser amenizado pela substituição da VPC 10 pela VPC 13 ou VPC 15. Já quanto à ceftriaxona, mostrou-se uma suscetibilidade maior após a VPC 10 (PEREIRA et. al., 2024).
Por fim, a grande maioria das crianças com complicações advindas de uma pneumonia se recuperam (BENEDICTIS et. al., 2024). Nos casos de DP, não há evidências científicas que validem a associação entre bactérias mais resistentes ao tratamento antibacteriano e evoluções ruins. O que ocorre são internações com tempo de duração maior (JANAHI; FAKHOURY, 2024).
A radiografia de tórax e TC de tórax normalizam-se ou possuem melhora significativa das imagens de pneumonias complicadas em até seis a nove meses após o paciente receber alta médica. Destaca-se ainda que a mortalidade por PACC em crianças é menor quando comparado com adultos, tendo ainda suas funções pulmonares completamente recuperadas após a reabilitação da doença (BENEDICTIS et. al., 2024).
3. OBJETIVOS
3.1 Objetivo Geral:
Analisar o perfil clínico-radiológico dos pacientes pediátricos diagnosticados com pneumonia comunitária complicada atendidos no Pronto Socorro do Hospital Regional de Taguatinga (HRT) de 01 de março de 2022 a 01 de março de 2024.
3.2. Objetivos Específicos:
Identificar os casos de pacientes pediátricos diagnosticados com Pneumonia Comunitária Complicada atendidas no Pronto Socorro de Pediatria do Hospital Regional de Taguatinga (HRT) de 01 de março de 2022 a 01 de março de 2024; identificar o curso clínico e descrições radiológicas da PAC complicada nesses pacientes; identificar se há comorbidades associadas; identificar as complicações da PAC no trato respiratório e/ou sistêmica desses pacientes; identificar os agentes etiológicos da PAC complicada desses pacientes, de acordo com resultado de hemocultura e/ou cultura de líquido pleural realizada; identificar a terapêutica farmacológica adota para esses pacientes; sugerindo, se possível, mudanças a nível de rotina hospitalar quanto à identificação clínica e radiológica dos pacientes pediátricos com PAC complicada.
4. METODOLOGIA
Trata-se de um estudo transversal, descritivo, observacional, retrospectivo e de curto prazo. Foram selecionados 216 pacientes diagnosticados com PAC, atendidos no Pronto Socorro (PS) de Pediatria do Hospital Regional de Taguatinga (HRT) no período de 01 de março de 2022 a 01 de março de 2024. Destes, baseados nos critérios pré-definidos de inclusão e exclusão, abaixo descritos, obteve-se amostra total de 51 pacientes.
Foram incluídos no estudo, os pacientes com idade até 14 anos (incompletos) diagnosticados com PAC complicada atendidas no PS de Pediatria do Hospital Regional de Taguatinga (HRT) de 01 de março de 2022 a 01 de março de 2024.
Já os critérios de exclusão incluem: pacientes com suspeita de PAC, mas sem diagnóstico definitivo, pacientes que tenham ido à óbito antes do diagnóstico ou pacientes que tenham sido diagnosticados na instituição, mas que não tenham dado seguimento ao tratamento, no qual possa ter corroborado para que não haja informações completas ou relevantes para o estudo no prontuário clínico.
A amostra foi adquirida por meio do livro de registros do PS de Pediatria do Hospital Regional de Taguatinga (HRT).
Quanto às variáveis avaliadas: idade, mês e ano do diagnóstico, comorbidades, curso clínico (quadro clínico da admissão, evolução do quadro de PAC para PACC, necessidade de encaminhamento para unidade de terapia intensiva pediátrica (UTIP), tempo de internação e o desfecho para alta ou óbito), determinação se houve a realização e descrição de exames de imagens e/ou laboratoriais, além da possível identificação do agente etiológico e qual a terapia instituída para os pacientes.
Para avaliação da descrição radiológica, estabeleceu -se as nomenclaturas mais utilizadas na literatura e conforme determina o site Radiografia de Tórax em Estudos Epidemiológicos da OMS1 para definição de PAC e/ou PACC, realizando a busca por tais nomes nos detalhamentos dos referidos exames.
A análise dos dados foi feita a partir do programa Excel 2024. Este estudo foi aprovado pelo Comitê de Ética da Escola Superior de Ciências da Saúde do Distrito Federal (CAAE): 81669824.2.0000.5553.
5. RESULTADOS
5.1 Sociodemográficos:
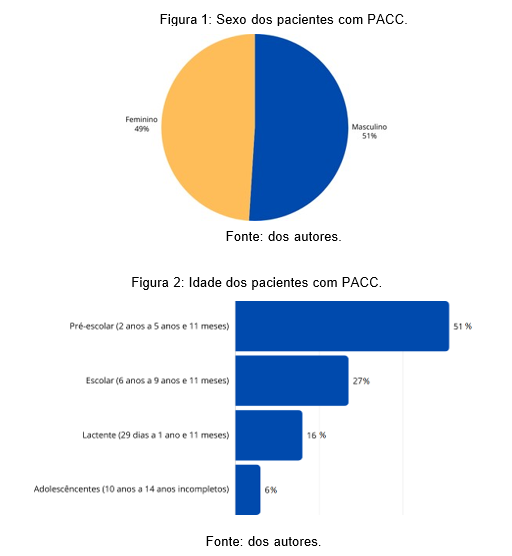
Foram inclusos no estudo 51 participantes de pesquisa que atenderam aos critérios de inclusão, havendo leve predominância do sexo masculino, com 51%, sendo os outros 49% do sexo feminino (Figura 1). Desses, 26 pacientes (51%) eram pré-escolares (de 2 anos a 5 anos, 11 meses e 29 dias), 14 (27%) em idade escolar (6 anos a 9 anos, 11 meses e 29 dias), 8 (16%) lactentes (29 dias a 1 ano, 11 meses e 29 dias) e 3 (6%) adolescentes (10 anos a 13 anos, 11 meses e 29 dias – idade limite de inclusão do estudo) (figura 2).
5.2. Registro de casos e sazonalidade:
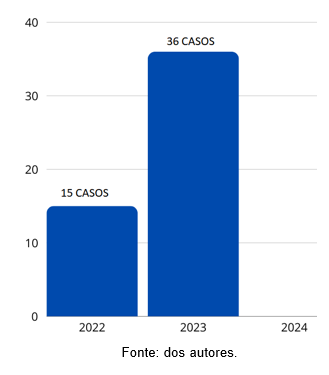
Os casos encontrados foram registrados no período que compreendeu março a novembro do ano de 2022 e 2023. Mostrou-se aumento da incidência dos casos do ano de 2022 para 2023, de 15 casos registrados de março a novembro de 2022 para 36 casos de março a novembro de 2023, totalizando um aumento de 140% (Figura 3). Não houveram registros no ano de 2024 (de janeiro a março).
Figura 3: Incidência por ano de PACC.
Percebeu-se também uma incidência ainda mais elevada nos meses entre junho a setembro dos referidos anos, sendo 10 casos registrados no período informado de 2022 e 20 casos em 2023. Os demais meses com maior incidência foram de março a maio, com 4 casos em 2022 e 11 casos em 2023. Ademais, em 2022 houve 1 registro em novembro e 5 entre outubro e novembro de 2023.
5.3. Comorbidades e fatores de risco
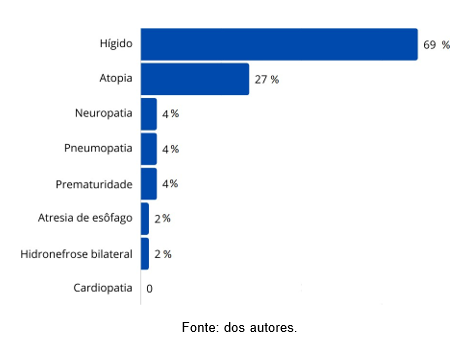
Do total da amostra, 35 pacientes (69%) foram considerados hígidos, 14 (27%) possuíam algum tipo de atopia, como rinite alérgica, asma, dermatite atópica e outros, 2 (4%) com alguma neuropatia descrita e 2 pacientes (4%) com pneumopatias. Outros fatores, que possam ter relevância citadas foram: 2 pacientes com histórico de prematuridade (4%), 1 paciente com atresia de esôfago resolvida ao nascimento (2%) e 1 criança com hidronefrose bilateral que ainda estava em acompanhamento (2%) (Figura 4).
Figura 4: Comorbidades associadas.
5.4. Perfil clínico-radiológico:
Os sinais e sintomas descritos foram avaliados em um primeiro atendimento, logo na admissão do PS, e, posteriormente, ao longo da internação. Assim como a solicitação e avaliação de exames complementares.
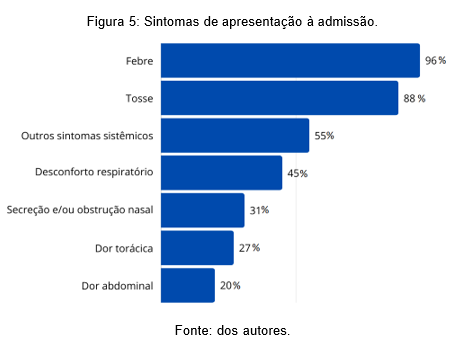
No primeiro atendimento, ainda no PS, foram descritos os sintomas a seguir: febre em 96% dos casos – com média de 5,8 dias de picos febris anteriores à admissão, 88% apresentavam tosse, 51% descreviam desconforto respiratório, 32% secreção e/ou obstrução nasal, 27% relataram dor torácica, 20% dor abdominal e 55% descreviam demais sintomas sistêmicos (vômitos e inapetência) (Figura 5).
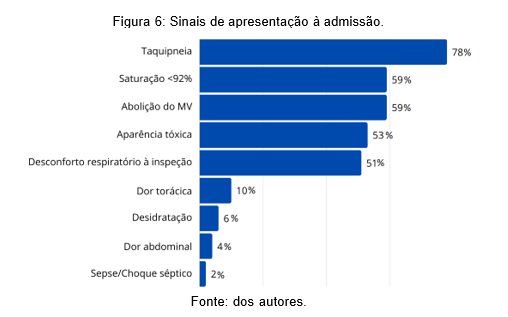
Quanto aos sinais observados em exame físico pode-se observar que a taquipneia fora a mais incidente – 78%, seguida por 59% dos casos com saturação de oxigênio em oximetria de pulso menor que 92% em ar ambiente, 59% com diminuição e/ou abolição do murmúrio vesicular (MV) pulmonar, aparência tóxica em 53% dos casos, desconforto respiratório à inspeção e estertor fino à ausculta pulmonar em 51%, dor torácica referida à palpação em 10%, 6% com sinais de desidratação, 4% apresentava dor abdominal à palpação, 2% apresentando critérios de sepse e 2% sem sinais clínicos de alteração ao exame físico de entrada (Figura 6).
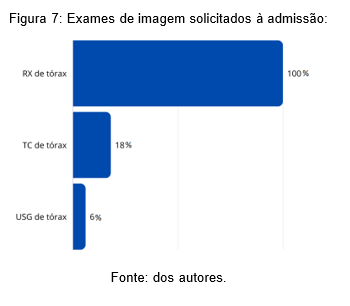
Dos exames radiológicos solicitados à admissão, pode-se observar que o RX de tórax fora solicitado em todos os pacientes avaliados – 51 (100%), seguido pela TC de tórax em 9 pacientes (18%) e a USG de tórax em 3 crianças (6%) (Figura 7).
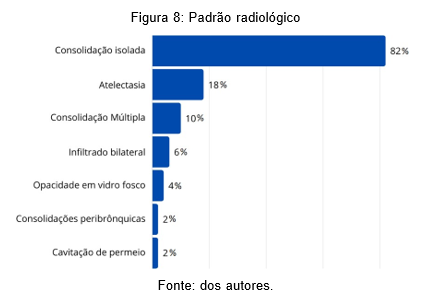
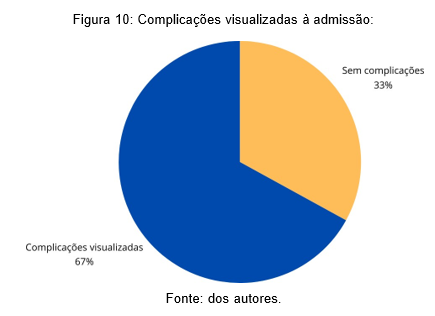
O padrão radiológico que predominou fora a pneumonia lobar – 44 (86%) – seguida pela broncopenumonia – 4 (8%) e pneumonia intersticial 3 (6%). Foi visto ainda que a consolidação de forma isolada fora a apresentação radiológica predominante, observada em 42 imagens (82%), ademais observou-se ainda 9 descrições de atelectasia (18%), 5 consolidações múltiplas (10%), 3 com padrão de infiltrado intersticial bilateral (6%), 2 com opacidade em vidro fosco (4%), 1 com consolidações peribrônquicas (2%) e 1 com cavitação de permeio (pneumatocele) (2%). No mais, observou-se 34 imagens radiológicas compatíveis com derrame pleural (67%) e 17 (33%) sem complicações visualizadas à admissão.
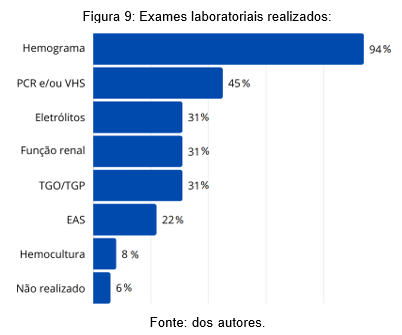
Dentre os exames laboratoriais solicitados, cita-se: hemograma (48 pacientes, 94%), provas de atividade inflamatória (proteína C reativa quantitativa e velocidade de hemossedimentação, PCR e VHS, respectivamente) (23 solicitações, 45%), eletrólitos, transaminases hepáticas (aspartato aminotransferase – ALT e alanina aminotransferase – AST) e função renal (creatinina e ureia) (16 resultados, 31%), hemocultura solicitada para 4 pacientes (8%) e, por fim, exame sumário de urina ou urina tipo I com 11 solicitações (21%). Apenas 6% não tiveram exames laboratoriais requisitados (figura 9).
Concluiu-se, em uma primeira análise, que 34 crianças (67%) tiveram o diagnóstico de PACC já à admissão, sendo 100% delas o derrame pleural como a complicação identificada. Desses, 10 pacientes (29%) já haviam feito uso ou estavam em vigência de tratamento com antibioticoterapia (43% com amoxicilina com clavulanato, 24% com amoxicilina, 19% com azitromicina, 9% teriam feito uso da penicilina benzatina e 5% tinham administrado a ampicilina com sulbactam em data próxima ao diagnóstico).
Entre os pacientes que não apresentaram diagnóstico de PACC à admissão (17 indivíduos, 33%), avaliou-se como comportaram-se durante a evolução da doença em um período que compreendeu de 24 a 72h após a admissão hospitalar (Tabela 1).
Tabela 1: Curso clínico dos pacientes não diagnosticados de PACC à admissão:
n % Persistência da febre além das 48-72h do início do tratamento ou reaparecimento da febre após período afebril 12 70% Diminuição/abolição do MV 12 70% Persistência e/ou surgimento de taquipneia 11 65% Persistência e/ou surgimento da tosse 9 53% Hipoxemia persistente 8 47% Dificuldade respiratória moderada/grave 8 47% Dor abdominal e/ou torácica 6 35% Melhora clínica após 48-72h do início do tratamento 1 6% Critérios para sepse/choque séptico 0 0 Macicez à percussão torácica 0 0
Fonte: dos autores.
Daqueles pacientes que apresentaram à admissão diagnóstico de PACC – 34 indivíduos (67%), 17 (50%) evoluíram satisfatoriamente após 48 a 72h do início do tratamento antimicrobiano. No entanto, os demais evoluíram com piora clínica, citando-se à semelhança da evolução clínica de pacientes sem diagnóstico primário de PACC, descritos na Tabela 2.
Tabela 2: Curso clínico PAC complicada pacientes diagnosticados com PACC à admissão:
n % Melhora clínica após 48-72h do início do tratamento 17 50% Persistência e/ou surgimento de taquipneia 15 44% Persistência e/ou surgimento da tosse 14 41% Hipoxemia persistente 14 41% Persistência da febre além das 48-72h do início do tratamento ou reaparecimento da febre após período afebril 14 41% Dificuldade respiratória moderada/grave 12 35% Dor abdominal e/ou torácica 9 27% Diminuição/abolição de MV 8 23% Sepse/choque séptico 3 9% Macicez à percussão torácica 2 3%
Fonte: dos autores.
Observou-se ainda que novas imagens radiológicas foram realizadas na maioria da amostra, em 46 pacientes avaliados (90%). Desses, 43 realizaram radiografia de tórax (93%), 11 (24%) fizeram USG de tórax e 9 (20%) uma TC de tórax.
E assim como avaliado à admissão, a apresentação radiológica foi analisada, sendo que em 87% delas (40 do total) mostrou ser uma consolidação isolada. Novamente a atelectasia mostrou-se frequente, estando presente em 7 das imagens avaliadas (15%), seguida por 5 exames (11%) com consolidações múltiplas e outras 5 (11%) com cavitação de permeio, além de 1 (2%) imagem com opacidade em vidro fosco e 1 (2%) com consolidações peribrônquicas.
Ademais, observou-se aqui que 42 dessas novas imagens realizadas mostrava como complicação única associada o derrame pleural (91%), 1 (2%) com abscesso pulmonar e derrame pleural, 1 imagem (2%) com empiema pleural, 1 (2%) com abscesso pulmonar e 1 (2%) com pneumonia necrotizante.
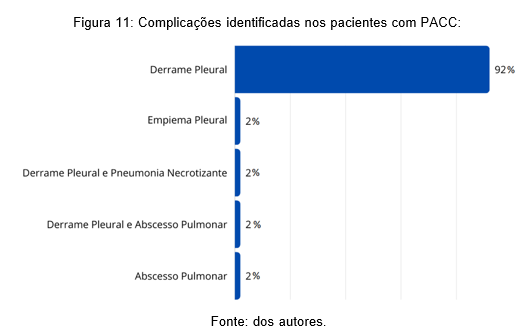
Com isso, estabeleceu-se que 92% da amostra, 47 do total, apresentaram DP como complicação única da PACC diagnosticada, 1 paciente (2%) com empiema pleural (EP), 1 paciente (2%) com DP e pneumonia necrotizante (PN) associadas, 1 criança (2%) com DP e abscesso pulmonar (AP) e 1 indivíduo (2%) com AP (Figura 11).
5.5. TERAPÊUTICA
Avaliou-se ainda o tratamento que fora instituído aos pacientes analisados tanto na admissão, quanto ao longo da internação.
Já na admissão, todos os pacientes receberam prescrição com antibioticoterapia, descritos na Tabela 3.
Tabela 3: Primeira troca de terapêutica realizada no curso da internação:
n Porcentagem (%) Ampicilina + Sulbactam 36 71% Ceftriaxona 5 10% Ceftriaxona + Oxacilina 5 10% Cefepime + Oxacilina 2 4% Ampicilina 2 4% Cefepime 1 2%
Fonte: dos autores.
Foi observado, no entanto, que ao longo da internação houve uma primeira mudança da terapêutica instituída para 27 pacientes (53%). As medicações para as quais foram realizadas as trocas estão expostas na Tabela 4 abaixo.
Tabela 4: Primeira troca de terapêutica realizada no curso da internação:
n Porcentagem (%) Ceftriaxona + Oxacilina 9 33% Cefepime 6 22% Ampicilina + Sulbactam 5 18% Ceftriaxona 3 11% Vancomicina 2 7% Ampicilina 1 4% Ceftriaxona + Vancomicina 1 4%
Fonte: dos autores.
Por fim, levantou-se que 25% (n = 13) desses pacientes ainda tiveram novamente a terapêutica modificada, relatadas na Tabela 5.
Tabela 5: Segunda troca de terapêutica realizada no curso da internação:
n Porcentagem (%) Ampicilina + Sulbactam 5 38% Vancomicina 3 23% Vancomicina + Meropeném 1 8% Ceftriaxona 1 8% Cefepime 1 8% Clindamicina 1 8% Piperaciclina + Tazobactam 1 8%
Fonte: dos autores.
5.6 Identificação do agente etiológico das PACC:
Dos 50 pacientes com diagnóstico de derrame pleural (com ou sem outras complicações associadas), 40% deles (20 crianças) tiveram drenagem do DP realizada, sendo que em 11 delas (55%) houve encaminhamento do material para análise e cultura de germes, sendo que em apenas 2 pacientes (4%) tiveram o agente etiológico definido através da cultura do DP, sendo o Streptococcus pneumoniae a etiologia de ambos os diagnósticos.
Importante enfatizar tal dado já que a partir dessa análise a indicação antibacteriana possa ser mais bem direcionada (JANAHI; FAKHOURY, 2024).
Já quanto a hemoculturas, para apenas 8% dos pacientes fora solicitado, mesmo quando a suspeita inicial já fosse de PACC. Trata-se, contudo, de um exame indicado em todas as pneumonias complicadas, mesmo havendo baixas chances de positividade. Em casos de DP, por exemplo, a cultura do líquido pleural pode vir negativa, sendo a hemocultura de grande valia (JANAHI; FAKHOURY, 2024).
5.7 Encaminhamento para UTIP
Em 80,4% dos casos não houve internação em leitos de cuidados intensivos pediátricos. Dos indivíduos que necessitaram dessa internação – 10 deles (19,6%), o tempo médio de permanência foi de 7,7 dias.
5.8 DESFECHO
Todos os pacientes obtiveram como desfecho a alta hospitalar e o tempo médio de internação total foi de 13,1 dias.
6. DISCUSSÃO
Foram selecionados 216 pacientes diagnosticados com PAC, atendidos no Pronto Socorro (PS) de Pediatria do Hospital Regional de Taguatinga (HRT) no período de 01 de março de 2022 a 01 de março de 2024. Destes, baseados nos critérios pré-definidos de inclusão e exclusão, obteve-se uma amostra total de 51 pacientes. Este dado demonstra que, a cada 5 pacientes com diagnóstico de PAC na instituição, pelo menos um terá idade entre 28 dias a 13 anos, 11 meses e 29 dias e diagnóstico de PACC.
Ademais, diante dos resultados expostos, pode-se inferir que o perfil dos pacientes encontrados revela uma predominância de crianças hígidas, do sexo masculino e, em sua maioria, com menos de cinco anos de idade. Observa-se ainda a presença de sintomas característicos na admissão – como tosse, taquipneia e febre. Sabe-se que houve baixa frequência de comorbidades de risco associadas, como neuropatias e uso prévio de antibióticos. Nesse sentido, por meio da realização do teste qui-quadrado de independência, não se observou uma associação significativa (p-valor > 0,50) entre os fatores de riscos e presença de pneumonia comunitária complicada na instituição.
Quanto ao curso clínico, o estudo mostrou ser variável. A persistência da febre além das 48-72h do início do tratamento ou ressurgimento de picos febris após tempo afebril, a persistência e/ou surgimento de taquipneia e/ou tosse, além da diminuição e/ou abolição do MV à ausculta e hipoxemia merecem destaque quanto ao padrão clínico mais frequentemente observado, indo de encontro ao que é informado pela literatura, já que esses sinais e sintomas clínicos são os mais habituais de ocorrerem nas complicações de pneumonias (BENEDICTIS et. al., 2024). Observou-se que esses pacientes, em sua maioria classificados como hígidos, já se apresentavam com PAC complicada na admissão (67%), sendo a tosse e a febre os sintomas mais persistentes, tendo ainda a consolidação isolada como apresentação radiológica na maior parte dos casos e o derrame pleural como complicação apresentada. Todavia, em nenhum dos casos demonstrou ser uma associação estatisticamente significativa esses dados com a persistência de febre além de 48-72 horas ou reaparecimento após um período afebril ou persistência e/ou surgimento de taquipneia (p-valor> 0,50).
Analisou-se ainda os exames de imagem repetidos ao longo da internação, os quais serviram para monitorar a evolução das complicações. Foram realizados na maioria dos pacientes – 90% dos pacientes repetiram RX de tórax e/ou USG de tórax e/ou TC de tórax. Infere-se que muito assemelha-se quanto às descrições inicialmente realizadas à admissão e na repetição dos exames. Destacando-se para o DP visto em 91% das imagens.
Importante destacar nesses casos o papel da radiografia simples na avaliação da criança com derrame pleural. A partir dela, pode ser inferida a necessidade de intervenção cirúrgica – a realização da toracocentese ou mesmo da colocação de dreno de tórax (níveis acima de 1 cm já são suficientes para indicar a drenagem). No entanto, ressalta-se que, caso esse derrame seja moderado ou volumoso, a USG de tórax é indicada, determinando o tamanho, se há septações ou loculações associadas (JANAHI; FAKHOURY, 2024). Apesar de não mencionado nas descrições avaliadas pelo estudo, destaca-se os sinais radiográficos que possam estar presentes à radiografia de tórax: apagamento do seio costofrênico, sinal do menisco e escoliose. Já para definição do tamanho do derrame, o nível de acometimento do tórax pode contribuir. Com isso, opacidades que são menores que a metade do tórax estimam derrame moderado, outros que superam tal achado acredita-se tratar de derrames muito volumosos. Contudo, enfatiza-se a necessidade da realização da USG de tórax nos casos de grandes derrames para melhor definição da extensão do derrame e qual a parcela de envolvimento parenquimatoso, entretanto, até em derrames de pequena monta sugere-se que a USG de tórax seja mais sensível do que a radiografia simples (JANAHI; FAKHOURY, 2024; BENEDICTIS et. al., 2024). A TC de tórax, por sua vez, não é superior à USG de tórax, como já mencionado, todavia, pode ser útil em situações em que há suspeita de necrose, de formação de abscessos ou ainda em casos de dúvida da etiologia do derrame pleural (JANAHI; FAKHOURY, 2024).
Apenas 1 imagem (2%) foi visto a PN. Ressalta-se que, em sua fase inicial, a distinção da necrose com o parênquima pulmonar é difícil, pois as cavidades necróticas são encobertas por fluido, havendo igual densidade pulmonar (BENEDICTIS et. al., 2024). Nesse caso, a TC de tórax mostra-se mais sensível para o diagnóstico de pneumonia necrosante, porém a USG de tórax é também eficaz para detecção dessa complicação, podendo, futuramente, a TC de tórax ser reservada para situações específicas como quando o paciente não evolui de forma satisfatória ao tratamento instituído (CHEN et. al., 2020).
Quanto aos abscessos pulmonares, 2 imagens foram compatíveis com a complicação, sendo 1 associada ainda a derrame pleural (2%) e outra apenas com abscesso pulmonar visualizado (2%). Em casos de AP, o RX de tórax mostra uma cavidade que é bem delimitada, com paredes espessadas com nível de fluído interior. No entanto, a radiografia simples pode não distinguir um abscesso pulmonar de uma consolidação isolada, sendo útil a realização da USG de tórax. Caso seja preciso a realização da TC de tórax, deve ser feita com a utilização de contraste. A distinção pela TC de tórax de abscesso e necrose pulmonar se dá através da seguinte observação: na necrose há paredes finas, preenchido com fluido em seu interior, já em abscessos a parede é grossa, com fluido em seu interior, contendo ou não ar (BENEDICTIS et. al., 2024).
Contudo, em uma avaliação de correlação entre padrões radiológicos observados e as complicações clínicas apresentadas pelos pacientes, não houve associação significativa (p-valor > 0,50). Sendo assim, apesar dos padrões radiológicos serem importantes para o diagnóstico e acompanhamento dos pacientes com PACC, eles não podem ter uma inspeção direta com a ocorrência de complicações específicas nesses casos.
Já quanto à terapêutica, observou-se uma gama de antibióticos escolhidos. Foi predominante a escolha, na admissão, por ampicilina com sulbactam – em 71% dos casos, seguido por ceftriaxona e ceftriaxona com oxacilina em 10% dos casos. Quando se optou pela modificação da medicação, predominou-se, em uma primeira troca, por ceftriaxona com oxacilina (33%), seguido por cefepime, em 22% dos casos analisados. Na segunda troca, pode-se avaliar que em 38% dos pacientes que receberam a modificação, a troca foi para ampicilina com sulbactam.
Avaliou-se que no caso em que a necrose pulmonar fora detectada, não houve mudança de antibioticoterapia já em curso – a ampicilina com sulbactam – havendo tempo total de dezesseis dias de antibioticoterapia via parenteral, o mesmo foi visto quando o empiema pleural foi diagnosticado, diferenciando-se que, esse último, o tempo de tratamento venoso fora de 23 dias.
Já no caso do derrame pleural e abscesso pulmonar como complicações, houve mudança da ampicilina com sulbactam vigente para cefepime, havendo tempo total de tratamento endovenoso de 12 dias. Quando o abcesso pulmonar fora a causa única da complicação, a também em curso ampicilina com sulbactam foi substituída por ceftriaxona com oxacilina, com 26 dias de tratamento venoso. Nos demais casos
– DP como única complicação – infere-se que muito divergiu-se quanto a mudanças terapêuticas e, quando houveram, verificou -se variadas medicações prescritas (detalhadas nas Tabelas 3, 4 e 5 acima descritas). Dessa forma, observa-se que não há seguimento bem estabelecido de qual tratamento é instituído para os pacientes com PACC na instituição.
Por fim, observou-se que a grande maioria dos casos foram tratados na própria instituição de cuidado, na enfermaria, não havendo necessidade de encaminhamento para UTIP. No mais, todos os 51 pacientes tiveram como desfecho a alta hospitalar.
7. CONCLUSÃO
É possível observar o aumento crescente dos casos de PACC, justificado por estudos que mostram a maior incidência das cepas 19A e 3 do SP, principal etiologia bacteriana relacionada às complicações de pneumonias. Os sinais e sintomas rapidamente identificados, associado a solicitação assertiva de exames complementares, levam a um correto diagnóstico e rápido manejo clínico, o que diminui a morbimortalidade dos pacientes. O presente estudo mostrou que faltam critérios melhor elaborados na condução dos casos, elaborando protocolos direcionados para a suspeita de PACC. Cita-se então que rotinas hospitalares devem ser elaboradas a fim da rápida identificação dos casos de PACC, com critérios bem definidos na reavaliação dos pacientes para identificação de cursos clínicos desfavoráveis e com complicações, fazer a solicitação de USG de tórax a despeito da TC de tórax, realizar a solicitação para todos os pacientes da hemocultura, tendo como objetivo a identificação etiológica e antibiograma, definindo-se com mais clareza e assertividade qual ou quais antibióticos devem ser determinados nos casos de PACC na instituição. Apesar de desfechos favoráveis, protocolos hospitalares definidos diminuem a morbimortalidade da doença, já que, na PACC, o tempo de início do tratamento determina menos tempo de internação e menores complicações futuras.
8. REFERÊNCIAS BIBLIOGRÁFICAS
1 BARSON, W. J. Pneumonia in children: Inpatient treatment. UpToDate, Junho de 2024.
2 Sociedade Brasileira de Pediatria. Departamentos Científicos de Pneumologia e Infectologia. Pneumonias Adquiridas na Comunidade Complicadas: Atualização 2024. 29 de abril de 2024. Disponível em: https://www.sbp.com.br/fileadmin/user_upload/24347d- DC_PneumoniaAdquiridas_ComunidadeComplicada-Atualiza2024.pdf. Acessado em 29 de julho de 2024.
3 Sociedades Brasileiras de Imunizações, Infectologia e Pediatria. Posicionamento Conjunto Sociedades Brasileiras de Imunizações, Infectologia e Pediatria Frente ao Lançamento da Nova Vacina Pneumocócica Conjugada 15-Valente (VPC15). 22 de dezembro de 2023. Disponível em: 24345j-GPA- PosicionSocied nova vacina PneumoConjug 15-Valente.indd (sbp.com.br). Acessado em 16 de agosto de 2024.
4 JANAHI, I. A. FAKHOURY, K. Epidemiology, clinical presentation, and evaluation of parapneumonic effusion and empyema in children. UpToDate, Junho de 2024.
5 BENEDICTIS, F. M. et. al. Complicated pneumonia in children. The Lancet, v. 10253, n. 396, London, UK, p. 786–798, 2020.
6 CHEN, Y. et. al. Necrotizing Pneumonia in Children: Early Recognition and Management. Journal of Clinical Medicine, Hangzhou, China, v. 12, n. 6, p. 1- 14, 2023.
7 FERNANDES, F. D. AZEVEDO, C. T. O. Abordagem da pneumatocele gigante em pré-escolar: relato de caso. Revista de Saúde, v. 14, n. 2, p. 68-71, 2023.
8 PERDRIZET, J. Cost-effectiveness analysis of replacing the 10-valent pneumococcal conjugate vaccine (PCV10) with the 13-valent pneumococcal conjugate vaccine (PCV13) in Brazil infants. Human Vaccines & Immunotherapeutics, New York, USA, v. 17, n. 4, p. 1162-1172, 2021.
9 TUOMANEN, E. I. KAPLAN, S. L. OLARTE, L. Pneumococcal pneumonia in children. UpToDate, Setembro de 2024.
10 PRESTES, L. M. et. al. Manejo de pneumonia e derrame pleural em crianças. Jornal Brasileiro de Pneumologia, Porto Alegre (RS), Brasil, v. 49, n. 6, p. 1-3, 2023.
11 JANAHI, I. A. FAKHOURY, K. Management and prognosis of parapneumonic effusion and empyema in children. UpToDate, Junho de 2024.
12 PEREIRA, P. A. K. et. al. Antimicrobial Resistance in Streptococcus pneumoniae before and after the Introduction of Pneumococcal Conjugate Vaccines in Brazil: Systematic Review. Antibiotics, Switzerland, v. 66, n. 13, p. 1-20, 2024.
13 BARSON, W. J. Pneumonia in children: Epidemiology, pathogenesis, and etiology. UpToDate, Setembro de 2024.
14 BARSON, W. J. Community-acquired pneumonia in children: Clinical features and diagnosis. UpToDate, Setembro de 2024.
15 JANAHI, I. A. FAKHOURY, K. Epidemiology, clinical presentation, and evaluation of parapneumonic effusion and empyema in children. UpToDate, Junho de 2024.
16 SCHVARTSMAN, C. et. al. Pronto Socorro. 4 ed. Santana de Parnaíba (SP): Editora Manole, 2023.
17 CARVALHO, C. M. N. Community-acquired pneumonia among children: the latest evidence for an updated management. Journal de Pediatria, v. 96, n.1, p. 29-38, 2020.
18 ALEMAYHEU, G. et. al. Children hospitalized with community acquired pneumonia complicated by effusion: a single-centre retrospective cohort study. BMC Pediatrics, v. 181, n. 23, p. 1-6, 2023.
19 PERVAIZ, F. et. al. Building a Prediction Model for Radiographically Confirmed Pneumonia in Peruvian Children: From Symptoms to Imaging. Chest Journal, v. 154, n. 6, p. 1385-1394, 2018.
20 BUNTHI et. al. Etiology and Clinical Characteristics of Severe Pneumonia Among Young Children in Thailand. The Pediatric Infectious Disease Journal, v. 40, n. 9, p. 91-100, 2021.
21 MZUMARA et. al. Radiographically confirmed pneumonia in Malawian children and associated pneumococcal carriage after introduction of the 13-valent pneumococcal conjugate vaccine. BMC Pediatrics, v. 23, n. 16, p. 1-6, 2024.
1Médico (a) Residente em Pediatria pelo Hospital Regional de Taguatinga – DF. E-mail: coutolimaana@gmail.com
2Médico (a) Especialista em Pediatria e preceptor do Programa de Residência Médica do Hospital Regional de Taguatinga – DF. E-mail: fvlino@gmail.com
3Médica Residente em Pediatria pelo Hospital Regional de Taguatinga – DF. E-mail: bastosheloise1@gmail.com
4Médica Residente em Pediatria pelo Hospital Regional de Taguatinga – DF. E-mail: renatamachadobonfim@gmail.com
5Médica Residente em Pediatria pelo Hospital Regional de Taguatinga – DF. E-mail: julianafaleirop@gmail.com
6Médica Residente em Pediatria pelo Hospital Materno Infantil de Brasília – DF. E-mail: amandalalencar@gmail.com
7Médico Residente em Pediatria pelo Hospital Regional de Taguatinga – DF. E-mail: eduardojfsales@gmail.com
8Médica Residente em Pediatria pelo Hospital Regional de Taguatinga – DF. E-mail: anacarolbuta@gmail.com
9Médica Residente em Pediatria pelo Hospital Materno Infantil de Brasília – DF. E-mail: gabrielaramosam@gmail.com
